Similar presentations:
Атомная физика
1. Атомная физика
Ширина Татьяна АлександровнаДоцент кафедры «Физика»
МАДИ
2. Возникновение понятия «атом»
Понятие «атом» впервыепоявилось в работах
древнегреческих философов
Демокрита и Левкиппа.
Под атомом они понимали
мельчайшую частицу вещества
(atomos – неделемый).
К атомной гипотезе они пришли
только на основании
размышлений, т.к. в то время
люди не владели современными
физическими методами
исследования.
Демокрит
(ок. 460–370 до н.э.)
Древнегреческий ученый
3. Отыщи всему начало, и ты многое поймешь. Козьма Прутков
400 г. до н.э. Демокрит: «Существуетпредел деления атома».
Аристотель: «Делимость вещества
бесконечна».
1626 г., Париж: учение об атоме запрещено
под страхом смерти
4. Экспериментальные данные, свидетельствующие о делимости атома
1.2.
3.
Открытие явления радиоактивности
1896г.
Открытие электрона 1897г.
Опыт Эрнеста Резерфорда 1911г.
5. Открытие электрона
Занимаясь изучением газовогоразряда Д.Д.Томсон, совместно с
сотрудниками выполнил серию
классических работ, приведших к
открытию электрона - впервые
измерил отношение заряда
электрона к массе в 1897 г.
Джозеф-Джон Томсон - английский
физик, удостоенный в 1906 г.
Нобелевской премии по физике за
работы, которые привели к
открытию электрона.
Джозеф-Джон
ТОМСОН
(18.12.1856 - 30.8.1940)
6. Экспериментальные данные, свидетельствующие о делимости атома
В природе существует материальный носительнаименьшего заряда – электрон.
1906 – 1914 г.г. Роберт Милликен (1868 – 1953).
Провел эксперименты по точному определению
массы и заряда электрона.
me = 9,109389 10 -31 кг ;
qе = 1,602177 10 – 19 Кл
7. Радиоактивность
В 1896 году французскийученый Анри Беккерель
открыл явление естественной
радиоактивности самопроизвольного распада
ядер атомов тяжелых
элементов.
Анри
БЕККЕРЕЛЬ
(15.XII.1852 - 25.VIII.1908)
Явление радиоактивности давало основания предположить, что в
состав атома входят отрицательно и положительно заряженные
частицы. Кроме того, было известно, что атом в целом нейтрален.
8. Модель атома Томсона
В 1903г. английский физик Джозеф Джон Томсон предложилодну из первых моделей строения атома – «кекс с изюмом».
•По предположению Томсона, атом представлял собой шар
радиусом ≈ 10-10 м, по всему объему которого равномерно
распределен положительный заряд.
•Внутри этого шара находятся
электроны, которые могут колебаться
около своего положения равновесия.
Положительный заряд шара равен по
модулю суммарному отрицательному
заряду электрона, поэтому
электрический заряд атома в целом
равен нулю.
9. Опыт Резерфорда
Модель строения атома Томсона нуждалась вэкспериментальной проверке.
Важно было проверить,
действительно ли положительный
заряд распределён по всему
объёму атома с постоянной
плотностью.
Поэтому в 1906 г. Резерфорд
совместно со своими сотрудниками
провел ряд опытов по исследованию
состава и строения атомов.
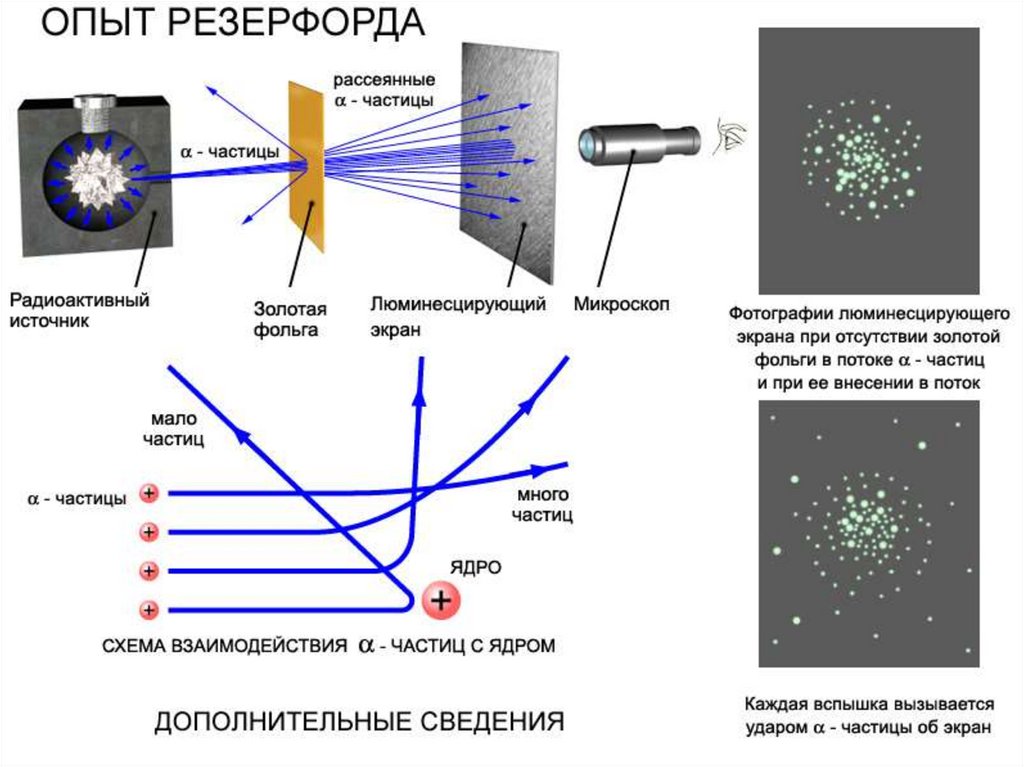
10. Идея опыта
Зондировать атом альфа–частицами.Альфа-частицы возникают при распаде радия.
Масса альфа-частицы в 8000 раз больше массы электрона.
Электрический заряд альфа-частицы в 2 раза больше
заряда электрона.
Скорость альфа-частицы около 15 000 км/с.
Альфа-частицы является ядром атома гелия.
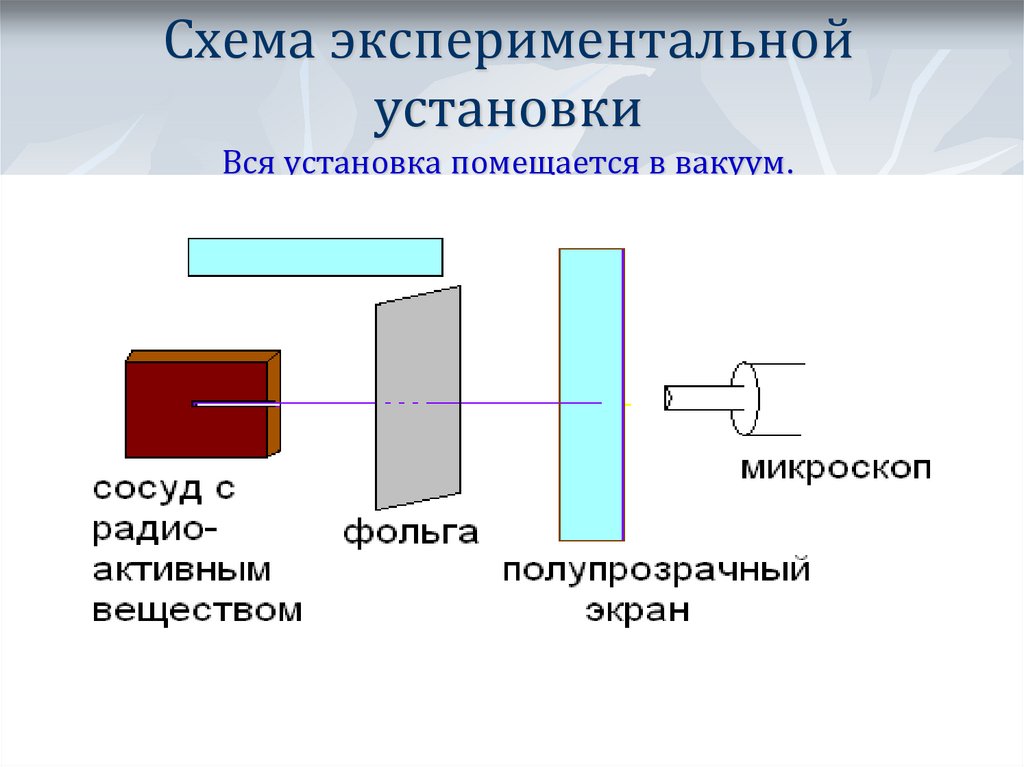
11. Схема экспериментальной установки Вся установка помещается в вакуум.
12. В отсутствии фольги – на экране появлялся светлый кружок напротив канала с радиоактивным веществом.
13. Когда на пути пучка альфа-частиц поместили фольгу, площадь пятна на экране увеличилась. Помещая экран сверху и снизу установки,
Резерфорд обнаружил, чтонебольшое число альфа-частиц отклонилось на углы около 900.
Единичные частицы были отброшены назад.
14.
15. Выводы из опыта Резерфорда
Именно случаи рассеяния α-частиц на большие углыпривели Резерфорда к выводу:
Столь сильное отклонение α-частиц
возможно только в том случае, если
внутри атома имеется чрезвычайно
сильное электрическое поле. Было
рассчитано, что такое поле могло быть
создано зарядом, сконцентрированным
в очень малом объеме (по сравнению с
объемом атома).
16. Выводы из опыта Резерфорда
Поскольку масса электрона примерно в 8 000 раз меньше массыα-частицы, электроны, входящие в состав атома, не могли
существенным образом изменить направление движения αчастиц. Поэтому:
В данном случае речь может
идти только о силах
электрического отталкивания
между α-частицами и
положительно заряженной
частью атома, масса которой
значительно больше массы αчастицы.
17. Модель атома Резерфорда
В центре атома находится положительно заряженное ядро,вокруг которого вращаются по определенным орбитам
электроны.
Основная масса атома сосредоточена в ядре m ядра =
99,4% m атома.
В зависимости от массы ядро имеет диаметр порядка
10-14 – 10-15 м, т.е. оно в десятки или даже в сотни тысяч
раз меньше атома (диаметр атома ≈ 10-10 м).
Атом электрически нейтрален.
18. Модель атома Резерфорда
Направление полетаα-частиц зависит от
того, на каком
расстоянии от ядра
они пролетают. Оно
сильно меняется
только в том случае,
если частица
проходит очень
близко к ядру.
19. Модель атома Резерфорда
Таким образом, в результате опытов по рассеянию α-частицбыла доказана несостоятельность модели атома Томсона,
выдвинута ядерная модель строения атома и определен
порядок диаметров атомных ядер.
20.
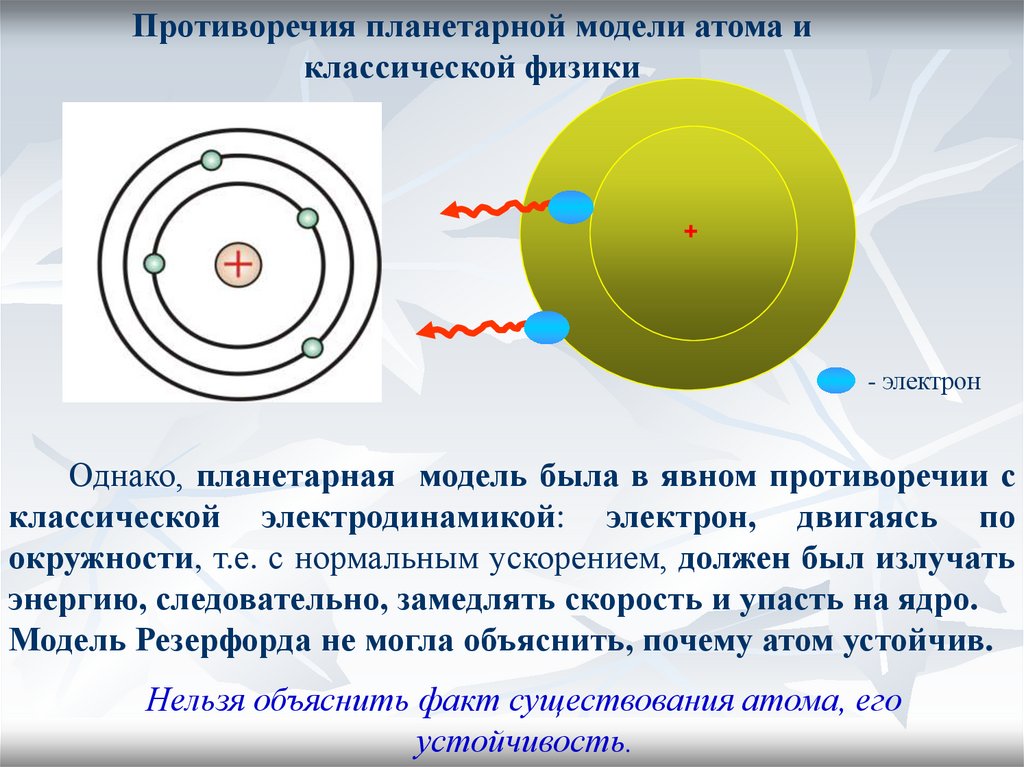
Противоречия планетарной модели атома иклассической физики
+
- электрон
Однако, планетарная модель была в явном противоречии с
классической электродинамикой: электрон, двигаясь по
окружности, т.е. с нормальным ускорением, должен был излучать
энергию, следовательно, замедлять скорость и упасть на ядро.
Модель Резерфорда не могла объяснить, почему атом устойчив.
Нельзя объяснить факт существования атома, его
устойчивость.
21. Теория атома Н.Бора (1913г.) Нобелевская премия по физике 1922 г.
Нильс Бор (1885-1962)21
22. Первый постулат Бора
Атомная система может находится только в особыхстационарных квантовых состояниях, каждому из
которых соответствует определенная энергия En.
В стационарных состояниях атом не излучает.
-
+
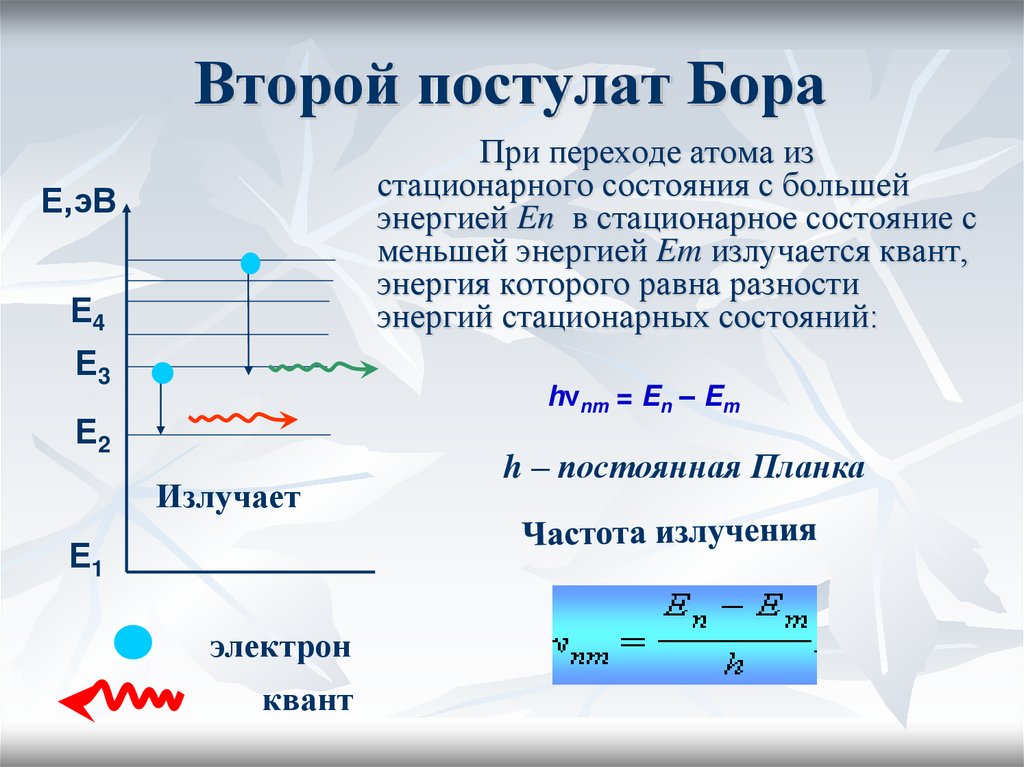
23. Второй постулат Бора
При переходе атома изстационарного состояния с большей
энергией En в стационарное состояние с
меньшей энергией Em излучается квант,
энергия которого равна разности
энергий стационарных состояний:
Е,эВ
Е4
Е3
hνnm = En – Em
Е2
Излучает
Е1
электрон
квант
h – постоянная Планка
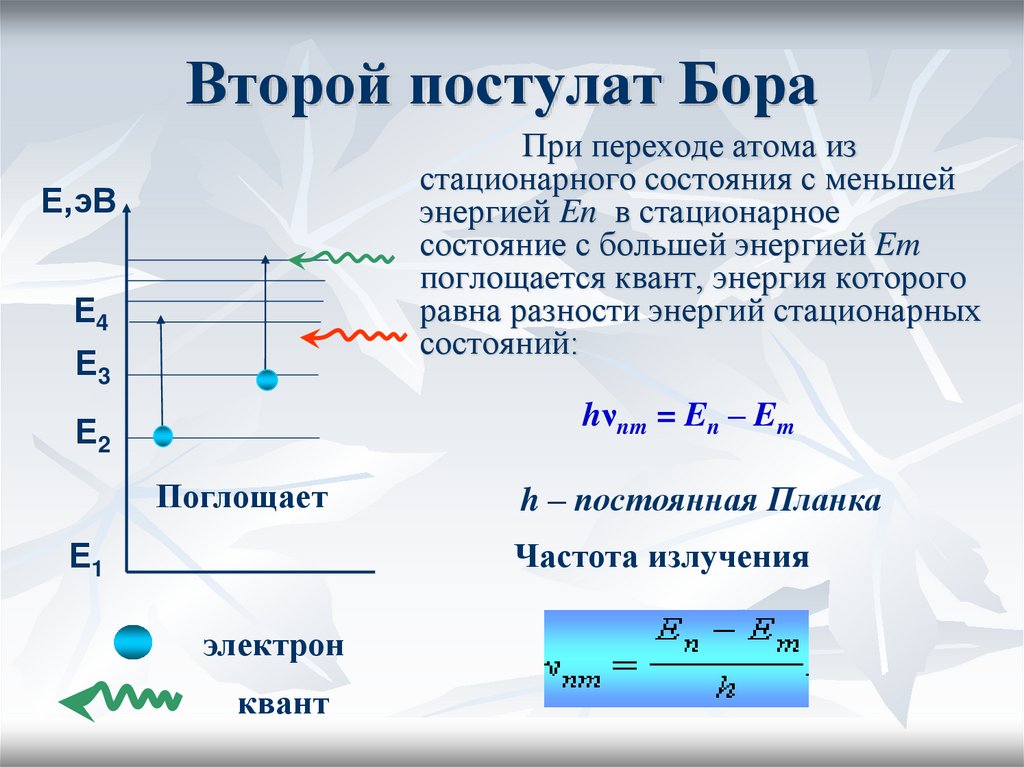
24. Второй постулат Бора
При переходе атома изстационарного состояния с меньшей
энергией En в стационарное
состояние с большей энергией Em
поглощается квант, энергия которого
равна разности энергий стационарных
состояний:
Е,эВ
Е4
Е3
hνnm = En – Em
Е2
Поглощает
h – постоянная Планка
Частота излучения
Е1
электрон
квант
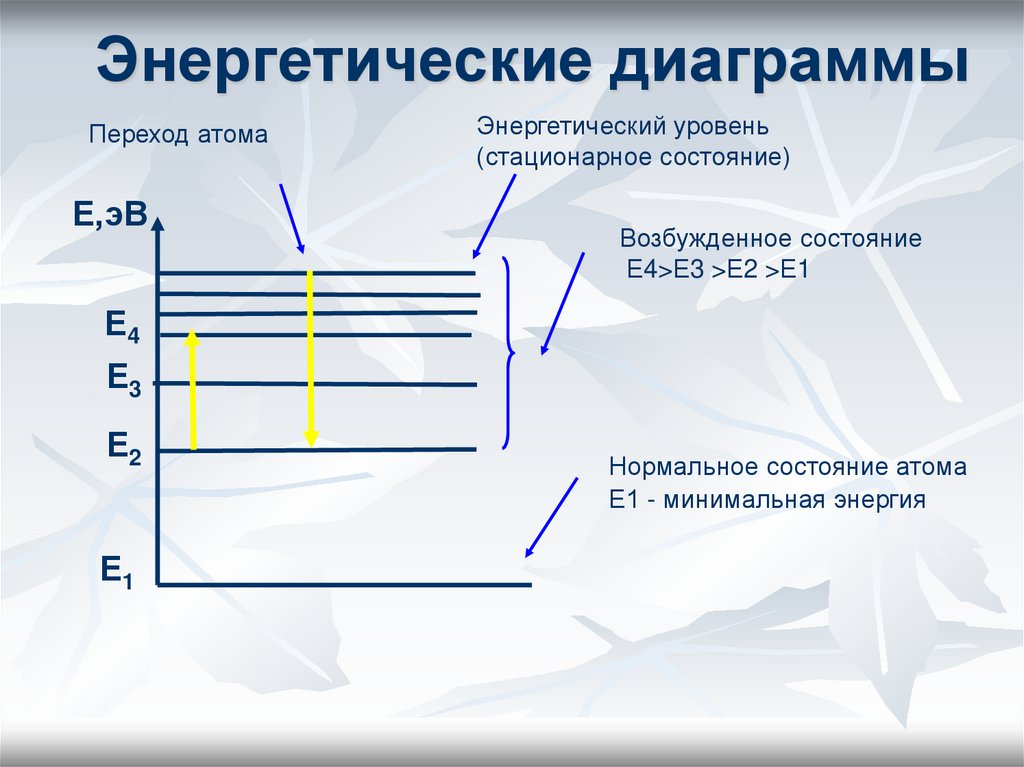
25. Энергетические диаграммы
Переход атомаЕ,эВ
Энергетический уровень
(стационарное состояние)
Возбужденное состояние
Е4>Е3 >Е2 >Е1
Е4
Е3
Е2
Е1
Нормальное состояние атома
Е1 - минимальная энергия
26. Правило квантования Бора
В стационарном состоянии атома электрон, двигаясь покруговой орбите, должен иметь дискретные, квантованные
значения момента импульса
me - масса электрона,
υ – скорость электрона
rn – радиус стационарной круговой
орбиты
Правило квантования Бора позволяет вычислить радиусы
стационарных орбит электрона в атоме водорода и
определить значения энергий
27. Важно!
2728. Радиус орбиты электрона в атоме
22
v
1 Ze
m
r 4 0 r 2
mvr n
mv r
2 2 2
1
4 0
m v r ( n )
2 2 2
mZe2 r
2
2
2
2
rn 4 0
n r0 n
2
mZe
Радиус первой орбиты атома водорода
r0=0.529 ангстрем=0,529 10-10 м
28
29. Энергия электрона в атоме
2mV
1 Ze
1 Ze
1 Ze
E
2
4 0 r
4 0 2r 4 0 r
1
Ze
4 0 2r
mZ 2 e 4
1
me4 Z 2
Z2
En 2 2
2 E1 2
2
2
2 n
(4 0 ) 2 n
n
Энергия первого уровня атома водорода
Е1=-13,6 эВ
29
30.
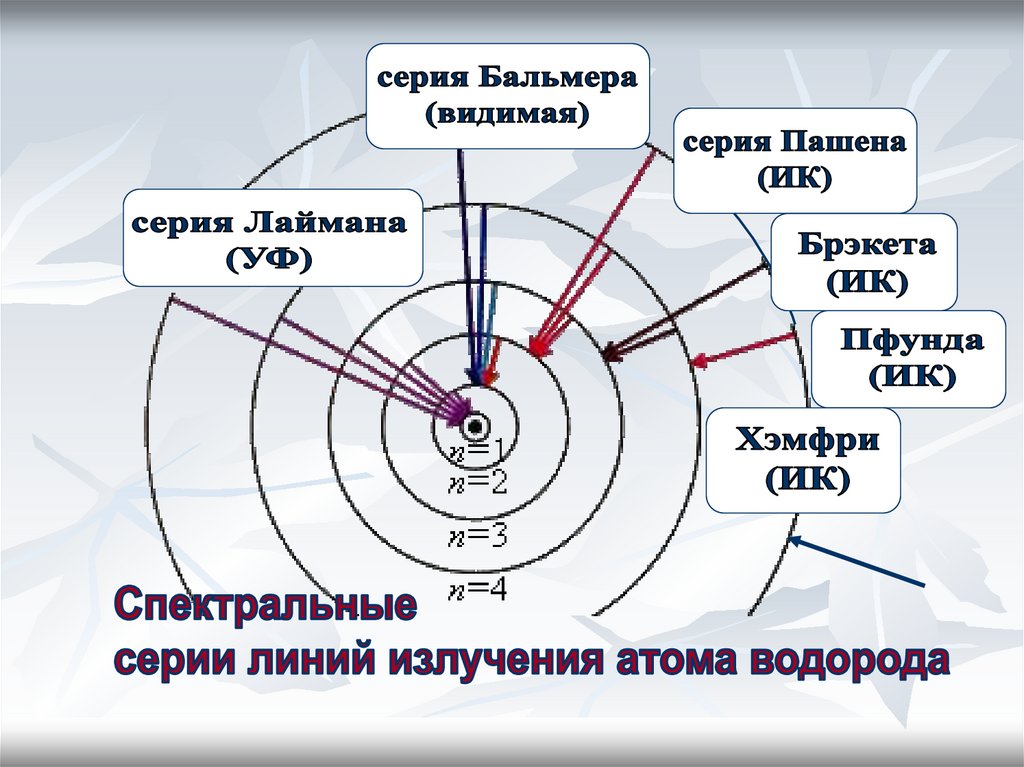
3031.
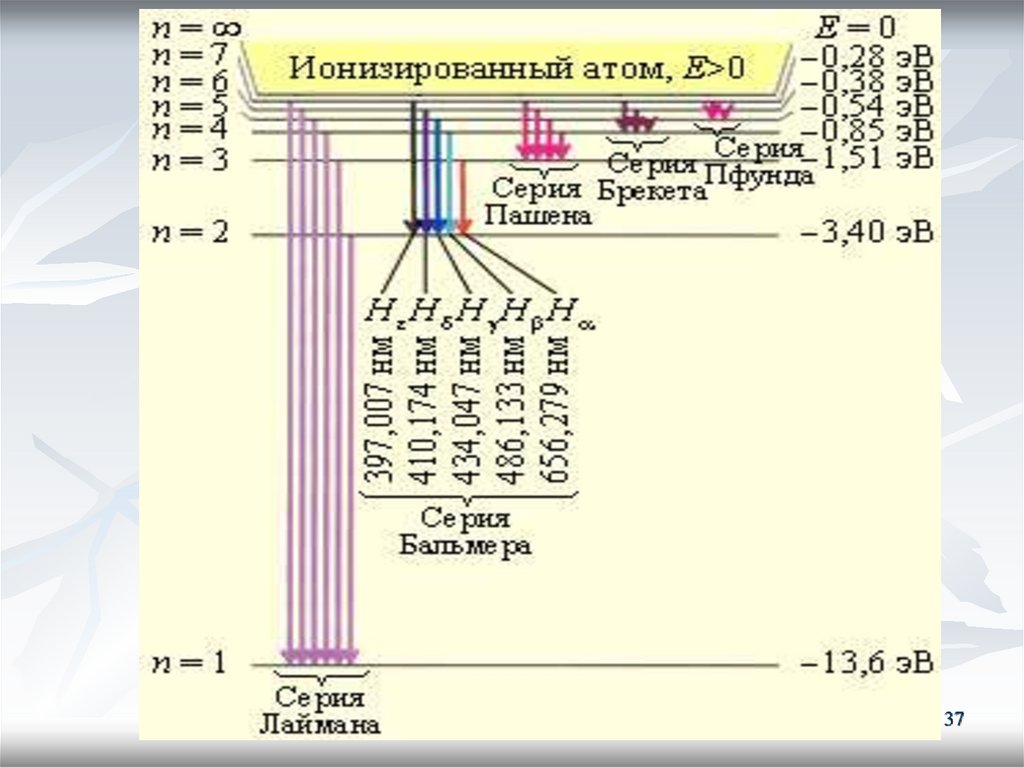
Еще в начале XIX века были открыты дискретныеспектральные линии в излучении атома водорода в
видимой области (так называемый линейчатый
спектр).
Совокупность спектральных линий атома
водорода в видимой части спектра была названа
серией Бальмера.
Позже аналогичные серии спектральных
линий были обнаружены в ультрафиолетовой и
инфракрасной частях спектра.
31
32.
33.
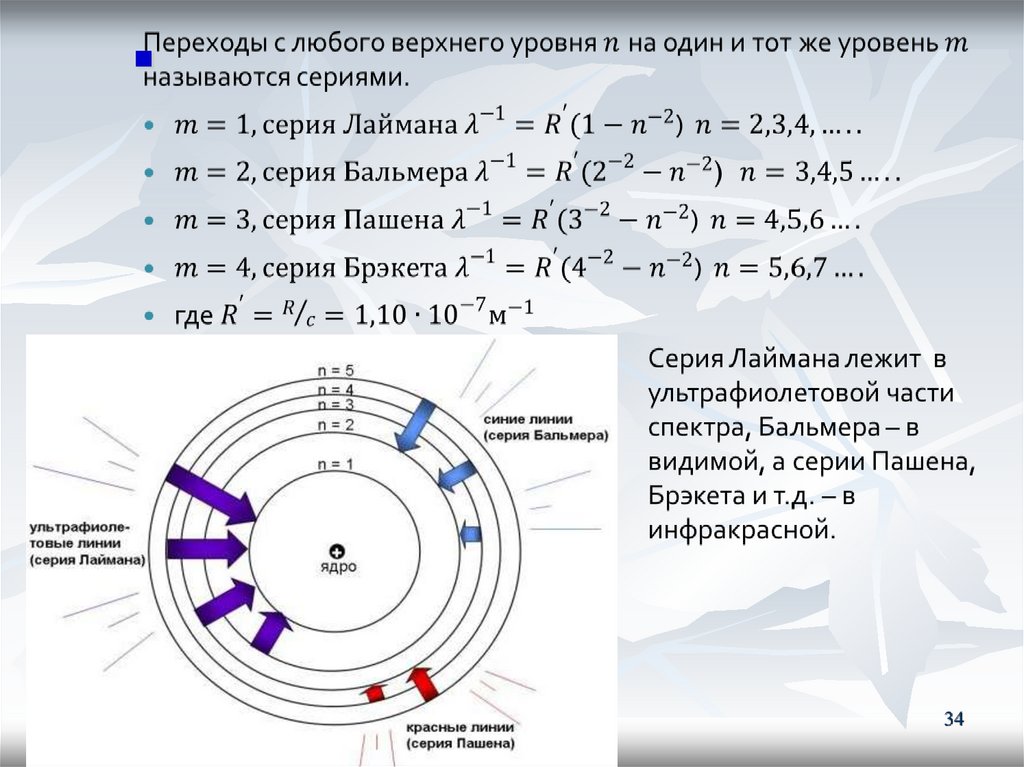
В 1890 году И. Ридберг получил эмпирическуюформулу для частот спектральных линий:
1
1
nm R 2 2
n
m
Для серии Бальмера m = 2, n = 3, 4, 5, ... . Для
ультрафиолетовой серии (серия Лаймана)
m = 1, n = 2, 3, 4, ... . Постоянная R в этой
формуле называется постоянной Ридберга.
Ее численное значение
R = 3,29·1015 Гц.
33
34.
3435.
Швейцарский физик Й. Бальмер в 1885 году установил,что длины волн серии в видимой части спектра водорода
могут
быть
представлены
формулой
(формула
Бальмера):
2
n
λ λ0 2
n 4
1
1
1
R' 2 2
λ
n
2
0 = const, n = 3, 4, 5,…
или
1
1
ν R 2 2
2 n
R = 1,09·107 м-1 – постоянная Ридберга, n = 3, 4, 5,…
В физике постоянной Ридберга называют и другую
величину равную R = R ·с.
R = 3,29·1015c-1
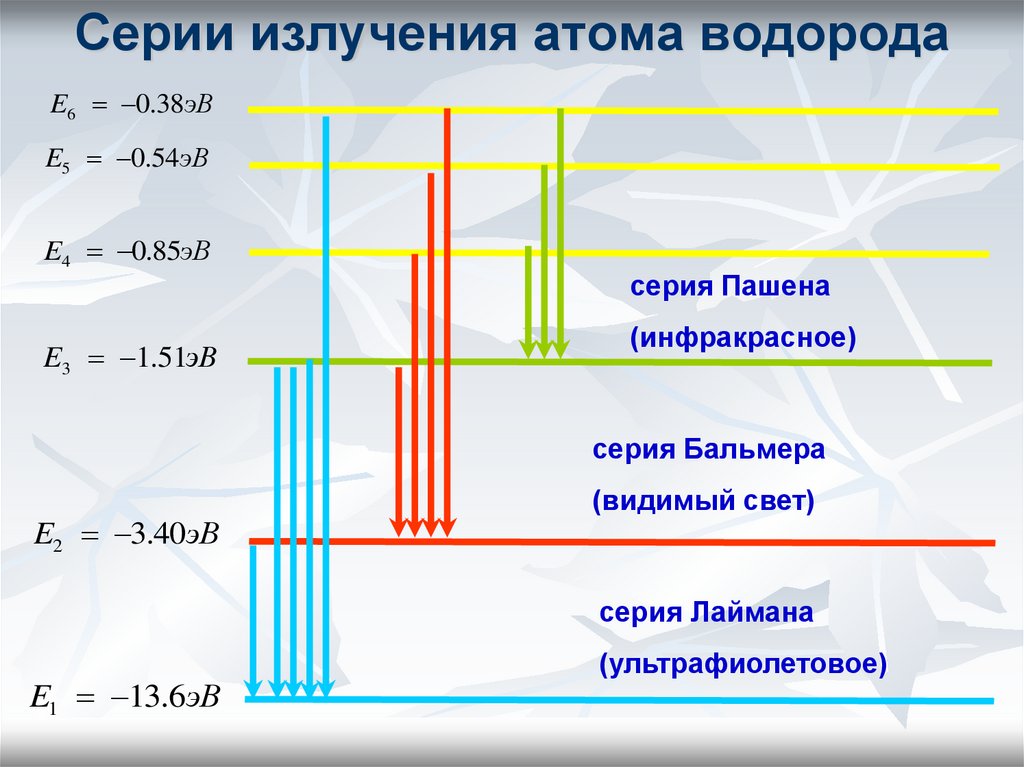
36. Серии излучения атома водорода
E6 0.38эВE5 0.54эВ
E4 0.85эВ
E3 1.51эВ
серия Пашена
(инфракрасное)
серия Бальмера
E2 3.40эВ
(видимый свет)
серия Лаймана
E1 13.6эВ
(ультрафиолетовое)
37.
3738. Достоинства теории Бора
Позволила объяснить, почему атомы испускаютлинейчатые спектры и точно предсказать для атома
водорода длины волн испускаемого излучения
Позволила объяснить и спектры поглощения:
столкновение фотона с атомом приводит к переходу
электрона с одного энергетического уровня на другой,
более высокий.
Гарантировала стабильность атомов и позволила
теоретически определить радиус атома водорода.
Точно предсказала энергию ионизации водорода 13,6 эВ.
39. Недостатки теории Бора
На основе теории не удалось количественно объяснитьспектр более сложных атомов (гелия и др.).
Правило квантования Бора применимо не всегда.
Представление об определенных орбитах, по которым
движется электрон в атоме Бора, оказалось условным.
40.
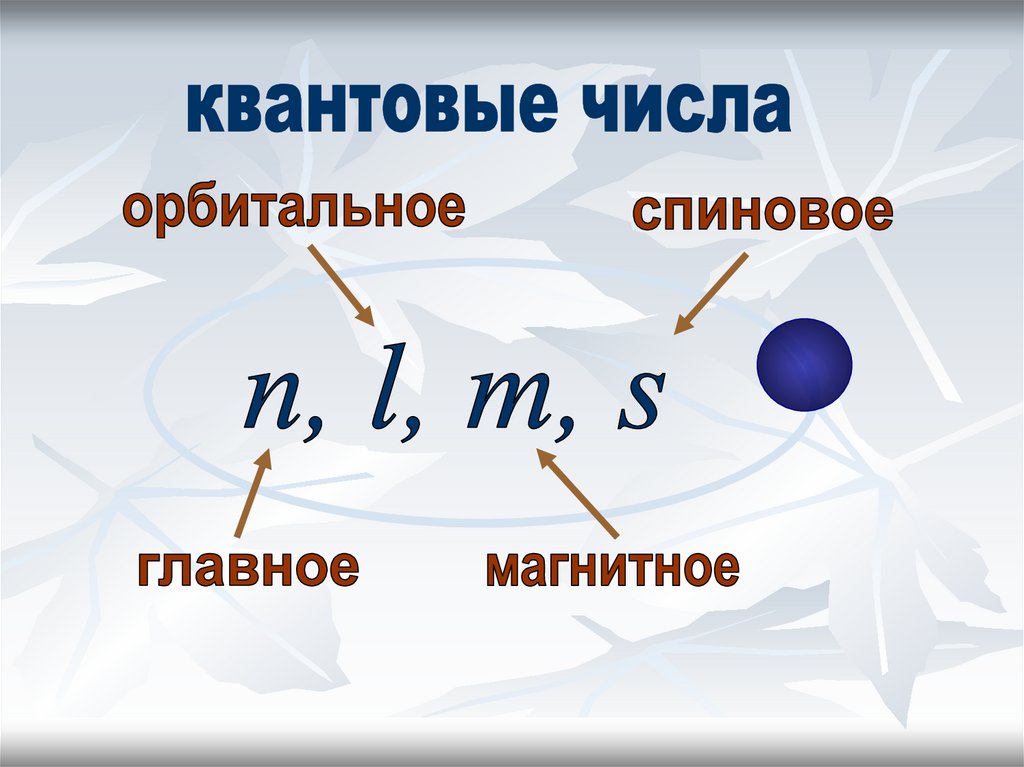
41. Квантовые числа электронов
Состояние каждого электрона в атоме обычноописывают с помощью четырех квантовых
чисел:
главного (n),
орбитального (l),
магнитного (m)
спинового (s).
Первые три характеризуют движение электрона
в пространстве, а четвертое - вокруг
собственной оси.
41
42. Квантовые числа электронов
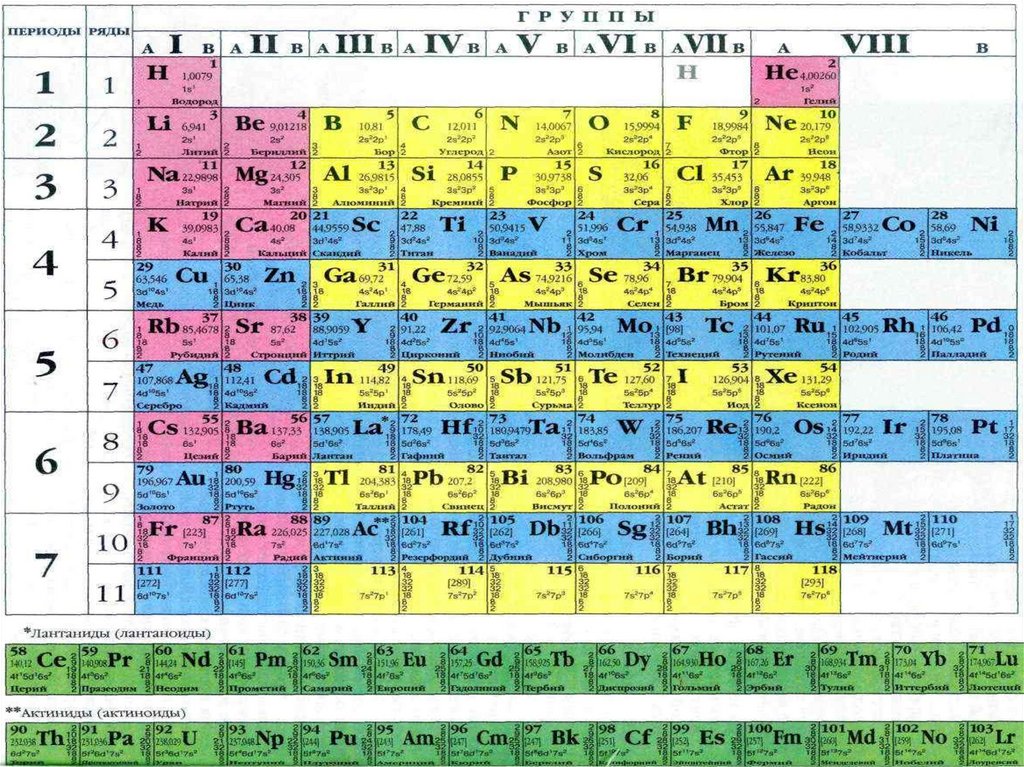
Главное квантовое число (n).Определяет энергетический уровень
электрона, удаленность уровня от ядра,
размер электронного облака.
Принимает целые значения (n = 1, 2, 3 ...) и
соответствует номеру периода. Из
периодической системы для любого элемента
по номеру периода можно определить число
энергетических уровней атома и какой
энергетический уровень является внешним.
42
43. Квантовые числа электронов
Орбитальное квантовое число (l)характеризует геометрическую форму орбитали.
Принимает значение целых чисел от 0 до (n - 1).
l=0: s- подуровень, s- орбиталь сфера
l=1 : p- подуровень, p- орбиталь гантель
l=2: d- подуровень, d- орбиталь – орбиталь
сложной формы
l=3: f-подуровень, f- орбиталь еще более
сложной формы
43
44. Квантовые числа электронов
Магнитное квантовоечисло (m) характеризует
положение электронной
орбитали в пространстве
и принимает
целочисленные значения
от -I до +I, включая 0.
Это означает, что для
каждой формы орбитали
существует
(2l + 1) энергетически
равноценных ориентации
в пространстве.
44
45. Квантовые числа электронов
Спиновое квантовое число (s) характеризуетсобственный магнитный момент электрона.
Проекция s принимает только два значения
+1/2 и –1/2.
Принцип Паули
В атоме не может быть двух электронов, у
которых значения всех квантовых чисел (n, l,
m, s) были бы одинаковы, т.е. на каждой
орбитали может находиться не более двух
электронов (c противоположными спинами).
45



































 physics
physics








