Similar presentations:
Карбонові кислоти
1.
Тема: Карбонові кислоти1. Номенклатура та ізомерія карбонових
кислот.
2. Способи одержання карбонових кислот
(створення карбоксильної групи).
3. Фізичні властивості, будова карбоксильної
групи.
4. Хімічні властивості.
2.
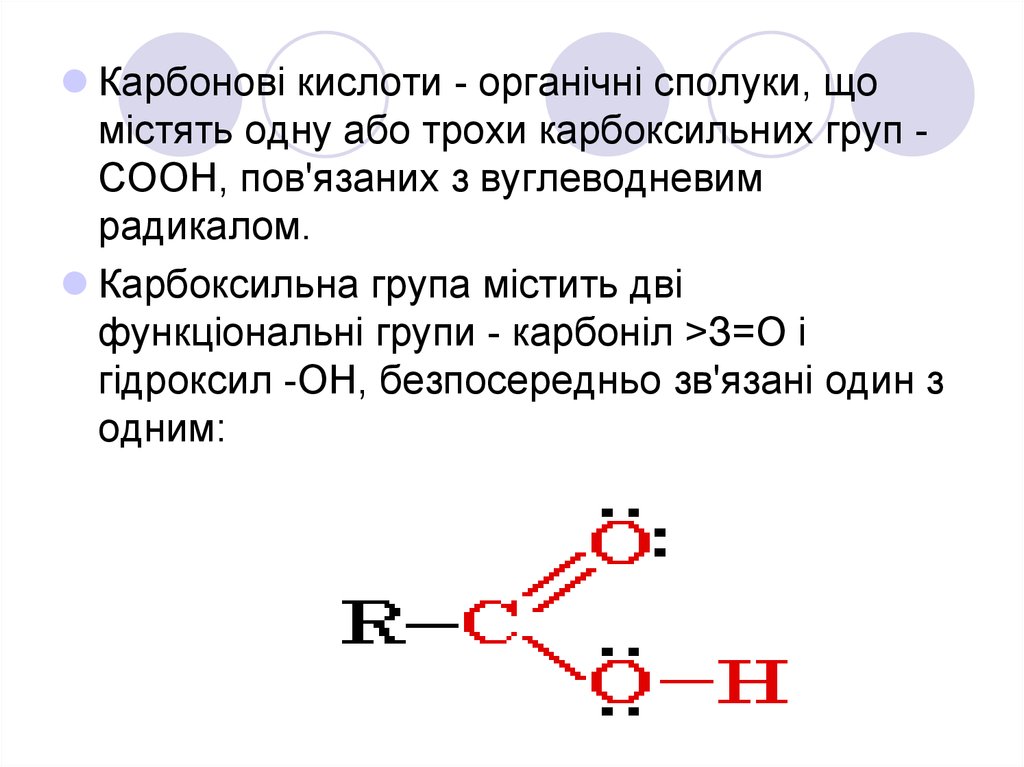
Карбонові кислоти - органічні сполуки, щомістять одну або трохи карбоксильних груп СООН, пов'язаних з вуглеводневим
радикалом.
Карбоксильна група містить дві
функціональні групи - карбоніл >З=О і
гідроксил -OH, безпосередньо зв'язані один з
одним:
3.
Номенклатура карбонових кислотСистематичні назви кислот даються за
назвою відповідного вуглеводню з
додаванням суфікса –ова й слова
кислота.
Часто використаються також тривіальні
назви.
4.
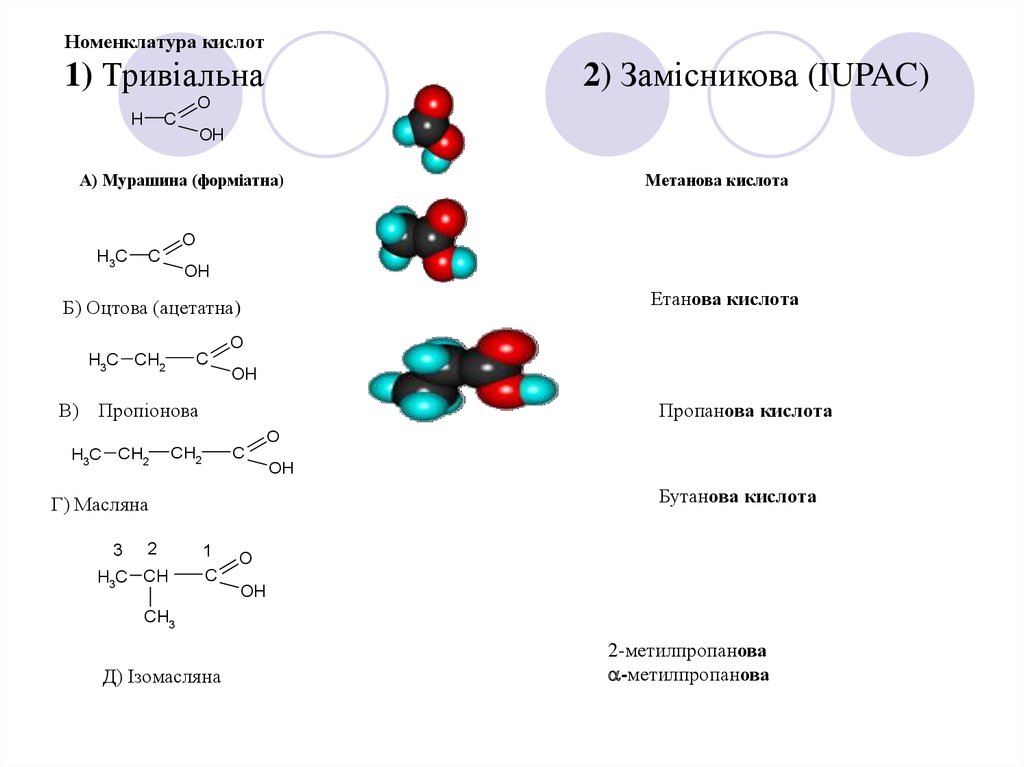
Номенклатура кислот1) Тривіальна
2) Замісникова (IUPAC)
O
H
C
OH
А) Мурашина (форміатна)
Метанова кислота
O
H3C
C
OH
Етанова кислота
Б) Оцтова (ацетатна)
O
C
H3C CH2
OH
В) Пропіонова
Пропанова кислота
O
H3C CH2
CH2
C
OH
Бутанова кислота
Г) Масляна
3
2
H3C CH
1
C
O
OH
CH3
Д) Ізомасляна
2-метилпропанова
-метилпропанова
5.
OH3C CH2
CH2
C
CH2
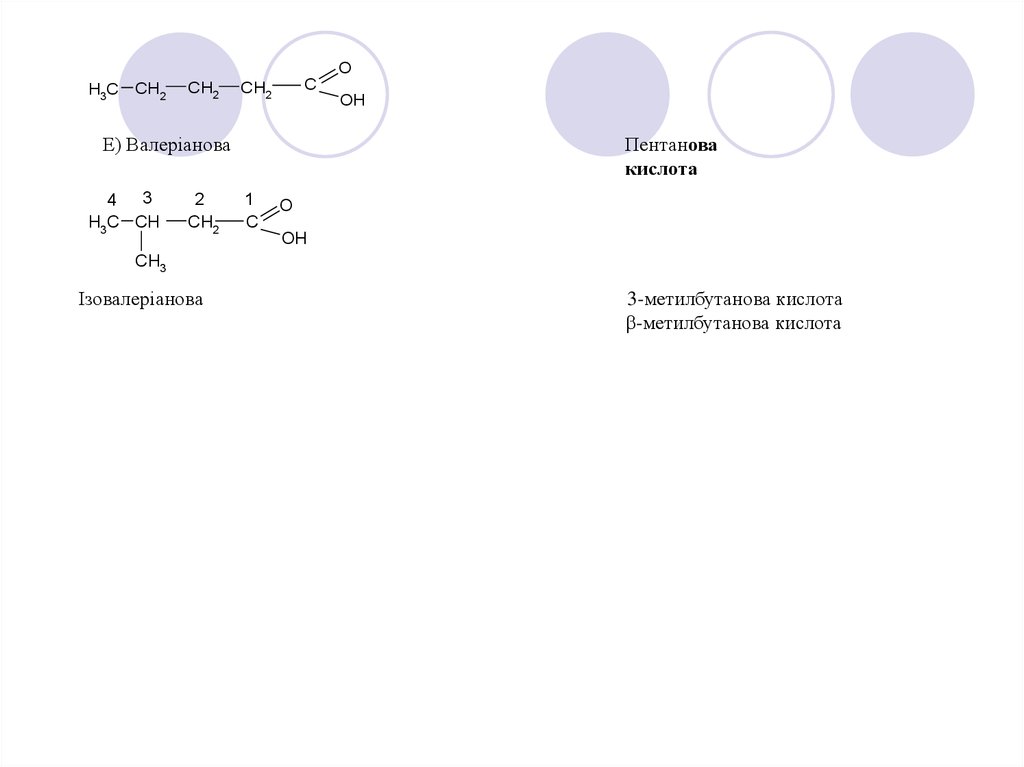
Е) Валеріанова
4 3
H3C CH
2
CH2
OH
Пентанова
кислота
1
C
O
OH
CH3
Ізовалеріанова
3-метилбутанова кислота
-метилбутанова кислота
6.
Класифікація карбонових кислотКарбонові кислоти класифікують по двох структурних
ознаках.
По числу карбоксильних груп кислоти поділяються на:
одноосновні (монокарбонові)
Наприклад:
багатоосновні (дикарбонові, трикарбонові й т.д.).
По характері вуглеводневого радикалу розрізняють кислоти:
насичені (наприклад, CH3CH2CH2COOH);
ненасичені (CH2=CHCH2COOH);
і ароматичні (RC6H4COOH).
7.
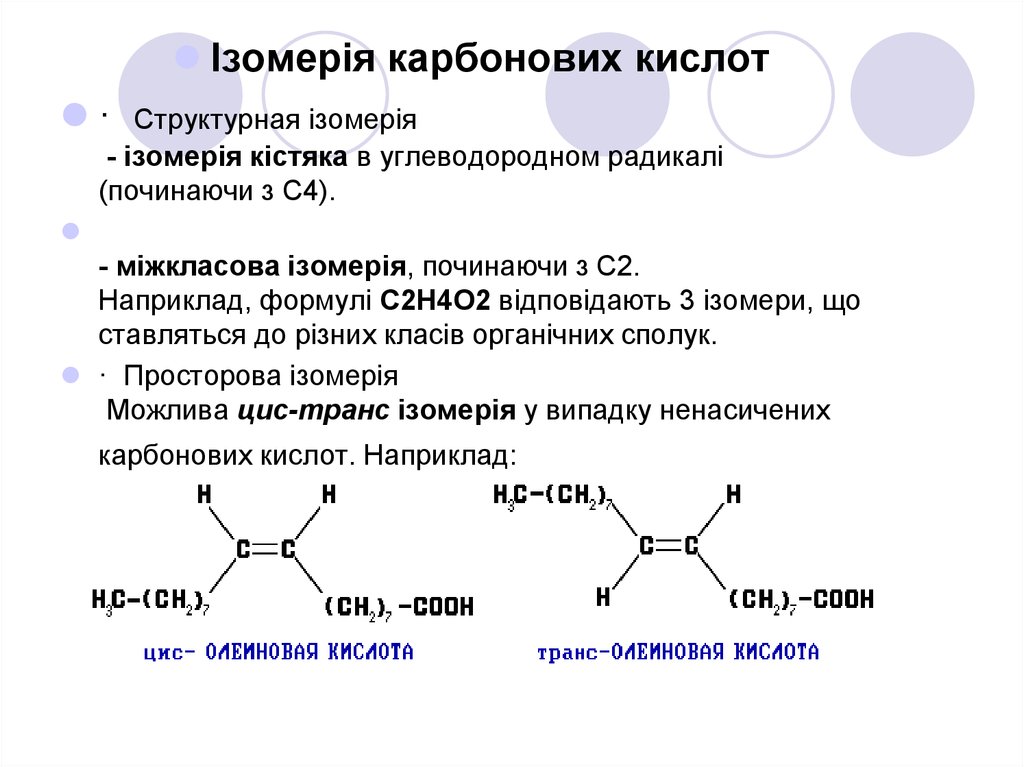
Ізомерія карбонових кислот·
Cтруктурная ізомерія
- ізомерія кістяка в углеводородном радикалі
(починаючи з C4).
- міжкласова ізомерія, починаючи з C2.
Наприклад, формулі C2H4O2 відповідають 3 ізомери, що
ставляться до різних класів органічних сполук.
· Просторова ізомерія
Можлива цис-транс ізомерія у випадку ненасичених
карбонових кислот. Наприклад:
8.
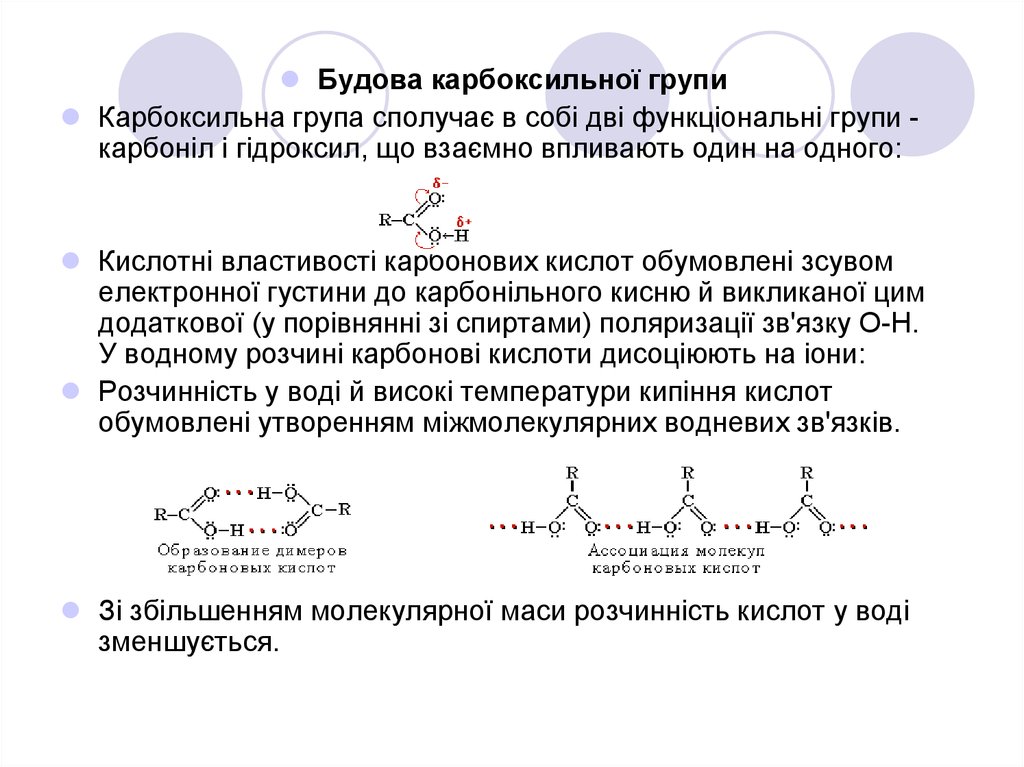
Будова карбоксильної групиКарбоксильна група сполучає в собі дві функціональні групи карбоніл і гідроксил, що взаємно впливають один на одного:
Кислотні властивості карбонових кислот обумовлені зсувом
електронної густини до карбонільного кисню й викликаної цим
додаткової (у порівнянні зі спиртами) поляризації зв'язку О-Н.
У водному розчині карбонові кислоти дисоціюють на іони:
Розчинність у воді й високі температури кипіння кислот
обумовлені утворенням міжмолекулярних водневих зв'язків.
Зі збільшенням молекулярної маси розчинність кислот у воді
зменшується.
9.
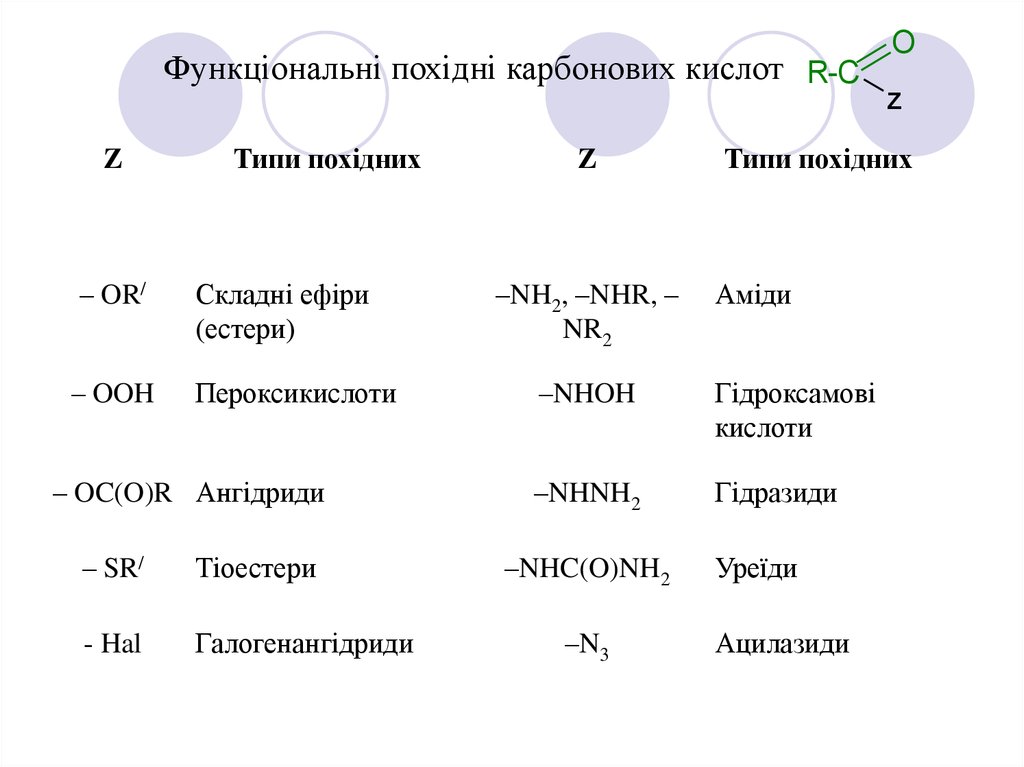
Функціональні похідні карбонових кислотКарбонові кислоти проявляють високу реакційну
здатність. Вони вступають у реакції з різними
речовинами й утворять різноманітні сполуки, серед
яких велике значення мають функціональні похідні,
тобто сполуки, отримані в результаті реакцій по
карбоксильній групі.
10.
Функціональні похідні карбонових кислот R-CZ
– OR/
– OOH
Типи похідних
Складні ефіри
(естери)
Пероксикислоти
– OC(O)R Ангідриди
– SR/
Тіоестери
- Hal
Галогенангідриди
Z
–NH2, –NHR, –
NR2
Аміди
Гідроксамові
кислоти
–NHNH2
Гідразиди
–N3
z
Типи похідних
–NHOH
–NHC(O)NH2
O
Уреїди
Ацилазиди
11.
OO
R-C
z
+
Nu-
R
C
Nu
O
R-C
Nu
z
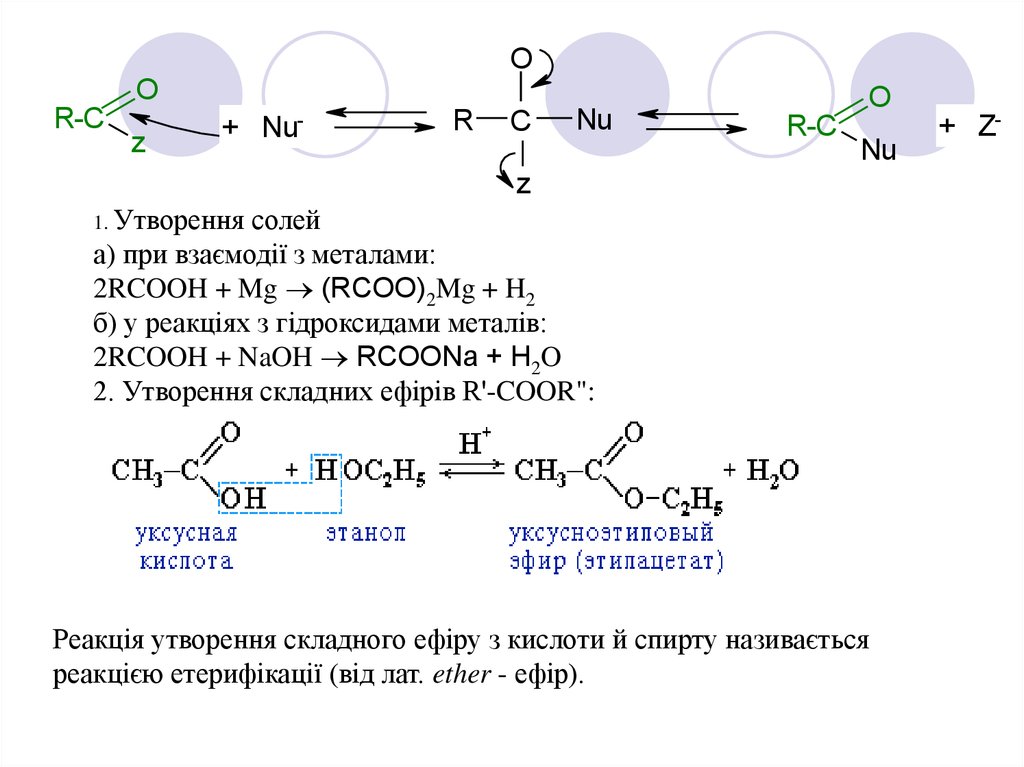
1. Утворення
солей
а) при взаємодії з металами:
2RCOOH + Mg (RCOO)2Mg + H2
б) у реакціях з гідроксидами металів:
2RCOOH + NaOH RCOONa + H2O
2. Утворення складних ефірів R'-COOR":
Реакція утворення складного ефіру з кислоти й спирту називається
реакцією етерифікації (від лат. ether - ефір).
+ Z-
12.
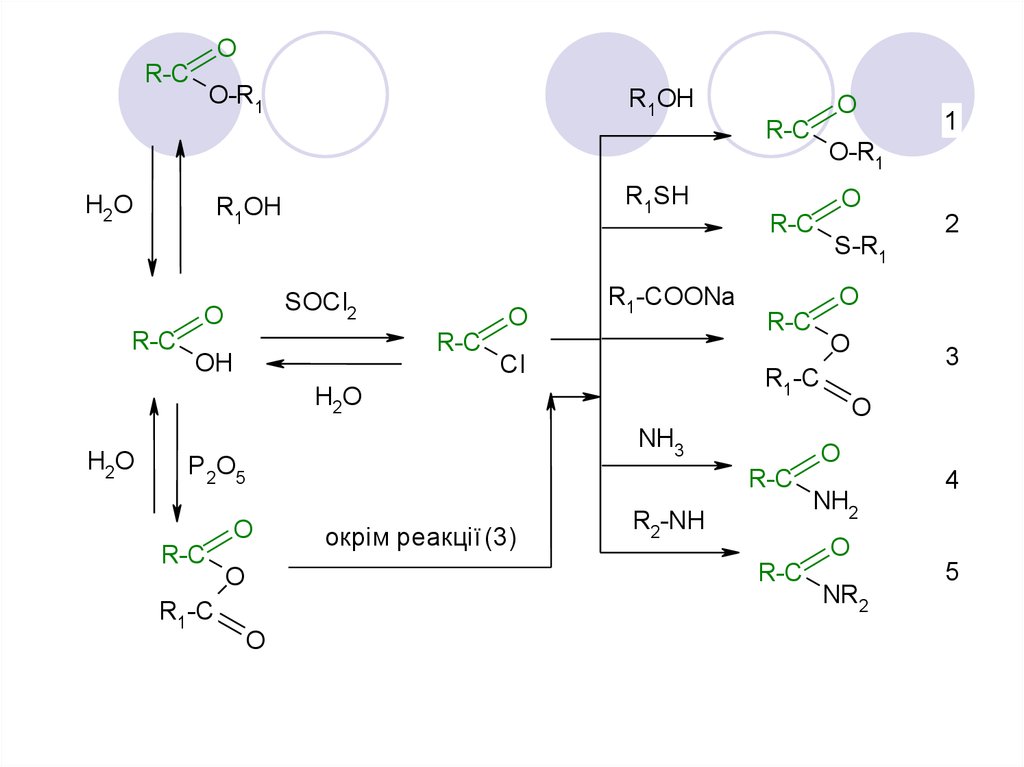
Замість карбонових кислот частіше використають їх галогенангидриди:Аміди утворяться також при взаємодії карбонових кислот (їх галогенангидридів або
ангідридів) з органічними похідними аміаку (амінами):
Аміди відіграють важливу роль у природі. Молекули природних пептидів і
білків побудовані з -амінокислот за участю амидних груп - пептидних
зв'язків
13.
Складні ефіриСкладні ефіри - сполуки із загальною формулою R–COOR',
де R й R' - вуглеводневі радикали.
Складні ефіри можуть бути отримані при взаємодії карбонових кислот зі спиртами
(реакція етерифікації). Каталізаторами є мінеральні кислоти.
Дана реакція оборотна. Зворотний процес - розщеплення складного ефіру при
дії води з утворенням карбонової кислоти й спирту - називають гідролізом
складного ефіру. Гідроліз у присутності лугу протікає необоротньо (тому що
утворений негативно заряджений карбоксилат-аніон RCOO– не вступає в
реакцію з нуклеофильним реагентом - спиртом).
Ця реакція називається омиленням складного ефіру.
Ефіри нижчих карбонових кислот і нижчих одноатомних спиртів мають
приємний запах квітів, ягід і фруктів. Ефіри вищих одноосновних кислот і вищих
одноатомних спиртів - основа природних восків. Наприклад, бджолиний віск
містить складний ефір пальмітинової кислоти й мірицилового спирту
(мірицилпальмітат)
CH3(CH2)14–CO–OCH2(CH2)29CH3.
14.
OR-C
O-R1
R1OH
O
R-C
H2O
R1SH
R1OH
SOCl2
O
R-C
O
R-C
OH
R1-COONа
Cl
H2O
R1-C
R-C
окрім реакції (3)
R-C
O
2
O
3
O
O
R2-NH
NH2
4
O
R-C
O
S-R1
O
R-C
O
R-C
O
NH3
P2O5
O-R1
R1-C
H2O
1
NR2
5
15.
ЖириЖири - складні ефіри гліцерину й вищих одноатомних карбонових кислот.
Загальна назва таких сполук - тригліцериди або триацилгліцерини, де
ацил - залишок карбонової кислоти -C(O)R.
До складу природних тригліцеридів входять залишки насичених кислот
(пальмітинової C15H31COOH, стеаринової C17H35COOH) і ненасичених
(олеїнової C17H33COOH, лінолевої C17H29COOH).
Жири містяться у всіх рослинах і тваринах.
Тваринні жири (баранячий, свинячий, яловичий і т.п.), як правило, є
твердими речовинами з невисокою температурою плавлення
(виключення - риб'ячий жир). Жири складаються головним чином із
тригліцеридів насичених кислот.
Рослинні жири - масла (соняшникове, соєве, бавовняне й ін.) - рідини
(виключення - кокосове масло). До складу тригліцеридів масел входять
залишки ненасичених кислот.
16.
Продукт гідрогенізації масел - твердий жир (штучне сало, саломас).Маргарин - харчовий жир, складається із суміші гідрогенізованних
масел (соняшникового, кукурудзяного, бавовняного й ін.), тваринних
жирів, молока й смакових добавок (солі, цукру, вітамінів й ін.).
Жирам як складним ефірам властива оборотна реакція гідролізу, що
кеаталізується мінеральними кислотами. При участі лугів гідроліз
жирів відбувається необоротньо. Продуктами в цьому випадку є мила
- солі вищих карбонових кислот і лужних металів.
Натрієві солі - тверді мила, калієві - рідкі. Реакція лужного гідролізу жирів, і взагалі всіх
складних ефірів, називається також омиленням.
17. Установка для отримання води очищеної з кондуктометричним датчиком для контролю якості води очищеної
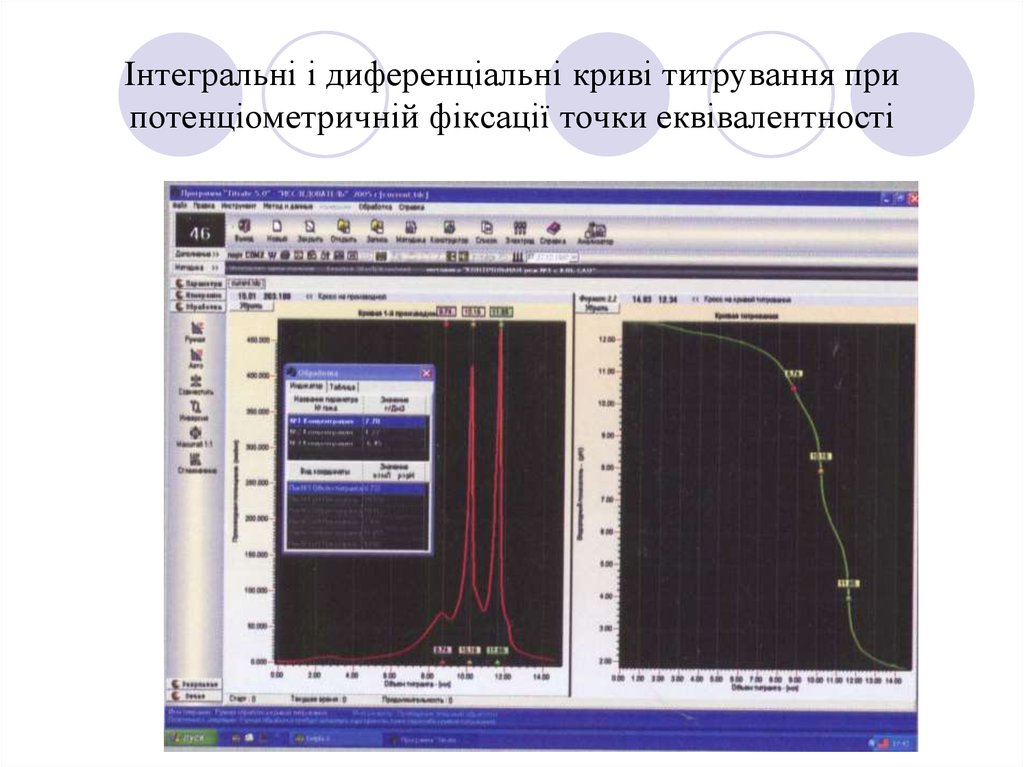
18. Інтегральні і диференціальні криві титрування при потенціометричній фіксації точки еквівалентності
19.
20.
Тема: Альдегіди і кетони1. Номенклатура та ізомерія насичених альдегідів і
кетонів.
2. Способи одержання альдегідів і кетонів.
3. Фізичні властивості, будова карбонільної групи.
4. Хімічні властивості.
4.1. Реакції приєднання:
а) приєднання водню (гідрування) – відновлення
оксосполук.
4.2. Реакції нуклеофільного приєднання:
а) реакції простого приєднання;
б) реакції приєднання – відщеплення;
в) приєднання вуглецевих нуклеофілів:
–
альдольна конденсація;
–
кротонова конденсація;
–
реакції диспропорціонування;
–
естерова конденсація.
г) реакції заміщення;
д) реакції окиснення;
е) реакції полімеризації.
21.
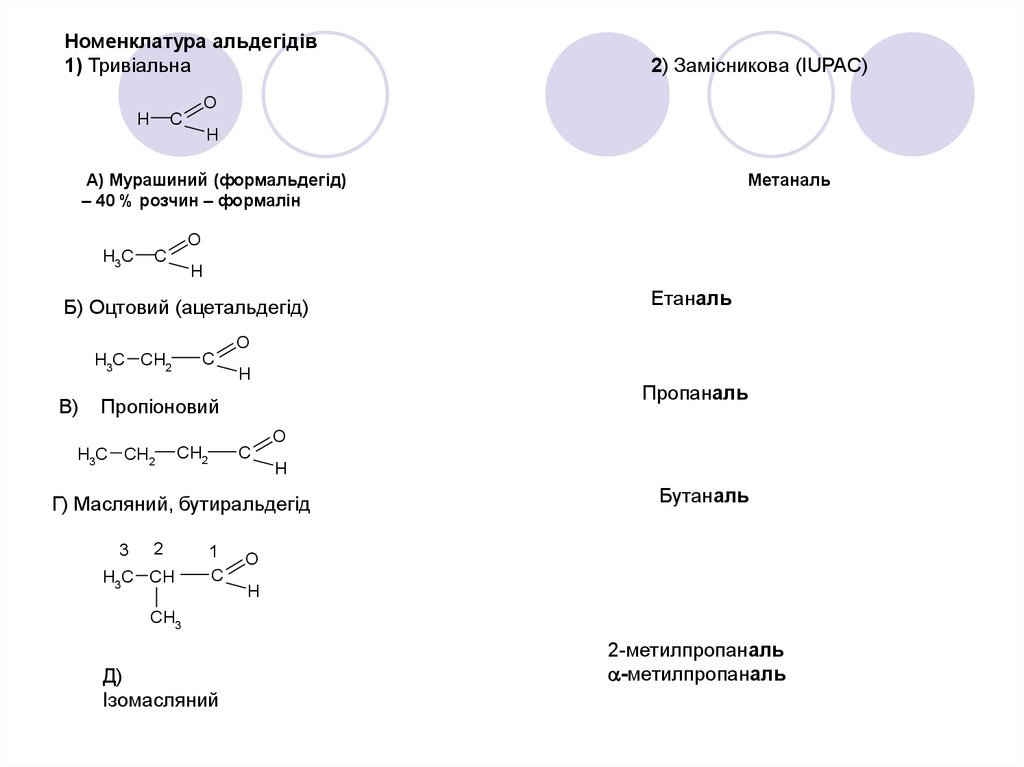
Номенклатура альдегідів1) Тривіальна
2) Замісникова (IUPAC)
O
H
C
H
А) Мурашиний (формальдегід)
– 40 % розчин – формалін
Метаналь
O
H3C
C
H
Б) Оцтовий (ацетальдегід)
Етаналь
O
C
H3C CH2
В)
H
Пропаналь
Пропіоновий
O
H3C CH2
CH2
C
H
Г) Масляний, бутиральдегід
3
2
H3C CH
1
C
Бутаналь
O
H
CH3
Д)
Ізомасляний
2-метилпропаналь
-метилпропаналь
22.
OH3C CH2
CH2
C
CH2
H
Е) Валеріановий
3
4
H3C CH
2
CH2
1
C
Пентаналь
O
H
CH3
Ізовалеріановий
_
O
CH2 - CH2 - C _=
3
2
1 H
Br
β-бромпропіоновий альдегід
3-бромпропаналь
3-метилбутаналь
-метилбутаналь
23.
та кетонів:1) Замісникова (IUPAC)
H3C
C
2) Радикально-функціональна
3)Тривіальна
CH3
O
Пропанон
5 4
H3C CH2
3
CH2
Диметилкетон
2
Ацетон
1
CH3
C
O
Пентанон-2
1 2
H3C CH2
3
C
Метилпропілкетон
4
CH2
5
CH3
O
Пентанон-3
Діетилкетон
4
3
H3C CH
2
CH3
O
C
3-Метилбутанон-2
1
CH3
Метилізопропілкетон
24.
Введення альдегідної групи обумовлює наркотичну дію ідезинфікуючі властивості сполук.
Препарати: 40 % р-н формальдегіду – формалін
Хлоральгідрат - 1,2-диокси-2,2,2-трихлоретан – заспокійливий,
снодійний, анальгезуючий засіб, викликає наркотичну залежність.
Cl _
__OH
_
Cl _ C - C _ H
Cl
OH
Гексаметилентетрамін – уротропін
Дезинфікант, консервант, дубильна речовина
При взаємодії з HNO3 конц. – утворює 1,3,5-тринітрогексагідро1,3,5-триазин – або гексоген (циклоніт) – вибухова речовина.
25.
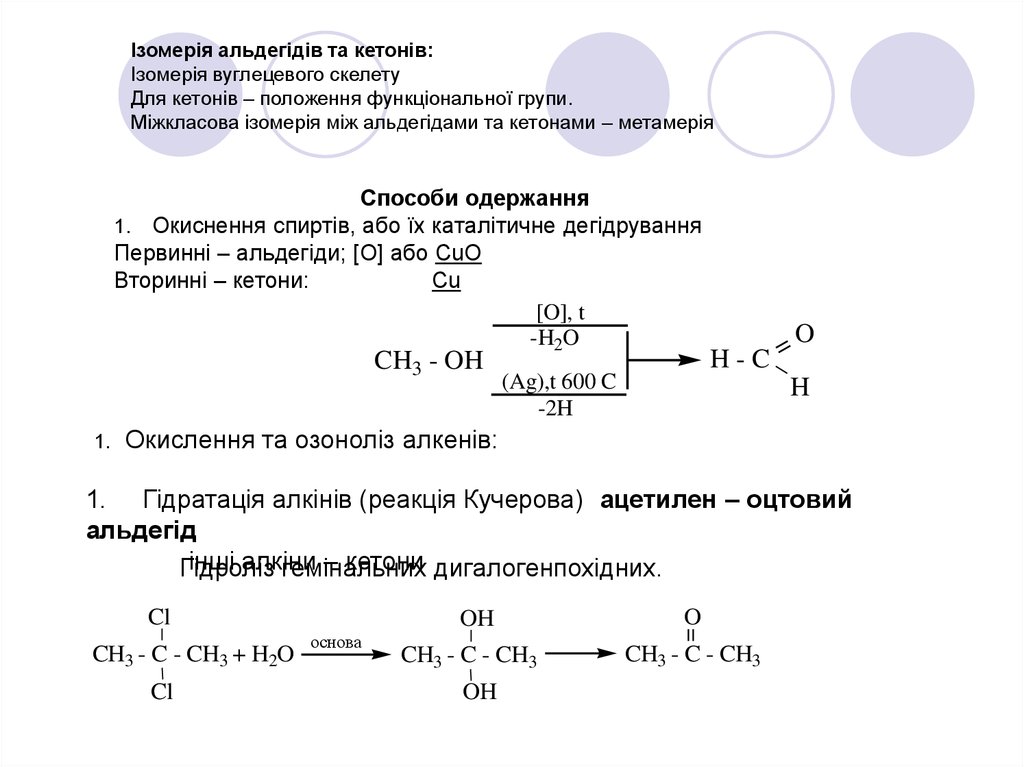
Ізомерія альдегідів та кетонів:Ізомерія вуглецевого скелету
Для кетонів – положення функціональної групи.
Міжкласова ізомерія між альдегідами та кетонами – метамерія
Способи одержання
1. Окиснення спиртів, або їх каталітичне дегідрування
Первинні – альдегіди; [O] або СuO
Вторинні – кетони:
Сu
[O], t
-H2O
CH3 - OH
1.
(Ag),t 600 C
-2H
O
=
H-C_
H
Окислення та озоноліз алкенів:
1. Гідратація алкінів (реакція Кучерова) ацетилен – оцтовий
альдегід
інші алкіни
– кетони дигалогенпохідних.
Гідроліз
гемінальних
CH3 - C - CH3
OH
O
=
Cl
основа
_
_
CH3 - C - CH3 + H2O
OH
_
_
Cl
CH3 - C - CH3
26.
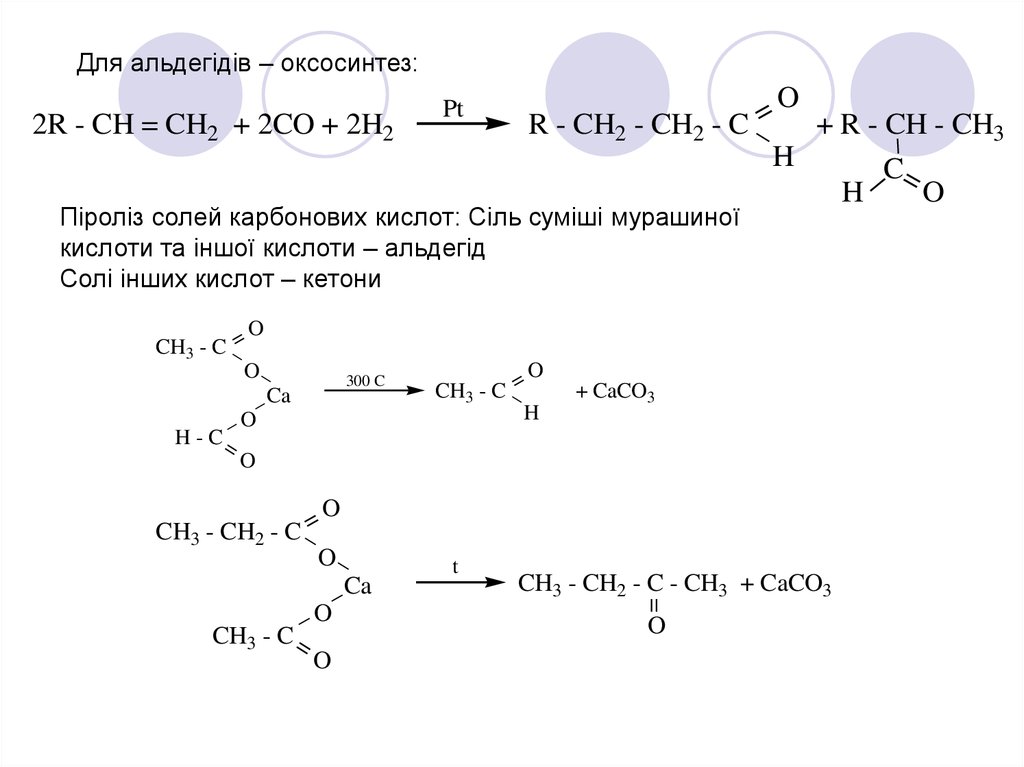
Для альдегідів – оксосинтез:O
=
R - CH2 - CH2 - C _
+ R - CH - CH3
H
C=
O
H
_
Піроліз солей карбонових кислот: Сіль суміші мурашиної
кислоти та іншої кислоти – альдегід
Солі інших кислот – кетони
O
CH3 - C _=
O_
_ Ca
_O
H - C=
O
300 C
t
+ CaCO3
CH3 - CH2 - C - CH3 + CaCO3
=
O
=
CH3 - CH2 - C _
O_
_ Ca
_O
CH3 - C=
O
O
=
_
CH3 - C
H
O
_
2R - CH = CH2 + 2CO + 2H2
Pt
27.
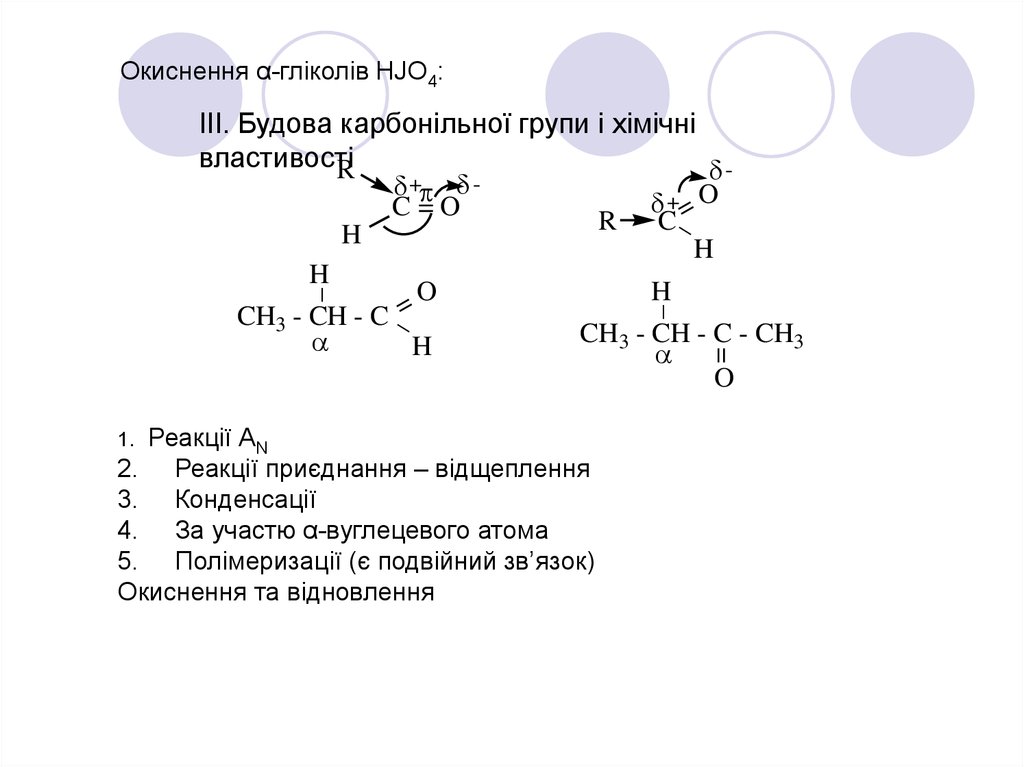
Окиснення α-гліколів HJO4:_
ІІІ. Будова карбонільної групи і хімічні
властивості
R
+ + _= O
C=O
R C
H
H
H
O
H
=
CH3 - CH - C _
CH3 - CH - C - CH3
H
O
_
=
Реакції АN
2. Реакції приєднання – відщеплення
3. Конденсації
4. За участю α-вуглецевого атома
5. Полімеризації (є подвійний зв’язок)
Окиснення та відновлення
1.
28.
Реакції нуклеофільного приєднання (АN) синильноїкислоти, NaHSO3, H2O, спиртів, реактивів Гріньяра, гідридів
металів.
1.
2.
Приєднання гідридів металів – реакція
відновлення LiH, LiAlH4, NaH, NaBH4
первинні спирти утворюються з альдегідів,
В
вторинні спирти утворюються з кетонів.
А.
CH3 _ _ OM
_C
H
H
_
CH3 _
_C=O + HM
H
CH3 - CH2 - OH
Приєднання HCN – утворення α-гідроксинітрилів (ціангідридів) –
проміжних сполук для одержання α-гідроксикислот
H - CN
OH
O
CH3
CH3 - CH2 - C - C = N
_ _
=
CH3 - CH2 - C - CH3
OH
нітрил -метил- -оксимасляної кислоти
_
CH3
_
CH3 - CH2 - C - COOH
OH
29.
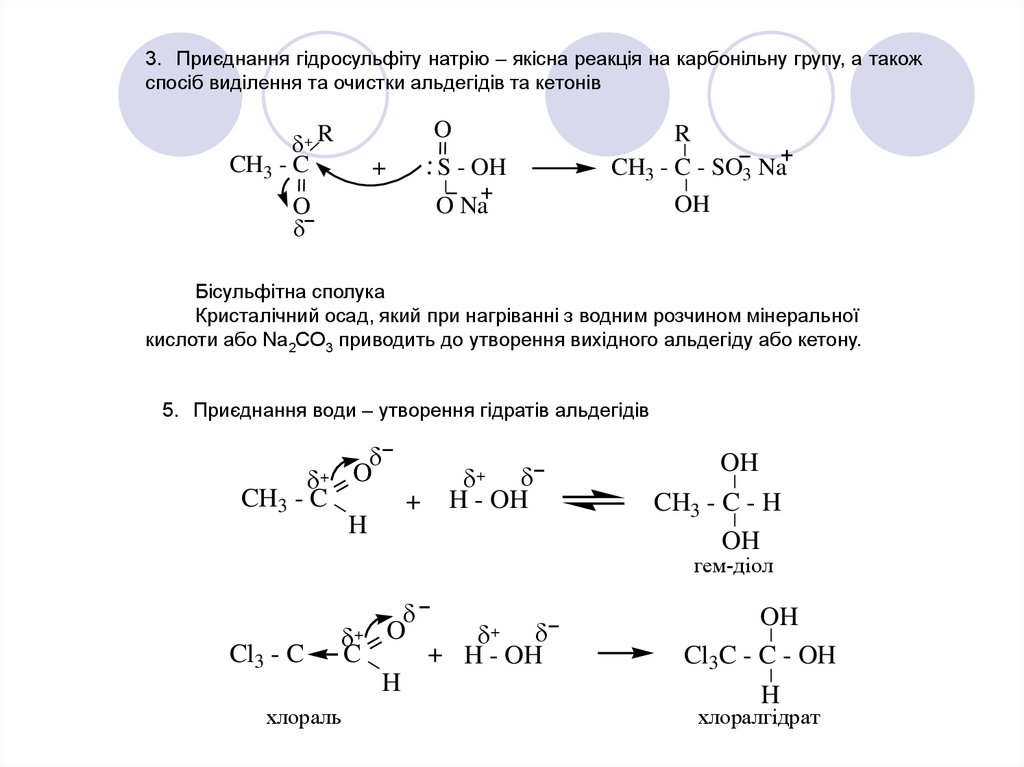
3. Приєднання гідросульфіту натрію – якісна реакція на карбонільну групу, а такожспосіб виділення та очистки альдегідів та кетонів
O
S - OH
_
=
+
R
CH3 - C - SO3 Na
O Na
O
_ _
=
+_R
CH3 - C
OH
Бісульфітна сполука
Кристалічний осад, який при нагріванні з водним розчином мінеральної
кислоти або Na2CO3 приводить до утворення вихідного альдегіду або кетону.
5. Приєднання води – утворення гідратів альдегідів
+
+
H - OH
OH
CH3 - C - H
OH
_ _
O
CH3 - C _=
H
+
гем-діол
OH
Cl3C - C - OH
H
_
хлораль
+
+ H - OH
_
Cl3 - C
O
_=
C
H
+
хлоралгідрат
30.
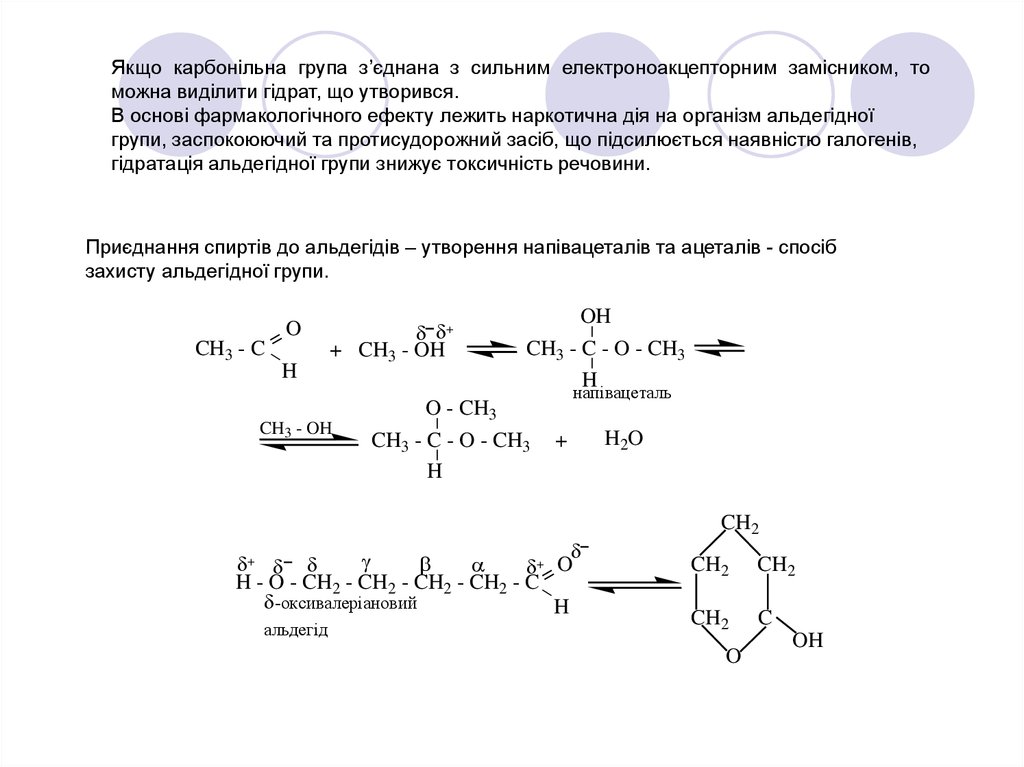
Якщо карбонільна група з’єднана з сильним електроноакцепторним замісником, томожна виділити гідрат, що утворився.
В основі фармакологічного ефекту лежить наркотична дія на організм альдегідної
групи, заспокоюючий та протисудорожний засіб, що підсилюється наявністю галогенів,
гідратація альдегідної групи знижує токсичність речовини.
Приєднання спиртів до альдегідів – утворення напівацеталів та ацеталів - спосіб
захисту альдегідної групи.
CH3 - C _=
H
+
+ CH3 - OH
O - CH3
CH3 - C - O - CH3
H
_ _
CH3 - OH
OH
CH3 - C - O - CH3
H
_ _
O
напівацеталь
+
+
+ = O
H - O - CH2 - CH2 - CH2 - CH2 - C _
-оксивалеріановий
H
альдегід
H2O
CH2
CH2
CH2
CH2
C
O
OH
31.
Ацеталі – стійкі в лужному середовищі, але легко гідролізуються до вільногоальдегіду у вільних кислотах. Якщо альдегідна група і спиртова знаходяться в
одній молекулі, то за рахунок внутрішньомолекулярної реакціївони утворюють
циклічні напівацеталі – стійкі, 5- та 6-ти членні.
Взаємодія з магнійорганічними сполуками (реактивом Гріньяра) – спосіб
одержання одноатомних спиртів.
Б. Реакції приєднання – відщеплення.
Альдегіди та кетони взаємодіють з аміаком та амінами типу H2N – х (де х =
Alk, OH, Ar, NH2 та ін.) з утворенням на першій стадії нестійких продуктів
приєднання, які стабілізуються за рахунок відщеплення води (ІІ стадія)
Ці реакції використовують для виділення альдегідів та кетонів з реакційної
суміші та їх ідентифікації, оскільки утворені похідні, як правило, є
кристалічними речовинами з чіткими t пл.
32.
R _ OHC_
R'
N-H
_
_
R'
-H2O
_
R_
C=N-X
R'
_
H _ R _ + - + N - X
H
C=O
X
NH3
-H2O
R_
C = NH
R' _
H2N-R"
R'
_
C=O
R' _
C = N-R" (2) основи Шиффа
R_
H2N-OH
R' _
C = N-OH (3)
R_
оксими (альдо- та кетоксими)
H2N-NH2
_
R'
_ C = N-NH2 (4)
R
гідразон
H2N-NH-C6H5
_
R'
_ C =_N-NH-C6H5 (5) фенілгідразон
O
R
R'
O
H2N-NH-C _=
_=
(6)
NH2
C
=
N-NH-C
_
NH2
семікарбазид
R
семікарбазон
R' _
S
S
=
H2N-NH-C _
(7)
C = N-NH-C _=
_
NH2
NH2
R
тіосемікарбазид
тіосемікарбазон
NO2
R' _
_ NO (8)
NO2
C = N-NH2
_
R
_
2,4-динітрофенілгідразон
H2N-NHNO
_
R _
(1)
2
33.
В результаті реакції (1) утворюються альдіміни, які полімеризуються – такБутлеров одержав при взаємодії формальдегіду з аміаком у співвідношенні
6:4 – уротропін (гексаметилентетрамін) – дезинфікуючий засіб при запаленні
сечовивідних шляхів – в кислому середовищі розщеплюється з виділення
формальдегід.
Іміни (реакція 2) – основи Шиффа – проміжні продукти в багатьох
ферментативних процесах, біосинтезі α-амінокислот в організмі, синтезі амінів
з альдегідів і кетонів з подальшим відновленням імінів
Реакція (4) дозволяє окрім гідразонів одержувати ще й азини:
R_
C = O + NH3
R'
-H2O
_
R'
2
R C = O + H2N - NH2
R_
C = NH
R'
H2/Ni
R_
CHNH2
R'
R' _
_ R' + 2H2O
C
=
N
N
=
C
R
R
азини
34.
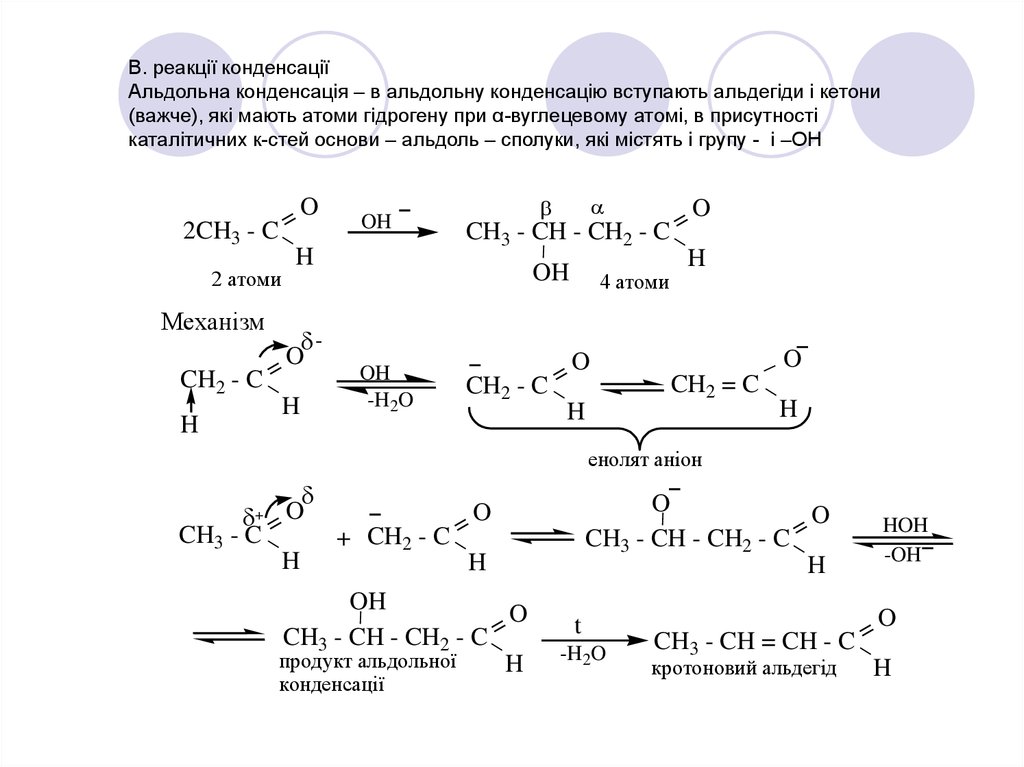
В. реакції конденсаціїАльдольна конденсація – в альдольну конденсацію вступають альдегіди і кетони
(важче), які мають атоми гідрогену при α-вуглецевому атомі, в присутності
каталітичних к-стей основи – альдоль – сполуки, які містять і групу - і –ОН
OH
2 атоми
Механізм
O
CH2 - C _=
H
H
O
=
_
CH3 - CH - CH2 - C
H
OH 4 атоми
_
O
=
2CH3 - C _
H
OH
-H2O
O
=
_
CH2 - C
H
_O
CH2 = C _
H
енолят аніон
O
O
=
CH3 - CH - CH2 - C _
H
O
_
O
CH3 - C _=
H
+
+ CH2 - C _=
H
_
OH
O
=
_
CH3 - CH - CH2 - C
продукт альдольної
H
конденсації
t
-H2O
HOH
-OH
O
=
CH3 - CH = CH - C _
кротоновий альдегід
H
35.
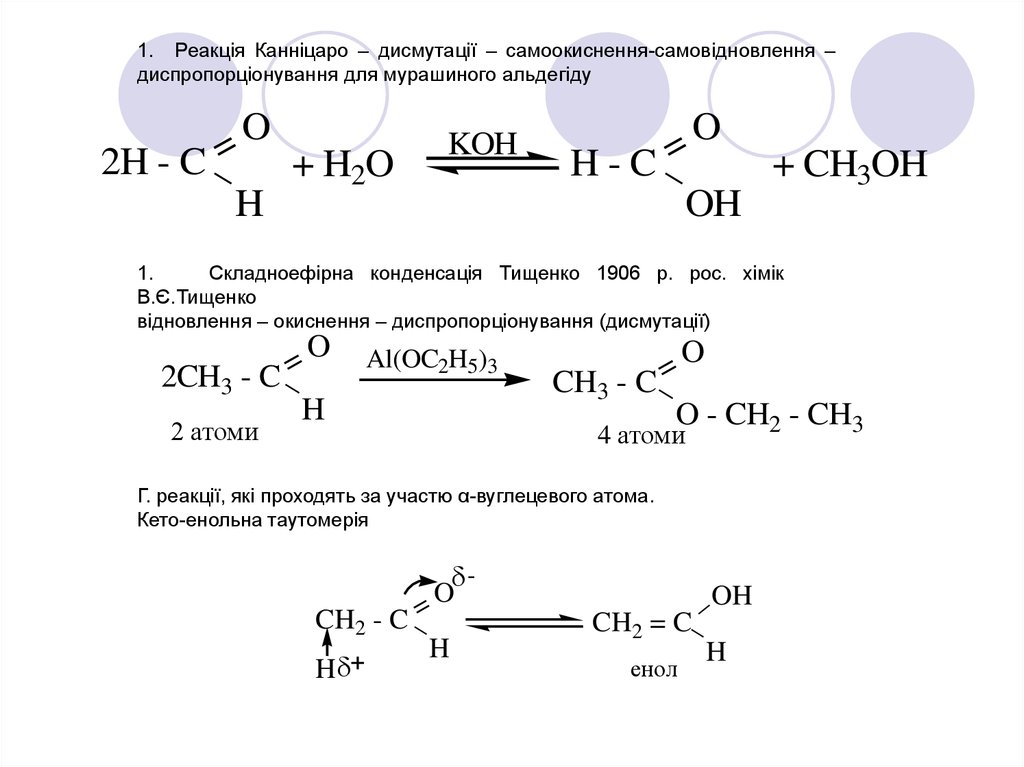
1. Реакція Канніцаро – дисмутації – самоокиснення-самовідновлення –диспропорціонування для мурашиного альдегіду
O
2H - C _= + H2O
H
KOH
O
H - C _=
+ CH3OH
OH
1.
Складноефірна конденсація Тищенко 1906 р. рос. хімік
В.Є.Тищенко
відновлення – окиснення – диспропорціонування (дисмутації)
O
=
2CH3 - C _
H
Al(OC2H5)3
2 атоми
O
=
CH3 - C _
O - CH2 - CH3
4 атоми
Г. реакції, які проходять за участю α-вуглецевого атома.
Кето-енольна таутомерія
O
OH
_
CH2 - C _=
H
H
CH2 = C _
енол
H
36.
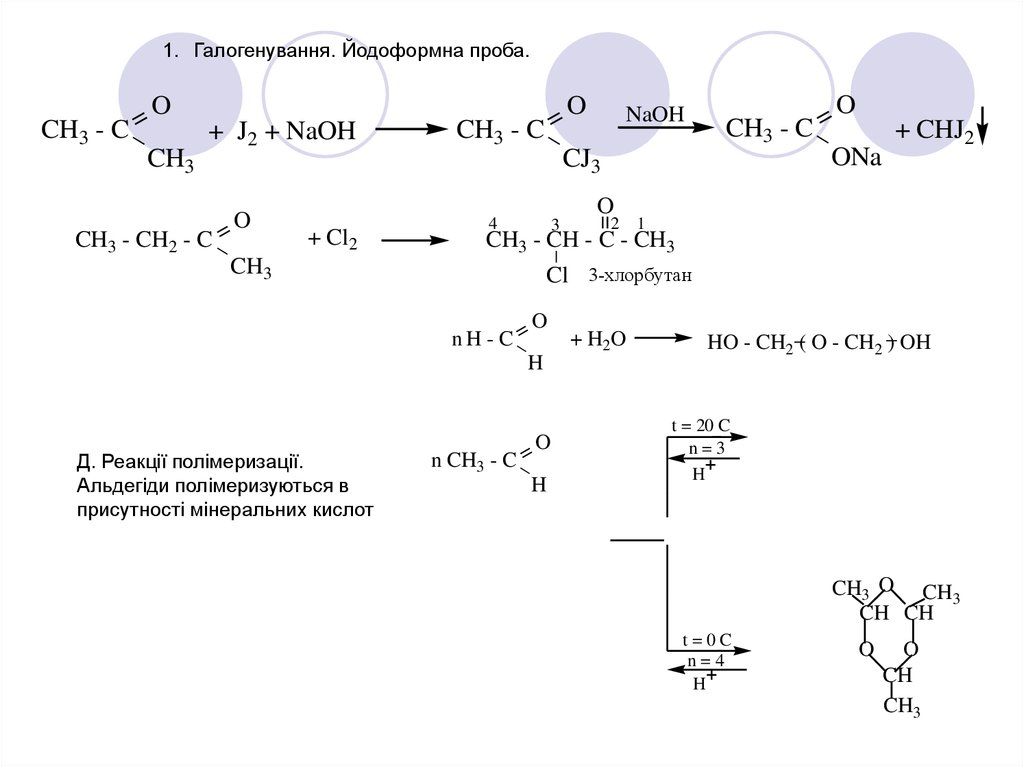
1. Галогенування. Йодоформна проба.O
=
CH3 - C _
+ J2 + NaOH
CH3
+ Cl2
O
2 1
CH3 - CH - C - CH3
4
3
_
CH3 - CH2 - C _=
CH3
Cl 3-хлорбутан
O
n H - C _=
H
Д. Реакції полімеризації.
Альдегіди полімеризуються в
присутності мінеральних кислот
O
=
_
CH3 - C
+ CHJ2
ONa
=
O
O NaOH
=
CH3 - C _
CJ3
O
n CH3 - C _=
H
+ H2O
HO - CH2_( O - CH2 _) OH
t = 20 C
n=3
H
CH3 O CH3
CH CH
t=0C
n=4
H
O
O
CH
CH3
37.
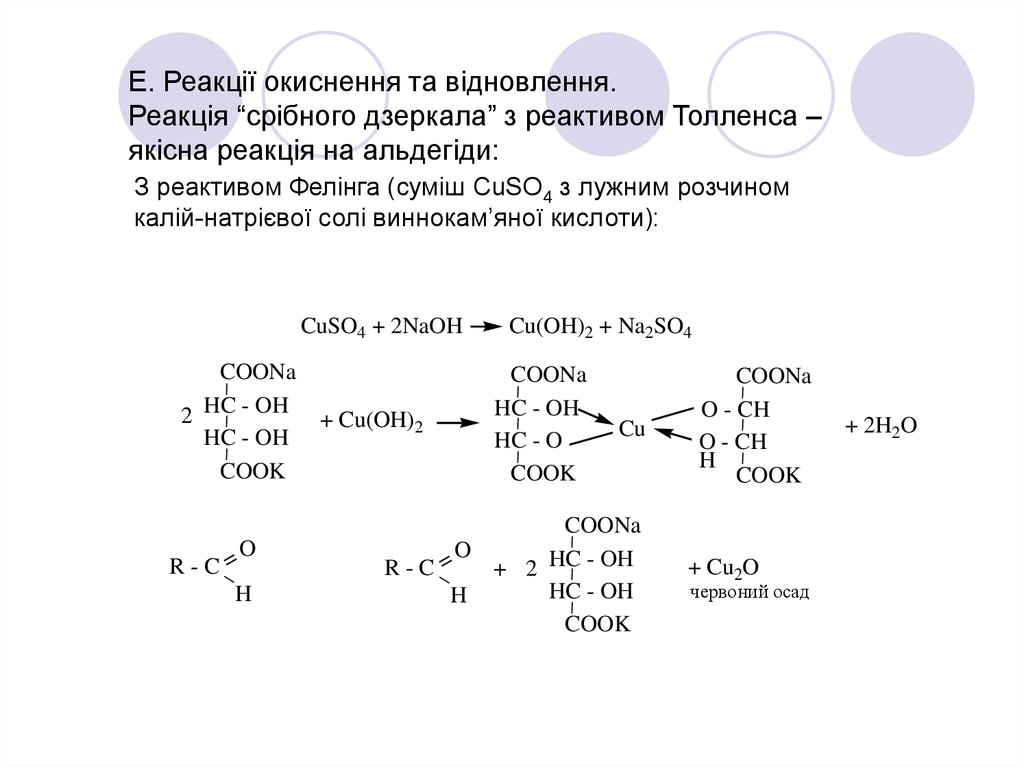
Е. Реакції окиснення та відновлення.Реакція “срібного дзеркала” з реактивом Толленса –
якісна реакція на альдегіди:
З реактивом Фелінга (суміш CuSO4 з лужним розчином
калій-натрієвої солі виннокам’яної кислоти):
O
R - C _=
H
Cu
COONa
O
=
R-C_
+ 2 HC - OH
HC - OH
H
COOK
COONa
O - CH
O - CH
H
COOK
_ _ _
+ Cu(OH)2
COONa
HC - OH
HC - O
COOK
_ _ _
_ _ _
COONa
2 HC - OH
HC - OH
COOK
Cu(OH)2 + Na2SO4
_ _ _
CuSO4 + 2NaOH
+ Cu2O
червоний осад
+ 2H2O
38.
Окиснення кетонів=
O
CH3 - CH2 - C - CH3
[O]
O
=
2CH3 - C _
H
O
=
CH3 -CH2-C _
H
O
=
2H - C _
H




















 chemistry
chemistry








