Similar presentations:
Карбонові кислоти
1.
Загальна характеристика карбонових кислот.Одноосновні насичені карбонові кислоти, будова, ізомерія,
номенклатури.
3. Методи одержання карбонових кислот.
4. Фізичні властивості карбонових кислот.
5. Хімічні властивості карбонових кислот
1.
2.
2.
Карбонові кислоти — органічні сполуки, щомають у складі своїх молекул одну або кілька
карбоксильних груп —СООН. Карбонові кислоти
— похідні вуглеводнів, у молекулах яких один або
кілька атомів Гідрогену заміщені на групи —
СООН. Карбоксильна група
(карбоксил) одновалентна атомна група, яку
можна розглядати як поєднання карбонільної С=
О і гідроксильної —ОН групи. Це і зумовлює
наявність у них кислотних властивостей.
3.
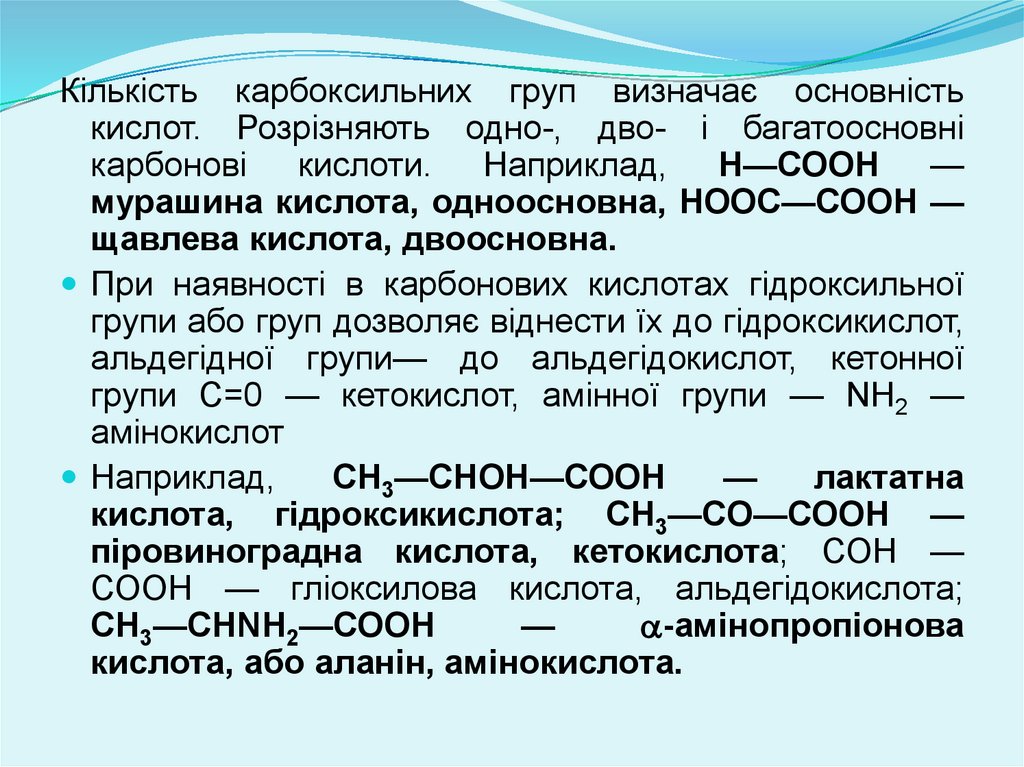
Кількість карбоксильних груп визначає основністькислот. Розрізняють одно-, дво- і багатоосновні
карбонові кислоти. Наприклад, Н—СООН —
мурашина кислота, одноосновна, НООС—СООН —
щавлева кислота, двоосновна.
При наявності в карбонових кислотах гідроксильної
групи або груп дозволяє віднести їх до гідроксикислот,
альдегідної групи— до альдегідокислот, кетонної
групи C=0 — кетокислот, амінної групи — NH2 —
амінокислот
Наприклад,
СН3—СНОН—СООН
—
лактатна
кислота, гідроксикислота; СН3—CO—СООН —
піровиноградна кислота, кетокислота; СОН —
СООН — гліоксилова кислота, альдегідокислота;
СН3—CHNH2—СООН
—
-амінопропіонова
кислота, або аланін, амінокислота.
4.
Одноосновні насичені кислотиОдноосновні насичені кислоти — похідні алканів, у молекулі яких
атом Гідрогену заміщений на карбоксильну групу. Іноді їх
називають кислотами жирного ряду, оскільки окремі з них
виділені з продуктів гідролізу жирів.
Загальна формула СnН2n+1 — СООН.
Н — СООН — мурашина, СН3—СООН — ацетатна,
С2Н5-СООН - пропіонова, С3Н7—СООН - масляна,
С4Н9-СООН — валеріанова, С5Н11—СООН —
капронова, С6Н13— СООН- енантова С7Н15-СООН каприлова, С8Н17 - СООН — пеларгонова, С9Н19—
СООН — капринова, С10Н21—СООН — ундеканова,
С11Н23—СООН — лауринова, С 12Н25—СООН —
дидеканова, С13Н,7—СООН — міристинова, С14Н29—
СООН — пентадецилова, С15Н31—СООН —
пальмітинова, С16Н33—СООН — маргаринова,
С17Н35—СООН — стеаринова кислоти.
5.
Способиодержання. Карбонові кислоти в
природі знаходяться у вільному (наприклад,
мурашина — у виділеннях мурашок, у сечі та поті
тварин, кропиві, деяких овочах і фруктах) і
зв'язаному
(наприклад,
ВЖК
у
вигляді
тригліцеридів — жирів) станах. ВЖК одержують
гідролізом нейтральних жирів і олій. Більшість
карбонових
кислот
одержують
методами
органічного синтезу.
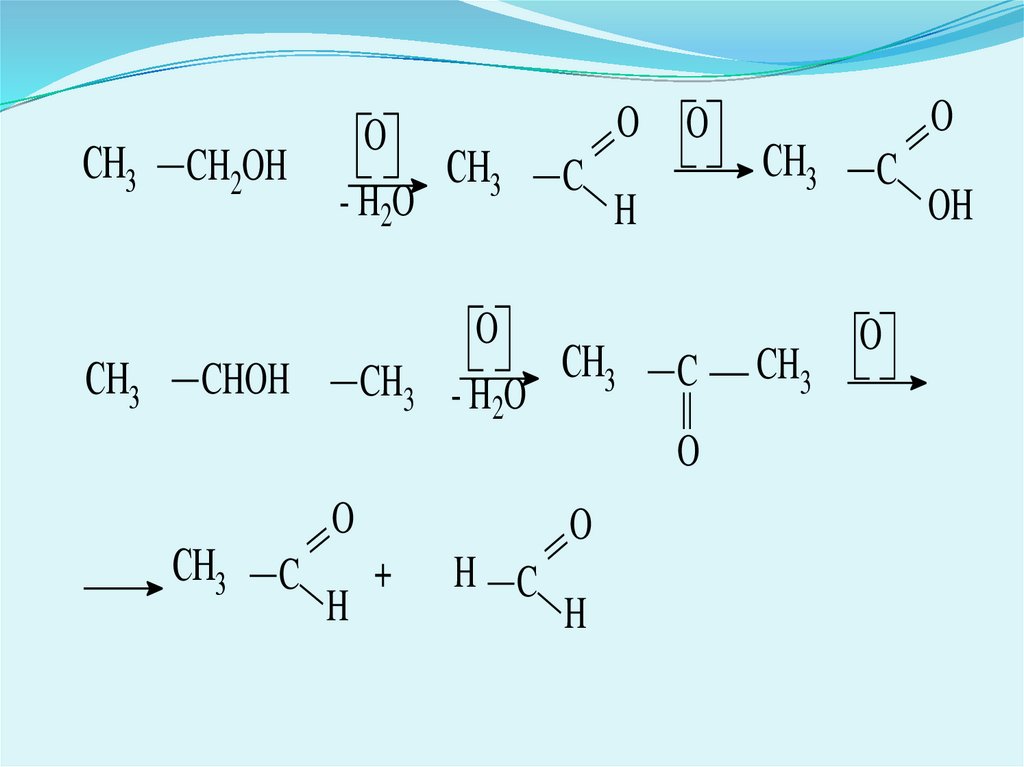
1. Окиснення первинних (утворюється одна
кислота),
вторинних
або
третинних
(утворюються дві кислоти, іноді альдегіди і
кетони, а також інші продукти) спиртів:
6.
СH3СH3
CH2OH
O
СH3
- H2O
CHOH
CH3
O
C
O
H
O
СH3
- H2O
C
O
СH3
O
C
H
O
+
H C
H
СH3
CH3
O
C
O
OH
7.
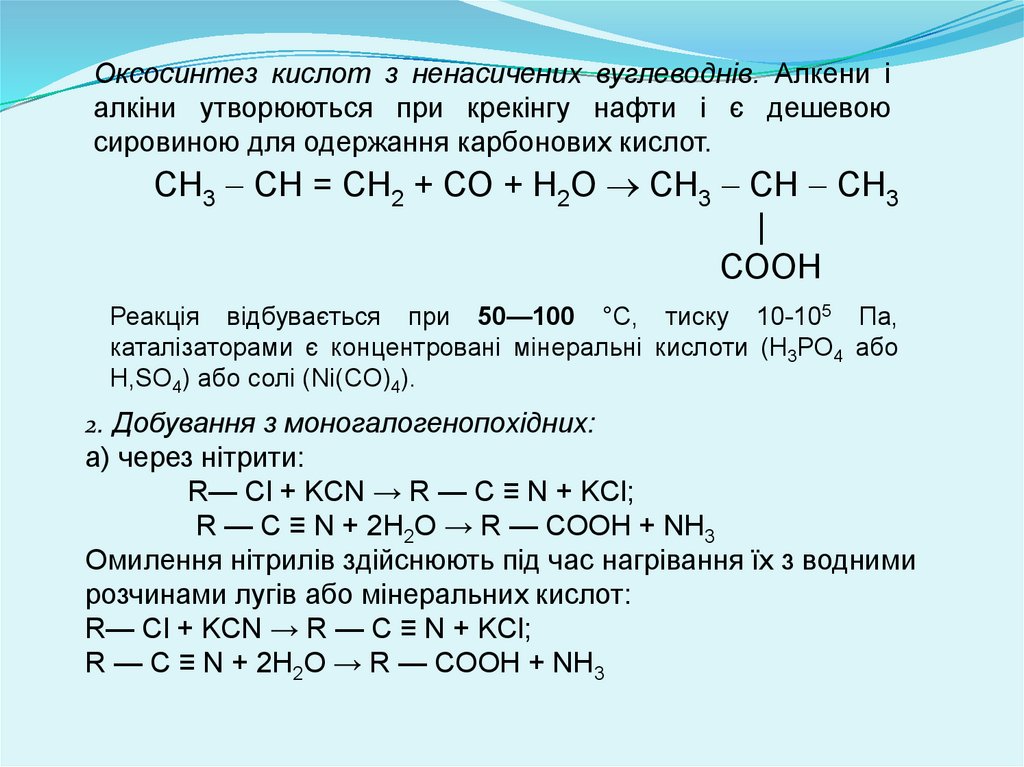
Оксосинтез кислот з ненасичених вуглеводнів. Алкени іалкіни утворюються при крекінгу нафти і є дешевою
сировиною для одержання карбонових кислот.
СН3 СН = СН2 + СО + Н2О СН3 СН СН3
|
СООН
Реакція відбувається при 50—100 °С, тиску 10-105 Па,
каталізаторами є концентровані мінеральні кислоти (Н3РО4 або
H,SO4) або солі (Ni(CO)4).
2. Добування з моногалогенопохідних:
а) через нітрити:
R— Cl + KCN → R — C ≡ N + KCl;
R — C ≡ N + 2H2O → R — COOH + NH3
Омилення нітрилів здійснюють під час нагрівання їх з водними
розчинами лугів або мінеральних кислот:
R— Cl + KCN → R — C ≡ N + KCl;
R — C ≡ N + 2H2O → R — COOH + NH3
8.
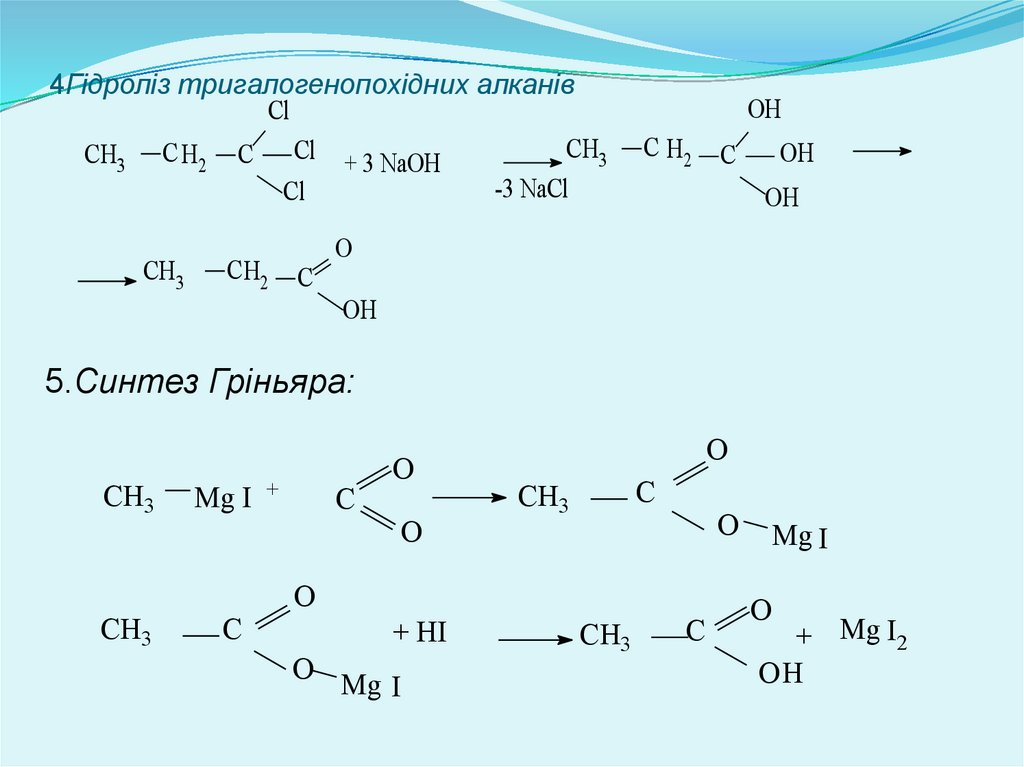
4Гідроліз тригалогенопохідних алканівCl
СH3
СH3 C H2 C Cl + 3 NaOH
-3 NaCl
Cl
СH3
C H2
C
OH
C H2
OH
C
OH
O
OH
5.Синтез Гріньяра:
СН3
Mg I +
C
O
O
O
C
СН3
O
O
СН3
C
+ HI
O
Mg I
СН3
C
Mg I
O
+ Mg I2
OH
9.
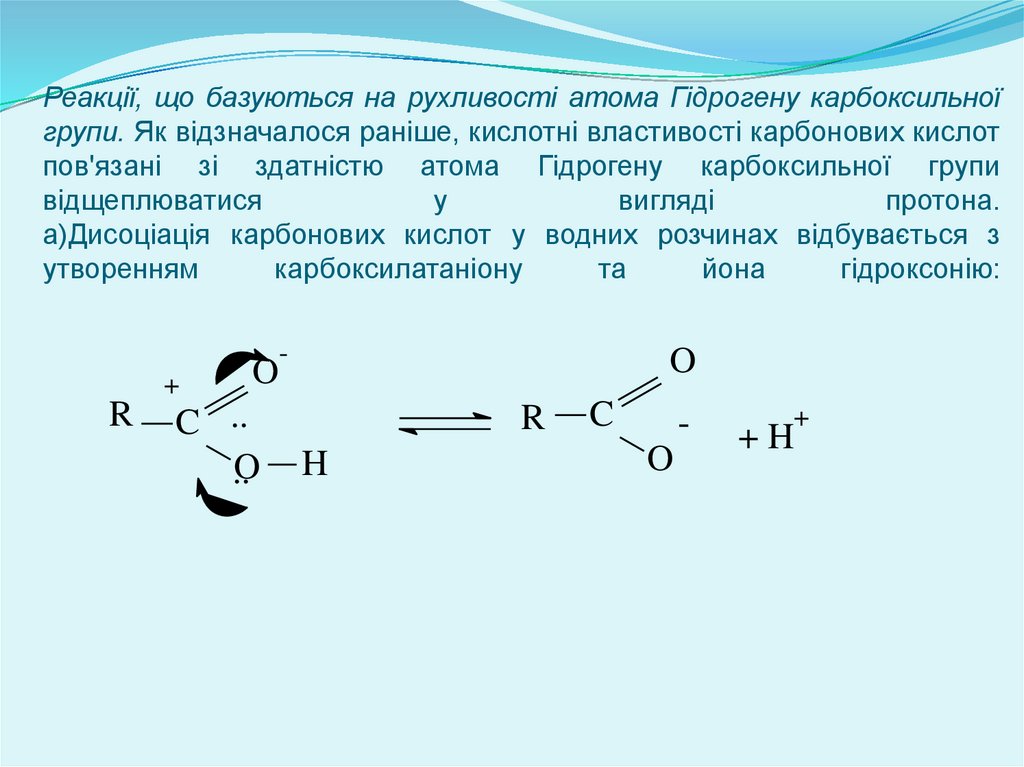
Реакції, що базуються на рухливості атома Гідрогену карбоксильноїгрупи. Як відзначалося раніше, кислотні властивості карбонових кислот
пов'язані зі здатністю атома Гідрогену карбоксильної групи
відщеплюватися
у
вигляді
протона.
а)Дисоціація карбонових кислот у водних розчинах відбувається з
утворенням
карбоксилатаніону
та
йона
гідроксонію:
-
+
R
O
O
C ..
..O
R
H
C
O
+
+H
10.
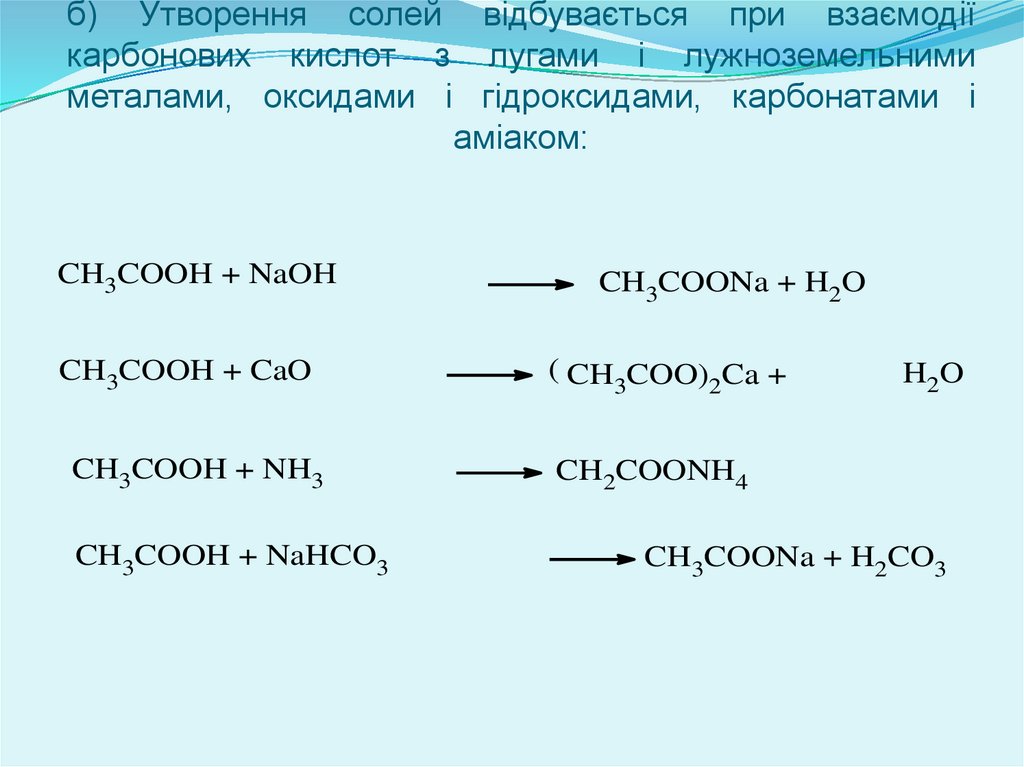
б) Утворення солей відбувається при взаємодіїкарбонових кислот з лугами і лужноземельними
металами, оксидами і гідроксидами, карбонатами і
аміаком:
CH3COOH + NaOH
CH3COONa + H2O
CH3COOH + CaO
( CH COO) Ca +
CH3COOH + NH3
CH2COONH4
CH3COOH + NaHCO3
3
2
H2 O
CH3COONa + H2CO3
11.
2. Реакції заміщення гідроксилу карбоксильної групи на атоми іатомні групи приводять до утворення функціональних похідних
карбонових
кислот.
Залежно від хімічної природи реагенту карбонові кислоти можуть
утворювати
ряд
функціональних
похідних
—
естери,
галогеноангідриди, ангідриди кислот, аміди кислот, продукти
відновлення
тощо.
а) Утворення естер і в (реакція естерифікації) відбувається при
взаємодії карбонової кислоти зі спиртами в присутності
концентрованих
мінеральних
кислот
O
R
C
OH
R
O
+
C
OH
-
H+
+ R1OH
+H+
- H+
R
O
R
+
C
O
+
C
O
H
O
H
R1
H2O
12.
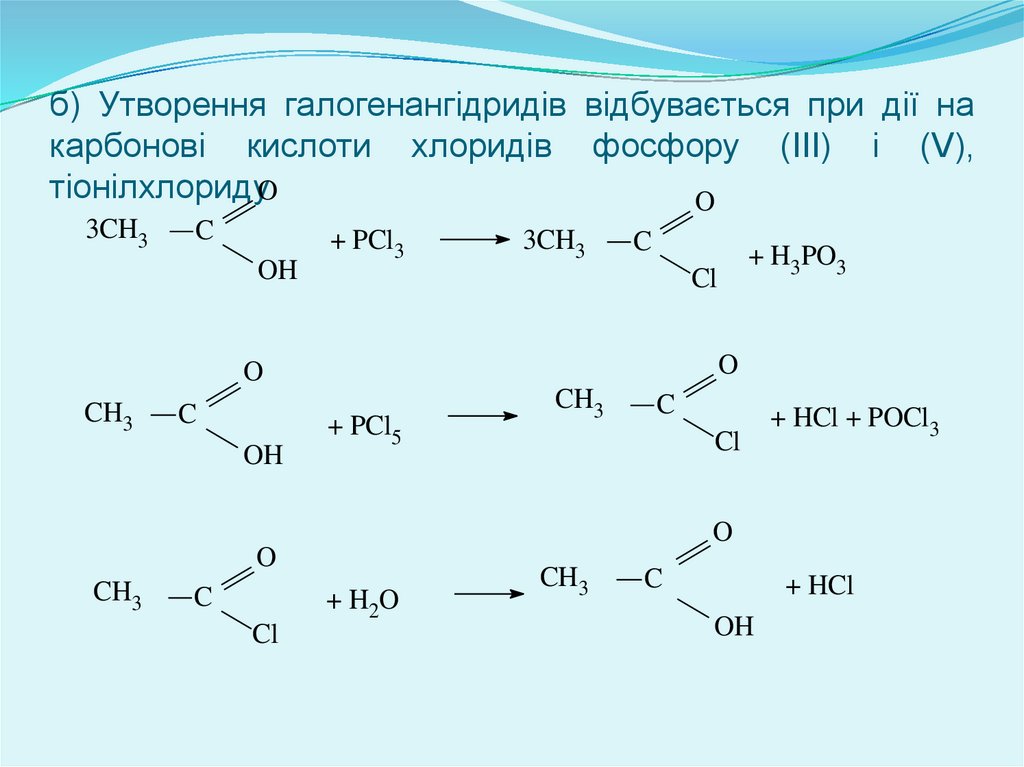
б) Утворення галогенангідридів відбувається при дії накарбонові кислоти хлоридів фосфору (III) і (V),
тіонілхлоридуO
O
3CH3
C
OH
+ PCl3
3CH3
C
Cl
O
O
CH3
C
OH
+ PCl5
C
+ H2O
Cl
CH3
C
Cl
+ HCl + POCl3
O
O
CH3
+ H3PO3
CH3
C
+ HCl
OH
13.
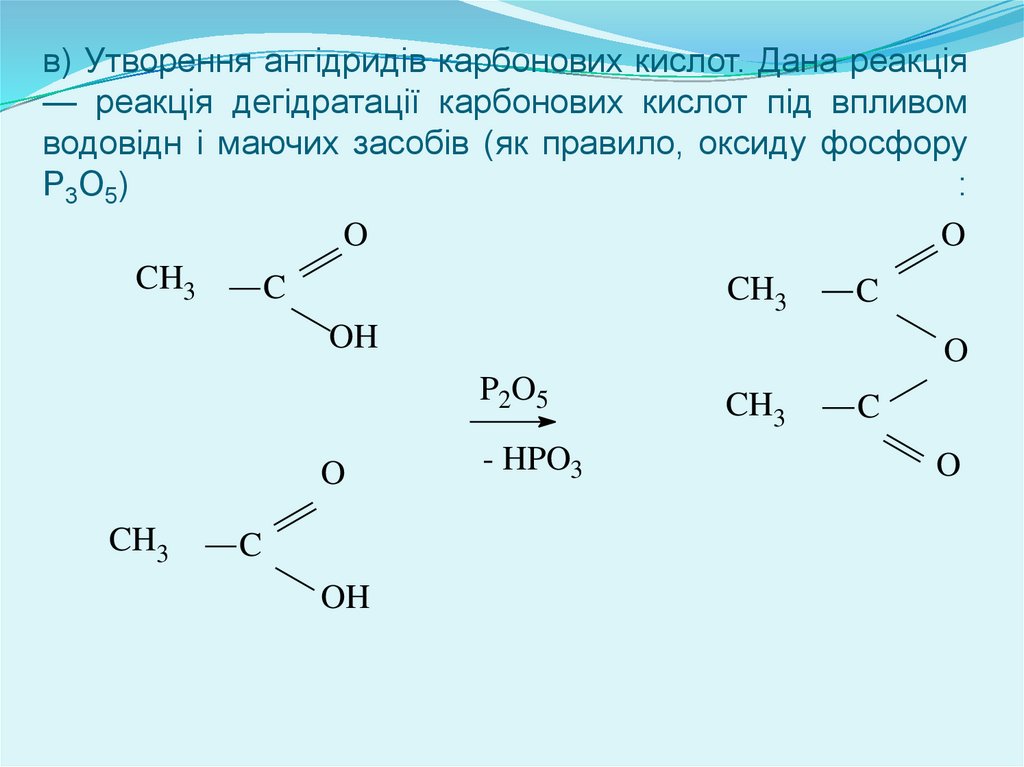
в) Утворення ангідридів карбонових кислот. Дана реакція— реакція дегідратації карбонових кислот під впливом
водовідн і маючих засобів (як правило, оксиду фосфору
Р3О5)
:
O
O
CH3
C
CH
C
3
OH
O
P2O5
O
CH3
C
OH
- HPO3
CH3
C
O
14.
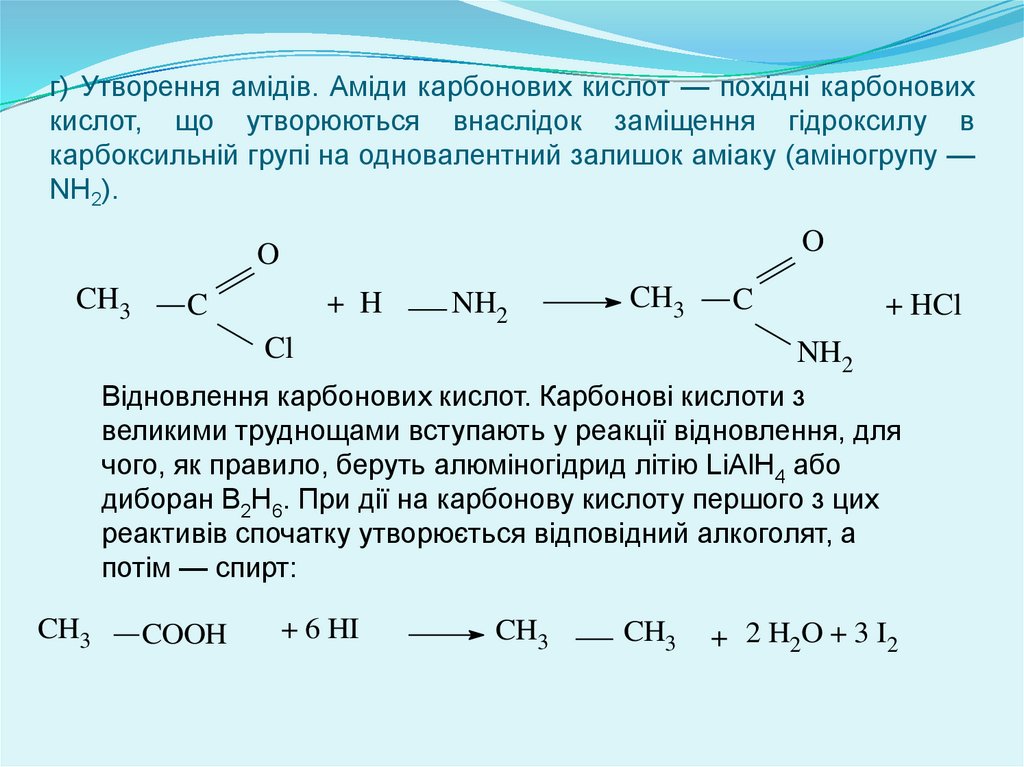
г) Утворення амідів. Аміди карбонових кислот — похідні карбоновихкислот, що утворюються внаслідок заміщення гідроксилу в
карбоксильній групі на одновалентний залишок аміаку (аміногрупу —
NH2).
O
O
CH3
+ H
C
NH2
CH3
Cl
C
+ HCl
NH2
Відновлення карбонових кислот. Карбонові кислоти з
великими труднощами вступають у реакції відновлення, для
чого, як правило, беруть алюміногідрид літію LiAlH4 або
диборан В2Н6. При дії на карбонову кислоту першого з цих
реактивів спочатку утворюється відповідний алкоголят, а
потім — спирт:
CH3
COOH
+ 6 HI
CH3
CH3
+ 2 H2O + 3 I2
15.
. Реакції за участю радикалів. Алкільний радикал карбонов кислотиможе вступати в реакції вільнорадикального галогенування, типового
для
алканів,
а
також
в
реакції
окиснення.
а) Галогенування насичених аліфатичних карбонових кислот (реакція
Гелля — Фольгарда — Зелінського).
CH3
COOH
+ Cl2
COOH
CH2
+ HCl
Cl
Cl
CH2
COOH
+ Cl2
COOH
+ HCl
Cl
Cl
CHCl2
CH
COOH + Cl2
CCl3
COOH
+ HCl
16.
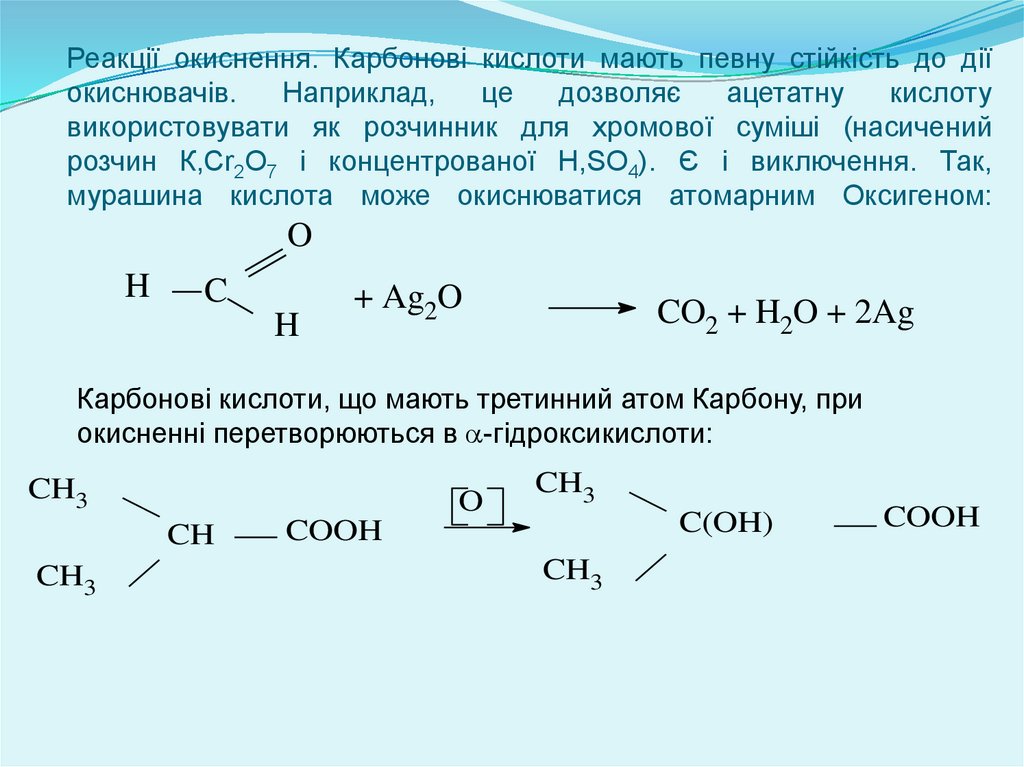
Реакції окиснення. Карбонові кислоти мають певну стійкість до діїокиснювачів.
Наприклад,
це
дозволяє
ацетатну
кислоту
використовувати як розчинник для хромової суміші (насичений
розчин К,Сr2О7 і концентрованої H,SO4). Є і виключення. Так,
мурашина кислота може окиснюватися атомарним Оксигеном:
O
H
C
H
+ Ag2O
CO2 + H2O + 2Ag
Карбонові кислоти, що мають третинний атом Карбону, при
окисненні перетворюються в -гідроксикислоти:
CH3
O
CH
CH3
CH3
C(OH)
COOH
CH3
COOH
17.
При дії на карбонові кислоти пероксиду гідрогенуутворюються
-гідроксикислоти:
CH3
CH2
CH2
COOH
+ H2O2
- H2O
CH3
CH(OH)
CH2
COOH
18.
в) -Oкиснення карбонових кислот. Відбувається в клітинах живихорганізмів. При цьому під впливом відповідних ферментів поступово
скорочується карбоновий ланцюг радикала на два атома Карбону,
починаючи від карбоксильного кінця. Двокарбоновий фрагмент
утворює з КоА ацетил-КоА, який у циклі трикарбонових кислот (циклі
Кребса) перетворюючись в АТФ і її структурні аналоги, є джерелом
хімічної енергії.
-2H
CH2
CH
+ H2O
COOH
CH3
+
CH3
-2H
C
O
CH2
COOH
COOH
COOH
CHOH
CH2
CH
CH2
CH3
CH3
CH3
CH3
COOH
COOH
+ 2H2O








 chemistry
chemistry