Similar presentations:
«Контейнерная химия»: комплексоны, комплексообразование, применение
1.
«Контейнерная химия»:комплексоны,
комплексообразование,
применение
2.
Жесткость лиганда3.
Предорганизация лиганда4.
Подандокоронанды(лариат-эфиры)
HO
OMe
O
O
N
O
O
O
MeO
OH
HO
O
O
N
HO
O
O
O
N
N
N
N
O
O
O
O
N
O
HO
OH
HO
OH
5.
Лариат - эфиры6.
Реагенты для магнитно-резонансной томографииРеагенты для получения радиофармакологических препаратов
7.
Геометрическое соответствие8.
Плотность заряда катиона9.
Константы устойчивости комплексов с катионамисеребра в различных неводных полярных растворителях
H
H
Растворитель
H
N
N
H
O
O
O
O
O
O
O
O
N
N
O
O
O
N
H
O
N
H
метанол
этанол
7.5
7.4
ДМСО
ацетонитрил
5.7
6.4
9.4
7.4
7.9
пропилен
карбонат
нитрометан
13.2
15.6
14.9
10.3
13.0
12.7
10.0
9.4
9.3
6.7
7.9
10.
11.
Валиномицин12 фрагментов окси- и аминокислот;
водородные связи RNH--O=COR
природа растворителя влияет на структуру валиномицина: в неполярных
растворителях она овальна, а в полярных растворителях становится
пропеллером.
12.
Образование комплексов с анионами13.
Образование комплексов с анионамиH
H
N
N
+
H
H
H
H
N
H
H
N
+
N
Cl-, RCOO-, HxP2O7n-
N
H
H
N
N
+
N
H
H
O - O
C
R
P2O7-4, HP2O7-3, H2P2O7-2
14.
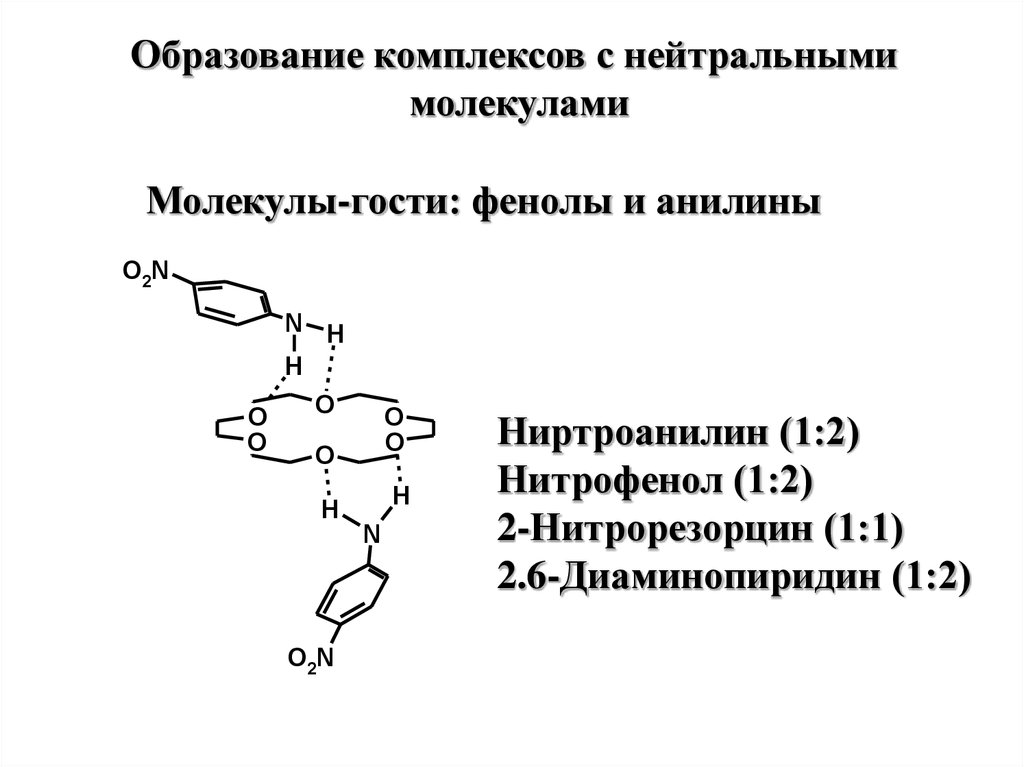
Образование комплексов с нейтральнымимолекулами
Молекулы-гости: фенолы и анилины
O2N
N H
H
O
O
O
O
O
O
H
H
N
O2N
Ниртроанилин (1:2)
Нитрофенол (1:2)
2-Нитрорезорцин (1:1)
2.6-Диаминопиридин (1:2)
15.
Циклофаны и нейтральные молекулыNH2
Me
Me
NH
HN
NH
HN
Me
Me
HN
HN
HO3S
NH
NH
16.
17.
18.
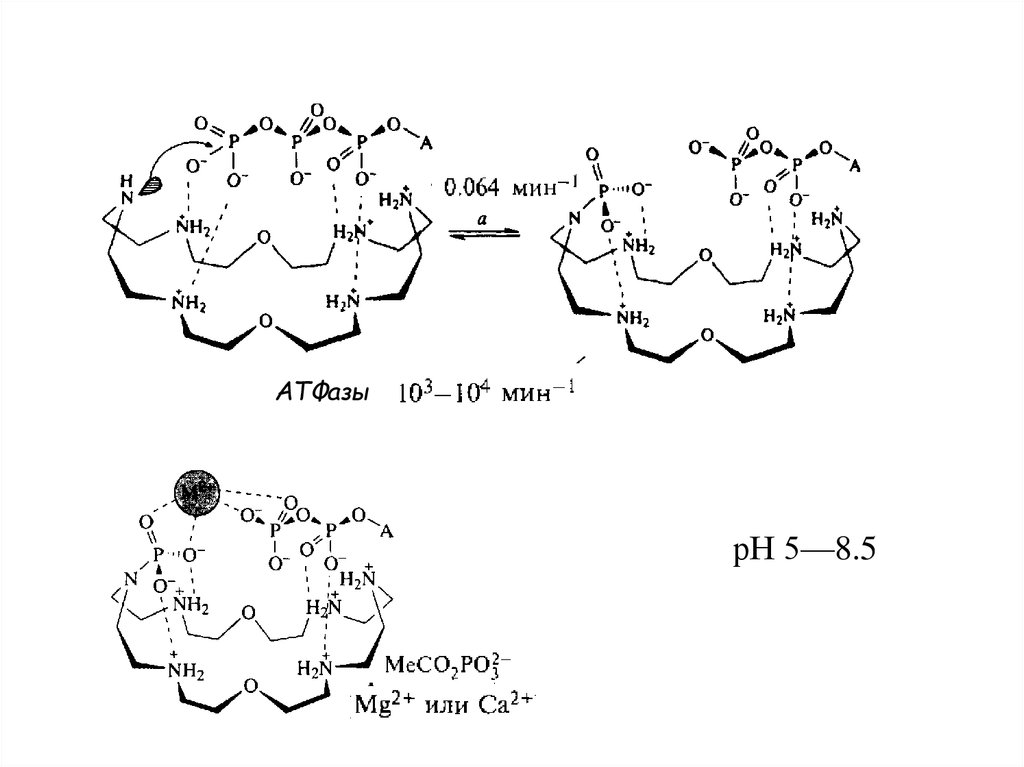
Гидролиз АТР в физиологических условияхПри физиологическом значении рН
и 30 °С период, за который половина количества
молекул превращается в аденозинмонофосфат (AMP), равен только 6 с, в то
время как этот параметр для некатализируемой реакции составляет, по оценкам,
3 000 000 лет. Ускорение – 1013 раз.
19.
АТФазырН 5—8.5
20.
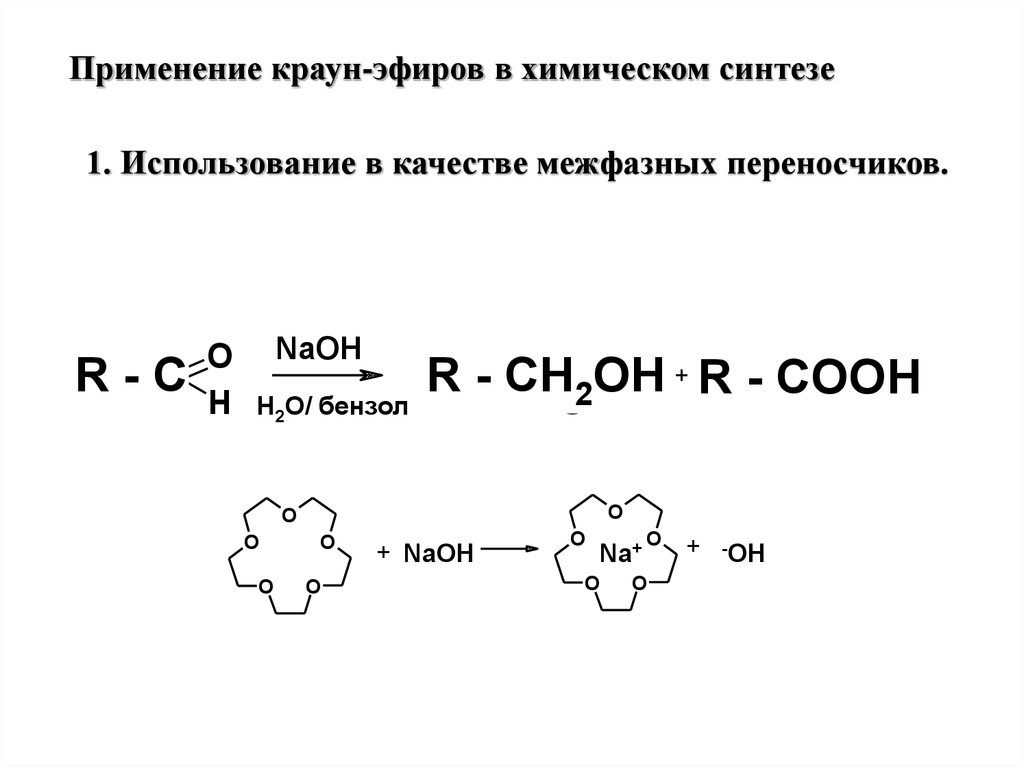
Применение краун-эфиров в химическом синтезе1. Использование в качестве межфазных переносчиков.
R-C
O
H
NaOH
H2O/ бензол
+ R - COOH
O
R - CH
OH
O2
O
O
O
O
O
O
+ NaOH
O
Na+
O
O
O
+
-OH
21.
Применение краун-эфиров в химическом синтезе2. Модификация химической реакционной способности
Активация анионов:
O
(HOOC)2CH + R-C
(HOOC)2CH2
H
H
-H2O
HOOC-CH=CHR
(HOOC)2CH-C-R
-CO2
-OMe
OH
O
O
O
O
O
O
+ NaOMe
O
Na+
O
O
O
+
-OMe
22.
Применение краун-эфиров в химическом синтезе2. Модификация химической реакционной способности
R-C
O
H
LiAlH4
O
O
O
O
O
R - CH
OH
2
O
23.
Применение краун-эфиров в аналитичекой химииЭкстракция (природные ионофоры).
Разделение катионов (щелочноземельных, тяжелых;
бинафтил-18-краун-6 - суперселективность к Sr2+
дициклогексан-18-краун-6 - с Co2+ в приcутствии Zn,
Ni, Cu, Pb, Sn ).
Большая перспектива в использовании краун-соединений
открылась в области разделения изотопов. Например, можно
отделить кальций-40 от кальция-44, разделить натрий-23 и
натрий-24, литий-6 и литий-7, изотопы радиоактивных
элементов. Это может иметь огромное значение для создания
будущих реакторов термоядерного синтеза.
Концентрирование микропримесей (радионуклидов)
24.
Применение краун-эфиров в аналитической химииКолоночная хроматография (низкого, высокого
давления и ионная хроматография).
Ионнообменники
- сополимер винилзамещенных краун-соединений.
Разделение катионов, анионов,
производных мочевины, гетероциклических соединений.
25.
Применение краун-эфиров в физической химииФотометрия (экстракция пикратов в орг. фазу, анализ кол-ва
экстрагируемого ве-ва оптическим методом).
Потенциометрия (использование макроцикла в титрующем
расворе).
Полярография (катионы, образующие комплексы, сильно
адсорбируются на капельном электроде).
Кондуктометрия (изменение электропроводности в присутствии
и отсутствии карун-соединений).
Ион-селективные электроды (переносчики в электродах).
26.
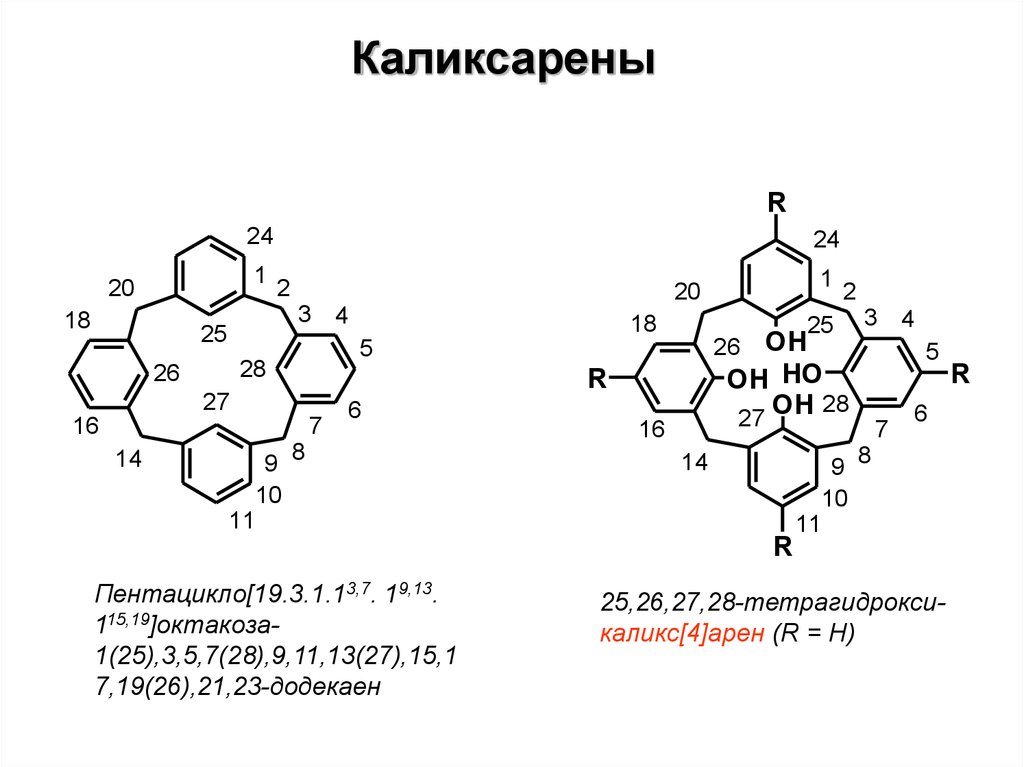
Каликсарены27.
28.
КаликсареныR
24
1
20
18
24
2
3 4
25
7
14
25
6
9 8
10
11
OH
OH HO
OH 28
27
16
14
R
Пентацикло[19.3.1.13,7. 19,13.
115,19]октакоза1(25),3,5,7(28),9,11,13(27),15,1
7,19(26),21,23-додекаен
2
3 4
26
R
27
16
18
5
28
26
1
20
5
7
6
9 8
10
11
25,26,27,28-тетрагидроксикаликс[4]арен (R = H)
R
29.
Особенности каликсаренов:• высокая температура плавления
• низкая растворимость в органических
растворителях
Физико-химические методы исследования
•ИК-спектры: валентные колебания ОН-групп в области 3200 см-1
•В УФ-спектрах имеется полоса поглощения при 280-288 нм
•ЯМР-спектры: более простые спектры по сравнению с линейными
аналогами
•Масс-спектры: распад с сохранением циклической структуры и
отщеплением заместителей
30.
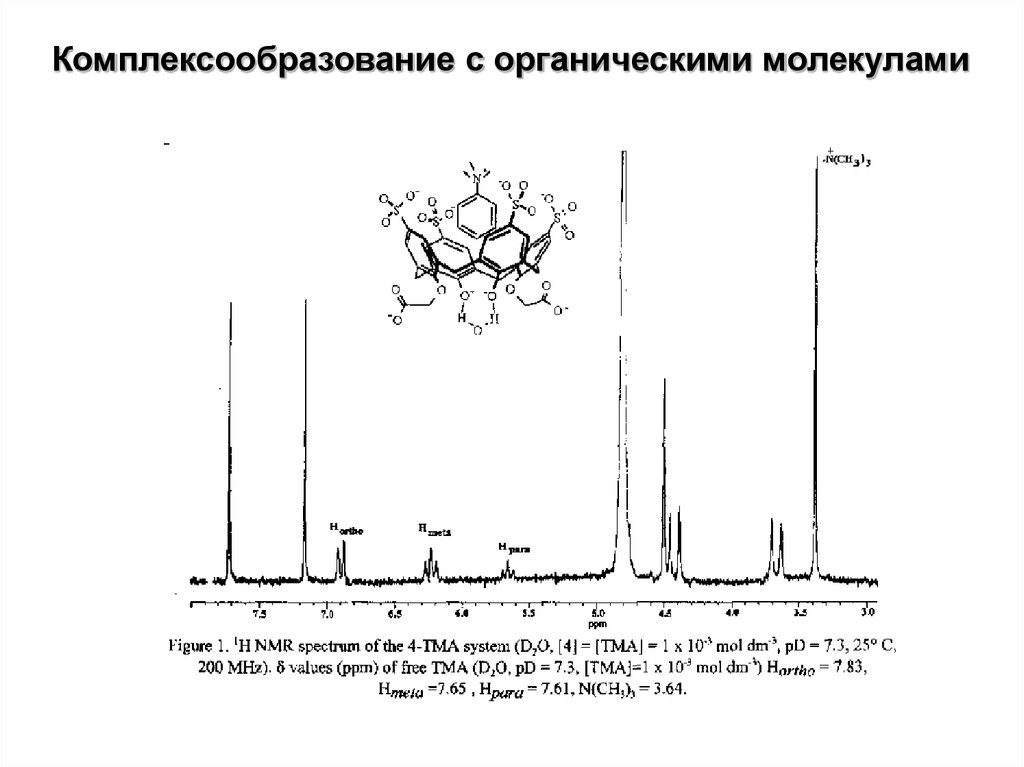
Комплексообразование c органическими молекулами31.
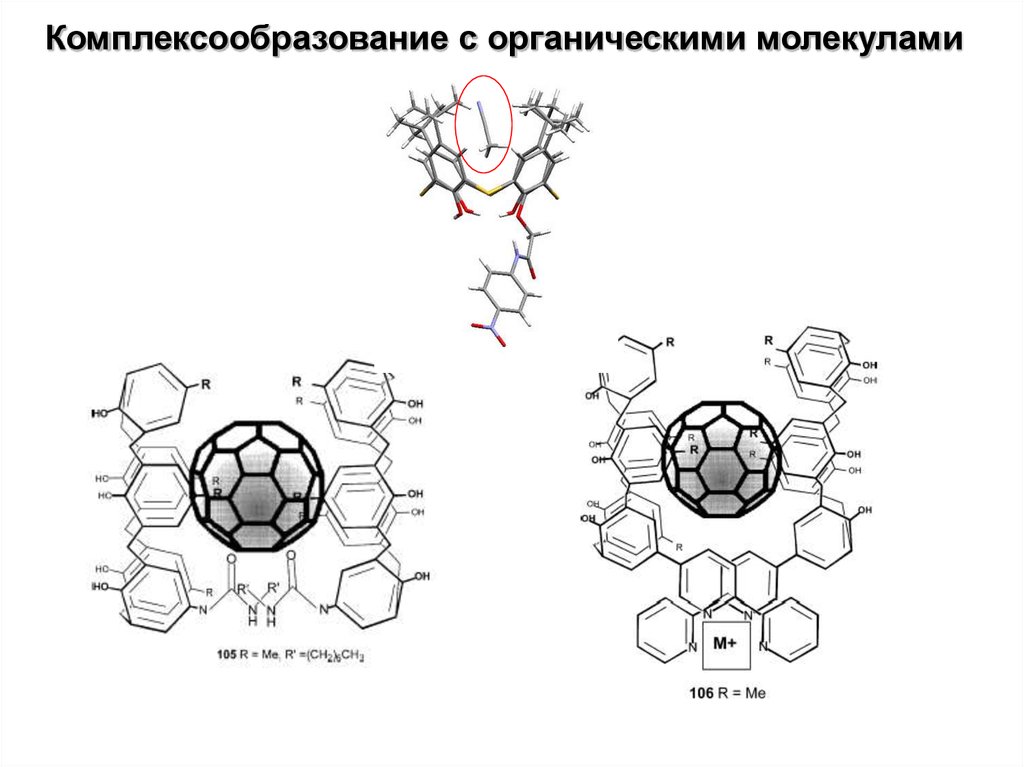
Комплексообразование c c органическими молекулами32.
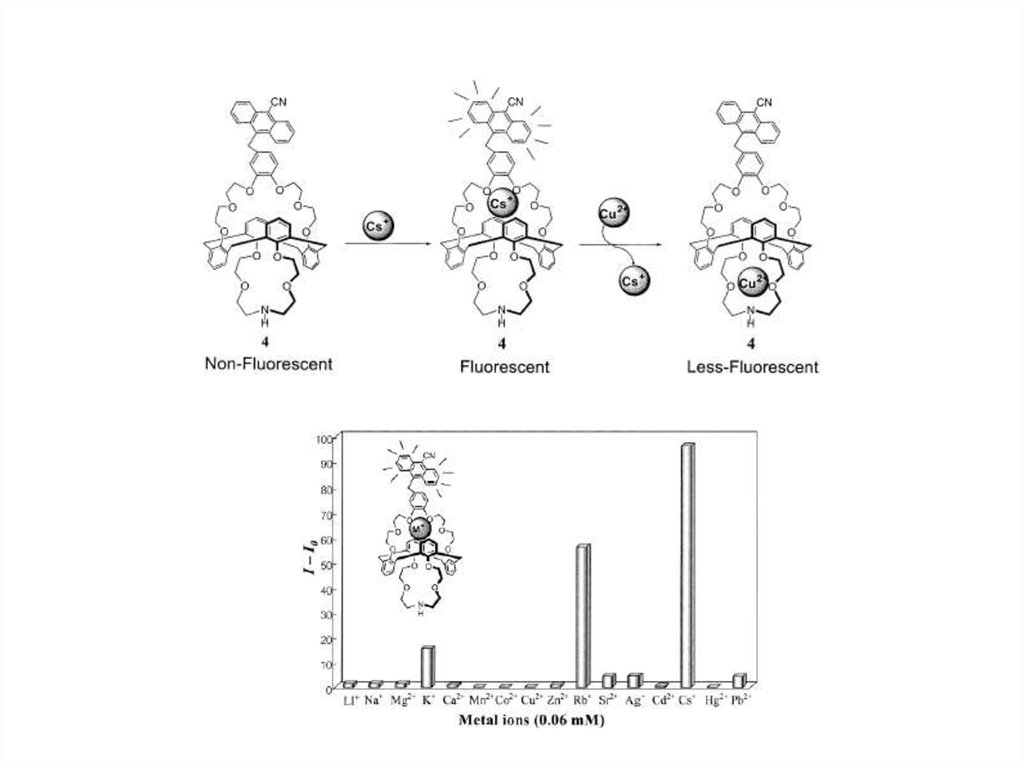
Комплексообразование c органическими молекулами33.
34.
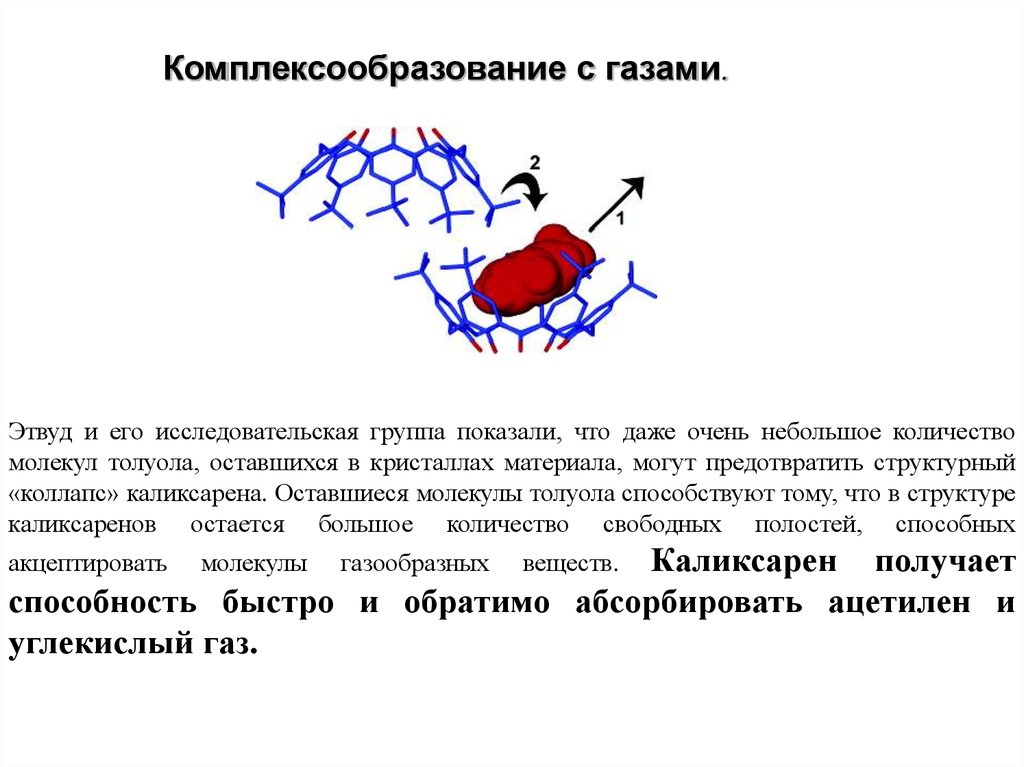
Комплексообразование с газами.Этвуд и его исследовательская группа показали, что даже очень небольшое количество
молекул толуола, оставшихся в кристаллах материала, могут предотвратить структурный
«коллапс» каликсарена. Оставшиеся молекулы толуола способствуют тому, что в структуре
каликсаренов остается большое количество свободных полостей, способных
Каликсарен получает
способность быстро и обратимо абсорбировать ацетилен и
углекислый газ.
акцептировать
молекулы
газообразных
веществ.
35.
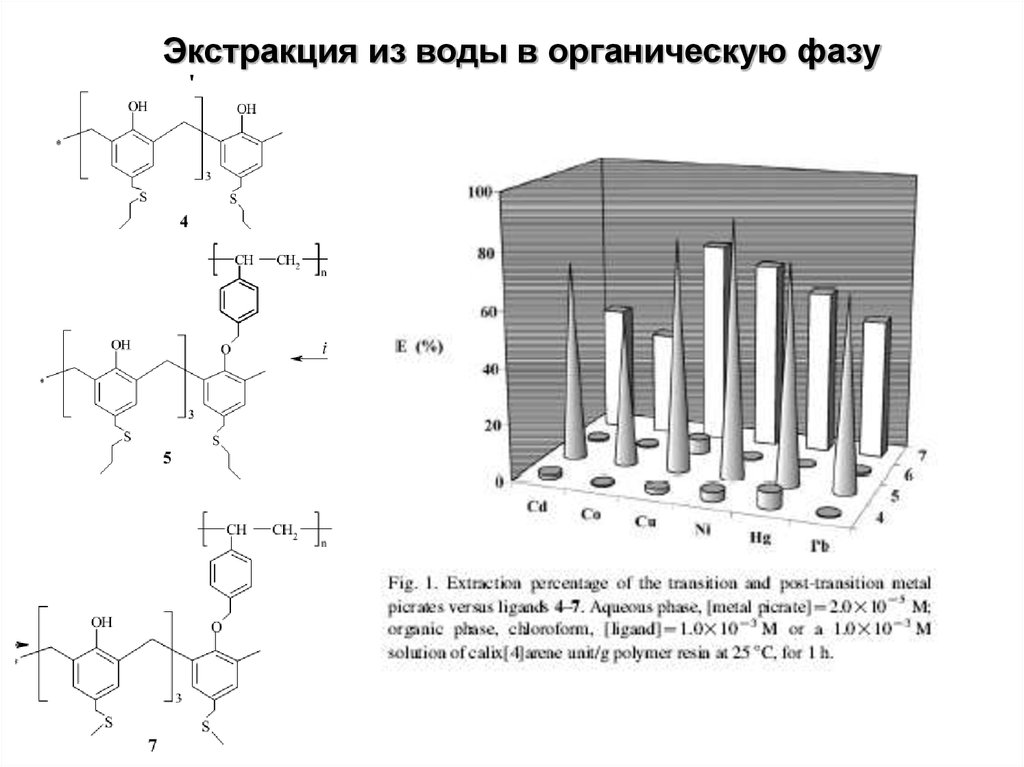
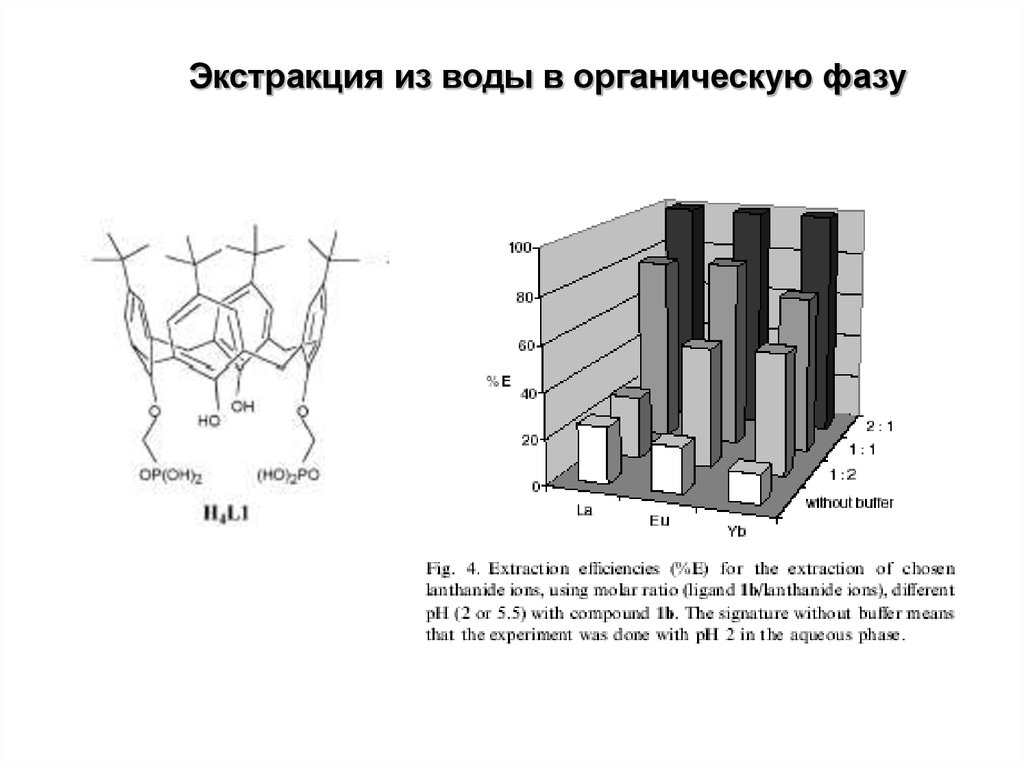
Экстракция из воды в органическую фазу36.
Экстракция из воды в органическую фазу37.
Экстракция из воды в органическую фазу38.
Экстракция из воды в органическую фазу39.
Электрохимические сенсорыНе мешают:
40.
Структура комплеса (РСА)Цитохром-каликсарен
Ассоциация 20 молекул каликсарена: экстракция цитохрома,
использование его в каталитических процессах
41.
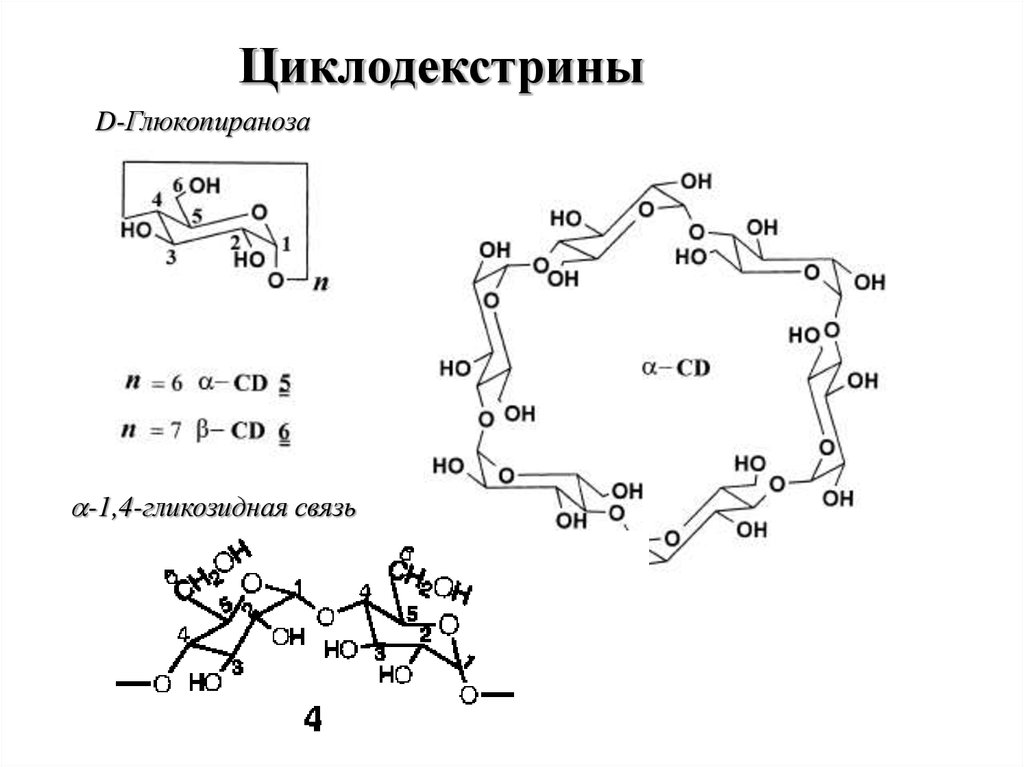
ЦиклодекстриныD-Глюкопираноза
-1,4-гликозидная связь
42.
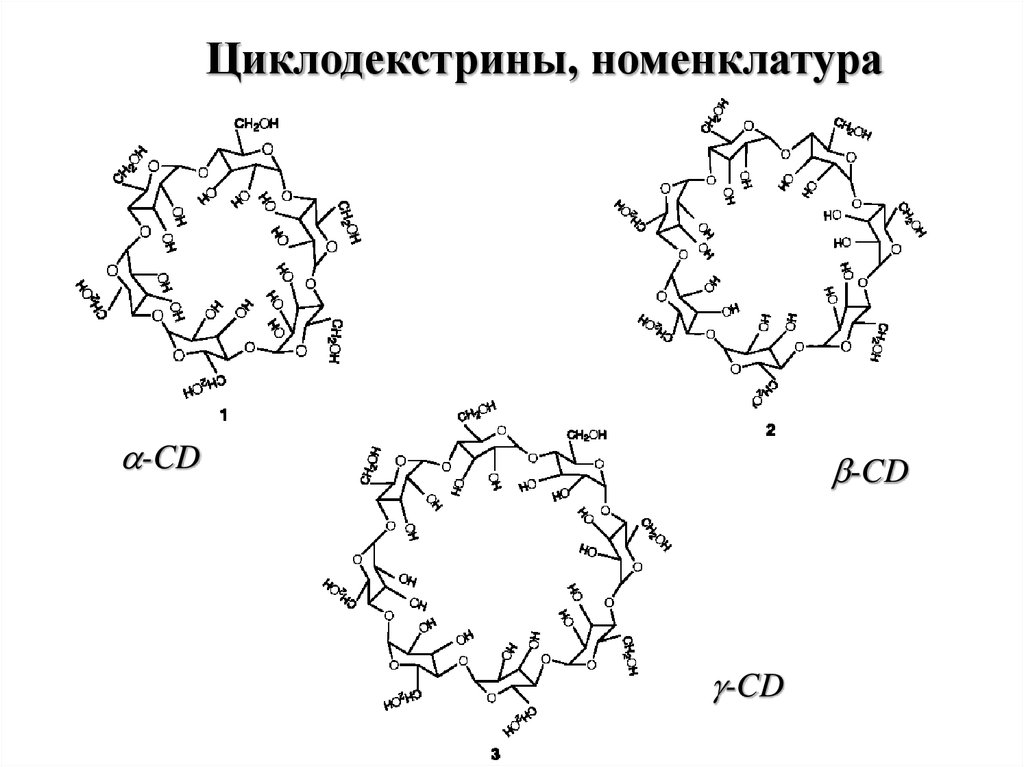
Циклодекстрины, номенклатура-CD
-CD
g-CD
43.
Строение циклодекстриновГидрофобная полость
Гидрофильная оболочка
44.
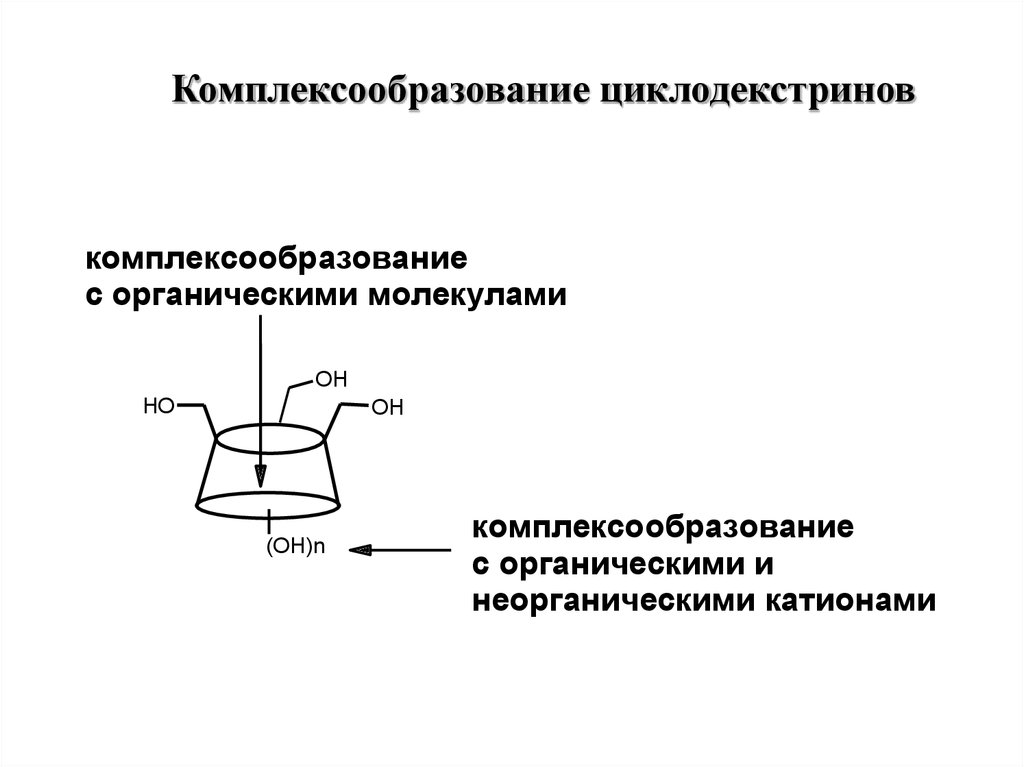
Комплексообразование циклодекстриновкомплексообразование
с органическими молекулами
OH
HO
OH
(OH)n
комплексообразование
с органическими и
неорганическими катионами
45.
Комплексообразование циклодекстриновс катионами металлов
β-ЦД
46.
Комплексообразование циклодекстриновс органическими молекулами
Константы комплексообразования
47.
Комплексообразование циклодекстриновH-3
H-5
21
48.
OS
N
O
O
слабый оптический отклик
нерастворимо в воде
O
O
CSB
HP- -CD dipole moment
O
O
O
O
O
O
O
O
N
S
O
O
N
S
CSB dipole moment
T / °C
10
20
30
40
Log K1
3.637+-0.01
3.578+-0.01
3.546+-0.01
3.467+-0.01
Log K2
4.8+-0.15
4.7+-0.15
4.7+-0.15
4.8+-0.15
49.
Реакции, протекающие в полости ЦД50.
Реакции, протекающие в полости ЦДРеакции
Субстрат
Ускорение
Гидролиз эфиров
Фениловые эфиры
300
Гидролиз амидов
Пенициллины
89
Расщепление фосфатов
Диарилметилфосфаты
66
Декарбоксилирование
Цианоацетаты
44
Реакции Дильса-Альдера
Циклопентадиен+бутен
14
Реакционная способность не коррелирует с прочностью
комплекса. Необходима наиболее выгодная
пространственная ориентация субстрата для эффектиного
протекания реакции.
51.
Некоторые примеры применения ЦД•Комплексообразование с ЦД позволяет
•увеличить растворимость органических соединений в воде,
(алифатические кислоты - 1-20 раз);
•изменить диссоциацию молекул
(констаны кислотности фенолов, орагнических кислот);
•изменить редокс-потенциал;
•изменить ряд физико-химических характеристик
(фотофизические, спектральные);
•изменить КД спектры оптически активных веществ;
умньшить летучесть соединения
(уменьшение потерь при хранении летучих масел).
•Капсулирование биологически активных соединений
•ускорения процессов переноса в организме,
пролонгированного действия лекарственных препаратов,
•для защиты от внешних факторов
( устойчивость к окислению витамина D, простагландинов);
•создание более удобных лекарственных форм .
Глазные
капли
«Вольтарен»
52.
Капсулирование и высвобождение диазепама из полости циклодекстрина53.
Кукурбитурилы54.
Структура кукурбитуриловгликольурильные фрагменты
55.
Структура кукурбитуриловЗа 100 мг:
82 €
78 €
166 €
342 €
СВ (от английского слова CucurBiturile)
56.
Синтез кукурбитурилов57.
Комплексообразование кукурбитурилов• Обладает
высоким
отрицательным
зарядом на донорных атомах кислорода;
• Образует
комплексы с
заряженными частицами;
положительно
• Обладает структурной «жёсткостью».
O
O
O
O
O
O
18-краун-6-эфир
α-ЦД
CB[6]
56
58.
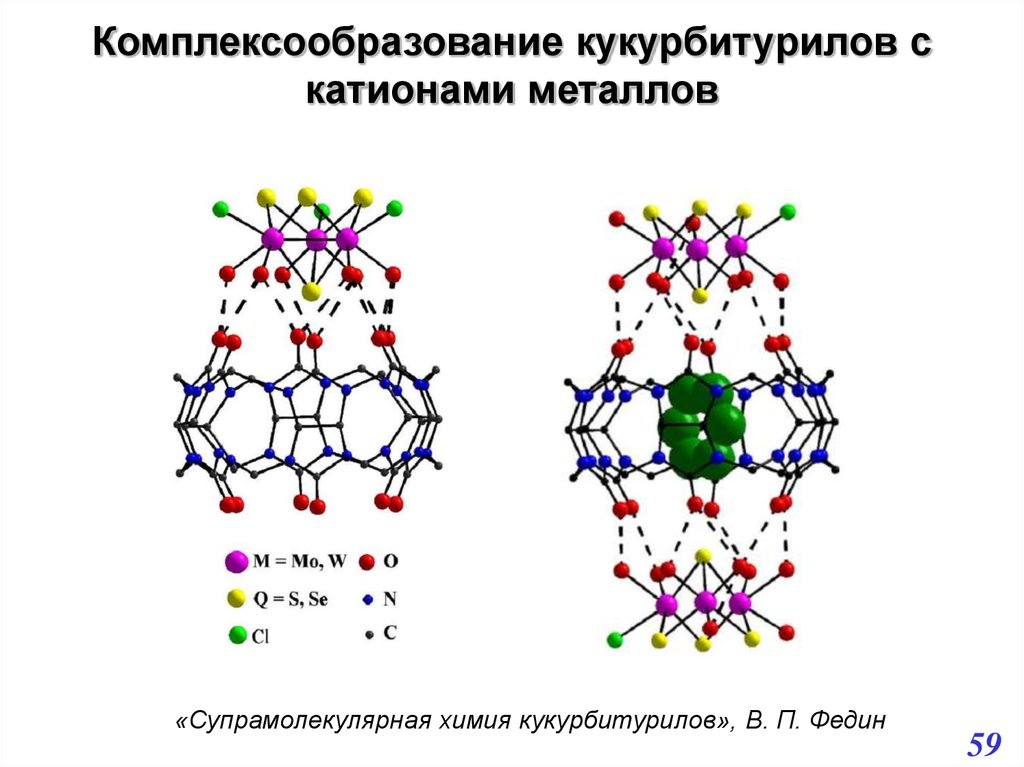
Комплексообразование кукурбитурилов скатионами металлов
«Супрамолекулярная химия кукурбитурилов», В. П. Федин
59
59.
60.
Комплексообразование кукурбитурилов61.
62.
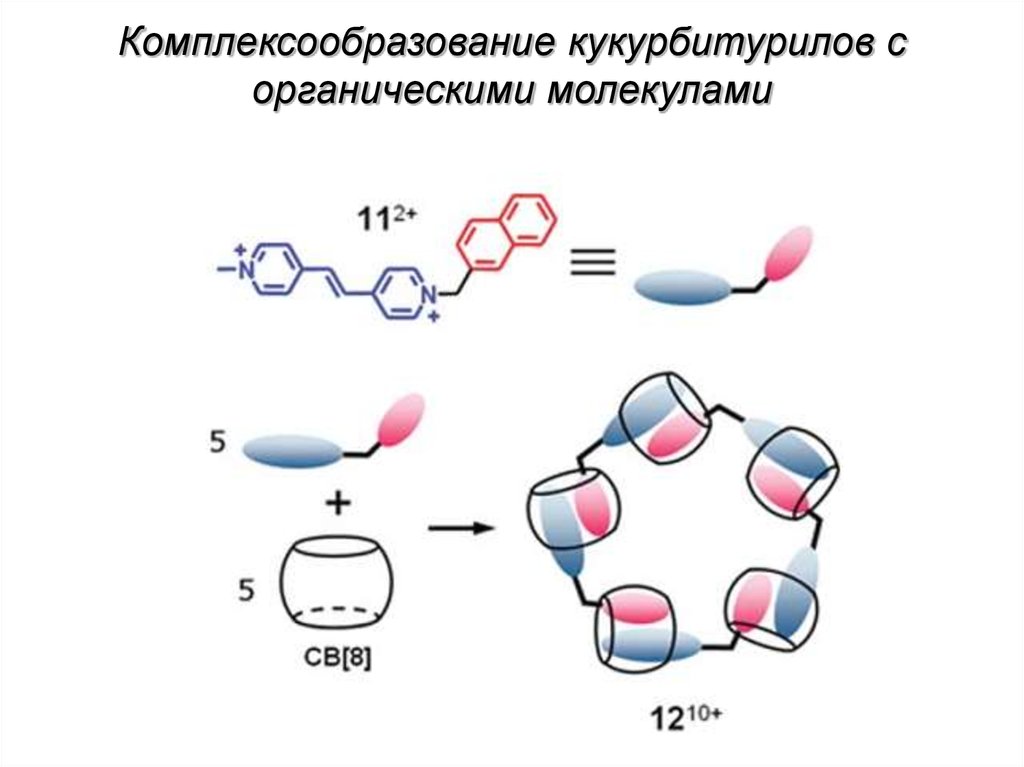
Комплексообразование кукурбитурилов сорганическими молекулами
63.
6764.
Комплексообразование кукурбитурилов сорганическими молекулами
65.
Фотохимические реакции в полости СВ66.
67.
Кооперативное взаимодействие СВ + органическая молекула +катион металла
тиофлавина Т
Ca2+ - в 270 раз
Na+- в 160 раз
Данный процесс имитирует интеркаляцию тиофлавина Т в
амилоидные фибриллы (разгорание флуоресценции в 1000 раз),
что лежит в основе применения тиофлавина Т в медицине для
лечения болезней Паркинсона и Альцгеймера
68.
Комплексы с цис-платином69.
CB[7]-контролируемая цитотоксичность функционализированныхнаночастиц золота
70.
Адресная доставка лекарства к больному органу71.
Адресная доставка лекарства к больному органу«Принцип работы наноклапана». Работающие в воде pH-регулируемые
наноклапаны представляют собой присоединенные к поверхности
пористых кварцевых наночастиц линейные молекулы, которые
при нейтральных и низких (кислых) значениях pH связываются с молекулами
псевдоротаксана и закрывают поры (слева на рисунке). При повышении
pH до щелочных значений, клапаны открываются и содержащееся в
порах вещество (родамин В - rhodamine B, показан красным) высвобождается
(справа на рисунке). Родамин B – флюоресцирующее вещество и
его высвобождение из наносфер легко регистрировать по
увеличению интенсивности флюоресценции.
72.
НоменклатураO
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
1,4,7,10,13,16Гексаоксатрицикло[20.4.0.09,14]
гексакоза-1(22),8,11,13,23,24гексаен
1,4,7,10,13,16Гексаоксациклооктадекан
18-Краун-6-эфир
O
Бензо-18-краун-6-эфир
Дибензо-18-краун-6-эфир
























































 chemistry
chemistry








