Similar presentations:
Серосодержащие макрогетероциклы (тиакраун-соединения)
1. СЕРОСОДЕРЖАЩИЕ МАКРОГЕТЕРОЦИКЛЫ (ТИАКРАУН-СОЕДИНЕНИЯ)
2.
Синтетические макрогетероциклы впервые
были получены более семи десятилетий назад,
но только в последние сорок лет, когда стали
известны
их
уникальные
комплексообразующие свойства, они оказались
в центре внимания химиков. Началом химии
кислородсодержащих макрогетероциклов или
краун-эфиов можно считать опубликованную в
1967 г. датским химиком Педерсеном статью
по синтезу более чем 60 макроциклических
соединений с различным размером кольца и
содержащихся в нем гетероатомов.
3.
Charles JohnPedersen
Donald J. Cram
Jean-Marie Lehn
4.
В статье также сообщалось об образованиимакрогетероциклами комплексов со многими
катионами, преимушественно металлов I и II групп
Периодической
системы.
Интенсивные
исследования химии этих соединений рядом
научных групп привели к тому, что в 1987 г. трем
исследователям - Педерсену, Краму и Лену- была
присуждена Нобелевская премия по химии за
работы в области химии краун-эфиров.
Исследования Педерсена дали бурный толчок
развитию химии макрогетероциклов, получивших
название "краун-эфиры".
Впоследствии было
обнаружено, что краун-эфиры также способны
быть переносчиками катионов через мембраны и
катализаторами многих органических реакций.
5.
OS
S
O
O
O
O
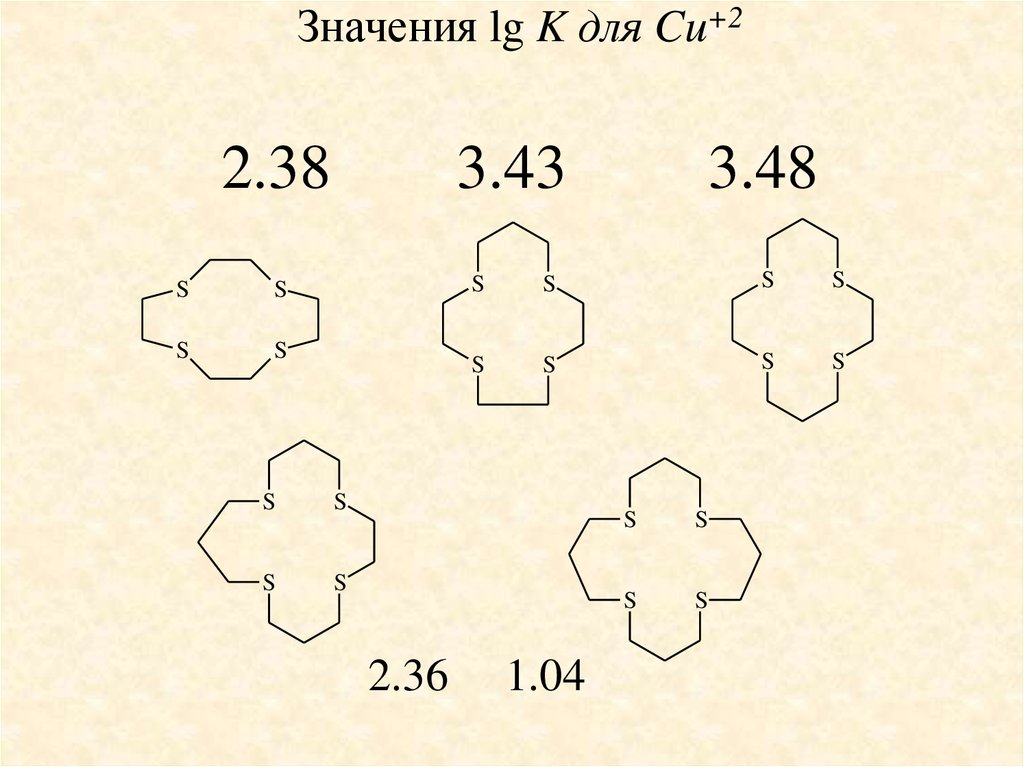
O
O
O
O
O
O
O
O
O
O
S
Тиа-18-краун-6-эфир
1,4,7,10,13,16ГексаоксациклооктаДитиа-18-краун-6-эфир
декан
18-Краун-6-эфир
6.
•В последние 15-20 лет повышенный интереспроявляется к макроциклам, содержащим вместо
или наряду с кислородом и другие гетероатомы,
особенно серу и азот (тиа- и аза-краунсоединения).
Наличие этих гетероатомов является фактором,
позволяющим целенаправленно регулировать
"совместимость" атомов-доноров в макроцикле
с атомом металла в соответствии
с принципом жестких и мягких кислот и оснований
(концепция Пирсона).
7. МЕТОДЫ СИНТЕЗА ТИАКРАУН-СОЕДИНЕНИЙ
8.
• Взаимодействие дигалогенидов с сульфидами игидросульфидами Na и K .
Na2S
S
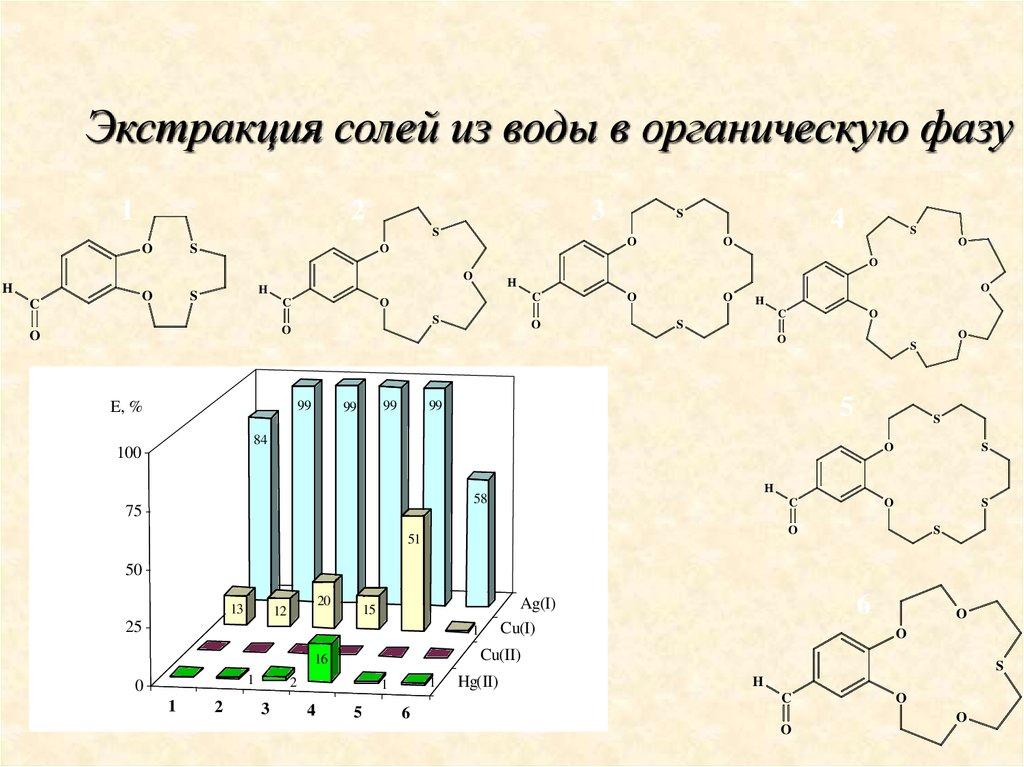
I
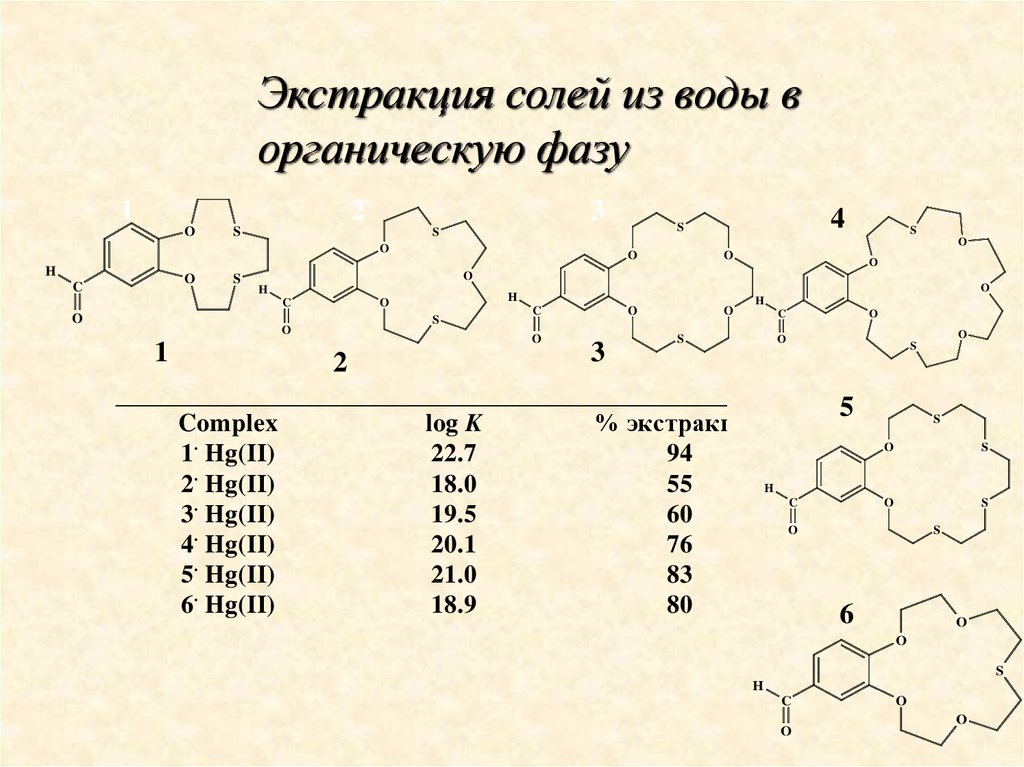
I
S
S
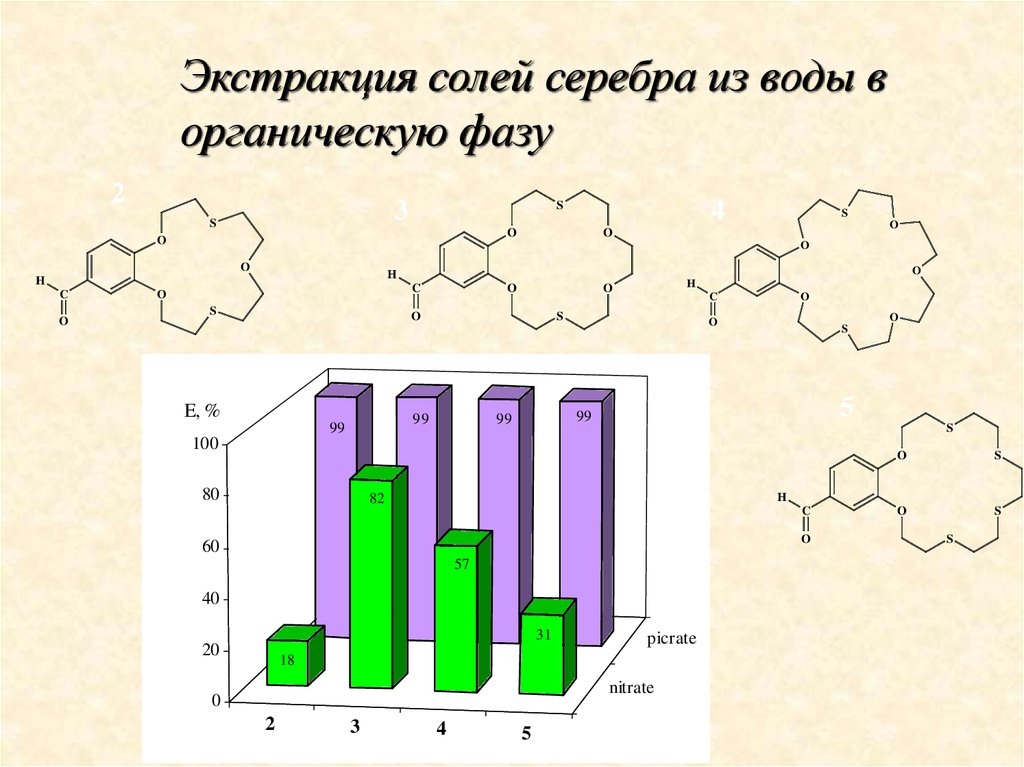
14%
Br
Br
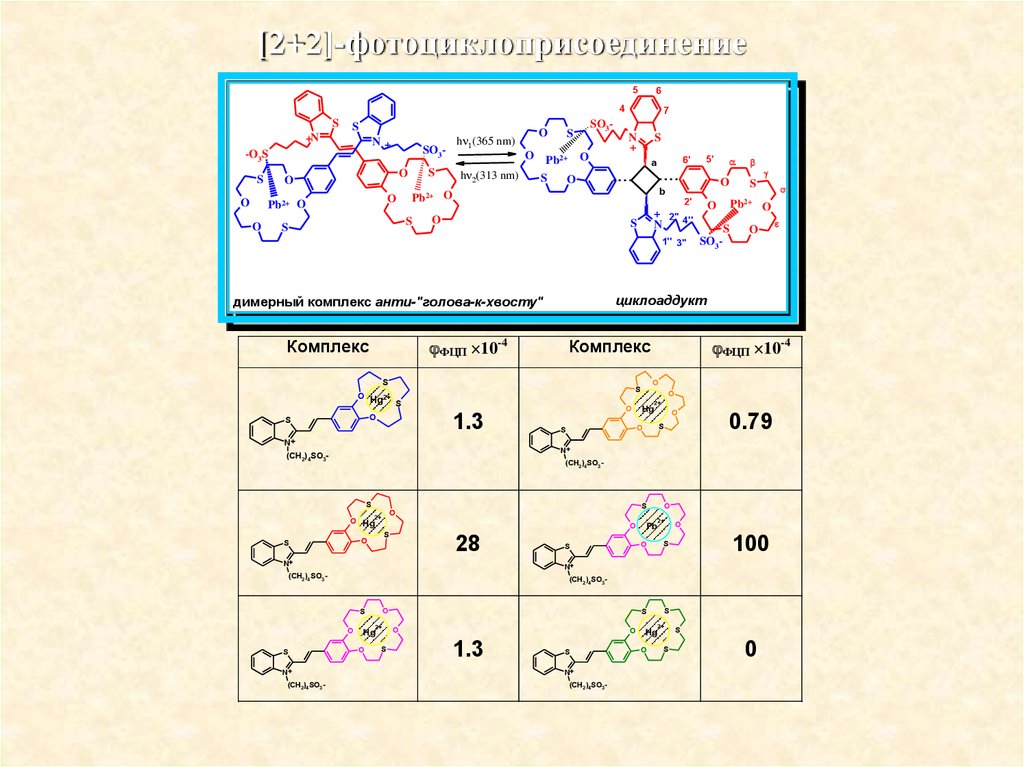
S
KSH
H2S
S
S
1%
9.
Реакция ВильямсонаCl
S
O
+
Na2S
50% EtOH
O
O
O
+
O
O
Cl
S
S
S
O
S
O
O
O
O
O
O
O
O
O
O
O
14%
29%
36%
Cl(CH2CH2OCH2CH2OCH2CH2S)n
10.
Различныесеросодержащие
макрогетероциклы можно получить с помощью
реакции Вильямсона, то есть взаимодействием
алкилгалогенидов с тиолятами.
Продуктами реакции
дигалогеналкана с
дитиолами
могут
быть
циклический
дитиоэфир, его димер и продукт линейного
строения. Выход продукта реакции зависит в
этом случае от строения исходных веществ и
условий
реакции.
Выход
циклических
соединений по этому методу в случае, если
кольцо содержит более девяти звеньев, очень
низок.
11.
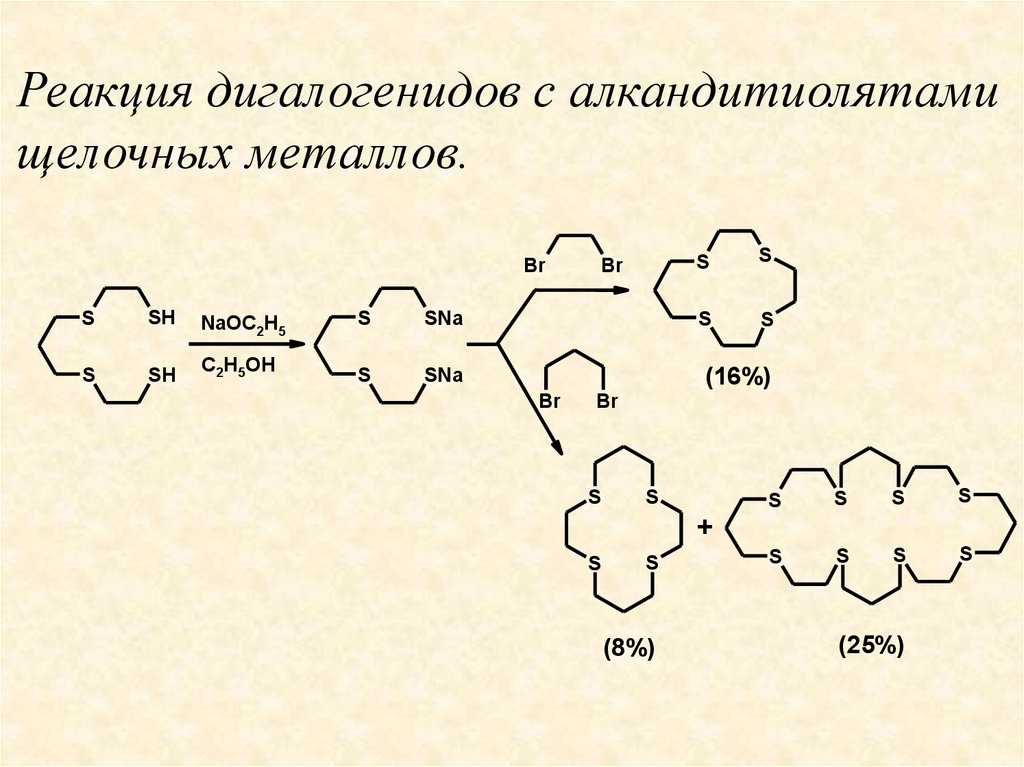
Реакция дигалогенидов с алкандитиолятамищелочных металлов.
:
Br
S
SH
NaOC2H5
S
SNa
S
SH
C2H5OH
S
SNa
Br
S
S
S
S
(16%)
Br
Br
S
S
S
S
S
S
S
S
S
S
+
S
S
(8%)
(25%)
12.
• Необходимость подавления побочныхпроцессов
потребовала
разработки
специальных
методов
синтеза
макроциклических
соединений.
призванных обеспечить наибольшие
выходы целевых продуктов. Наиболее
часто
в
синтезе
макроциклов
используются
метод
высокого
разбавления.
13. Метод высокого разбавления
• Метод основан на том, что при оченьнизких концентрациях реагирующих
веществ между столкновениями молекул
проходит время, достаточное для
завершения реакции циклизации.
14.
Методики синтеза макроциклов методом высокого
разбавления в большинстве случаев одинаковы:
реагенты очень медленно добавляются к большому
объему интенсивно перемешиваемого растворителя.
Так как скорость прибавления реагентов лимитируется
скоростью
самой
реакции,
метод
высокого
разбавления на практике применим лишь к
быстропротекающим процессам. Это приводит к тому,
что в синтезе таким методом чаще всего используют
высокоактивные
реагенты,
что
порождает
определенные трудности в проведении эксперимента и
существенно сужает круг используемых исходных
веществ.
15.
Реакция дигалогенидов с алкандитиолятамищелочных металлов.
SH
Cl
O
S
O
Na2CO3
O
O
O
50% EtOH
O
O
+
O
SH
Cl
S
34%
ИСПОЛЬЗОВАНИЕ МЕТОДА ВЫСОКОГО РАЗБАВЛЕНИЯ ПОВЫШАЕТ ВЫХОД ДО
69%
16.
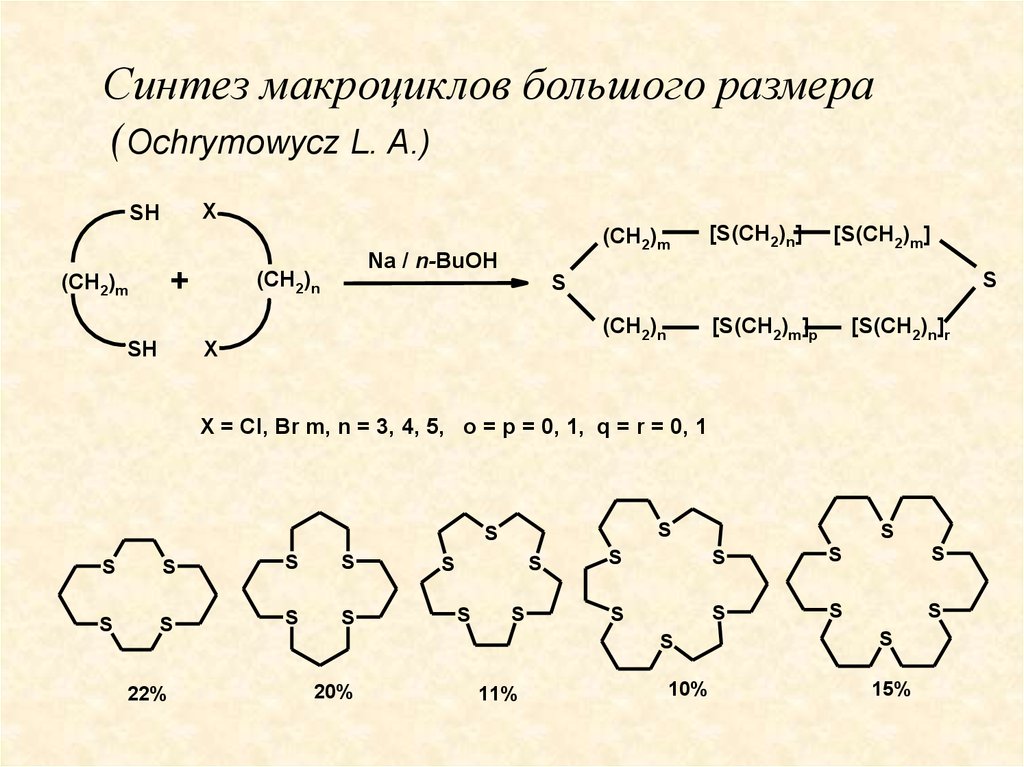
Синтез макроциклов большого размера(Ochrymowycz L. A.)
X
SH
+
(CH2)m
(CH2)m
Na / n-BuOH
(CH2)n
[S(CH2)m]
o
q
S
(CH2)n
X
SH
[S(CH2)n]
[S(CH2)m]p
S
[S(CH2)n]r
X = Cl, Br m, n = 3, 4, 5, o = p = 0, 1, q = r = 0, 1
S
S
S
S
S
S
S
S
S
S
22%
S
S
S
S
S
S
S
S
S
S
S
S
S
20%
11%
S
10%
S
15%
17.
Образование циклического иона сульфонияS
S
S
_
S
Br
S
S
S
S
S
_
S+
S
S
S
S
S
S
+
S
S
18.
Синтез в присутствии CsCO3 (Kellogg R.M.)Политиамакрогетероциклы стали доступны с того
момента, когда Келлог с сотр. использовали в реакциях
макроциклизации в качестве темплатного средства
соли цезия.
Взаимодействие алифатических , -алкандитиолов
с , -дибромалканами в присутствии карбоната сезия
дает дитиациклоалканы с выходами 45-90%
19.
Синтез в присутствии CsCO3 (Kellogg R.M.)SH
S
X
+
(CH2)m
SH
Cs2CO3
(CH2)n
(CH2)n
(CH2)m
ДМФА
S
X
Получение 1,7- дитиациклогептадекана (m = 10, n = 5)
M2CO3
Cs2CO3
Rb2CO3
K2CO3
Na2CO3
Li2CO3
Выход,
90
84
48
33
0
%
20.
Цезий ускоряет циклизацию промежуточнообразующихся линейных монотиолятов цезия. Катион
Cs+ обладает большим, чем другие щелочные металлы,
ионным радиусом (1,65 А), низкой плотностью
поверхностного заряда (0,03 Z/A) и высокой
поляризуемостью (2,9 А).
Катион цезия представляет собой положительно
заряженную поверхность, на которой происходит
координация отрицательно заряженного
нуклеофильного тиолята и уходящего аниона Br-.
Объемный катион цезия также слабо сольватируется в
ДМФА и поэтому образует контактные ионные пары с
нуклеофилом.
Меньшие по размеру ионы щелочных металлов
образуют менее реакционноспособные сольватноразделенные ионные пары.
21.
Сравнение выходов получениятиакраун-эфиров по различным методам
Na / n-BuOH
SH
Cl
S
+
S
SH
(35%)
S
S
S
EtOH
S
Cl
S
M2CO3 / ДМФ
А
,
M = K (38%)
M = Cs (76%)
S
S
S
(31%)
NaS
Br
+
S
Br
NaS
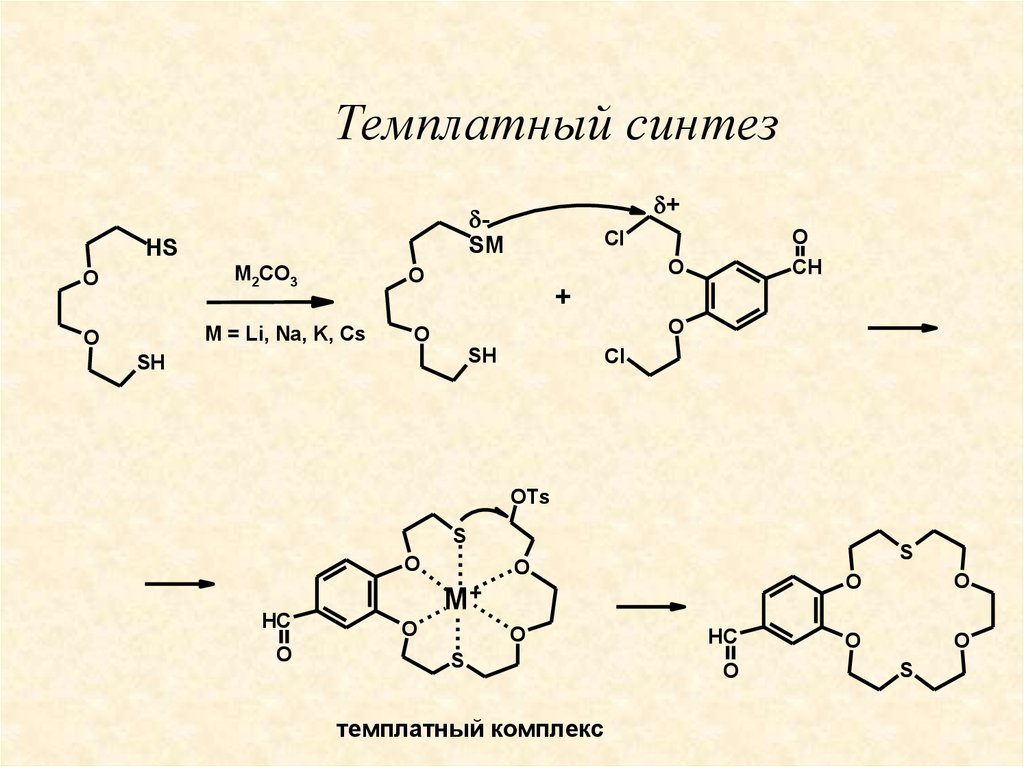
22. Темплатный синтез
• Темплатным называется метод, в котором атомметалла, образующий комплексное соединение с
синтезируемым
макроциклическим
лигандом,
служит матрицей для сборки макроцикла из
исходных фрагментов.
23.
Темплатный синтезHS
M2CO3
O
O
CH
Cl
O
O
M = Li, Na, K, Cs
O
+
SM
+
O
O
SH
SH
Cl
OTs
S
O
HC
O
S
O
M+
O
O
S
темплатный комплекс
HC
O
O
O
O
O
S
24.
Темплатный синтезS
O
HC
M+ Выход(%)
Li 44
Cs 42
S
O
O
S
O
O
HC
S
O
S
O
O
O
O
O
S
Li
Na
K
Cs
Li
Na
K
Cs
80
30
30
61
79
75
41
61
Li
Na
K
Cs
O
O
O
O
HC
O
O
HC
S
O
S
58
57
74
55
S
HC
O
O
S
O
S
Li 62
Cs 68
S
CH
O
O
O
S
SH
OTs
O
O
25.
• Действие ионов метала, сводящееся ксмещению равновесия в сторону устойчивого
комплекса,
носит
название
термодинамического темплатного эффекта.
Под кинетическим темплатным эффектом
подразумевается механизм, в котором ион
металла лишь ускоряет некоторые стадии
циклизации. В таких случаях макроцикл
выделяется в свободном виде. Наиболее
эффективным в темплатном синтезе является
использование
в
качестве
комплексообразующего средства карбоната
цезия Cs2CO3.
26.
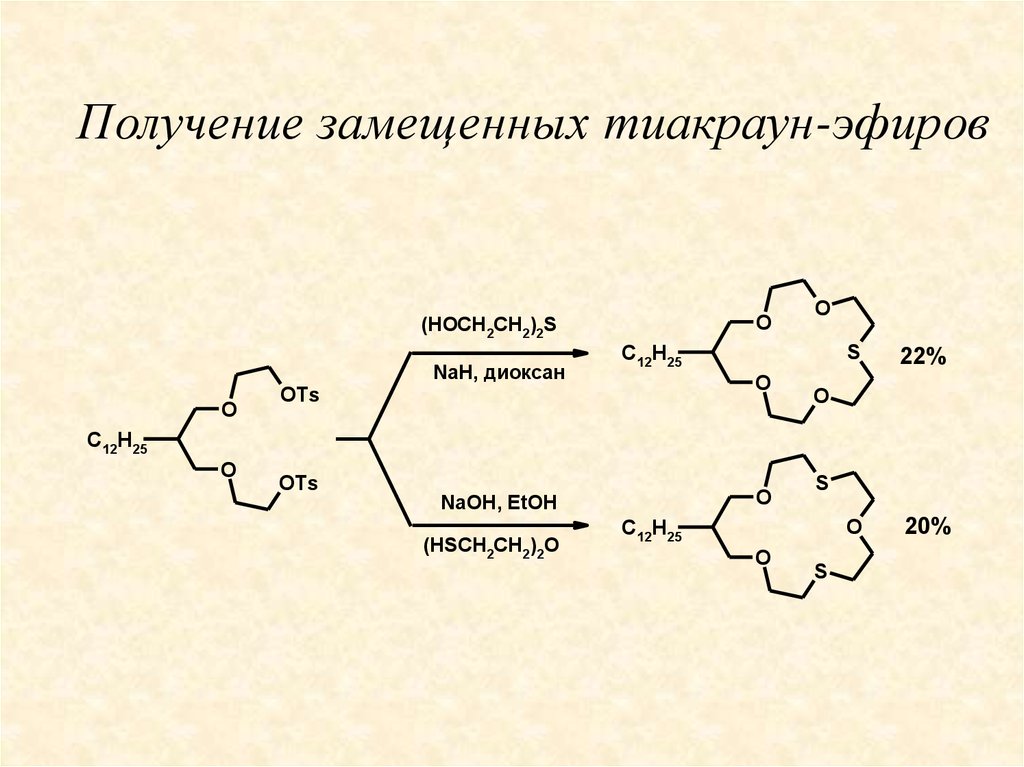
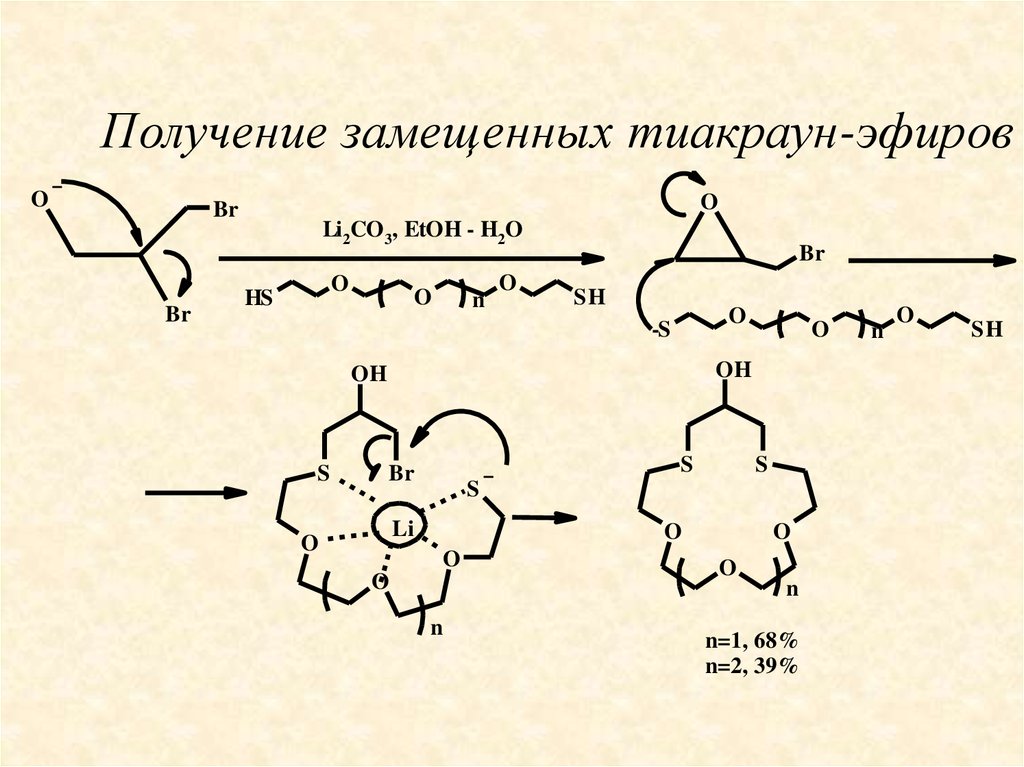
Получение замещенных тиакраун-эфировO
(HOCH2CH2)2S
NaH, диоксан
O
O
C12H25
O
OTs
S
22%
O
20%
O
C12H25
O
OTs
O
NaOH, EtOH
(HSCH2CH2)2O
S
C12H25
O
S
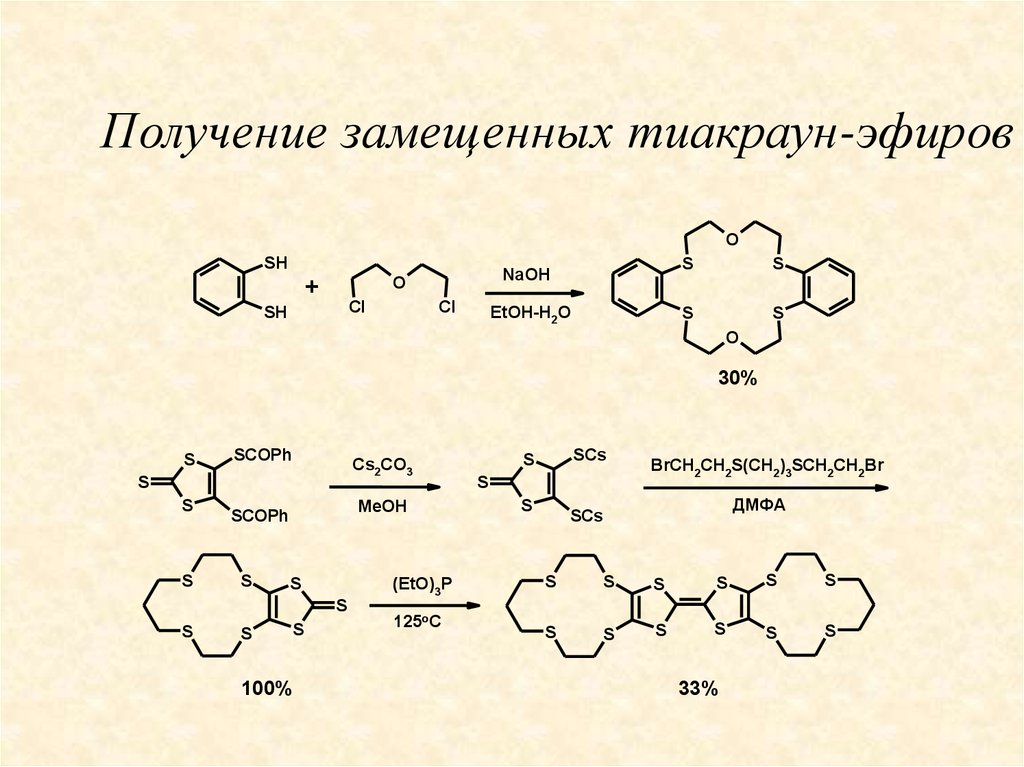
27. Получение замещенных тиакраун-эфиров
Получение замещенных тиакраунэфировOH
OH
HS
SH
+
I
O
O
I
O
ДМФА
n
S
S
Cs2CO3
O
O
O
n
n=1(73%), n=2 (60%)
28.
Получение замещенных тиакраун-эфировO
O
Br
Br
Li2CO3, EtOH - H2O
O
HS
O
n
O
Br
SH
O
-S
OH
OH
S
O
S
Br
S
Li
O
S
O
O
O
O
O
n
n
n=1, 68%
n=2, 39%
n
O
SH
29.
Получение замещенных тиакраун-эфировO
SH
NaOH
O
+
Cl
Cl
SH
EtOH-H2O
S
S
S
S
O
30%
S
SCOPh
Cs2CO3
S
S
S
MeOH
SCOPh
S
(EtO)3P
S
S
S
S
S
100%
125oC
SCs
S
S
S
BrCH2CH2S(CH2)3SCH2CH2Br
ДМФА
SCs
S
S
S
S
S
S
S
S
S
S
S
S
33%
30.
Другие методы получения тиакраунсоединений• Реакции
непредельных
соединений
с
дихлоридом серы SCl2 пока не получили
широкого
распространения
в
синтезе
макрогетероциклов, хотя их синтетический
потенциал довольно высок. Использование этого
реагента может быть проиллюстрировано на
некоторых примерах.
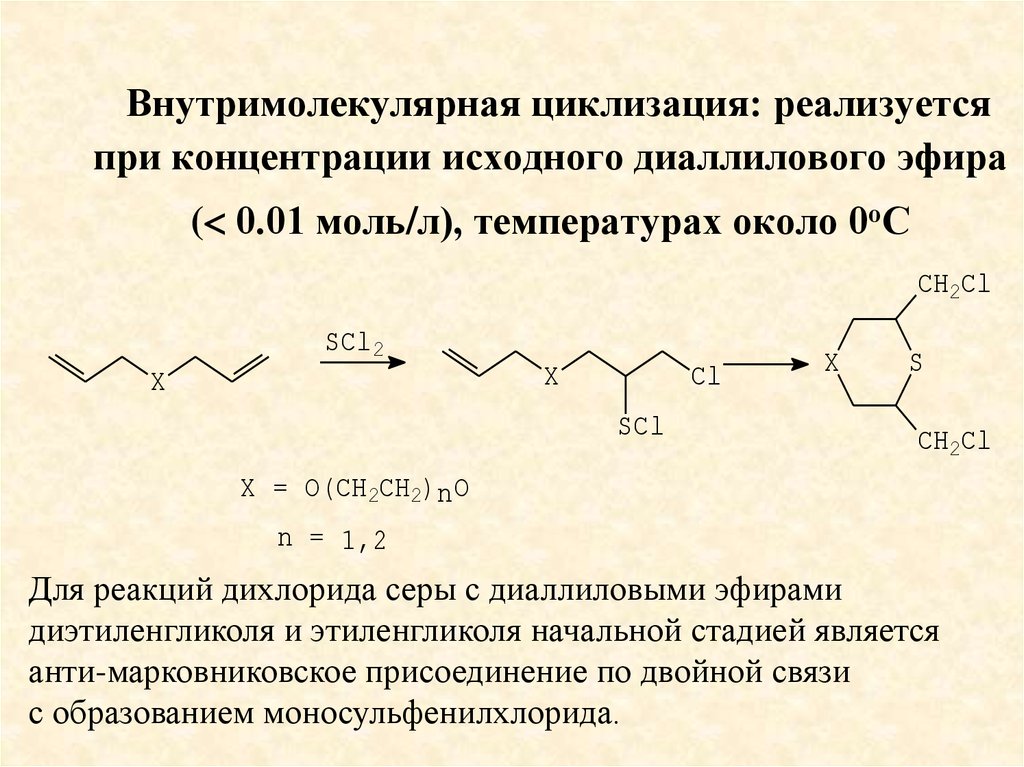
31. Внутримолекулярная циклизация: реализуется при концентрации исходного диаллилового эфира ( 0.01 моль/л), температурах около
Внутримолекулярная циклизация: реализуетсяпри концентрации исходного диаллилового эфира
( 0.01 моль/л), температурах около 0оС
CH2Cl
SCl2
X
X
Cl
SCl
X
S
CH2Cl
X = O(CH2CH2)nO
n = 1,2
Для реакций дихлорида серы с диаллиловыми эфирами
диэтиленгликоля и этиленгликоля начальной стадией является
анти-марковниковское присоединение по двойной связи
с образованием моносульфенилхлорида.
32.
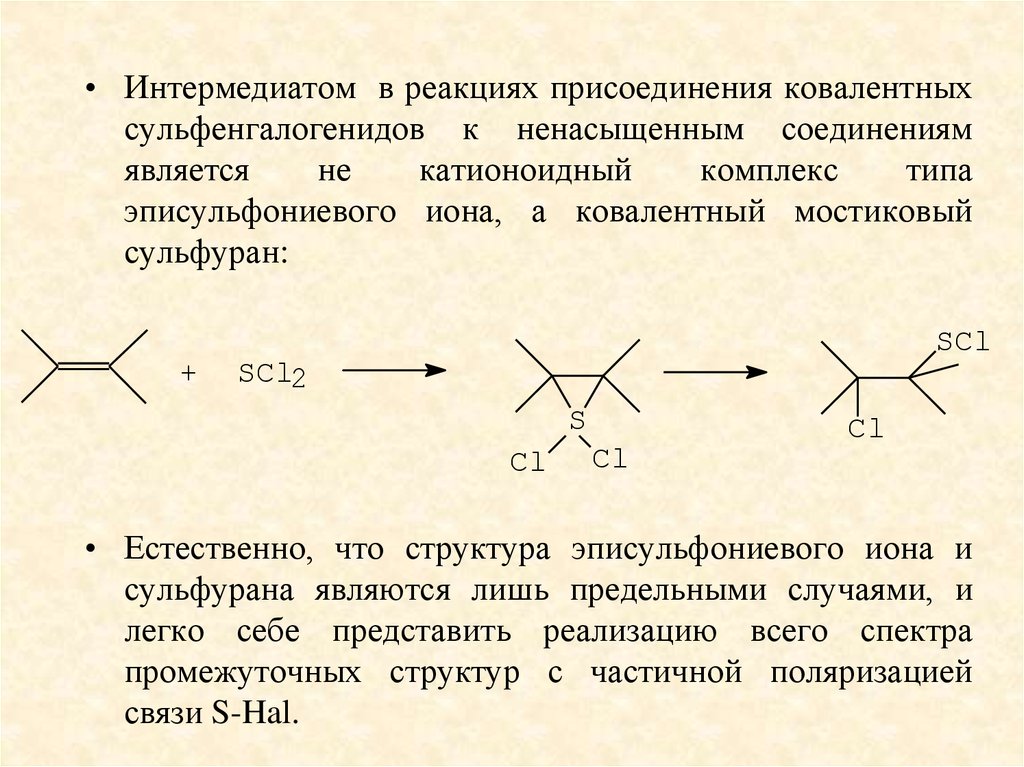
• Интермедиатом в реакциях присоединения ковалентныхсульфенгалогенидов к ненасыщенным соединениям
является
не
катионоидный
комплекс
типа
эписульфониевого иона, а ковалентный мостиковый
сульфуран:
SCl
+
SCl2
S
Cl
Cl
Cl
• Естественно, что структура эписульфониевого иона и
сульфурана являются лишь предельными случаями, и
легко себе представить реализацию всего спектра
промежуточных структур с частичной поляризацией
связи S-Hal.
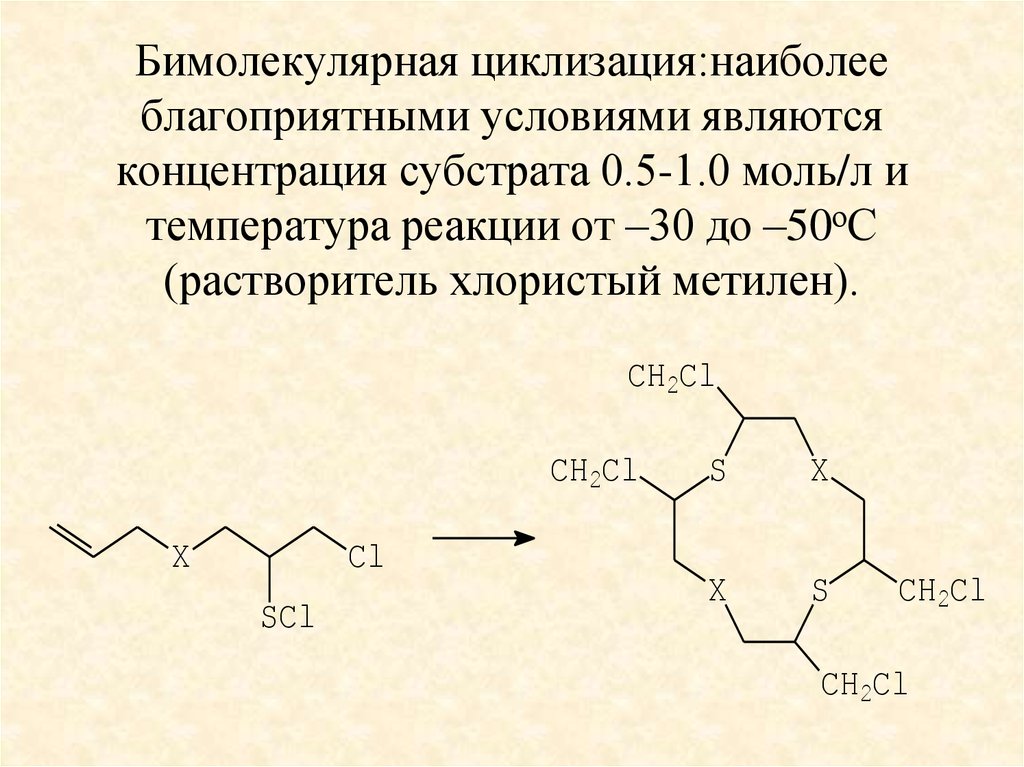
33. Бимолекулярная циклизация:наиболее благоприятными условиями являются концентрация субстрата 0.5-1.0 моль/л и температура
реакции от –30 до –50оС(растворитель хлористый метилен).
CH2Cl
CH2Cl
X
Cl
SCl
S
X
X
S
CH2Cl
CH2Cl
34.
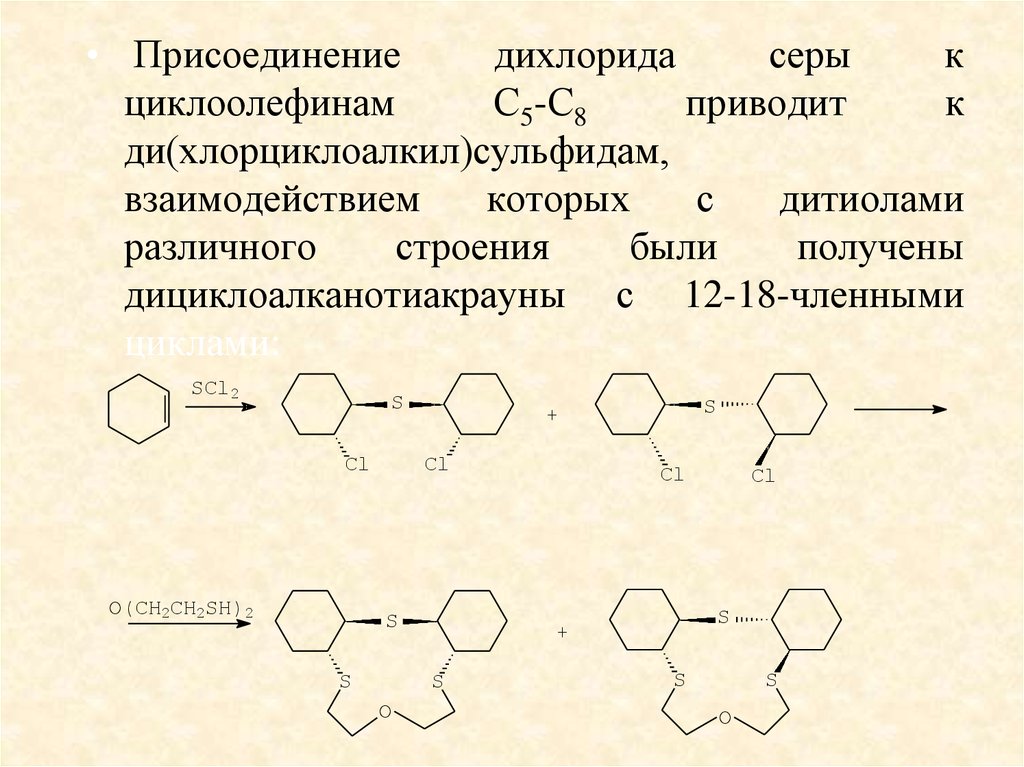
• Присоединениедихлорида
серы
к
циклоолефинам
С5-С8
приводит
к
ди(хлорциклоалкил)сульфидам,
взаимодействием
которых
с
дитиолами
различного
строения
были
получены
дициклоалканотиакрауны с 12-18-членными
циклами:
SCl2
S
Cl
O(CH2CH2SH)2
Cl
S
S
Cl
Cl
S
+
S
O
S
+
S
S
O
35.
Взаимодействие замещенных в циклогексановыхкольцах дихлорсульфидов с 1,8-димеркапто-3,6диоксаоктаном с использованием методики высокого
разбавления привело к образованию соответствующего
макроцикла в виде смеси четырех стереоизомеров (по
данным спектроскопии ЯМР 13С); спектральные данные
хорошо соответствуют структуре и совпадают с
рассчитанными химическими сдвигами:
ROOC
ROOC
S
ClCl
COOR
ROOC
HS
O
O
S
COOR
SH
ROOC
COOR
R = Me,Et
S S
O O
COOR
36.
Трехмерные макрогетероциклы - криптанды иклатрохеланты
способны
полность
инкапсулировать ионы металла. По своей
устойчивости
комплексы
трехмерных
макрогетероциклов значительно превосходят
комплексы
с
мономакроциклическими
лигандами.
Интересны
серосодержащие
макробициклы
(криптанды),
образующие
стабильные комплексы с ионами переходных
металлов, синтез их осуществляется по
следующей схеме:
37.
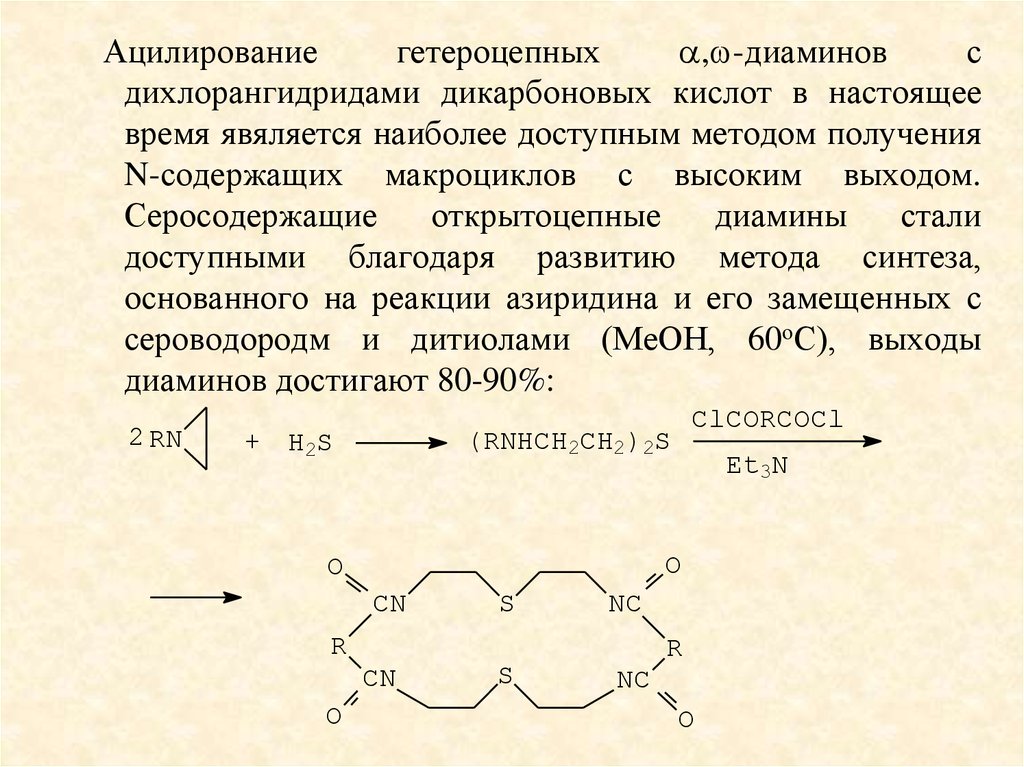
Ацилированиегетероцепных
, -диаминов
с
дихлорангидридами дикарбоновых кислот в настоящее
время явяляется наиболее доступным методом получения
N-содержащих макроциклов с высоким выходом.
Серосодержащие
открытоцепные
диамины
стали
доступными благодаря развитию метода синтеза,
основанного на реакции азиридина и его замещенных с
сероводородм и дитиолами (МеОН, 60оС), выходы
диаминов достигают 80-90%:
2 RN
+
H2S
Et3N
O
O
CN
S
NC
R
CN
O
ClCORCOCl
(RNHCH2CH2)2S
S
R
NC
O
38.
NH2S
S
NH2
Cl
S
S
Cl
O
NH
S
S
O
O
NH
N
S
S
S
S
S
S
S
S
S
S
O
N
NH
восстановл.
N
O
S
S
S
S
S
S
(ClCOCH2XCH2)2
N
S
S
NH
O
B2H6
HCl
39.
КомплексообразованиеВ
общем
случае
вероятность
комплексообразования
определяется
возможным изменением конформации
макроцикла при его взаимодействии с
металлом.
Макроциклы
способны
координироваться таким образом, чтобы
обеспечивалось наиболее благоприятное
размещение
гетероатомов
вокруг
центрального атома металла.
40.
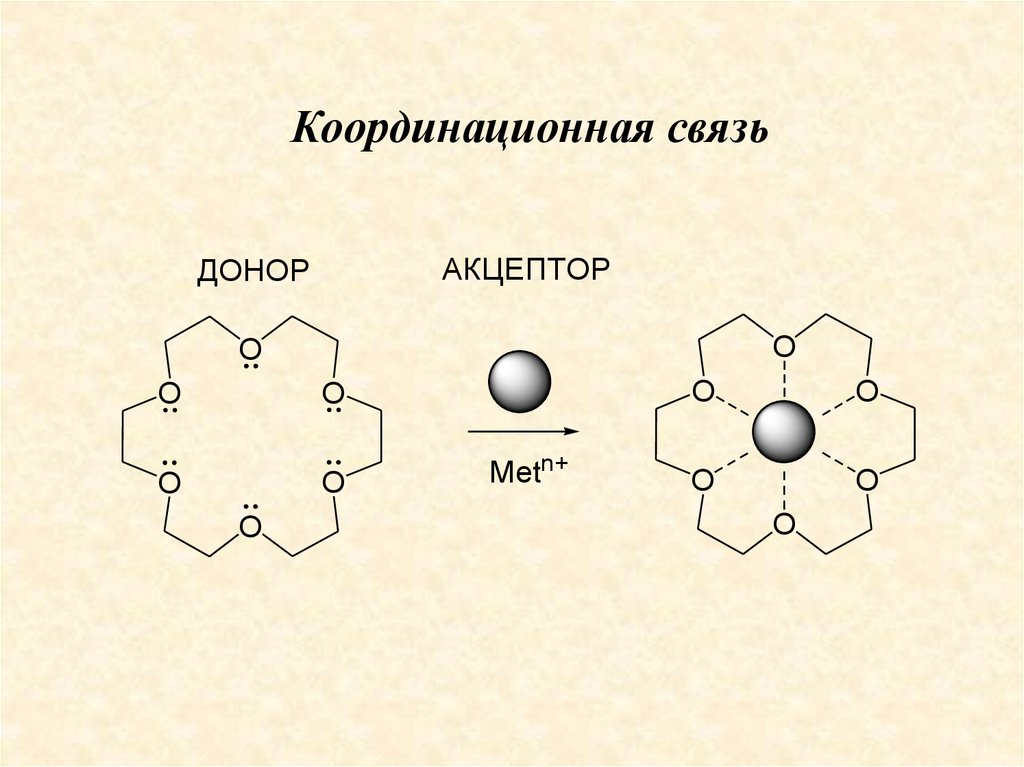
Координационная связьАКЦЕПТОР
ДОНОР
O
O
O
O
O
O
O
Metn+
O
O
O
O
O
41.
Макроциклическийэффект
означает
повышенную
термодинамическую
и
кинетическую
устойчивость
комплексов
металлов с макроциклическим соединением по
сравнению с его линейным аналогом. Впервые
этот эффект был установлен Маргерумом.
Существуют два основных подхода к
объяснению
этого
эффекта
–
термодинамический,
характеризующийся
изменением свободной энергией Гиббса, и
кинетический,
обусловленный
низкими
скоростями диссоциации макроциклических
комплексов по сравнению с нециклическими
аналогами.
42.
Устойчивость связи между металлом имакроциклом в первую очередь природой
металла и активных атомов макроцикла. Для
оценки
этого
фактора,
объяснений
накопленного материала и предсказаний
использован принцип мягких и жестких кислот
и
оснований.
С
использованием
рентгеноструктурного анализа установлено,
что важная роль при комплексообразовании
металлов
с
макроциклами
отводится
стереохимическим требованиям металла. В
комплексах макроцикл обычно принимает
такую конформацию, которую требует ион
металла.
43.
Комплексообразование: природа донорныхцентров
O
logK
K+
Ag+
H
N
S
H
N
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
O
S
O
6.10
1.60
1.15
4.34
3.90
3.30
N
H
2.04
7.80
44.
Комплексообразование:природа донорных
центров
O
S
O
S
S
O
O
O
2'
a
6'
5'
O
O
X
O
M2+
, ’
, ’
, ’
Hg2+
Pb2+
-0.14 0.51
0.14, 0.13
-0.06
Hg2+
Pb2+
Cd2+
0.26
0.17
0.01
0.78
0.20
0.03
Hg2+
Pb2+
Cd2+
0.26
0.35
0.06
0.82
0.34
0.11
Hg2+
0.19
0.61
0.4
4
0.0
9
0.7
0
0.1
7
0.0
3
0.7
2
0.3
1
0.1
0
0.5
4
Pb2+
0.26, 0.38
0.19
S
S
S
b
, ppm
/
O
MeCN-d3 at 50 oC ([CSD]:[M2+]= 1:1)
S
n
O
O
S
S
O
O
O
O
O
S
Pb2+
S
S
O
S
O
S
0.19
0.48
. ’
0.22
0.19
0.01
0.23
0.43
0.05
0.21
0.37
0.10
0.10
0.06
(H 0.06)
0.28
(H 0.35)
0.43
0.3
2
0.4
6
, ’
0.42
0.42
45.
Комплексообразование: размер макроциклаВажной
характеристикой
макроциклического соединения являются размеры
его полости, определяемые в первом
приближении числом атомов, образующих
макрогетероцикл. В зависимости от его
размеров ион металла может находиться
либо в полости макроцикла, либо над этой
полостью. Наиболее прочные комплексы
образуются, когда размер полости краунсоединения совпадает с размером катиона
металла.
46.
Комплексообразование: размер макроциклаS
S
O
Hg
N+
CH3
O
S
O
S
O
2+
N+
lgK 15.9
2+
O
S
N+
CH3
Hg
S
ClO4
lgK 5.6
O
S
O
CH3
O
S
O
S
lg K 18.5
2+
O
CH3
Pb
O
S
N+
ClO4
O
Pb
O
S
ClO4
2+
O
S
ClO4
lg K 7.5
47.
• Сравнение устойчивости комплексовмеди(II)
с
макроциклическими
соединениями, имеющими различный
размер цикла и содержащими чертыре
атома
серы,
показывает,
что
в
зависимости от числа атомов в цикле –
от 12 до 16 – логарифмы констант
устойчивости
комплексов
Cu(II)
меняются в следующем порядке:
48. Значения lg K для Cu+2 2.38 3.43 3.48
Значения lg K для Cu+22.38
S
S
S
S
3.43
S
S
S
S
2.36
3.48
S
S
S
S
S
S
S
S
1.04
S
S
S
S
49.
• Исследование спектральных и окислительновосстановительныхсвойств
комплексов
политиакраунов с Cu(II) показало, что они
идентичны по свойствам медьсодержащим
"синим" белкам. Последние являются важными
металлсодержащими ферментами для живых
организмов, участвующими в переносе
электронов, окислительно-восстановительном
катализе дыхательных клеток и обмене
веществ.
50.
Комплексы ионов меди(II) с политиакраунсоединениями
обладают
необычными
спектральными
и
окислительновосстановительными свойствами. Эти же
свойства характерны и для медьсодержащих
синих белков. Электронные спектры имеют
сильную полосу поглощения в области 600 нм
и высокий окислительно-восстановительный
потенциал CuII/CuI (+0,2- 0,8 B).
51.
КомплексыCu(I)
c
политиамакроциклами катализируют реакции
окисления спиртов кислородом воздуха,
при этом этанол окисляется до
ацетальдегида и уксусной кислоты, а
изопропанол - до ацетона.
52.
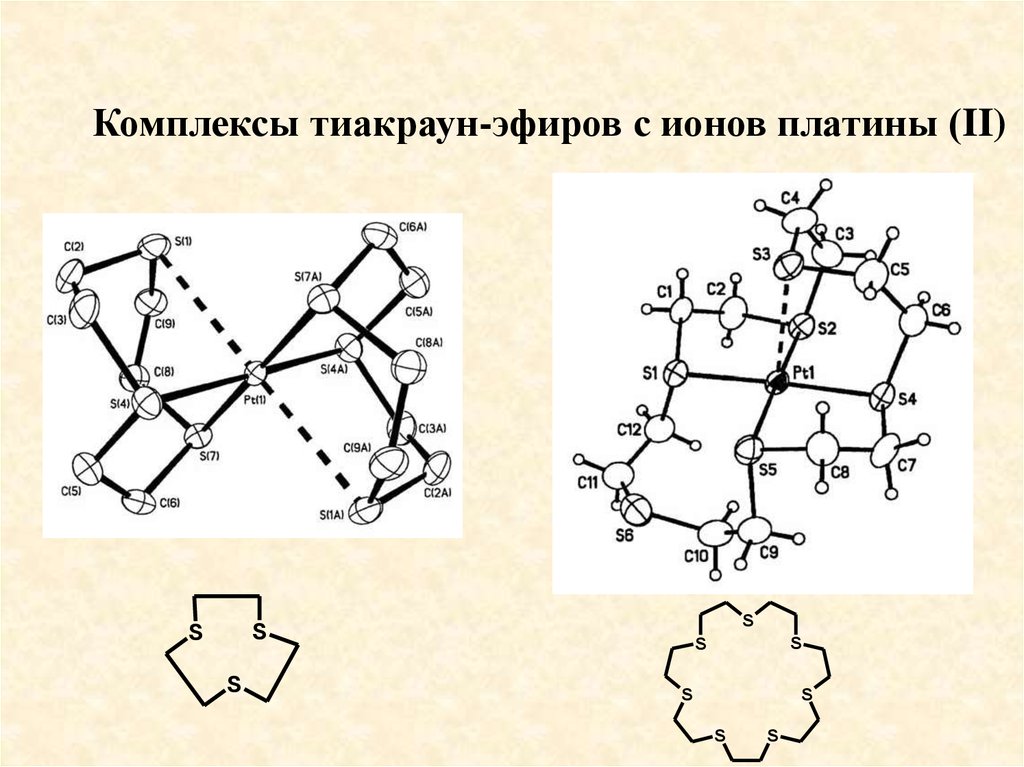
Комплексы тиакраун-эфиров с ионов платины (II)S
S
S
S
S
S
S
S
S
S
53.
Комплексы ионов пладия (II) с лигандами,содержащими фрагмент тиомалеодинтрил
54.
Возможность селективного взаимодействиятиакраун-эфиров с ионами тяжёлых и
переходных
металлов
может
быть
использована для получения химических
сенсоров на их основе.
Молекулы сенсора, как правило, состоят из
распознающей части – в нашем случае ей
может быть фрагмент тиакраун-эфира, и
сигнальной
части
фрагмента,
который
обладает
свойствами,
которые
легко
обнаружить с помощью прибора, и которые
изменяются в зависимости от того, произошло
ли связывание распознающей части с
распознаваемой молекулой или ионом.
55.
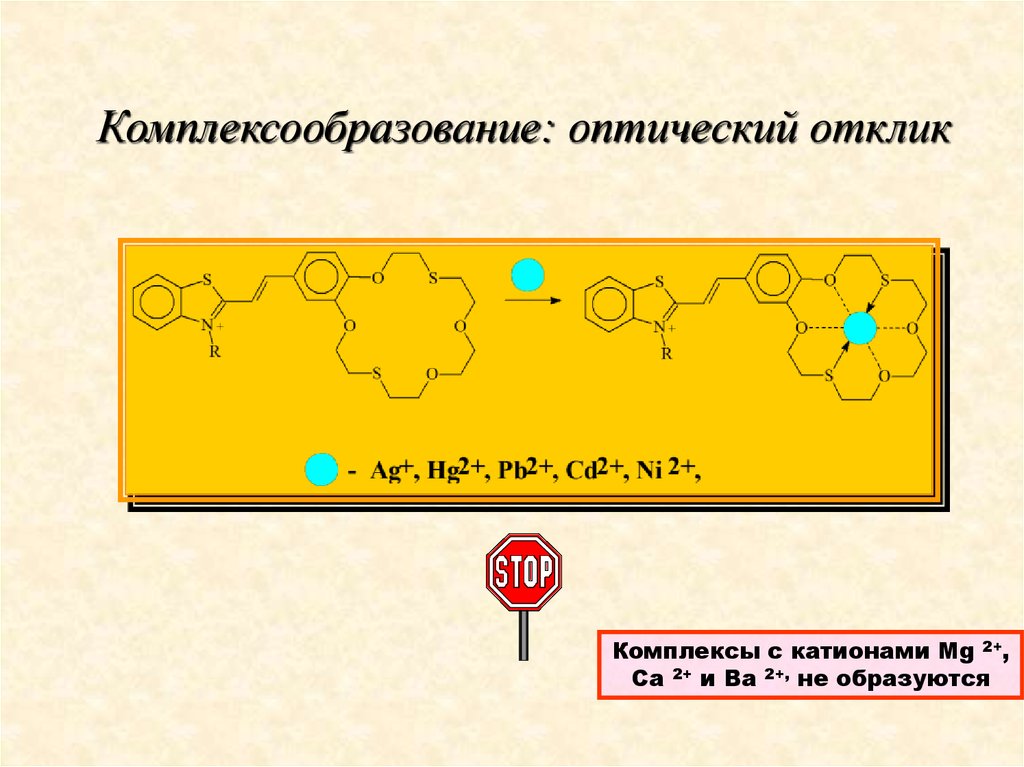
Комплексообразование: оптический откликКомплексы с катионами Mg 2+,
Ca 2+ и Ba 2+, не образуются
56.
Комплексообразование: оптический отклик-1
Extinction / 10000 L cm
-1
M
5
4
Complex
(LPb)
Ligand
Log K
3
2
1
0
250
300
350
400
Wavelength / nm
450
500
550
Ag+
Hg2+
Pb2+
5.1
19.8
7.3
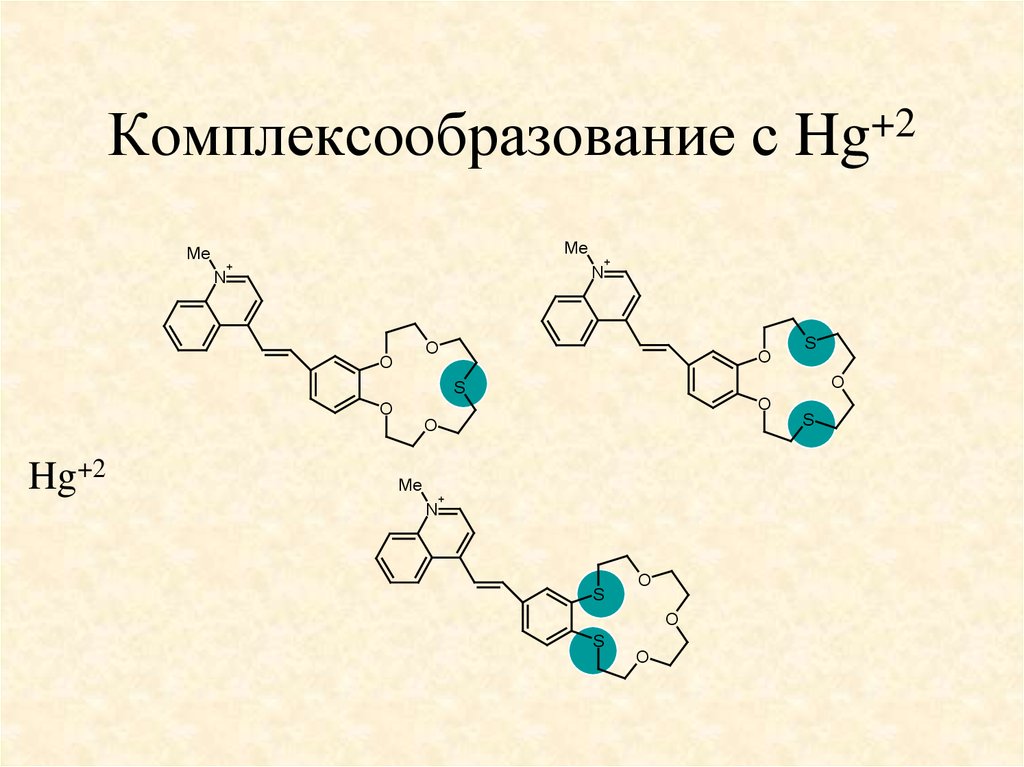
57. Комплексообразование с Hg+2
MeMe
+
+
N
N
O
O
O
S
O
S
O
O
S
O
Hg+2
Me
+
N
S
O
O
S
O
58.
Комплексообразование:электрохимический отклик
59.
Мультипараметрический сенсор60. Переключаемые макрогетероциклы и их комплексы
61.
Переключаемые
макрогетероциклы
способны
изменять конформацию цикла под влиянием внешних
воздействий:
рН
среды,
окислительновосстановительного потенциала, электрохимической
энергии, света, температуры и др. Конформационные
преобразования макроцикла влияют на реакционную
способность краун-соединения, например меняют
прочность связывания ионов.
Молекула переключаемого макроцикла должна быть
построена
таким
образом,
чтобы
одна
из
функциональных групп могла служить антенной,
воспринимающей сигнал извне, а другая обеспечивать дальнейшее превращение, вызванное
принятым сигналом.
62.
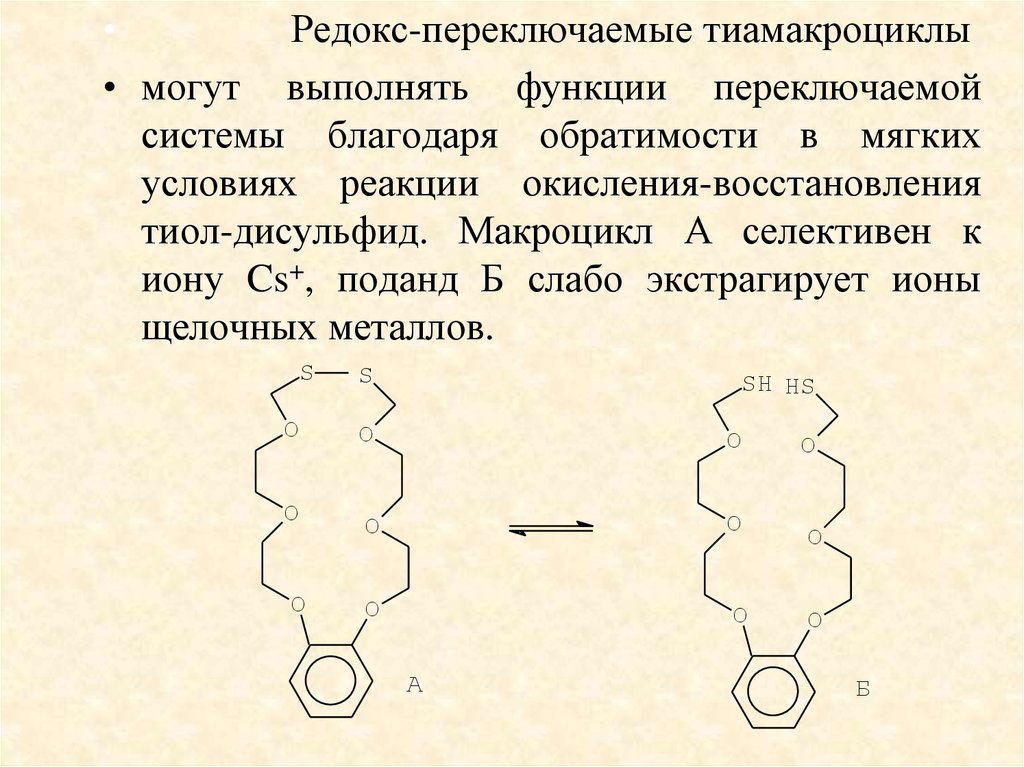
Редокс-переключаемые тиамакроциклы
• могут выполнять функции переключаемой
системы благодаря обратимости в мягких
условиях реакции окисления-восстановления
тиол-дисульфид. Макроцикл А селективен к
иону Cs+, поданд Б слабо экстрагирует ионы
щелочных металлов.
S
O
O
O
S
SH HS
O
O
O
O
O
O
A
O
O
O
Б
63.
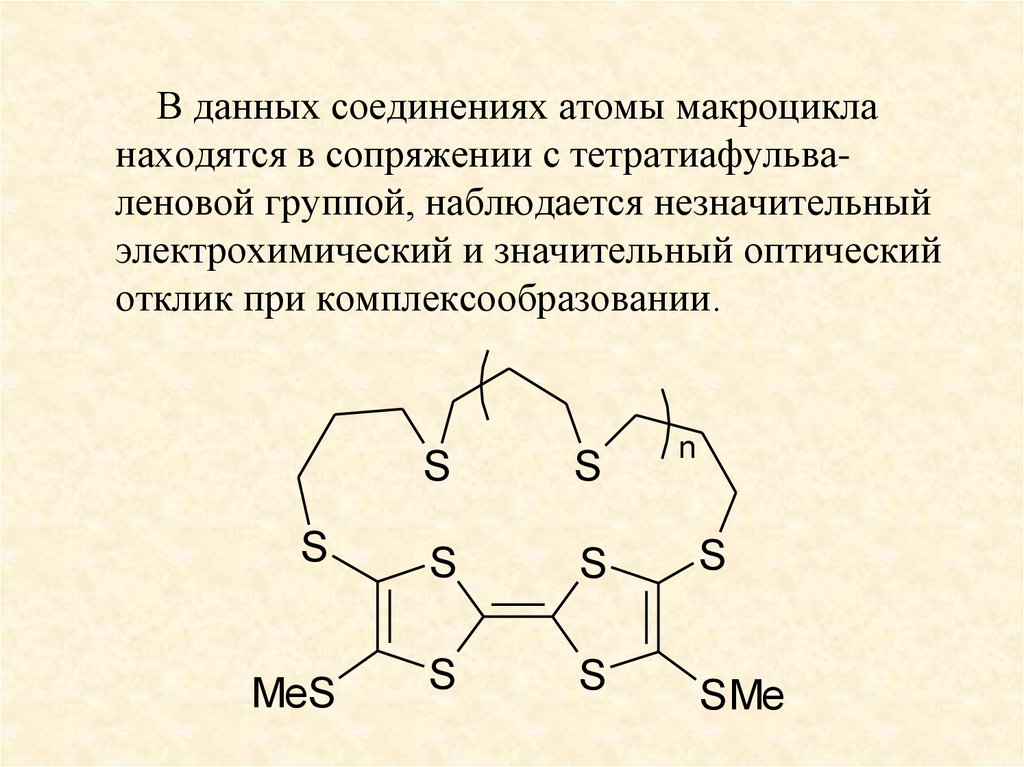
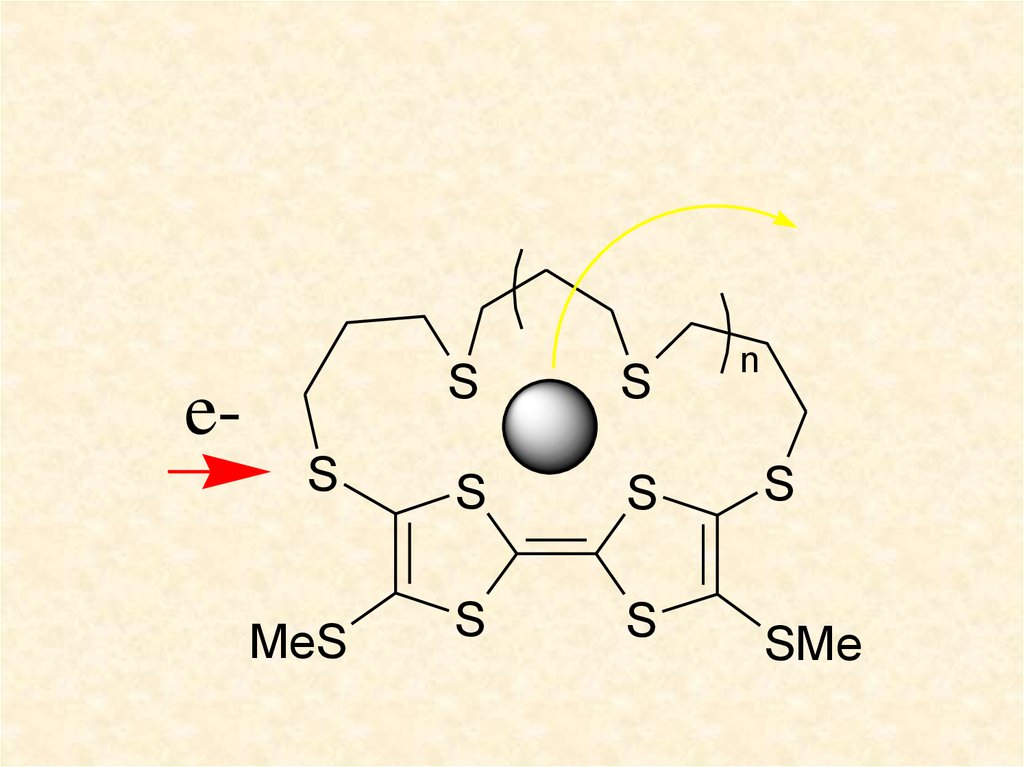
В данных соединениях атомы макроцикланаходятся в сопряжении с тетратиафульваленовой группой, наблюдается незначительный
электрохимический и значительный оптический
отклик при комплексообразовании.
n
S
S
S
S
S
S
MeS
S
S
SMe
64.
nS
S
S
S
S
S
MeS
S
S
SMe
e-
65.
Тиакраунсодержащий сенсорO
O
O
N+
CH3
Pb
S
t-c=0.40
S
O
CH3
O
-
ClO4
S
O
ClO4-
2
c-t=0.55
N+
4
h
ClO4
1
Pb
S
3
0
S
2+
O
1
2
4
O
CH3
O
S
O
S
h =0.55
c-t
O
Pb
2+
N+
CH3
t-c=0.45
S
3
+
ClO4-
1
N+
S
O
S
2+
O
2
O
S
Absorbance
S
O
O
200
250
300
350
400
Wavelength / nm
450
500
550
66.
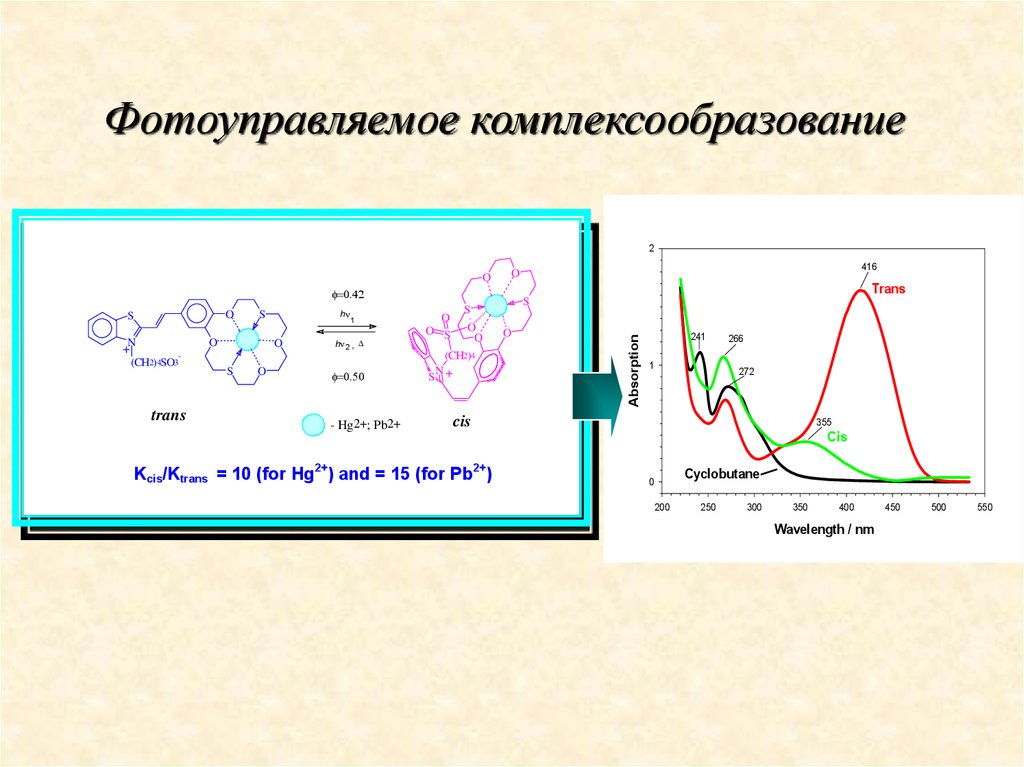
Фотоуправляемое комплексообразование2
O
Trans
N
+
S
O
(CH2)4SO3
trans
h
O
1
h 2 ,
O
O S
S
-
O
O
(CH2)4
S
O
- Hg2+; Pb2+
S
N
S +
O
Absorption
O
S
416
O
241
1
266
272
cis
Kcis/Ktrans = 10 (for Hg2+) and = 15 (for Pb2+)
355
Cis
Cyclobutane
0
200
250
300
350
400
Wavelength / nm
450
500
550
67.
OO
O
S
+
N
O
O
-
+N
O
S
O
S
2
S
Pb2+
(CH2)4SO3
( CH2) 4S O3
1
O
S
S
O
O
O
S
O
O
(CH2)4
O
S
N
+
S
SO
3
68.
• Комплексообразованиемакрогетероциклов
возможно с катионами. анионами и нейтральными
молекулами, в последнем случае по типу "гостьхозяин" за счет многократных нековалентных
взаимодействий. Макроциклический рецептор в
зависимости от структуры может образовывать
молекулярные комплексы с одним, двумя и более
субстратами,
такие
ассоциаты
называются
супрамолекулярными. Молекулярные рецепторы
можно определить как органические структуры с
ковалентными связями, способные к селективному
связыванию с ионными и/или молекулярными
субстратами
посредством
различных
межмолекулярных взаимодействий с образованием
ансамбля из двух или более частиц, супермолекулы.
69. Рецепторы на нейтральные молекулы
70.
Так, 16-членный макроцикл, содержащийчетыре
метоксикарбонилэтильные
группы,
координируется
с
четырьмя
молекулами
мочевины. Комплексообразование протекает за
счет водородных связей атомов водорода
мочевины с карбонильными кислородами
сложноэфирных групп:
R
R
R
N
S
N
N
S
N
R = CH2CH2COOCH3
R
71. Анионсвязывающие рецепторы
• Макротрициклы, содержащие в своихмолекулах положительно заряженные
группы или электронодефицитные атомы
(Si, B, Sn и др.) могут связывать Hal-, N3и другие анионы. Молекулы-рецпторы с
эндоциклическимим
или
экзоциклическими
карбоксильными
группами могут удерживать анионы за
счет образования водородных связей.
72.
• Гетероциклофан с положительно заряженнымигруппами в водном растворе
имеет
гидрофобную полость, что способствует
проникновению "гидрофобного" гостя и его
комплексообразованию с макроциклом. Размер
полости этого гетроциклофана составляет 7А и
является
достаточным
для
включения
фенильной и нафтильной группы ; его
комплексообразование
было
подробно
исследовано на примере связывания 1анилинонафтиламино-8-сульфоната натрия. Для
него также был зафиксирван каскадный тип
комплексообразования с нитратом меди и
азидом натрия.
73.
Анионсвязывающие рецепторыMe
S
+
+
S Me HO S
3
R
O
S OH S+
O
Me
S
+
S
+
Me
гетероциклофан
74.
Тиакраун-соединения в экспериментахпо экстракции солей из воды в органическую
фазу
75.
Металлыэкстрагируются
краунэфирами обычно в виде ионных
ассоциатов,
поэтому
лучшими
растворителями являются умереннополярные вещества (4 10),
обеспечивающие наряду с эффективной
сольватацией аниона высокие значения
констант образования ионных пар.
76.
Экстракция солей из воды в органическую фазуЭкстракция
ионов
металлов
макроциклическими
лигандами
–
наиболее удобный способ изучения их
комплексообразующей
способности.
Краун-эфиры
представляют
интерес
прежде всего для концентрирования и
разделения щелочных и щелочноземельных металлов, а также свинца,
ртути и ряда жестких (по Пирсону) ионов
металлов-актинидов и лантанидов.
77.
Экстракция солей из воды в органическую фазу1
2
3
S
O
S
O
O
4
S
S
O
O
O
O
H
O
C
H
H
S
C
C
O
O
O
H
O
O
S
O
O
99
E, %
O
C
S
O
O
99
99
S
5
99
S
84
100
S
O
S
H
58
75
O
C
O
51
S
50
13
20
12
25
1
0
1
2
2
3
1
1
4
O
O
Cu(II)
16
1
6
Ag(I)
Cu(I)
15
Hg(II)
S
H
C
5
6
O
O
O
78.
Экстракция солей из воды ворганическую фазу
1
2
O
3
S
O
C
S
S
O
O
H
4
S
S
O
O
O
O
H
C
O
S
O
1
C
O
2
Complex
1. Hg(II)
2. Hg(II)
3. Hg(II)
4. Hg(II)
5. Hg(II)
6. Hg(II)
O
H
O
log K
22.7
18.0
19.5
20.1
21.0
18.9
O
3
O
H
C
S
O
O
O
% экстракции
94
55
H
60
76
83
80
S
5
C
S
O
S
O
S
O
S
6
O
O
S
H
C
O
O
O
79.
Экстракция солей из воды ворганическую фазу
O
H
O
O
S
H
O
O
O
S
O
S
O
S
H
O
O
S
O
S
O
O
H
O
O
O
80.
В общем случае экстракция ионов металловуменьшается в ряду противоионов
Pi ClO4 SCN J NO3 Br PhCOO- Сl CN HSO4 HCO3 F OH SO4- CO32-
PO43-,
что связано с ростом энергии гидратации
ионов.
Лучшими
противоионами
для
экстракции являются крупные гидрофобные
анионы, такие как пикрат, дипикриламинат,
динитрофенолят, тетрафенилборат, анионы
сульфофталеиновых красителей.
81.
Экстракция солей серебра из воды ворганическую фазу
2
3
S
O
O
O
O
S
O
O
O
O
H
H
C
4
S
C
O
S
O
O
E, %
C
S
99
99
H
O
O
O
O
S
5
99
99
S
100
80
82
O
60
57
40
31
picrate
18
nitrate
0
2
3
S
O
S
H
C
20
O
4
5
S
82.
83.
Важныммоментом
для
селективного
связывания катиона металла
является
конформация макроцикла, на которую влияет
наличие
функциональных
групп
или
алициклических
фрагментов
различной
конформационной подвижности.
84.
[2+2]-фотоциклоприсоединение5
6
4
S
S
+N
N+
-O3S
S
O
O
O
O
S
h 313 nm)
S
O
N
+
S
6'
a
O
b
2'
O
1'' 3''
ФЦП 10-4
S
S
1.3
N+
O
O
S
0.79
(CH2 )4SO3 -
S
O
S
O
S
O
S
O
2+
28
N+
2+
100
S
O
S
O
Pb
N+
(CH2 )4SO3 -
(CH2 )4SO3 -
O
S
O
(CH2 )4SO3 -
O
2+
Hg
O
S
O Hg
S
O
N+
(CH2)4SO3-
N+
S
2+
Hg
O
S
S
S
O
O
1.3
SO3 -
O
O
ФЦП 10-4
Комплекс
O Hg2+
S
S
S
циклоаддукт
димерный комплекс анти-"голова-к-хвосту"
Комплекс
Pb2+ O
O
+ 2''
4''
N
S
5'
O
Pb2+ O
S
S
O
O Pb2+
S
O
Pb2+ O
h (365 nm)
SO3 -
7
SO3 -
S
N+
(CH2 )4SO3 -
2+
Hg
O
S
S
0
85.
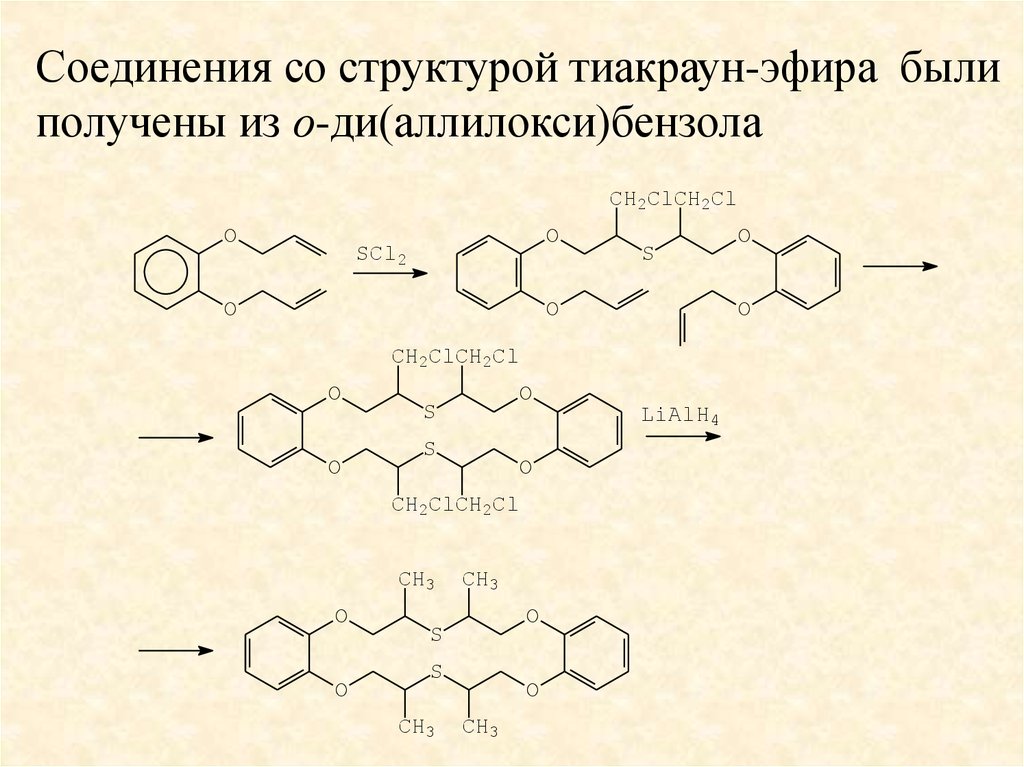
Соединения со структурой тиакраун-эфира былиполучены из о-ди(аллилокси)бензола
CH2ClCH2Cl
O
O
SCl2
O
S
O
O
CH2ClCH2Cl
O
O
O
S
S
O
CH2ClCH2Cl
CH3
O
O
CH3
O
S
S
CH3
O
CH3
O
LiAlH4
86.
SCl+
SCl2
+
S
Cl
-
Cl
• Особо
следует
сказать
о
механизме
взаимодействия дихлорида серы с двойной
связью. Общепринято считать, что начальной
стадией присоединения дихлорида серы по
двойной
связи
является
образование
эписульфониевого иона:
87.
Комплексы тиакраун-эфиров с ионами меди (II)рутения (II) и никеля (II)






























































 chemistry
chemistry








