Similar presentations:
Методы количественного анализа ЛВ и варианты методов
1.
МЕТОДЫКОЛИЧЕСТВЕННОГО
АНАЛИЗА ЛВ
И ВАРИАНТЫ методов
2.
МЕТОД ЦЕРИМЕТРИИ(метод окислительно-восстановительного титрования)
1. Вариант прямого титрования
А) Викасол (после гидролиза и восстановления)
O
O
OH
CH3
CH3
SO3Na Zn,HCl
OH
+SO2 +NaCI
O
OH
CH3
CH3
+ 2Ce(SO4)2
OH
Индикатор
ортофенантролин
Э=1/2Моль
+Ce2(SO4)3+H2SO4
O
2+
N
4+
Се
Fe
3+
N
3+
Cе
Fe
N
N
красный
синий
3.
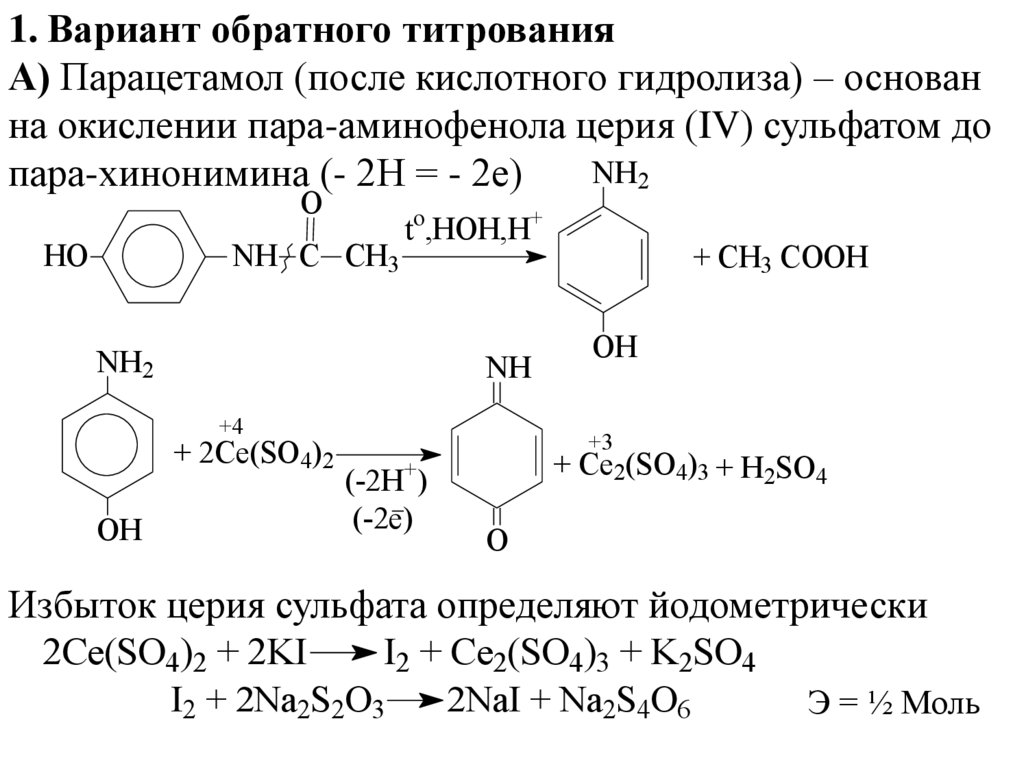
1. Вариант обратного титрованияА) Парацетамол (после кислотного гидролиза) – основан
на окислении пара-аминофенола церия (IV) сульфатом до
NH2
пара-хинонимина (- 2Н = - 2е)
O
HO
NH С СH3
to,НОН,H+
NH2
NH
+4
+ 2Ce(SO4)2
OH
(-2H+)
(-2e)
+ CH3 COOH
OH
+3
+ Ce2(SO4)3 + H2SO4
O
Избыток церия сульфата определяют йодометрически
2Ce(SO4)2 + 2KI
I2 + Ce2(SO4)3 + K2SO4
I2 + 2Na2S2O3
2NaI + Na2S4O6
Э = ½ Моль
4.
ПродолжениеБ) Раствор формальдегида (вариант обратного
титрования), основан на окислении формальдегида до
Муравьиной (метановой) кислоты
Э = ½ Моль
O
C + 2Ce(SO4)2
H
H
+ H2O
O
H
C
+Ce2(SO4)3 +H2SO4
OH
избыток церия сульфата титруют раствором соли Мора
до желтого окрашивания (изб. капля титранта)
2Ce(SO4)2 + 2FeSO4∙(NH4)2SO4∙6H2O→Ce2(SO4)3 +
+Fe2(SO4)3+ 2(NH4)2SO4 +6H2O
5.
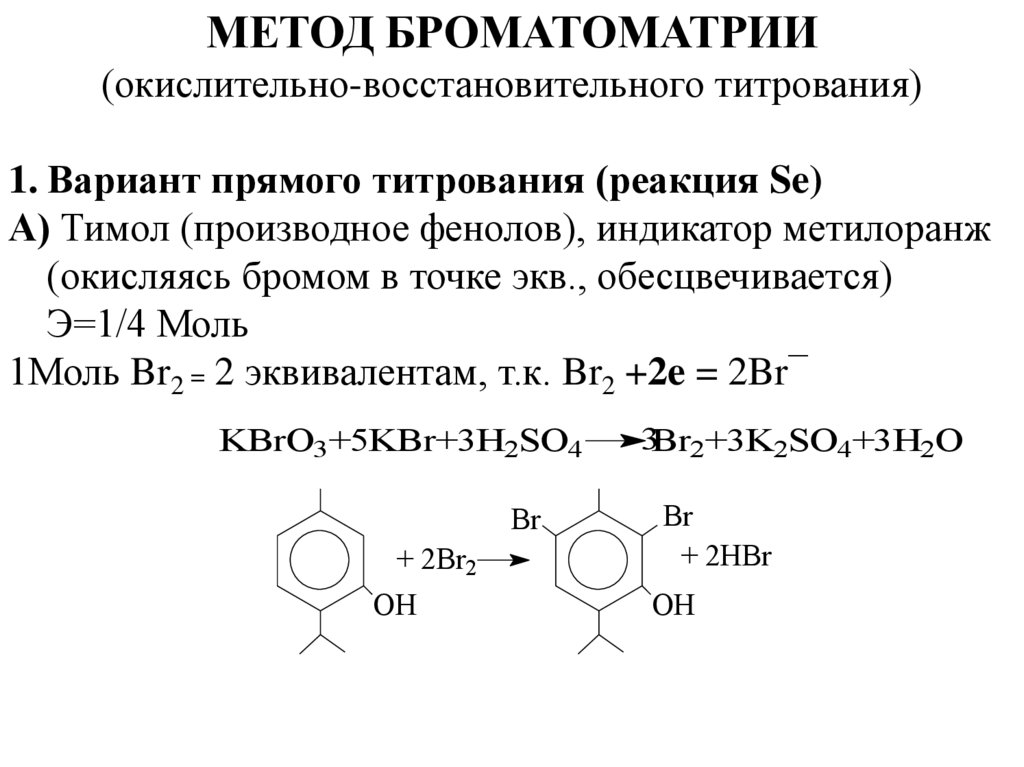
МЕТОД БРОМАТОМАТРИИ(окислительно-восстановительного титрования)
1. Вариант прямого титрования (реакция Se)
А) Тимол (производное фенолов), индикатор метилоранж
(окисляясь бромом в точке экв., обесцвечивается)
Э=1/4 Моль
1Моль Br2 = 2 эквивалентам, т.к. Br2 +2e = 2Br¯
KBrO3+5KBr+3H2SO4
Br
+ 2Br2
OH
3Br2+3K2SO4+3H2O
Br
+ 2HBr
OH
6.
Б) Ароматические первичные аминопроизводные ЛВокисляются бромом на первой стадии метода при
стоянии с бромат-бромидной смесью и получается
завышенный результат
-новокаин и др. ЛВ ПАБК, Э=1/4 Моль
-сульфаниламиды (норсульфазол, стрептоцид и др.)
Э=1/4Моль
KBrO3 + 5KBr + 6 HCl
3Br2 + 6 KCl
NH2
NH2
Br
+ 2Br2
R
+ 3H2O
Br
M .O
+ 2HBr
R
7.
2. Вариант обратного титрования (реакции Se)А) ЛВ фенолов (фенол, резорцин, синестрол и др.)
3Br2+3K2SO4+3H2O
KBrO3+5KBr+3H2SO4
Резорцин
Э=1/6 Моль
OH
Br
+ 3Br2
OH
OH
Br + 3HBr
Br
OH
Избыток брома определяется йодометрическим методом
Br2 + 2KI
I2 + 2Na2S2O3
I2 + 2KBr
2NaI +Na2S4O6
8.
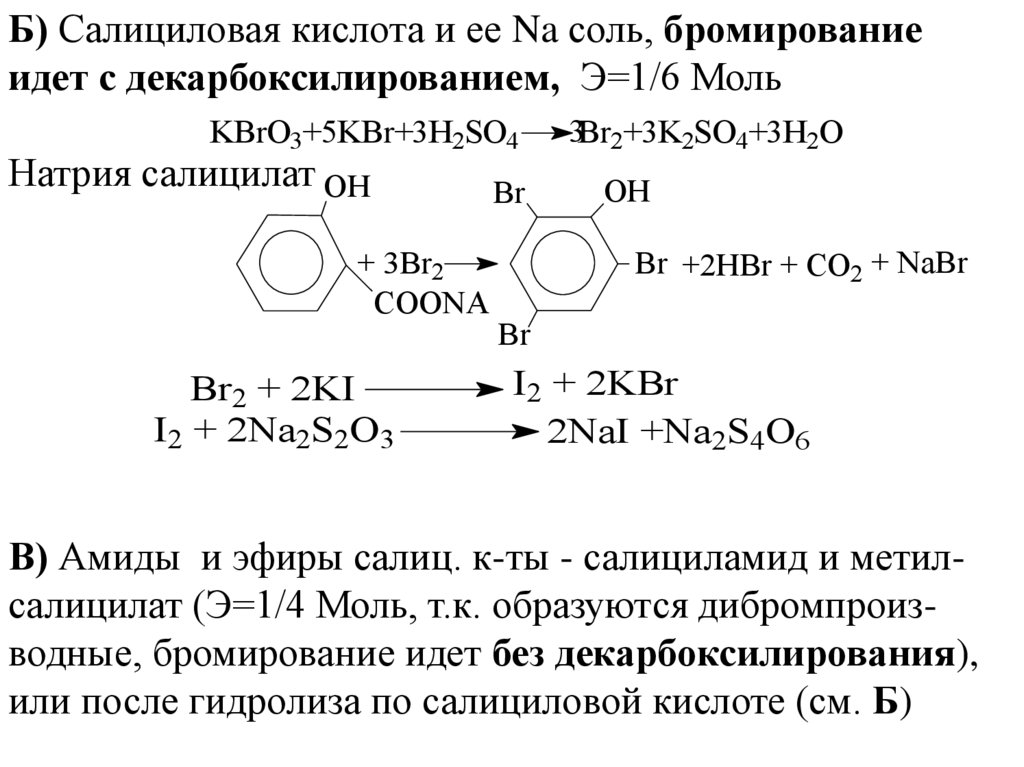
Б) Салициловая кислота и ее Na соль, бромированиеидет с декарбоксилированием, Э=1/6 Моль
KBrO3+5KBr+3H2SO4
Натрия салицилат OH
+ 3Br2
COONA
Br2 + 2KI
I2 + 2Na2S2O3
Br
3Br2+3K2SO4+3H2O
OH
Br +2HBr + CO2 + NaBr
Br
I2 + 2KBr
2NaI +Na2S4O6
В) Амиды и эфиры салиц. к-ты - салициламид и метилсалицилат (Э=1/4 Моль, т.к. образуются дибромпроизводные, бромирование идет без декарбоксилирования),
или после гидролиза по салициловой кислоте (см. Б)
9.
МЕТОД ЙОДАТОМЕТРИИ(окислительно-восстановительного титрования)
1.Вариант прямого титрования
А) Лактоны полиоксикислот- аскорбиновая кислота
OH OH
O
+
3
O
OH
CH2OH
H
O
KIO3
O
3
H
O
OH
CH2OH
+KI + 3H2O
O
В точке эквивалентности (крахмал с I2 дает синее окраш.)
KIO3 +5KI + 6HCI → 3I2 + 6KCI +3H2O Э =1/2 Моль
Примеров варианта обратного титрования на 3курсе нет
10.
МЕТОД ЙОДОМЕТРИИ(окислительно-восстановительного титрования)
1. Вариант прямого титрования
А) Тиосульфат натрия (Э =1Моль)
2 экв.
2NaI + Na2S4O6
2Na2S2O3 +I2
Б) Кислота аскорбиновая, инд. крахмал (Э =1/2 Моль)
OH OH
O
+
O
OH
CH2OH
H
O
O
I2
H
O
OH
CH2OH
O
+2HI
11.
2. Вариант обратного титрованияА) Альдегидопроизводные ЛВ, окисление в щелочной
среде (формальдегид, хлоралгидрат в среде NaOH,
глюкоза в среде NaHCO3) до кислоты (т.е. – 2е)
O
O
C
+ I2 + 3NaHCO3
C
+ 2NaI + 2H2O + CO2
H
ONa
R
R
I2 + 2Na2S2O3
2NaI + Na2S2O3 Э=1/2Моль
изб.
Б) Фенолопроизводные (фенол и др., салициловая к-та и ее
произв. – без декарбоксилирования, перв. аром. амины
–новокаин и др. ПАБК, стрептоцид и др. СА), реакция Se
Э=1/2n Моль, где n=число I в продукте галоидирования
OH
I
+ 3I2
OH
резорцин
OH
I + 3HI
I
OH
Эрезорцина = 1/6 Моль
изб.
I2+2Na2S2O3
2NaI+Na2S4O6
12.
В) Вариант обратного титрования для органическихоснований: первичных –норадреналин, вторичных –
эфедрин и др. арилалкиламины, третичных –димедрол,
новокаин и др.ПАБК, лидокаин и др. ацетанилиды и т.д.
Основан на реакции комплексообразования с раствором
йода – образования полииодидов R-NH-R1∙HI∙nI2↓ или
состав в ионном виде R-N+H2-R1 I- · n I2 ↓
Э= 1/2n Моль, где n = 1, 2 и т.д. у разных оснований ЛВ
Эфедрина г/хл n = 1, поэтому Э = ½ Моль
*
*
+ KI∙I2→↓R-NH-R1∙HI∙I2 +KCI
CH
CH
CH
1
2
3 3
HCl
OH NH CH 3
изб.I +2Na S O
2
2 2 3
2NaI+Na2S4O6
Г) Природные пенициллины – окисление продуктов
гидролиза
13. Д) Алифатические серосодержащие аминокислоты (цистеин, метионин), окисление по R-SH или R-S-R1 Цистеин, Э = 1 Моль (1Моль
теряет 1е, окислениепроисходит до гомоцистина по тиогруппе -SH)
2H2N-CH-COOH + I2 → 2HI + H2N-CH-COOH
|
|
SH
S – S – CH- COOH
|
NH2
изб.I +2Na S O
NaI+Na
S
O
2
2
2 2 3
2 4 6
Метионин, Э =1/2 Моль (окисление происходит до
сульфоксида путем присоединения кислорода по замещенной тиогруппе –SH, т. е. 1 Моль метионина теряет 2е)
R-S-CH3 + I2 +H2O → R-S = O + 2HI
|
CH3
изб.I +2Na S O
2
2 2 3
2NaI+Na2S4O6
14.
3. Вариант косвенного титрованияМеди сульфат, выделившийся йод титруют натрия
тиосульфатом, восстановление меди(II) до меди(I),
Э = 1Моль (+1e)
2CuSO4 + 4KI →↓2CuI + I2 +2K2SO4
выд.I2+2Na2S2O3
2NaI+Na2S4O6
Растворы перексида водорода, гидроперит, магния
перекись (после растворения в минеральной кислоте)
Э =1/2 Моль (+2e)
H2O2 + 2KI + H2SO4 → I2 + 2H2O + K2SO4
выд. I2+2Na2S2O3
2NaI+Na2S4O6
15.
МЕТОД ЙОДХЛОРМЕТРИИ1. Вариант обратного титрования
А) Реакция Se – ЛВ фенолов (резорцин и др.),
ароматических перв. аминов ( новокаин и др. ПАБК,
паск –Na, стрептоцид и др. СА)
Э=1/2n Моль, где n=число I в продукте галоидирования
OH
I
+ 3IСI
OH
OH
I + 3HCI
I
OH
изб. ICl + KI
I2 + KCl
I2+2Na2S2O3
2NaI+Na2S4O6
Б) Реакция комплесообразования
органических
оснований (образуются йодмонохлориды в виде осадков
R≡N∙HCI∙nICI), Э =1/2n Моль, где n –число молекул ICI
Димедрол R-N(CH3)2∙HCI+2ICI→↓R-N(CH3)2 ∙HCI∙2ICI
Э дим. =1/4 Моль дим.
изб. ICl + KI
I2 + KCl
I2+2Na2S2O3
2NaI+Na2S4O6
16.
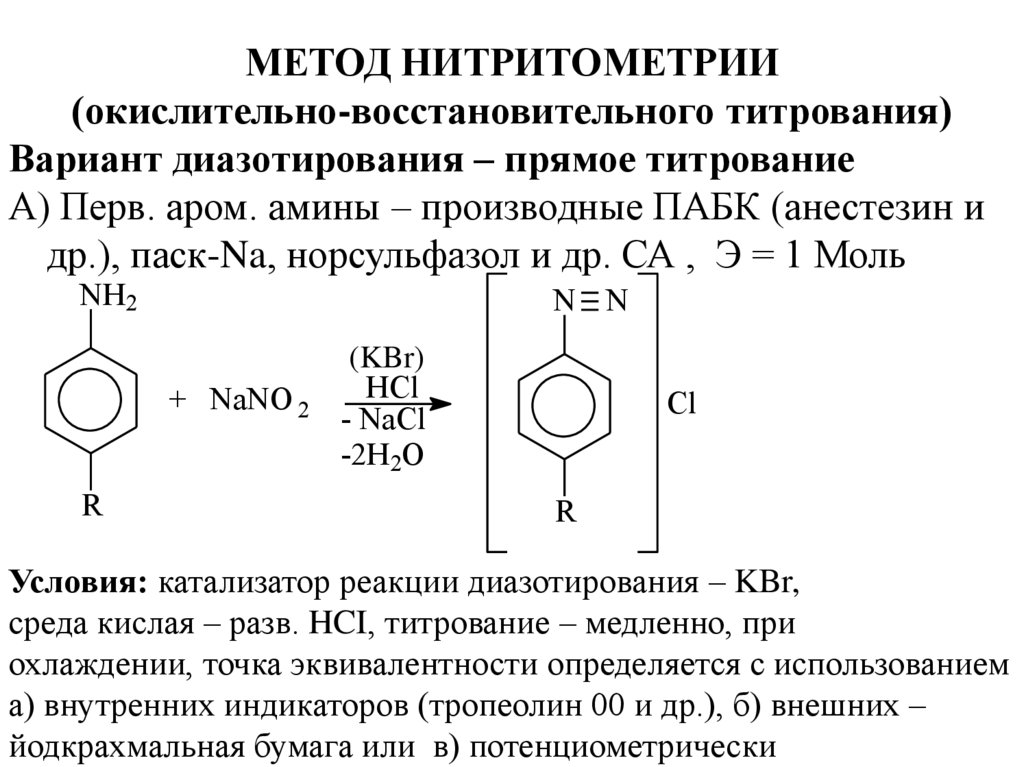
МЕТОД НИТРИТОМЕТРИИ(окислительно-восстановительного титрования)
Вариант диазотирования – прямое титрование
А) Перв. аром. амины – производные ПАБК (анестезин и
др.), паск-Na, норсульфазол и др. СА , Э = 1 Моль
NH2
N N
+ NaNO 2
R
(KBr)
HCl
- NaCl
-2H2O
Cl
R
Условия: катализатор реакции диазотирования – KBr,
среда кислая – разв. HCI, титрование – медленно, при
охлаждении, точка эквивалентности определяется с использованием
а) внутренних индикаторов (тропеолин 00 и др.), б) внешних –
йодкрахмальная бумага или в) потенциометрически
17.
2. Вариант нитрозирования (пример – один препаратдикаин) – прямое титрование
N
NH-C4H9
+ NaNO 2
HCl
- NaCl
-H2O
R HCI
R
Э преп. = 1Моль
N O
C 4H 9
18.
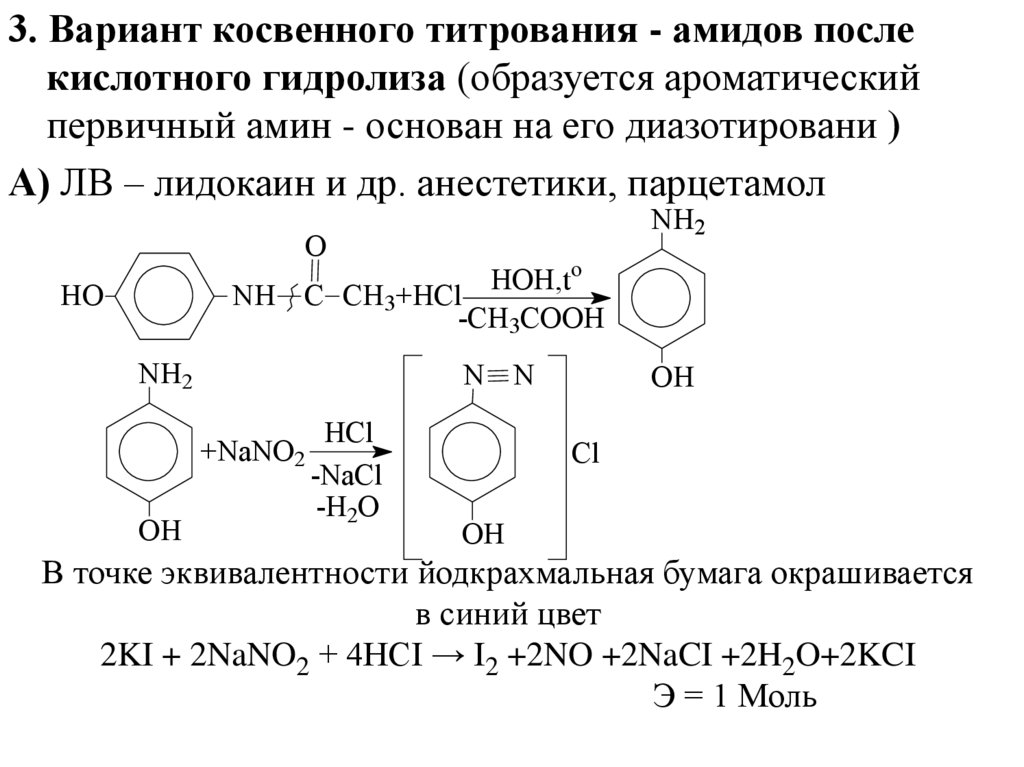
3. Вариант косвенного титрования - амидов послекислотного гидролиза (образуется ароматический
первичный амин - основан на его диазотировани )
А) ЛВ – лидокаин и др. анестетики, парцетамол
NH2
O
HOH,to
NH С СH3+HCl
-CH3COOH
HO
NH2
OH
N N
HCl
+NaNO2
-NaCl
-H2O
OH
Cl
OH
В точке эквивалентности йодкрахмальная бумага окрашивается
в синий цвет
2KI + 2NaNO2 + 4HCI → I2 +2NO +2NaCI +2H2O+2KCI
Э = 1 Моль
19. 4. Вариант косвенного титрования ароматических нитропроизводных после восстановления Ar-NO2 до R-NH2
А) Левомицетин и его эфиры,точка эквивалентности – с внешним индикатором
(йод - крахммальная бумага),
Э =1Моль
o
R
NO2 Zn,HCl,t
R
NH2 +NaNO2 + 2HCl (KBr)
1 Моль
1 Моль
R
+
Cl
N N
- NaCl, - 2H2O
соль диазония
20.
МЕТОД КОМПЛЕКСОНОМЕТРИИ1. Вариант прямого титрования
А) Магния и цинка сульфат (металлиндикатор – хром
черный специальный), кальция хлорид (металлиндикатор – кислотный хром темно-синий) и др. соли
2-х валентных металлов (аммиачный буфер pH =8-9)
H 2O
H 2O
Mg
OH
2
N N
MgSO4
N
N
H2SO4
NaO3S
NaO3S
NO2
MgSO4
O
O
OH
NO2
CH2 COONa
CH2 COONa
N
N
CH2 COO
CH2 COOH MgInd
CH2
буфер CH2
CH2
COOH
N CH2
CH2 COONa
CH2
N CH2 COO
CH2 COONa
Mg
H2Ind(своб.инд.)
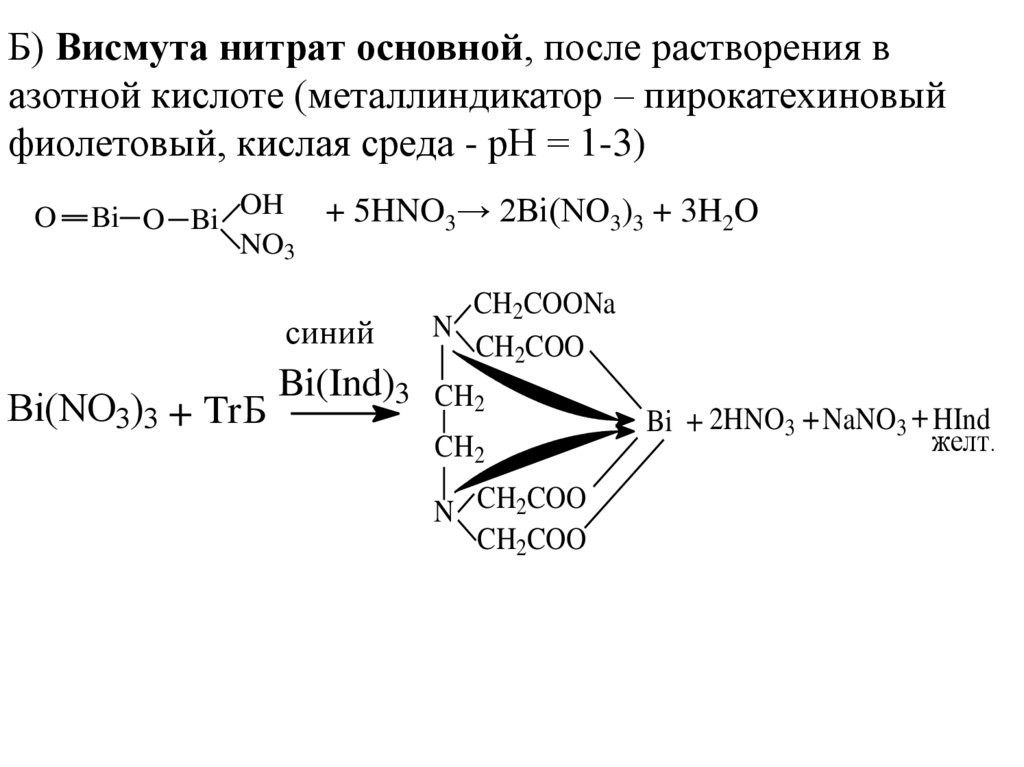
21. Б) Висмута нитрат основной, после растворения в азотной кислоте (металлиндикатор – пирокатехиновый фиолетовый, кислая среда -
рН = 1-3)O
Bi O Bi OH
NO3
+ 5HNO3→ 2Bi(NO3)3 + 3H2O
синий
Bi(NO3)3
TrБ
CH2COONa
N
CH2COO
Bi(Ind)3 CH2
CH2
N CH2COO
CH2COO
Bi
2HNO3 NaNO3 HInd
желт.
22.
2. Вариант обратного титрования солей 3-х валентныхметаллов (титров. р-ры: эдетат натрия и свинца нитрат
или цинка сульфат и др. соли тяжелых металлов)
А) Алюминия фосфат и гидроксид после растворения в кислоте
AlPO4 + 3HCI →AlCI3 + H3PO4
1стадия
избыток титранта
AlCl3
CH2 COONa
N
CH2 COOH
CH2
CH2
COOH
N CH2
CH2 COONa
2 стадия
TrБ
Pb(NO3)2
CH2 COONa
N
CH2 COO
CH2
HInd
2HCl CH2
NaCl N CH2 COO
CH2 COO
CH2 COONa
N
CH2 COO
HInd CH2
2HNO3 CH2
N CH2 COO
CH2 COONa
Al
Pb
PbInd
23.
МЕТОД КЪЕЛЬДАЛЯА) ЛВ азотсодержащие (амиды, амины - первичные,
вторичные, третичные, нитропроизводные и т.д.),
алифатические аминокислоты (глютаминовая и др.)
Метод основан на минерализации азотсодержащих ЛВ
конц. H2SO4 до гидросульфата аммония, Э = 1/n Моль,
где n = числу атомов азота в ЛВ
Прозерин
Э = 1/2 Моль
N C O
H 3C
O
CH3
+
N CH3
к.H2SO4
CH
SO
3
4
2NH4HSO4
CH3
минерализация
2 NH4HSO4 + 2 NaOH
2 NH3 + 2 H [B(OH)4]
2NH4 [B(OH)4] + 2 HCI
2NH3 + Na2SO4 + 2 H2O
2 NH4 B(OH)4
2NH4Cl+2H3BO3+2H2O
H 3C
24.
1. Вариант метода Къельдаля - основан на щелочномгидролизе амидов с образованием летучих веществ
– аммиака или низкомолекулярных аминов
(алкиламинов)
А) Салициламид , прозерин
Прозерин Э=1Моль
CH3
30%,NaOH,
+
N CH3
HOH,to
+H[B(OH)4]
CH
SO
NH(CH
)
3
4
3
2
CH3
гидролиз
H 3C
N C O
H 3C
O
H 3C
H 3C
+
N
H
H
B(OH)4
+HCl
+
(H3C)2 NH2 Cl+H3BO3+H2O
25. МЕТОД МЕРКУРИМЕТРИИ (осадительного титрования)
А) Неорг. ЛВ – галогениды щелочных металлов (натрия икалия хлориды, йодиды, бромиды, Э = 1 Моль,
т.к 1 Моль ртути (II) нитрата соответствует 2 эквивалентам
(дихлорид ртути (II) - растворимое но трудноионизируемое в-во,
а дииодид и дибромид ртути (II) – осадки)
2ГаI ¯+ Hg2+ →Hg ГаI 2
Кальция хлорид, Э= ½ Моль
1 Моль 2 эквивалента
CaCI2 + Hg(NO3)2 →HgCI2 + 2NaNO3
Индикатор – дифенилкарбазон, среда – кислая (HNO3)
C6H5 NH NH
C6H5
N
N
C O + Hg2+
O C
NH
N
N
N
C6H5
Hg/2
C6H5
26.
Б) Орг. ЛВ – соли HГаL кислот и органическихтретичных, вторичных оснований (новокаина г/хл и др.
производные ПАБК, эфедрина г/хл и др. ЛВ арилалкиламинов),
2R1-NH-R2 · HCI + Hg(NO3)2 → HgCI2 + 2 R1-NH-R2 ∙ HNO3
2 Моль
2 эквивалента
Э = 1 Моль (для соли однокислотного основания)
Точка эквивалентности определяется по дифенилкарбазону
(переход окраски от малинового к фиолетовой)
Метод аргентометрии
Варианты Мора, Фаянса, Фольгарда, Кольтгофа
(среда, индикаторы, эквивалент - см. лекцию
«ГаI производные неорганической природы» -галогениды калия
и натрия, кальция хлорид, HГаI соли органических оснований,
подобно меркуриметрии)
27. Методы аргентометрии I. Методы аргентометрии для ЛП неорганической природы
Метод Мора - Cl¯,Br¯(ФС)NaCl+AgNO3
AgCl +NaNO3
2AgNO3+K2CrO4
Ag2CrO4 +2KNO3
изб. капля
красно-оранжевый Э = 1Моль
- титруют в нейтральной или слабощелочной среде
2+
2CrO
+2H
+
4
в H среде, т.к.
Cr2O72-+H2O
- нельзя
- нельзя в сильно OH¯, т.к. образуется черный
осадок оксида серебра
Ag++OHAg(OH)
Ag2O +H2O
28.
Метод Фаянса – для Cl¯, Br¯, I¯с адсорбционными индикаторами:
- для Cl¯, Br¯ - бромфеноловый синий (илиHInd) +
CH3COOH разв. (среда)
в точке эквивалентности осадок AgHaI окрашивается в
сине-фиолетовый цвет
- для I- - натрия эозинат (или NaInd)+ CH3COOH разв.,
в точке экв. осадок окрашивается в розовый цвет
Индикатор в растворе диссоциирует на ионы:
HInd H+ + IndΘ и при титровании в точке эквивалентности
происходит адсорбция анионов индикатора на осадке Ind
Э=1 Моль
+
Ag
Ind Ag+
AgI+NaNO3
NaI+AgNO3
Ind
+
AgHal
Ag
[(AgI)Ag+]Ind(AgI)Ag++IndAg+ Ag+
розовый Э=М
IndInd-
29.
. Метод Фольгарда – Cl¯, Br¯, I¯(неоф.)вариант обратного титрования,
индикатор – железоаммониевые квасцы
1 стадия: к раствору препарата добавляют точное
избыточное количество титранта (р-р AgNO3)
Э=1 Моль NaCl+AgNO
AgCl +NaNO
3
3
AgNO3+NH4SCN
AgSCN +NH4NO3
2 стадияост.
3+
титрование
3NH4SCN + (NH4)Fe(SO4)2
-в точке эквив.
ЖАК
Fe(SCN)3+2(NH4)2SO4
буро-красный
30.
Метод Кольгофа – I¯ (не мешают Cl¯, Br¯)р-р NaI + 0,1н. KIO3 + крахмал + Н2SO4 разв. до синего
окраш-я
1реакция
I¯ + IO3¯ + 6H+ = I2 + 3H2O
I2 + I¯ + крахмал =комплекс. соединение типа
включения синего цвета
Затем титруют 0,1н. АgNO3 до исчезновения
синего
окрашивания
NaI + AgNO3 = AgI(осадок) + NaNO3
Э= 1Моль
В точке эквивалентности 1 реакция идет в обратном
направлении и весь иодид ион осаждается нитратом
серебра.
31.
II. Методы аргентометрии для лекарственныхпрепаратов –солей галогеноводородных
кислот и органических оснований
Метод Мора и др. варианты
R1-NH-R2•HCI+AgNO3 → R1-NH-R2∙HNO3 +AgCI↓
в точке экв. 2AgNO3 + K2CrO4→↓Ag2CrO4 + 2KNO3
Э=1 Моль,
т.к. ЛП содержит 1 галогенид ион в составе
Метод аргентометрии для ЛП , содержащих
галоген органически связанный проводится после
дегалогенирования (переведения в галогенид ион),
смотри ниже
32.
III. Аргентометрические методы (варианты Фаянса,Фольгарда,
Мора)
количественного
анализа
галогенопроизводных органических ЛП
с I, Br, CI ковалентно (органически) связанными после
дегалогенирования способами:
1) Zn + NaOH (to) или 2) Zn + CH3COOH (to)
Э препарата = Моль/n,
где n – это число ГаI в составе молекулы препарата
Например для йодоформа:
CHI3 + Zn + 5NaOH → 3NaI + CH4 + Na2ZnO2 +2H2O
Далее титрование по варианту Фаянса, после подкисления
кислотой уксусной, индикатор натрия эозинат ( NaInd )
3NaI + 3AgNO3 → 3AgI ↓ + 3NaNO3
В точке эквивалентности осадок окрашивается в розовый цвет
↓ [(AgI) Ag ]+ Ind- Э йодоформа = 1/3 Моль CHI3


























 chemistry
chemistry








