Similar presentations:
Методы количественного анализа ЛВ
1.
МЕТОДЫКОЛИЧЕСТВЕННОГО
АНАЛИЗА ЛВ
И ВАРИАНТЫ методов
2.
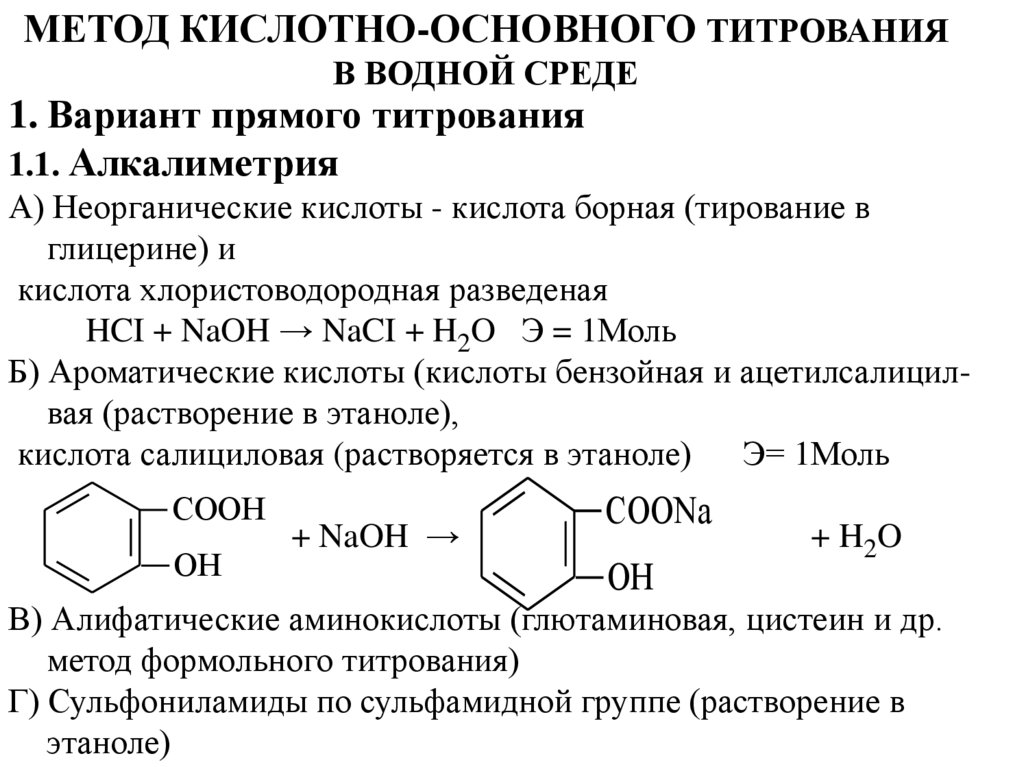
МЕТОД КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯВ ВОДНОЙ СРЕДЕ
1. Вариант прямого титрования
1.1. Алкалиметрия
А) Неорганические кислоты - кислота борная (тирование в
глицерине) и
кислота хлористоводородная разведеная
HCI + NaOH → NaCI + H2O Э = 1Моль
Б) Ароматические кислоты (кислоты бензойная и ацетилсалицилвая (растворение в этаноле),
кислота салициловая (растворяется в этаноле)
Э= 1Моль
COOH
OH
+ NaOH →
COONa
OH
+ H2O
В) Алифатические аминокислоты (глютаминовая, цистеин и др.
метод формольного титрования)
Г) Сульфониламиды по сульфамидной группе (растворение в
этаноле)
3.
Д) Соли органических оснований (препараты ПАБК –новокаин и др., арилалкиламины – адреналина г/хл. и
др.)
NH2
C
O
Новокаин
CH2
O
CH2
N
C2H5
C2H5
CHCI3
HCl + NaOH → NaCI + H O +
2
NH2
+↓
Э = 1Моль
C O
O
CH2 CH2 N
C2H5
C2H5
4.
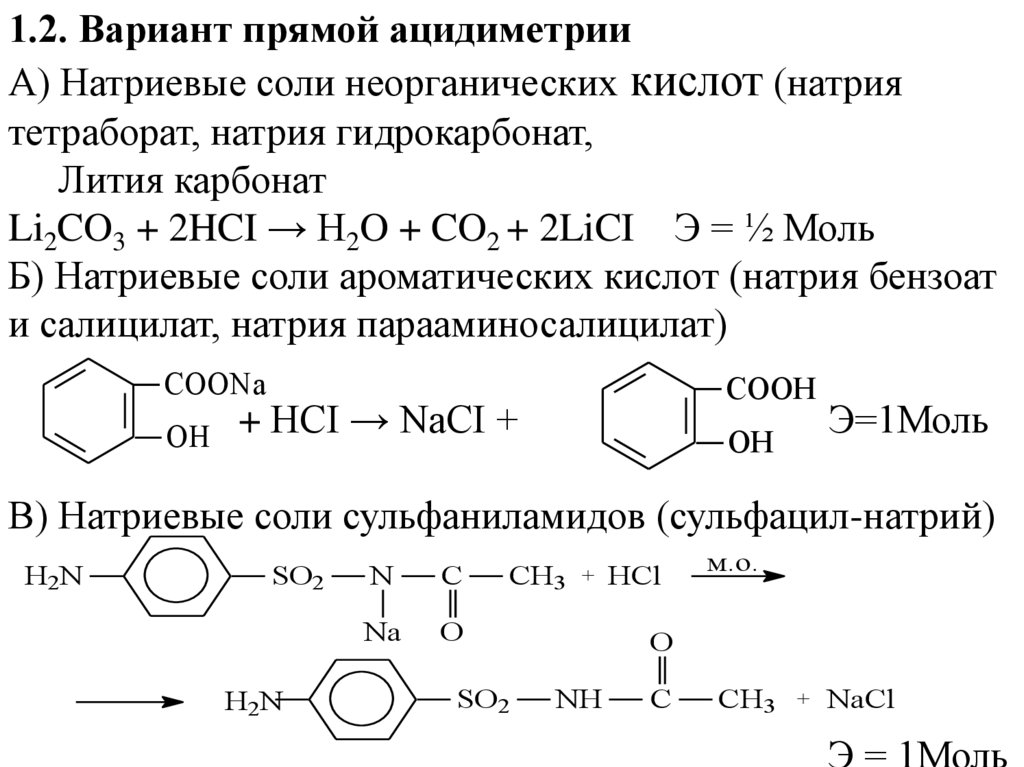
1.2. Вариант прямой ацидиметрииА) Натриевые соли неорганических кислот (натрия
тетраборат, натрия гидрокарбонат,
Лития карбонат
Li2CO3 + 2HCI → H2O + CO2 + 2LiCI Э = ½ Моль
Б) Натриевые соли ароматических кислот (натрия бензоат
и салицилат, натрия парааминосалицилат)
COONa
COOH
OH
OH
+ HCI → NaCI +
Э=1Моль
В) Натриевые соли сульфаниламидов (сульфацил-натрий)
H2N
SO2
H2N
N
C
СH3 + HCl
Na
O
O
SO2
NH
C
м.о.
СH3
+
NaCl
Э = 1Моль
5.
1.3. Вариант косвенного КОТА) Бициклические терпены (кето-производные) оксимный метод для камфоры, бромкамфоры и др.)
O
N OH
+ H2N
OH HCl
+ HCl
-H2O
выделившаяся HCI + NaOH → NaCI + H2O Э=1Моль
1.4. Вариант обратного КОТ
А) Метод ацетилирования для спиртов (многоатомных),
терпенов и фенолов
+
OH
изб. H3C C
O
H3C
H3C
O + H2O
2
C
O
O
C
O
2CH3COOH
+ CH3COOH
O C CH3
O
CH3COOH + NaOH → CH3COONa + H2O
Э = 1Моль
6.
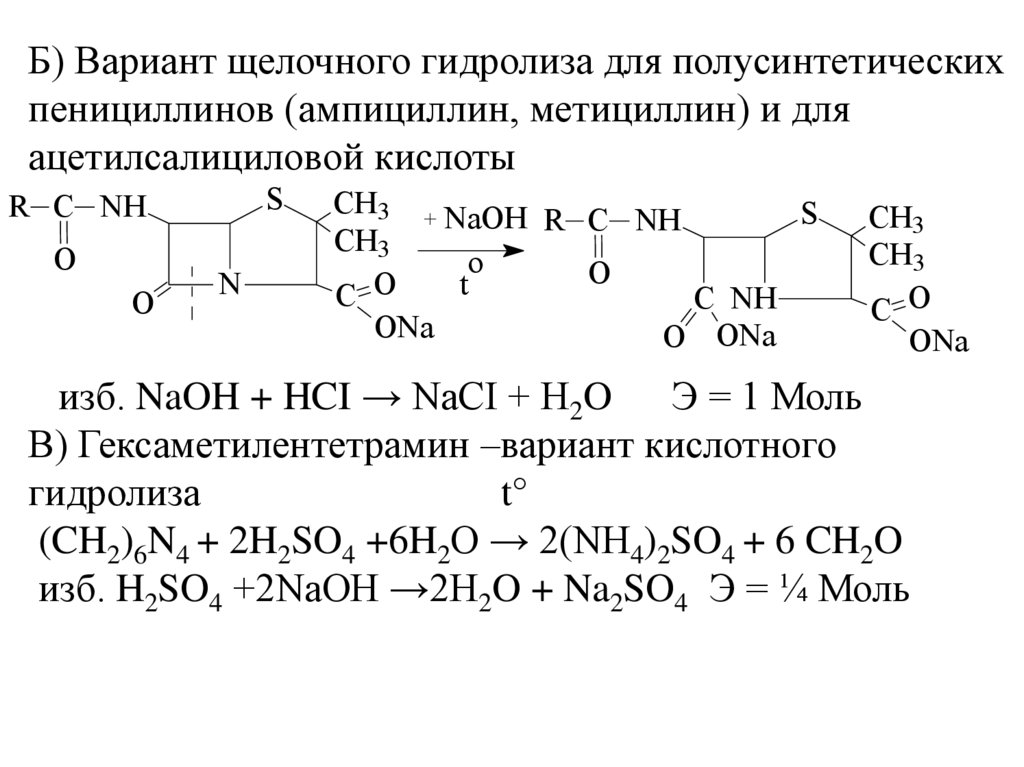
Б) Вариант щелочного гидролиза для полусинтетическихпенициллинов (ампициллин, метициллин) и для
ацетилсалициловой кислоты
S
R C NH
O
O
N
CH3 + NaOH
S
R C NH
CH3
o
O
O
t
C
C NH
ONa
O ONa
CH3
CH3
C O
ONa
изб. NaOH + HCI → NaCI + H2O
Э = 1 Моль
В) Гексаметилентетрамин –вариант кислотного
гидролиза
t°
(CH2)6N4 + 2H2SO4 +6H2O → 2(NH4)2SO4 + 6 CH2O
изб. H2SO4 +2NaOH →2H2O + Na2SO4 Э = ¼ Моль
7.
Метод КОТ в неводной среде1.Метод КОТ в неводной среде
протогенного растворителя
1.1. Метод КОТ в ледяной CH3COOH
A)ЛВ – органические основания или соли
органических кислот, а, также, серной и азотной.
-Арилалкиламины - атенолол и др.
Норадреналина гидротартрат
Э=1 Моль
R-NH 2
CH(OH)COOH
лед CH 3COOH
CH(OH)COOH
-CH(OH)COOH
+HClO 4
CH(OH)COOH
(Слабая кислота)
..
R-NH2 HClO4
8.
1.2. Метод КОТ для солей орг. оснований с HГаl ктами – добавляют Hg(CH3COO)2 для их связывания1. Арилалкиламины (изадрин, адреналина г/хл и др.)
А)
Сумарное уравнение:
лед. СH3COOH
2R-NH-R’•HCI+2HCIO4 +Hg(CH3COO)2 →
→2R-NH-R’∙HCIO4 + HgCI2
1ст. Протонизация основания и связывание HCI
2R-NH-R’•HCI+2CH3COOH +Hg(CH3COO)2 → (+)
→2(R-NH-R’) + HgCI2
\H
2 ст. Протонизация растворителя хлорной кислотой
HCIO4 + CH3COOH → CIO4 ¯ + (CH3COOH2)+
3 ст. Образование перхлората основания
( R-NH2-R’)+ + CIO4¯→ R-NH-R’∙HCIO4
4 ст. (CH3COOH2)+ + CH3COO¯ → 2CH3COOH
Б) ЛВ – производные ПАБК (новокаин, дикаин и др.), димедрол
9.
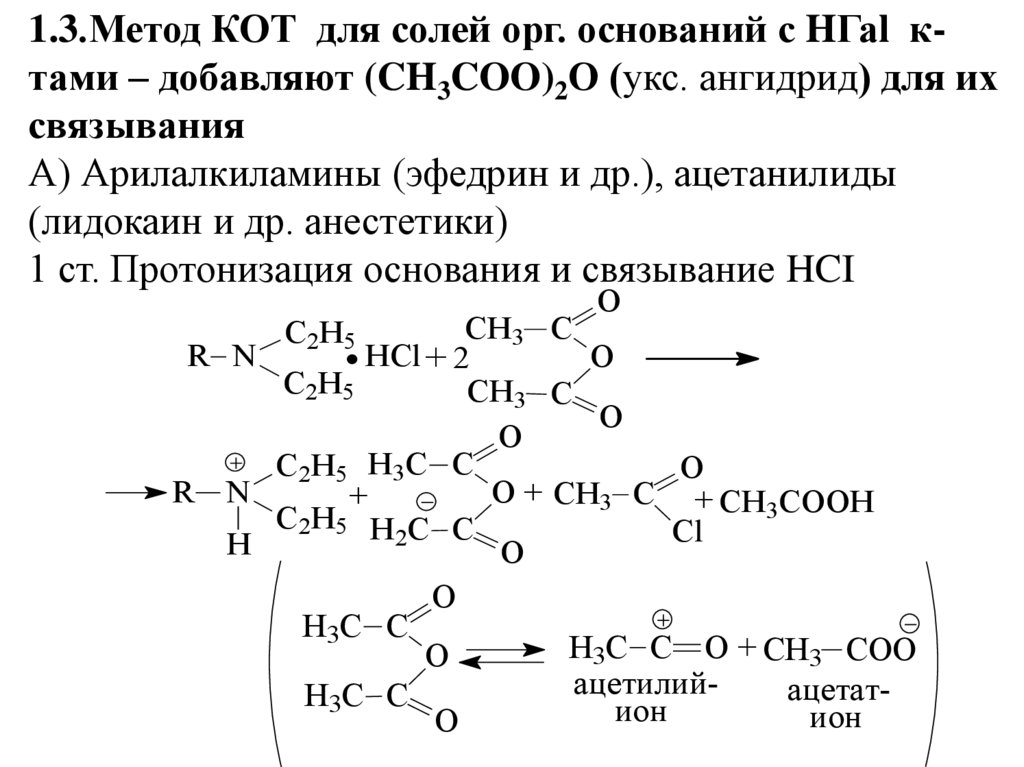
1.3.Метод КОТ для солей орг. оснований с HГаl ктами – добавляют (CH3COO)2О (укс. ангидрид) для ихсвязывания
А) Арилалкиламины (эфедрин и др.), ацетанилиды
(лидокаин и др. анестетики)
1 ст. Протонизация основания и связывание HCI
O
CH3 C
R N
HCl + 2
O
C 2H 5
CH3 C
O
O
C 2H 5 H 3 C C
O
R N
O + CH3 C + CH3COOH
+
C 2H 5 H C C
Cl
2
H
O
C 2H 5
H3C C
H3C C
O
O
O
H3C C O + CH3 COO
ацетилийацетатион
ион
10.
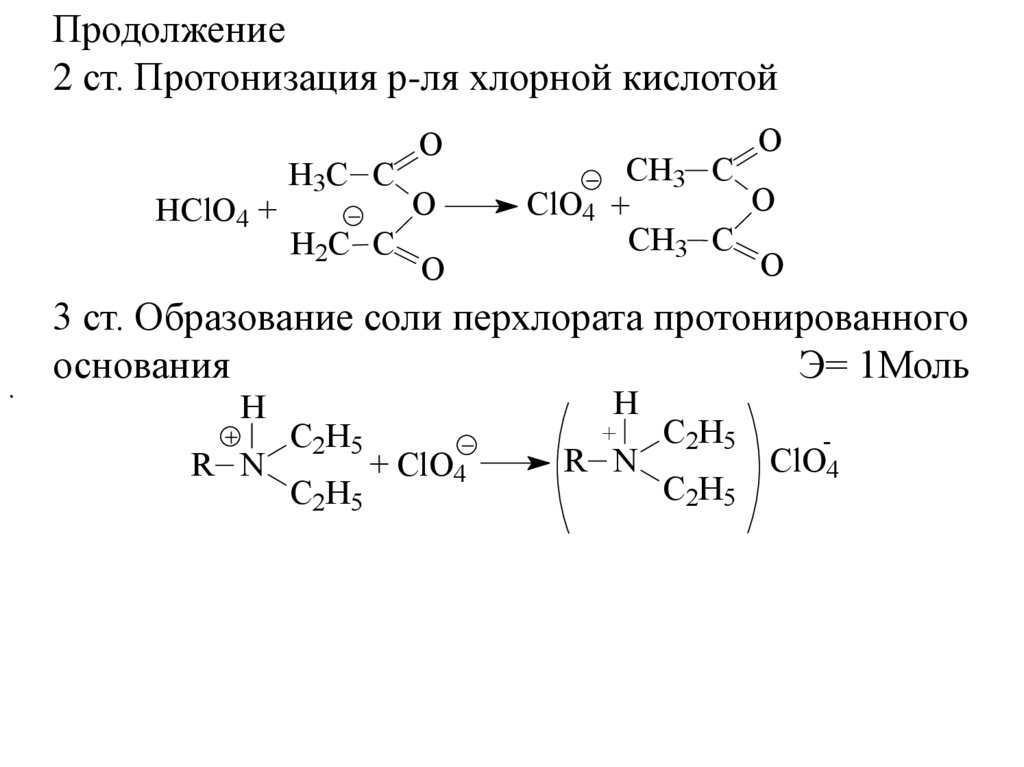
Продолжение2 ст. Протонизация р-ля хлорной кислотой
HClO4 +
.
H3C C
H2C C
O
O
O
O
CH3 C
O
ClO4 +
CH3 C
O
3 ст. Образование соли перхлората протонированного
основания
Э= 1Моль
H
R N
C2H5
C2H5
H
+ ClO4
+
R N
C2H5
C2H5
ClO4
11.
1.4. Метод КОТ в неводной среде протогенногорастворителя, вариант обратного титрования
А) Аминокислоты арилалкиламинов
(левопа, -метилдофа)
+
R NH3 + CH3COO
1ст. R NH2 + CH3COOH
ледяная
протонированное
основание
2 ст. HClO4 + CH3COOH
ClO4- + CH3COOH2+
ледяная
+
3 ст. R NH3 + ClO4
-
ион ацилония
+
-перхлорат
ClO
R NH3
4
протониров.
основания
4 ст. CH3COO- + CH3COOH2+
2CH3COOH
5 ст. ClO4- + CH3COOH2+ + CH COONa
3
титруют
избыток
титров. р-ра
NaClO4 + 2CH3COOH
Э = 1Моль
12.
2. Метод КОТ в неводной средепротофильного растворителя ДМФА
А) Аминокислоты алифатического ряда (глютаминовая к+
та, пеницилламин
и др.), Э= 1Моль
R CH COO
+
NH3
+
H 3C
O
N C
H 3C
R CH COONH2
+ CH3ONa
NH2
+
H 3C
OH
N C
H
H 3C
R CH COONa
NH2
+ CH3O
-
+
OH
N C
+ CH3OH
H3C
H3C
H
R CH COO-
CH3OH +
H3C
H3C
O
N C
H
ДМФА
R CH COOH
R CH COONa
+
CH3OH
+ CH3ONa
NH2
NH2
13.
Б) Сульфониламиды (фталазол, сульфален и др. СА,гипотиазид и др.)
Сумарное уравнение: фталазол
O
S
R
O
NH
C
NH
ДМФА
- 2 С H OH
3
+ 2 C H 3O N a
O
O
С
COOH
O
NH
СOONa
S
N
R
ONa
Э = 1/2 Моль (фталазола, салазопиридазина)
Э = 1 Моль для остальных ЛВ (титрование по сульфамидой группе)
14.
ПродолжениеN
O
С NH
1ст.
SO2NH
+
S
O
2
C
H
CH3
N
CH3
СOOH
O
С NH
O
S N
O-
СOO2ст.
N
O
S
N
O-
СO NH
S
N
S
CH3
HO+
+
C N
2H
CH3
протонированный
ДМФА
+ 2CH3ONa
метилат натрия
СOOO
S
N
ONa
СO NH
N
+
S
2CH3O
метилат ион
СOONa
HO+
3ст. 2
C
H
N
CH3
CH3
+
2СH3O
-
O
2
H
C
N
CH3
CH3
+
2СH3OH
15.
МЕТОД ПЕРМАНГАНАТОМЕТРИИ(метод окислительно-восстановительного титрования)
1. Вариант прямого титрования
А) Препараты пероксида водорода (р-р перекиси водорода,
гидроперит, перекись магния)
5H2O2 +2KMnO4 + 3H2 SO4
5O2 +2MnSO4 + K2SO4 + 8H2O
Эквивалент H2O2 = 1/2 Моль H2O2 , т. к. при окислении одного Моль
пероксид иона до кислорода теряется 2 электрона.
Б) Препараты железа (II) сульфат, кальция лактат
2. Вариант обратного титрования
А) Натрия нитрит Э=1/2 Моль (N+3 - 2e →N+5)
5NaNO2 + 2KMnO4 + 3H2SO4
2KMnO4 + 10KI + 8H2SO4
I2 + 2Na2S2O3
5NaNO3 + 2MnSO4 + K2SO4 +3H2O
5I2 + 6K2SO4 + 2MnSO4 + 8H2O
2NaI + Na2S4O6










 chemistry
chemistry








