Similar presentations:
Комплексные соединения
1. Лекция №5 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
2.
• Комплексное соединение - сложноесоединение, образующееся при
взаимодействии более простых
структурных частиц (атомов, ионов
или молекул), каждая из которых
способна существовать независимо
в обычных условиях.
3. [Cu(NH3)4]SO4
CuSO4NH3
Na[Al(OH)4]
NaOH
Al(OH)3
4.
Комплексными соединениями,или просто комплексами,
называют соединения,
имеющие в своем составе
комплексные ионы.
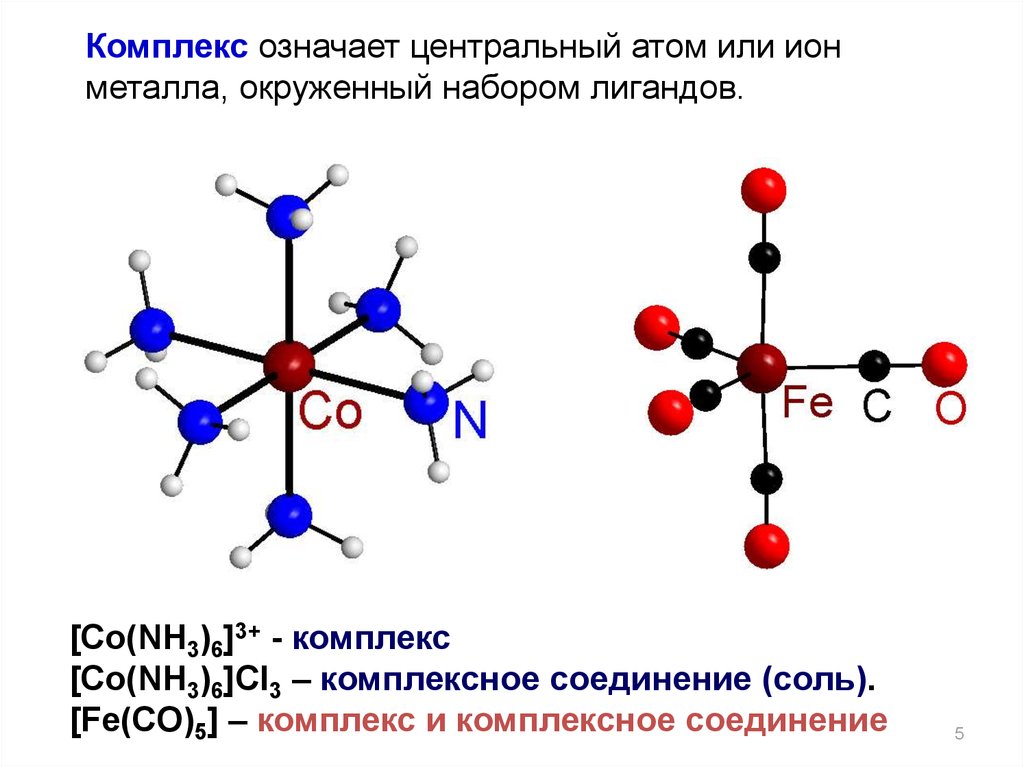
5.
Комплекс означает центральный атом или ионметалла, окруженный набором лигандов.
[Co(NH3)6]3+ - комплекс
[Co(NH3)6]Cl3 – комплексное соединение (соль).
[Fe(CO)5] – комплекс и комплексное соединение
5
6. Основные положения координационной теории
1Комплексообразователь
(центральный катион) - катион
металла, который обладает
вакантными орбиталями.
Катионы:
металлов (d-элементов):
Сu+2, Co+3, Fe+3, Hg+2 и др.
(реже р-элементы): Al+3
(иногда неметаллы):В+3, Si+4.
+ +3
K3 [Fe(CN)6]
7. Основные положения координационной теории
2.Вокруг комплексообразователя расположены
лиганды – частицы, обладающие
неподеленными электронными парами.
Молекулы:
.. ..
H2O,
.. NH3,
Анионы:
CN-, OH-, Cl-, Br-, NO2-
8. Основные положения координационной теории
3.Координационное число – количество
лигандов, которые может присоединять
комплексообразователь.
Координационное число – обычно в 2 раза
больше, чем С.О. центрального иона.
+1
+2
+3
+4
(2)
(4, 6)
(6, 4)
(8, 6)
+2
[Cu(NH3)4]+2
9. Основные положения координационной теории
4.Комплексообразователь и лиганды
составляют внутреннюю сферу
комплекса.
[Cu(NH3)4
+2
]
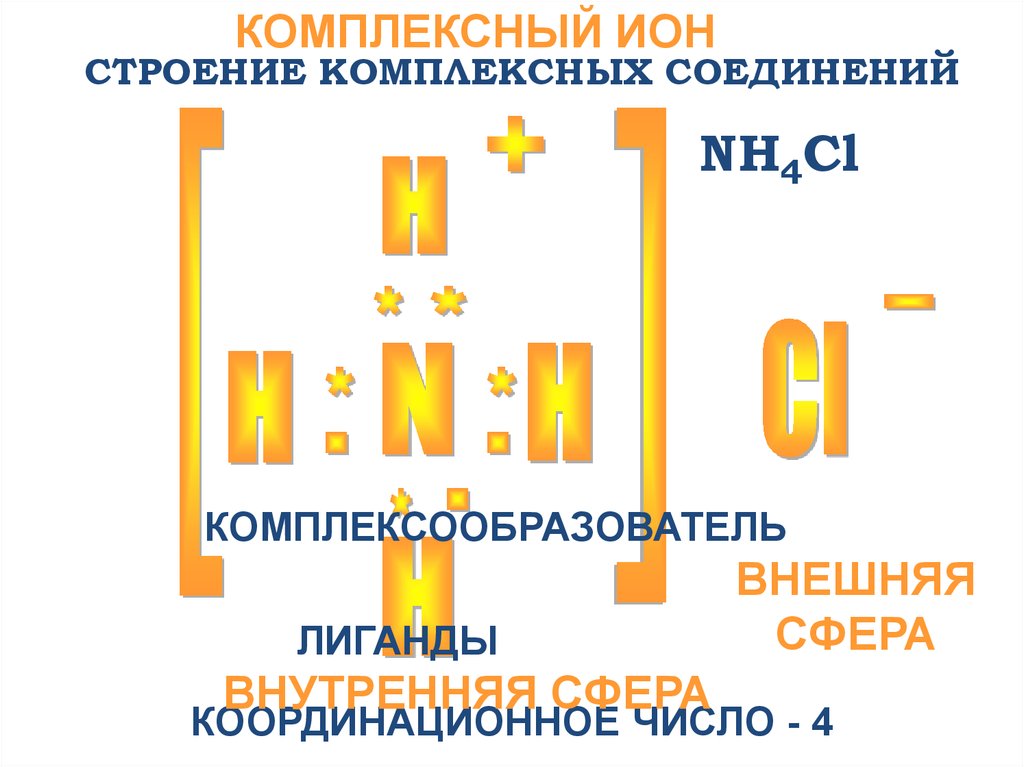
10.
КОМПЛЕКСНЫЙ ИОНСТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
NH4Cl
КОМПЛЕКСООБРАЗОВАТЕЛЬ
ЛИГАНДЫ
ВНУТРЕННЯЯ СФЕРА
ВНЕШНЯЯ
СФЕРА
КООРДИНАЦИОННОЕ ЧИСЛО - 4
11.
-3+1
-1
[N H 4]Cl
ВНУТРЕННЯЯ СФЕРА:
+
]
[NH
КОМПЛЕКСНЫЙ ИОН
4
-3
КОМПЛЕКСООБРАЗОВАТЕЛЬ N
+
ЛИГАНДЫ H
ВНЕШНЯЯ СФЕРА
АНИОН Cl-
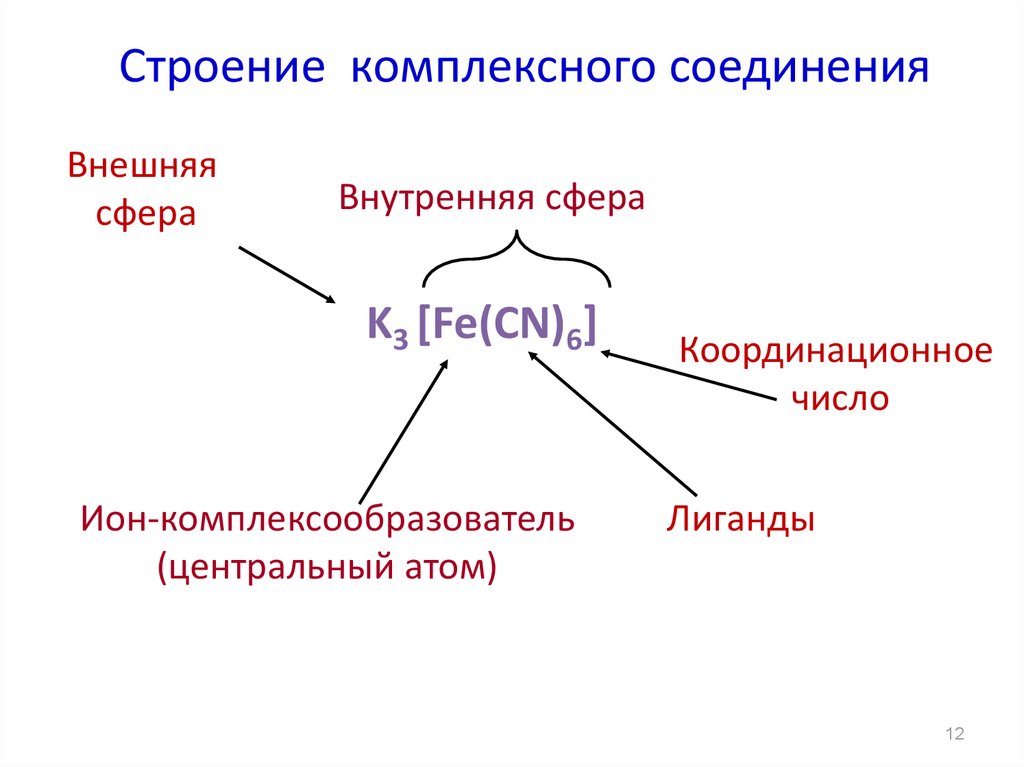
12. Строение комплексного соединения
Внешняясфера
Внутренняя сфера
K3 [Fe(CN)6]
Ион-комплексообразователь
(центральный атом)
Координационное
число
Лиганды
12
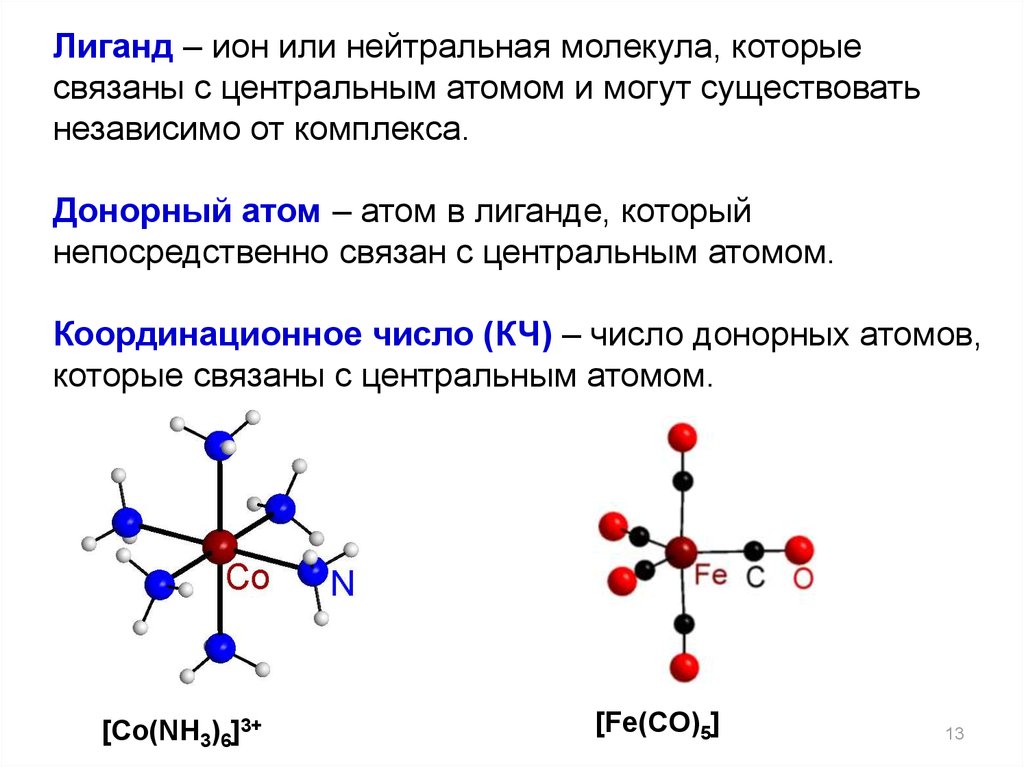
13.
Лиганд – ион или нейтральная молекула, которыесвязаны с центральным атомом и могут существовать
независимо от комплекса.
Донорный атом – атом в лиганде, который
непосредственно связан с центральным атомом.
Координационное число (КЧ) – число донорных атомов,
которые связаны с центральным атомом.
[Co(NH3)6]3+
[Fe(CO)5]
13
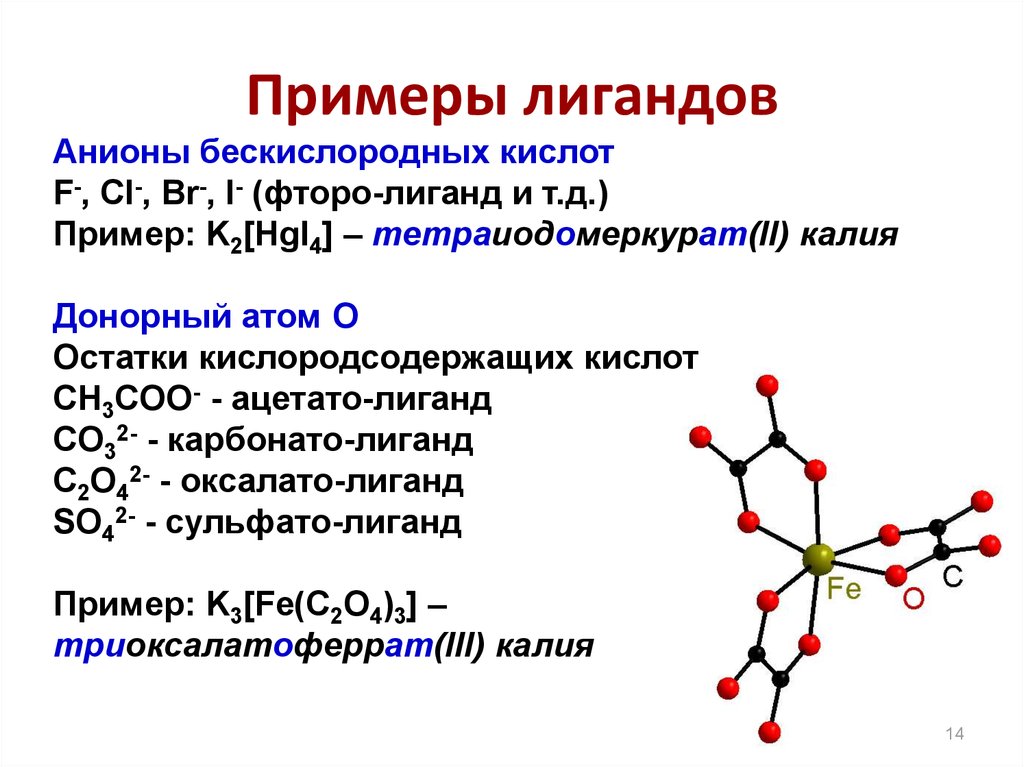
14. Примеры лигандов
Анионы бескислородных кислотF-, Cl-, Br-, I- (фторо-лиганд и т.д.)
Пример: K2[HgI4] – тетраиодомеркурат(II) калия
Донорный атом O
Остатки кислородсодержащих кислот
CH3COO- - ацетато-лиганд
CO32- - карбонато-лиганд
C2O42- - оксалато-лиганд
SO42- - сульфато-лиганд
Пример: K3[Fe(C2O4)3] –
триоксалатоферрат(III) калия
14
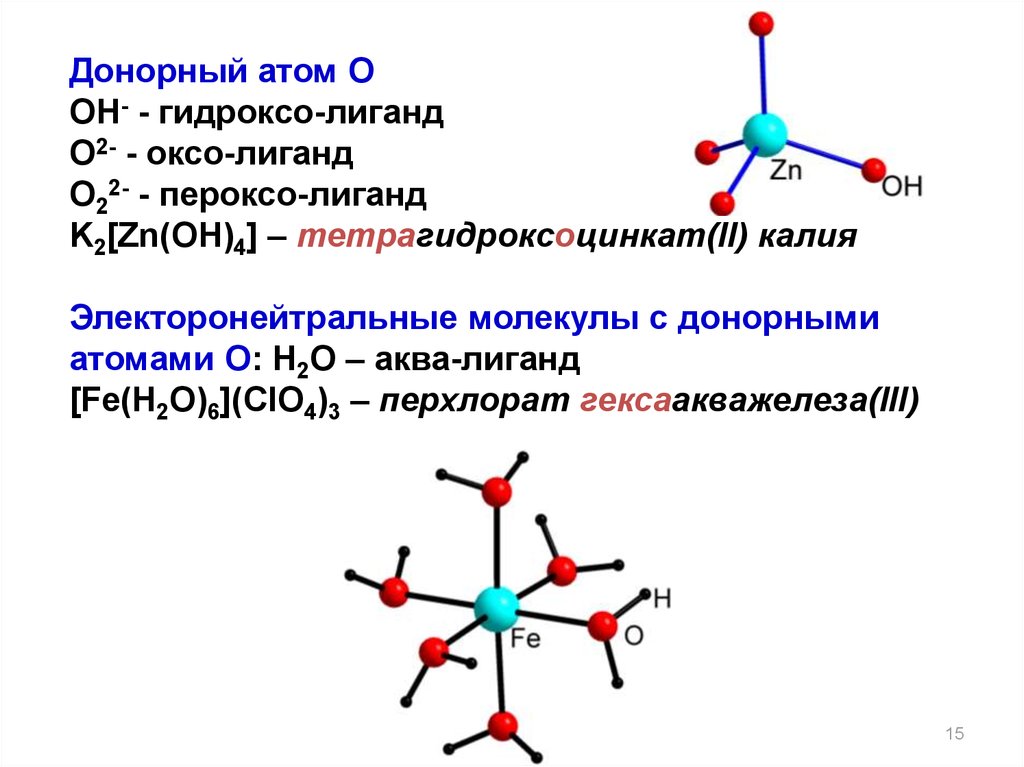
15.
Донорный атом OOH- - гидроксо-лиганд
O2- - оксо-лиганд
O22- - пероксо-лиганд
K2[Zn(OH)4] – тетрагидроксоцинкат(II) калия
Электоронейтральные молекулы с донорными
атомами O: H2O – аква-лиганд
[Fe(H2O)6](ClO4)3 – перхлорат гексаакважелеза(III)
15
16.
Na+2 [Zn+x (OH)-4 ](+1) ·2 + x + (-1) ·4 = 0
x = 0-2+4
x = +2
Na2+[Zn+2(OH)-4]
17.
РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНАКОМПЛЕКСООБРАЗОВАТЕЛЯ:
Na3[AlF6]
Ответ: Na+3[Al+3F-6]
K[MgCl3]
Ответ: K+[Mg+2Cl-3]
Na[Al(OH)4] Ответ: Na+[Al+3(OH)-4]
Na4[Fe(CN)6] Ответ:Na+4[Fe+2(CN)-6]
Na3[Al(OH)6] Ответ:Na+3[Al+3(OH)-6]
[Cu(NH3)4]Cl2 Ответ:[Cu+2(NH3)04]Cl-2
18. Строение комплексных соединений
Координационные соединения образованыметаллами побочных подгрупп, имеющими, как
правило, незавершенный d - уровень.
Образование комплексного иона можно
объяснить наличием у катионов d-металлов
вакантных орбиталей на
s-, p-, d- и f- подуровнях, которые принимают
участие в донорно-акцепторном механизме
образования связей в комплексных соединениях.
Co0
Co3+
4s
3d
4р
4s
3d
4р
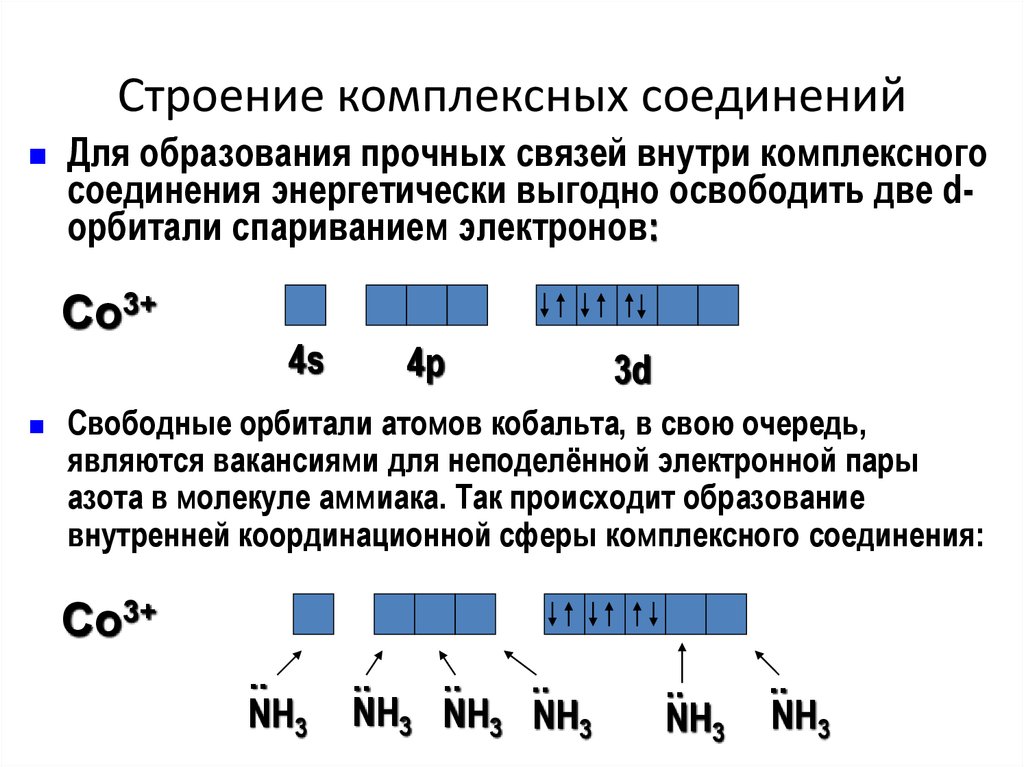
19. Строение комплексных соединений
Для образования прочных связей внутри комплексногосоединения энергетически выгодно освободить две dорбитали спариванием электронов:
Co3+
4s
4р
3d
Свободные орбитали атомов кобальта, в свою очередь,
являются вакансиями для неподелённой электронной пары
азота в молекуле аммиака. Так происходит образование
внутренней координационной сферы комплексного соединения:
Co3+
..
NH3
..
..
..
NH3 NH3 NH3
..
NH3
..
NH3
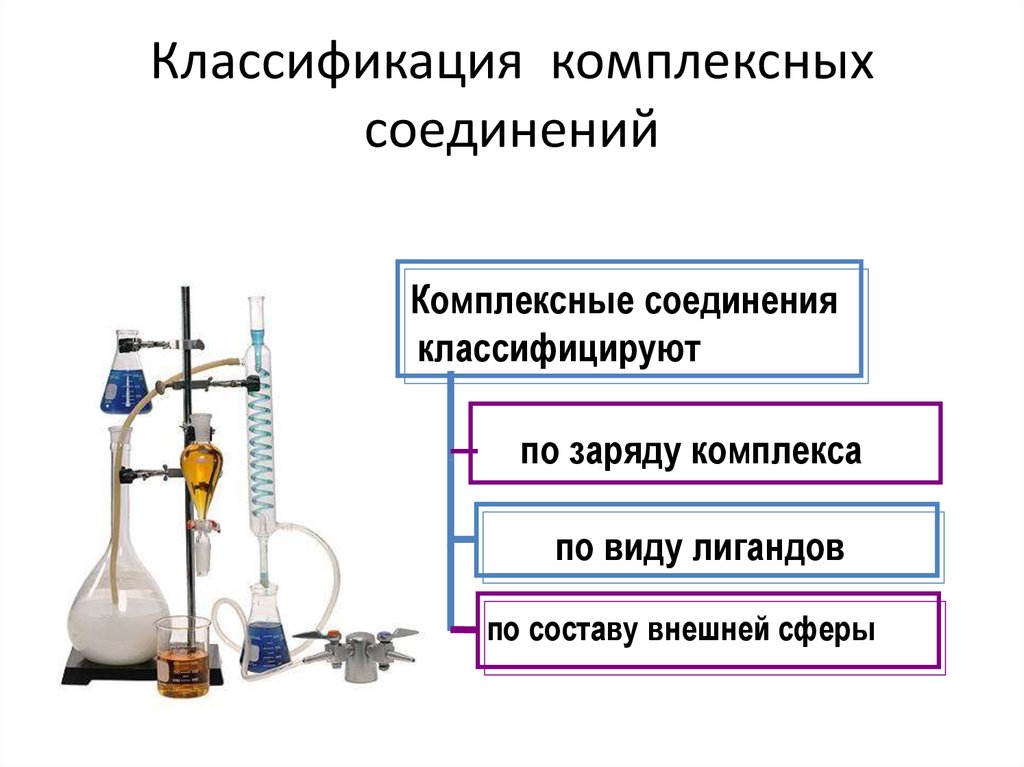
20. Классификация комплексных соединений
Комплексные соединенияклассифицируют
по заряду комплекса
по виду лигандов
по составу внешней сферы
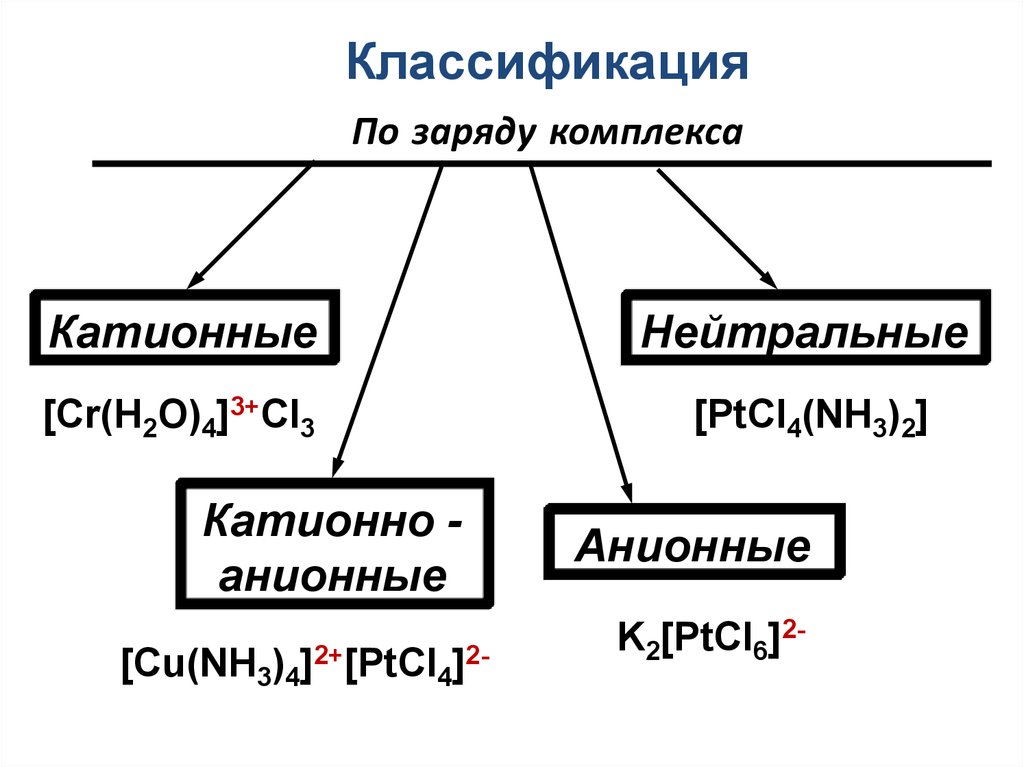
21. Классификация По заряду комплекса
КатионныеНейтральные
[Cr(H2O)4]3+Cl3
[PtCl4(NH3)2]
Катионно анионные
[Cu(NH3)4]2+[PtCl4]2-
Анионные
K2[PtCl6]2-
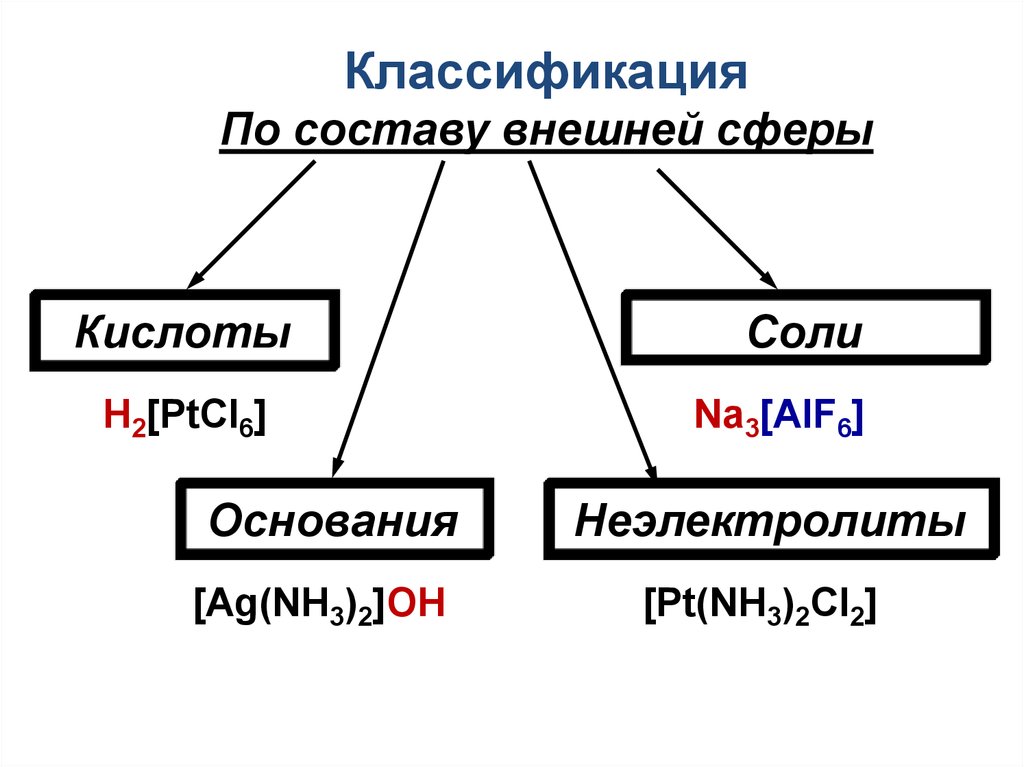
22.
КлассификацияПо составу внешней сферы
Кислоты
H2[PtCl6]
Основания
[Ag(NH3)2]OH
Соли
Na3[AlF6]
Неэлектролиты
[Pt(NH3)2Cl2]
23.
КлассификацияПо виду лигандов
Аквакомплексные
[Fe(H2O)6]SO4
Смешанные
[CoCl(NH3)3(H2O)2](NO3)2
Ацидокомплексные
K[Au(CN)4]
Аминокомплексные
[Zn(NH3)4]Cl2
24.
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙЧИСЛИТЕЛЬНЫЕ:
23456-
дитритетрапентагекса-
НАЗВАНИЯ ЛИГАНДОВ:
H2O - аква
NH3 - амин
СO - карбонил
OН- - гидроксо(СN)- - циано
(NO3)- - нитро
F-, Cl-, Br-, I- - фторо-, хлоро-,
бромо-, йодо-
25.
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙНАЗВАНИЯ АНИОНОВ:
Fe - феррат
Cu - купрат
Ag - аргентат
Au - аурат
Hg - меркурат
Zn - цинкат
Al - алюминат
От латинского названия
комплексообразователя с
добавлением суффикса
-ат
26.
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙNa+2[Zn+2 (OH)-4]
тетра гидроксо цинкат натрия
[Cr+3(H2O)06] Cl-3
хлорид
гексааква xрома (III)
K+2 [Hg+2 I- 4]
тетрайодомеркурат (II) калия
27.
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]
Гексафтороалюминат натрия
Na[Al(OH)4]
Тетрагидроксоалюминат натрия
K4[Fe(CN)6]
Гексационоферрат (II) калия
28.
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4
Сульфат тетраамминмеди (II)
[Ag(NH3)2]Cl
Хлорид диамминсеребра
[Cr(H2O)6]Cl3
Хлорид гексааквахрома (III)
29.
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВГексахлороплатинат (IV) калия
Ответ: K2[PtCl6]
Нитрат хлоронитротетраамминкобальта (III)
Ответ: [Co(NH3)4(NO3)Cl]NO3
Гексагидроксохромат (III) натрия
Ответ: Na3[Cr(OH)6]
Нитрат гексаамминникеля (II)
Ответ: [Ni(NH3)6](NO3)2
30.
ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙЛабораторный опыт.
Получение тетрагидроксоалюмината натрия
AlCl3+3NaOH = Al(OH)3↓+3NaCl
Al(OH)3 + NaOH = Na[Al(OH)4]
Лабораторный опыт.
Получение гидроксида тетраамминмеди (II)
CuCl2+2NH3 +2H2O = Cu(OH)2↓+NH4Cl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
31. Химические свойства комплексных соединений
• 1. В растворе комплексные соединенияведут себя как сильные электролиты, т.е.
полностью диссоциируют на катионы и
анионы.
[Pt(NH3)4]Cl2 = [Pt(NH3)4] 2+ + 2Cl –,
K2[PtCl4] = 2K+ + [PtCl4] 2–
[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42-
32. ХИМИЧЕСКИЕ СВОЙСТВА
2. Реакции по внешней сфереFeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl
[Cu(NH3)4]SO4+BaCl2→
→[Cu(NH3)4]Cl2+BaSO4↓
33. ХИМИЧЕСКИЕ СВОЙСТВА
3. Реакции с участием лигандов[Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4
4. Реакции по центральному иону
Обменные:
[Ag(NH3)2]Cl + KI → AgI↓ + KCl + 2NH3
Окислительно-восстановительные:
2[Ag(NH3)2]OH+R-C=O
H
→2Ag↓+RCOONH4+H2O+3NH3
34.
• 5. Нагревание (термолиз) всехаммиакатов приводит к их
разложению, например:
[Cu(NH3) 4]SO4 = CuSO4 + 4NH3 .
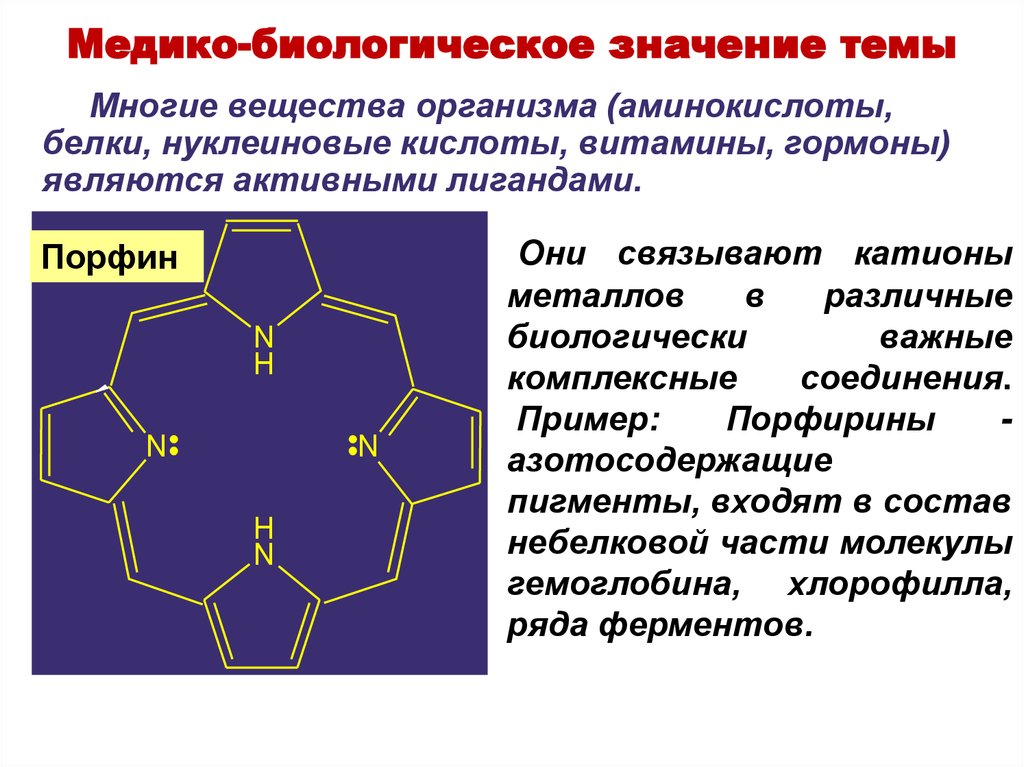
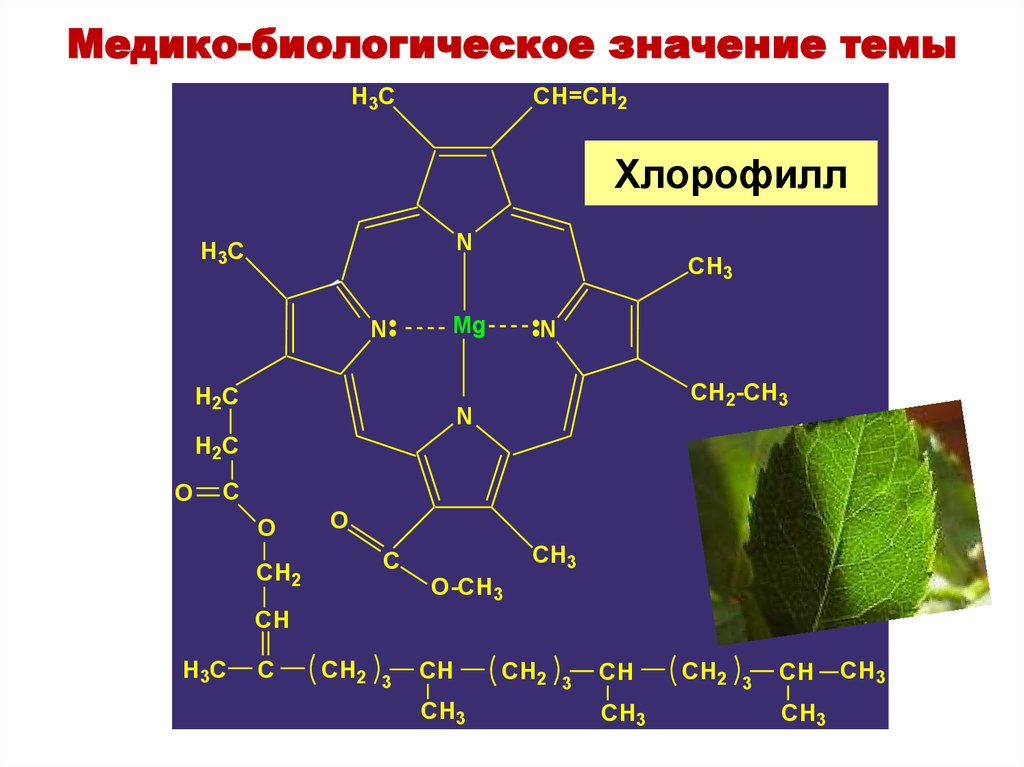
35. Они связывают катионы металлов в различные биологически важные комплексные соединения. Пример: Порфирины - азотосодержащие
Медико-биологическое значение темыМногие вещества организма (аминокислоты,
белки, нуклеиновые кислоты, витамины, гормоны)
являются активными лигандами.
Порфин
N
H
N
N
H
N
Они связывают катионы
металлов
в
различные
биологически
важные
комплексные
соединения.
Пример:
Порфирины
азотосодержащие
пигменты, входят в состав
небелковой части молекулы
гемоглобина, хлорофилла,
ряда ферментов.
36. Хлорофилл
Медико-биологическое значение темыH3C
CH=CH2
Хлорофилл
N
H3C
CH3
N
Mg
H2C
N
CH2-CH3
N
H2C
O
C
O
O
CH3
C
CH2
O-CH3
CH
H3C
C
CH2
3
CH
CH3
CH2
3
CH
CH3
CH2
3
CH
CH3
CH3
37.
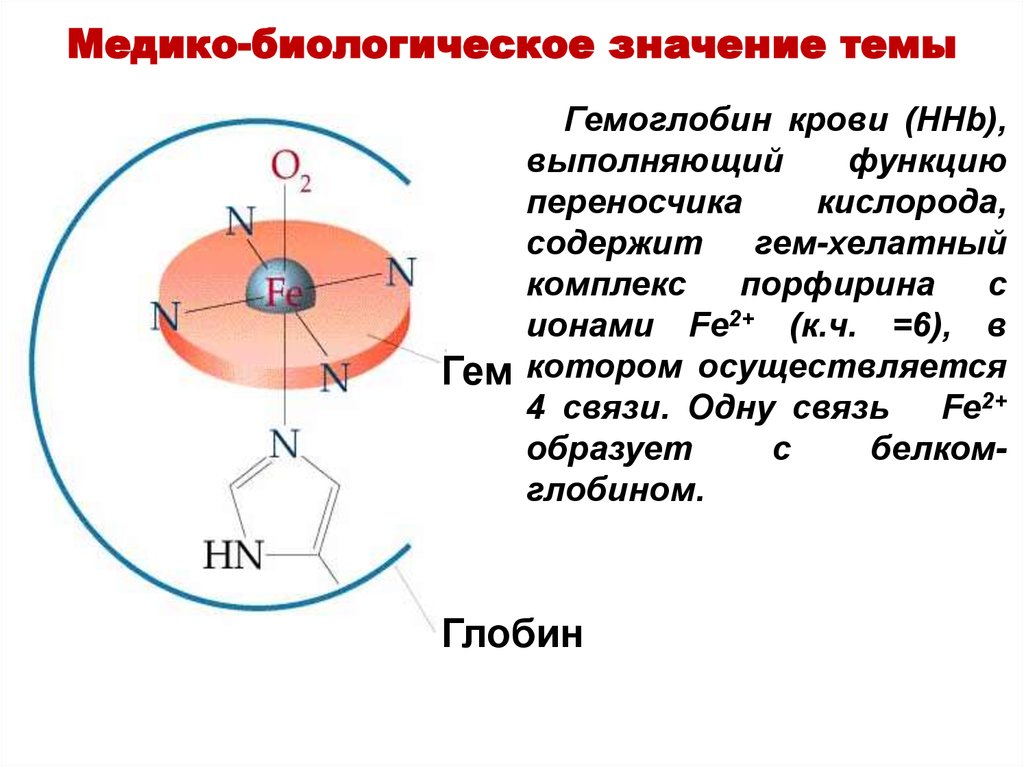
Медико-биологическое значение темыГемоглобин крови (HHb),
выполняющий
функцию
переносчика
кислорода,
содержит
гем-хелатный
комплекс
порфирина
с
ионами Fe2+ (к.ч. =6), в
Гем котором осуществляется
4 связи. Одну связь
Fe2+
образует
с
белкомглобином.
Глобин
38.
Медико-биологическое значение темыВ легких, где парциальное
давление O2 высоко, он
присоединяется к Fe(II) на
шестую координационную
связь, а в тканях, из-за
снижения парциального
давления, кислород
освобождается.
HHb + O2
Гемоглобин
HHbO2
оксигемоглобин
39.
Медико-биологическое значение темыВ условиях патологии лигандами могут быть
другие вещества - например угарный газ (CO).
Он образует с гемоглобином хелатный комплекс
в 300 раз более устойчивый, чем с кислородом.
Этим объясняется токсическое действие
угарного газа на организм.
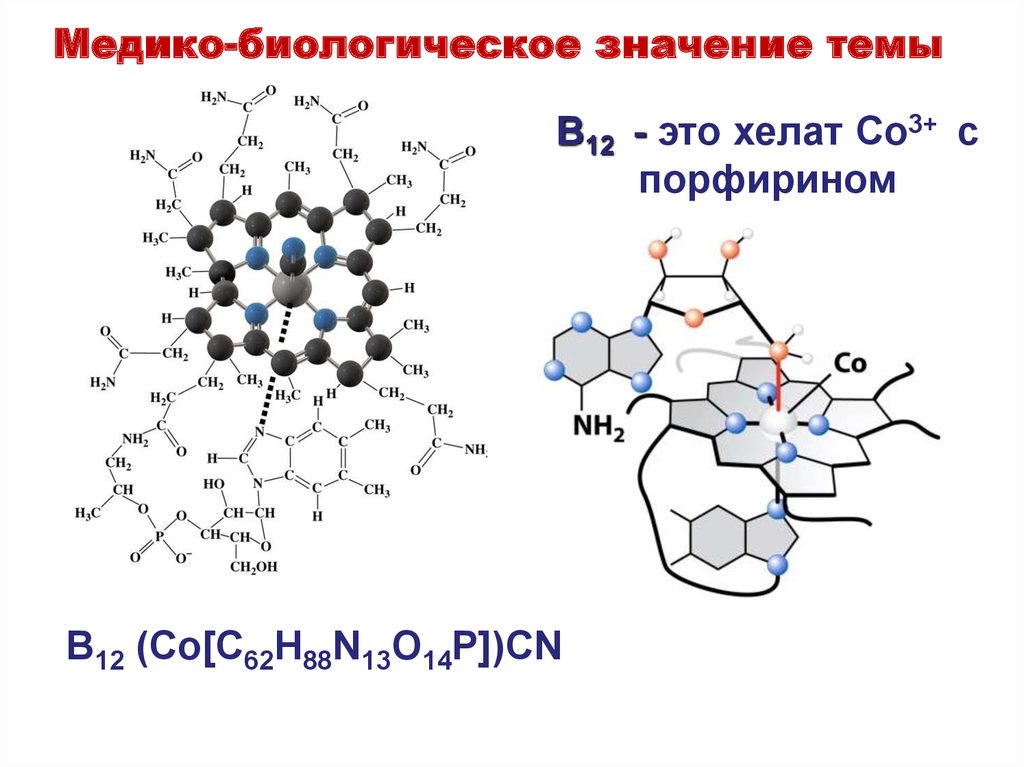
40. B12 - это хелат Co3+ c порфирином
Медико-биологическое значение темыB12 - это хелат Co3+ c
порфирином
B12 (Co[C62H88N13O14P])CN
41.
Медико-биологическое значение темыМеталлоферменты - это комплексы металлов с
белками.
Цитохром с в своей структуре
содержит гем, является
компонентом дыхательной цепи
митохондрий.
42. Гормон инсулин - хелат Zn2+ c белком.
Медико-биологическое значение темыГормон инсулин - хелат Zn2+ c белком.
43.
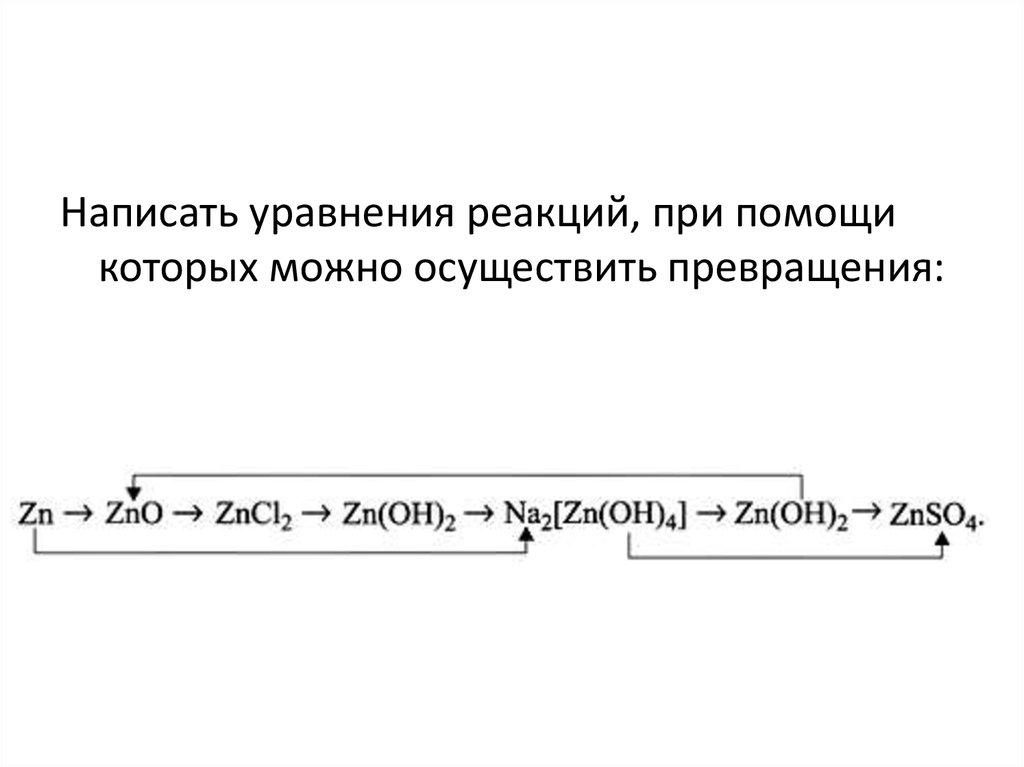
Написать уравнения реакций, при помощикоторых можно осуществить превращения:
44.
Хелаты. КомплексоныЛиганды могут присоединяться к
комплексообразователю посредством
одного или нескольких атомов, т.е.
лиганды обладают
координационной емкостью дентатностью.
Монодентатные лиганды присоединяются
к комплексообразователю одним атомом и
образуют одну координационную связь.
Например: H2O, NH3, Cl-, CN-, OH- и др.
45. Хелаты. Комплексоны. Краун-эфиры
Полидентатные лиганды присоединяютсяк
комплексообразователю
посредством
нескольких атомов.
Например: функциональные органические
соединения.
Большое практическое значение имеют
комплексоны – полидентатные лиганды,
содержащие несколько
функциональных
групп и образующие прочные комплексы
практически
со
всеми
двухзарядными
ионами металлов (Ca2+, Mg2+, Zn2+, Cu2+,
Pt2+…).
46. Хелаты. Комплексоны. Краун-эфиры
Н-р, комплексон -I:NH2
CH2 CH2
NH2
Этилендиамин
En
содержит два атома азота.
За счет электронных пар этих атомов
этилендиамин
присоединяется
к
комплексообразователю
двумя
координационными связями.
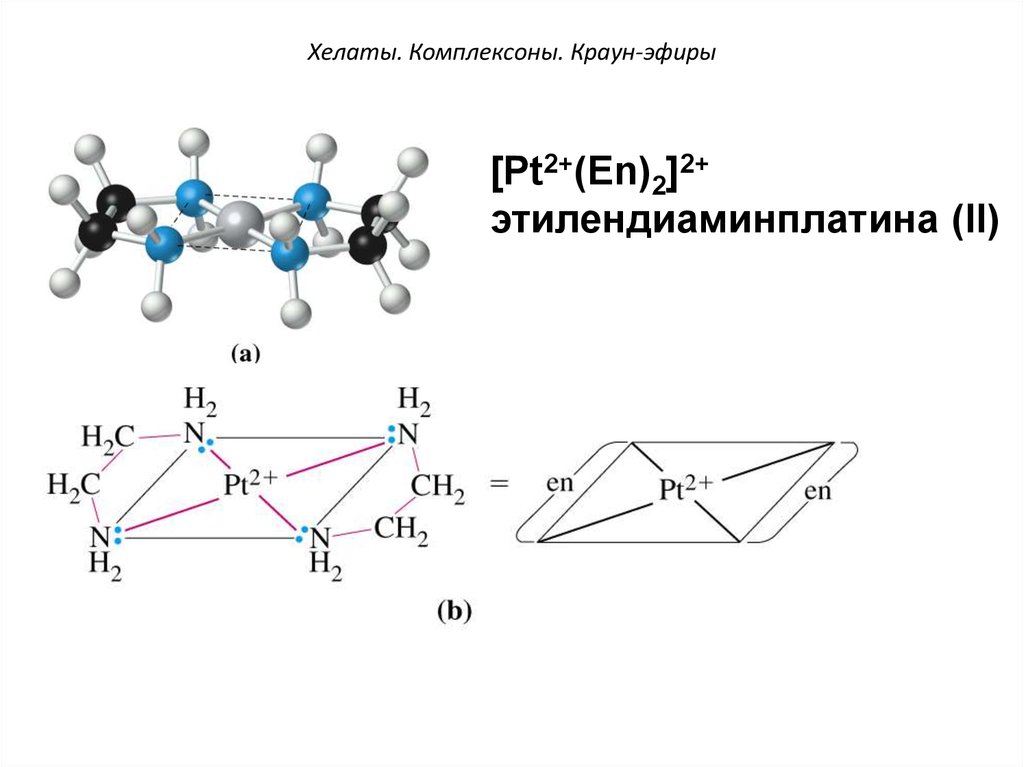
47. Хелаты. Комплексоны. Краун-эфиры
[Pt2+(Еn)2]2+этилендиаминплатина (II)
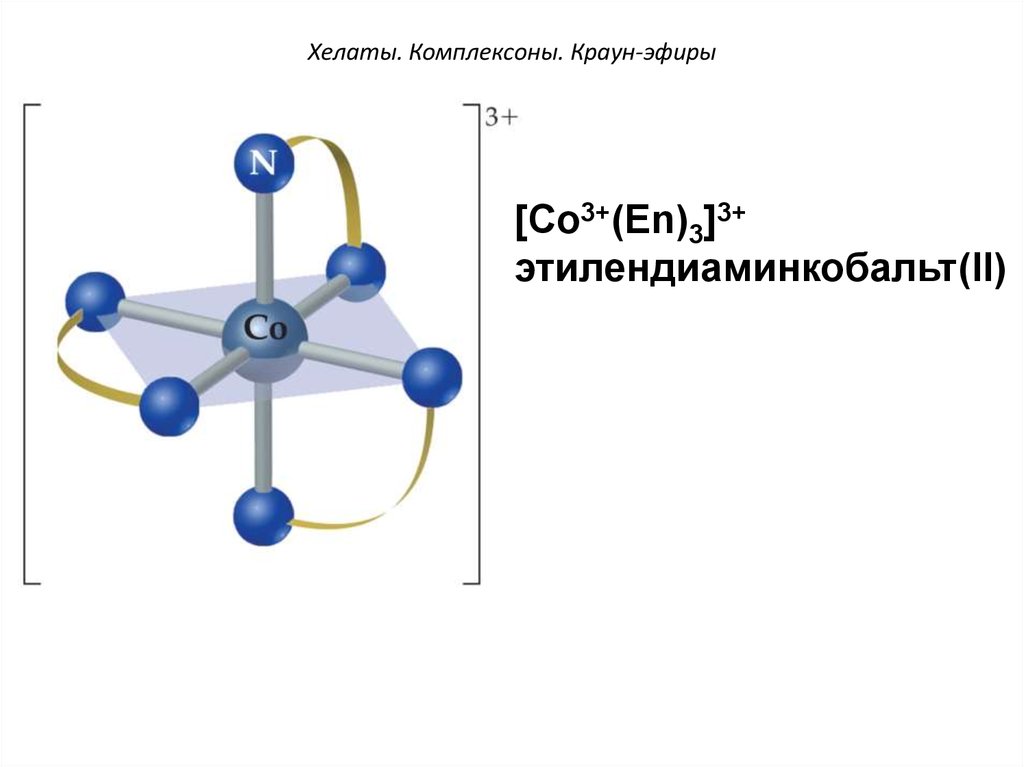
48. Хелаты. Комплексоны. Краун-эфиры
[Co3+(Еn)3]3+этилендиаминкобальт(II)
49. Хелаты. Комплексоны. Краун-эфиры
Для удобства координации молекулыполидентатных лигандов сворачиваются в циклы. В
таких комплексах комплексообразователь зажат
«клешней» лигандов.
Комплексы, содержащие полидентатные
лиганды, называются хелатами (от греч.
chelate - клешня).
Термин «хелат»,
1920 г. Морган и Дрю
Ni2+
50. Хелаты. Комплексоны. Краун-эфиры
H 2CH2 C
OH
OH
H2C
O
H2C
O
H
Cu
H
O
CH2
O CH2
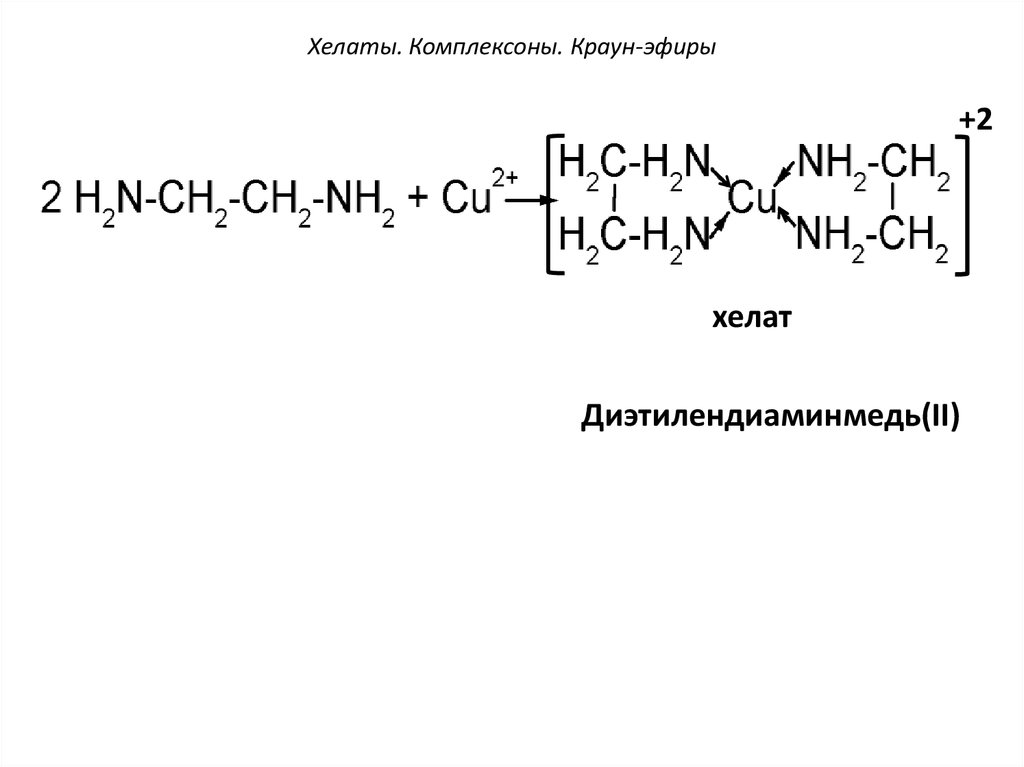
51. Хелаты. Комплексоны. Краун-эфиры
+2хелат
Диэтилендиаминмедь(II)
52. Хелаты. Комплексоны. Краун-эфиры
Обычно хелаты гораздо устойчивеекомплексных соединений, содержащих
монодентатные лиганды, т.к.
комплексообразователь связан с лигандами
несколькими донорно-акцепторными связями.
Наиболее известными комплексонами
высшего порядка являются:
• комплексон -II этилендиаминтетрауксусная
кислота (ЭДТА)
• комплексон- III двузамещенная натриевая
соль ЭДТА - Трилон Б: Na2[H2Tr]
53. Хелаты. Комплексоны. Краун-эфиры
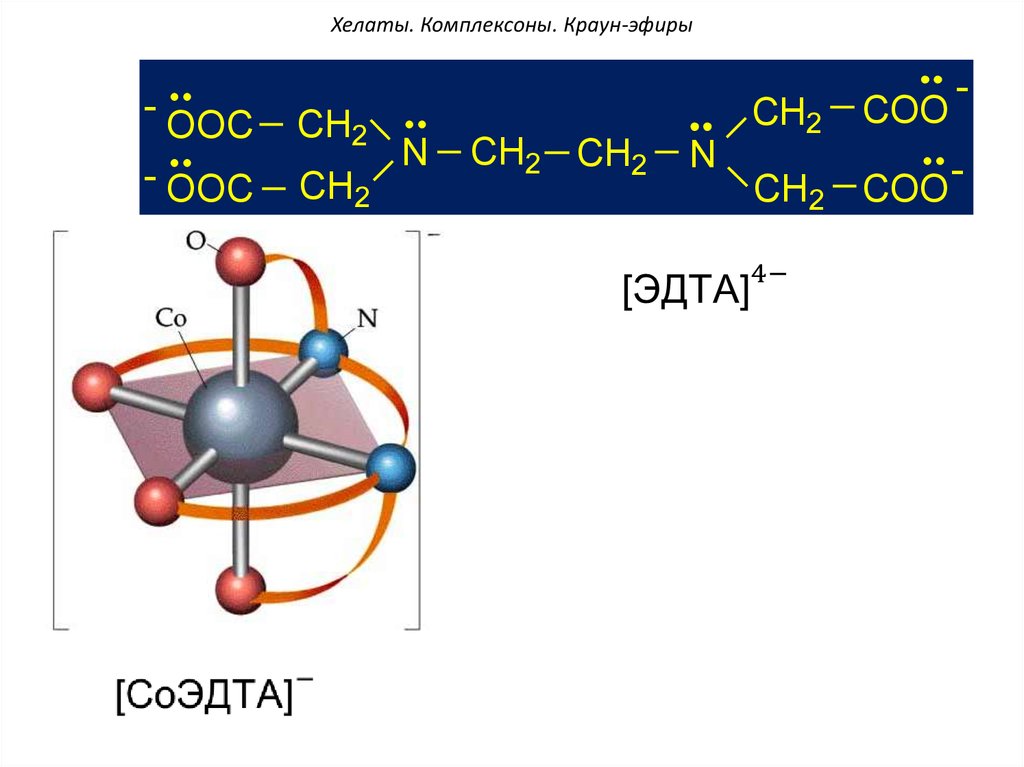
-OOC
CH2
- OOC
CH2
N
CH2 CH2
CH2
N
COO
CH2 COO
-
54. Хелаты. Комплексоны. Краун-эфиры
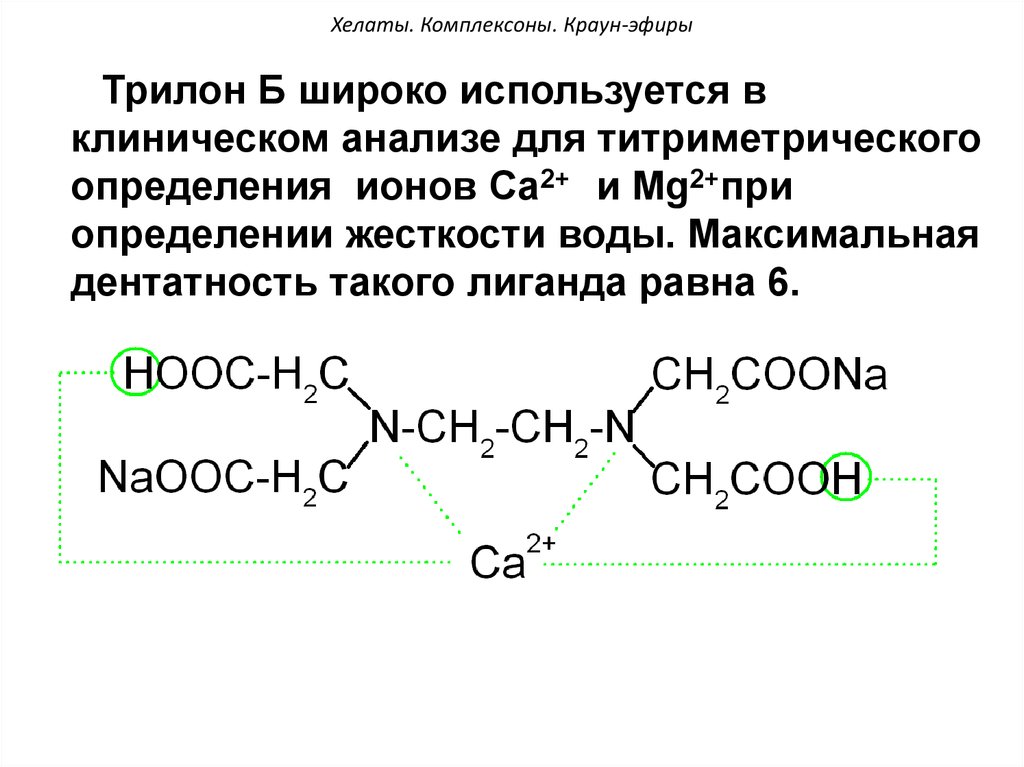
Трилон Б широко используется вклиническом анализе для титриметрического
определения ионов Са2+ и Мg2+при
определении жесткости воды. Максимальная
дентатность такого лиганда равна 6.
55. Хелаты. Комплексоны. Краун-эфиры
Особый тип полидентатных лигандовпредставляет собой циклические эфиры или
краун-эфиры (от анг. crown - корона).
В них донорные атомы кислорода заключены
в плоский цикл определенного размера.
Краун-эфиры содержат от 4 до 12 атомов
кислорода (краун-4, краун-5 и т.д).
Полости краун-эфиров имеют строго
определенные размеры. Поэтому краун-эфиры
могут избирательно связывать ионы металлов,
размеры которых близки к размерам полости.
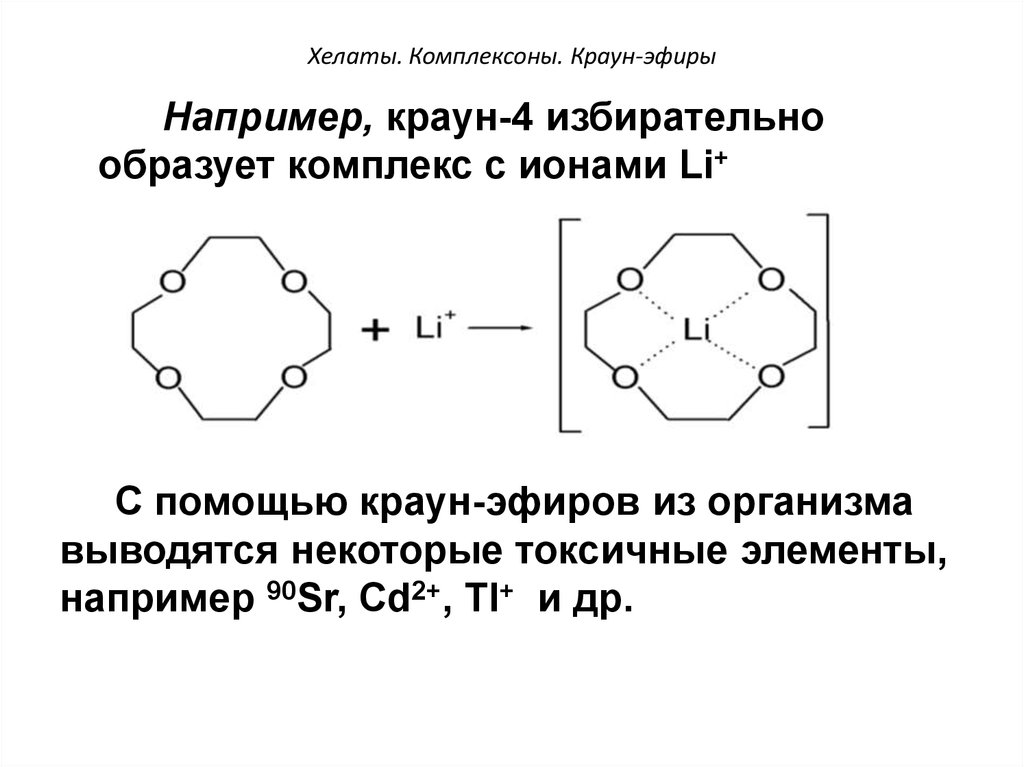
56. Хелаты. Комплексоны. Краун-эфиры
Например, краун-4 избирательнообразует комплекс с ионами Li+
+
С помощью краун-эфиров из организма
выводятся некоторые токсичные элементы,
например 90Sr, Cd2+, Tl+ и др.
57.
СПАСИБО ЗАВАШЕ
ВНИМАНИЕ!


![[Cu(NH3)4]SO4 [Cu(NH3)4]SO4](https://cf.ppt-online.org/files/slide/p/pMILbnjZH4lOG8F6J0fD5crNP9VKxwSCgTvmdX/slide-2.jpg)






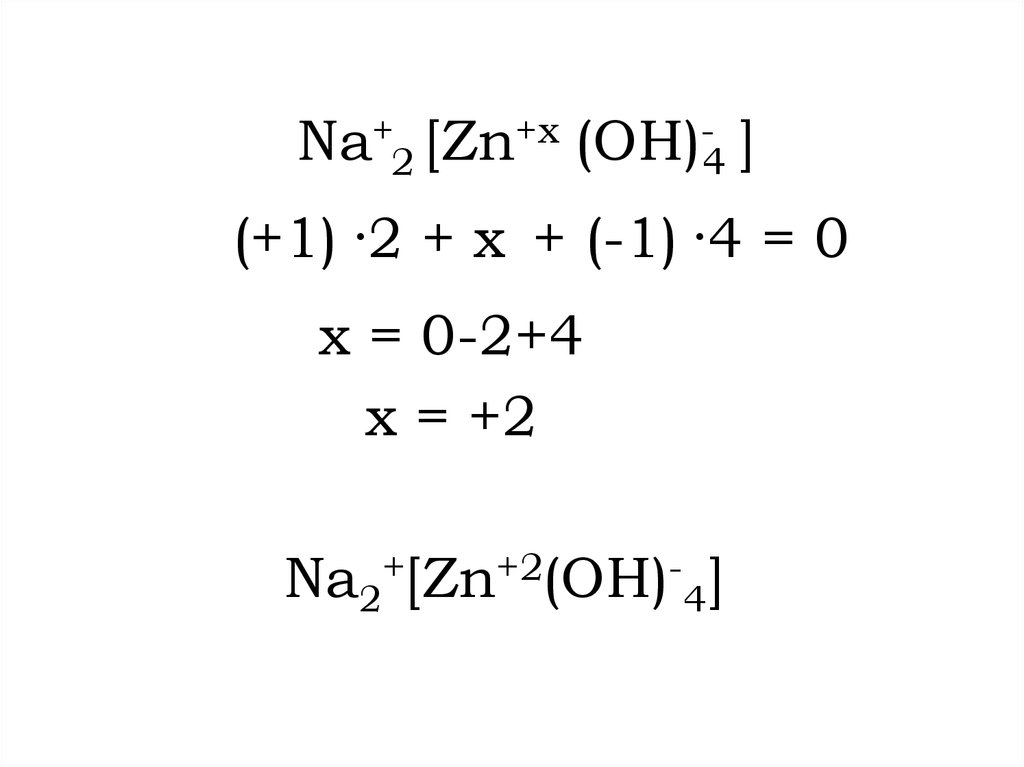

























 chemistry
chemistry








