Similar presentations:
Комплексные соединения
1.
Комплексные соединения• Основные положения координационной теории.
• Типичные комплексообразователи и лиганды.
• Характер химической связи в комплексных
соединениях.
• Диссоциация комплексных соединений в растворах.
• Константа нестойкости.
Лектор: Лобанова Елена Петровна, старший преподаватель
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания о
координационной теории строения,
классификации, номенклатуре, изомерии и
устойчивости комплексных соединений.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний, развить
логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию
у обучающихся устойчивого интереса к изучению
дисциплины.
3.
Медико-биологическое значение темыГемоглобин крови,
выполняющий функцию
переносчика кислорода,
содержит гем-хелатный
комплекс порфирина с
ионами Fe2+ (к.ч. =6), в
Гем котором осуществляется
4 связи. Одну связь Fe2+
образует с белкомглобином.
Глобин
4.
Медико-биологическое значение темыВ легких, где парциальное
давление O2 высоко, он
присоединяется к Fe(II) на
шестую координационную
связь, а в тканях, из-за
снижения парциального
давления, кислород
освобождается.
HHb + O2
Гемоглобин
HHbO2
оксигемоглобин
5.
Медико-биологическое значение темыВ условиях патологии лигандами могут быть
другие вещества - например угарный газ (CO).
Он образует с гемоглобином хелатный
комплекс в 300 раз более устойчивый, чем с
кислородом. Этим объясняется токсическое
действие угарного газа на организм.
6.
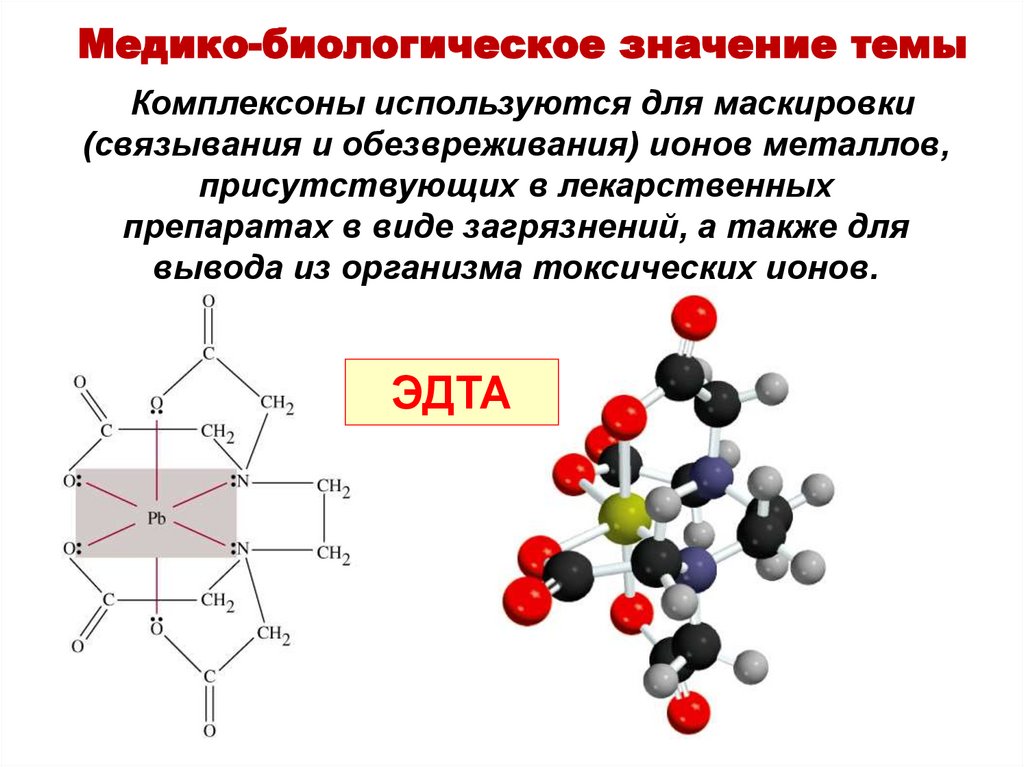
Медико-биологическое значение темыКомплексоны используются для маскировки
(связывания и обезвреживания) ионов металлов,
присутствующих в лекарственных
препаратах в виде загрязнений, а также для
вывода из организма токсических ионов.
ЭДТА
7.
Комплексные(координационные) соединения
Красная
кровяная соль
Медный
купорос
Хромокалиевые
квасцы
называются соединения,
в узлах кристаллической
решетки которых
находятся комплексные
ионы, способные к
самостоятельному
существованию при
переходе соединения в
расплавленное или
растворенное
состояние.
8.
Координационная теорияА. Вернера (1893 г. )
"Меня часто охватывает
экстаз пред красотой моей
науки. Чем дальше я
погружаюсь в ее тайны, тем
более она кажется мне
огромной, величественной,
слишком красивой для
простого смертного."
Альфред
Вернер
(1866-1919),
швейцарский
химик
9.
Координационная теория(1893 г. )
лиганды (от лат. ligare – связывать, соединять)
[ Ag (NH3)2] Cl
внутренняя сфера
комплексообразователь
внешняя сфера
координационное число
10.
Строение комплексных соединений. Классификация. НоменклатураВнутренняя сфера комплекса включает
центральный атом или ионкомплексообразователя, вокруг
которого находятся связанные с ним
лиганды - молекулы или ионы.
При записи формул внутреннюю сферу
выделяют квадратными скобками.
11.
Строение комплексных соединений. Классификация. Номенклатура[Co(NH3)6]3+ - комплекс
[Co(NH3)6]Cl3 –
комплексное соединение.
[Fe(CO)5] – комплекс и
комплексное соединение
12.
Строение комплексных соединений. Классификация. НоменклатураКомплексообразователями
являются атомы или ионы металлов,
имеющие свободные орбитали (чаще
металлы d-элементы Co3+, Cu2+, Cu+,
Fe3+, Pt2+ и др.), т.е. они являются
акцепторами электронов.
13.
Комплексообразователь (центральный атом) Мзанимает центральное положение в КС и предоставляет
свободные атомные орбитали
Являются d- и f – металлы.
2
2
6
2
6
10
2
6
10
1
47Ag 1S 2S 2p 3S 3p 3d 4S 4p 4d 5S
Число свободных орбиталей М, определяет его
координационное число.
14.
15.
16.
Строение комплексных соединений. Классификация. Номенклатура17.
Строение комплексных соединений. Классификация. НоменклатураЛиганды (от лат. ligo – привязываю)
имеют неподеленные электронные пары,
т.е. являются донорами электронов гидроксогруппы (OH-), кислотные остатки
(Cl, Br-, J-, NO2-, CN-, SO42- и др.),
а также нейтральные полярные молекулы
(H2O, NH3, CO и др.).
.
18.
Строение комплексных соединений. Классификация. Номенклатура19.
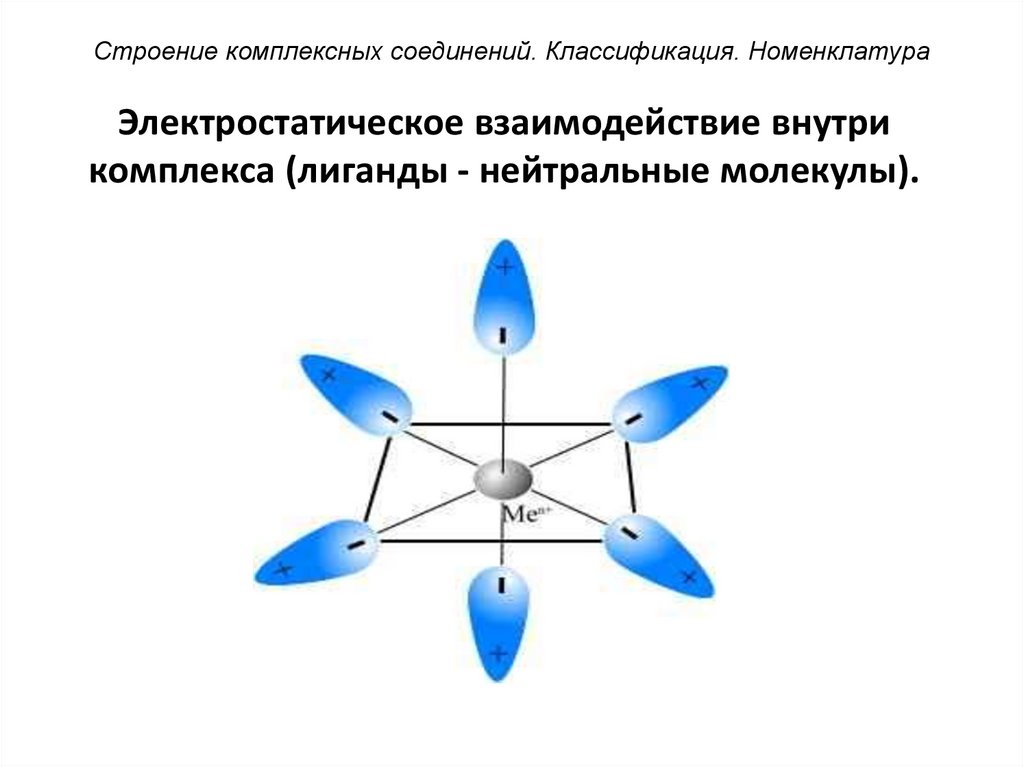
Строение комплексных соединений. Классификация. НоменклатураЭлектростатическое взаимодействие внутри
комплекса (лиганды - нейтральные молекулы).
20.
Строение комплексных соединений. Классификация. Номенклатура5. Механизм комплексообразования
связан с межионным,
межмолекулярным взаимодействиями,
но основной вклад в образование
внутренней сферы вносит донорноакцепторное взаимодействие.
Комплексные соединения – устойчивые
химические соединения сложного состава, в
которых хотя бы одна связь, образована по
донорно-акцепторному механизму.
21.
донорно-акцепторная связь22.
Строение комплексных соединений. Классификация. Номенклатура23.
Механизм образования комплексного иона[Al(OH)4]3d
3d
3d
3+
AlAl Al
3+
3p
3p
3p
3s
3s3s
OH
OH
OH
OH
24.
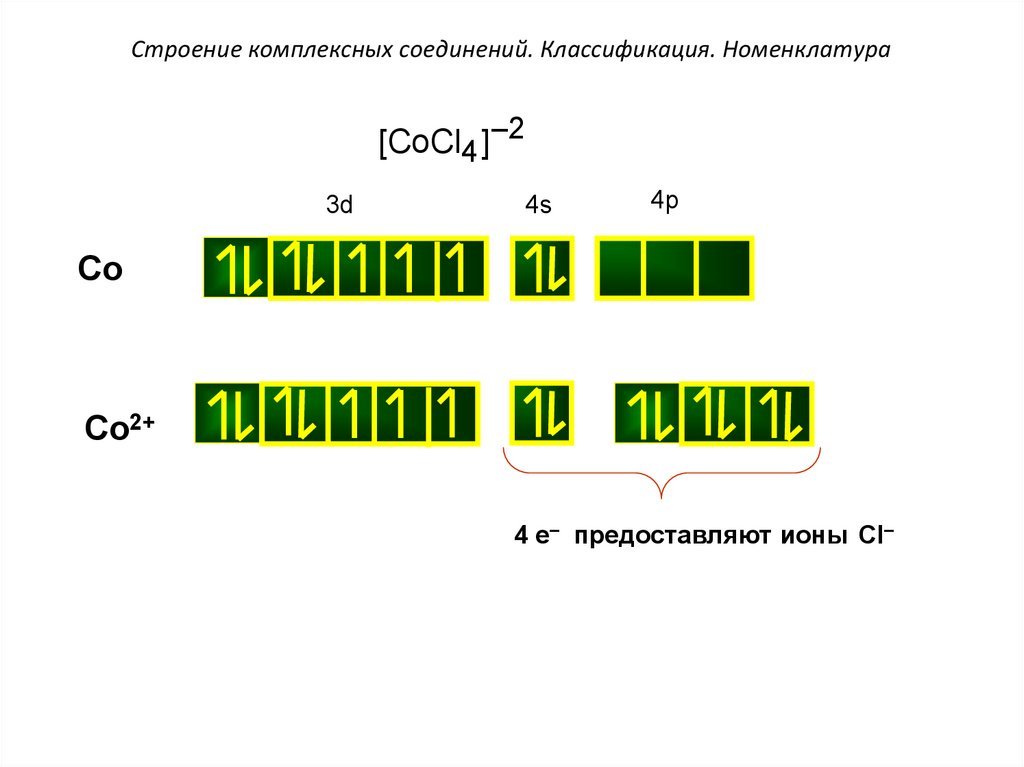
Строение комплексных соединений. Классификация. Номенклатура[CoCl4 ]–2
3d
4s
4p
Co
Co2+
4 e– предоставляют ионы Cl–
25.
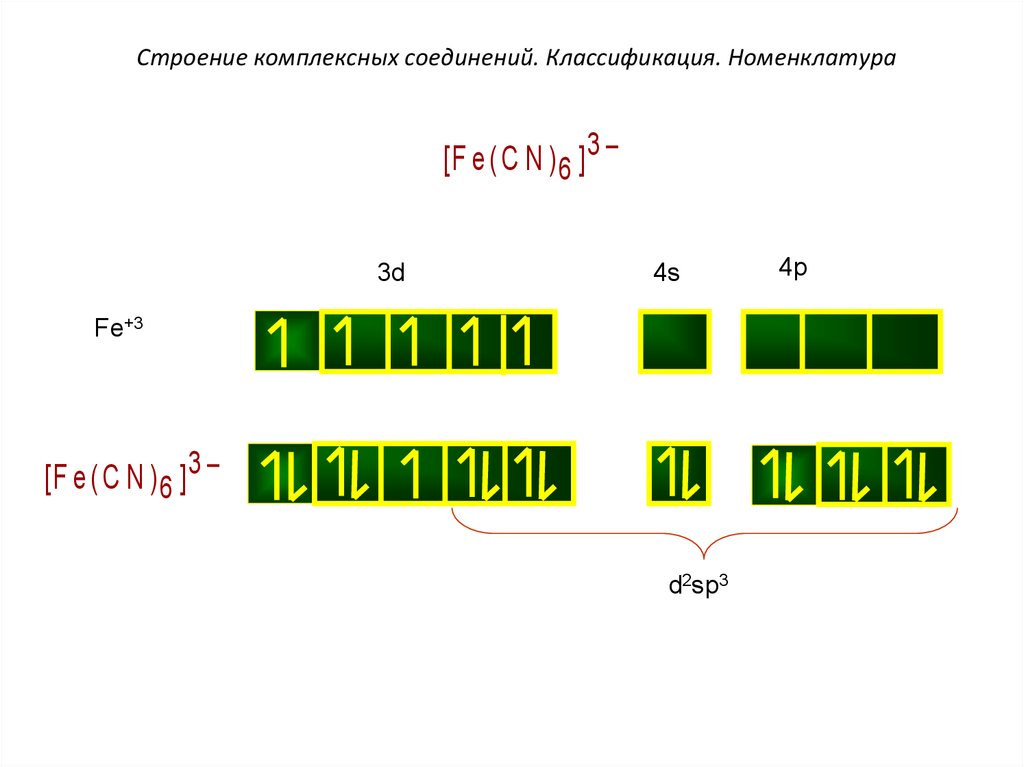
Строение комплексных соединений. Классификация. Номенклатура[F e (C N ) 6 ] 3 –
3d
4s
Fe+3
[F e (C N ) 6 ] 3 –
d2sp3
4p
26.
Строение комплексных соединений. Классификация. Номенклатура6. Координационное число (к. ч.)
комплексообразователя показывает,
сколько связей образует
комплексообразователь с лигандами.
Величина к.ч. зависит от природы
комплексообразователя, лигандов и
условий комплексообразования
(концентрации, рН, температуры и др.).
27.
Строение комплексных соединений. Классификация. НоменклатураКоординационные числа наиболее
распространенных комплексообразователей:
Комплексообразователь
К.ч.
Ag+ , Cu+
Cu2+ , Zn2+, Pt2+, Hg2+
Fe3+, Co3+, Fe2+, Ni2+, Al3+, Pt4+
2
4
6
Обычно оно равно удвоенному заряду иона
комплексообразователя и определяет структуру
внутренней сферы КС.
28.
Строение комплексных соединений. Классификация. НоменклатураЗаряд внутренней сферы
комплексного соединения Z равен
алгебраической сумме зарядов
комплексообразователя и лигандов.
Пример:
29.
Строение комплексных соединений. Классификация. НоменклатураПример:
Комплексообразователь – Со3+
Лиганды- Сl- , Н2О
КЧ (Со3+) = 6
[Со3+ (Сl- )4(Н2О)2]Z = 1 ·(+3)+4 ·(-1)+2 · 0 = -1
Дописываем ионы внешней сферы :
К+ [Со3+ (Сl- )4 (Н2О)2 ]-
30.
Строение комплексных соединений. Классификация. НоменклатураВнешняя сфера - это совокупность
ионов, непосредственно не связанных
с центральным атомом
комплексообразователя и
удерживаемых около внутренней
сферы электростатическими силами.
31.
Строение комплексных соединений. Классификация. НоменклатураВнешняя
сфера
Внутренняя сфера
K3[Fe(CN)6]
ИонКоординационное
Комплексочисло
образователь Лиганды
[Cu(NH3)4]Cl2
Внутренняя
сфера
Внешняя
сфера
32.
Комплексные соединенияхимические вещества, в состав которых входят комплексные частицы
Комплексная частица — сложная химическая
частица, все или часть связей в которой
3
6
образованы по донорно-акцепторному механизму
Комплексообразователь — центральный атом комплексной частицы.
Обычно комплексообразователь — атом металла. Комплексообразователь
обычно положительно заряжен и в таком случае именуется
металлоцентром;
заряд комплексообразователя может быть также отрицательным
или равным нулю
Лиганды — атомы или изолированные группы атомов, располагающиеся
вокруг комплексообразователя.
- в качестве лигандов могут выступать нейтральные молекулы (H2O, CO,
NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+
K [Fe(CN) ].
Внутренняя сфера комплексного соединения — центральный атом
со связанными с ним лигандами, то есть, собственно, комплексная частица
Внешняя сфера комплексного соединения — остальные частицы, связанные
с комплексной частицей ионной или межмолекулярными связями,
включая водородные
33.
34.
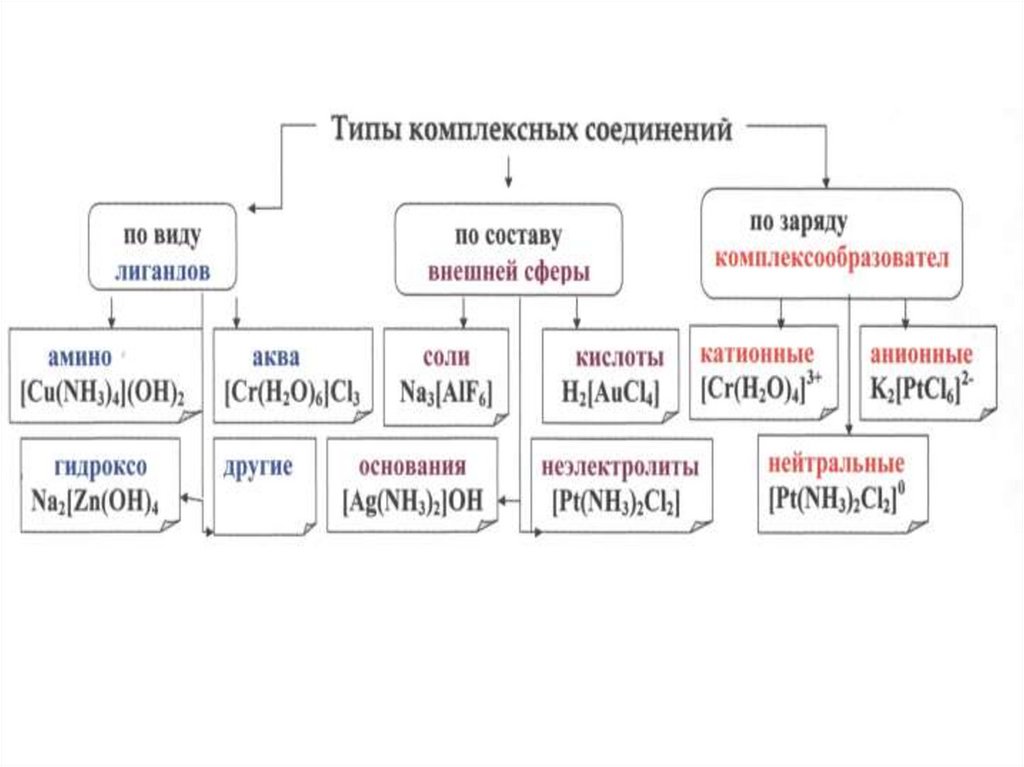
Комплексные соединенияКлассификация по заряду комплексной частицы
1) Катионные комплексы образованы в результате координации
вокруг положительного иона нейтральных молекул (H2O, NH3и др.).
[Zn(NH3)4]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает
атом с положительной степенью окисления, а лигандами являются
простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул
вокруг нейтрального атома, а также при одновременной координации
вокруг положительного иона —
комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
35.
Номенклатура комплексных частицЧисло лигандов –
греч. числит.
Название комплекса:
число лигандов
1 – (моно)
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
7 – гепта …
название лигандов
название
комплексообразователя
36.
I. Номенклатура катионных комплексовНазывают лиганды:
а) нейтральные молекулы (их называют в первую
очередь): Н2О – аква; NH3 – аммин; СО –
карбонил; NO – нитрозил.
б) лиганды-анионы называют с окончанием «-о»:
ОН- - гидроксо; CI- -хлоро; Br- - бромо; I- - иодо;
NO2- - нитро; NO3- - нитрато; SO42- - сульфато; CN- циано; SCN- - родано.
• Называют комплексообразователь
русским наименованием.
• Отмечают валентность
комплексообразователя римской цифрой
в скобках.
37.
Строение комплексных соединений. Классификация. НоменклатураПримеры:
II
[Cu(NH3)4]Cl2
хлорид тетраамминмеди(II)
1 – моно
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
H2O – аква
NH3 – аммин
I(NH ) ]OH –
[Ag
3 2
Cl – хлорогидроксид
диамминсеребра
(I)
NO2- - нитро
CN- - цианоIII(NH ) ]Cl –
[Co
3 6
3
SCN - роданохлорид гексаамминкобальта (III)
38.
II. Номенклатура анионных комплексов• Греческим числительным называют число
лигандов.
• Называют лиганды.
• Называют комплексообразователь латинским
наименованием с окончанием «-ат».
• Отмечают валентность
комплексообразователя римской цифрой в
скобках.
39.
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙНАЗВАНИЯ АНИОНОВ:
Fe - феррат
Cu - купрат
Ag - аргентат
Au - аурат
Hg - меркурат
Zn - цинкат
Al - алюминат
40.
Строение комплексных соединений. Классификация. Номенклатура1 – моно
2 – ди
Примеры:
III
3 – три
K3[Fe(CN)6]
4 – тетра
Гексацианоферрат(III) калия
5 – пента
6 – гекса
[Fe(CN)6]3–
H2O – аква
– гексацианоферрат(III)-ион
NH3 – аммин
Cl- – хлоро–
[Ag(CN)
]
2
NO2 – нитро
– дицианоаргентат(I)-ион
CN- – цианоSCN- – родано- K2[HgI4]
– тетраиодомеркурат(II) калия
K2[PtCl6] –
гексахлороплатинат(IV) калия
41.
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВГексахлороплатинат (IV) калия
Ответ: K2[PtCl6]
Нитрат хлоронитротетраамминкобальта (III)
Ответ: [Co(NH3)4(NO3)Cl]NO3
Гексагидроксохромат (III) натрия
Ответ: Na3[Cr(OH)6]
Нитрат гексаамминникеля (II)
Ответ: [Ni(NH3)6](NO3)2
42.
Комплексные соединенияКлассификация
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака,
например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода:
[Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются
молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные
остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты:
H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве
лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
43.
Типы комплексныхсоединений
1. Аквакомплексы
В водных растворах:
• [Be(H2O)4]2+
• [Al(H2O)6]3+
• [Cr(H2O)6]3+ …
Кристаллогидраты:
• [Be(H2O)4]SO4
• [Al(H2O)6]Cl3
• [K(H2O)6][Cr(H2O)6](SO4)2
• [Cu(H2O)4]SO4·H2O
• [Ni(H2O)6]SO4·H2O
M
: OH2
44.
2. Гидроксокомплексы[Zn(OH)4]2–
M
: OH–
45.
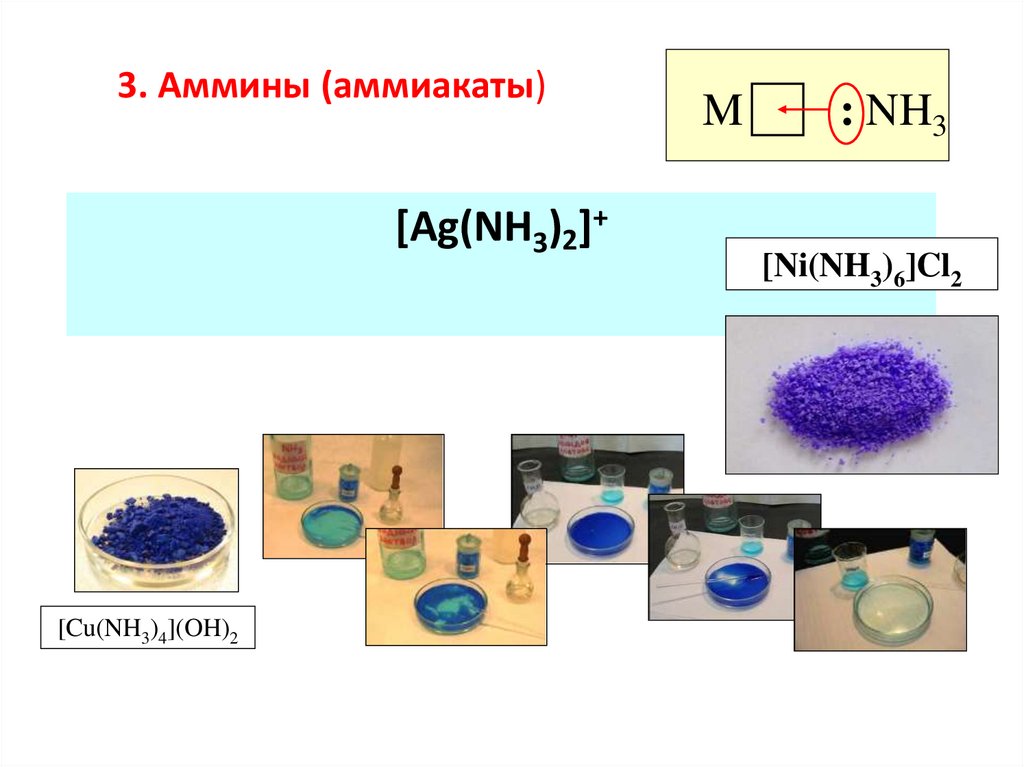
3. Аммины (аммиакаты)[Ag(NH3)2]+
[Cu(NH3)4](OH)2
M
: NH3
[Ni(NH3)6]Cl2
46.
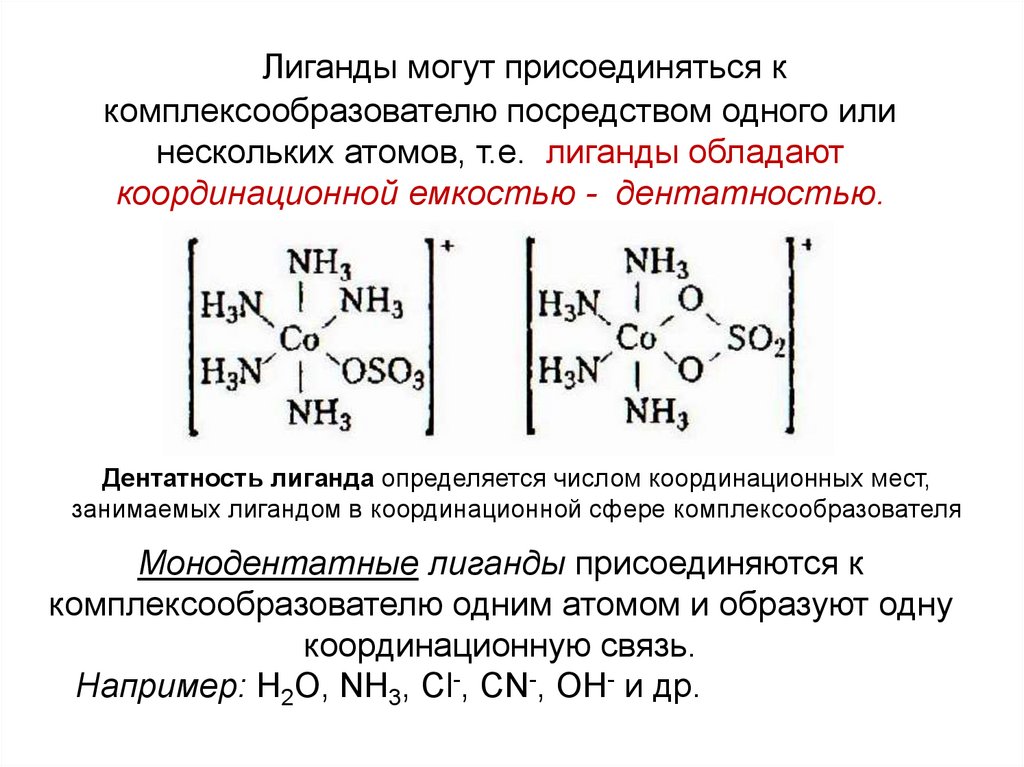
Лиганды могут присоединяться ккомплексообразователю посредством одного или
нескольких атомов, т.е. лиганды обладают
координационной емкостью - дентатностью.
Дентатность лиганда определяется числом координационных мест,
занимаемых лигандом в координационной сфере комплексообразователя
Монодентатные лиганды присоединяются к
комплексообразователю одним атомом и образуют одну
координационную связь.
Например: H2O, NH3, Cl-, CN-, OH- и др.
47.
Комплексные соединенияКлассификация
По числу мест, занимаемых лигандами
в координационной сфере
1) Монодентатные лиганды. Такие лиганды бывают нейтральными
(молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−,
SCN−, и др.)
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной
кислоты H2N — CH2 — COO−, оксалат-ион −O — CO — CO — O−,
карбонат-ион СО32−, сульфат-ион SO42−, тиосульфат-ион S2O32−
3) Полидентатные лиганды. Например, комплексоны — органические
лиганды, содержащие в своём составе несколько групп −С≡N
или −COOH (этилендиаминтетрауксусная кислота — ЭДТА).
Циклические комплексы, образуемые некоторыми полидентатными
лигандами, относят к хелатным (гемоглобин и др.)
48.
Если в состав лиганда входит атом имеющийодну неподеленную пару электронов –
монодентатный L:
•
Cl-,
•
OH-,
•
CN-,
•
H2O,
две пары – бидентатный L:
NH2
CH2 CH2
•
R-OH,
•
NH3
NH2
и более – полидентатные L:
- OOC
CH2
- OOC
CH2
N
CH2 CH2
N
-
CH2
COO
CH2
COO
49.
Хелаты. Комплексоны. Краун-эфирыH2C
H2C
OH
OH
H2C
O
H2C
O
H
Cu
H
O
CH2
O CH2
50.
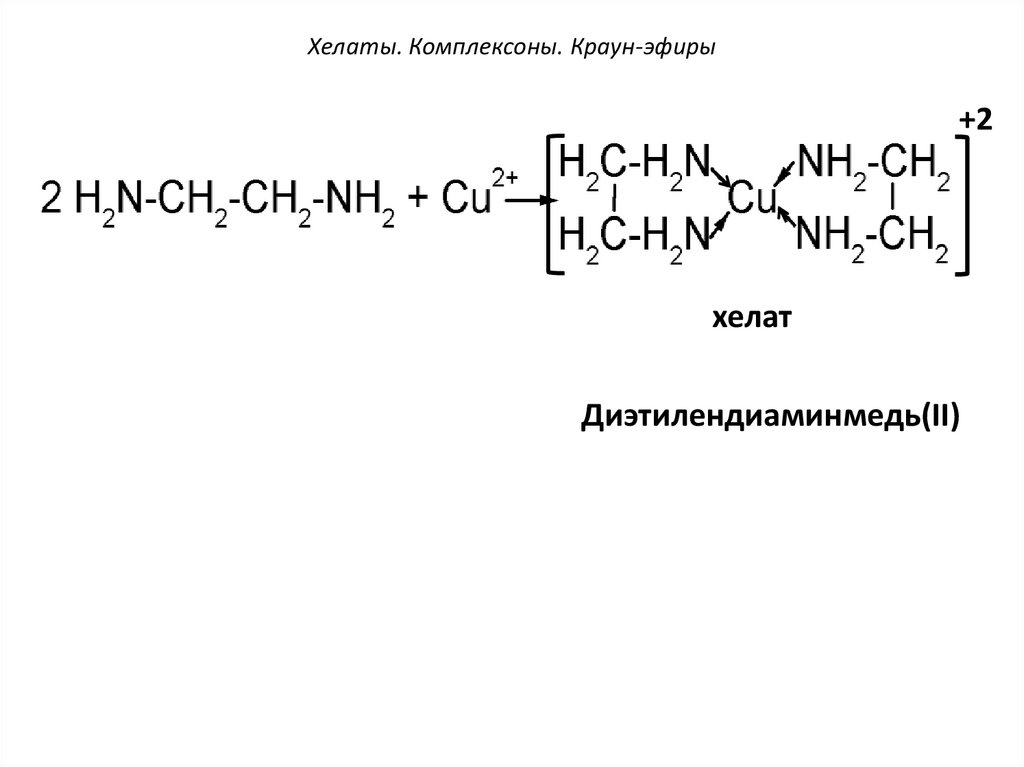
Хелаты. Комплексоны. Краун-эфиры+2
хелат
Диэтилендиаминмедь(II)
51.
Хелаты. Комплексоны. Краун-эфирыПолидентатные лиганды присоединяются
к комплексообразователю посредством
нескольких атомов.
Например: функциональные органические
соединения.
Большое практическое значение имеют
комплексоны – полидентатные лиганды,
содержащие несколько функциональных
групп и образующие прочные комплексы
практически со всеми двухзарядными
ионами металлов
(Ca2+, Mg2+, Zn2+, Cu2+, Pt2+…).
52.
Би- и полидентатные лиганды часто образуютхелаты (от греч. «клешня») – комплексы, в
которых лиганд и центральный атом образуют
цикл.
Увеличение прочности комплексов с
полидентатными лигандами по сравнению с
монодентатными, называется хелатным
эффектом.
53.
Хелаты. Комплексоны. Краун-эфирыОбычно хелаты гораздо устойчивее
комплексных соединений, содержащих
монодентатные лиганды, т.к.
комплексообразователь связан с лигандами
несколькими донорно-акцепторными связями.
Наиболее известными комплексонами
высшего порядка являются:
• комплексон -II этилендиаминтетрауксусная
кислота (ЭДТА)
• комплексон- III двузамещенная натриевая
соль ЭДТА - Трилон Б: Na2[H2Tr]
54.
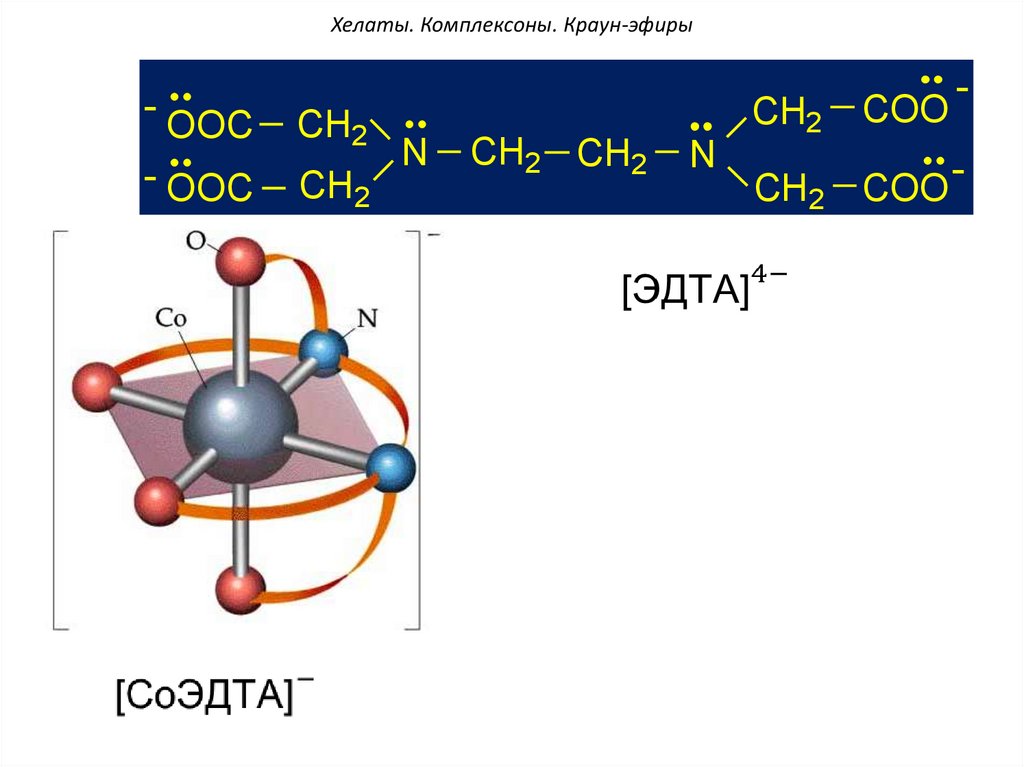
Хелаты. Комплексоны. Краун-эфиры-
OOC
CH2
- OOC
CH2
N
CH2 CH2
CH2
N
COO
-
CH2 COO -
55.
Хелаты. Комплексоны. Краун-эфирыТрилон Б широко используется в
клиническом анализе для титриметрического
определения ионов Са2+ и Мg2+ при
определении жесткости воды.
Максимальная дентатность такого лиганда
равна 6.
56.
Диссоциация комплексных соединенийПервичная диссоциация комплексных соединений это распад КС в растворе на ионы внешней и
внутренней сфер подобно cильным электролитам, так
как эти ионы связаны ионными (электростатическими)
силами.
Вторичная диссоциация комплексного соединения
– это распад внутренней сферы на составляющие ее
компоненты. Этот процесс протекает по типу слабых
электролитов, так как частицы внутренней сферы
связаны ковалентной связью.
57.
Устойчивость комплексных соединенийУстойчивость комплексных ионов
характеризуется константой нестойкости
(Кнест), которая определяется на основании
закона действующих масс.
[Ag+] [NH3]2
= 5,89.10-8
KH =
[Ag(NH3)2+]
58.
Константы нестойкости некоторых комплексовКомплексный ион
[Fe(CN)6]3[Fe(CN)6]4[Co(NH3)6]2+
[Ag(NH3)2]+
[Cu(NH3)4]2+
[Zn(OH)4]2–
Константа нестойкости
1,0 . 10–31
1,0 . 10–36
7,75 . 10–6
9,31 . 10–8
2,14 . 10–13
3,6 . 10–16
59.
Устойчивость комплексных соединенийКонстанта нестойкости характеризует
термодинамическую устойчивость комплекса,
которая зависит от прочности связей между
центральным атомом и лигандами.
Чем меньше значение Кнест, тем более
прочен комплекс, тем он устойчивее.
60.
Устойчивость комплексных соединенийМерой прочности комплекса является энергия
разрыва связей, величина которой характеризуется
изменением энергии Гиббса (∆G) в результате
вторичной диссоциации. Уравнением изотермы:
G RT ln Kнест.
0
G 2,303RT lg Kнест. ,
0
где:
R = 8,314 Дж моль-1 К-1
T – температура, К
ln К = 2,303 . lgК
61.
ПОЛУЧЕНИЕ КОМПЛЕКСНЫХСОЕДИНЕНИЙ
1. Получение гексогидроксоалюмината натрия
AlCl3+3NaOH = Al(OH)3↓+3NaCl
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
2. Получение гидроксида тетраамминмеди (II)
CuCl2+2NH3 +2H2O = Cu(OH)2↓+NH4Cl
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
62.
Химические свойствакомплексных соединений
1. В растворе комплексные соединения ведут
себя как сильные электролиты, т.е.
полностью диссоциируют на катионы и
анионы.
[Pt(NH3)4]Cl2 = [Pt(NH3)4] 2+ + 2Cl –,
K2[PtCl4] = 2K+ + [PtCl4] 2–
[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42-
63.
ХИМИЧЕСКИЕ СВОЙСТВА2. Реакции по внешней сфере
FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl
[Cu(NH3)4]SO4+BaCl2→
→[Cu(NH3)4]Cl2+BaSO4↓
64.
СПАСИБО ЗАВАШЕ
ВНИМАНИЕ!






















































 chemistry
chemistry








