Similar presentations:
Лигандообменные равновесия и процессы
1.
Лигандообменныеравновесия и процессы
2.
Координационная теория,предложенная в 1893 году А. Вернером и
дополненная Л.А.Чугаевым.
Альфред
Вернер
(1866-1919)
Лев Александрович
Чугаев
(1873-1922)
3.
Образование комплексной соли3KCN + Fe(CN)3 = K3[Fe(CN)6]
Комплексные соединения – устойчивые хим.
соединения сложного состава, в которых хотя
бы одна связь, образована по донорноакцепторному механизму.
4.
[Ag(NH3)2] Clкомплексныйкоординационное число
катион
лиганды
внутренняя сфера внешняя сфера
комплексообразователь
K3 [Fe(CN)6]
комплексный
анион
5.
КЛАССИФИКАЦИЯпо составу:
Основания
Соли
[Ag(NH3)2]OH
Na2[Zn(OH)4]
Кислоты
Неэлектролиты
Н[AuCl4]
[Pt(NH3)2Cl2]
6.
по виду лигандов:Амино-
Гидроксо-
[Cu(NH3)4](OH)2
Na2[Zn(OH)4]
Аква-
[Cr(H2O)6]Cl3
7.
по заряду внутренней сферы:Катионные
[Ag(NH3)2
+
] OH
Анионные
Na2[Zn(OH)4]
Нейтральные
[Pt(NH3)2Cl2
0
]
8. Диссоциация комплексных соединений
Первичная диссоциация –распад КС в растворе на ионы внешней
и внутренней сфер подобно cильным
электролитам, т.к. они связаны ионными
(электростатическими) силами.
[Zn(NH3)4]Cl2 → [Zn(NH3)4]2+ + 2Cl-
9.
Вторичная диссоциация – распадвнутренней сферы на составляющие
ее компоненты. Процесс протекает по
типу слабых электролитов, т.к. частицы
внутренней
сферы
связаны
ковалентной связью.
2+
[Zn(NH3)4]
↔
2+
Zn
+
0
4NH3
10. Устойчивость комплексных соединений
Для качественной характеристикиустойчивости КС используют:
Константа нестойкости
комплекса (Кнест)
Zn NH
2
К нест
.
4
3
2
Zn(NH 3 )4
Чем меньше значение
более устойчиво КС.
Кнест,
тем
11.
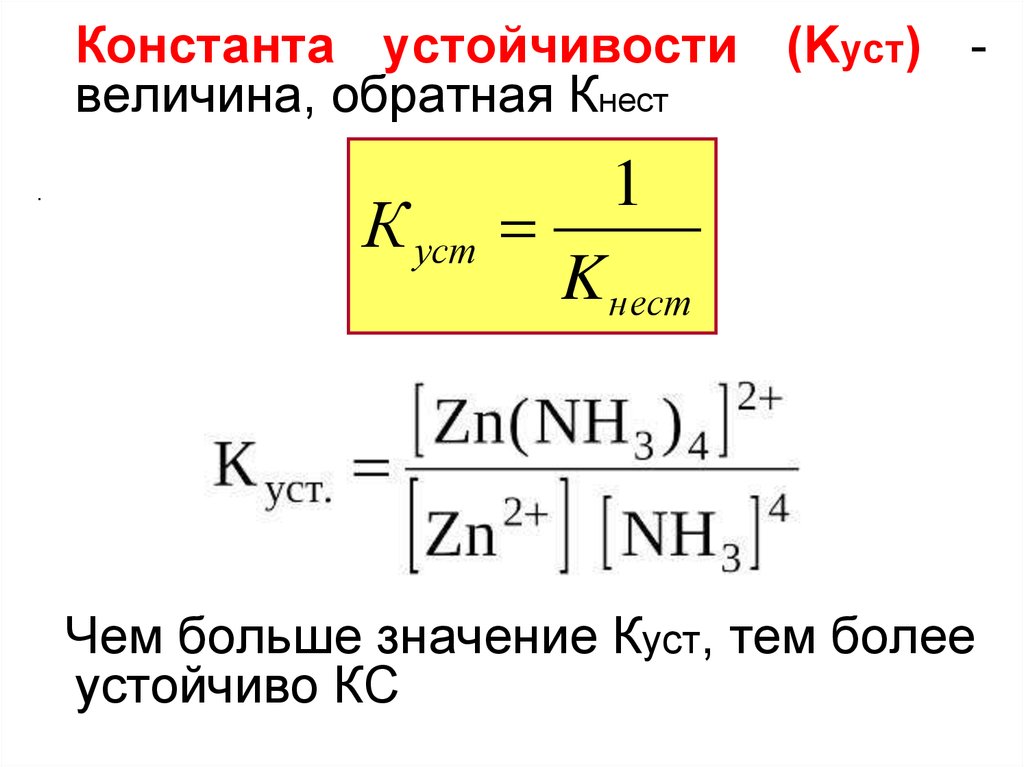
Константа устойчивости (Kуст) величина, обратная Кнест.
К уст
1
K нест
Чем больше значение Куст, тем более
устойчиво КС
12.
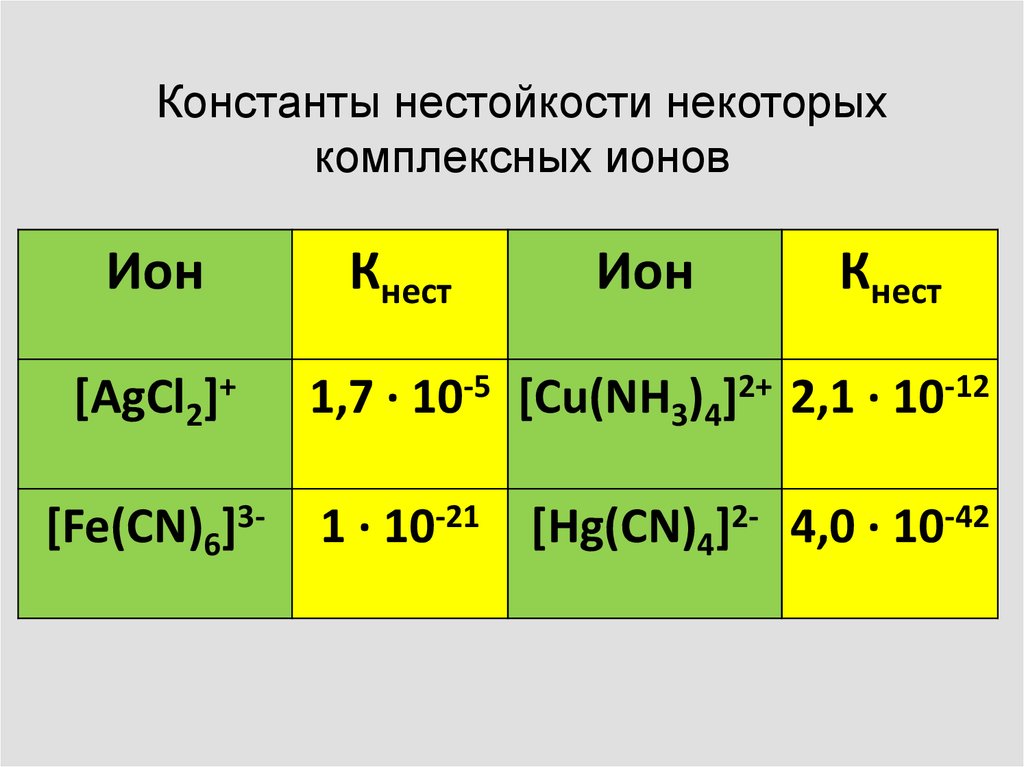
Константы нестойкости некоторыхкомплексных ионов
Ион
Кнест
Ион
Кнест
[AgCl2]+
1,7 ∙ 10-5 [Cu(NH3)4]2+ 2,1 ∙ 10-12
[Fe(CN)6]3-
1 ∙ 10-21 [Hg(CN)4]2- 4,0 ∙ 10-42
13.
Комплексообразователь (центральный атом (М))– атом или ион, который является акцептором
электронных пар, предоставляя свободные атомные
орбитали, и занимает центральное положение в КС.
Являются d- и f – металлы
22S22p63S23p63d104S24p64d105S1
Ag
1S
47
Число свободных орбиталей М, определяет его
координационное число. Обычно оно равно
удвоенному заряду иона комплексообразователя
и определяет структуру внутренней сферы КС.
14.
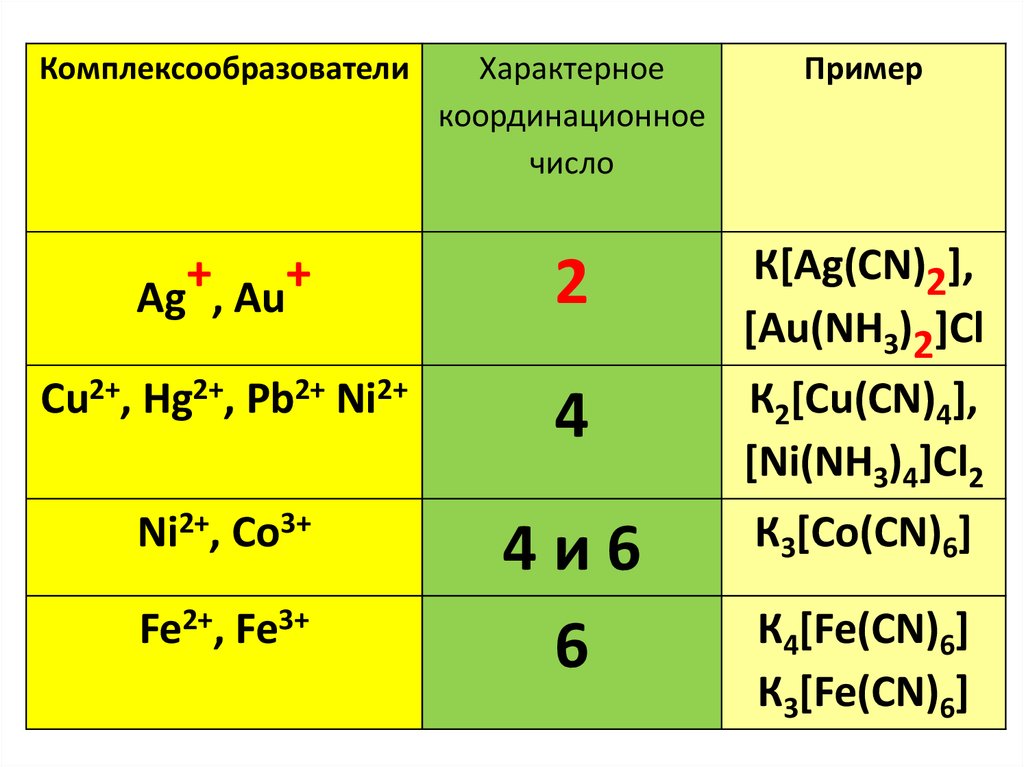
Комплексообразователи+
+
Ag , Au
Cu2+, Hg2+, Pb2+ Ni2+
Ni2+, Co3+
Fe2+, Fe3+
Характерное
координационное
число
Пример
2
К[Ag(CN)2],
[Au(NH3)2]Cl
4
К2[Cu(CN)4],
[Ni(NH3)4]Cl2
4и6
6
К3[Co(CN)6]
К4[Fe(CN)6]
К3[Fe(CN)6]
15.
16.
Лиганды (L) – молекулы или ионы, которыеявляются донорами электронных пар и
связаны непосредственно с
комплексообразователем.
донорно-акцепторная связь
По числу связей, образуемых лигандом с
комплексообразователем, лиганды делятся
на моно-, би- и полидентатные.
17.
Если в состав лиганда входит атом имеющийодну неподеленную пару электронов –
монодентатный L:
•
Cl-,
•
OH-,
•
CN-,
•
H2O,
•
R-OH,
•
NH3
две пары – бидентатный L:
NH2
CH2 CH2
NH2
и более – полидентатные L:
-
OOC
- OOC
CH2
CH2
N
CH2 CH2
CH2
N
COO
CH2 COO
-
18.
Би- и полидентатные лиганды частообразуют хелаты (от греч. «клешня») –
комплексы, в которых лиганд и
центральный атом образуют цикл.
Увеличение прочности комплексов с
полидентатными лигандами по сравнению
с монодентатными, называется
хелатным эффектом.
19.
Эффективность донорноакцепторного взаимодействия L и M(прочность связи) определяется их
поляризуемостью.
Чем меньше радиус и число
электронов у частицы, тем менее
поляризуема («жесткие»), наоборот
– «мягкие».
20.
21.
Наиболее прочная связь возникаетмежду «мягкими» L и M.
Белки содержат «мягкие» группы –
-COO , –NH2 и –SH. Поэтому
«металлы жизни» в организме
встречаются только в виде
комплексов, а Na+ и K+ («жесткие»)
– в виде ионов.
22.
Биокомплексы: ферменты, витамины,гармоны.
23.
Очень «мягкие»: Cd2+, Pb2+, Hg2+,сильно токсичны, т.к. образуют прочные
комплексы с белком (особенно
содержащие группу – SH), нарушая
обмен веществ, вызывая появление
опухолей, мутагенез.
Тиоловые яды
24.
Детоксикацию организма от металловтоксикантов проводят при помощи лигандпрепаратов на основе полидентатных L –
хелатотератия.
Эффективными препаратами для хелатотерапии
являются:
этилендиаминтетрауксусная
кислота
25.
сукцимерH2 C - S - H
H2 C - S
Hg
H C - S - H + HgCl2 H C - S
H2 C - SO3Na
унитиол
H2 C - SO3Na
+ 2HCl
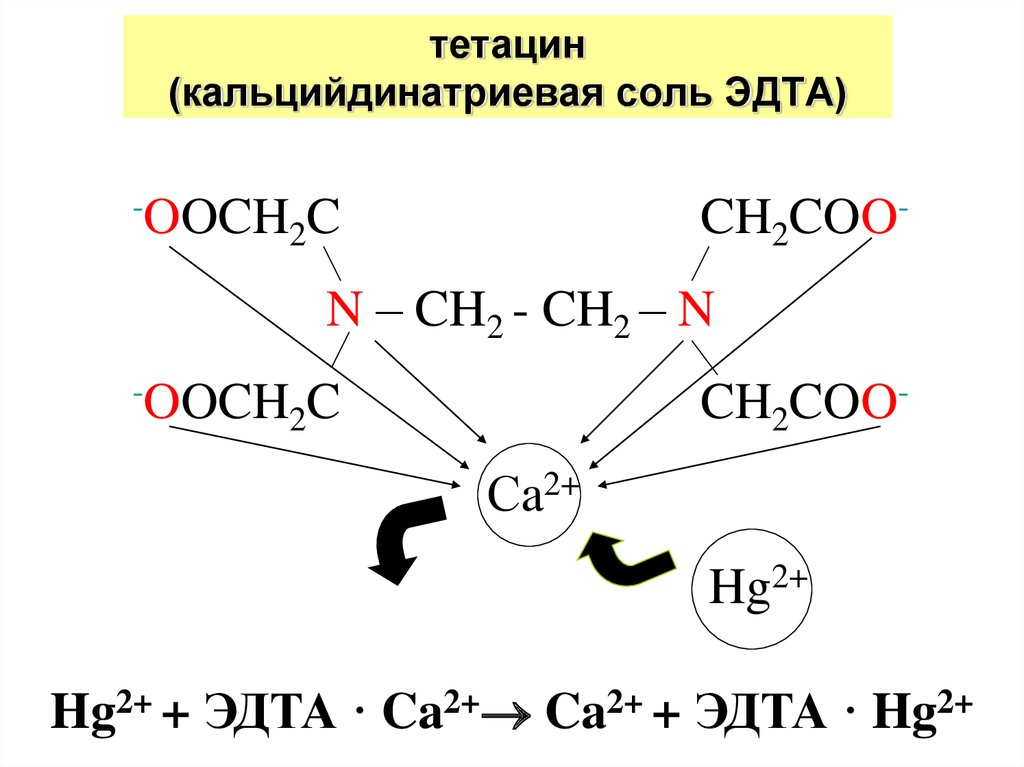
26. тетацин (кальцийдинатриевая соль ЭДТА)
-OOCHCH2COO-
2C
N – CH2 - CH2 – N
-OOCH
CH2COO-
2C
Сa2+
Hg2+
Hg2+ + ЭДТА · Ca2+ Ca2+ + ЭДТА · Hg2+






















 chemistry
chemistry