Similar presentations:
Общая теория лигандообменных равновесий и процессов
1.
Общая теория лигандообменных равновесий ипроцессов.
Гетерогенное равновесие в системе: осадокнасыщенный раствор
Химия. Лекция №4
Кафедра медицинской и биологической химии ХМГМА
2.
План лекции:1.
2.
3.
4.
5.
6.
7.
8.
Комплексные соединения. Координационная теория Вернера.
Классификация комплексов по заряду и природе лигандов.
Номенклатура комплексных соединений.
Ионные равновесия в растворах комплексных соединений.
Константы нестойкости.
Внутрикомплексные
соединения.
Роль
комплексных
соединений в жизнедеятельности организма.
Константа растворимости. Условия образования и растворения
осадка. Факторы, влияющие на образование и растворение
осадка.
Изолированные и совмещенные гетерогенные равновесия в
растворах электролитов.
Реакции, лежащие в основе образования неорганического
вещества костной ткани гидрофосфата кальция. Явление
изоморфизма. Остеотропность металлов.
Механизм функционирования кальциевого буфера.
Реакции, лежащие в основе образования конкрементов.
3.
Комплексные соединения(К.С.) – соединения, в узлахкристаллической решетки которых находятся ионы, способные к
самостоятельному существованию в растворе.
Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)2 + 4H2O
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
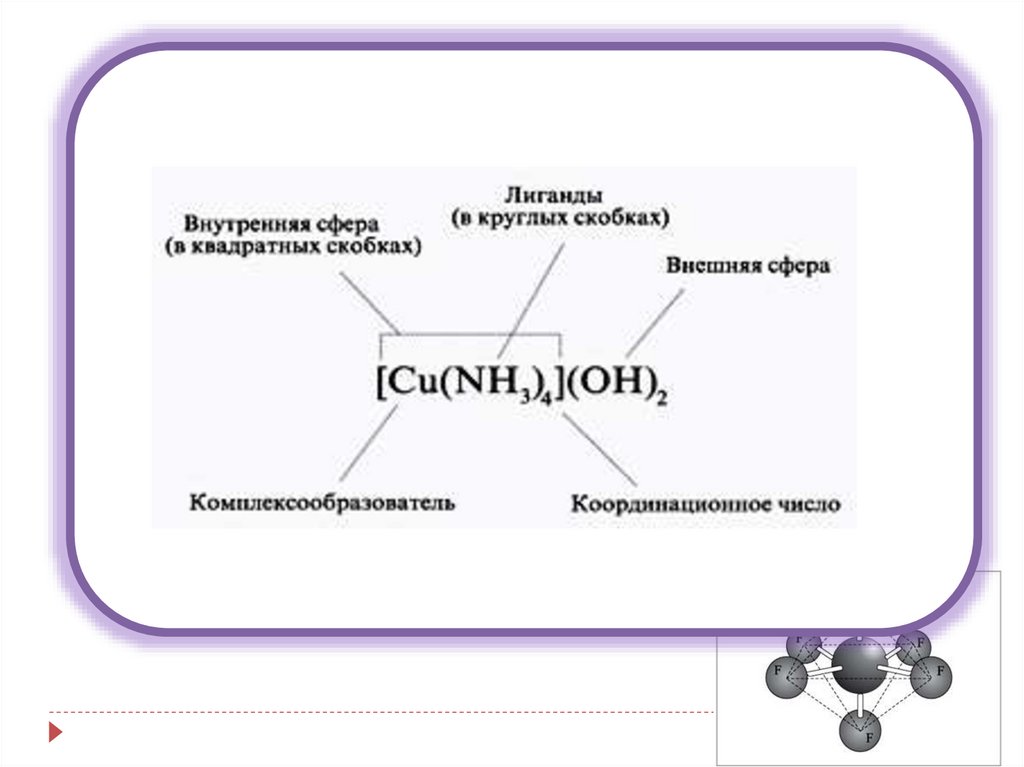
Строение К.С.( по теории Вернера)
К[MeLn], [MeLn]A
4.
Кt[MeLn] - Комплексное соединениеMen+ - комплексообразователь (центральный атом) –
атом или ион, который является акцептором электронных
пар, предоставляя свободные атомные орбитали, и
занимает центральное положение в комплексном
соединении. Роль комплексообразователя выполняют d- и
f-элементы реже p-элементы.
L - лиганды – молекулы или ионы, которые являются
донорами электронных пар и непосредственно связаны с
комплексообразователем.
n - координационное число (кч) - число свободных
атомных орбиталей, предоставляемых
комплексообразователем, определяет его, значение
которого зависит от многих факторов, но, обычно равно,
удвоенному заряду иона комплексообразователя.
5.
Кt[MeLn] - комплексное соединение[MeLn]х- внутренняя сфера комплексного
соединения
(комплексный
ион)
–
это
совокупность центрального атома и лигандов.
Заряд внутренней сферы определяется как
алгебраическая
сумма
зарядов
комплексообразователя и всех лигандов
Кtх+ - внешняя сфера комплексного соединения
–
это
ионы
противоположного
знака,
нейтрализующие заряд комплексного иона и
связанные с ним ионной связью.
6.
7.
Классификация и номенклатураI. По заряду внутренней сферы:
Катионные:
[Cu(NH3)4]SO4 сульфат тетраамминмеди (II),
[Cu(Н2О)3OH]Cl хлорид гидроксотриаквамеди (II);
Анионные:
K3[Fe(CN)6]3 гексацианоферрат (III) калия,
K4[Со(NО3)6] гексанитрокобольтат (II) калия;
Неэлектролиты:
[Со(Н2О)3(CN)3] триакватрицианокобальт.
8.
Классификация и номенклатураI. По заряду внутренней сферы:
Катионные:
[Cu(NH3)4]SO4 сульфат тетраамминмеди (II),
[Cu(Н2О)3OH]Cl хлорид гидроксотриаквамеди (II);
Анионные:
K3[Fe(CN)6]3 гексацианоферрат (III) калия,
K4[Со(NО3)6] гексанитрокобольтат (II) калия;
Неэлектролиты:
[Со(Н2О)3(CN)3] триакватрицианокобальт.
9.
II. По кислотно-основным свойствам:соли; кислоты; основания.
III. По типу лиганда (природы лиганда):
Амино-; аква-; циано-; гидроксо-.
IV. По числу связей, образуемых лигандом с центральным
ионом - дентатность:
монодентатные – доноры одной электронной пары;
бидентатные – доноры двух электронных пар;
полидентатные – доноры нескольких электронных пар.
10.
Природа химических связей в комплексныхсоединениях
метод валентных связей (ВС). Между лигандом
и комплексообразователем возникает донорноакцепторная связь за счет неподеленной пары
электронов лиганда (донор) и свободной
орбитали
центрального
иона
(акцептор).
Комплексообразователь предоставляет свободные
гибридные орбитали, оси которых определенным
образом располагаются в пространстве, что и
обуславливает структуру внутренней сферы
комплекса.
теория кристаллического поля,
метод молекулярных орбиталей (МО).
11.
КЧТип
гибридизации
АО
Структура
внутренней сферы
Пример
sp
линейная
[Ag(NH3)2]Cl
sp3
тетраэдрическая
K[ВF4]
4
sp2d
квадратноплоскостная
[Cu(NH3)4](OH)2
октаэдрическая
6
sp3d2
d2sp3
K3[FeCl6]
K3[Fe(CN)6]
2
12.
Ионные равновесия в растворах комплексныхсоединений. Константы нестойкости.
На ионы внешней и внутренней сферы комплекса,
К.С. диссоциируют по типу сильных
электролитов.
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4Ионизация
внутренней
сферы
комплекса
протекает по типу слабого электролита
[Fe(CN)6]4- ↔ Fe2+ + 6CN-
13.
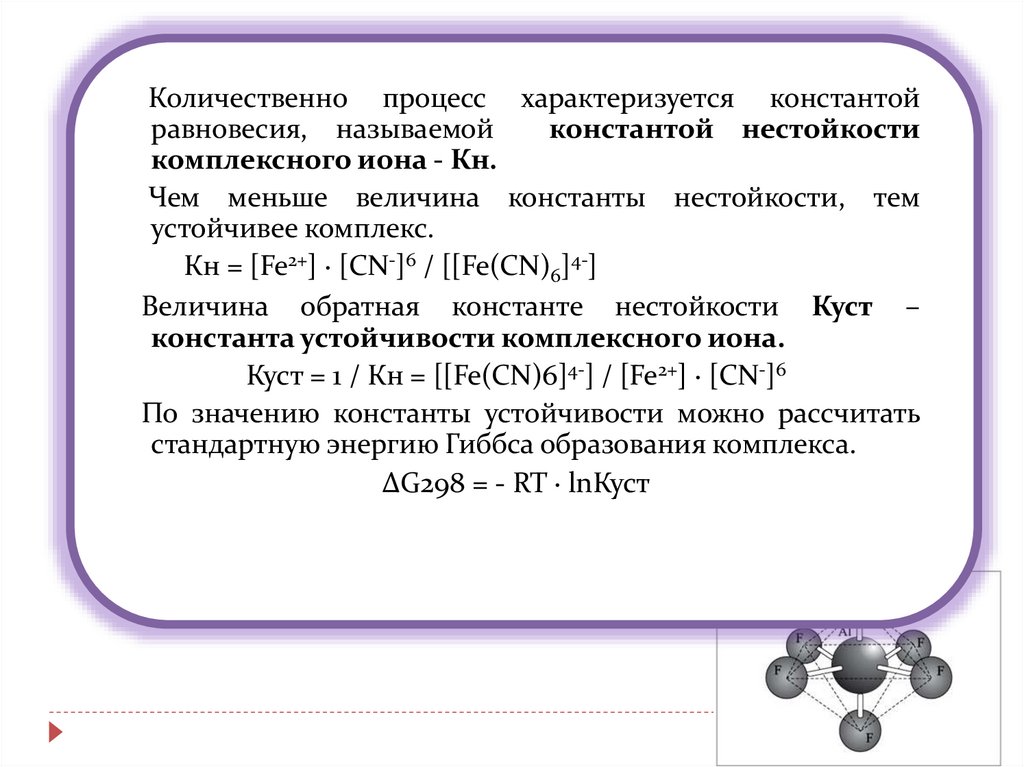
Количественно процесс характеризуется константойравновесия, называемой
константой нестойкости
комплексного иона - Кн.
Чем меньше величина константы нестойкости, тем
устойчивее комплекс.
Кн = [Fe2+] ∙ [CN-]6 / [[Fe(CN)6]4-]
Величина обратная константе нестойкости Куст –
константа устойчивости комплексного иона.
Куст = 1 / Кн = [[Fe(CN)6]4-] / [Fe2+] ∙ [CN-]6
По значению константы устойчивости можно рассчитать
стандартную энергию Гиббса образования комплекса.
∆G298 = - RT ∙ lnКуст
14.
Внутрикомплексные соединения.Роль внутрикомплексных соединений в
жизнедеятельности организма.
Строение молекулы гемоглобина.
Внутрикомплексными (хелатными, клешневидными)
называются соединения лиганд в которых образует
более чем одну связь с комплексообразователем.
Такие лиганды называются полидентантными.
Соединения, в которых лиганды связаны в единое
кольцо-цикл,
называют
макроциклическими.
Важнейшими макроциклическими соединениями
являются: хлорофилл, гемоглобин, цитохромы,
каталаза, витамин В12 и др.
15.
16.
Гемоглобин –– сложныйсложный олигомерный
олигомерный белок,
белок,
Гемоглобин
состоящий из
из четырех
четырех протомеров(субъединиц).
протомеров(субъединиц).
состоящий
Каждый протомер
протомер содержит
содержит небелковую
небелковую часть
часть –– гем,
гем,
Каждый
соединенный сс одной
одной полипептидной
полипептидной цепью.
цепью.
соединенный
Ион железа
железа +2
+2 вв геме
геме четырьмя
четырьмя связями
связями образует
образует
Ион
комплекс сс порфирином,
порфирином, пятой
пятой координационной
координационной
комплекс
связью железо
железо соединяется
соединяется сс белковой
белковой молекулой
молекулой
связью
через атом
атом азота
азота имидазольной
имидазольной группы
группы гистидина
гистидина
через
(Гис 8)
8) ,, шестая
шестая связь
связь предназначена
предназначена для
для
(Гис
присоединения кислорода.
кислорода.
присоединения
17. Миоглобин
18.
Миоглобин – сложный белок, состоит из 153аминокислот, имеет третичную структуру, одну
полипептидную цепь и один гем. Может связывать
одну молекулу кислорода.
Содержится в мышечной ткани, служит резервом
кислорода для работающей мышцы. Имеет меньшее
сродство к кислороду чем гемоглобин крови
19.
Витамин В1220. Цитохром С
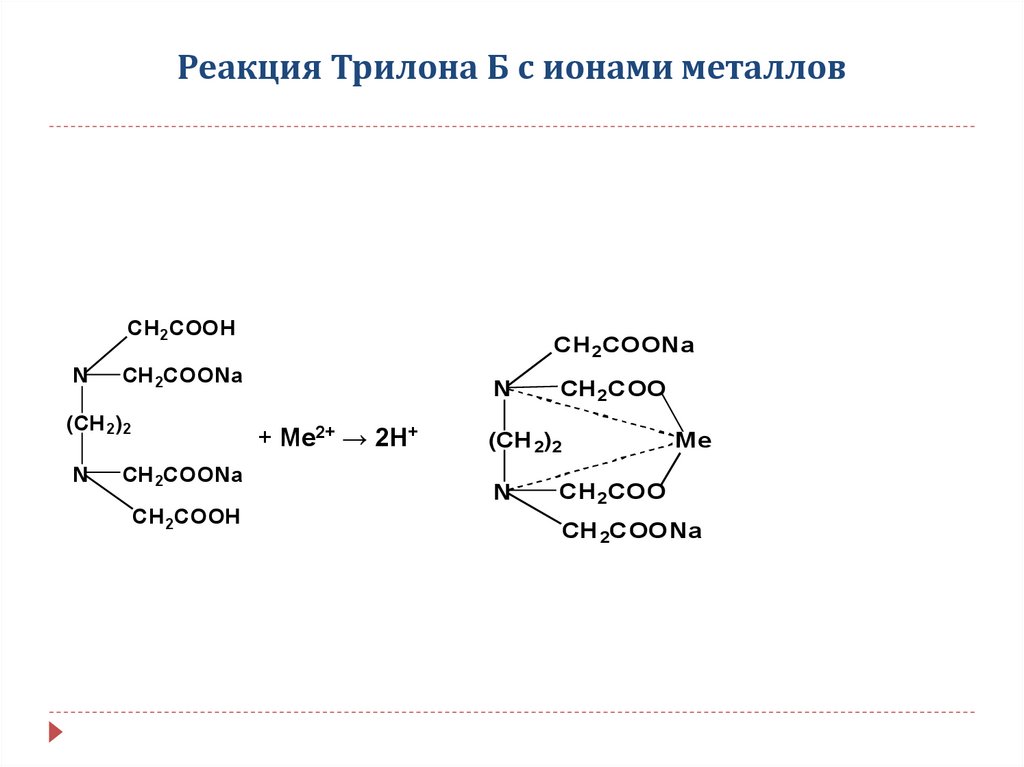
21. Реакция Трилона Б с ионами металлов
CH2 COOHN
CH 2COONa
(CH 2 )2
N
CH2 COONa
N
+ Me2+ → 2H+
CH 2COONa
CH 2COOH
CH2 COO
(CH 2)2
N
Me
CH2 COO
CH 2COONa
22.
Гетерогенные процессы в системе: осадок – насыщенныйраствор
Гетерогенными называют процессы, проходящие в системах,
состоящих из нескольких фаз.
Например: газ – твердое тело; газ – жидкость; жидкость – твердое
тело.
Гетерогенные процессы в системе: осадок – насыщенный
раствор.
На границе раздела фаз м/у осадком м раствором наблюдаются
процессы: часть ионов с поверхности осадка, гидратируясь,
переходит в раствор. Гидратированные ионы, сталкиваясь с
поверхностью осадка, осаждается на нем. Когда скорость процесса
гидратации станет равной скорости осаждения, наступает
химическое равновесие. Химическое равновесие наступает когда (в
насыщенном растворе над осадком) р-р над осадком становится
насыщенным.
23.
Например: осадок CaCO3 в условиях насыщения находится всостоянии равновесия с раствором
CaCO3↔ Ca2+ + CO32Kcт=a(Ca2+) a(CO32-)/a(CaCO3);
a(CaCO3)-const;
Ksт=a(Ca2+) a(CO32-)
Ks – константа растворимости, моль/л.
ПР – произведение растворимости, моль/л
24.
Для уравнения в общем видеAB↔A++B- ; Ksт(AB)=a(A+) a(B-) бинарный
электролит.
AmBn ↔ mAn+ + nBnKsт(AmBn)=am(An+) an(Bn-) небинарный
электролит
Ksт(Ca3(PO4)2)=a3(Ca2+) a2(PO43-)
Без учета ионной силы раствора:
Ks(Ca3(PO4)2)=[Ca2+]3 [PO43-]2
25.
Правило константы растворимости (произведениярастворимости):
«При определенных условиях (температура, природа
растворителя, давление) произведение концентраций
ионов в насыщенном растворе над осадком является
величиной постоянной»
Величина Ks является характеристикой природы
труднорастворимого электролита.
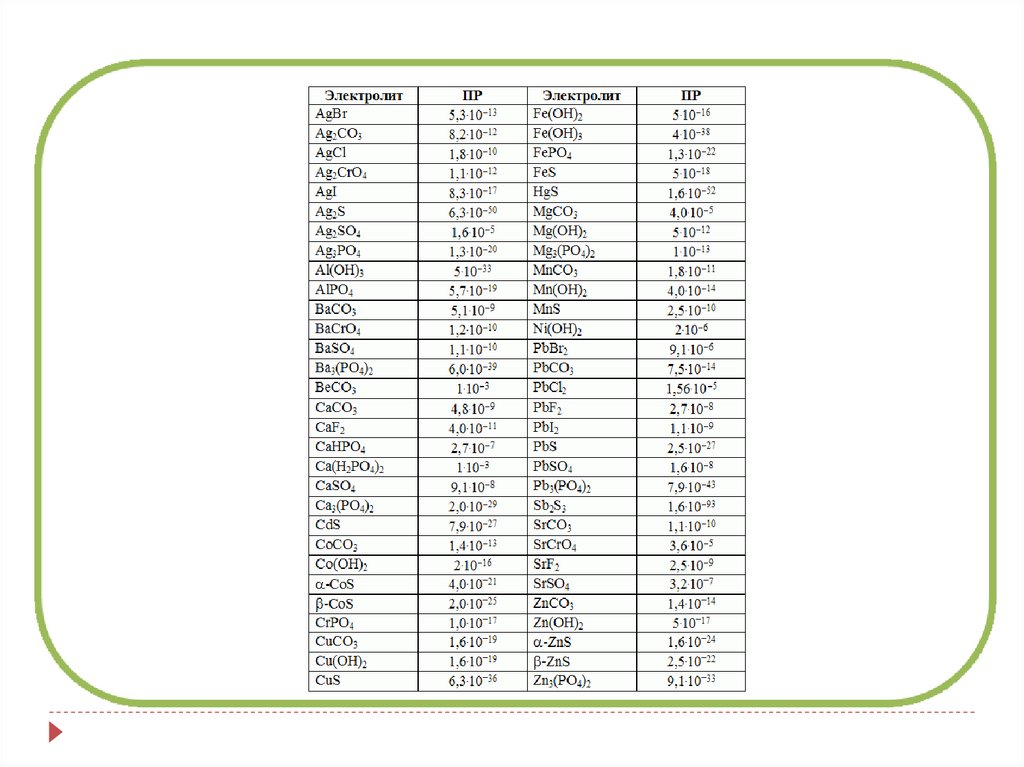
Ks – справочные величины.
По значению Ks можно сравнить растворимость
электролита, содержащего ионы одинаковой зарядности
Например: Ks(CaSO4)= 2,37 10-5 – наиболее растворим
Ks(SrSO4)= 3,2 10-7
Ks(BaSO4)= 1,1 10-10
26.
27.
Зная Ks, можно рассчитать растворимость вещества:А) для эл-та состава AB: P=√Ks(AB)
Б) для эл-та состава AmBn:
P=m+n√(Ks(AmBn))/mm nn
Например:
Ks(AgCl)=1,78 10-10
P=√Ks(AgCl)=√1,78 10-10=1,33 10-5 моль/л
Ks(Ag2CrO4)= 1,10 10-12
P=2+1√ Ks(Ag2CrO4)/22 11=3√1,10 10-12/4=6,54 10 -5
моль/л.
Для удобства расчетов используют значения
pKs=-lgKs - показатель константы растворимости.
28. Условия образования и растворения осадков
Чтобы осадок образовалсяΔG=RTln(Ks/Пс)<0, когда Пс>Кs
Раствор должен стать пересыщенным.
Чтобы осадок растворился:
Δ G=RTln(Ks/Пс)>0
Раствор над осадком должен стать ненасыщенным.
29.
Чтобы растворить осадок можно:1.разбавить р-р;
2.связать ионы в малоионизированные растворимые
соединения;
3.перевести ионы осадка в продукт, разлагающийся с
выделением газа;
4.связать ионы в комплексное соединение;
5. ионы осадка окислить или восстановить;
6.перевести ионы в другое труднорастворимое соединение;
7.ввести в раствор посторонние электролиты «солевой
эффект»;
8.измененить температурный режим;
9.заменить растворитель.
2-6 приёмы, приводящие к растворению осадка, представляют
собой конкурирующие за ион процессы. Они имеют
большое значение в биологических системах.
30.
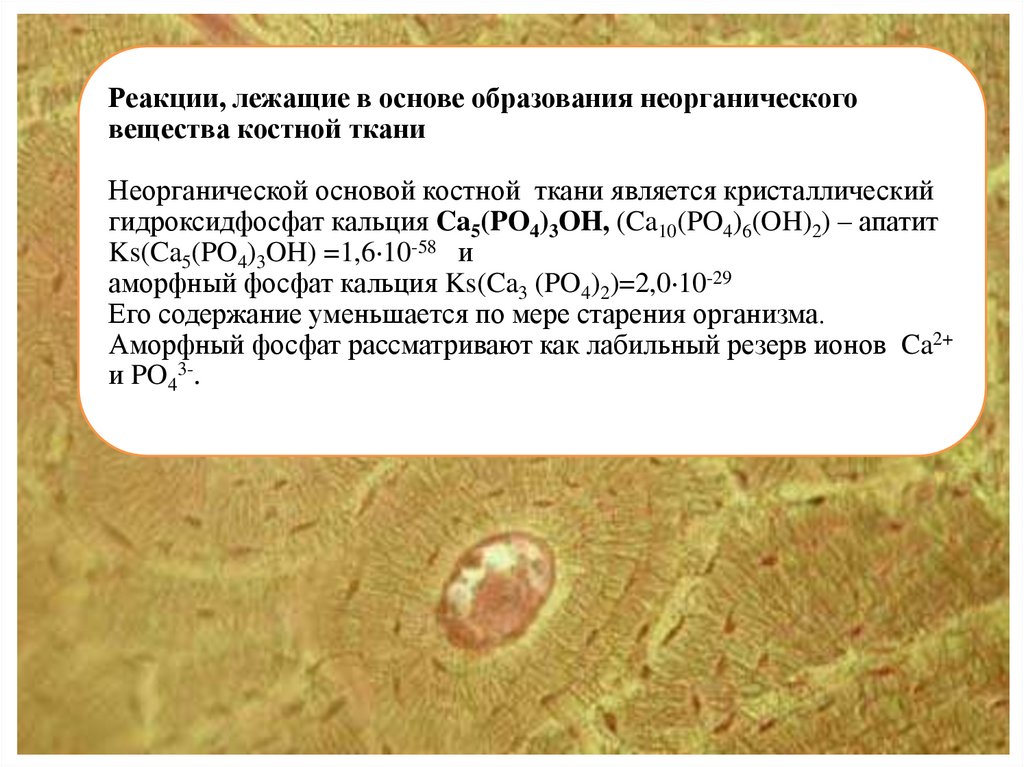
Реакции, лежащие в основе образования неорганическоговещества костной ткани
Неорганической основой костной ткани является кристаллический
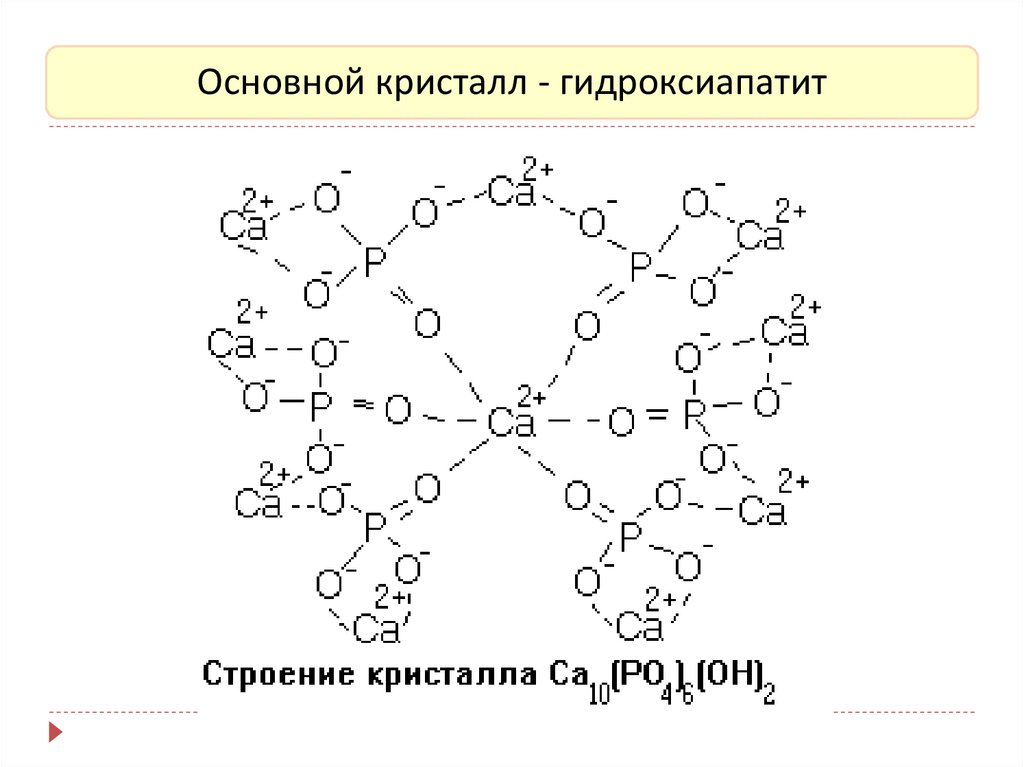
гидроксидфосфат кальция Ca5(PO4)3OH, (Ca10(PO4)6(OH)2) – апатит
Ks(Ca5(PO4)3OH) =1,6 10-58 и
аморфный фосфат кальция Ks(Ca3 (PO4)2)=2,0 10-29
Его содержание уменьшается по мере старения организма.
Аморфный фосфат рассматривают как лабильный резерв ионов Ca2+
и PO43-.
31.
Реакции находящиеся в основе образования костной ткани:Ca2++ HPO42- → CaHPO4
3CaHPO4+2OH-+Ca2+→Ca4H(PO4)3+2H2O
Ca4H(PO4)3+2OH-+Ca2+→Ca5(PO4)3OH+H2O
Неорганической основой костной ткани зубов является
фторидфосфат кальция Ca5(PO4)3F. Фторидфосфат кальция имеет
более плотную упаковку кристаллической решетки, входит в состав
эмали, что повышает ее устойчивость. Защитными факторами
костной ткани зубов является избыток в слюне Ca2+ и F- - ионов
32.
Основной кристалл - гидроксиапатит33.
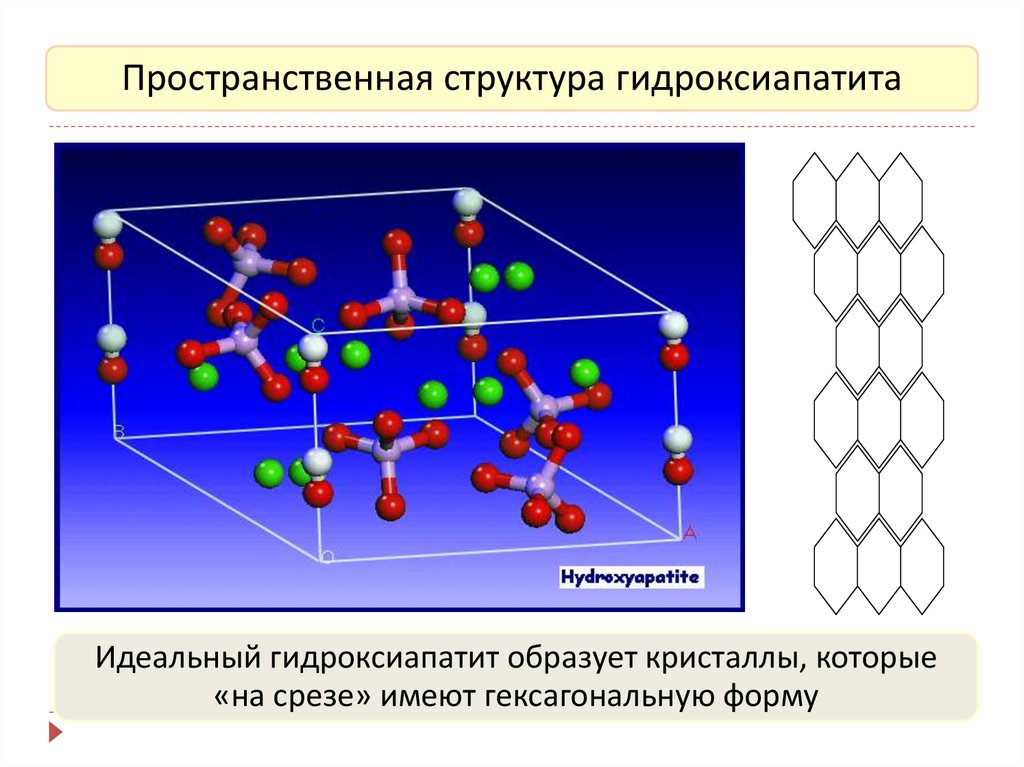
Пространственная структура гидроксиапатитаИдеальный гидроксиапатит образует кристаллы, которые
«на срезе» имеют гексагональную форму
34.
При формировании костной ткани наблюдается незначительноезамещение ионов Ca2+, PO43-, OH- на ионы Na+, K+, Mg2+, Sr2+, Cl-.
Явление замещения частиц одного компонента в узлах
кристаллической решетки частицами другого соединения называют
изоморфизмом.
Изоморфизм
характерен
для
соединений
с
аналогичной
кристаллической структурой, имеющих близкие значения размеров
радиусов, с аналогичным типом химической связи и поляризационными
свойствами.
35.
Минеральный состав костной тканиТкань
Химические элементы
(в % от сухой массы)
Са2+
РО43-
Mg2+
К+
Na+
Cl-
Эмаль
32-39
16-18
0,25-0,56
0,05-0,3
0,25-0,9
0,2-0,3
Дентин
26-28
12-13
0,8-1,0
0,02-0,04
0,6-0,8
0,3-0,5
Цемент
21-24
10-12
0,4-0,7
0,15-0,2
0,6-0,8
0,03-0,08
Кость
22-24
11
0,3
0,2
0,8
0,01
36. Механизм функционирования кальциевого буфера.
Ионы кальция: являются фактором свёртывания крови, участвуют впроцессах мышечного сокращения, регулируют проницаемость мембран,
активируют действие некоторых ферментов (например амилаза слюны) ….
Уровень ионов кальция в сыворотке крови в норме составляет: (общий)
2,23-2,57 ммоль/л.
Поддержание концентрации ионов кальция обеспечивается за счёт
системы: костная ткань – плазма крови, которую рассматривают как
кальциевый буфер.
37. Механизм функционирования кальциевого буфера.
При недостатке ионов кальция в плазме крови происходитчастичное растворение аморфного фосфата кальция или
гидроксидфосфата кальция, что приводит к поддержанию
концентрации Ca2+ на постоянном уровне.
Регулируется гормонально (паратгормон →резорбция костной
ткани; кальцитонин→минерализация).
Нарушение регуляции концентрации ионов кальция приводит
к гипо- и гиперкальциемии.
При гиперкальциемии может наблюдаться кальцификация
сосудов (при избыточном поступлении витамина Д3).
38. Реакции, лежащие в основе образования конкрементов
Причиной возникновениямочекаменной
болезни
могут
служить:
дегидратация
с
уменьшением
диуреза,
отклонение
рН
от
слабокислой реакции (рН
5,5 – 6,0) нарушение
экскреции с мочой ионов
кальция, щавелевой(Н2С2О4)
и
мочевой
кислоты,
фосфатов, индукторов и
ингибиторов
растворимости
и
кристаллизации солей.
воспаления)
39. Реакции, лежащие в основе образования конкрементов
Оксалурия – в моче преобладаютсоли и кристаллы оксалата кальция и
аммония(СаС2О4; (NH4)2С2О4). Может
возникать из-за низкого содержания
Мg2+ в воде.
Уратурия
–
повышенное
содержание в моче мочевой кислоты
и её солей (урат натрия, урат
аммония).
Наблюдается
при
закислении мочи рН<5.
Фосфатурия – выпадение в осадок
фосфатов кальция, магния и аммония
(Наблюдается при ощелачивании
мочи)































 chemistry
chemistry








