Similar presentations:
Лигандообменные процессы и равновесия. Гетерогенные процессы и равновесия
1.
Федеральное государственное бюджетное образовательноеучреждение высшего образования
«Кемеровский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
(ФГБОУ ВО КемГМУ Минздрава России)
Кафедра фармацевтической и общей химии
ХИМИЯ
Лигандообменные процессы и равновесия.
Гетерогенные процессы и равновесия.
Редокс-равновесие и редокс-процессы
Пинчук Людмила Григорьевна
д-р с.-х. наук, профессор
2024
2.
ПЛАН ЛЕКЦИИ1.Комплексные соединений; строении,
классификация, номенклатура.
2. Диссоциация комплексных соединений,
константы нестойкости и устойчивости.
3. Металло-лигандный гомеостаз,
биологическое значение.
4.Окислительно-восстановительные реакции,
классификация, электродный потенциал,
уравнения Нернста и Петерса.
5.Редокс-буферные системы организма,
механизме действия, биологическая роль.
3.
I. Комплексные соединения - наличиековалентной связи, образованной по
донорно-акцепторному механизму.
Координационная теория Вернера:
1. Комплексообразователь положительно заряженный ион (металл),
занимающий
центральное место в комплексном
соединении.
2. Лиганды – ионы противоположного
знака или нейтральные молекулы,
расположенные (координированы), вокруг
комплексообразователя
4.
3. Внутренняя сфера комплексообразователь и лиганды.4. Внешняя сфера - ионы, не
вошедшие во внутреннюю сферу, в
формуле, отделяется от внешней
квадратными скобками K3[Fe(CN)6].
5. Координационное число (к.ч.) –
число химических связей
комплексообразователя с лигандами
5.
Для написания формулукомплексного соединения
необходимо знатьзнать:
1) заряд (степень окисления)
комплексообразователя;
2) заряд лигандов;
3) координационное число;
4) ионы внешней сферы
6.
Важнейшие лиганды:а) нейтральные молекулы,
имеющие дипольный
характер: Н2О, NH3 , NO ,
CO и др.
б) ионы
2CN , NO , CI , Br , I , OH
и др.
7.
Дентатность - числохимических связей лиганда с
комплексообразователем.
Монодентатные лиганды занимают во внутренней сфере
одно место (CN-, NO2- , NH3)
Полидентатные - два, три и
более мест.
(СO3)2- , (SO4)2- - бидентатные)
8.
Заряд комплексного ионаравен сумме зарядов
комплексообразователя и
лигандов.
Заряд комплексного
соединения, не имеющего
внешней сферы равен нулю:
[Pt(NH3)2CI4]
9.
Классификация иноменклатура комплексных
соединений
По характеру электрического
заряда:
- Катионные
- Анионные
- Нейтральные
10.
Катионный комплекс. Номенклатура• Анион внешней сферы,
• Число лигандов: 2 - ди, 3 - три, 4 - тетра, 5 пента, 6 – гекса и т.д..
• Название лиганда: CN- - циано,
NO2- нитро, С1- - хлоро, ОН- - гидроксо, Н- гидридо, S2- - тио, SCN- - родано, С2О42- оксолато, Н2О - акво, NH3 - амин, СО –
карбонил и др.
Начинается с названия катиона
отрицательного лиганда с прибавлением
буквы «о», затем нейтральные молекулы.
•Название комплексообразователя
11.
[Al(H2O)6]3+Cl3хлорид гексааквоалюминия
(III);
[Zn(NH3)4]2+Cl2
хлорид тетраамминцинка
(II).
12.
Анионный комплексназывается аналогично названию
катиона, но с суффикса «ат» в
латинском названии
комплексообразователя, в скобках
указывают его степень окисления.
Na[Al(OH)4]
тетрагидроксоалюминат (III) натрия;
К[Ag(CN)2]
дицианоаргентат (I) калия
13.
Нейтральный комплекс - комплексынеэлектролитов. Нет внешней
сферы.
Название: из названий лигандов и
русских названий центральных
атомов в им. падеже, без степени
окисления комплексообразователя.
[Cr(C6H6)2] – Дибензолхром;
[Pt(NH3)2Сl4] –
Тетрахлородиаминплатина
14.
По природе лиганда:- Аквакомплексы
- Аминокомплексы
- Гидроксокомплексы
- Галогеносодержащие
- Смешанные.
По кислотно- основным свойствам:
- Кислоты
- Основания
- Соли
15.
II. Диссоциация комплексных соединенийв водных растворах:
Первичная диссоциация - катионные и
анионные комплексы распадаются на
комплексный ион и ионы внешней сферы,
практически полностью, т.к. соединены
ионной связью:
К3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
Вторичная диссоциация - обратимый распад
внутренней сферы (комплексного иона):
[Fe(CN)6]3-
↔ Fe3+ + 6 CNКомплексные соединения неэлектролитов
не диссоциируют, их молекулы гидратируются
16.
По закону действующих масс:17.
Константа нестойкостиКонстанта устойчивости величина, обратная константе
нестойкости
18.
19.
20.
Гетерогенные процессы иравновесие
2+
Часть ионов Ca замещены
ионами Mg2+, незначительная
–
часть ионов OH замещена
–
ионами фтора F ,
повышающих прочность
кости
21.
Изменение рН, концентрации ионовСа2+ или и комплексообразующих
соединений приводит к отложению
или растворению минеральных
компонентов клеток костной ткани.
Увеличении концентрации ионов Са2+
в плазме крови смещает равновесия,
в сторону отложения кальция в
костной ткани, снижение растворению её минеральных
компонентов
22.
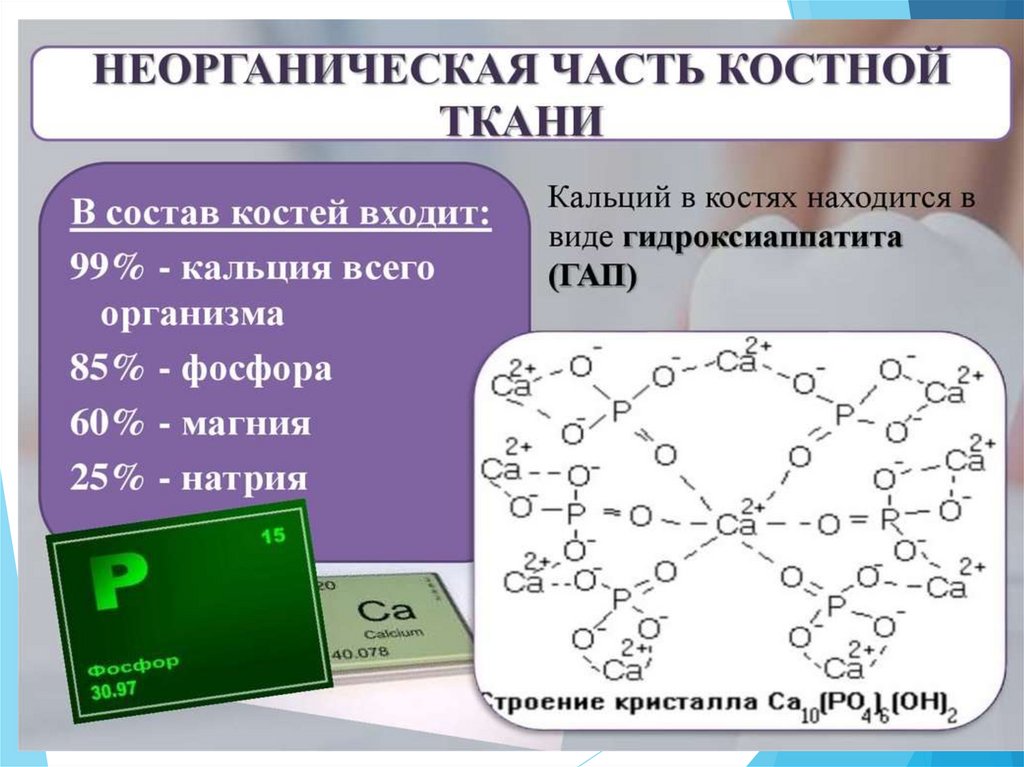
В состав костной ткани входят и другиенеорганические минералы:
CaНPO4 ∙ 2H2O - гидрофосфат кальция
(брушит);
Ca5(PO4)3F - фторапатит (в составе
зубной эмали);
Ca10(PO4)6(СO3) – карбонапатит;
Ca8H2 (PO4)6 ∙ 5H2O - октакальция
фосфат;
Mg10(PO4)6(OH)2 –
дигидроксигексафосфат магния;
Ca3(PO4)2 – аморфный фосфат кальция.
23.
Замещение кальция на бериллий(бериллоз или бериллиевый рахит),
стронций, барий в организме изоморфизм (конкуренция катионов
за анион) образуются менее
растворимые соединения:
Be5(PO4)3OH,
Sr5(PO4)3OH
Bа5(PO4)3OH
24.
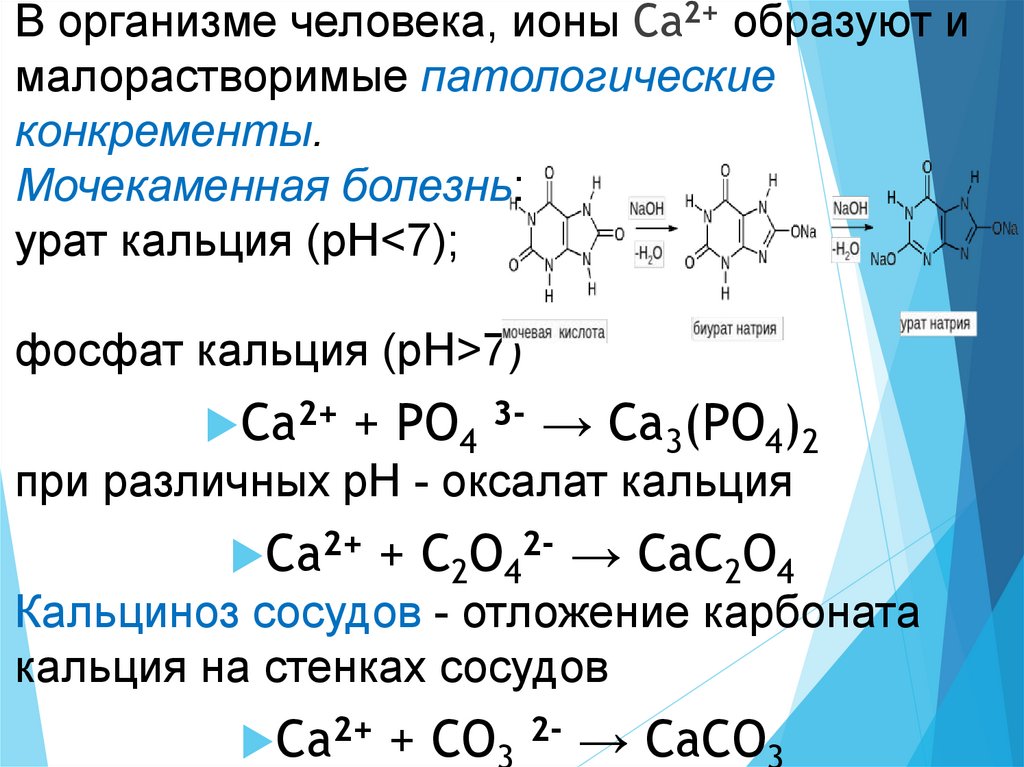
В организме человека, ионы Са2+ образуют ималорастворимые патологические
конкременты.
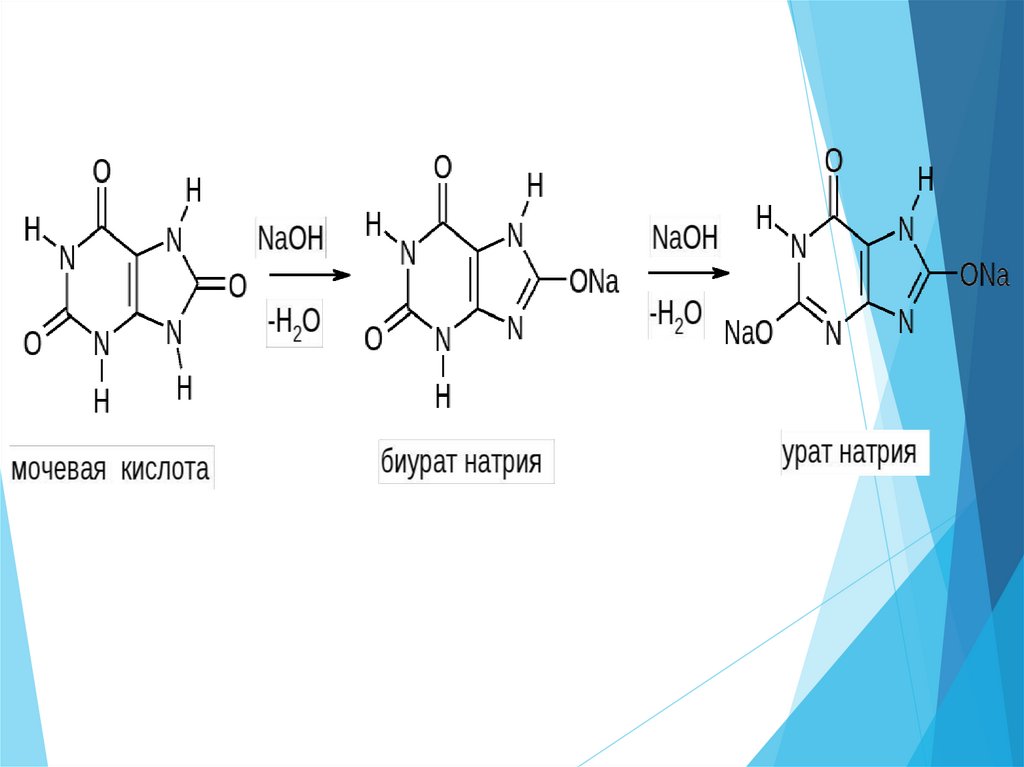
Мочекаменная болезнь:
урат кальция (рН<7);
фосфат кальция (рН>7)
Са2+ + РО4 3- → Са3(РО4)2
при различных рН - оксалат кальция
Са2+ + С2О42- → СаС2О4
Кальциноз сосудов - отложение карбоната
кальция на стенках сосудов
Са2+ + СО 2- → СаСО
25.
26.
27.
28.
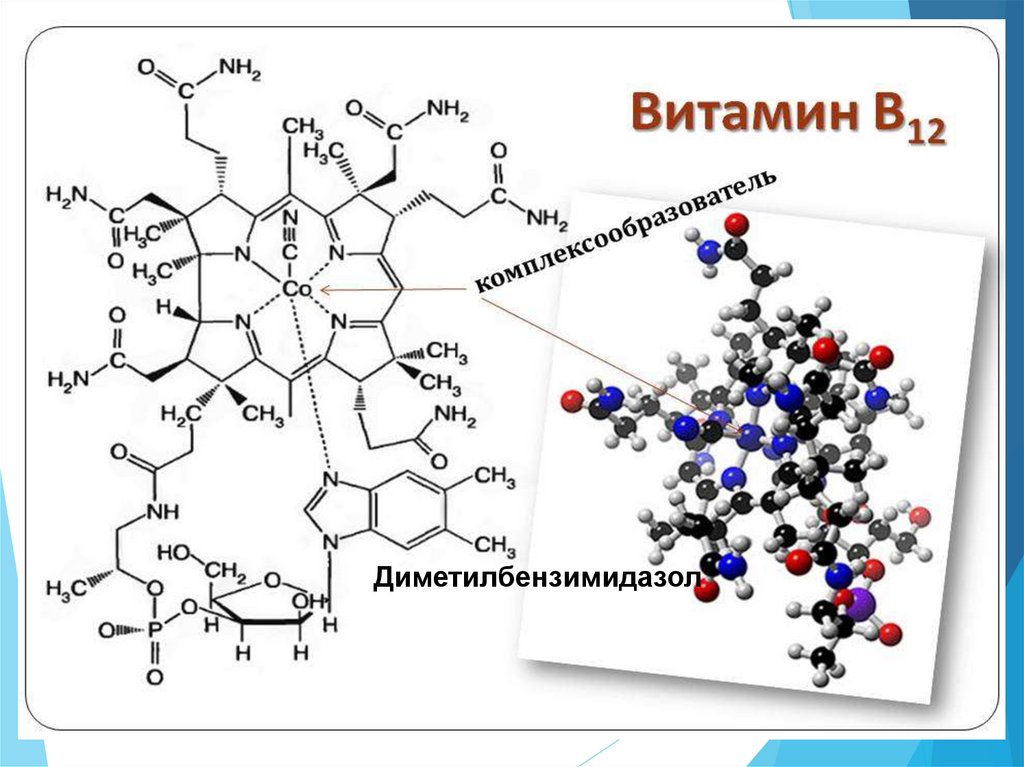
Диметилбензимидазол29.
III. Металло-лигандный гомеостазКонкурирующие процессы, со смещением
лигандообменного равновесия: конкуренция
между лигандами за ион металла, между
ионами металла за лиганд. Преобладает
процесс образования наиболее прочного
комплекса.
Причины нарушения
- Несбалансированное поступления элементов;
- Поступление в организм ионов токсикантов
(Be, Не, Cd, Те, Pb, Sr и др.).
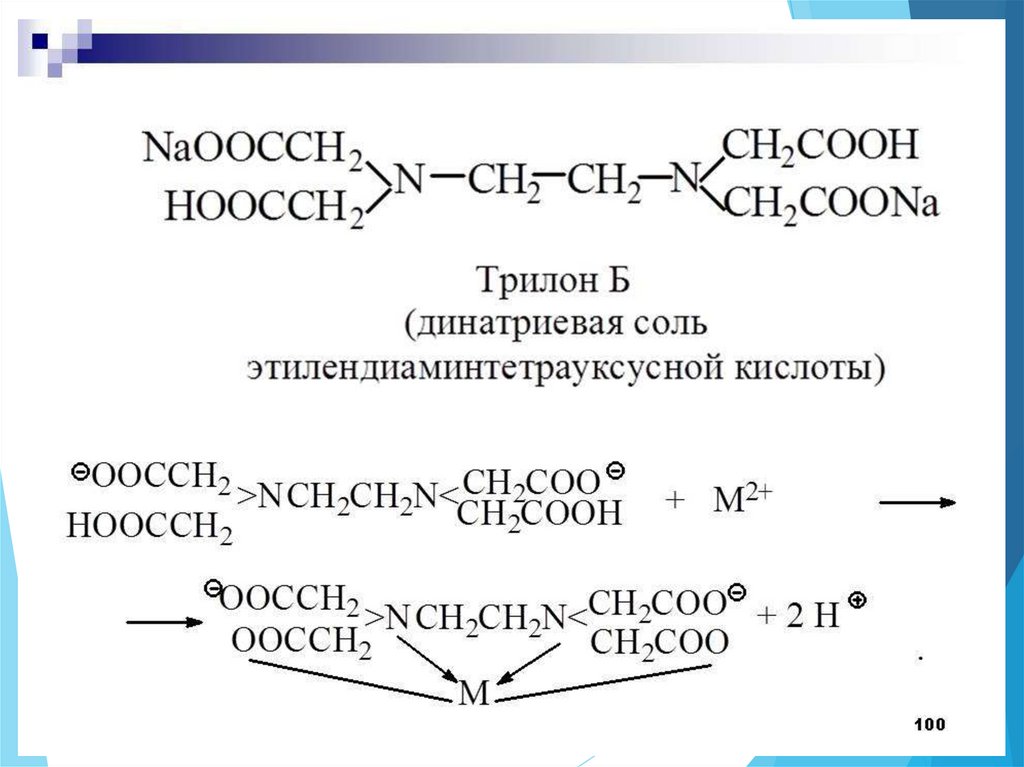
Хелатотерапия (комплексонотерапия) –
выведение токсичных ионов из организма,
путем связывания их в комплексы
30.
IV. Окислительновосстановительныереакции - протекающие с
изменением степени
окисления атомов
реагирующих веществ
31.
Классификация окислительновосстановительных реакций1) Межмолекулярные изменение степени окисления
атомов в разных молекулах:
2Na0 + 2H+2O = 2Na+OH + H20;
2N+4O2 + O20 + H2O = 4HN+5O3-2
32.
2) Внутримолекулярные изменение степени окисленияразных атомов в одной и той же
молекуле (термическое
разложение).
+5
-2
+3
0
2NaN O3
= 2NaN O2 + O2 ;
2КС1+5О3-2 = 2КС1-1 + 3О20
33.
3) Диспропорционирования изменение степени окисленияатомов одного и того же
элемента.
+6
+7
3К2Mn O4 + 2H2O = 2KMn O4 +
+4
Mn O2 + 4KOH;
3NaCl+1O = NaCl+5O3 + 2NaCl-1
3HN+3O2 = HN+5O3 + 2N+2O + H2O
34.
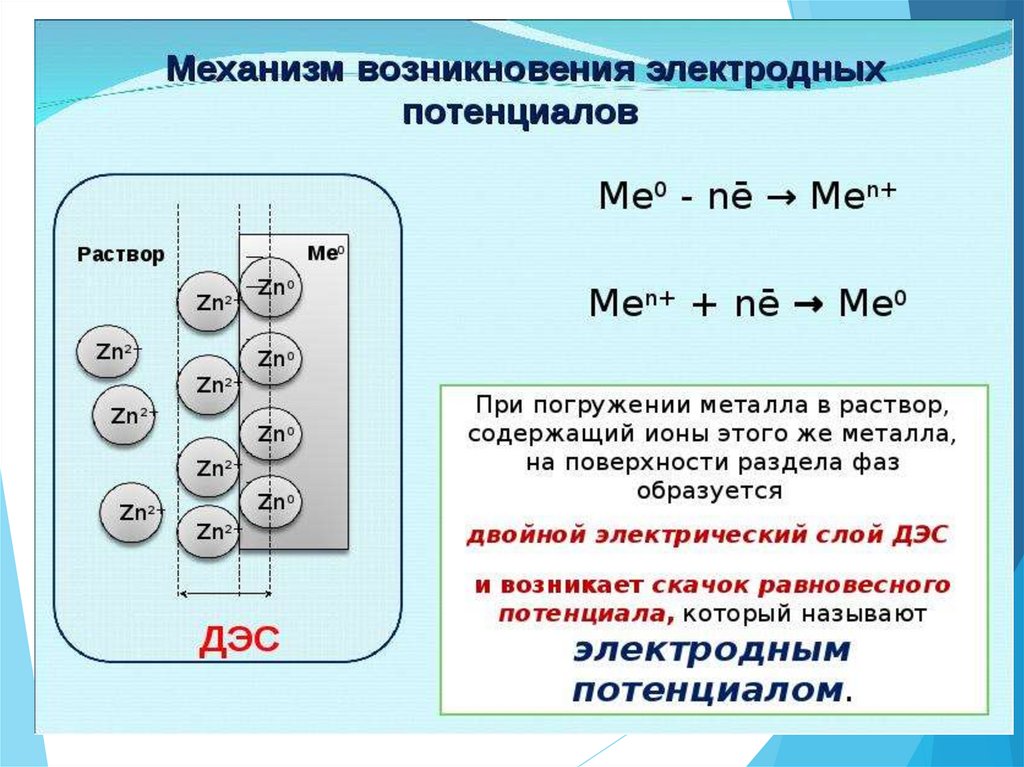
Редокс-потенциал количественнаяхарактеристика окислительновосстановительной системы разность потенциалов,
возникающий на границе раздела
фаз металл – водный раствор,
содержащий редокс-систему.
Измеряется в вольтах (В) и
рассчитывается по уравнению
Нернста-Петерса:
35.
E - электродный потенциал, вольт;Ео - стандартный электродный потенциал,
вольт;
R - универсальная газовая постоянная, 8,314
Дж/(моль·K);
T - абсолютная температура;
F - постоянная Фарадея, 96485,33 Кл·моль−1;
N - число электронов, участвующих в процессе;
a Ox; a Red - активности соответственно
окисленной и восстановленной форм вещества,
участвующего в полуреакции
36.
37.
Стандартный электродный потенциалЕо – потенциал, возникающий на границе
металл раствор при:
активности катиона металла в растворе
1 моль/л,
Т - 298 оК (25оС+273 оК),
Р = 1 атм (101 кПа), рН = 7,0.
Чем больше значение редокс-потенциала
редокс-системы, тем выше её
окислительная способность, т.е. тем
сильнее окислитель и слабее
сопряжённый ему восстановитель
38.
Для определения направлениясамопроизвольного протекания
редокс-процесса необходимо
сравнить редокс-потенциалы двух
редокс-систем. Окисленная форма
той редокс-системы, потенциал
которой больше, и будет выполнять
роль окислителя в данном процессе
39.
40.
Редокс - буферные системыорганизма поддерживают величину
редокс – потенциала, за счет
сохранения баланса концентраций
окислителей и восстановителей.
Нарушение приводит к патологии
(Сильные окислители: соединения
хрома и марганца в высших степенях
окисления - хроматы, дихроматы,
перманганаты)
41.
Токсическое действиеоксидов азота и нитратов,
восстанавливающихся в
организме до нитритов:
3+
2 NO + 2H + 2e → NO + Н2О
(Образование метгемоглобина,
нитрозаминов при
взаимодействии с вторичными
аминами)
42.
БЛАГОДАРЮЗА ВНИМАНИЕ!



































 chemistry
chemistry