Similar presentations:
Комплексные соединения
1. лекция 12. Комплексные соединения
2. КС– это такие соединения, в узлах кристаллической решётки которых находятся комплексы или комплексные ионы, способные к
Чугаев Л.А.Комплексные соединения (КС) – это продукт
сочетания простых соединений, способных
к самостоятельному существованию
КС– это такие соединения, в узлах
кристаллической решётки которых
находятся комплексы или комплексные
ионы, способные к самостоятельному
существованию
3. Примеры реакций комплексообразования
• HgI2 + 2KI = K2[HgI4]• KF + BF3 = K[BF4]
• Al(OH)3+ NaOH = Na[Al(OH)4]
• AgCl + 2NH3=[Ag(NH3)2]Cl
4.
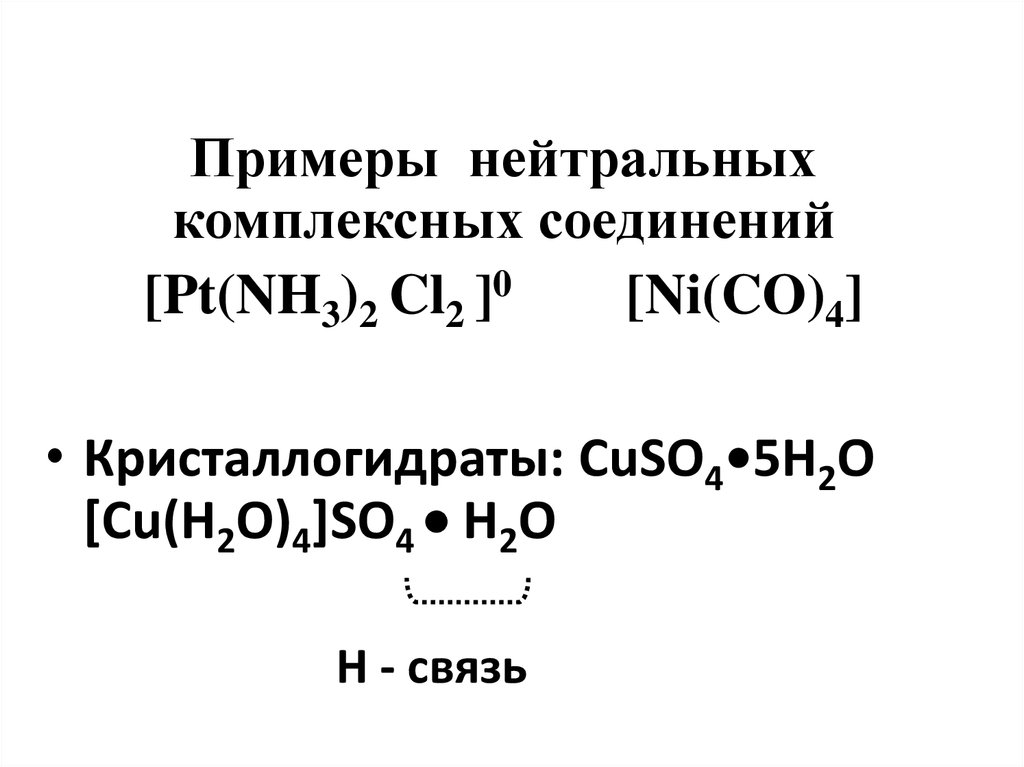
Примеры нейтральныхкомплексных соединений
[Pt(NH3)2 Cl2 ]0
[Ni(CO)4]
• Кристаллогидраты: CuSO4•5H2O
[Cu(H2O)4]SO4 Н2О
Н - связь
5.
АльфредВернер
Швейцарский химик,
1893г
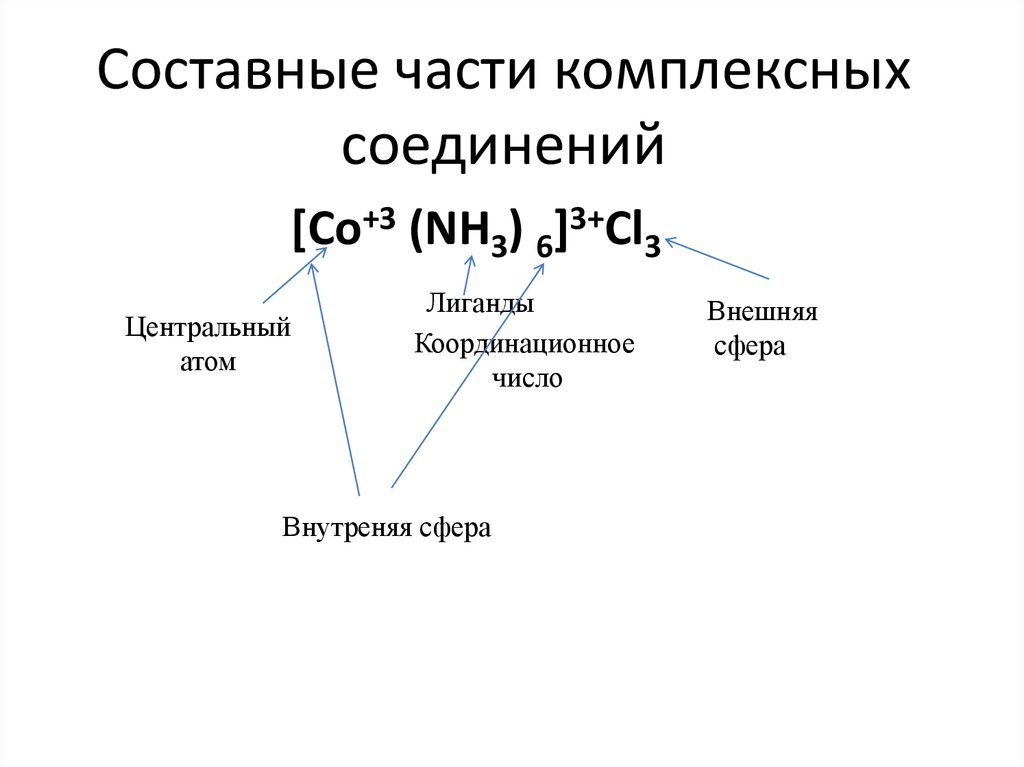
6. Составные части комплексных соединений
[Co+3 (NH3) 6]3+Cl3Центральный
атом
Лиганды
Координационное
число
Внутреняя сфера
Внешняя
сфера
7. Характеристика центрального атома
Комплексообразующая способностьэлементов
f >d>p>s
8. Важнейшие характеристики центрального атома :
• Степень окисления• Координационное число
• Ионный потенциал
9.
Степень окисленияПоложительная
K3[Fe3+(CN)6], K4[Fe2+(CN)6],
Cs[Xe+6F7], К[BF4]
Отрицательная
[N -3H4 ] Cl
Нулевая
[Cl2(H2O)4]
10. Координационное число (КЧ)
Это число атомов или группатомов, непосредственно
связанных с центральным
атомом
11. - от размеров центрального атома и лигандов.
КЧ зависит:- от размеров центрального
атома и лигандов.
Лат. liganda -то, что должно быть связано
12. Na[BF4] Na3[AlF6]
FF-
FF
F
F-
F
F
FF
B3+
F-
FF
rB3+ = 0,02 нм
FAl3+
F
F-
F
FF
F-
rAl3+ = 0,057 нм
13. Na3[AlF6] Na [AlCl4]
lF
F-
l
Cl-
Cl-
F-
F
l
F-
F
Al3+
F-
F
Al3+
F- F-
F
F
rF_ = 0,133 нм
l
Cl-
Cl-
rCl- = 0,181 нм
14. - от степени окисления центрального атома:
СтепеньКЧ
окисления ц.а. (подчеркнуто
характерное)
Примеры
+1
2, 3
[Ag(NH3)2]Cl
+2
3, 4, 6
[Cu(NH3)4]Cl2
+3
4, 5, 6
Na3[Co(NO2)6]
+4
6, 8
H2[SnCl6]
15.
Эмпирическое правило:К.ч. устойчивого
комплекса, как правило, в
два раза больше степени
окисления ц.а.
КЧ = 2Z
16. Al(OH)3 + NaOH= Na[Al(OH)4]
- концентрации исходныхкомпонентов :
Al(OH)3 + NaOH= Na[Al(OH)4]
Al(OH)3 +3 NaOH= Na3[Al(OH)6]
17. Характеристика лигандов
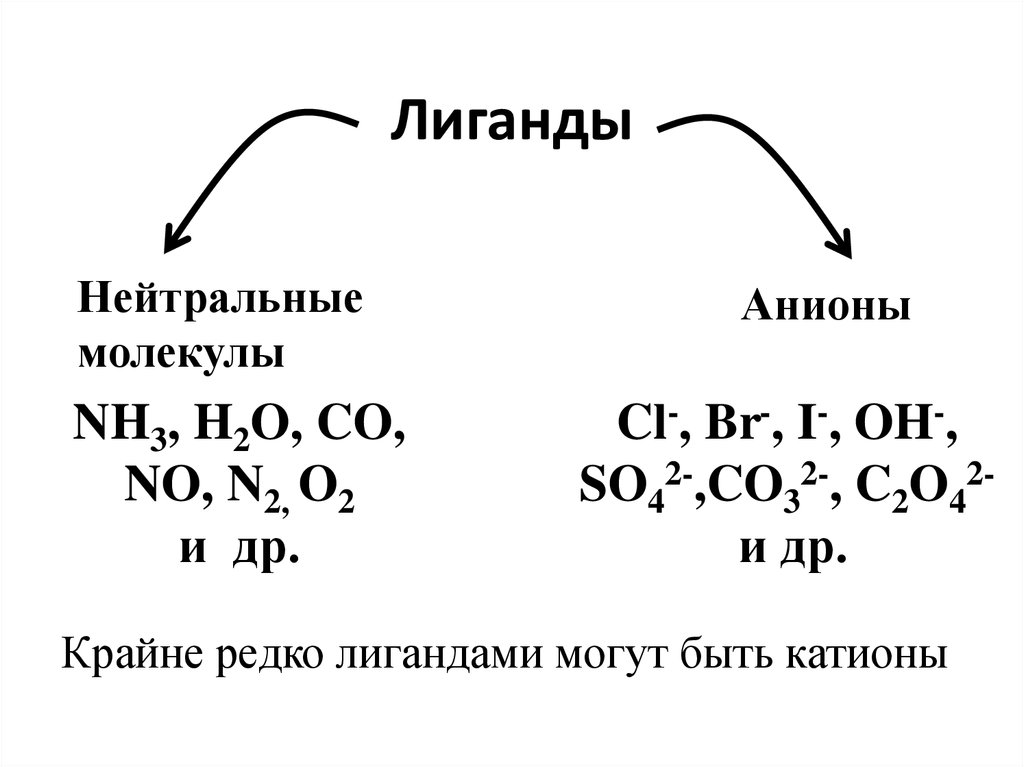
18. Лиганды
Нейтральныемолекулы
NH3, H2O, CO,
NO, N2, O2
и др.
Анионы
Cl-, Br-, I-, OH-,
SO42-,CO32-, C2O42и др.
Крайне редко лигандами могут быть катионы
19.
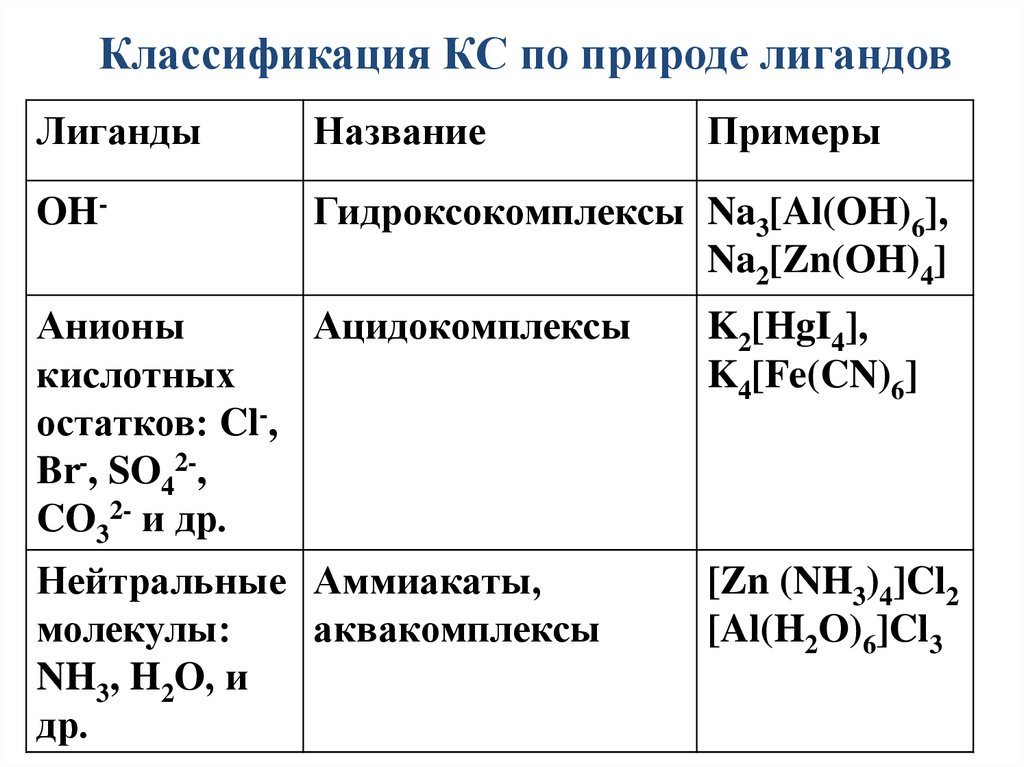
Классификация КС по природе лигандовЛиганды
Название
Примеры
OH-
Гидроксокомплексы Na3[Al(OH)6],
Na2[Zn(OH)4]
Анионы
Ацидокомплексы
кислотных
остатков: Cl-,
Br-, SO42-,
CO32- и др.
K2[HgI4],
K4[Fe(CN)6]
Нейтральные Аммиакаты,
молекулы:
аквакомплексы
NH3, H2O, и
др.
[Zn (NH3)4]Cl2
[Al(H2O)6]Cl3
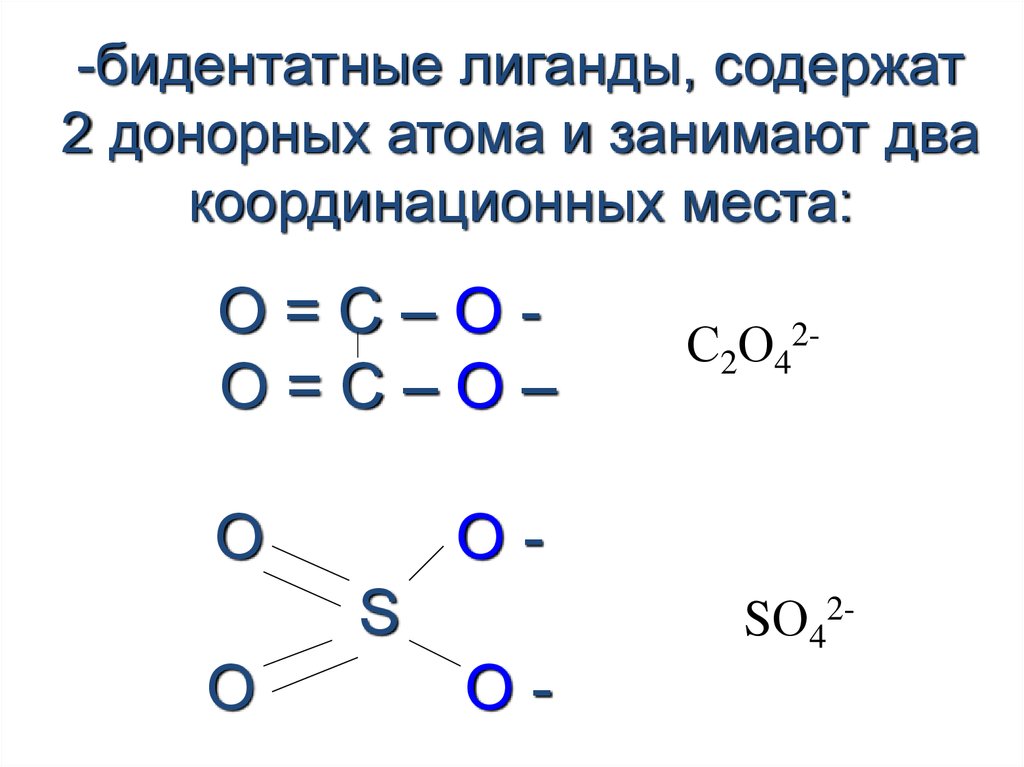
20. -монодентатные лиганды, содержат 1 донорный атом (H2 O, NH3, OH-, Cl-, Br-)
Число донорных атомов в лигандехарактеризует его координационную ёмкость –
дентатность
Лат. dentalus – имеющий зубы
-монодентатные лиганды,
содержат 1 донорный атом
(H2 O, NH3, OH , Cl , Br )
21.
-бидентатные лиганды, содержат2 донорных атома и занимают два
координационных места:
О=С–ОО=С–О–
O
OS
O
С2О42-
SО42-
O-
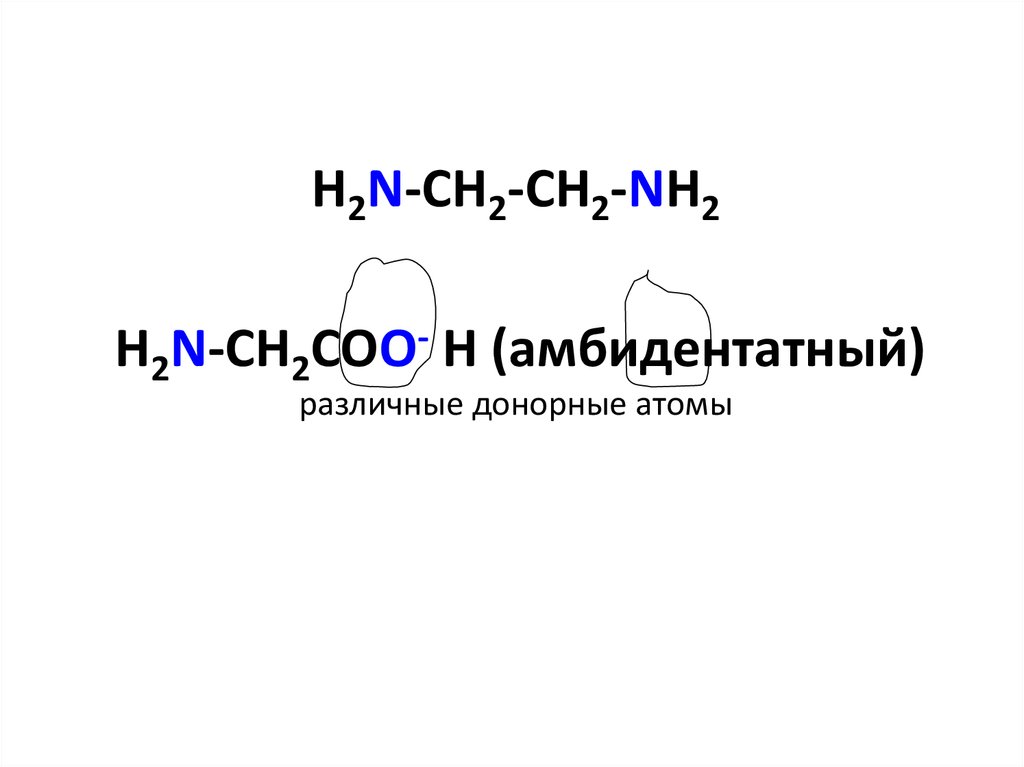
22. H2N-CH2-CH2-NH2 H2N-CH2COO- H (амбидентатный) различные донорные атомы
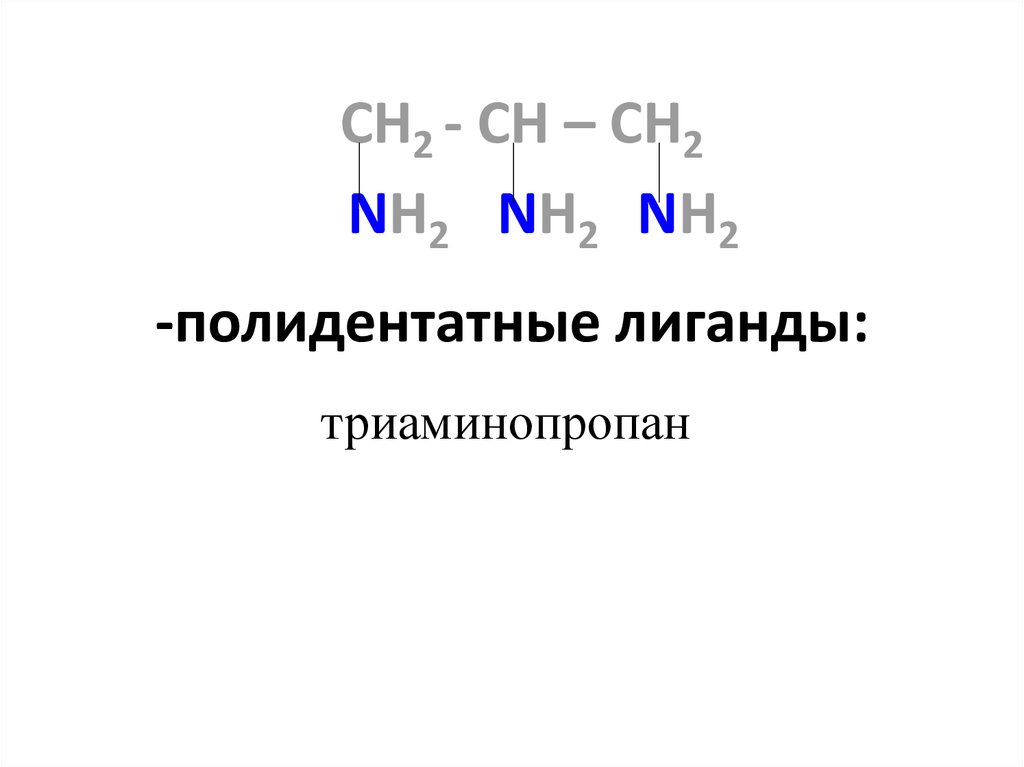
23. -полидентатные лиганды:
СН2 - СH – CH2NH2 NH2 NH2
-полидентатные лиганды:
триаминопропан
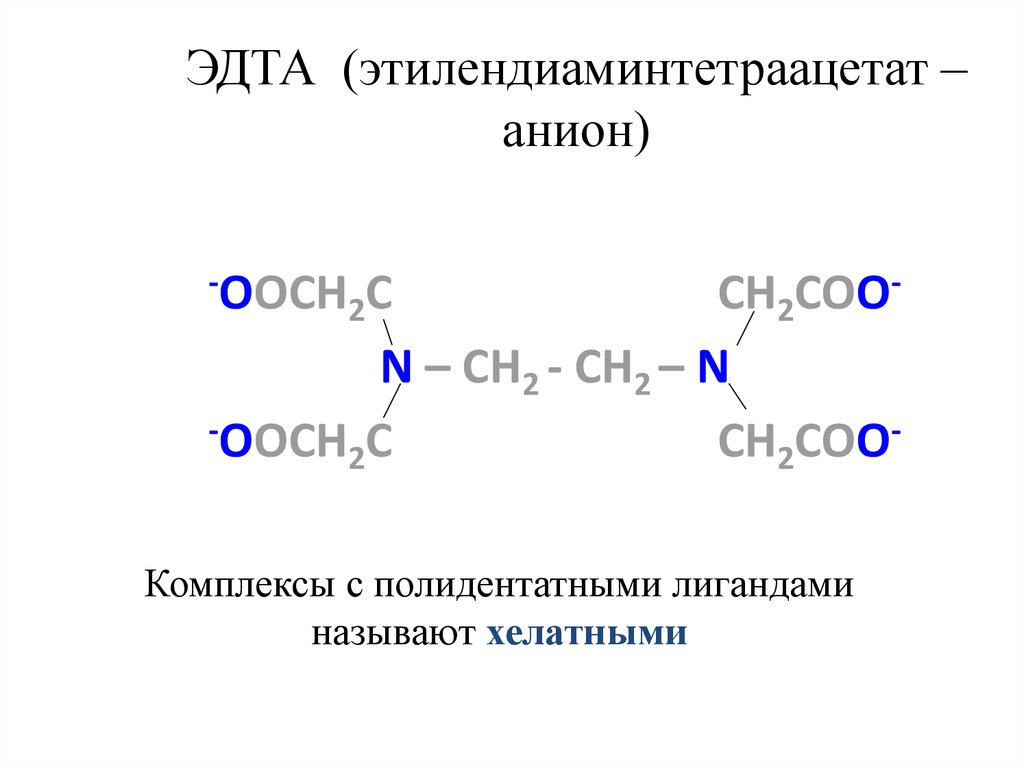
24. ЭДТА (этилендиаминтетраацетат –анион)
ЭДТА (этилендиаминтетраацетат –анион)
-OOCH C
2
CH2COON – CH2 - CH2 – N
-OOCH C
CH
COO
2
2
Комплексы с полидентатными лигандами
называют хелатными
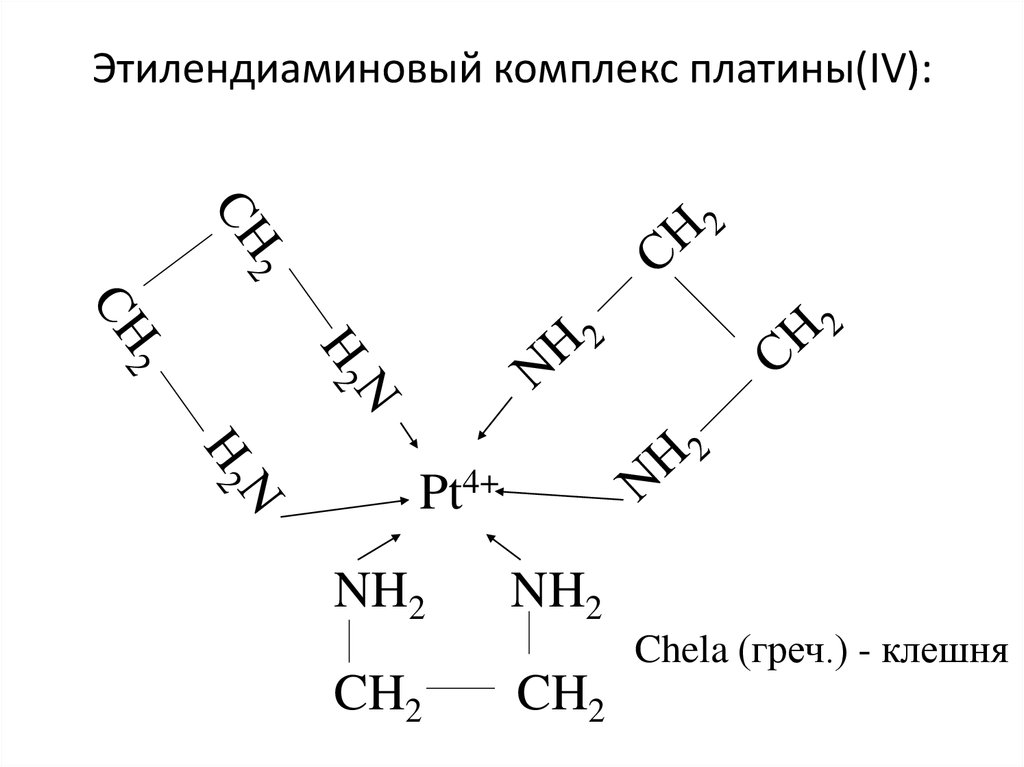
25. Этилендиаминовый комплекс платины(IV):
Pt4+NH2
NH2
Chela (греч.) - клешня
CH2
CH2
26. Природа химической связи в комплексных соединениях
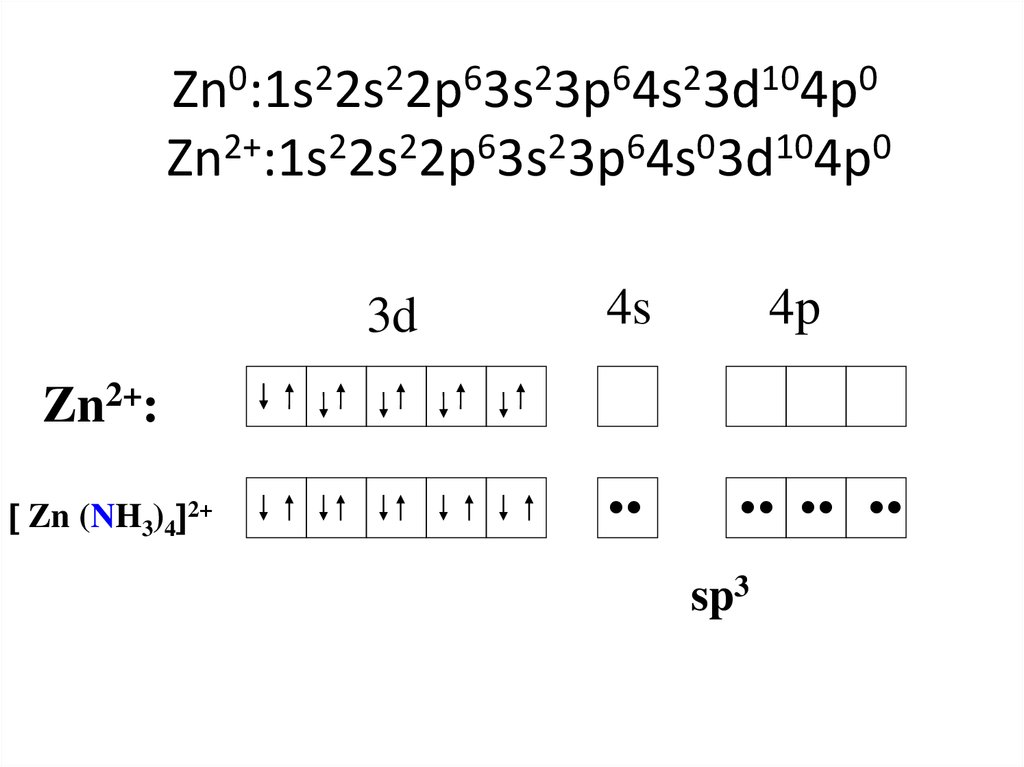
27. Zn2+ + 4 NH3 [Zn(NH3)4]2+
Zn2+ + 4 NH3 [Zn(NH3)4]2+28. Zn0:1s22s22p63s23p64s23d104p0 Zn2+:1s22s22p63s23p64s03d104p0
3d4s
4p
Zn2+:
Zn (NH3)4 2+
•
•• •• •
sp3
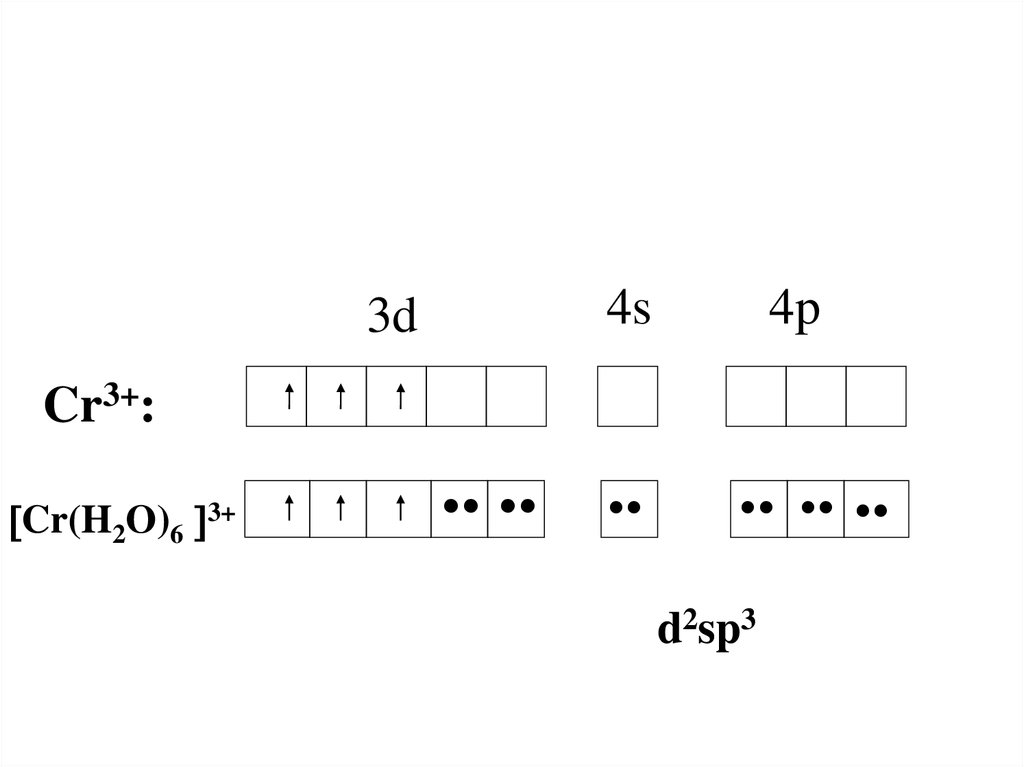
29.
4s3d
4p
Cr3+:
Cr(H2O)6 3+
•• •
•
•• •• •
d2sp3
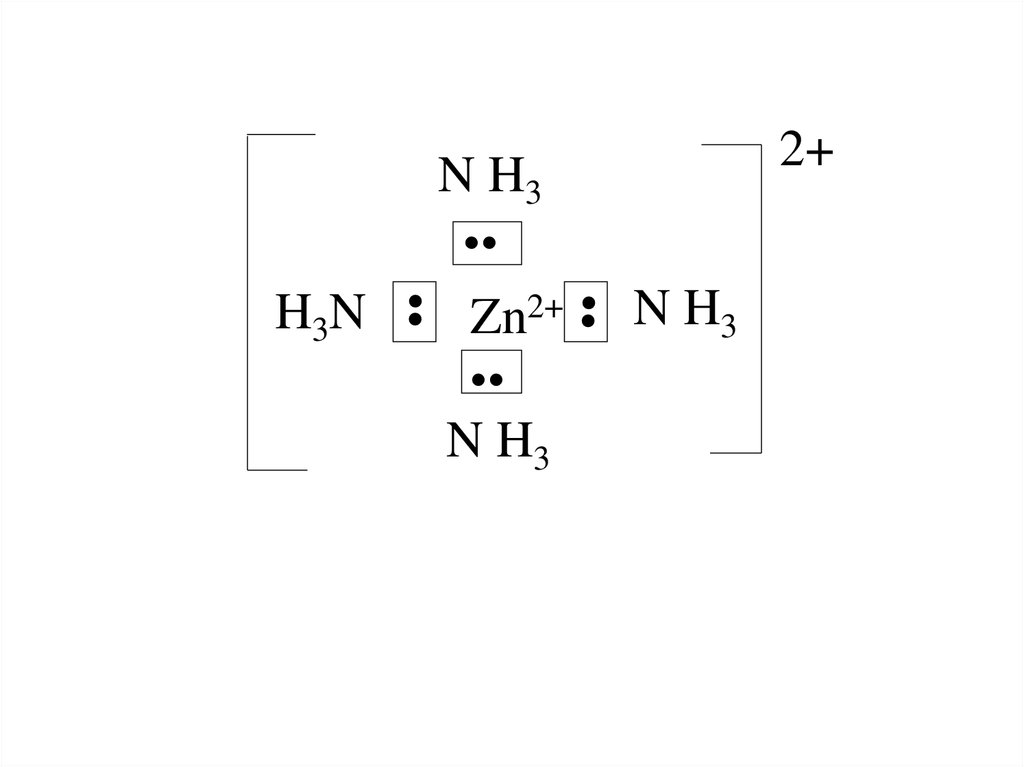
30.
H3NN H3
•
Zn2+
•
N H3
2+
N H3
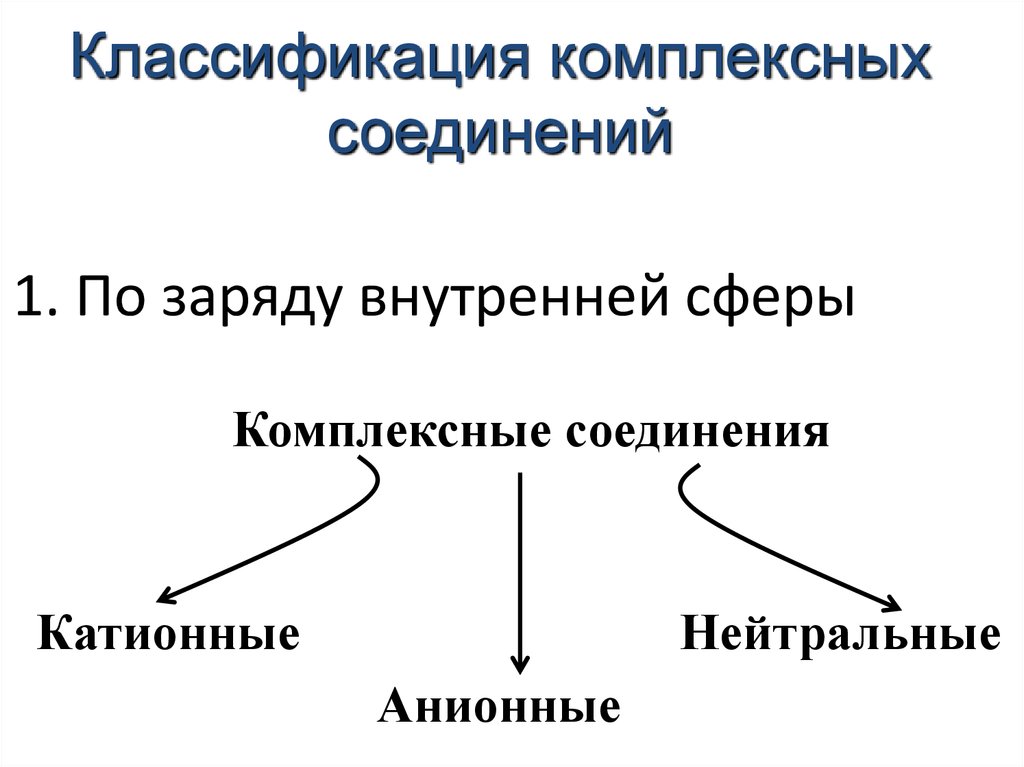
31. 1. По заряду внутренней сферы
Классификация комплексныхсоединений
1. По заряду внутренней сферы
Комплексные соединения
Катионные
Нейтральные
Анионные
32. [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6]
2+[Cu(NH3)4]SO4
+
[Co(NH3)4Cl2]Cl
[Fe(CO)5
0
]
Na3[Co(NO2)6]
3-
[Pt(NH3)2Cl2]
K3 [Fe(CN) 6]
0
3-
33. 2. По природе лиганда:
Гидроксокомплексы ( ОН-)
Аквакомплексы (Н2О)
Аммиакатные комплексы (NH3)
Ацидокомплексы ( CN- - циано, CNS—
родано, NO2- - нитро, Сl- - хлоро, SO42–
сульфато и т.д.)
• Карбонильные (СО)
• И др.
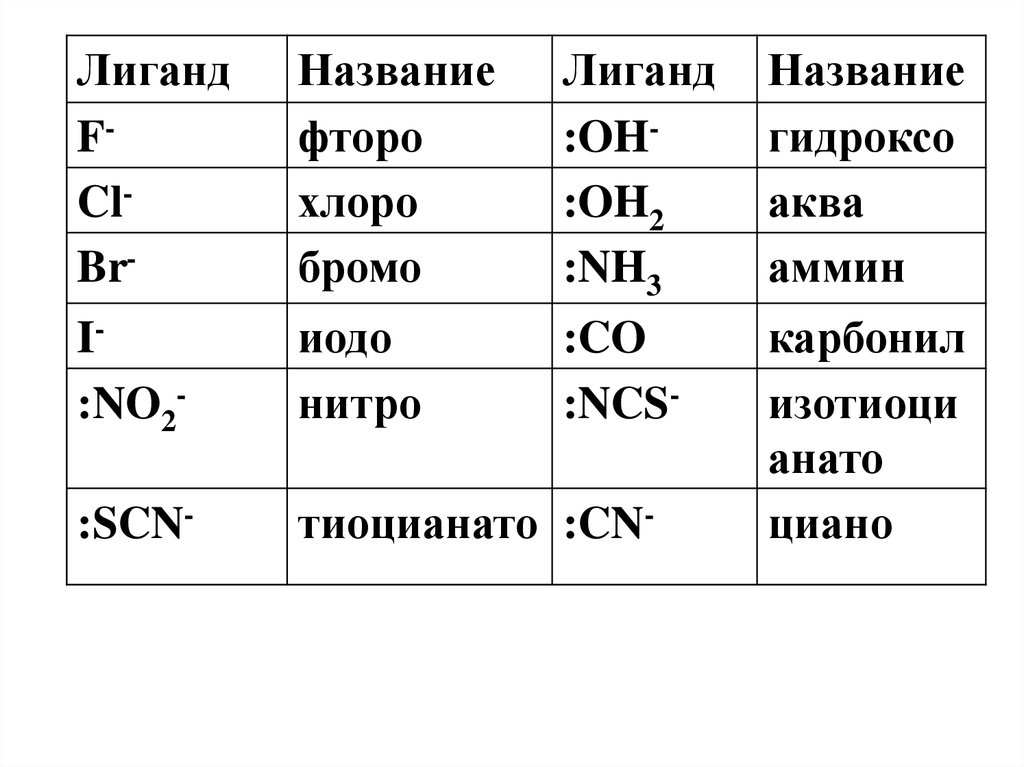
34. Номенклатура комплексных соединений
35.
ЛигандFClBr-
Название
фторо
хлоро
бромо
Лиганд
:OH:OH2
:NH3
Название
гидроксо
аква
аммин
I:NO2-
иодо
нитро
:CO
:NCS-
:SCN-
тиоцианато :CN-
карбонил
изотиоци
анато
циано
36.
[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)
Na3[Co(NO2)6]
Гексанитрокобальтат (III) натрия
[Pt(NH3)2Cl2]
Дихлородиамминплатина
[Cr(H2O)2(NH3)3 Cl]Br2
Бромид хлородиакватриамминхрома (III)
37. Диссоциация комплексных соединений
38. K4 [Fe(CN)6]
Ковалентная(диссоциация по типу слабого
электролита)
K4 [Fe(CN)6]
Ионная связь
(диссоциация по типу
сильного электролита)
39. K4 [Fe(CN)6] 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация
K4 [Fe(CN)6] 4+
K
+ [Fe(CN)6 ]
первичная диссоциация
4-
40.
[Fe(CN)6 ]вторичная диссоциация
4-
2+
Fe
+6(CN)
Константа нестойкости (Кн):
Кн =
[Fe2+] [CN-]6
[Fe (CN)6] 4-
Kн = 1∙10-31
(очень прочный комплекс)
41. [Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс)
[Ni(NH3)62+
]
-9
2*10
Кн =
(непрочный комплекс)
Куст.=1/ Кн
42. Кн и Ку относятся только к комплексному иону!
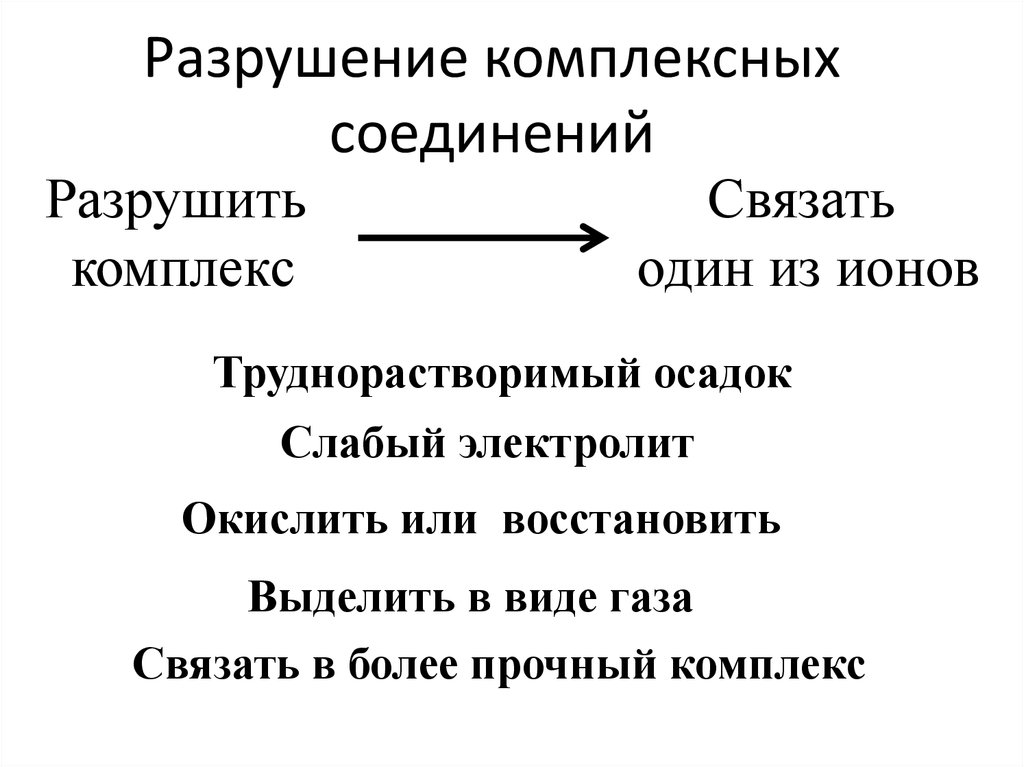
Не забывайте !43. Разрушение комплексных соединений
Разрушитькомплекс
Связать
один из ионов
Труднорастворимый осадок
Слабый электролит
Окислить или восстановить
Выделить в виде газа
Связать в более прочный комплекс
44. [Ag (NH3)2]+ Ag+ + 2 NH3 Кн = 9,3 ·10-8
[Ag (NH3)2]+ Ag+ + 2 NH3Кн = 9,3
-8
·10
45. [Ag (NH3)2]++ KI =AgI+ NH3 +K+ ПРAgI = 1,5·10 -16
[Ag (NH3)2]++ KI =AgI + NH3 +K+ПРAgI = 1,5·10 -16
[Ag (NH3)2]++2CN- = [Ag(CN)2]- +2NH3
Кн = 8·10-22
46. [Ag (NH3)2]+ Ag+ + 2 NH3
[Ag (NH3)2]+ Ag+ + 2 NH3+ KI
Образование
труднорастворимого
осадка
+ HNO3
+ KCN
NH4NO3
Образование
более прочного комплекса
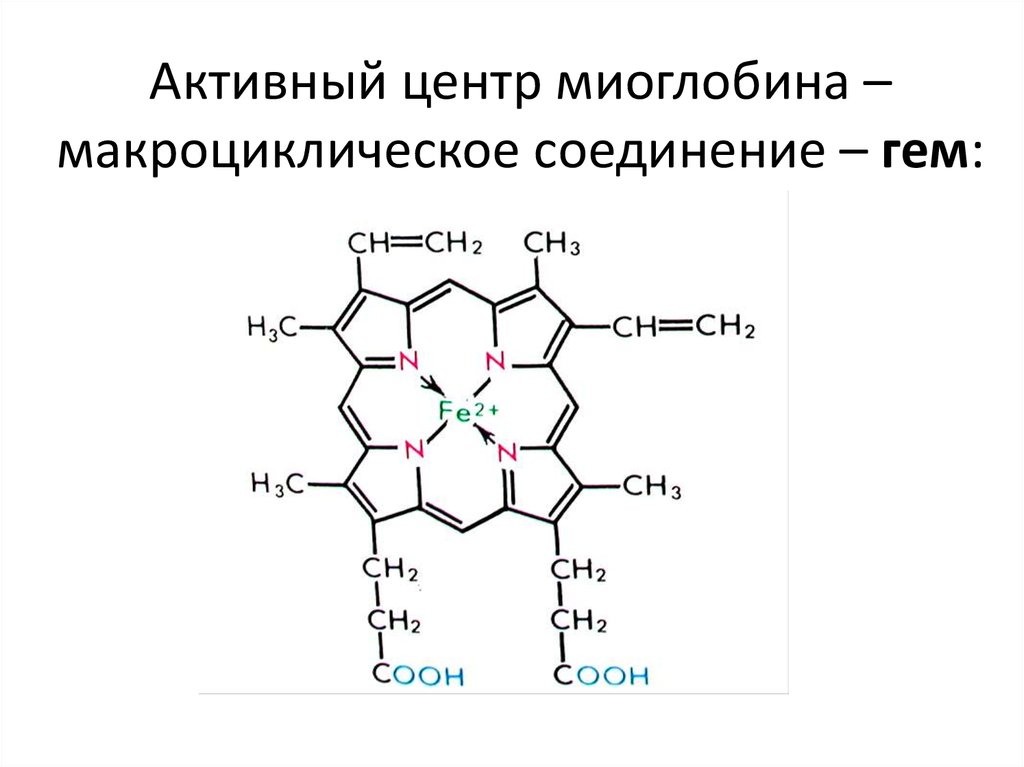
47. Биологическая роль комплексных соединений
48. Активный центр миоглобина – макроциклическое соединение – гем:
49.
Mb + O2 MbO2Создаёт депо кислорода в мышцах
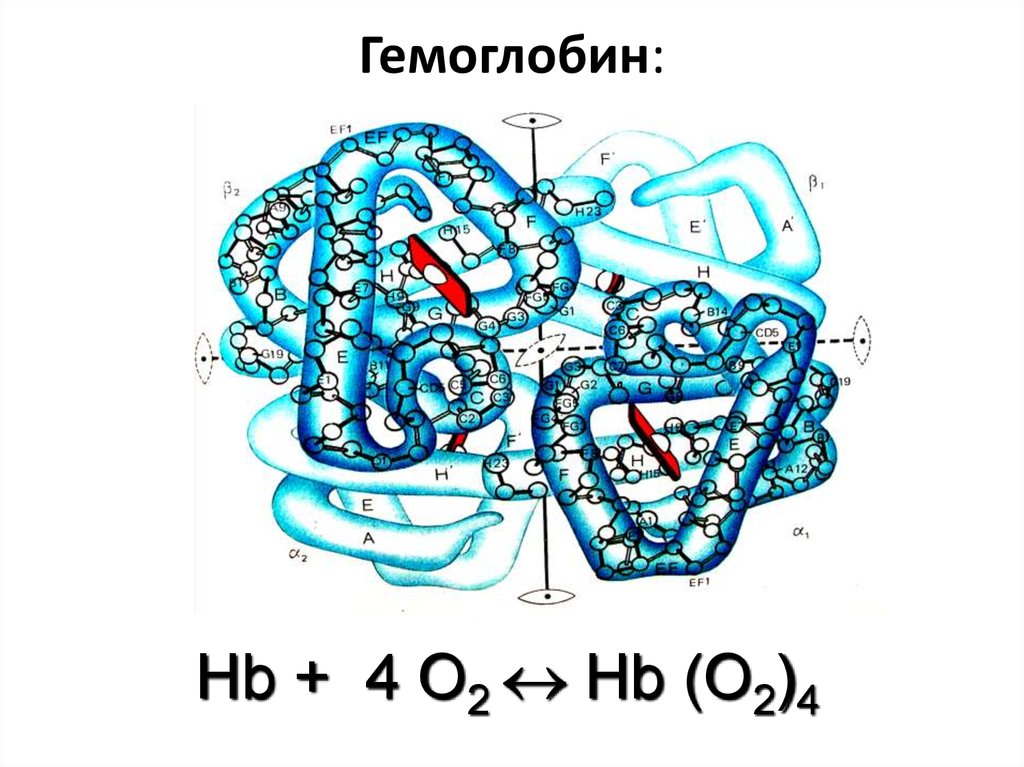
50. Гемоглобин:
Hb + 4 O2 Hb (O2)451. Зеленый пигмент растений –хлорофилл:
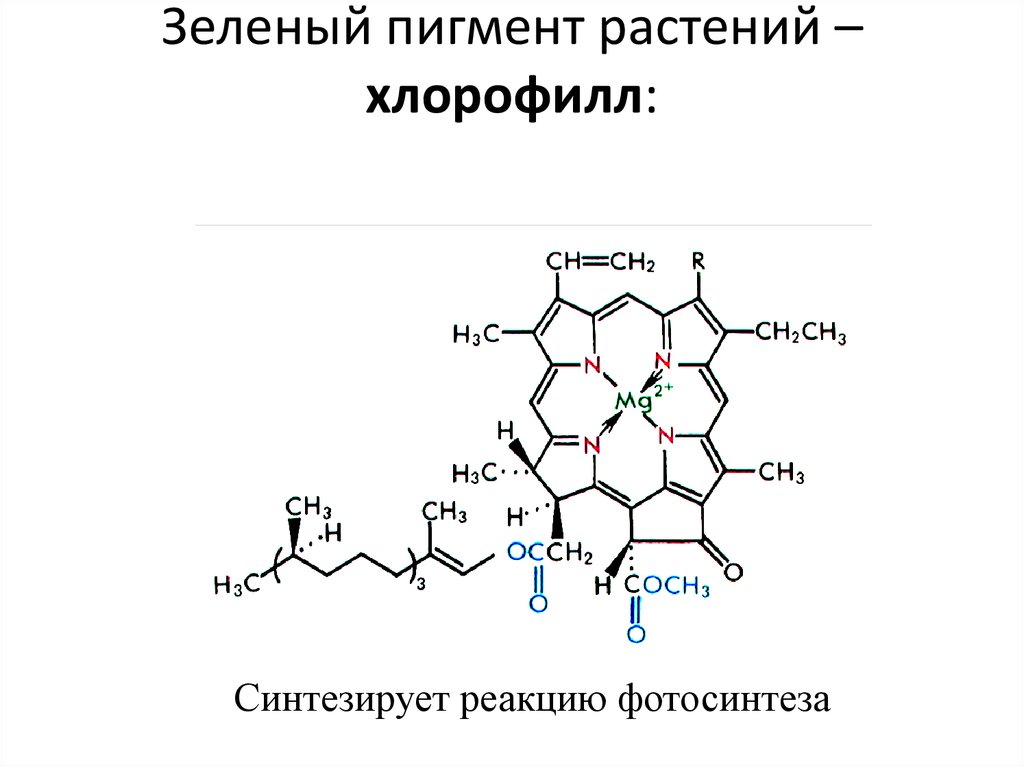
Зеленый пигмент растений –хлорофилл:
Синтезирует реакцию фотосинтеза
52.
Витамин В1253. Применение комплексных соединений в медицине
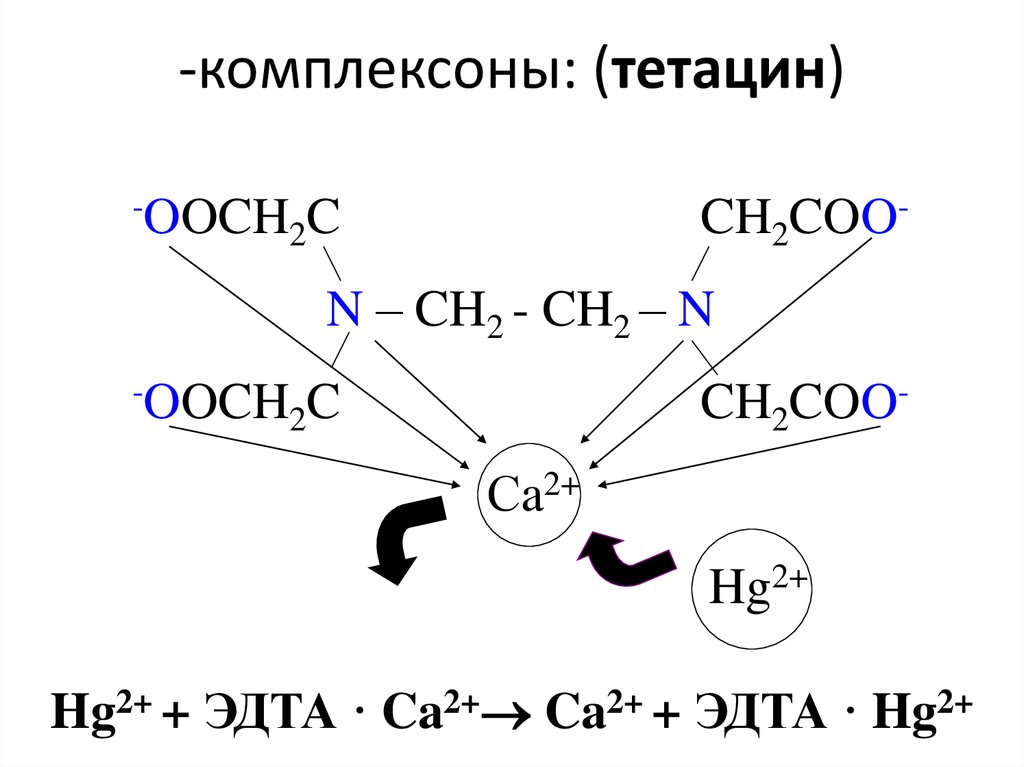
54. -комплексоны: (тетацин)
-OOCHCH2COO-
2C
N – CH2 - CH2 – N
-OOCH
CH2COO-
2C
Сa2+
Hg2+
Hg2+ + ЭДТА · Ca2+ Ca2+ + ЭДТА · Hg2+
55. -противоопухолевый препарат: цис-изомер дихлородиамминплатины (цис-платин) цис- [Pt(NH3)2Cl2] цис- [Pt(NH3)4Cl2]
-противоопухолевый препарат: цисизомер дихлородиамминплатины (цисплатин)цис- [Pt(NH3)2Cl2]
цис- [Pt(NH3)4Cl2]









![Na[BF4] Na3[AlF6] Na[BF4] Na3[AlF6]](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-11.jpg)
![Na3[AlF6] Na [AlCl4] Na3[AlF6] Na [AlCl4]](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-12.jpg)


![Al(OH)3 + NaOH= Na[Al(OH)4] Al(OH)3 + NaOH= Na[Al(OH)4]](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-15.jpg)



![Zn2+ + 4 NH3 [Zn(NH3)4]2+ Zn2+ + 4 NH3 [Zn(NH3)4]2+](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-26.jpg)
![[Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6] [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6]](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-31.jpg)




![K4 [Fe(CN)6] K4 [Fe(CN)6]](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-37.jpg)
![K4 [Fe(CN)6] 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация K4 [Fe(CN)6] 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-38.jpg)

![[Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс) [Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс)](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-40.jpg)

![[Ag (NH3)2]+ Ag+ + 2 NH3 Кн = 9,3 ·10-8 [Ag (NH3)2]+ Ag+ + 2 NH3 Кн = 9,3 ·10-8](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-43.jpg)
![[Ag (NH3)2]++ KI =AgI+ NH3 +K+ ПРAgI = 1,5·10 -16 [Ag (NH3)2]++ KI =AgI+ NH3 +K+ ПРAgI = 1,5·10 -16](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-44.jpg)
![[Ag (NH3)2]+ Ag+ + 2 NH3 [Ag (NH3)2]+ Ag+ + 2 NH3](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-45.jpg)




![-противоопухолевый препарат: цис-изомер дихлородиамминплатины (цис-платин) цис- [Pt(NH3)2Cl2] цис- [Pt(NH3)4Cl2] -противоопухолевый препарат: цис-изомер дихлородиамминплатины (цис-платин) цис- [Pt(NH3)2Cl2] цис- [Pt(NH3)4Cl2]](https://cf2.ppt-online.org/files2/slide/4/4KMFHg7CBP5ElZekXSqo1UiaNYt892GdVsrfzxcm6D/slide-54.jpg)

 chemistry
chemistry








