Similar presentations:
Комплексные соединения
1.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯКомплексные соединения – соединения, в
которых присутствует хотя бы одна связь,
образованная по донорно-акцепторному механизму
2.
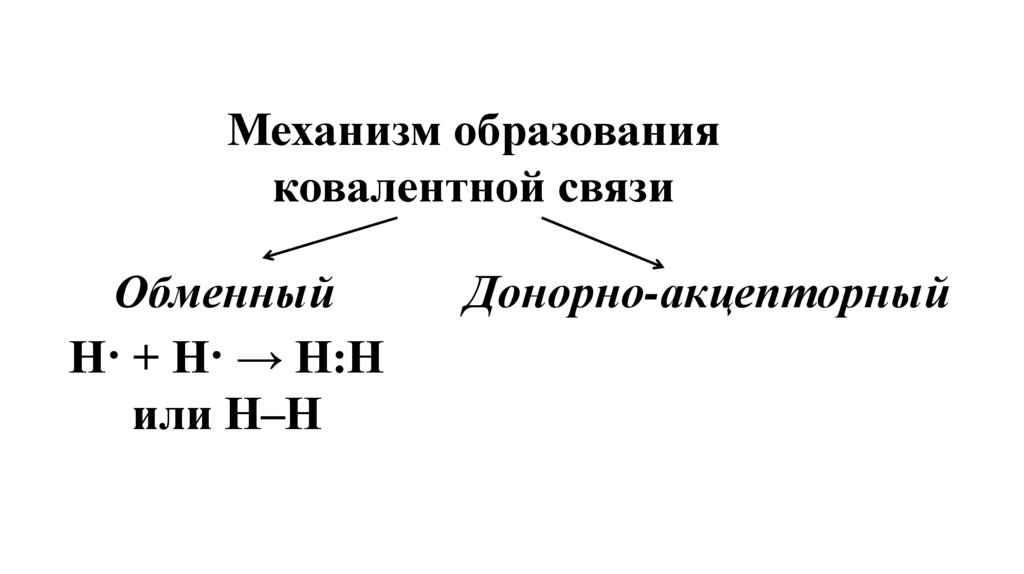
Механизм образованияковалентной связи
Обменный
Н· + Н· → Н:Н
или Н–Н
Донорно-акцепторный
3.
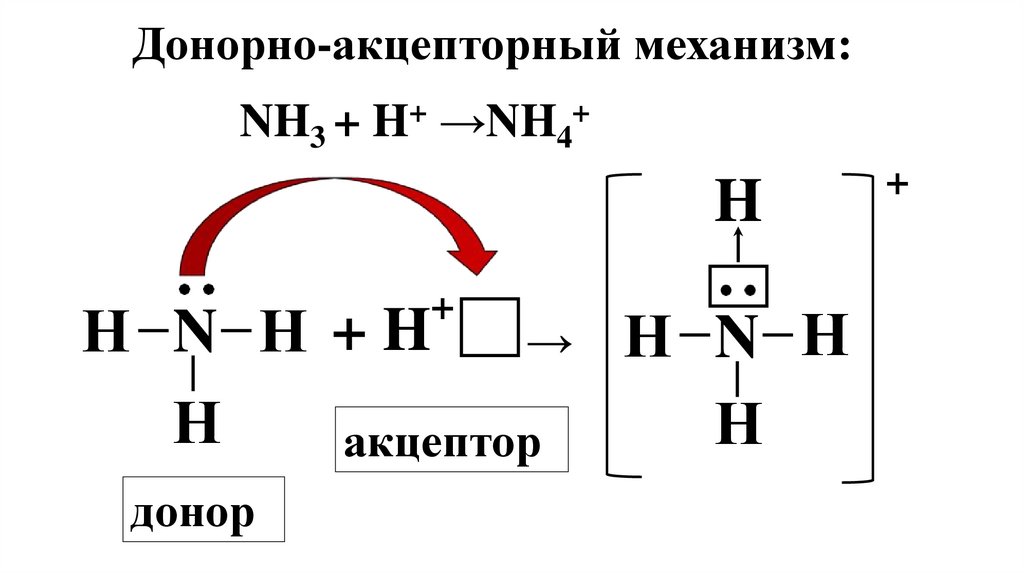
Донорно-акцепторный механизм:+
+
NH3 + H →NH4
H
+
Н N Н +H
→ Н N Н
Н
Н
акцептор
донор
+
4.
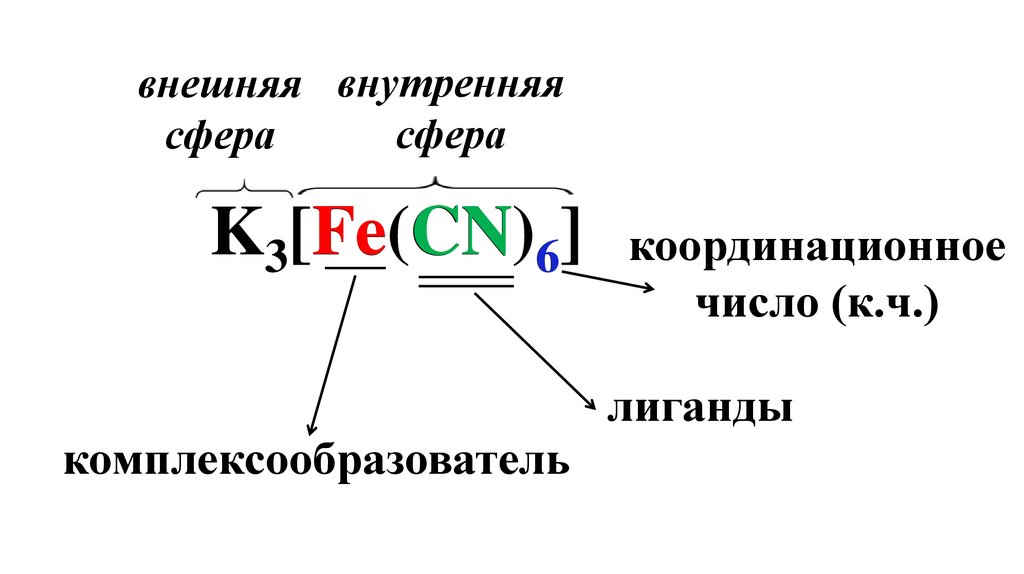
Координационная теория строения:1) В строении комплексных соединений выделяют
внутреннюю и внешнюю сферу
Внутреннюю сферу комплекса образуют
комплексообразователь и лиганды
Число связей комплексообразователя с лигандами
называют
координационным числом (к.ч.)
2) Заряд внешней сферы равен заряду внутренней сферы.
5.
внешняя внутренняясфера
сфера
Fe CN 6] координационное
K3[Fe(CN)
число (к.ч.)
лиганды
комплексообразователь
6.
Классификация комплексных соединений:1.По знаку заряда комплексного иона:
а) нейтральные: Fe + 5CO → [Fe(CO)5)]0
б) катионные: CuSO4 + 4H2O → [Cu(H2O)4]2+SO4
в) анионные: Fe(SCN)2 + 4KSCN → K4[Fe(SCN)6]4-
7.
2. По принадлежности к классу:а) кислоты: 2 HCl(конц) + CoCl2 →H2[CoCl4]
б) основания: AgOH + 2 NH3 → [Ag(NH3)2]OH
в) соли: BiI3 + NaI → Na[BiI4]
8.
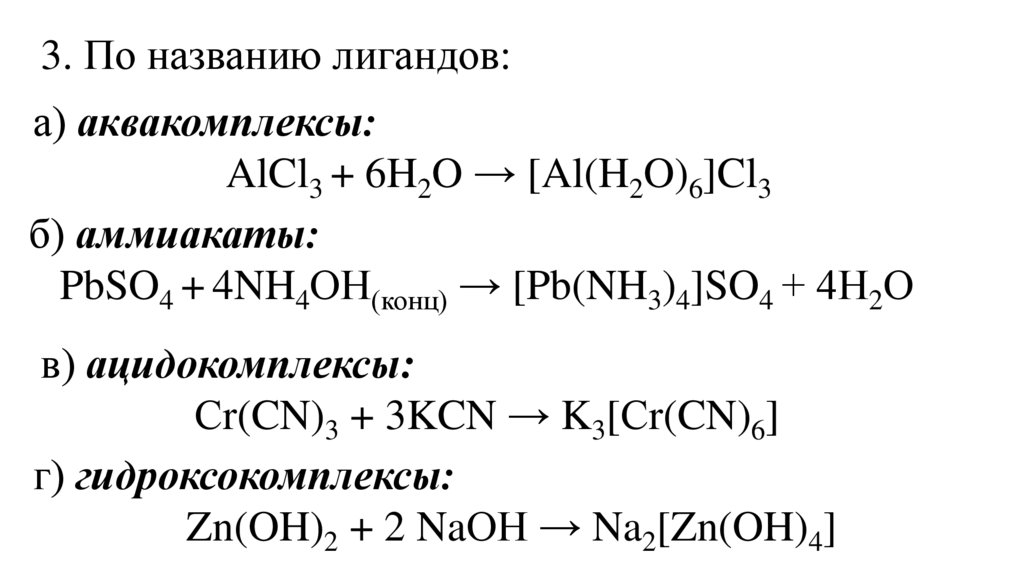
3. По названию лигандов:а) аквакомплексы:
AlCl3 + 6H2O → [Al(H2O)6]Cl3
б) аммиакаты:
PbSO4 + 4NH4ОН(конц) → [Pb(NH3)4]SO4 + 4Н2О
в) ацидокомплексы:
Сr(CN)3 + 3KCN → K3[Сr(CN)6]
г) гидроксокомплексы:
Zn(OH)2 + 2 NaОН → Na2[Zn(OH)4]
9.
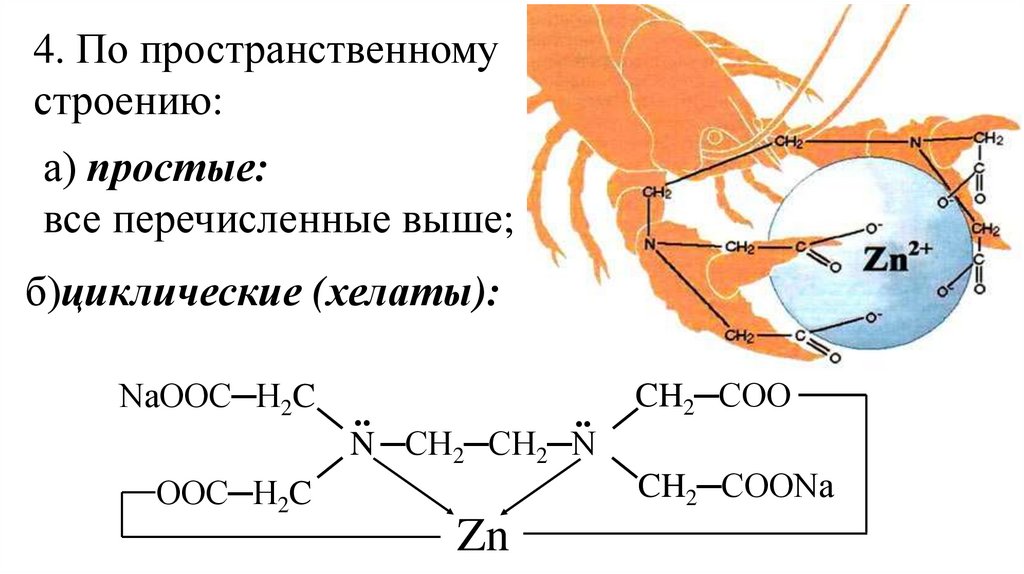
4. По пространственномустроению:
а) простые:
все перечисленные выше;
б)циклические (хелаты):
NaOOC─H2C
..
..
N ─CH2─CH2─N
OOC─H2C
Zn
CH2─COO
CH2─COONa
10.
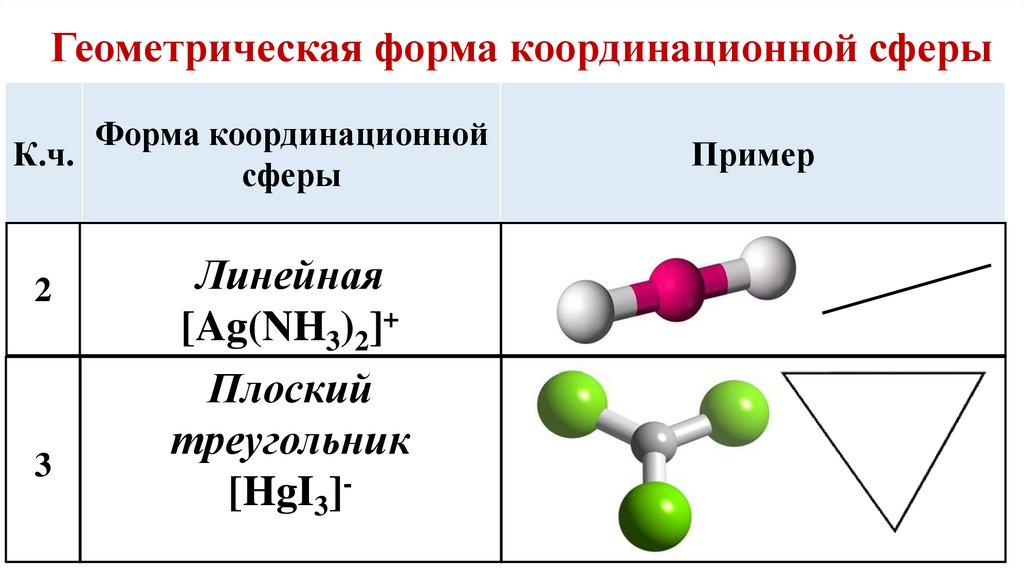
Геометрическая форма координационной сферыФорма координационной
К.ч.
сферы
2
3
Линейная
[Ag(NH3)2]+
Плоский
треугольник
[HgI3]-
Пример
11.
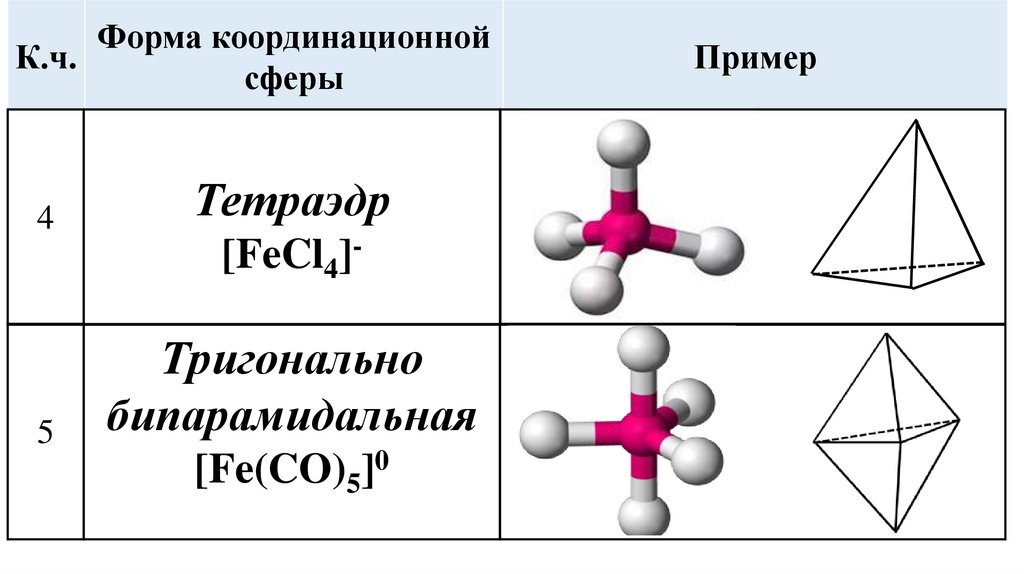
Форма координационнойК.ч.
сферы
4
Тетраэдр
5
Тригонально
бипарамидальная
[FeCl4]-
[Fe(CO)5]0
Пример
12.
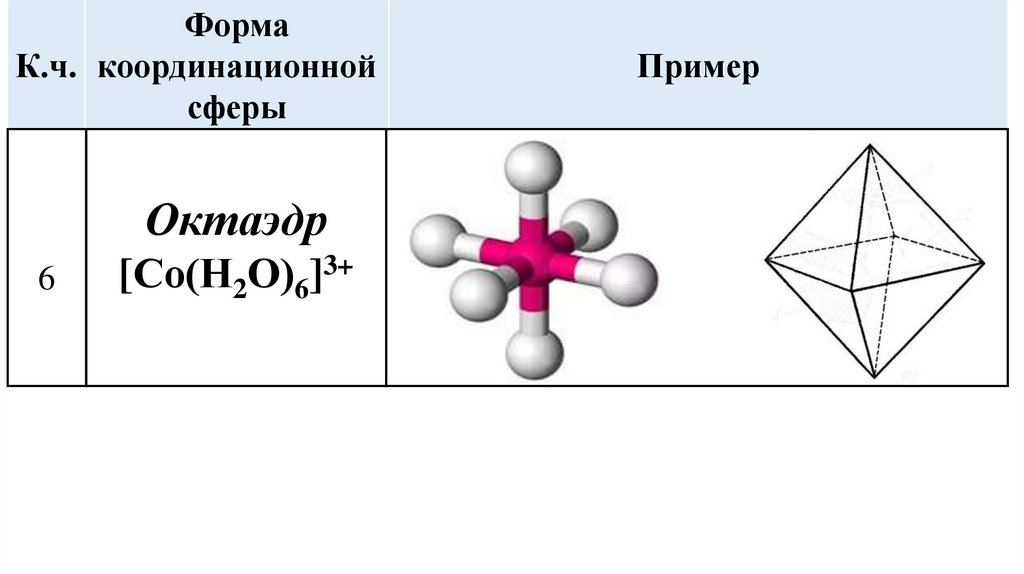
ФормаК.ч. координационной
сферы
Октаэдр
6
[Со(Н2О)6]3+
Пример
13.
Номенклатура комплексных соединений1. Сначала называют анион, затем катион.
2. В названии внутренней сферы перечисляют все
ее составные части справа налево.
3. Координационное число называют по-гречески:
1 – моно; 2 – ди; 3 – три; 4 – тетра; 5 – пента;
6 – гекса.
14.
Лиганды:1. Монодентатные
(занимают одно координационное место)
15.
16.
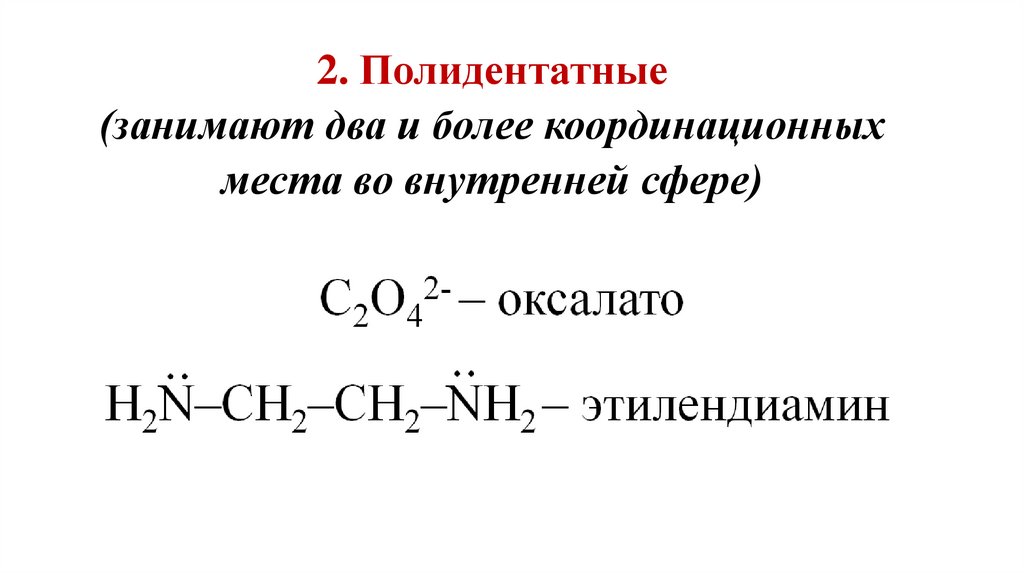
2. Полидентатные(занимают два и более координационных
места во внутренней сфере)
17.
18.
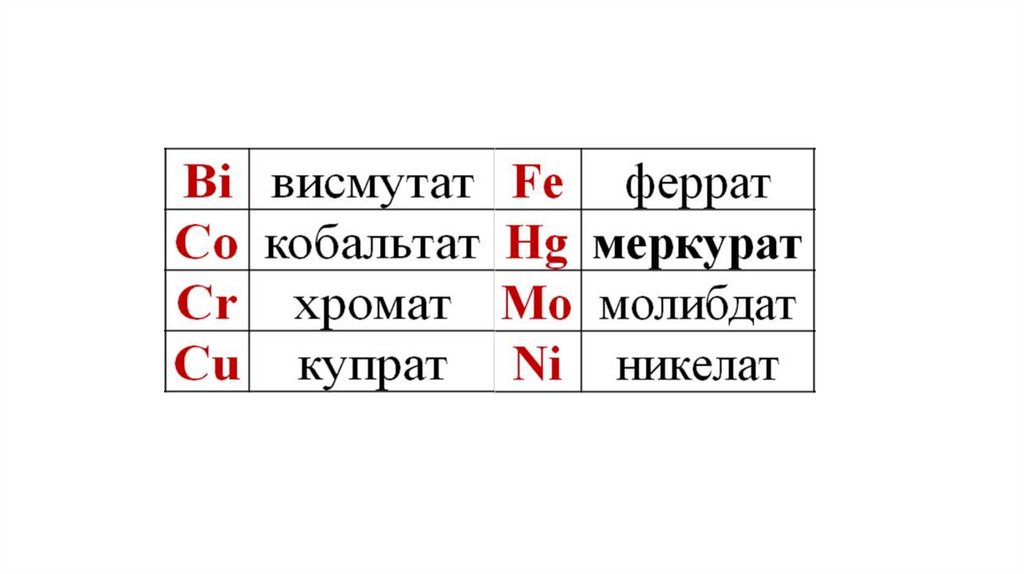
Названия комплексообразователей по-латыни(суффикс ум меняется на ат):
19.
20.
Примеры названий комплексных соединений:1) Соединения с незаряженной комплексной
сферой:
к.ч. → лиганды → комплексообразователь
по-русски в именительном падеже
[Fe(CO)5)]0 – пентакарбонилжелезо
[PtCl4]0 – тетрахлороплатина
21.
2) Соединения с комплексным катионом:кислотный остаток → к.ч. → лиганды →
→ комплексообразователь по-русски в
родительном падеже (с указанием степени
окисления)
[Cu(H2O)4]2+SO4 – сульфат тетрааквамеди(II);
[Ag(NH3)2]+OH – гидроксид диамминсеребра(I);
[Al(H2O)6]3+Cl3 – хлорид гексаакваалюминия.
22.
3) Соединения с комплексным анионом:к.ч. → лиганды →
→ комплексообразователь по-латыни (с указанием
степени окисления) → ионы внешней сферы порусски в родительном падеже
K4[Fe(SCN)6]4– – гексатиоцианатоферрат(II) калия;
Na[BiI4]– – тетраиодовисмутат(III) натрия;
K3[Cr(CN)6]3– – гексацианохромат(III) калия;
23.
В водных растворах комплексные соединениядиссоциируют с отщеплением ионов внешней сферы:
K2[Zn(OH)4]
2K+ + [Zn(OH)4]2─
Образующийся комплексный ион [Zn(OH)4]2─ не
обладает абсолютной устойчивостью и способен к
дальнейшей диссоциации:
[Zn(OH)4]2─
Zn2+ + 4OH─
24.
Данный равновесный процесс характеризуетсяконстантой нестойкости и константой
устойчивости. Это взаимообратные величины:
К уст
1
К нест
С[ Zn ( OH ) ]2
4
CZn 2 COH
4
25.
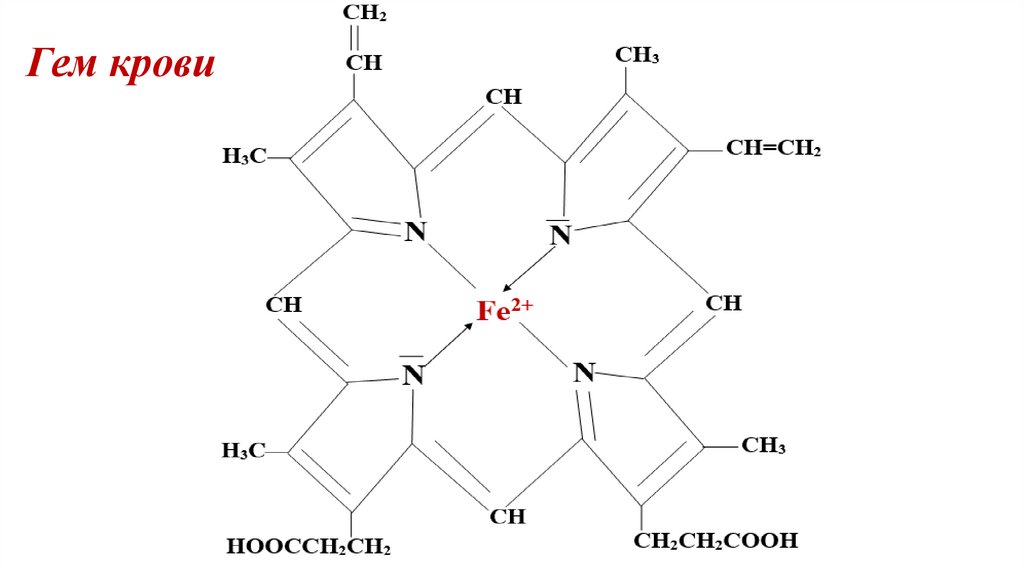
Макроциклические комплексы1. Гем крови
Красящее вещество крови – гемоглобин состоит из:
• белка – глобина;
• пигмента – гема: С34H32O4N4Fe.
Гем крови является переносчиком О2 из легких в
ткани и СО2 из тканей в легкие.
26.
В 1935г немецкий химик-органик Х. Фишерустановил строение и синтезировал гем крови.
Ханс Фишер
(1881-1945гг)
27.
Гем крови28.
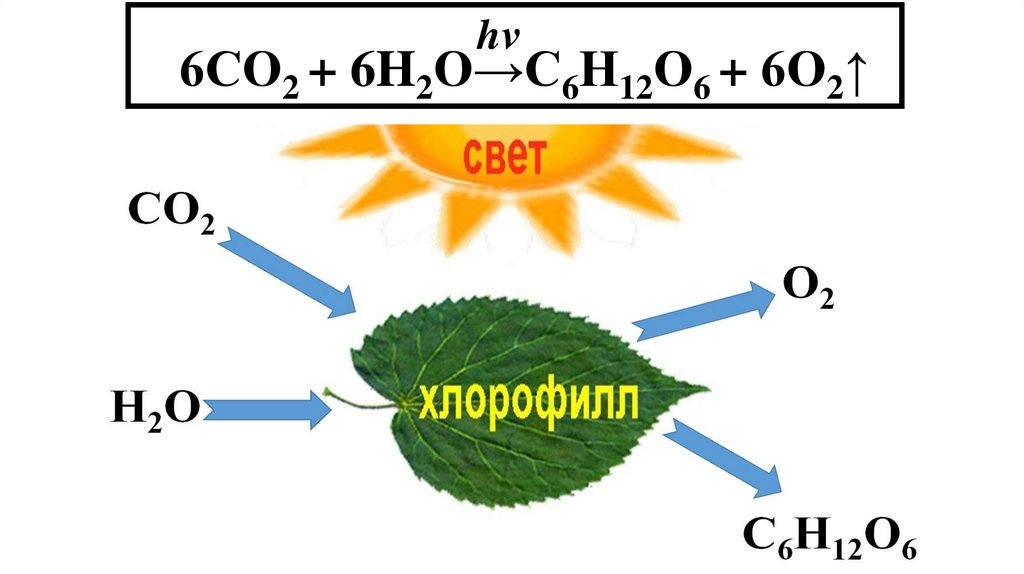
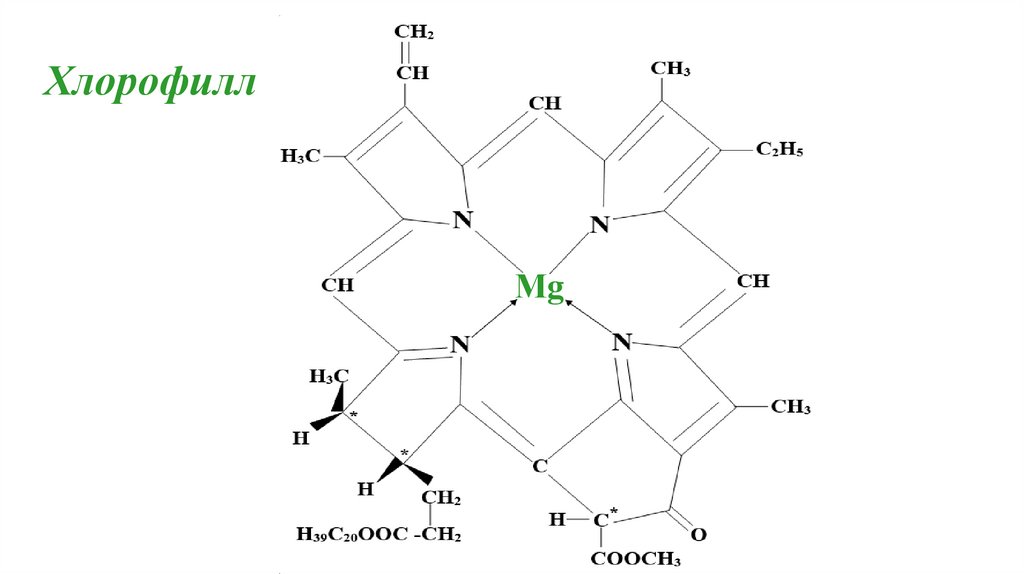
2. Хлорофилл – красящее зеленое веществорастений С55H72O5N4Mg.
Роль хлорофилла как катализатора процесса
фотосинтеза была установлена К.А. Тимирязевым в
1903г.
Климент Аркадьевич
Тимирязев (1843-1920гг)
29.
Синтетический хлорофилл синтезирован в 1958гамериканским химиком-органиком Р. Вудвордом
Вудворд, Роберт Бёрнс
(1917-1979гг)
30.
hν6СО2 + 6H2O→С6Н12О6 + 6О2↑
31.
ХлорофиллМg







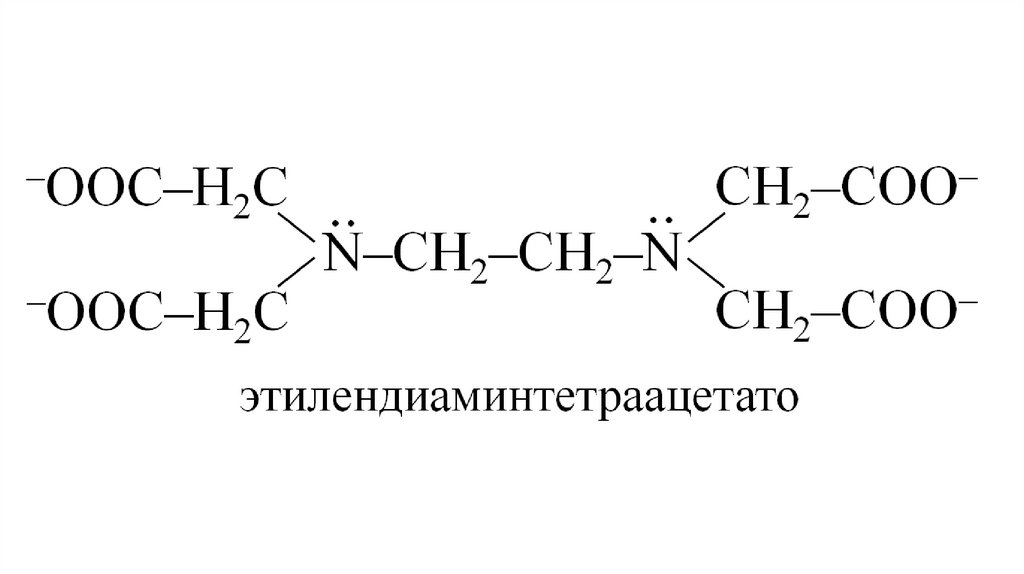










 chemistry
chemistry








