Similar presentations:
Диазины. Характеристика диазинов. (Лекция 8)
1.
Химия биологическиактивных веществ
Лекция 8
Диазины
2.
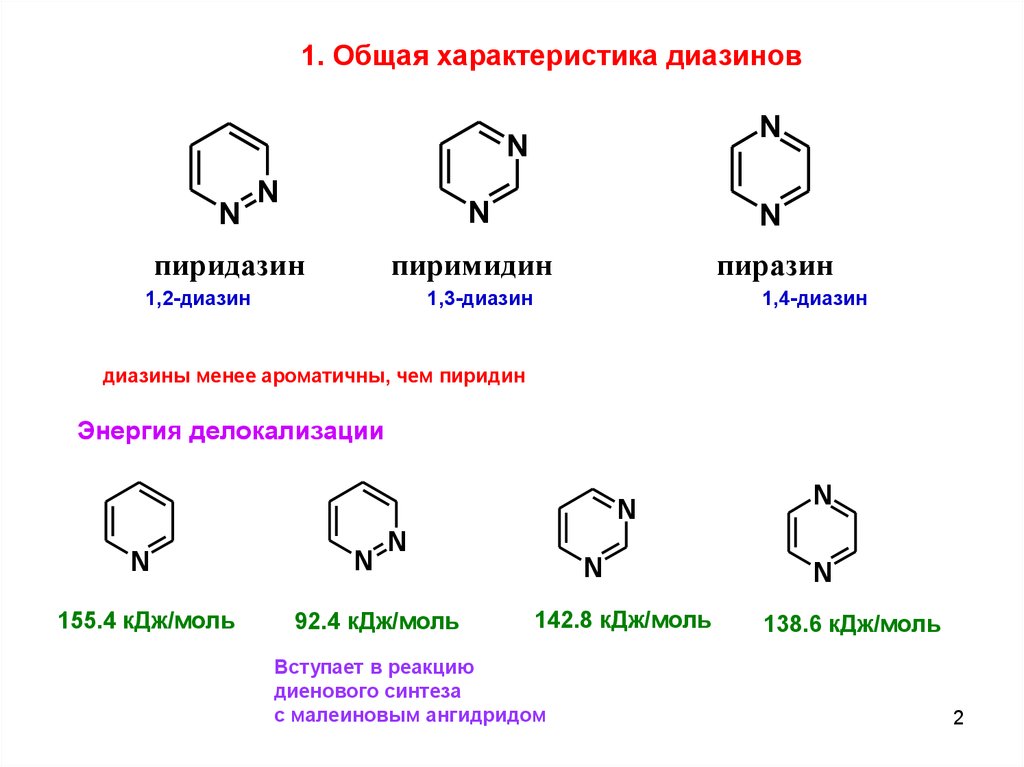
1. Общая характеристика диазиновN
N
N
N
пиридазин
N
N
пиримидин
пиразин
1,3-диазин
1,2-диазин
1,4-диазин
диазины менее ароматичны, чем пиридин
Энергия делокализации
N
N
155.4 кДж/моль
N
N
N
92.4 кДж/моль
N
142.8 кДж/моль
Вступает в реакцию
диенового синтеза
с малеиновым ангидридом
N
138.6 кДж/моль
2
3
3.
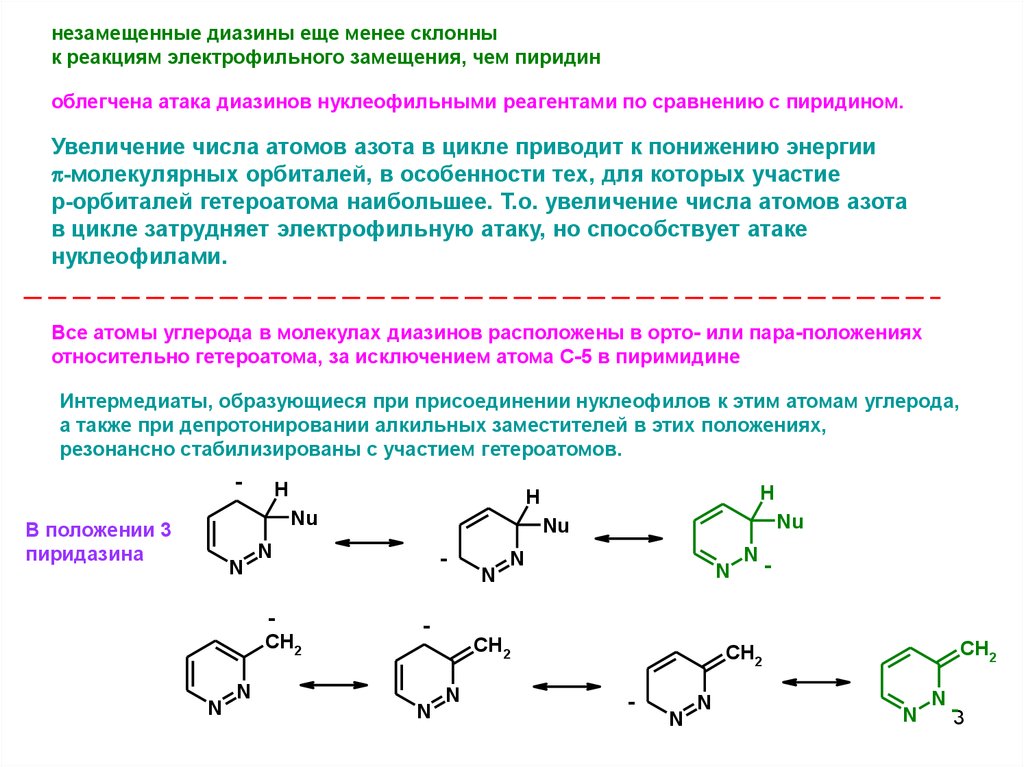
незамещенные диазины еще менее склоннык реакциям электрофильного замещения, чем пиридин
облегчена атака диазинов нуклеофильными реагентами по сравнению с пиридином.
Увеличение числа атомов азота в цикле приводит к понижению энергии
p-молекулярных орбиталей, в особенности тех, для которых участие
p-орбиталей гетероатома наибольшее. Т.о. увеличение числа атомов азота
в цикле затрудняет электрофильную атаку, но способствует атаке
нуклеофилами.
Все атомы углерода в молекулах диазинов расположены в орто- или пара-положениях
относительно гетероатома, за исключением атома С-5 в пиримидине
Интермедиаты, образующиеся при присоединении нуклеофилов к этим атомам углерода,
а также при депротонировании алкильных заместителей в этих положениях,
резонансно стабилизированы с участием гетероатомов.
-
H
Nu
В положении 3
пиридазина
N
Nu
Nu
N
CH2
N
H
H
-
N
N
N
N
-
CH2
N
N
N
CH2
CH2
-
N
N
N
N
-3
4.
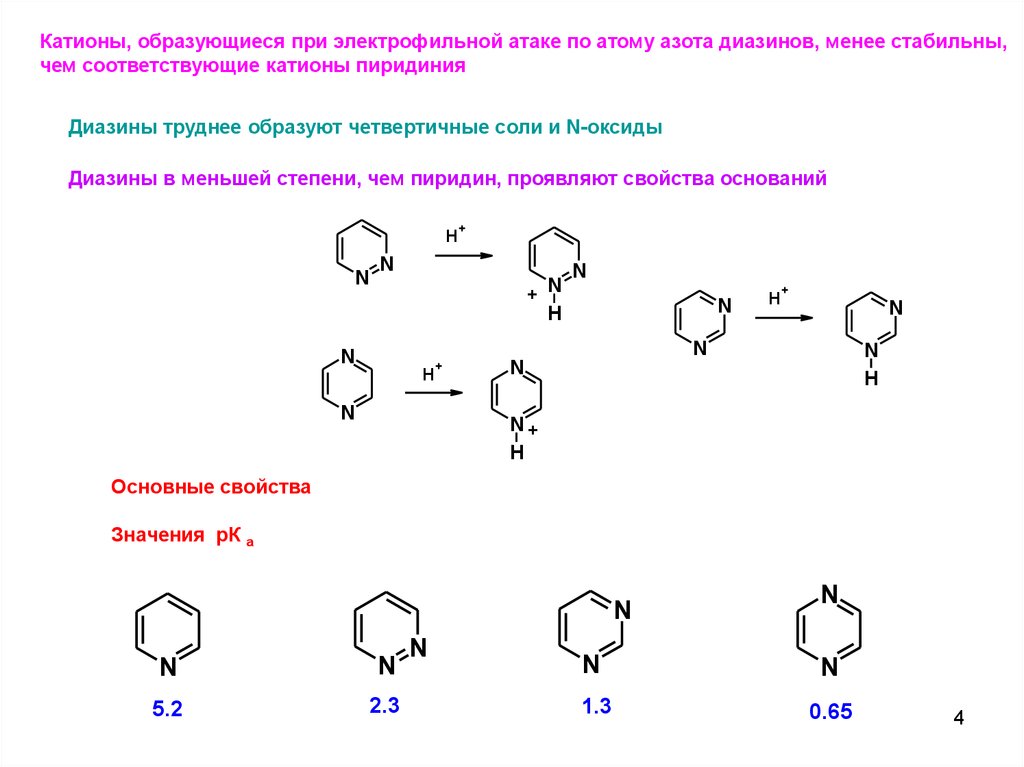
Катионы, образующиеся при электрофильной атаке по атому азота диазинов, менее стабильны,чем соответствующие катионы пиридиния
Диазины труднее образуют четвертичные соли и N-оксиды
Диазины в меньшей степени, чем пиридин, проявляют свойства оснований
H
N
+
N
N
+
H
N
N
H
+
N
N
N
H
N
+
N
H
N
N+
H
Основные свойства
Значения рК а
N
N
N
5.2
2.3
N
N
N
N
1.3
0.65
4
5.
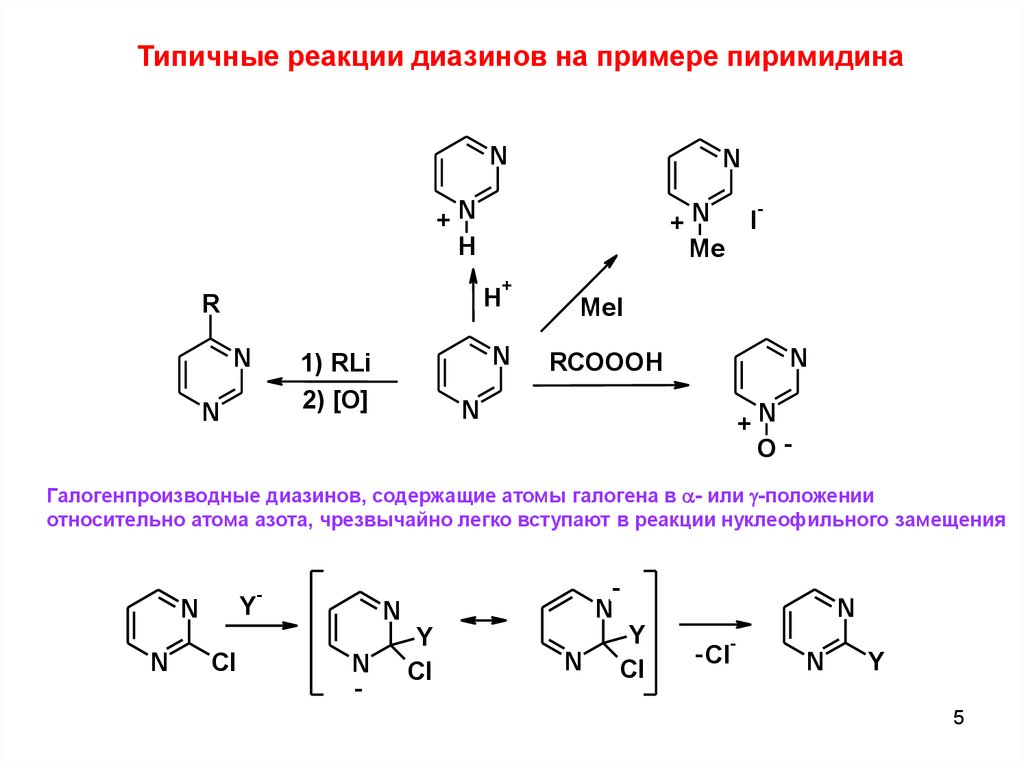
Типичные реакции диазинов на примере пиримидинаN
N
+N
H
+N
Me
I
-
+
H
R
N
N
1) RLi
2) [O]
N
MeI
N
RCOOOH
N
+N
O-
Галогенпроизводные диазинов, содержащие атомы галогена в a- или g-положении
относительно атома азота, чрезвычайно легко вступают в реакции нуклеофильного замещения
Y
N
N
Cl
-
N
N
N
-
Y
Cl
N
Y
Cl
N
- Cl
-
N
Y
5
4
6.
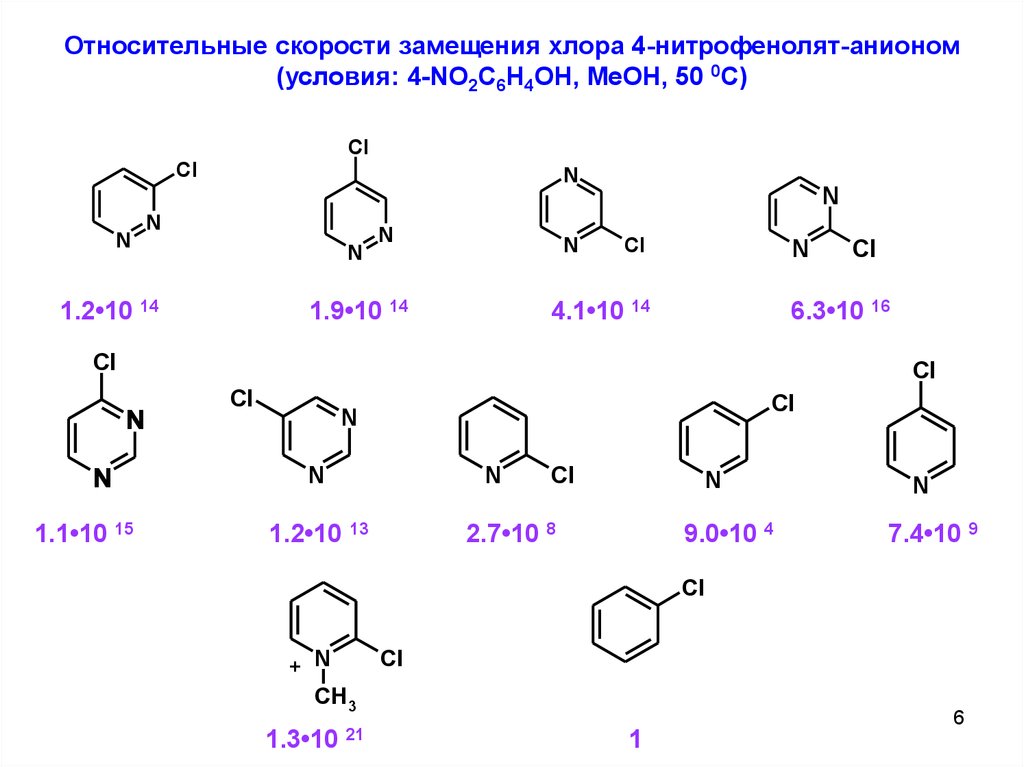
Относительные скорости замещения хлора 4-нитрофенолят-анионом(условия: 4-NO2C6H4OH, MeOH, 50 0C)
Cl
Cl
N
N
N
N
N
1.2•10 14
N
N
1.9•10 14
Cl
N
4.1•10 14
Cl
6.3•10 16
Cl
Cl
N
N
1.1•10 15
Cl
Cl
N
N
N
1.2•10 13
Cl
N
2.7•10 8
9.0•10 4
N
7.4•10 9
Cl
+ N
CH3
1.3•10
21
Cl
6
1
7.
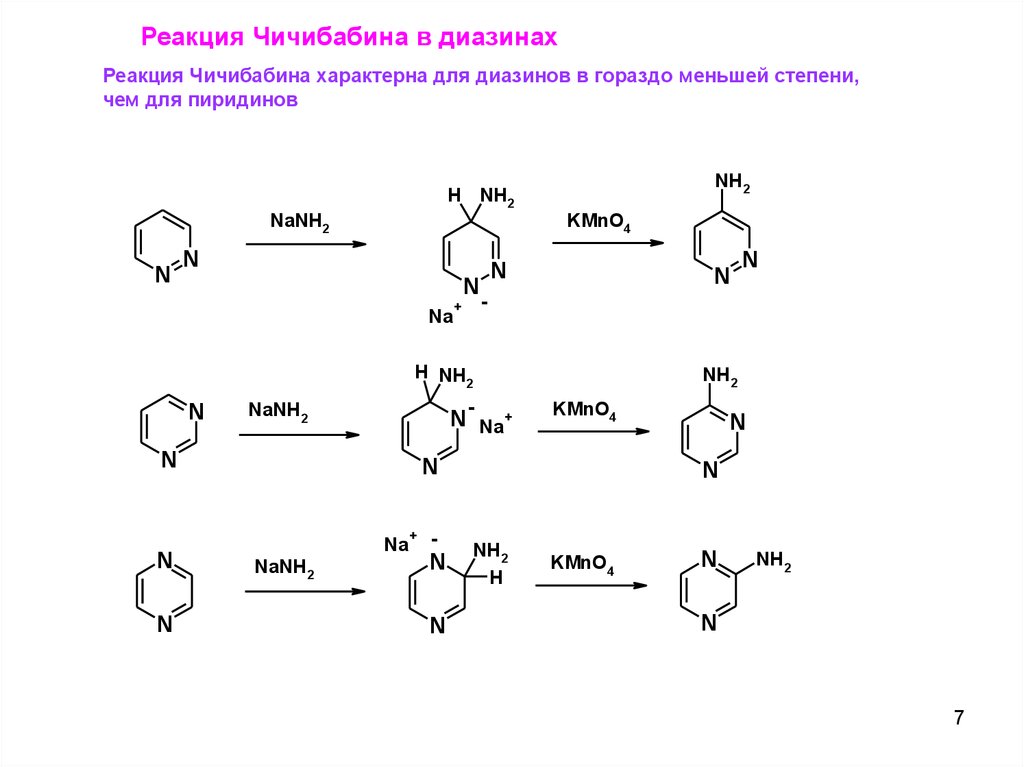
Реакция Чичибабина в диазинахРеакция Чичибабина характерна для диазинов в гораздо меньшей степени,
чем для пиридинов
NH2
H NH2
NaNH2
N
KMnO4
N
N
Na
+
N
N
-
H NH
2
N
-
NaNH2
N Na+
N
N
N
NH2
KMnO4
N
Na
NaNH2
+
-
N
N
N
N
N
NH2
H
KMnO4
N
NH2
N
7
8.
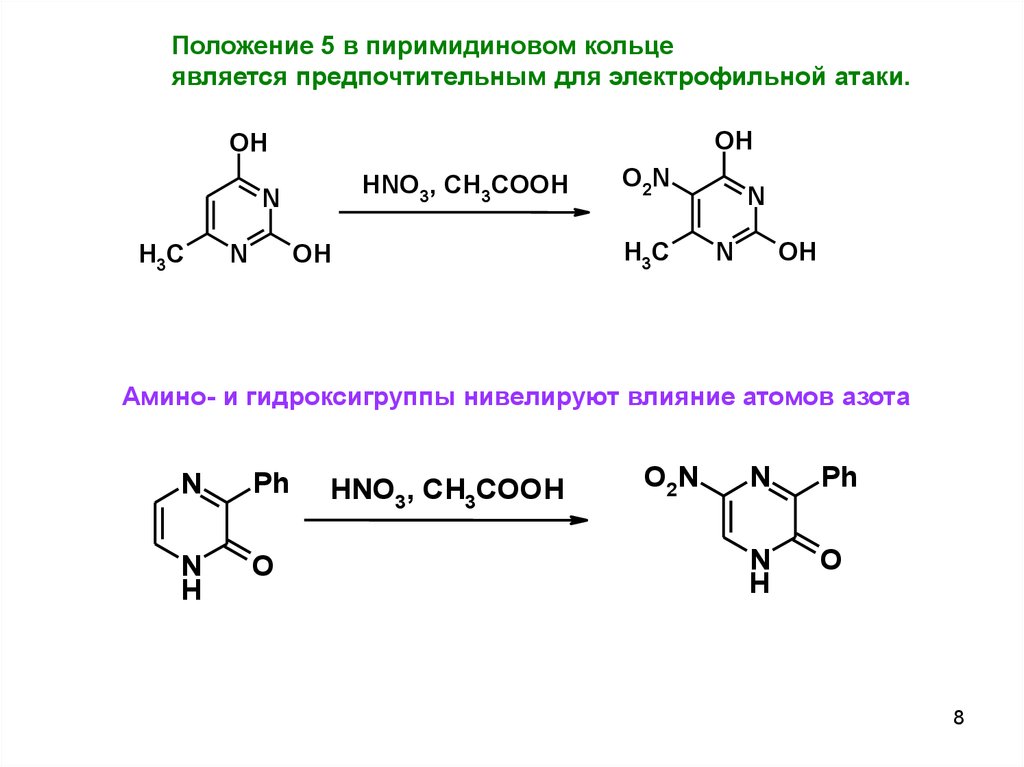
Положение 5 в пиримидиновом кольцеявляется предпочтительным для электрофильной атаки.
OH
OH
HNO3, CH3COOH
N
H3C
N
OH
O2 N
H3C
N
N
OH
Амино- и гидроксигруппы нивелируют влияние атомов азота
N
Ph
N
H
O
HNO3, CH3COOH
O2 N
N
Ph
N
H
O
8
9.
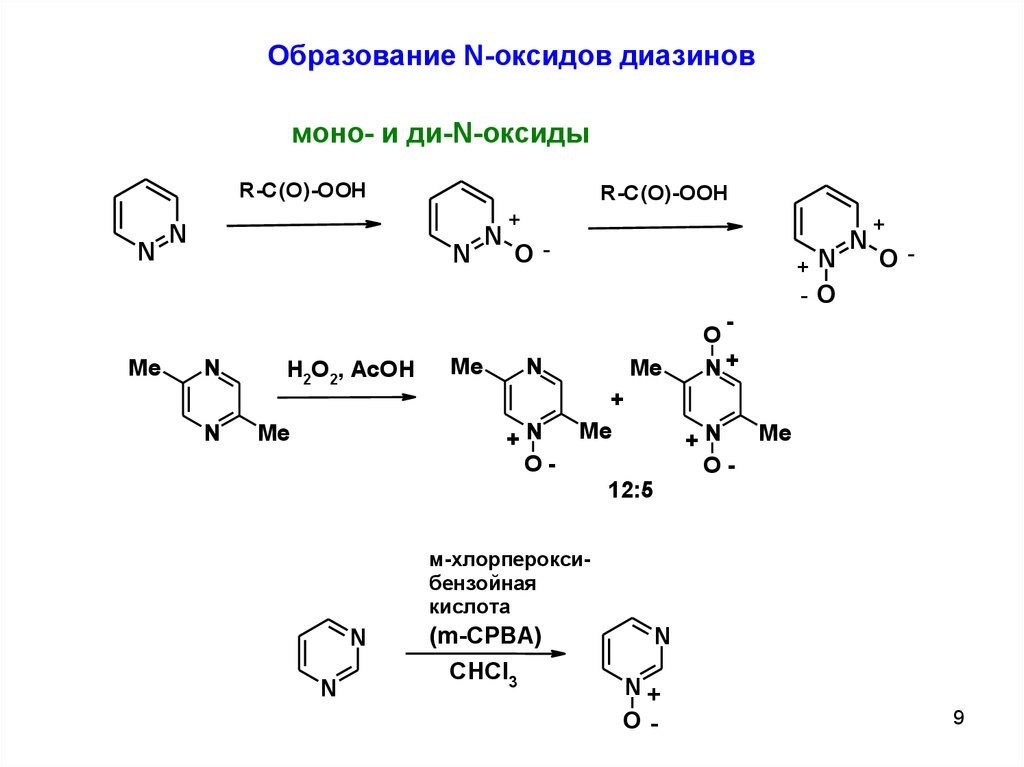
Образование N-оксидов диазиновмоно- и ди-N-оксиды
R-C(O)-OOH
N
Me
N
R-C(O)-OOH
N
N
N
H2O2, AcOH
N
+
O-
Me
N
+N
O-
Me
+N
-O
Me
+
Me
N
+
O-
O
N+
+N
O-
Me
12:5
м-хлорпероксибензойная
кислота
N
N
(m-CPBA)
CHCl3
N
N+
O-
9
10.
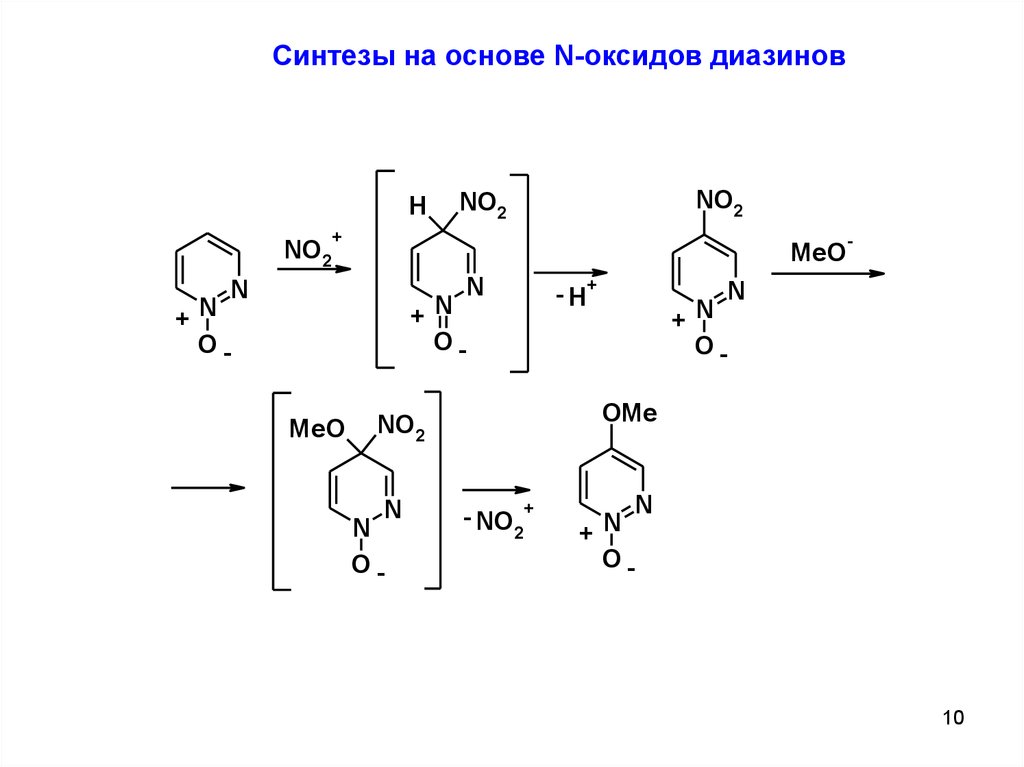
Синтезы на основе N-оксидов диазиновH
NO2
NO2
NO2
+
MeO
N
N
- H+
+N
O-
+N
O-
MeO
N
O-
N
N
+
OOMe
NO2
N
-
- NO
+
2
N
N
+
O-
10
11.
2. ПиридазинАлкилирование пиридазина: с алкилгалогенидами образует соли
по одному атому азота, с оксониевыми солями - по обоим
Me
+ Et3O BF4
ClCH2CH2Cl, t
Me
N
N+
Et
N
+
Et
2 BF4
N
MeI
Me
Me
+
N
+N
Me
OMe
Me
N
N
I
N
-
7:3
N
Me
+
I
OMe
MeI
Me
N N
I
+
Me
11 10
12.
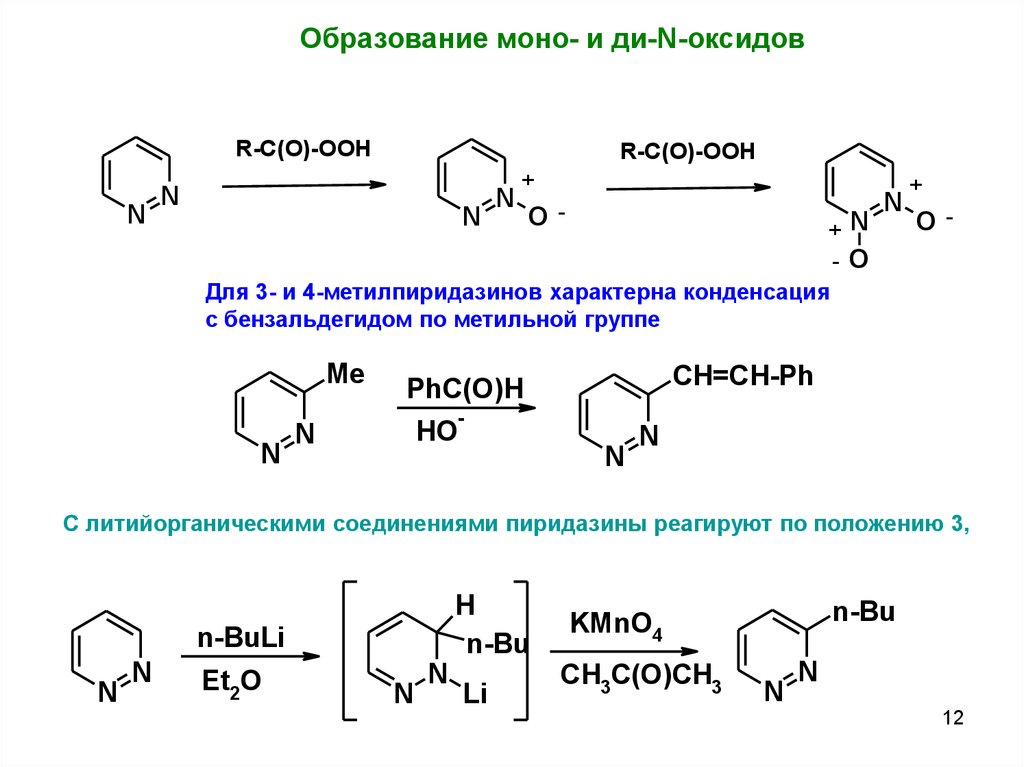
Образование моно- и ди-N-оксидовR-C(O)-OOH
N
R-C(O)-OOH
N
N
N
+
O-
+N
-O
Для 3- и 4-метилпиридазинов характерна конденсация
с бензальдегидом по метильной группе
Me
N
N
PhC(O)H
HO
N
+
O-
CH=CH-Ph
N
N
С литийорганическими соединениями пиридазины реагируют по положению 3,
H
n-Bu
n-BuLi
N
N
Et2O
N
N
Li
n-Bu
KMnO4
CH3C(O)CH3
N
N
12
13.
Синтез пиридазина взаимодействием гидразина с a-кетоглутаровой кислотойCOOH
HOOC
H2N-NH2
O
HOOC
O
HOOC
N
Cl
N
N
O
N
NH
O
t
NH
N
Br2, CH3COOH
- HBr
POCl3
NH
H2, Pd /C
- HCl
N
N
13 12
14.
3. ПИРАЗИНХимические свойства пиразина
Хлорирование 2-метилпиразина проходит в весьма мягких условиях,
наиболее вероятен механизм присоединения-элиминирования
N
Cl2, CCl4
Me
N
N
Cl
N
Me
Окисление до N-моно- или диоксида
Me
N
N
H2O2, AcOH
Me
N
+N
O-
Me
Me
+
Me
O
N+
+N
O-
Me
12:5
Реакции N-оксидов пиразина с нуклеофилами
Me
N
+ N
O-
POCl3
Me
Me
N
Cl
N
N
Me
H2N
+ N
O-
Me3SiCN
DMF, t
NC
H2N
N
+ N
O-
14
3
15.
Методы синтеза пиразина и его производныхКонденсация 2-аминокарбонильных соединений
Cl
R'
O
-
+
H3N
R
O
R
2
+
NH3 Cl+
R
3
HO
R'
-
N
H
2
H2O2
R
- 2HOH
R
H
3
N
R
2
R'
N
R
R
N
R
3
В ряде случаев 2-аминокарбонильные соединения образуются in situ из диазокетонов
O
Ph
CH2N2
H2, Pd
Bn
NH2
O
N
Bn
Cl
Bn
NH2
O -2 HOH
N
Bn
t
+
Bn
N
N
Bn
Конденсация эфиров аминокислот
-
Cl
EtO
O
+
H3N
Bn
+
Bn
NH3 Cl+
EtO
O
N
Bn
N
OEt
NH3, MeOH
OEt
DDQ
EtO
O
H
N
Bn
Bn
N
H
O
N
Bn
N
OEt
+
-
Et3O BF4
CH2Cl2
15
Bn
Bn
4
16.
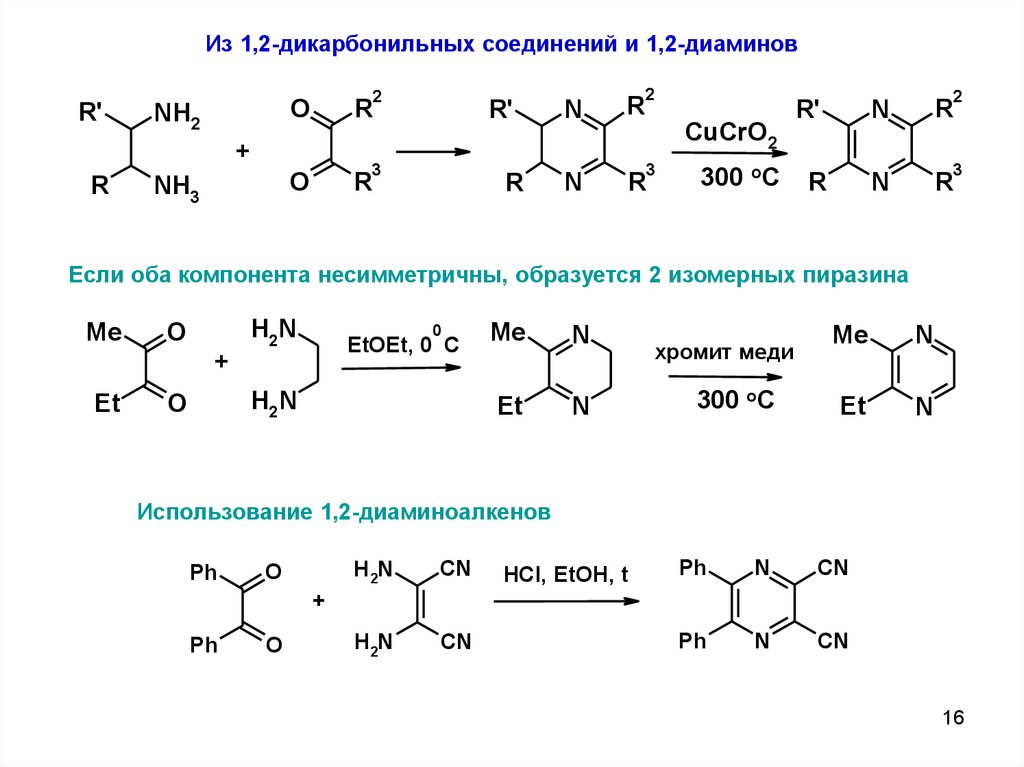
Из 1,2-дикарбонильных соединений и 1,2-диаминовR'
NH2
2
O
R
O
R
+
R
NH3
R'
3
R
2
N
R
N
R
CuCrO2
3
300 oC
2
R'
N
R
R
N
R
3
Если оба компонента несимметричны, образуется 2 изомерных пиразина
Me
H2N
O
0
EtOEt, 0 C
+
Et
H2N
O
Me
N
Et
N
хромит меди
300 oC
Me
N
Et
N
Использование 1,2-диаминоалкенов
Ph
O
H2N
CN
H2N
CN
HCl, EtOH, t
Ph
N
CN
Ph
N
CN
+
Ph
O
16
17.
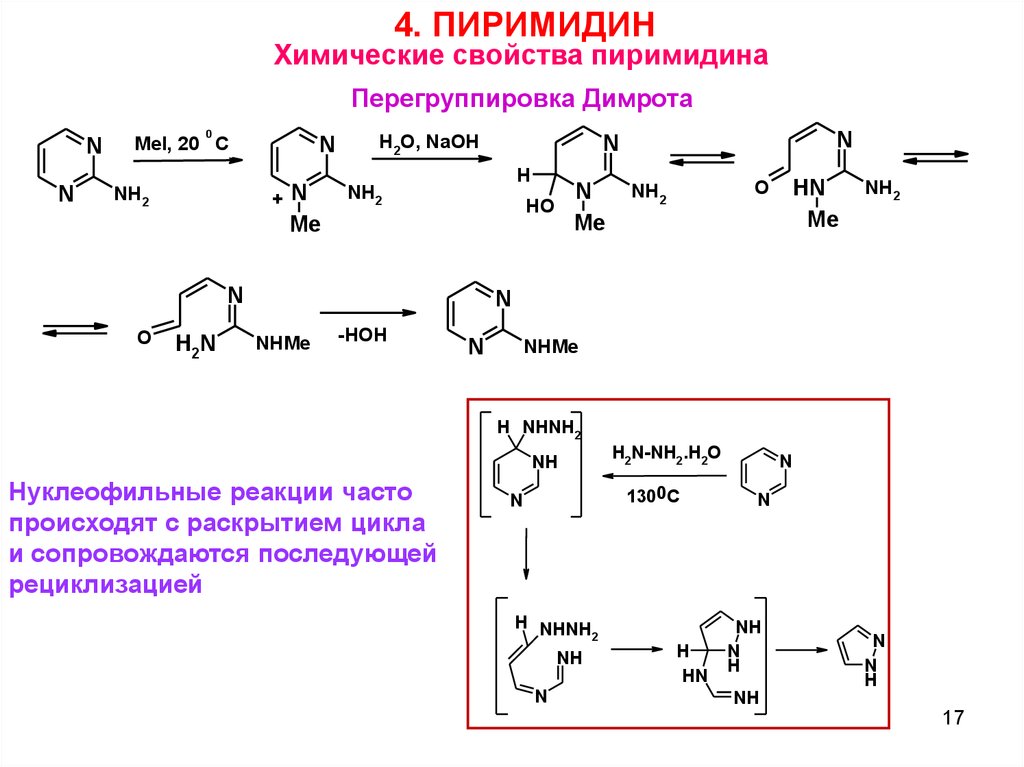
4. ПИРИМИДИНХимические свойства пиримидина
Перегруппировка Димрота
N
N
0
N
MeI, 20 C
+ N
Me
NH2
H2O, NaOH
H
NH2
O
H2N
N
Me
HO
N
N
N
HN
Me
O
NH2
NH2
N
NHMe
-HOH
N
NHMe
H NHNH2
NH
Нуклеофильные реакции часто
происходят с раскрытием цикла
и сопровождаются последующей
рециклизацией
H2N-NH2.H2O
1300C
N
H NHNH
2
NH
N
H
HN
N
N
NH
N
H
N
N
H
NH
17
18.
H3CПоложение 5 в пиримидиновом кольце
является предпочтительным для электрофильной атаки.
OH
OH
O2 N
АминоHNO3, CH3COOH
N
N
и гидроксигруппы
H3C
N
OH нивелируют
N
OH
влияние
атомов азота
Окисление пиримидинов H2O2 и надкислотами приводит к N-оксиду
N
m-CPBA
N
CHCl3
N
N+
O-
Образование
моно- и бисчетвертичных солей
I
Et
N
+
+ N IMe
+ Et3O BF4
N
N
MeI, MeOH
N
-
+N I
Me
18
4
19.
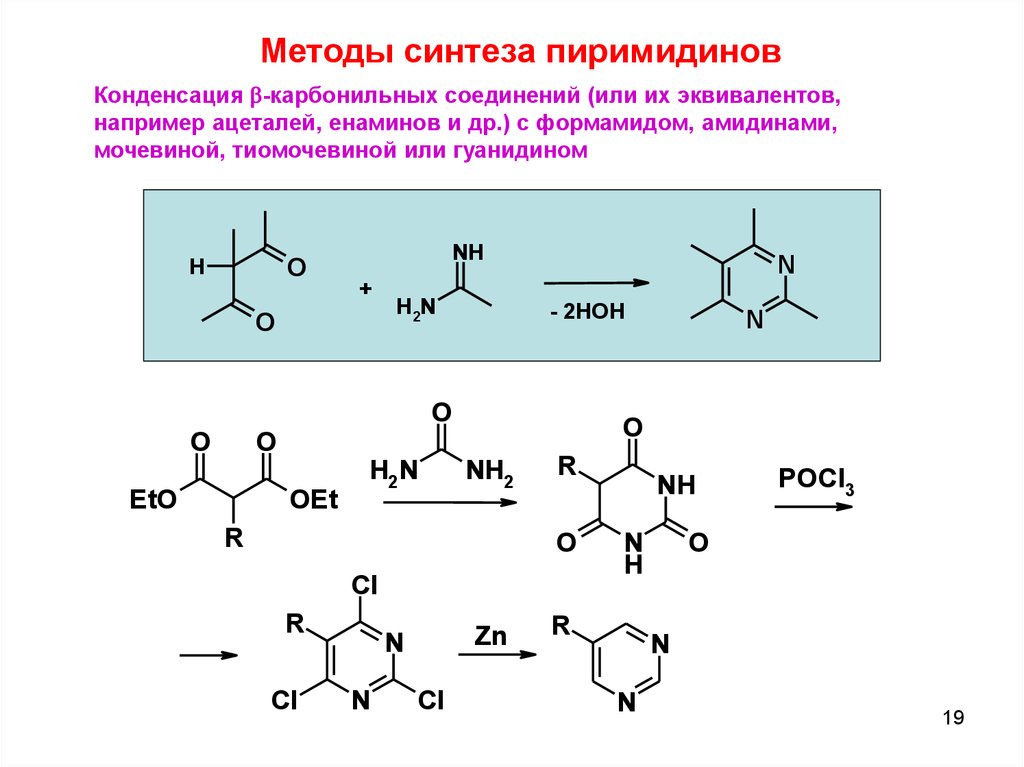
Методы синтеза пиримидиновКонденсация b-карбонильных соединений (или их эквивалентов,
например ацеталей, енаминов и др.) с формамидом, амидинами,
мочевиной, тиомочевиной или гуанидином
O
H
NH
+
O
H2N
N
- 2HOH
O
O
O
O
EtO
OEt
H2N
NH2
R
R
O
Cl
R
Cl
Zn
N
N
Cl
N
NH
N
H
R
POCl3
O
N
N
19 5
20.
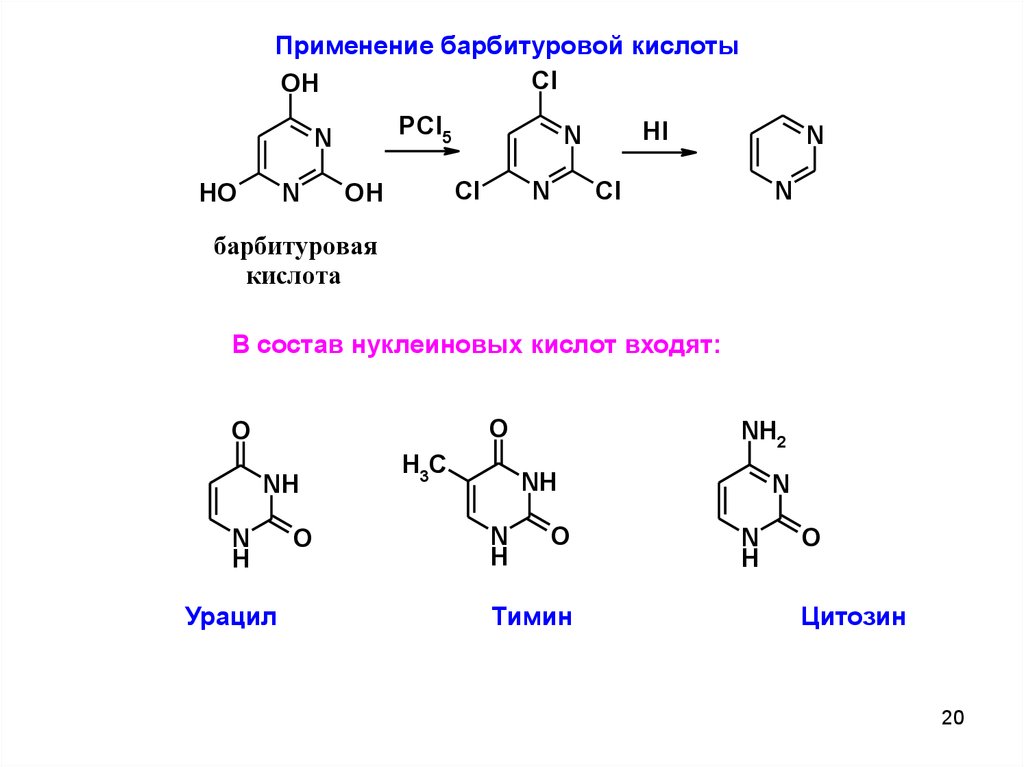
Применение барбитуровой кислотыCl
OH
PCl5
N
N
HO
N
Cl
OH
HI
N
N
N
Cl
барбитуровая
кислота
В состав нуклеиновых кислот входят:
O
O
NH
N
H
Урацил
O
H3C
NH2
NH
N
H
O
Тимин
N
N
H
O
Цитозин
20 6
21.
Синтезцитозина
NH2
N
OH
PCl5
N
HO
Cl
N
Cl
Cl
HOH
N
N
NH3
N
NH2
HO
цитозин
+
N
N
Cl
OH
HOH
N
H2N
N
N
H2N
N
изоцитозин
Другой метод синтеза цитозина - конденсация натриевой соли
формилуксусного эфира с S-этилтиомочевиной
SEt
COOEt H N
2
NH
ONa
Cl
OH
PCl5
N
EtS
EtS
N
EtS
HOH
N
N
NH2
NH2
N
NH3
N
N
HO
N
21
22.
Таутомерные превращения пиримидиновых основанийOH
O
N
HO
HN
N
O
N
H
кетонная (лактамная)
форма
енольная (лактимная)
форма
Нуклеозиды
O
O
NH
N
HO
O
H3C
NH
N
HO
O
N
OH
уридин (У)
HO
дезокситимидин (dT)
N
HO
O
O
HO
NH2
O
O
HO
OH
цитидин (Ц)
22 9
23.
OHNH2
Нуклеотиды
N
N
O
N
HOH2C
N
HOH2C
O
H H
цитидин-монофосфат
(ЦМФ)
H H
уридин-монофосфат
(УМФ)
OH
NH2
N
O
H H
H
H
O OH
HO P O
OH
аденозин-монофосфат
(АМФ)
N
N
N
N
HOH2C
O
H
H
O OH
HO P O
OH
H
H
O OH
HO P O
OH
N
O
H2N
HOH2C
N
N
O
H H
H
H
O OH
HO P O
OH
гуанозин-монофосфат
(ГМФ)
23 11
24.
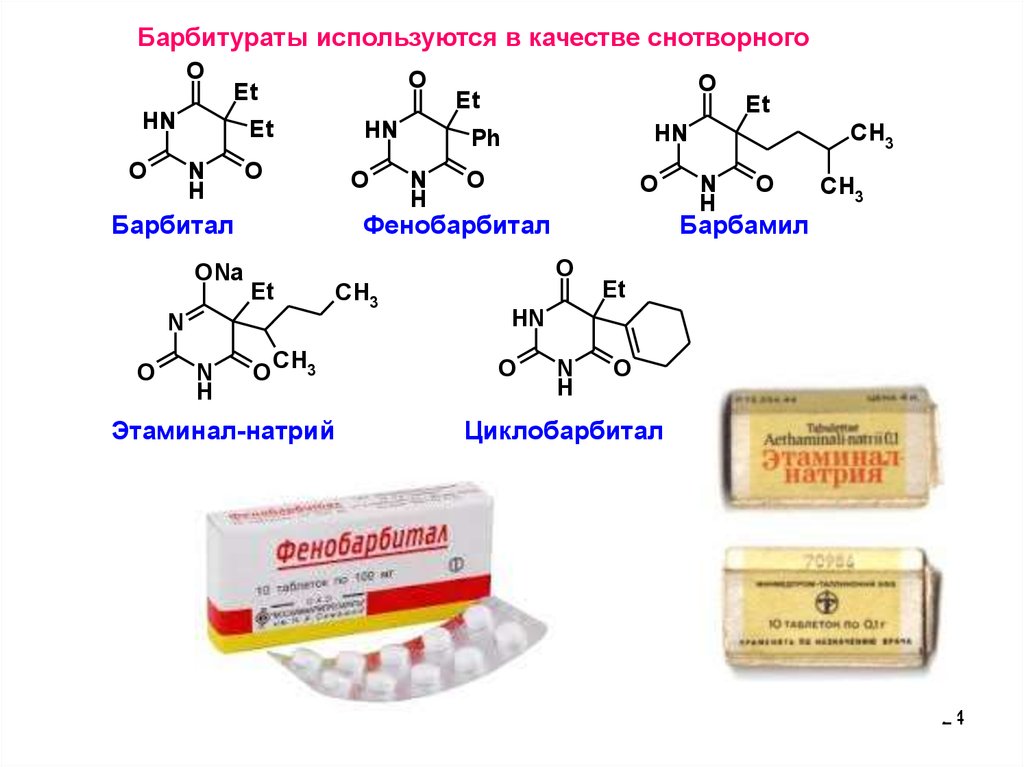
Барбитураты используются в качестве снотворногоO
HN
O
O
Et
Et
N
H
O
O
Барбитал
ONa
N
H
N
H
O
O
O
CH3
Этаминал-натрий
CH3
CH3
N
H
O
CH3
Барбамил
O
Et
Et
HN
Ph
Фенобарбитал
N
O
HN
O
Et
Et
HN
O
N
H
O
Циклобарбитал
24
25.
Схема синтеза барбитуратов на основе малонового эфира и мочевиныO
O
EtO
OEt
EtO
O
Na, EtOH
O
EtO
H2N
O
OEt
R
C2H5
OEt
2) RBr
O
NH2
O
1) Na, EtOH
C2H5
Na+
O
O
EtO
OEt
-
O
C2H5Br
C2H5
HN
O
R
N
H
O
R = C2H5 (барбитал), CH2CH2CH(CH3)2 (барбамил)
Комбинированный препарат беллатаминал
Действующие вещества:
эрготамина тартрат – 0,3 мг;
сумма алкалоидов красавки – 0,1 мг;
фенобарбитал – 20 мг в 1 таблетке.
25
26.
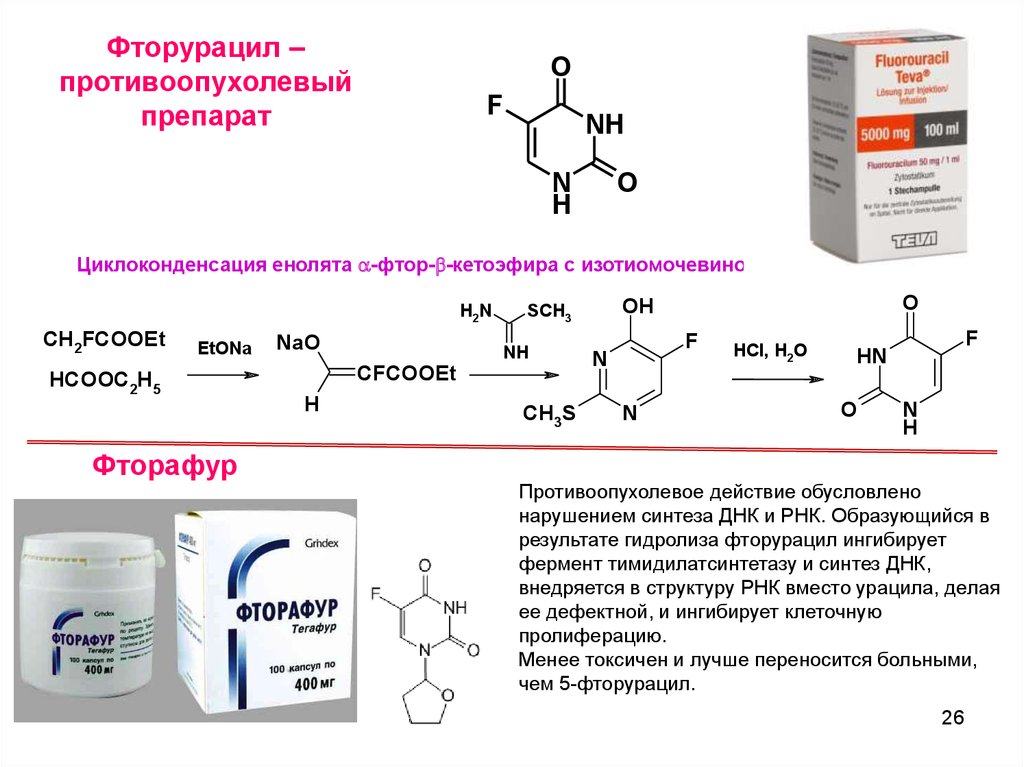
Фторурацил –противоопухолевый
препарат
O
F
NH
N
H
O
Циклоконденсация енолята a-фтор-b-кетоэфира с изотиомочевиной
H2N
CH2FCOOEt
EtONa
HCOOC2H5
Фторафур
NaO
NH
CFCOOEt
H
CH3S
O
OH
SCH3
F
N
N
HCl, H2O
F
HN
O
N
H
Противоопухолевое действие обусловлено
нарушением синтеза ДНК и РНК. Образующийся в
результате гидролиза фторурацил ингибирует
фермент тимидилатсинтетазу и синтез ДНК,
внедряется в структуру РНК вместо урацила, делая
ее дефектной, и ингибирует клеточную
пролиферацию.
Менее токсичен и лучше переносится больными,
чем 5-фторурацил.
26
27.
7Птеридин
(пиразино[2,3-d]пиримидин)
6
8
1
N
N
N
5
2
N3
4
птеридин
Птеридин в водном растворе проявляет свойства основания (рКа 11,21)
и кислоты (рКа 4,79)
7
6
8
1
N
N
2
HOH
N3
N
NH
N
4
5
N
N
H
OH
птеридин
Восстановление птеридина LiAlH4 приводит к 5,6,7,8-тетрагидроптеридину
N
N
N
LiAlH4
N
H
N
N
H
N
N
27 5
28.
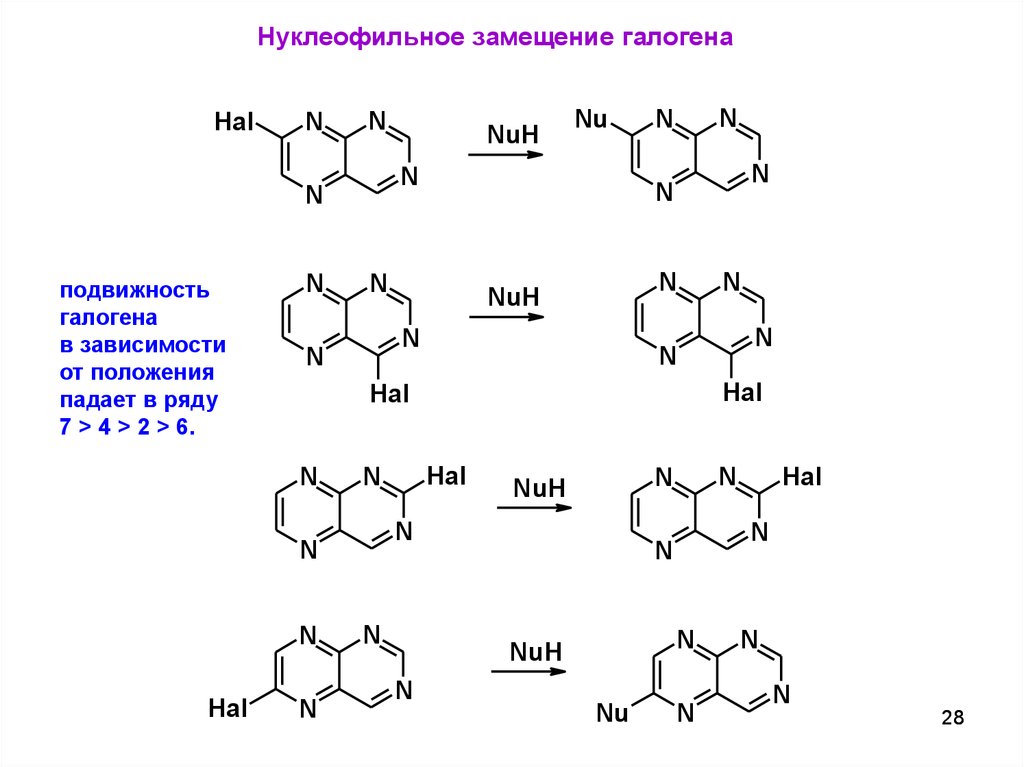
Нуклеофильное замещение галогенаHal
N
N
N
N
N
N
N
N
N
NuH
N
N
N
N
N
N
N
N
N
NuH
Nu
Hal
N
N
NuH
N
N
N
Hal
Hal
N
N
N
Hal
N
Hal
Nu
N
N
подвижность
галогена
в зависимости
от положения
падает в ряду
7 > 4 > 2 > 6.
NuH
N
N
N
28 6
29.
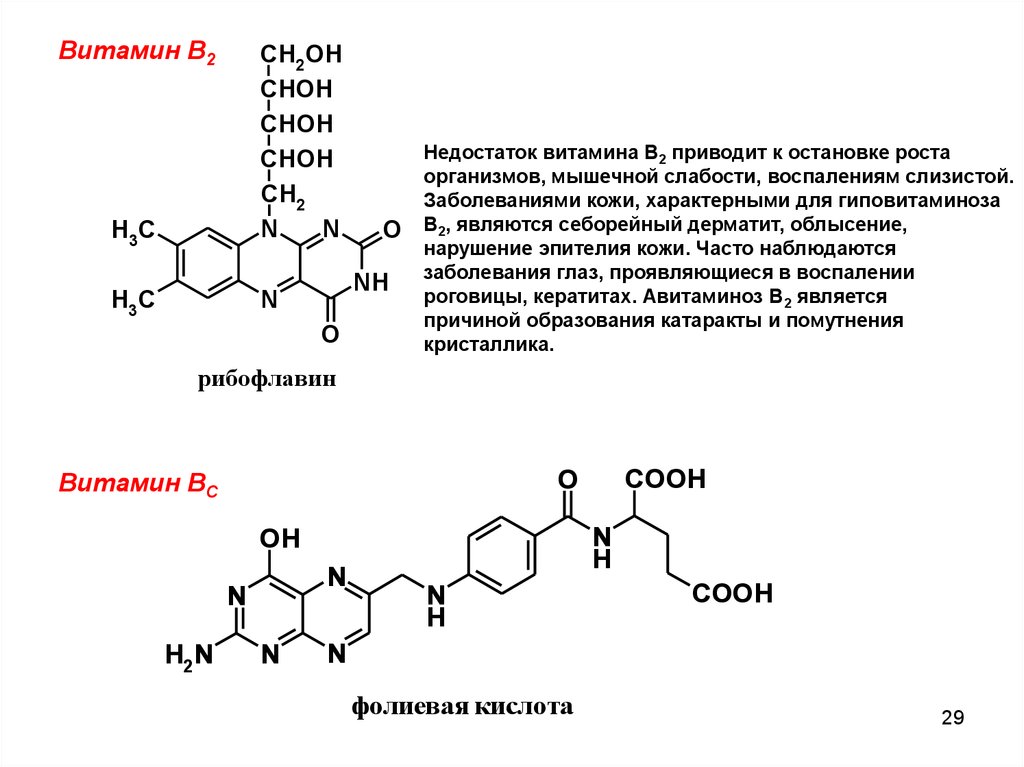
Витамин В2H3C
CH2OH
CHOH
CHOH
CHOH
CH2
N
N
H3C
N
O
NH
O
Недостаток витамина В2 приводит к остановке роста
организмов, мышечной слабости, воспалениям слизистой.
Заболеваниями кожи, характерными для гиповитаминоза
В2, являются себорейный дерматит, облысение,
нарушение эпителия кожи. Часто наблюдаются
заболевания глаз, проявляющиеся в воспалении
роговицы, кератитах. Авитаминоз В2 является
причиной образования катаракты и помутнения
кристаллика.
рибофлавин
Витамин ВC
N
H
OH
N
N
H2N
COOH
O
N
N
H
COOH
N
фолиевая кислота
29 8
30.
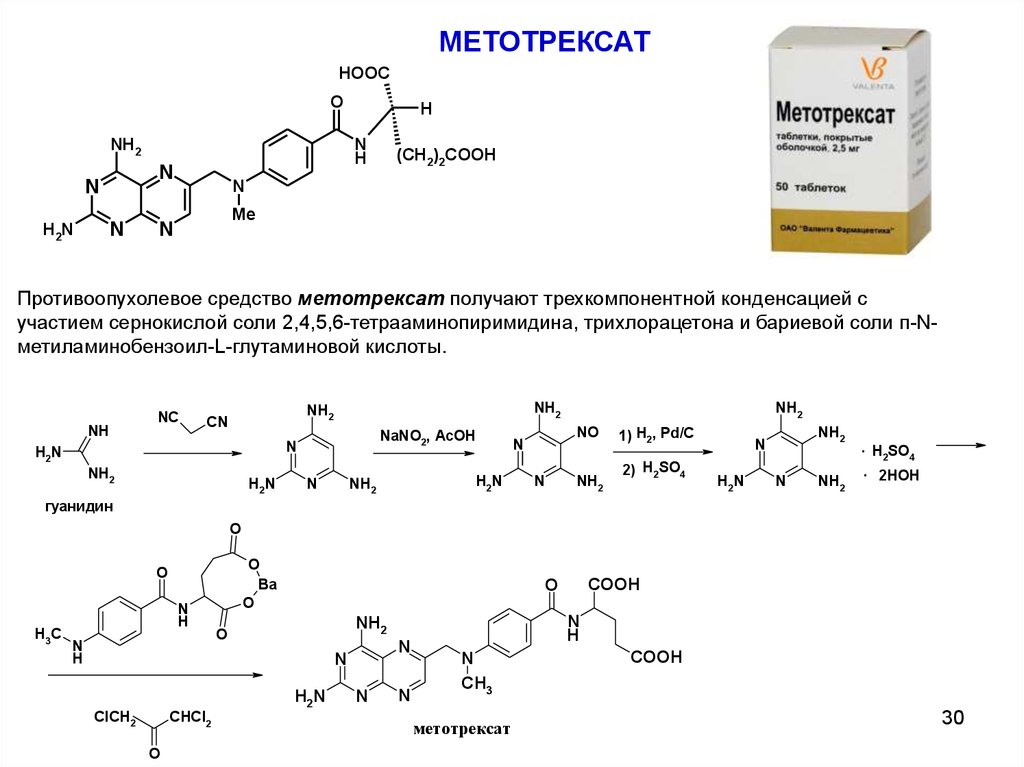
МЕТОТРЕКСАТHOOC
O
NH2
N
H2N
N
H
N
N
H
(CH2)2COOH
N
Me
N
Противоопухолевое средство метотрексат получают трехкомпонентной конденсацией с
участием сернокислой соли 2,4,5,6-тетрааминопиримидина, трихлорацетона и бариевой соли п-Nметиламинобензоил-L-глутаминовой кислоты.
NC
NH
NH2
NH2
CN
NaNO2, AcOH
N
H2N
NH2
H2N
N
H2N
NH2
NH2
NO
N
N
NH2
1) H2, Pd/C
2) H2SO4
NH2
N
H2N
N
NH2
. H SO
2
4
. 2HOH
гуанидин
O
O
Ba
O
O
H3C
N
H
N
H
H2N
CHCl2
O
N
H
NH2
O
N
N
ClCH2
COOH
O
N
N
N
CH3
метотрексат
COOH
30
31.
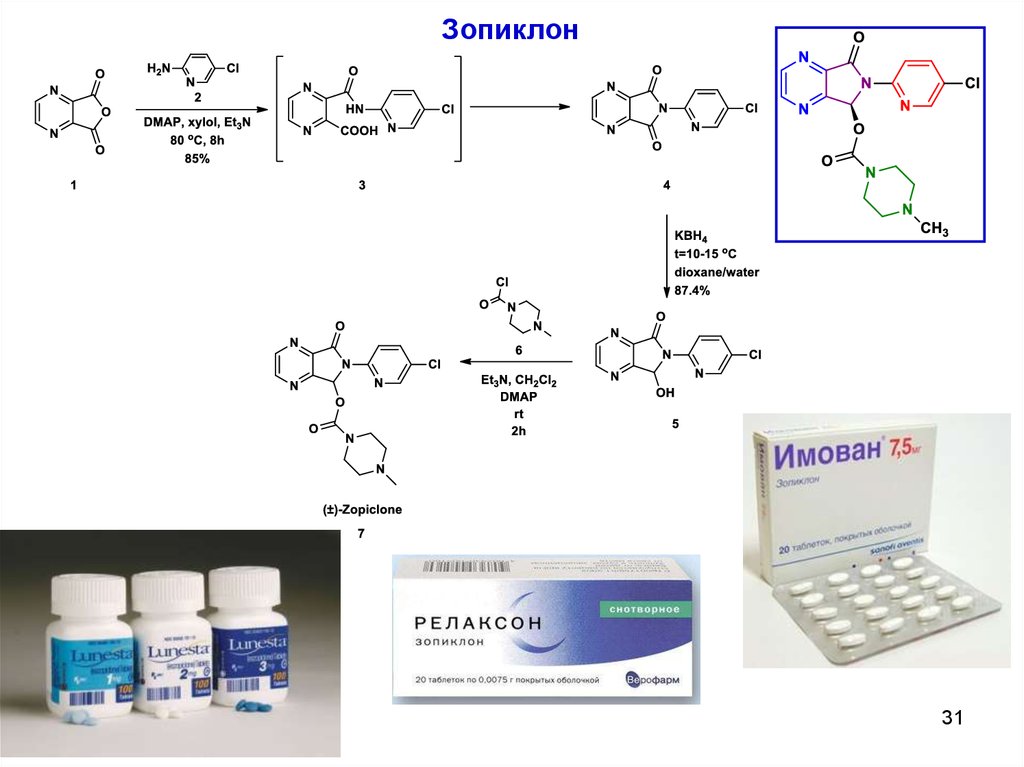
Зопиклон31
32.
Курс лекций является частью учебно-методического комплекса«Химия биологически активных веществ»
автор:
Носова Эмилия Владимировна, д.х.н., доцент кафедры органической и биомолекулярной
химии УГТУ-УПИ
Учебно-методический комплекс подготовлен на кафедре органической химии
химико-технологического института УрФУ
Никакая часть презентации не может быть воспроизведена в
какой бы то ни было форме без письменного разрешения авторов
32 14












 biology
biology chemistry
chemistry