Similar presentations:
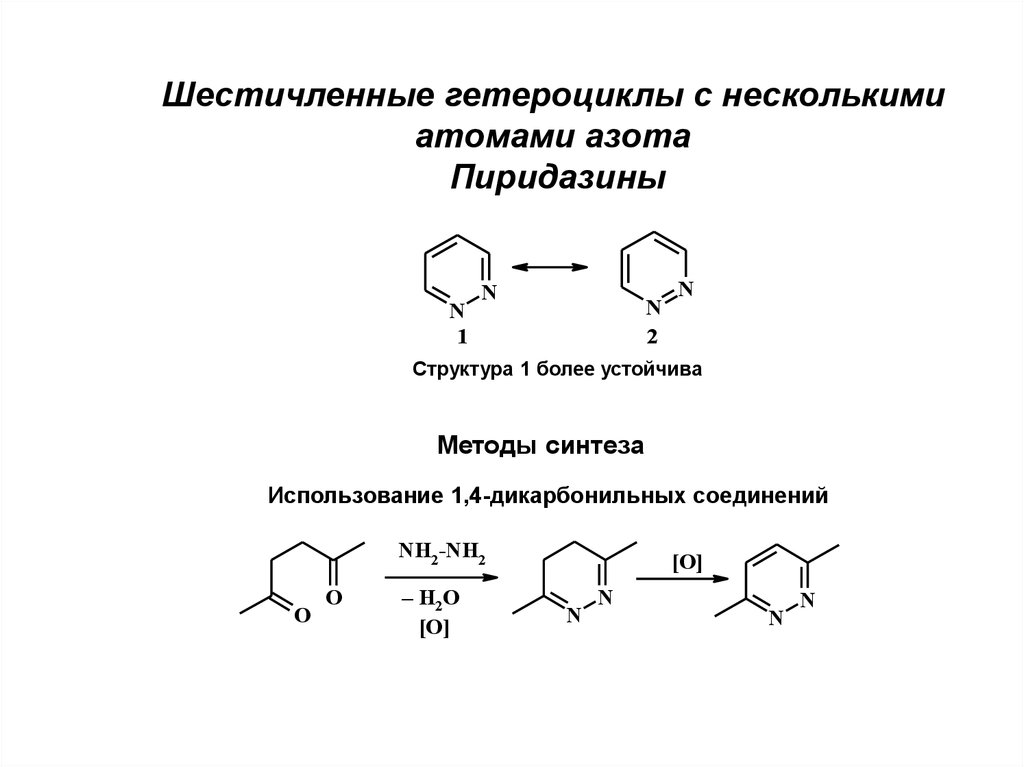
Шестичленные гетероциклы с несколькими атомами азота. Пиридазины
1.
Шестичленные гетероциклы с несколькимиатомами азота
Пиридазины
N
1
N
N
2
N
Структура 1 более устойчива
Методы синтеза
Использование 1,4-дикарбонильных соединений
NH2 -NH2
O
O
– H2O
[O]
[O]
N
N
N
N
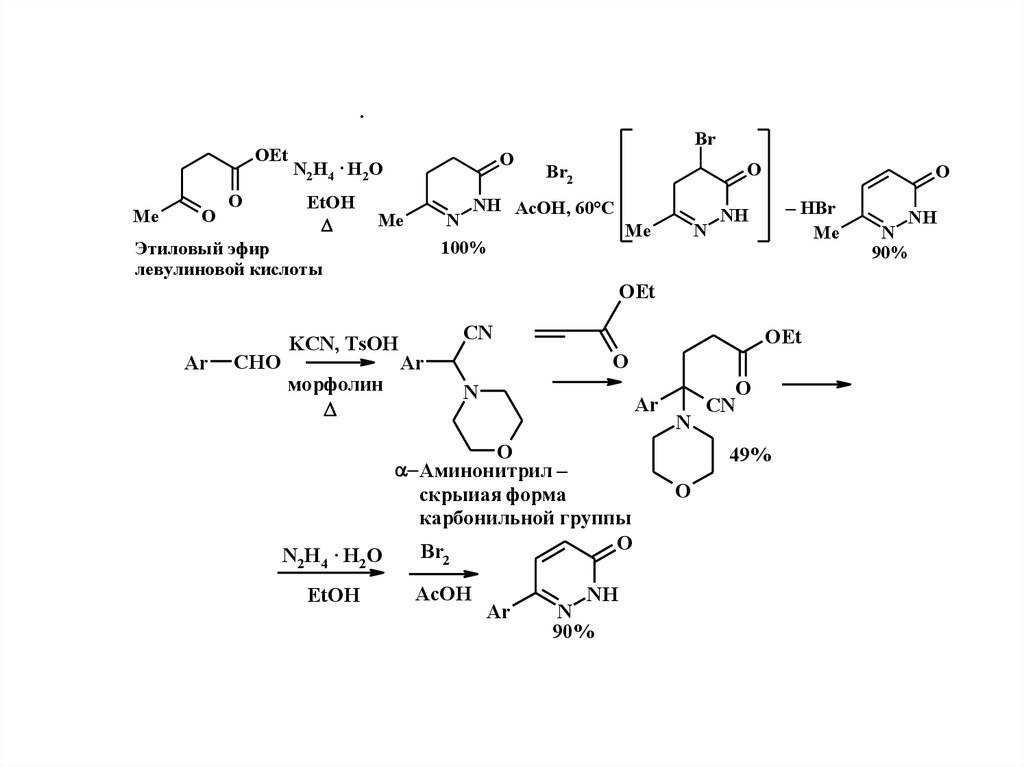
2.
.OEt
Me
O
O
Br
O
N2H4 · H2O
EtOH
O
Br2
NH AcOH, 60°C
N
Me
100%
Me
Этиловый эфир
левулиновой кислоты
N
O
– HBr
Me
NH
OEt
Ar
CHO
KCN, TsOH
морфолин
N2H4 · H2O
EtOH
CN
OEt
O
Ar
N
Ar
O
Аминонитрил –
скрыиая форма
карбонильной группы
O
Br
2
AcOH
Ar
NH
N
90%
N
O
CN
49%
O
NH
N
90%
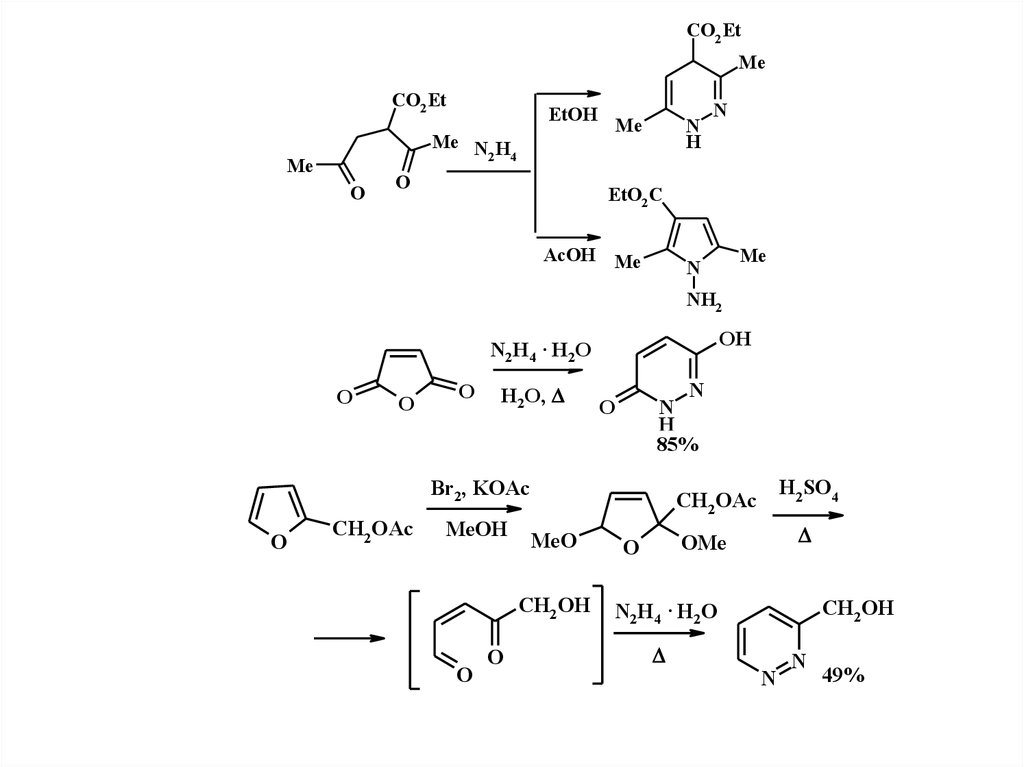
3.
CO2 EtMe
CO2 Et
EtOH
Me
Me N H
2 4
Me
O
O
N
H
N
EtO2 C
AcOH Me
Me
N
NH2
OH
N2H4 · H2O
O
O
O
H2O,
N
N
H
85%
O
Br2, KOAc
O
CH2 OAc
MeOH
MeO
CH2 OH
O
O
H2SO4
CH2 OAc
OMe
O
CH2 OH
N2H4 · H2O
N
N
49%
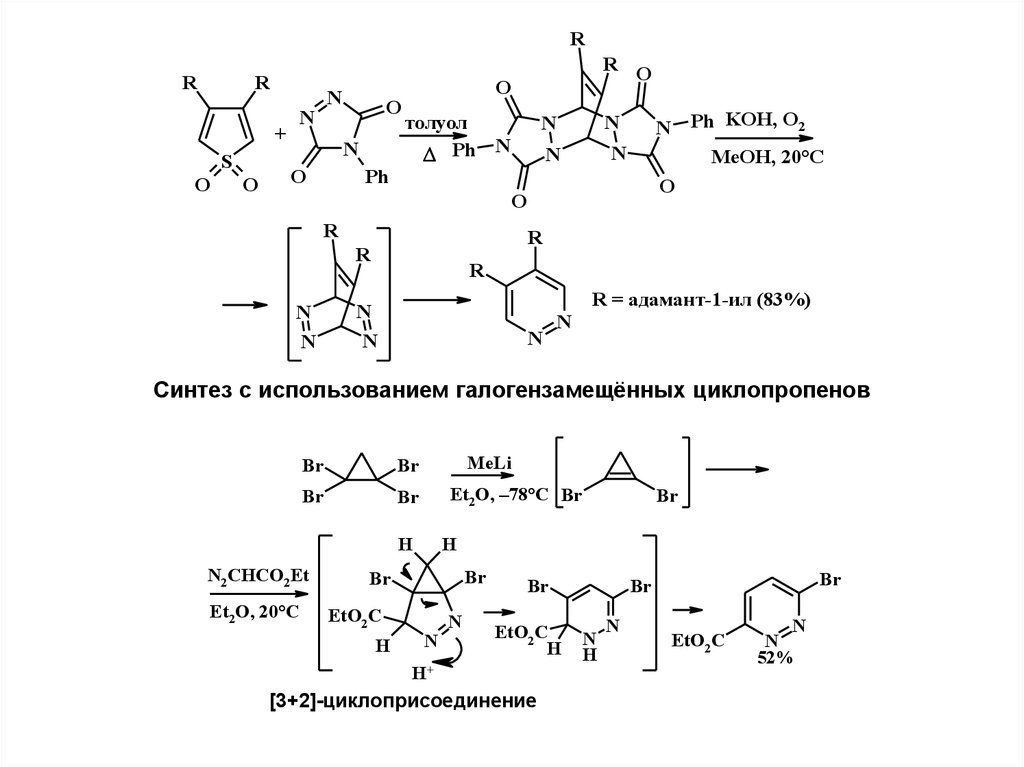
4.
Трансформации других гетероцикловNO2
N
N
Ph
NO2
N
N
+
диоксан
Me2N
N
NMe2
NO2
Me2N
N
N
N – N2
NO2
– Me2NH
Ph
R
2
N
R
R
N
N
1
N
N
R
R
R
N N
N
2
R
2
диоксан
R
2
R
N
N
1
R
2
2
R
- N2
R
N
N
1
5.
RR
R
N
+
S
O
O
N
O
N
Ph
O
R O
O
толуол
Ph N
N Ph KOH, O2
MeOH, 20°C
O
N
N
N
N
O
R
R
R
N
N
R
R = адамант-1-ил (83%)
N
N
N
N
Синтез с использованием галогензамещённых циклопропенов
Br
Br
Br
Br
MeLi
Et2O, –78°C Br
H
H
N2CHCO2Et
Et2O, 20°C
Br
Br
EtO2 C
H
Br
N
N
Br
EtO2 C
H
H+
[3+2]-циклоприсоединение
Br
Br
N
H
N
EtO2 C
N
N
52%
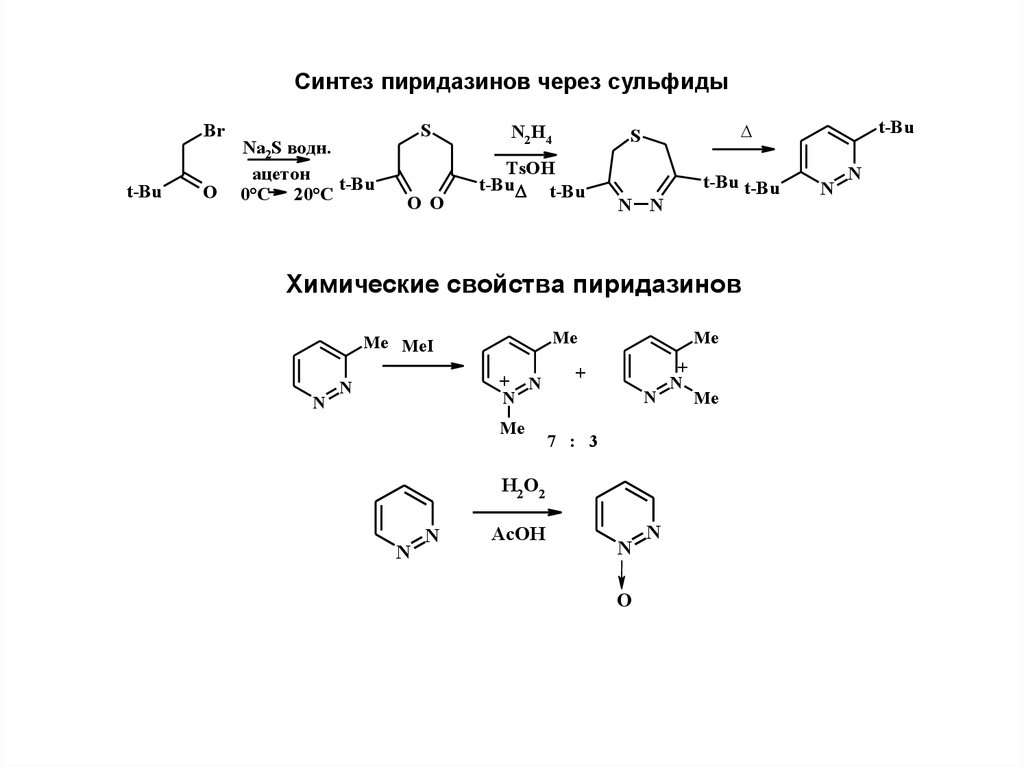
6.
Синтез пиридазинов через сульфидыBr
t-Bu
O
Na2S водн.
ацетон
t-Bu
0°С 20°С
S
O O
N2 H4
TsOH
t-Bu t-Bu
t-Bu t-Bu
N N
Химические свойства пиридазинов
N
+ N
N
N
Me
Me
Me MeI
Me
+
N
7 : 3
H2 O2
N
N
AcOH
N
O
t-Bu
S
N
+
N
Me
N
N
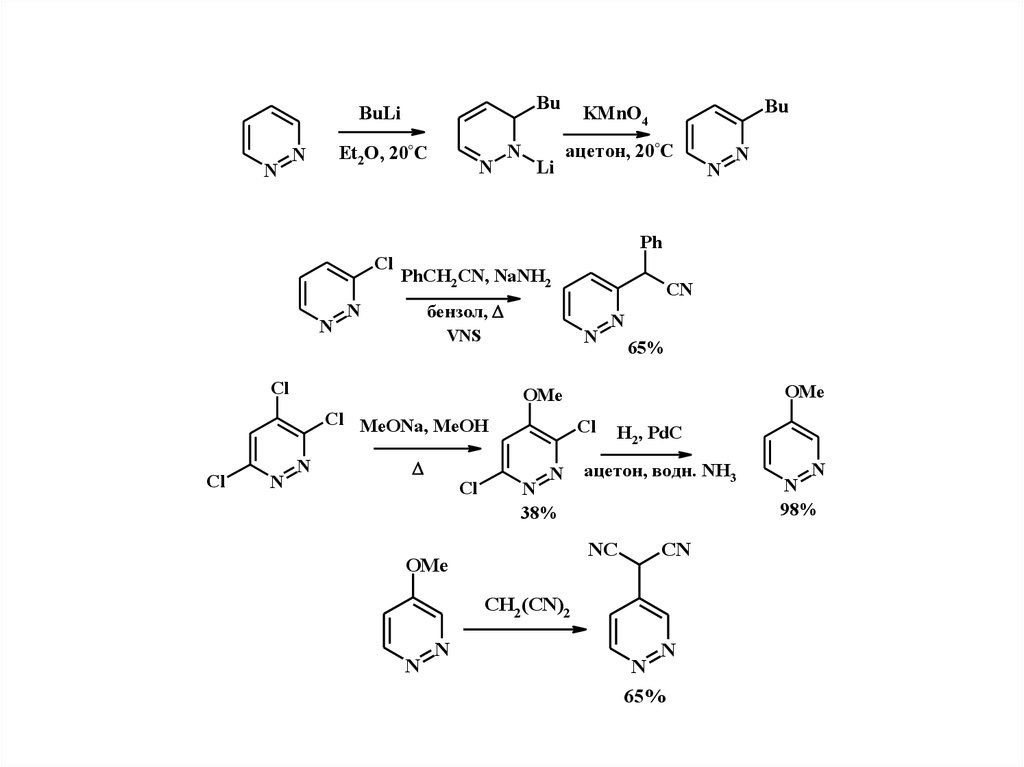
7.
BuBuLi
N
Et2O, 20°C
N
N
N
Li
Bu
KMnO4
ацетон, 20°С
N
N
Ph
Cl
N
PhCH2CN, NaNH2
N
VNS
Cl
N
N
65%
OMe
OMe
Cl MeONa, MeOH
Cl
CN
бензол,
N
N
Cl
Cl
N
N
38%
H2, PdC
ацетон, водн. NH3
NC
OMe
CN
CH2 (CN)2
N
N
N
N
65%
N
N
98%
8.
II
N
N
водн. MeOH
MeNH2
Me
N
N
I
MeNH2
+
NC
NC
O
CN
ТГФ
CN
0°C
N
N
толуол, водн. Na2CO3
MeNH2
Me
+ N
N
- CH(CN)
t-BuOK, ТГФ, ДМФА
0°С
+ N
N
- CH(CN)
71%
CH2SO3 -p-Tol
Me
(NH4)2S2O5
N
N
Me
ClCH2SO3-p-Tol
78%
N
N
CH2SO3 -p-Tol
2
MeOH
Ph
PhB(OH)2, Pd(PPh3)4
2
9.
ПиразиныN
N
Методы синтеза
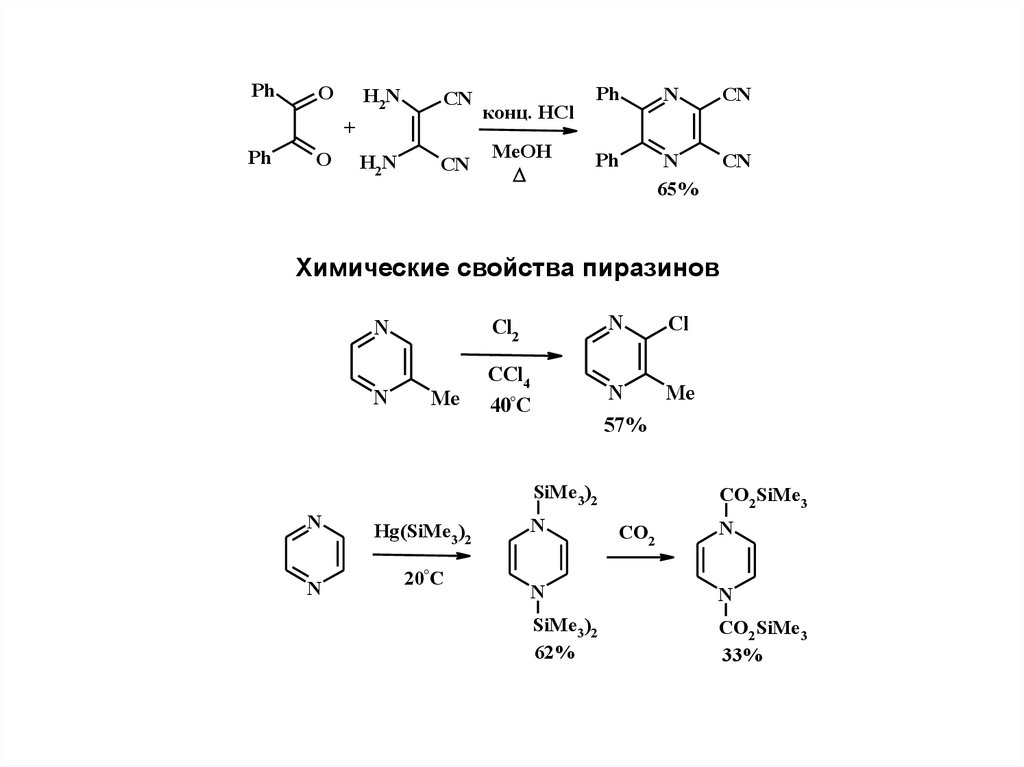
Самоконденсация 2-аминокетонов
R
O
H2N
R
+
1
R
NH2
O
R
PhCH2COCl
H2, Pd
Bn
O H2N
[O]
- H2 O
CH2N2
Bn
+
NH2 O
1
Bn
– 2H2O
1
R
N
R
1
N
R
R
PhCH2COCH2N2+
Bn
N
N
Bn
N
N
Bn
10.
Cl–EtO
O
Bn
NH3
+
H3N
Bn
O
OEt
+
Cl–
+
Bn
EtO
NH3, MeOH
N
N
45%
20°C
OEt
H
N
Bn
O
DDQ
бензол
Bn
O Et O+BF 3
4
N
H
60%
Bn
N
EtO
N
60%
Bn
CH2 Cl2
OEt
Bn
Из 1,2-дикарбонильных соединений и 1,2-диаминов
Me
O
H2N
+
Et
O
H2N
Et2 O
0oC
Me
Et
N
N
60%
хромит меди Me
300oC
Et
N
N
90%
11.
PhO
H2N
CN
H2N
CN
+
Ph
O
конц. HCl
MeOH
Ph
Ph
N
CN
N
65%
CN
Химические свойства пиразинов
N
Cl2
N
Cl
N
CCl4
40°C
N
Me
Me
57%
SiMe3 )2
N
N
Hg(SiMe3 )2
20°C
N
CO2SiMe3
CO2
N
N
N
SiMe3 )2
62%
CO2SiMe3
33%
12.
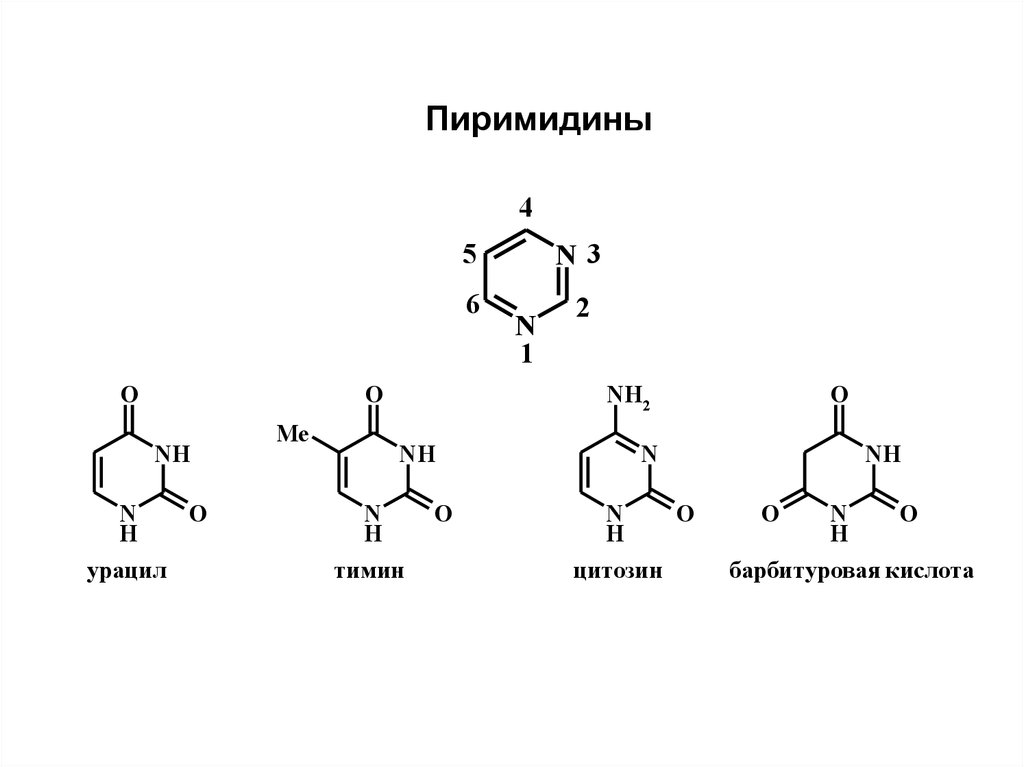
Пиримидины4
O
O
NH
N
H
урацил
O
Me
5
N3
6
2
N
1
NH2
NH
N
H
тимин
O
O
N
N
H
цитозин
NH
O
O
N
H
O
барбитуровая кислота
13.
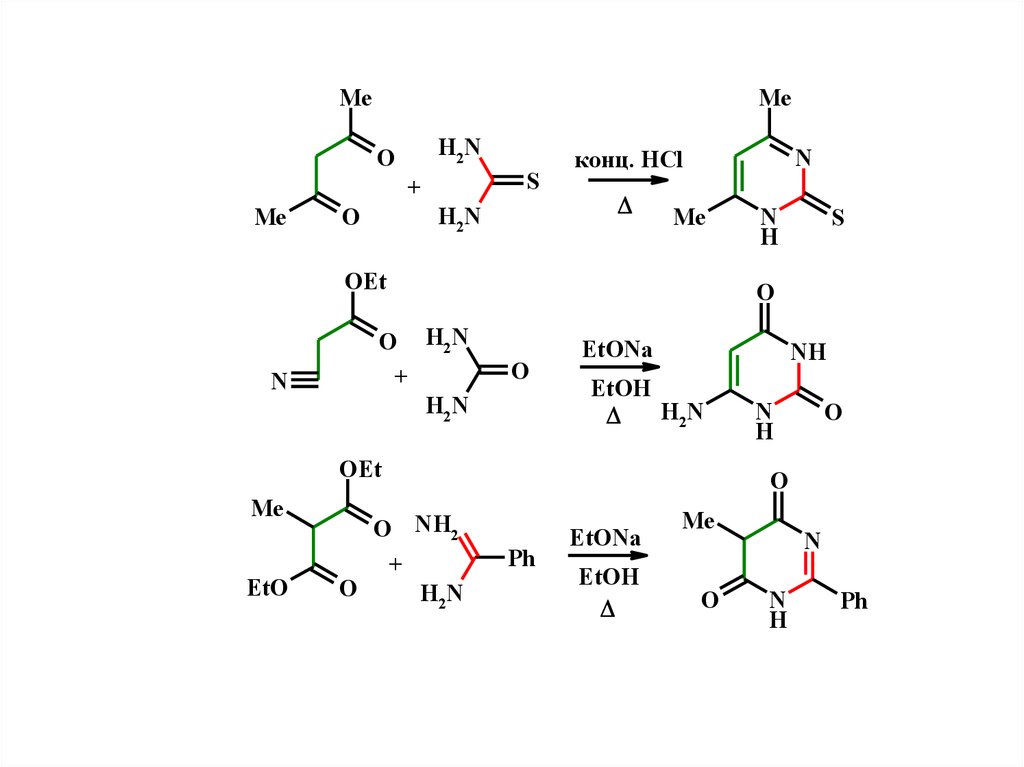
Методы синтеза пиримидиновN
N
трехуглеродный фрагмент
бисэлектрофил
1,3-дикарбонильное соединение
+
N-C-N
бинуклеофил
производные мочевины
мочевины
тиомочевины
гуанидин - NH=C(NH2)2
14.
MeN
Me
Me
Me
O
N
H
S
Me
N
H
O
NH2
Me
S
O
H2N
+
H2N
S
4,6-пиримидин-2-тион
O
NH
H2N
N
H
OEt
O
NH
O
N
H2N
O
N
H2N
O
H2N
O
+
6-аминоурацил
O
Me
O
O
NH
N
H
Ph
Me
OEt
Me
N
EtO
O H2N
5-метил-2-фенилпиримидин-4,6-дион
Ph
EtO
O NH2
+
O
H2N
Ph
15.
MeMe
H2N
O
S
+
Me
H2N
O
N
конц. HCl
Me
OEt
N
O H2N
+
H2N
EtO
O NH2
+
O
H2N
S
O
O
EtONa
NH
EtOH
H2N
OEt
Me
N
H
N
H
O
O
Ph
EtONa
EtOH
Me
O
N
N
H
Ph
16.
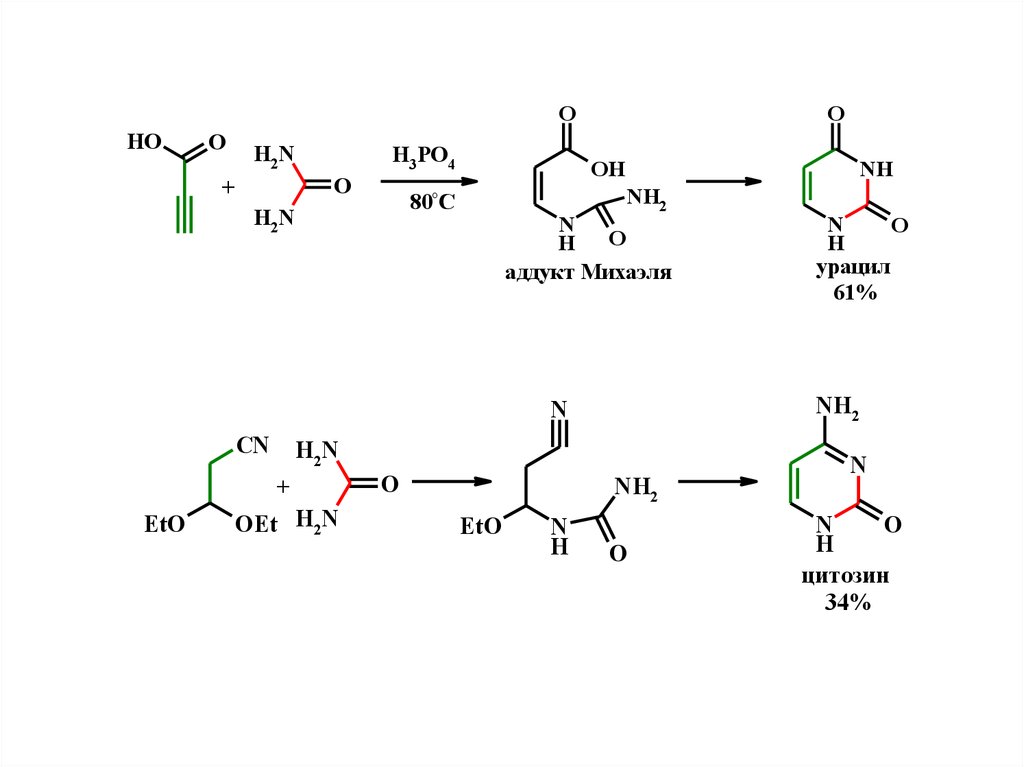
OHO
O
H2N
H3 PO4
O
+
OH
NH
NH2
80°C
H2N
O
N
H O
аддукт Михаэля
NH2
N
CN
H2N
+
EtO
OEt H2N
O
NH2
EtO
N
H
N
O
H
урацил
61%
O
N
N
O
H
цитозин
34%
17.
HCONH2Ph N C CHCHO
HCONHCH=CHCHO
H
Me
переаминирование
HCONH2
N
N
53%
енаминоальдегида
CHO
H2N
O
NH
CHO
H
N
3MeCN
MeOK
140°C
NH2
N
Me
N
Me
Me
N
67%
Me
18.
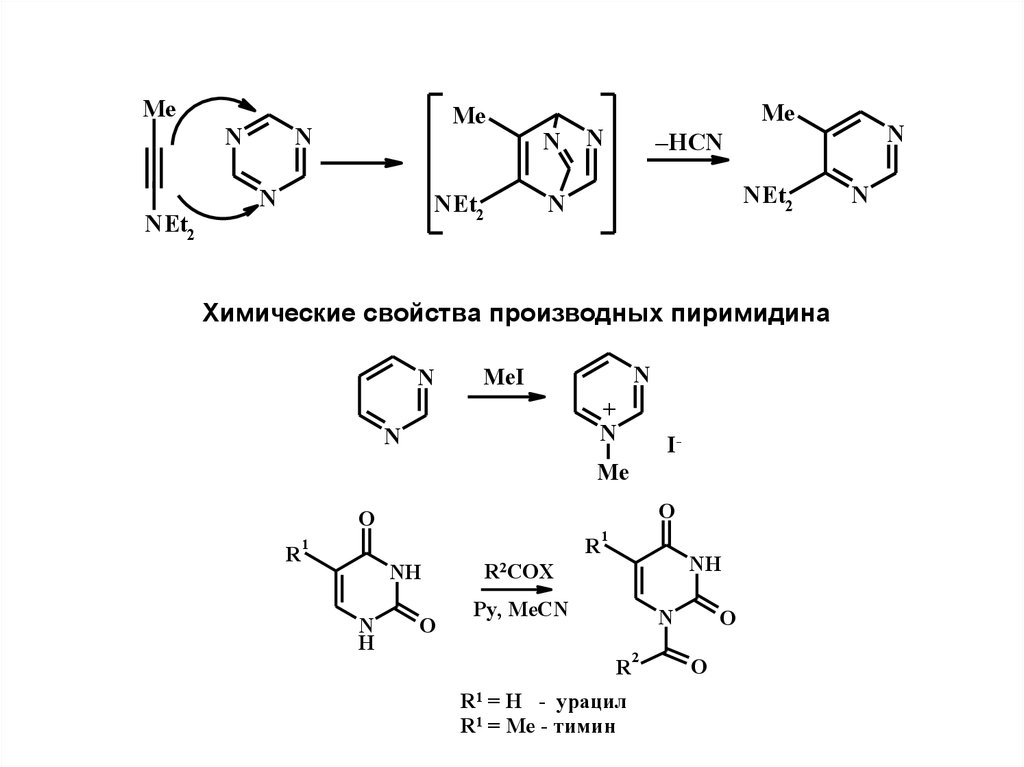
MeN
NEt2
Me
N
N
NEt2
N
Me
N
NEt2
N
Химические свойства производных пиримидина
N
N
MeI
+
N
N
I-
Me
O
O
R
R
1
NH
N
H
O
N
–HCN
1
NH
R2COX
Py, MeCN
N
R
R1 = H - урацил
R1 = Me - тимин
2
O
O
N
19.
CO 3HN
N
Cl
N
+
N
или H2O2
O
NH2
N
H2N
N
NH2
NH2
HNO2
ON
H2N
N
N
[H]
H2N
H2N
N
N
20.
Электрофильное замещение в молекуле урацилаЭлектрофил
Условия реакции
Выход, 5
NO2+
HNO3 (d=1.5), 75oC
90
Br+
Br2, H2O, 100oC
90
Cl+
N-хлорсукцинимид,
AcOH, 50oC
52
F+
F2, AcOH, 10oC
92
CH2=N+Me2
(CH2O)n, Me2N, 78oC
76
(CH2O)n, HCl, 80oC
57
+CH
2Cl
21.
OBr2, H2 O
NH
N
H
O
O
Br
NH
HO
O
Br
N
H
NH
- H2O
O
N
H
O
Нуклеофильное замещение
Cl
Cl
N
Y
Y–
N
N
Cl
–
N
Cl
N
OMe
N
MeONa, MeOH
Cl
20°C
N
N
N
– Cl–
N
N
N
Y
Y
Cl
22.
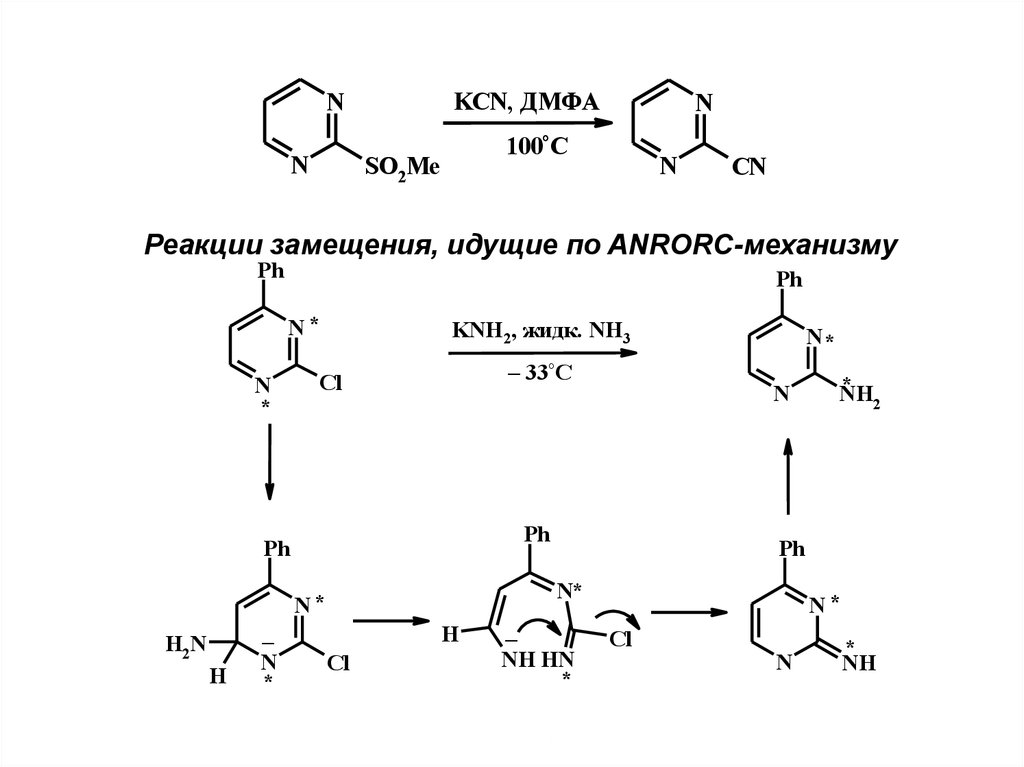
KCN, ДМФАN
N
N
100°C
SO2Me
N
CN
Реакции замещения, идущие по ANRORC-механизму
Ph
Ph
N*
N
*
KNH2, жидк. NH3
– 33°C
Cl
H
–
N
*
H
Cl
*
NH
2
Ph
N*
N*
H2N
N
Ph
Ph
N*
–
NH HN
*
N*
Cl
N
*
NH
23.
Перегруппировка ДимротаN
N
N
OH–
NH
HO
R
N
NH
медленно
R
N
O
N
R
N
NH
N
NHR
24.
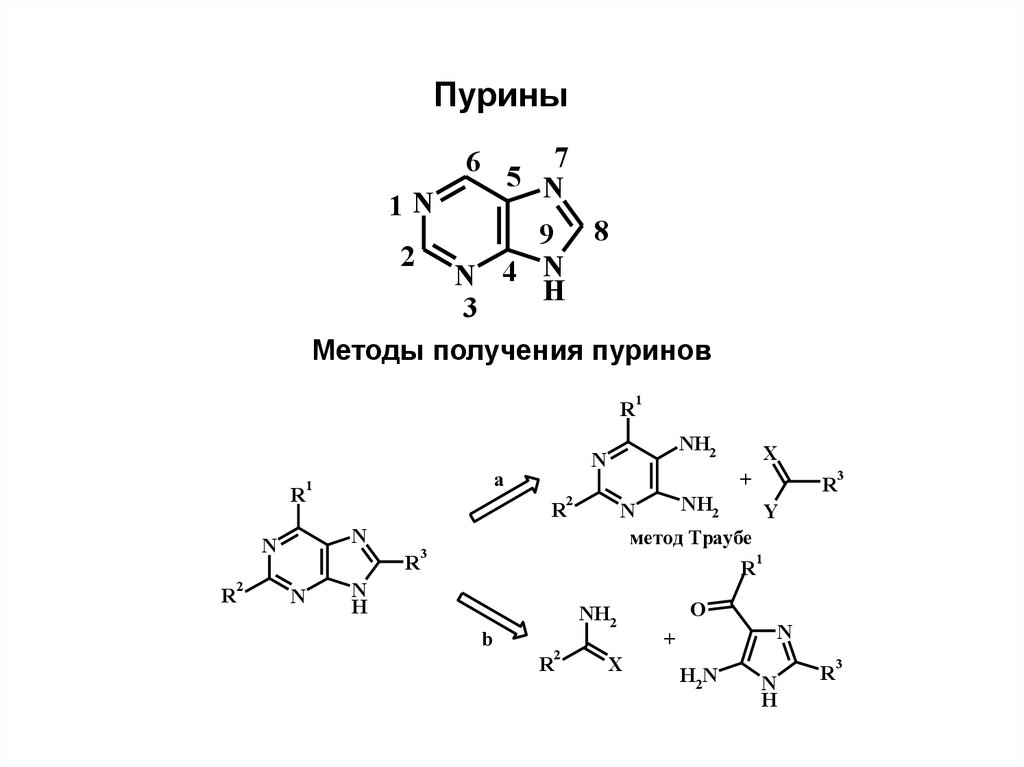
Пурины7
5 N
6
1N
9 8
2
N 4 N
H
3
Методы получения пуринов
R
R
R
2
R
N
N
R
N
NH2
N
a
1
1
X
+
NH2
N
Y
метод Траубе
2
3
R
N
H
NH2
b
R
2
X
R
3
1
O
N
+
H2N
N
H
R
3
25.
Синтез ТраубеO
NH2
HN
H2N
HCO2H
NH2
N
O
H2N
H2NCONH2
NH2
N
H
NH2
N
Ac2 O
NH2
HN
N
NHMe
O
NHCOMe
N
N
H
N
H
H
N
HN
S
N
N
H
Me
N
O
O
N
N
NH2
CS2, Py
N
H
H
N
HN
NH2
N
H
100%
N
O
NHCNH2
N
NH2
O
O
H2N
O
HN
N
HN
NH2
N
O
NH2
N
NHCHO
HN
O
HN
O
O
N
Me
26.
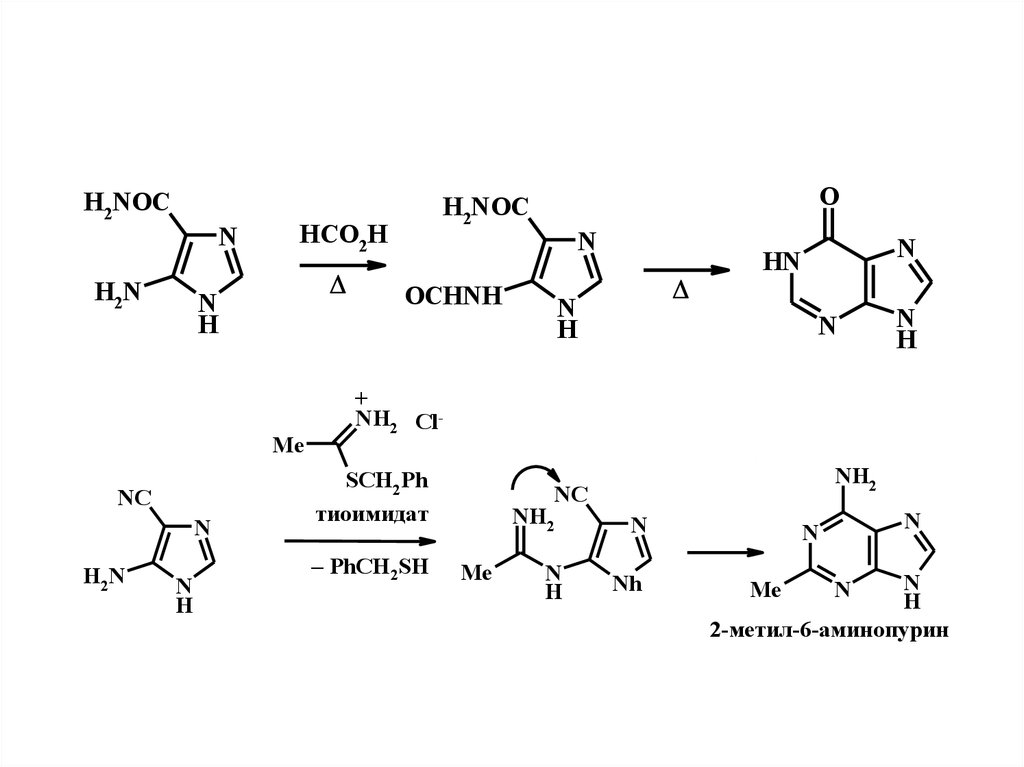
H2NOCN
H2N
HCO2H
N
H
Me
NC
N
H2N
N
H
O
H2NOC
N
OCHNH
N
H
N
HN
N
N
H
+
NH2 ClSCH2 Ph
тиоимидат
– PhCH2SH
NH2
NC
NH2
Me
N
H
N
Nh
N
N
N
H
2-метил-6-аминопурин
Me
N
27.
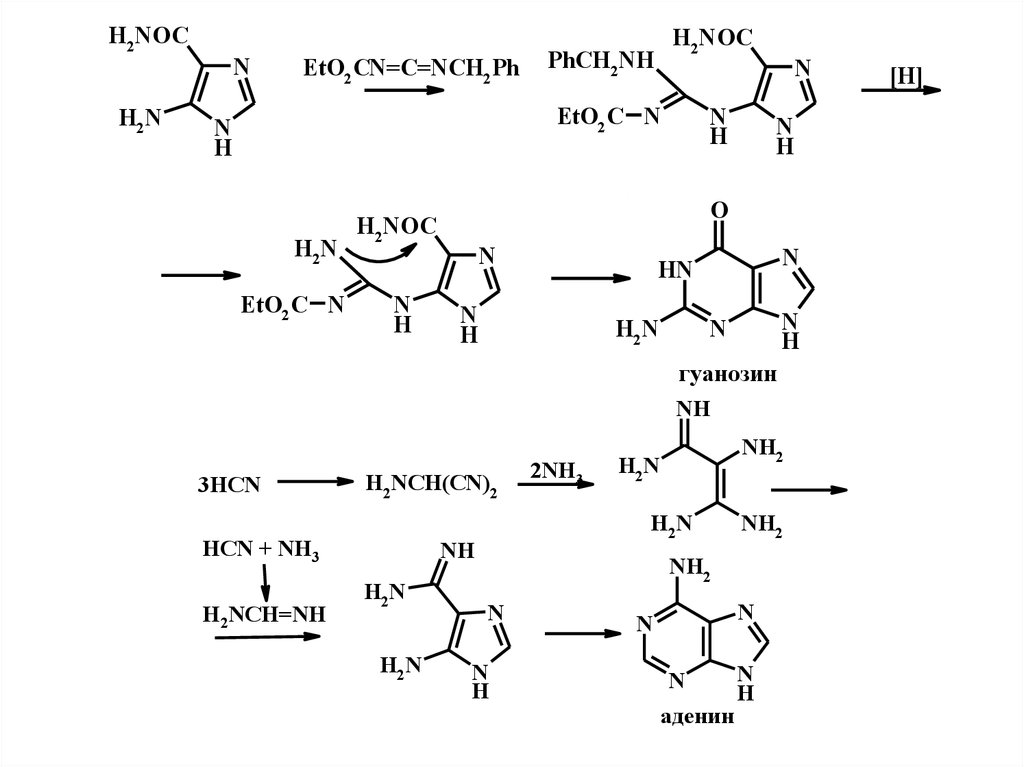
H2NOCH2N
N
EtO2 CN=C=NCH2 Ph
H2NOC
PhCH2NH
EtO2 C N
N
H
H2N
EtO2 C N
N
H
O
H2NOC
N
H
N
H
N
N
N
HN
N
H
H2N
N
H
N
гуанозин
NH
3HCN
H2NCH(CN)2
HCN + NH3
H2NCH=NH
H2N
H2N
H2N
NH
H2N
2NH3
NH2
NH2
NH2
N
N
H
N
N
N
аденин
N
H
[H]
28.
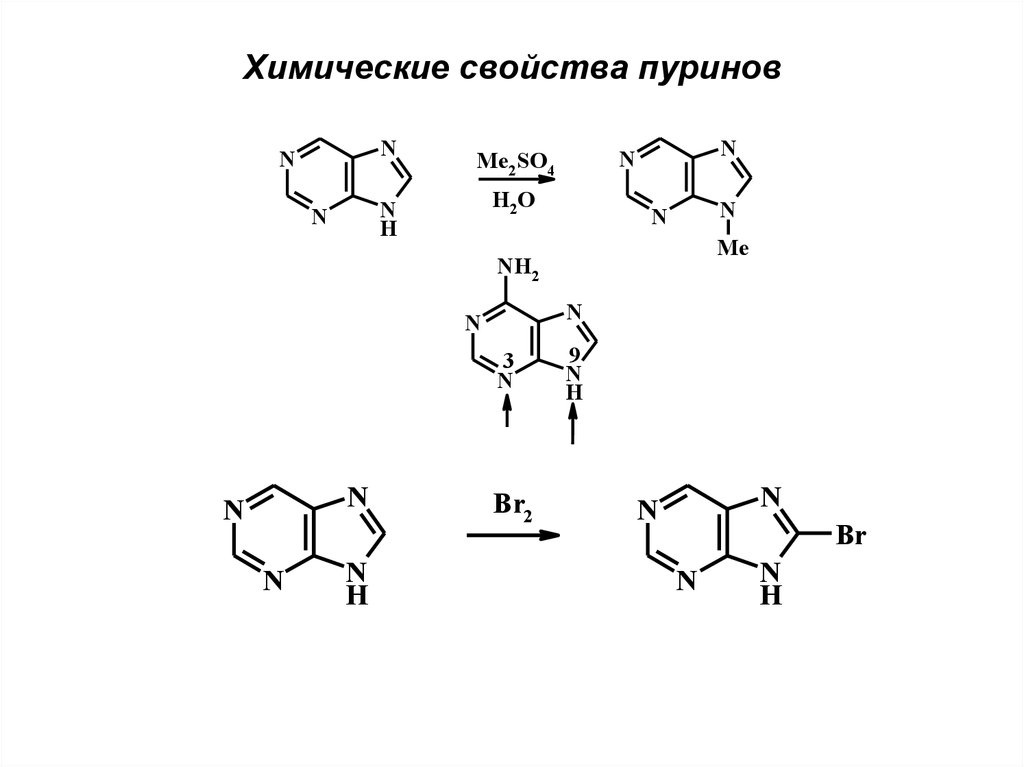
Химические свойства пуриновN
N
H2 O
N
H
N
N
N
Me2SO4
N
N
Me
NH2
N
N
3
N
N
N
N
N
H
Br2
9
N
H
N
N
Br
N
N
H
29.
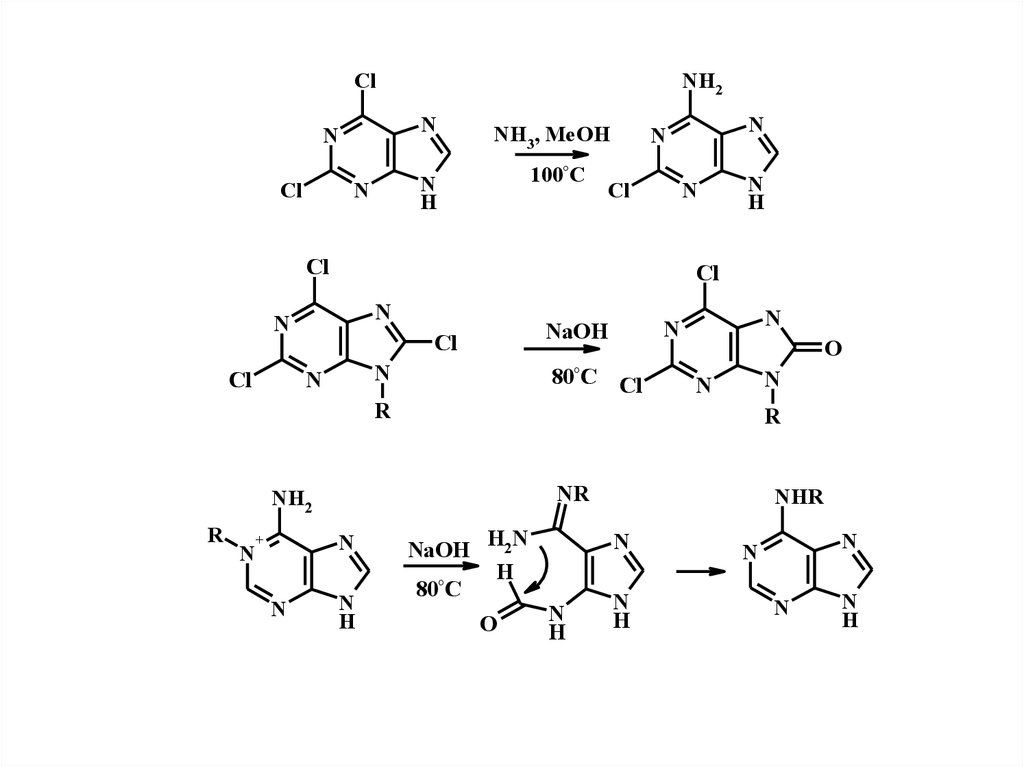
ClN
Cl
N
NH2
N
NH3, MeOH
N
H
100°C
Cl
N
Cl
N
H
Cl
N
N
Cl
N
N
Cl
N
N
80°C
N
N
NaOH
Cl
O
N
N
R
R
NR
NH2
R
N
N
+
N
N
H
NaOH
80°C
H2N
H
O
NHR
N
N
H
N
H
N
N
N
N
H












 chemistry
chemistry