Similar presentations:
Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии
1. Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии лектор – проф. Васюк С. А. 2016
ПРИМЕНЕНИЕ ЗДМ КРАВНОВЕСИЯМ
КОМПЛЕКСООБРАЗОВАНИЯ И ИХ
РОЛЬ
В АНАЛИТИЧЕСКОЙ ХИМИИ
лектор – проф. Васюк С. А.
2016
2. План
1. Комплексные соединения их структура иклассификация.
2. Константа образования и константа нестойкости КС.
Взаимосвязь между ними и их применение в анализе.
3. Влияние различных факторов на
комплексообразование.
4. Понятие о ВКС
5.Применение реакций комплексообразования в
аналитической химии.
3.
Номенклатура[Ag(NH3)2]Cl – хлорид диамминсеребра;
K[Ag(CN)2] – дицианоаргентат калия;
[Fe(SCN)3] – тритиоцианат железо.
4.
КлассификацияПо знаку заряда:
а) катионные [Cu(NH3)4]2+;
б) анионные [Fe(CN)6]4-;
в) нейтральные[Fe(SCN)3]0
По принадлежности к определенному классу
соединений:
а) комплексные кислоты H[AuCl4];
б) комплексные основания [Ag(NH3)2]ОН;
в) комплексные соли K2[HgI4].
5. Классификация
По характеру связи между составными частямикомплекса:
а) внутрисферные имеют непосредственную (как правило, координационную) связь центрального атома с
лигандами. В свою очередь подразделяются на:
- однороднолигандные (содержат лиганды одного
типа);
- смешанолигандные (содержат лиганды различной
природы);
- ди- или полидентатнолигандные, образующие хелаты.
б) внешнесферные содержат дополнительные ионы
или молекулы, не связанные непосредственно с
центральным атомом.
6.
КлассификацияПо числу центральных атомов:
а) моноядерные;
б) полиядерные.
По скорости образования комплексов:
а) лабильные;
б) инертные.
По природе лигандов:
а) аквакомплексы [Co(H2O)6]SO4;
б) аммиакаты [Cu(NH3)4]SO4;
в) ацидокомплексы K4[Fe(C2O4)3];
г) гидроксидокомплексы K3[Al(OH)6] и др.
7. Константа образования
M(S)n + L M(S)(n-1)L + SM(S)(n-1)L + L M(S)(n-2)L2 + S
………………………………….
M(S)L(n-1) + L MLn + S
8. Константа образования или устойчивости β:
M + L ↔ [ML][ML]
1
[M] [L]
[ML] + L ↔ [ML2]
[ML 2 ]
2
[ML] [L]
M + nL ↔ [MLn]
[ML n ]
β
[M] [L] n
β = β1·β2…βn.
9. Ag+ + NH3 [AgNH3]+ [AgNH3]+ + NH3 [Ag(NH3)2]+
Ag+ + NH3 [AgNH3]+[AgNH3]+ + NH3 [Ag(NH3)2]+
[[AgNH 3 ] ]
β1
[Ag ] [NH 3 ]
[[Ag(NH 3 ) 2 ] ]
β2
[[AgNH 3 ] ] [NH 3 ]
[[Ag(NH 3 ) 2 ] ]
β
[Ag ] [NH 3 ]2
10. [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-[Ag(NH3)2]+ [AgNH3]+ + NH3
[AgNH3]+ Ag+ + NH3
[Ag(NH3)2]+ Ag+ + 2 NH3
11. Константа нестойкости Кнест.
K нест.[Ag ][NH 3 ]2
[[Ag(NH 3 ) 2 ] ]
K нест.
1
;
β
β
1
К нест.
12.
[Ag(NH3)2]Cl + 2H+ → AgCl↓ + 2NH4+13.
[Ag(NH3)2]+ + I- → AgI↓+ 2NH314.
Переведение комплексообразователя в другой,более прочный, комплексный ион
[HgI4]2- + 4CN- ↔ [Hg(CN)4]2- + 4IКнест.[HgI4]2- = 1,48∙10-30 Кнест.[Hg(CN)4]2- = 3,0∙10-42
Kр
К нест.[HgI
4]
K нест.[Hg(CN)
2
2
]
4
1,48 10
11
4,9 10
- 42
3,0 10
-30
15.
[[М(NH3)n]2+ + nH+ → M2+ + nNH4+
где M = Cu2+, Cd2+, Co2+, Ni2+
16.
Разрушение комплекса путем восстановления илиокисления комплексообразователя
2[SbCl6]3- + 3Fe 2Sb↓ + 3Fe2+ + 12ClЕ0 [SbCl6]3- / Sb↓, 6Cl- = +0,2 В;
K p 10
( Е 0 ) n
0 ,0592
10
Е0 Fe2+ /Fe = -0,473 В
[ 0 , 20 ( 0 , 473)] 6
0 , 0592
10
68
17. а) осуществляется ли реакция: AgСl + 2NH3 [Ag(NH3)2]+
а) осуществляется ли реакция:AgСl + 2NH3 [Ag(NH3)2]+
Kр
ПР AgCl
K нест.[Ag(NH
1,78 10
-3
3,02 10
-8
5,9 10
-10
3 )2 ]
18. б) Возможен ли перевод катионов VI группы из осадков гидроксидов в раствор аммиакатов: Cu(OH)2 + 4NH3 [Cu(NH3)4]2+ + 2OH-
б) Возможен ли перевод катионов VI группы из осадковгидроксидов в раствор аммиакатов:
Cu(OH)2 + 4NH3 [Cu(NH3)4]2+ + 2OHKр
Р Cu(OH)2 2 1
Kр
ПР Cu(OH)2
4
Р Сu(OH)2
K нест.[Cu(N H
2
20
2
,
2
10
3
1,76 10 7 моль/л
4
Р Сu(OH)2
K нест.[Cu(N H
3 )4 ]
3 )4 ]
2
1,76 10 -7
5
1
,89
10
9,33 10 -13
19.
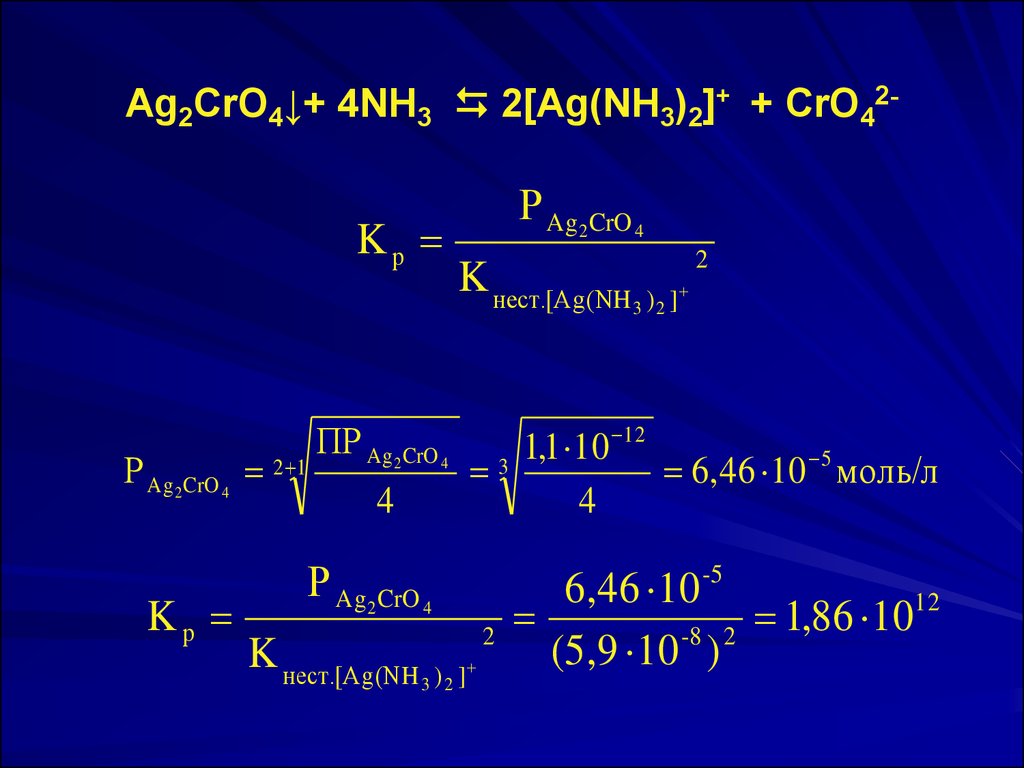
Ag2CrO4↓+ 4NH3 2[Ag(NH3)2]+ + CrO42-Kр
Р Ag 2 CrO 4 2 1
Kр
Р Ag2 CrO 4
K нест.[Ag(NH
ПР Ag 2 CrO 4
4
2
3 )2 ]
3 )2 ]
12
1
,
1
10
3
6, 46 10 5 моль/л
4
Р Ag 2 CrO 4
K нест.[Ag(NH
2
6,46 10 -5
12
1
,
86
10
(5,9 10 -8 ) 2








![Ag+ + NH3 [AgNH3]+ [AgNH3]+ + NH3 [Ag(NH3)2]+ Ag+ + NH3 [AgNH3]+ [AgNH3]+ + NH3 [Ag(NH3)2]+](https://cf.ppt-online.org/files/slide/f/fFIJGH4WdTuC8iSe9pDYAKM357lQwvnrkcLqzb/slide-8.jpg)
![[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-](https://cf.ppt-online.org/files/slide/f/fFIJGH4WdTuC8iSe9pDYAKM357lQwvnrkcLqzb/slide-9.jpg)






![а) осуществляется ли реакция: AgСl + 2NH3 [Ag(NH3)2]+ а) осуществляется ли реакция: AgСl + 2NH3 [Ag(NH3)2]+](https://cf.ppt-online.org/files/slide/f/fFIJGH4WdTuC8iSe9pDYAKM357lQwvnrkcLqzb/slide-16.jpg)
![б) Возможен ли перевод катионов VI группы из осадков гидроксидов в раствор аммиакатов: Cu(OH)2 + 4NH3 [Cu(NH3)4]2+ + 2OH- б) Возможен ли перевод катионов VI группы из осадков гидроксидов в раствор аммиакатов: Cu(OH)2 + 4NH3 [Cu(NH3)4]2+ + 2OH-](https://cf.ppt-online.org/files/slide/f/fFIJGH4WdTuC8iSe9pDYAKM357lQwvnrkcLqzb/slide-17.jpg)
 chemistry
chemistry








