Similar presentations:
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
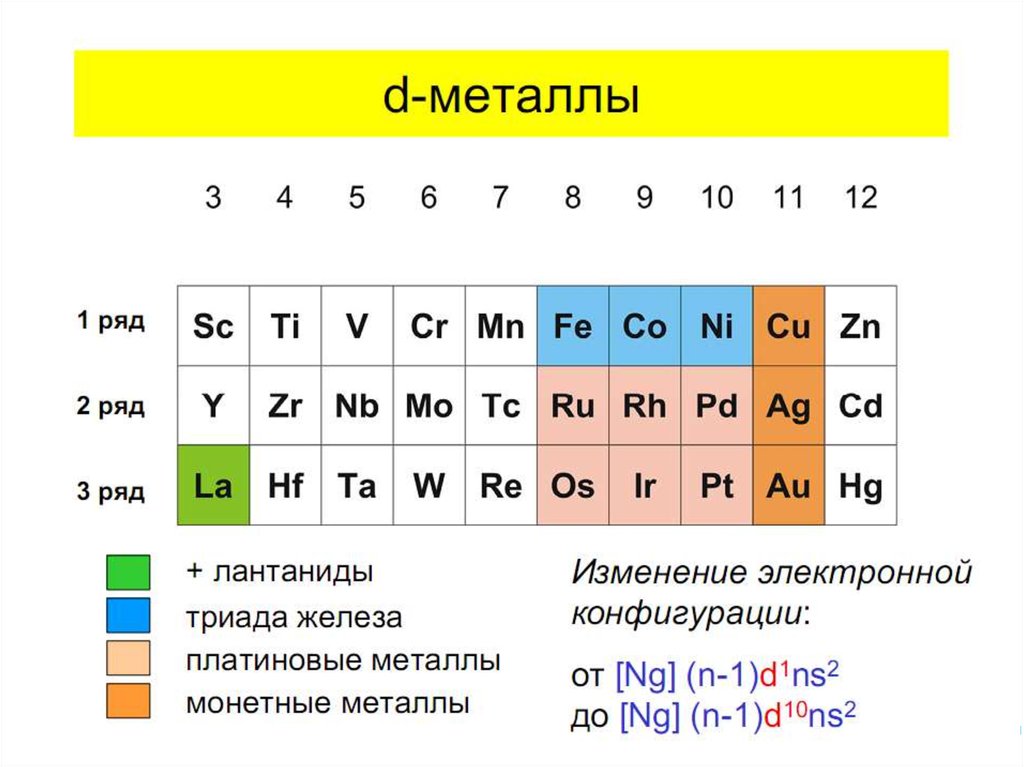
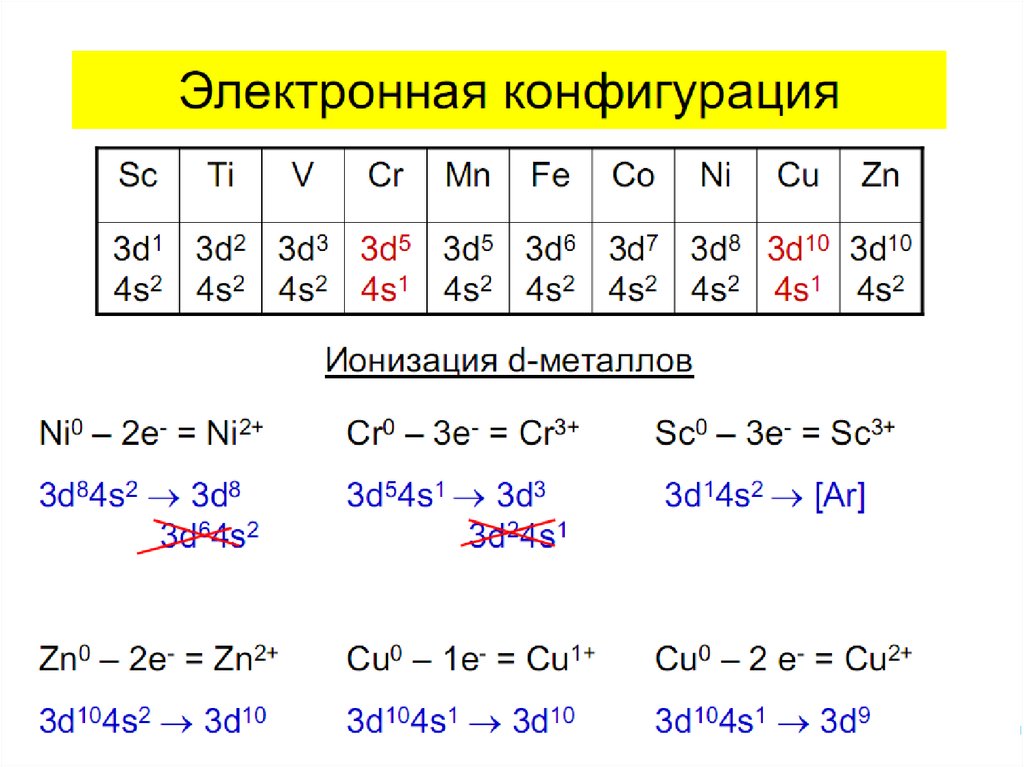
1. Химия элементов
Комплексные соединения.Основные понятия
координационной теории.
Номенклатура. Поведение
в растворе
2.
3.
4.
5. Простые и комплексные соединения
• HgI2 + 2KI = K2[HgI4]• HgI2(т) + 2K+(р) + 2I–(р)=
= 2K+(р) + [HgI4]2–(р)
• SO3(т) + K2O(т) =
• K2O(т) + SO3(т) =
= K2SO4(т)
SO3
K2SO4
= 2K+(р) + SO42–(р)
HgI2
KI
K2[HgI4]
6. Комплексные (координационные) соединения
Комплексами называютсложные частицы,
образованные из
реально существующих
более простых,
способные к
самостоятельному
существованию:
• в узлах
кристаллической
решетки
• в растворе
Красная
кровяная соль
Медный купорос
Хромокалиевые
квасцы
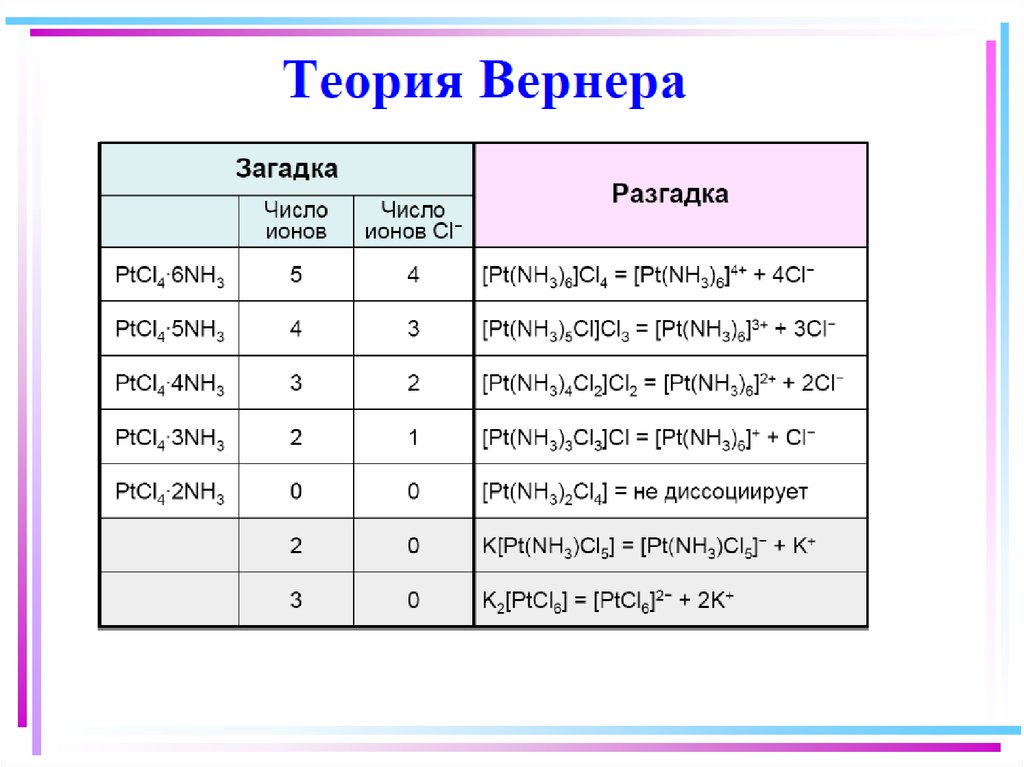
7. Координационная теория (1893 г. )
• Внутренняя и внешняясфера комплексного
соединения [MLx]Yz
• Комплексообразователь M±
• Лиганды L±
• Координационное число КЧ
• Дентатность лигандов
• Многоядерные комплексы
(мостиковые, смешанные,
кластеры)
Альфред Вернер
(1866-1919),
швейцарский химик
8. Внутренняя сфера [комплекс] Внешняя сфера (противоион)
Примеры[Ni(NH3)6]Cl2
Внутр.сфера
Внеш.сфера
K4[Fe(CN)6]
Внеш.сфера
Внутр.сфера
• [Cr(CO)6]
Внутр.сфера
Внеш.сферы
нет
• [Ni(NH3)6]2[Fe(CN)6]
Внутр.сфера
Внеш.сфера
Внеш.сфера
Внутр.сфера
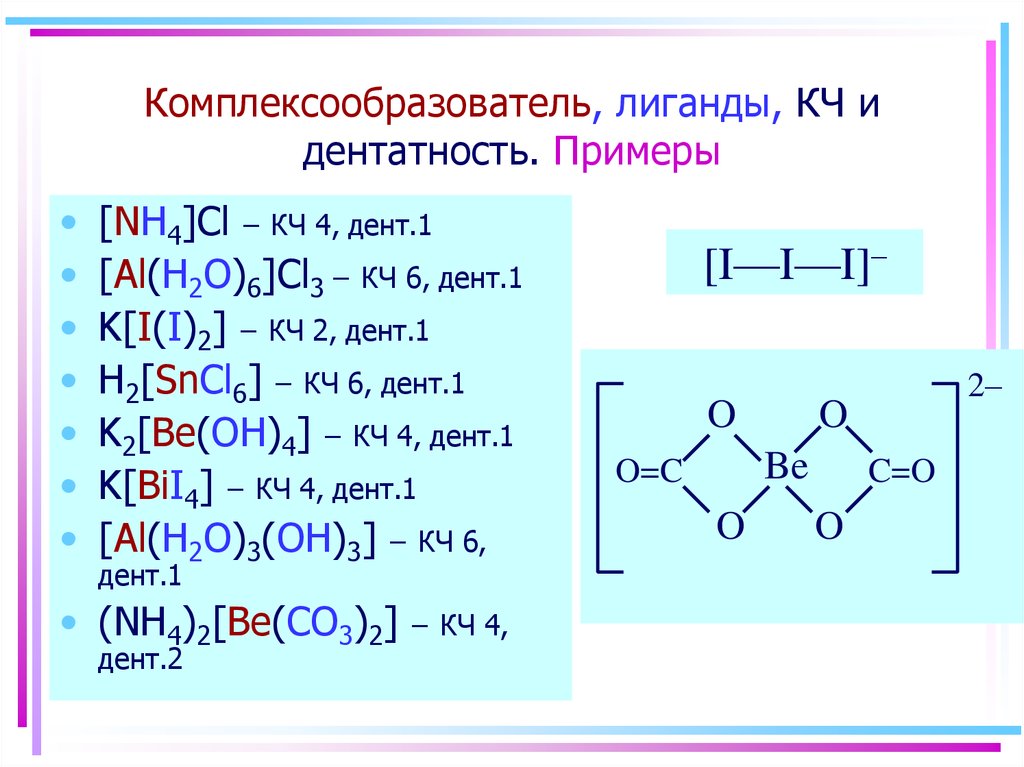
9. Комплексообразователь, лиганды, КЧ и дентатность. Примеры
[NH4]Cl – КЧ 4, дент.1
[Al(H2O)6]Cl3 – КЧ 6, дент.1
K[I(I)2] – КЧ 2, дент.1
H2[SnCl6] – КЧ 6, дент.1
K2[Be(OH)4] – КЧ 4, дент.1
K[BiI4] – КЧ 4, дент.1
[Al(H2O)3(OH)3] – КЧ 6,
дент.1
• (NH4)2[Be(CO3)2]
дент.2
– КЧ 4,
[I—I—I]–
O
O
Be
O=C
O
2–
C=O
O
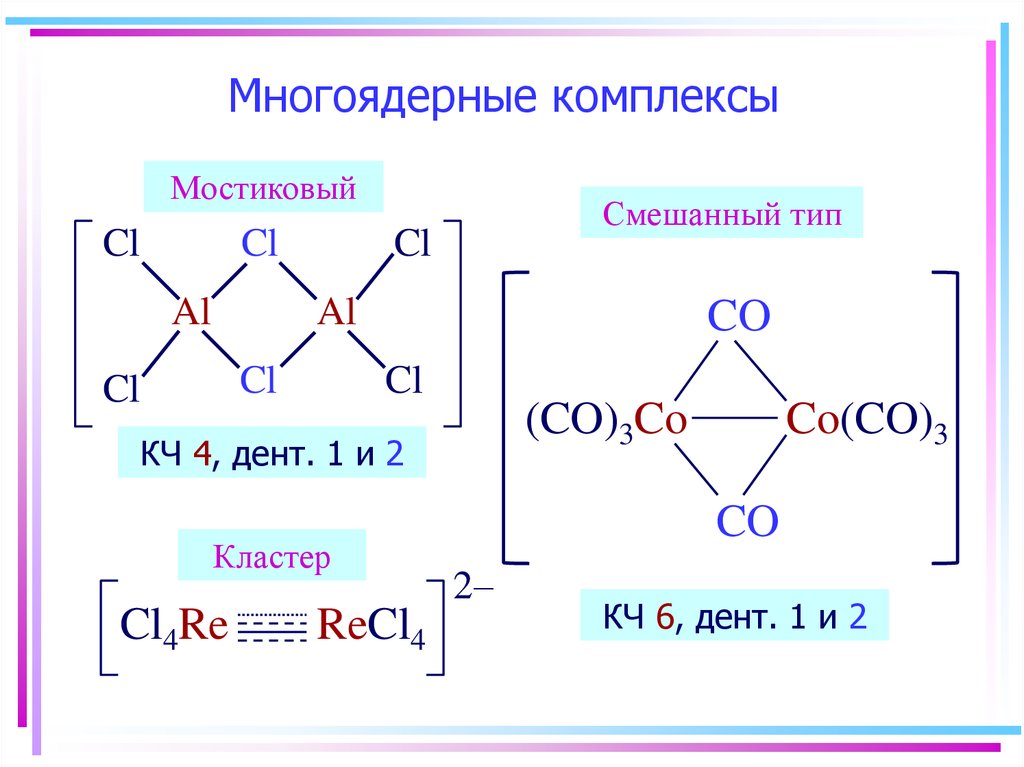
10. Полидентатные лиганды
этилендиаминтетрауксусная кислота11. Многоядерные комплексы
МостиковыйCl
Cl
Al
Смешанный тип
Cl
Al
Cl
Cl
CO
Cl
(CO)3Co
КЧ 4, дент. 1 и 2
Кластер
Cl4Re
ReCl4
Co(CO)3
CO
2–
КЧ 6, дент. 1 и 2
12. Номенклатура комплексных соединений. 1. Названия лигандов
0 : названиеL
L– : окончание «о»
F–
Cl–
O2–
S2–
OH–
SO42–
CN–
NO2–
H–
(Н+)
фторохлорооксотиогидроксосульфатоцианонитрогидридо(гидро-)
H2O
NH3
CO
NO
py
en
аква
аммин
карбонил
нитрозил
пиридин C5H5N
этилендиамин
NH2CH2CH2NH2
L+ : окончание «ий»
N2H5+
Н+
гидразиний
гидро-
13. 2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0
Название комплекса:Число лигандов –
греч. числит.
1 – (моно)
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
7 – гепта …
число лигандов каждого
типа название лигандов
название комплексообр.
в нужной форме
• Число сложных лигандов:
бис-, трис-, тетракис-,
пентакис- …
• [M(en)4] тетракис(этилендиамин)…
• [M(SO42-)2] бис(сульфато-)…
14. 3. Названия комплексных соединений
А) Комплексы без внешней сферы[MLn]
n L M (в одно слово)
Примеры:
[Ni(CO)4] – тетракарбонилникель;
[Co2(CO)8] – октакарбонилдикобальт;
[Al2Cl6] – гексахлородиалюминий;
[Co+III(NH3)3Cl3] – трихлоротриамминкобальт(III)
[Co+II(H2O)4(NO2)2] – динитротетрааквакобальт(II)
15. Названия комплексных соединений
• Б) Комплексный катион[MLn]+X–
«анион катиона»: n L M(ст.ок.)
Примеры:
[AgI(NH3)2]OH –
гидроксид диамминсеребра(I);
[CoIII(NH3)6](OH)2Cl –
хлорид-дигидроксид гексаамминкобальта(III);
[Cr2III(NH3)9(OH)2]Cl4 –
хлорид дигидроксононаамминдихрома(III)
16. Названия комплексных соединений
• В) Комплексный анионX+[MLn]–
«анион катиона»:
анион n L M(ст.ок.)-«ат»
Ag – аргентAu – аурCu – купр-
Fe – ферр-
Примеры:
Hg – меркур-
[Fe(CN)6]3– – гексацианоферрат(III)-ион
Mn – манган-
]–
[Ag(CN)2 – дицианоаргентат(I)-ион
K2[HgI4] – тетраиодомеркурат(II) калия
K2[PtCl6] – гексахлороплатинат(IV) калия
Ni – никколPb – плюмбSb – стибSn – станн-
17. Упражнения:
• Na3[AgI(SO3S)2] –бис(тиосульфато)аргентат(I) натрия
• [PtII(py)4]2[FeII(CN)6] –
гексацианоферрат(II) тетрапиридинплатины(II)
• [K(H2O)6][Al(H2O)6](SO4)2 –
сульфат гексаакваалюминия-гексааквакалия
• [(CO)5Mn-Mn(CO)5] –
бис(пентакарбонилмарганец)
• [(H2O)4Al(OH)2Al(H2O)4](SO4)2 –
сульфат ди( -гидроксо)бис(тетраакваалюминия)
18. Изомерия комплексных соединений
• Изомерия – явление существования соединений,одинаковых по составу и мол. массе, но
различающихся по строению и свойствам
(изомеров).
В случае комплексных соединений изомерия
обусловлена:
различием в строении и координации лигандов
различием в строении внутренней
координационной сферы
различным распределением частиц между
внутренней и внешней сферой.
19. Изомерия лигандов
• Связевая—NO2– и —ONO–
нитро-
нитрито-
• [Co(NH3)5NO2]2+
(желто-коричн.р-р)
• [Co(NH3)5ONO]2+
(розов.р-р)
—NCS– и —SCN–
тиоцианато-N
тиоцианато-S
• [Cr(H2O)5(NCS)]2+
• [Cr(H2O)5(SCN)]2+
• Изомерия
лигандов
Лиганды сложного
строения (напр.,
аминокислоты)
образуют изомеры,
координация которых
ведет к получению
комплексов с разными
свойствами.
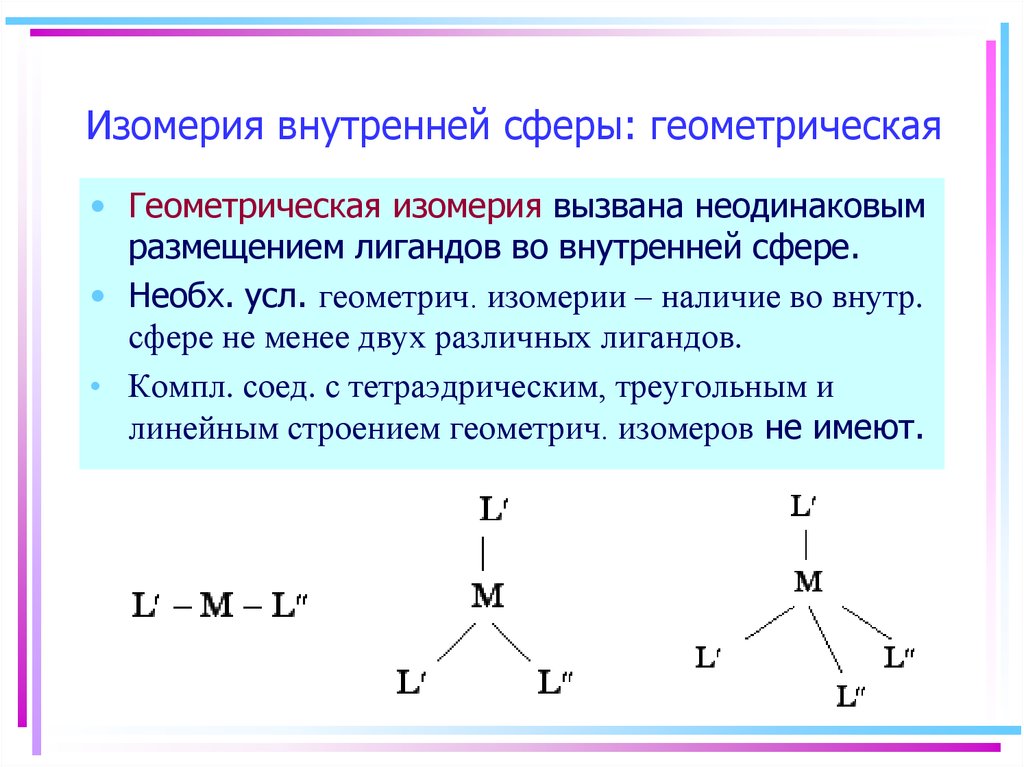
20. Изомерия внутренней сферы: геометрическая
• Геометрическая изомерия вызвана неодинаковымразмещением лигандов во внутренней сфере.
• Необх. усл. геометрич. изомерии – наличие во внутр.
сфере не менее двух различных лигандов.
• Компл. соед. с тетраэдрическим, треугольным и
линейным строением геометрич. изомеров не имеют.
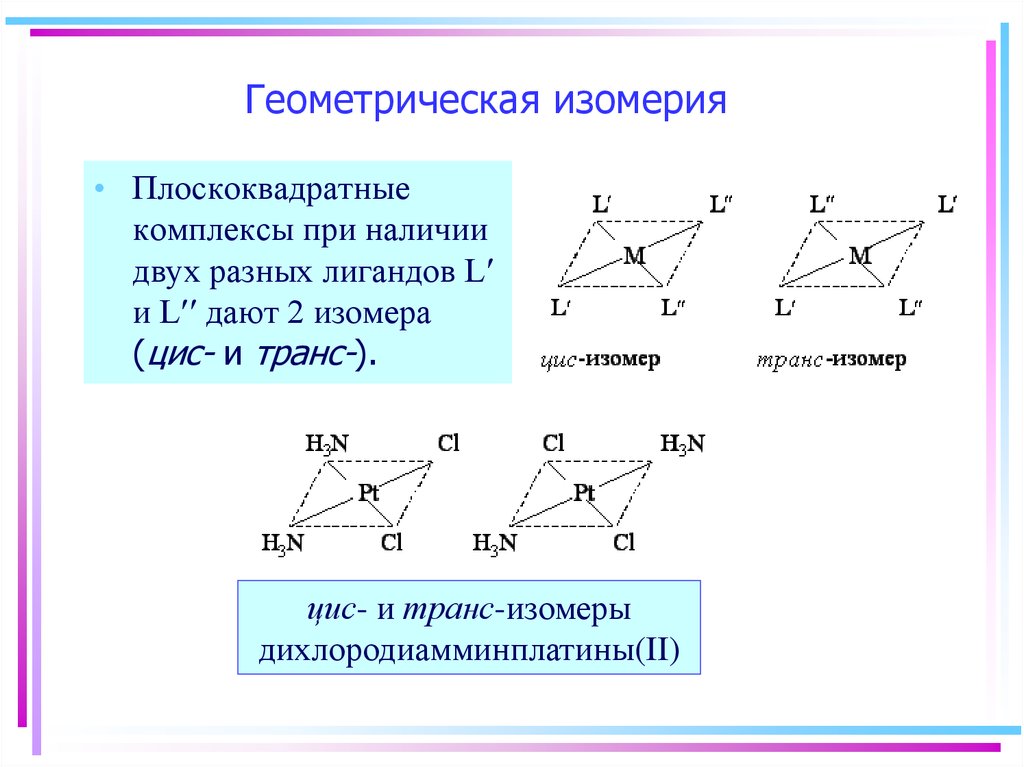
21. Геометрическая изомерия
• Плоскоквадратныекомплексы при наличии
двух разных лигандов L
и L дают 2 изомера
(цис- и транс-).
цис- и транс-изомеры
дихлородиамминплатины(II)
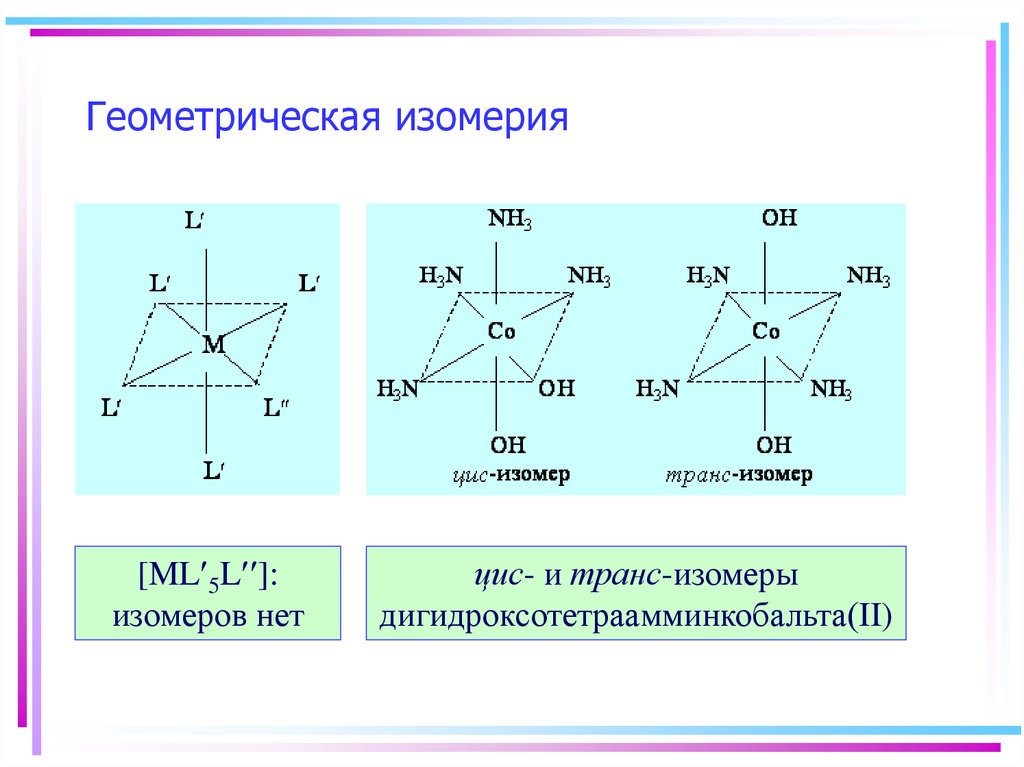
22. Геометрическая изомерия
[ML 5L ]:изомеров нет
цис- и транс-изомеры
дигидроксотетраамминкобальта(II)
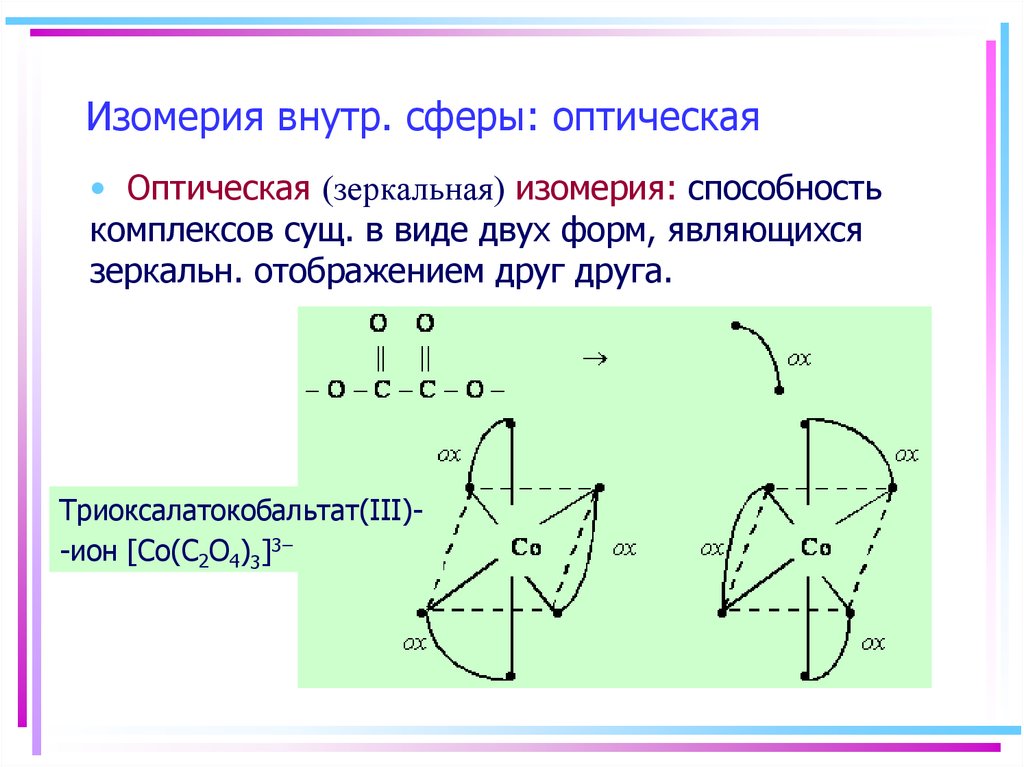
23. Изомерия внутр. сферы: оптическая
• Оптическая (зеркальная) изомерия: способностькомплексов сущ. в виде двух форм, являющихся
зеркальн. отображением друг друга.
Триоксалатокобальтат(III)-ион [Co(С2O4)3]3–
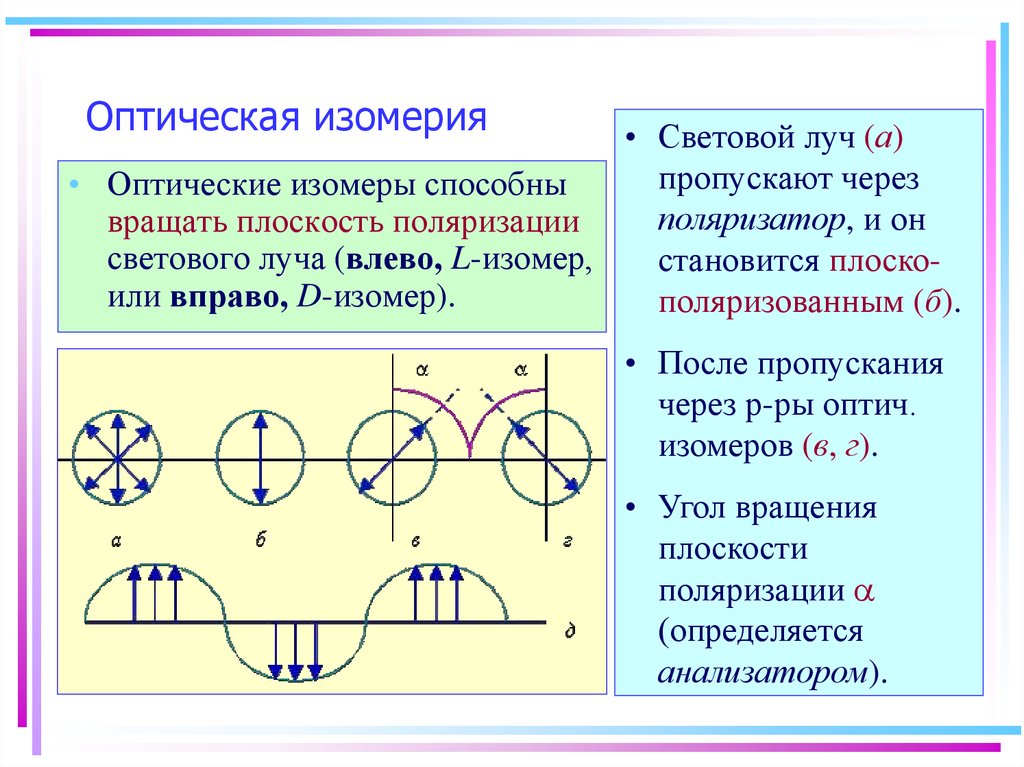
24. Оптическая изомерия
• Световой луч (а)пропускают через
• Оптические изомеры способны
поляризатор, и он
вращать плоскость поляризации
светового луча (влево, L-изомер,
становится плоскоили вправо, D-изомер).
поляризованным (б).
• После пропускания
через р-ры оптич.
изомеров (в, г).
• Угол вращения
плоскости
поляризации a
(определяется
анализатором).
25. Междусферная изомерия: 1) сольватная (гидратная); 2) ионная изомерия
• [Co(en)2Cl2]Cl · H2O • 1 Cl–; H2O (AgCl )• [Co(H2O)(en)2Cl]Cl2 • 2 Cl– (2 AgCl )
• [Co(NH3)5I]SO4
• [Co(NH3)5SO4]I
• SO42– (BaSO4 )
• I– (AgI )
26. Междусферная изомерия
• Ионные (ионизационные) изомеры• [Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2
• [Pt(NH3)4SO4](OH)2 и [Pt(NH3)4(OH)2]SO4
pH 7
pH 7
• Координационные изомеры
• [Cr(NH3)4(NCS)2][Cr(NH3)2(NCS)4]
• [Cr(NH3)6][Cr(NCS)6]
27. Комплексные соединения в растворах
1.2.
Неэлектролиты (слабые электролиты)
[Pt(NH3)2Cl2] (ср. H2O2, CO(NH2)2 )
Сильные электролиты
[Pt(NH3)4]Cl2 = [Pt(NH3)4]2+ + 2Cl–
соль
[Zn(NH3)4](OH)2 = [Zn(NH3)4]2+ + 2OH–
с. осн.
pH 7
H[BF4] + H2O = H3O+ + [BF4]–
с. к-та
pH 7
Акватация: [ … ] + H2O [ … ] + L
28. Реакции обмена лигандов
• [MLn] + H2O [MLn-1(H2O)] + L0 (n = КЧ)[H2O] = Const, р-р разбавленный
• Ступенчатая диссоциация комплекса:
• [MLn] [ML(n-1)] + L
• [MLn-1] [ML(n-2)] + L
Постепенное
• …
разрушение комплекса
• [ML2] [ML] + L
• [ML] M + L
Суммарное уравнение диссоциации комплекса:
• [MLn] M + nL
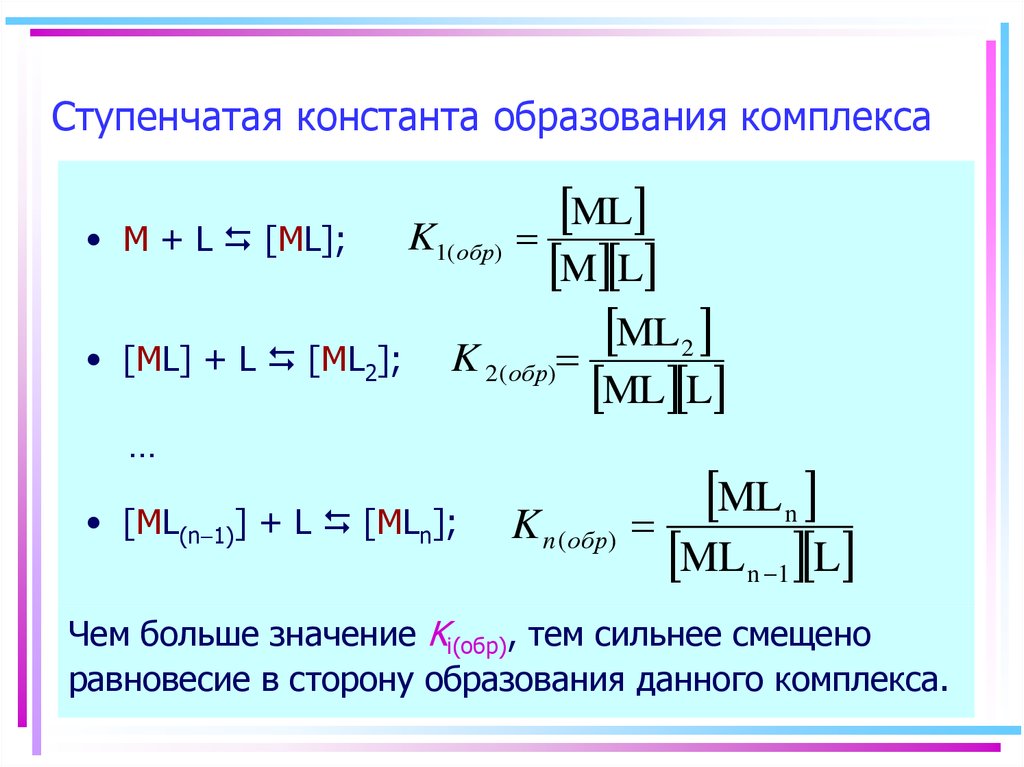
29. Ступенчатая константа образования комплекса
ML
K1( обр)
M + L [ML];
M L
ML 2
[ML] + L [ML2]; K 2( обр)
ML L
…
• [ML(n-1)] + L [MLn];
ML n
K n ( обр)
ML n -1 L
Чем больше значение Ki(обр), тем сильнее смещено
равновесие в сторону образования данного комплекса.
30. Полные (суммарные) константы образования
• M + L [ML];• M + 2L [ML2];
• ……
• M + nL [MLn];
ML
b1
M L
ML 2
b 2 ( обр )
M L 2
b n ( обр)
ML n
M L n
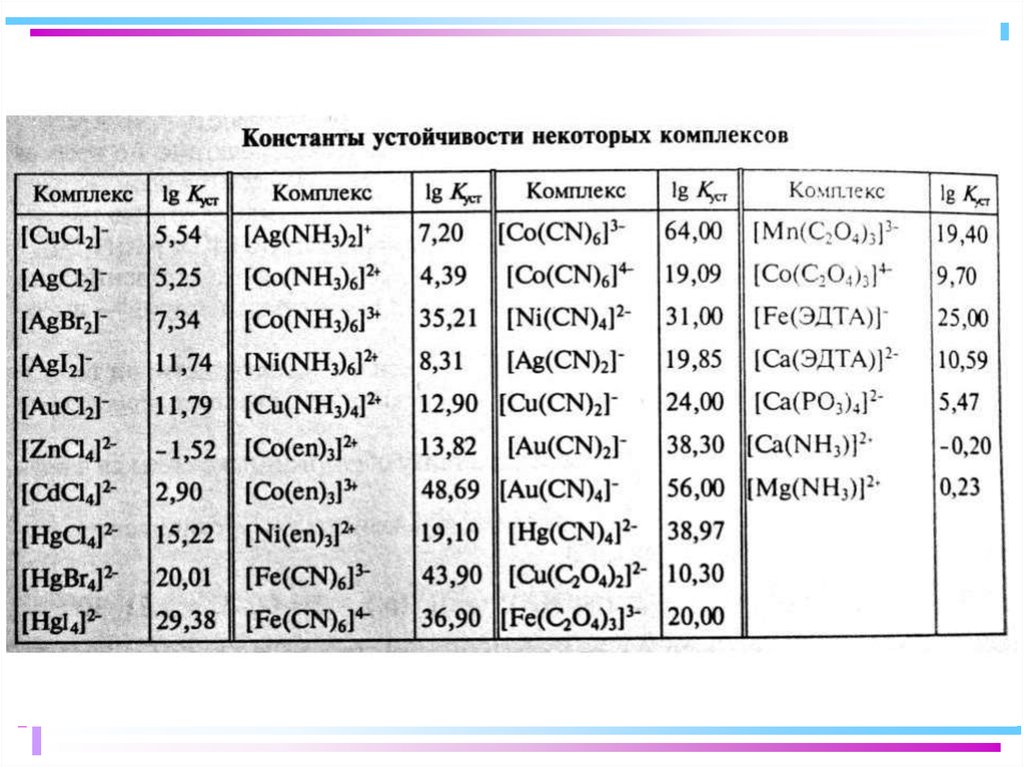
Характеристика устойчивости комплексного соединения:
чем больше значение bn(обр), тем более устойчив комплекс
данного состава.
31. Связь между полной и ступенчатой константами образования
bn(обр) = K1(обр)·K2(обр)·K3(обр)·… ·Kn(обр)Получение и применение K2[HgI4]
32. Сравнение констант образования и устойчивости комплексов
[Cu(NH3)4]2+Ki
[CuBr4]2–
Ki
bi
bi
K1, b1
1,4·104
1,4·104
4,5·105
4,5·105
K2, b2
3,2·103
4,5·107
37
1,7·107
K3, b3
7,7·102
3,5·1010 4,5
7,5·107
K4, b4
1,4·102
4,7·1012 2,4
2,0·108
33. Сравнение устойчивости аммиачных комплексов
Ступени комплексообразования• [Cu(NH3)2]+
K2(обр) = 5,0·104
• [Cu(NH3)]+
K1(обр) = 1,4·106
Природа комплексообразователя
• [Cu(NH3)2]+
b2(обр) = 7,0·1010
• [Ag(NH3)2]+
b2(обр) = 1,1·107
Комплекс Cu(I) устойчивее, чем комплекс Ag(I)
Степень окисления комплексообразователя
• [CoII(NH3)6]2+
b6(обр) = 1,3·105
• [CoIII(NH3)6]3+
b6(обр) = 3,2·1032
Комплекс Co(III) устойчивее, чем комплекс Co(II)
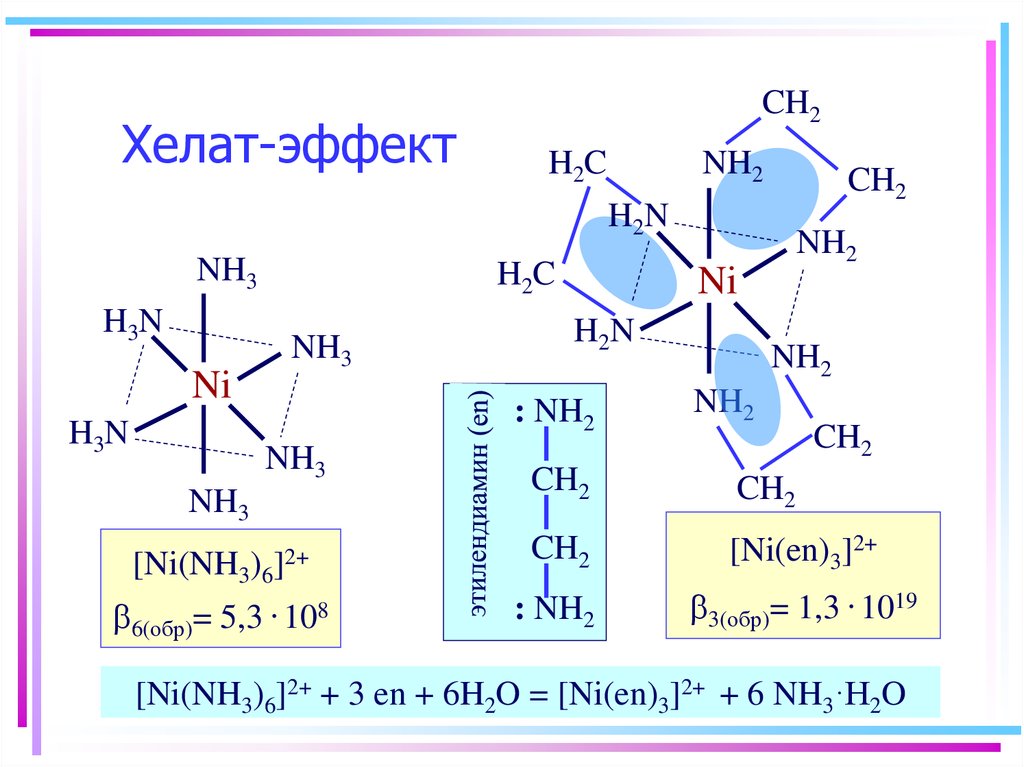
34. Хелат-эффект
CH2H2C
NH2
CH2
H2N
NH3
H2C
H3N
NH3
Ni
H3N
NH3
[Ni(NH3)6
b6(обр)= 5,3
Ni
H2N
: NH2
NH3
]2+
. 108
NH2
NH2
NH2
CH2
CH2
CH2
CH2
[Ni(en)3]2+
: NH2
b3(обр)= 1,3 . 1019
[Ni(NH3)6]2+ + 3 en + 6H2O = [Ni(en)3]2+ + 6 NH3·H2O
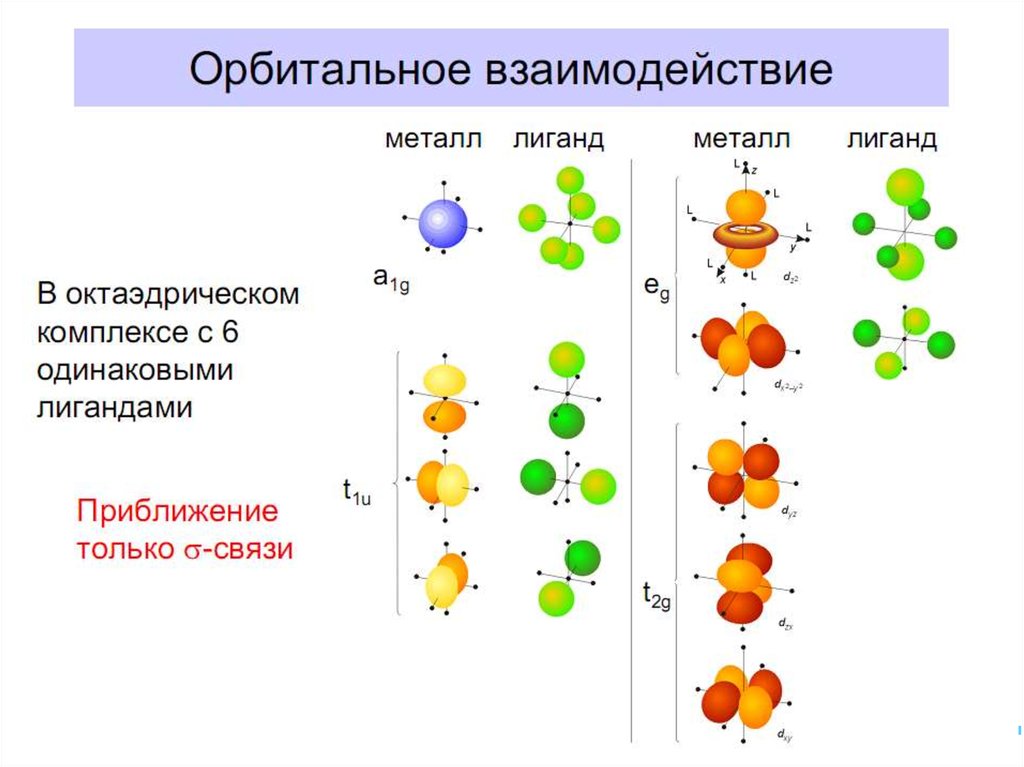
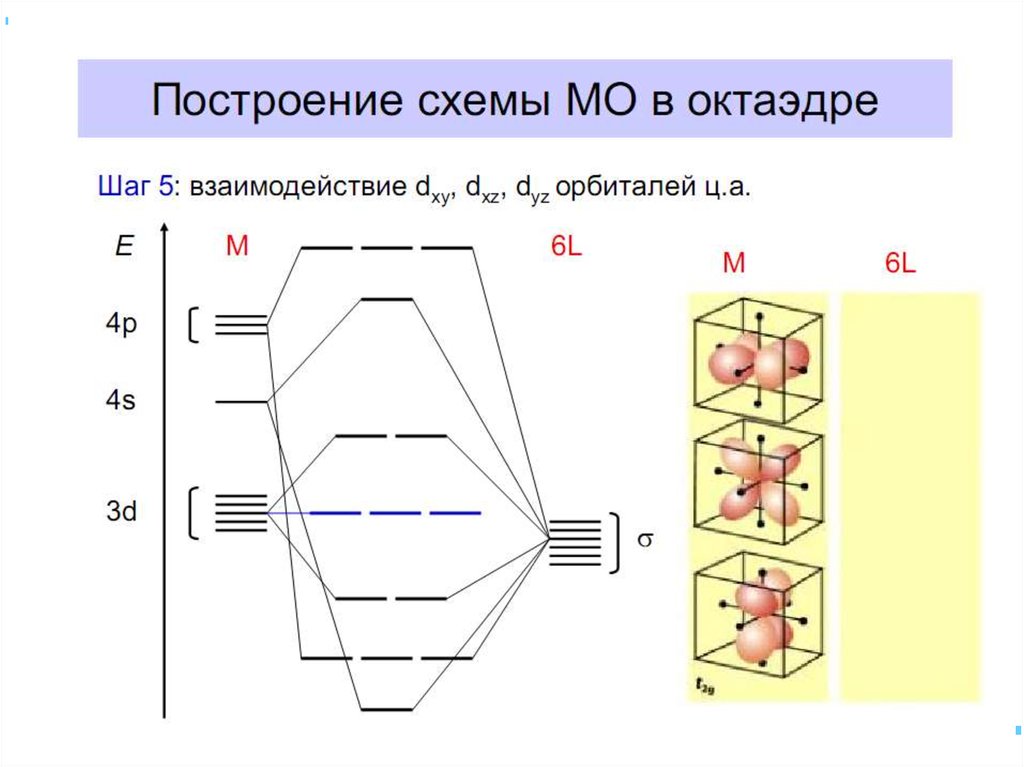
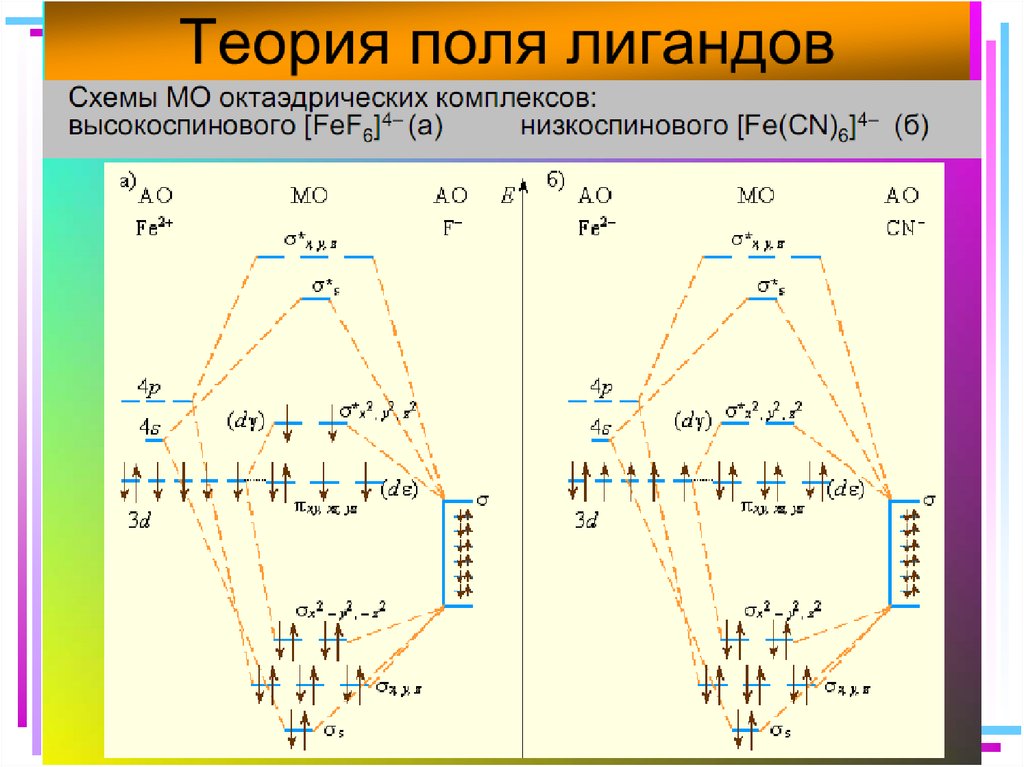
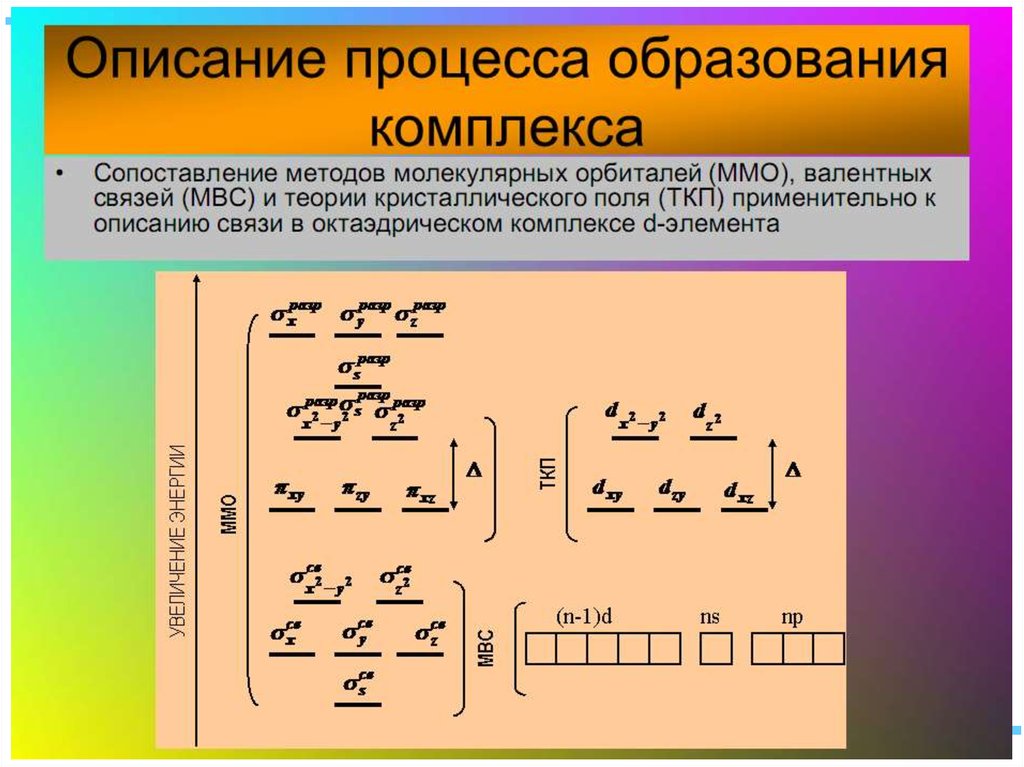
35. Квантовомеханические теории строения комплексных соединений
•Для объяснения строения комплексныхсоединений наиболее широко применяются
теория валентных связей (метод валентных
связей) и теория кристаллического поля.
• В рамках метода валентных связей
считается, что между
комплексообразователем и лигандами
существует чисто ковалентная связь, которая
реализуется по донорно-акцепторному
механизму.
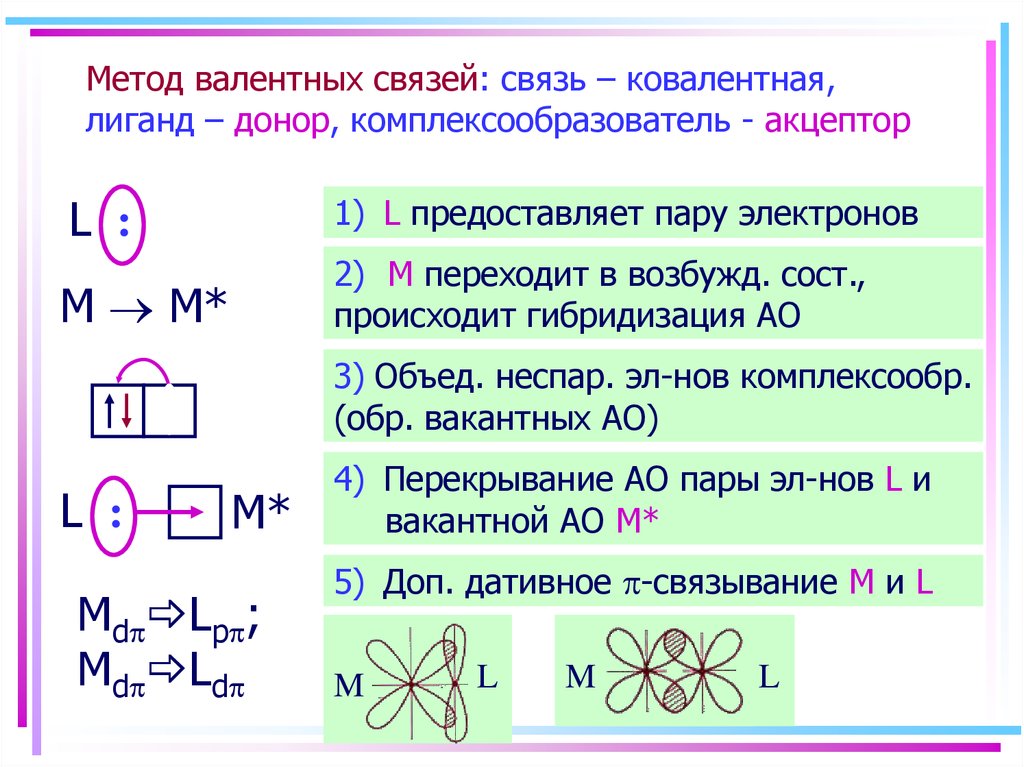
36. Метод валентных связей: связь – ковалентная, лиганд – донор, комплексообразователь - акцептор
L :1) L предоставляет пару электронов
M M*
2) M переходит в возбужд. сост.,
происходит гибридизация АО
3) Объед. неспар. эл-нов комплексообр.
(обр. вакантных АО)
L :
M*
Md Lp ;
Md Ld
4) Перекрывание АО пары эл-нов L и
вакантной АО M*
5) Доп. дативное -связывание M и L
M
L
M
L
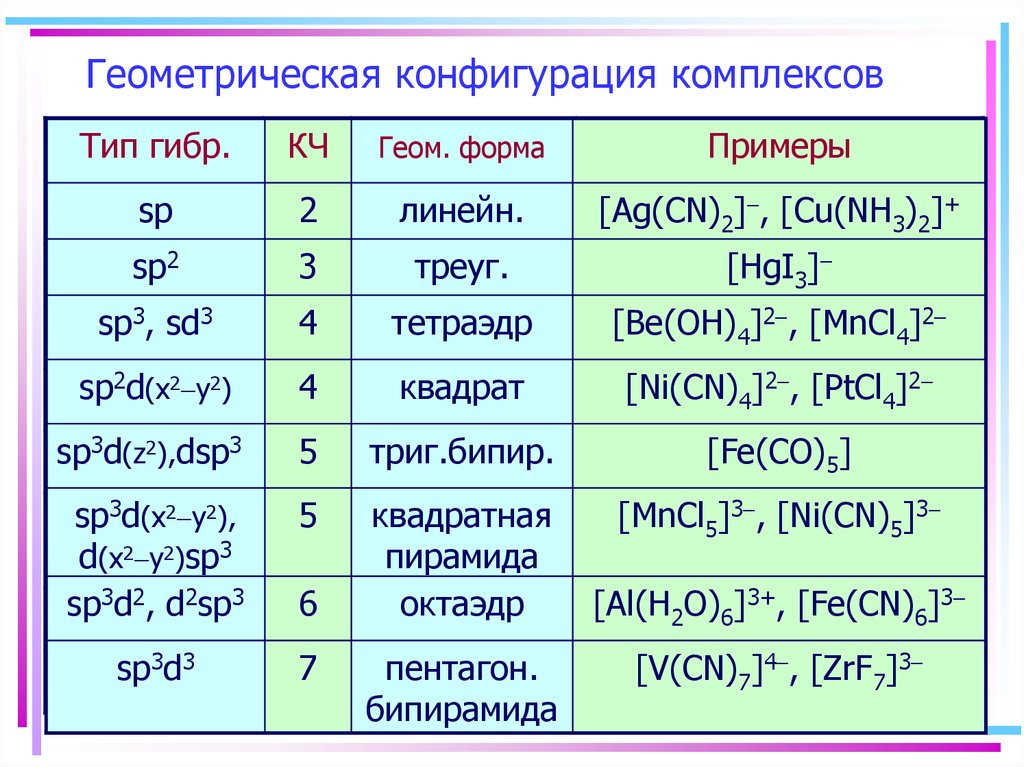
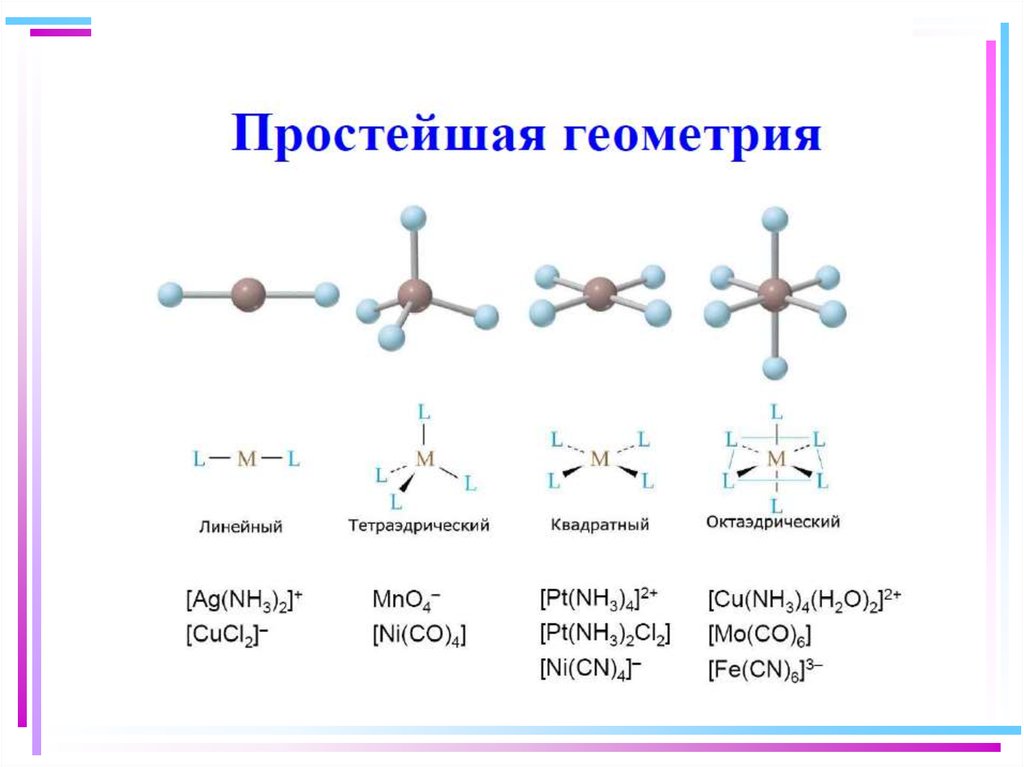
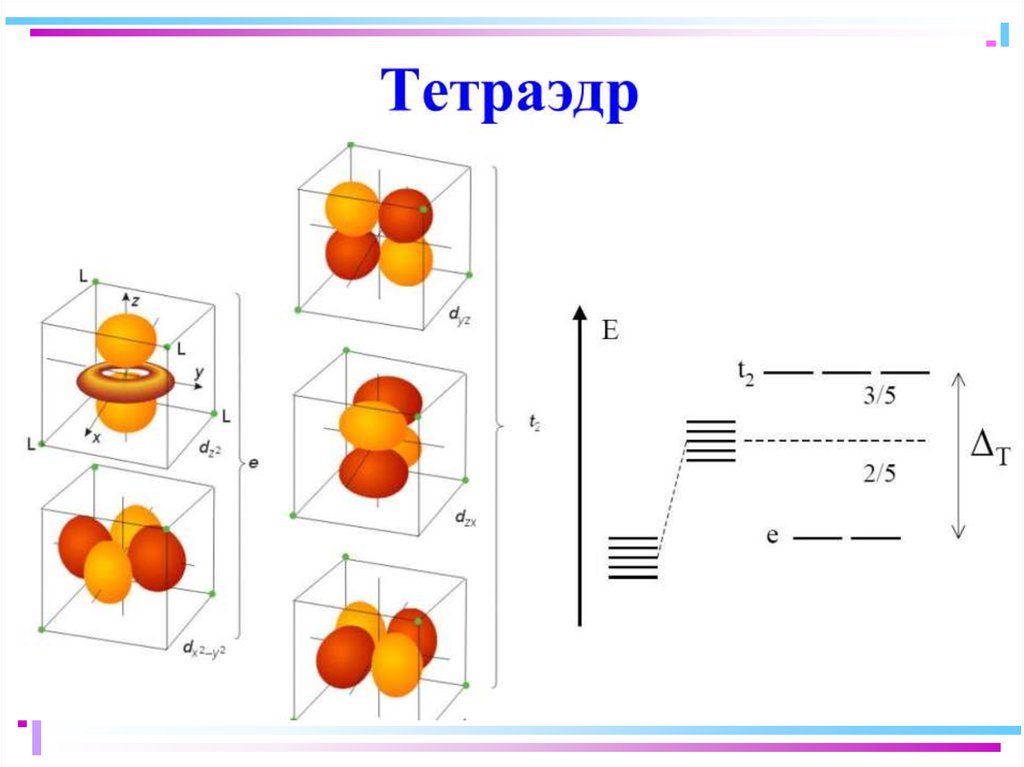
37. Геометрическая конфигурация комплексов
Тип гибр.КЧ
Геом. форма
Примеры
sp
2
линейн.
[Ag(CN)2]-, [Cu(NH3)2]+
sp2
3
треуг.
[HgI3]-
sp3, sd3
4
тетраэдр
[Be(OH)4]2-, [MnCl4]2-
sp2d(x2-y2)
4
квадрат
[Ni(CN)4]2-, [PtCl4]2-
sp3d(z2),dsp3
5
триг.бипир.
[Fe(CO)5]
sp3d(x2-y2),
d(x2-y2)sp3
sp3d2, d2sp3
5
квадратная
пирамида
октаэдр
[MnCl5]3-, [Ni(CN)5]3-
sp3d3
7
6
пентагон.
бипирамида
[Al(H2O)6]3+, [Fe(CN)6]3[V(CN)7]4-, [ZrF7]3-
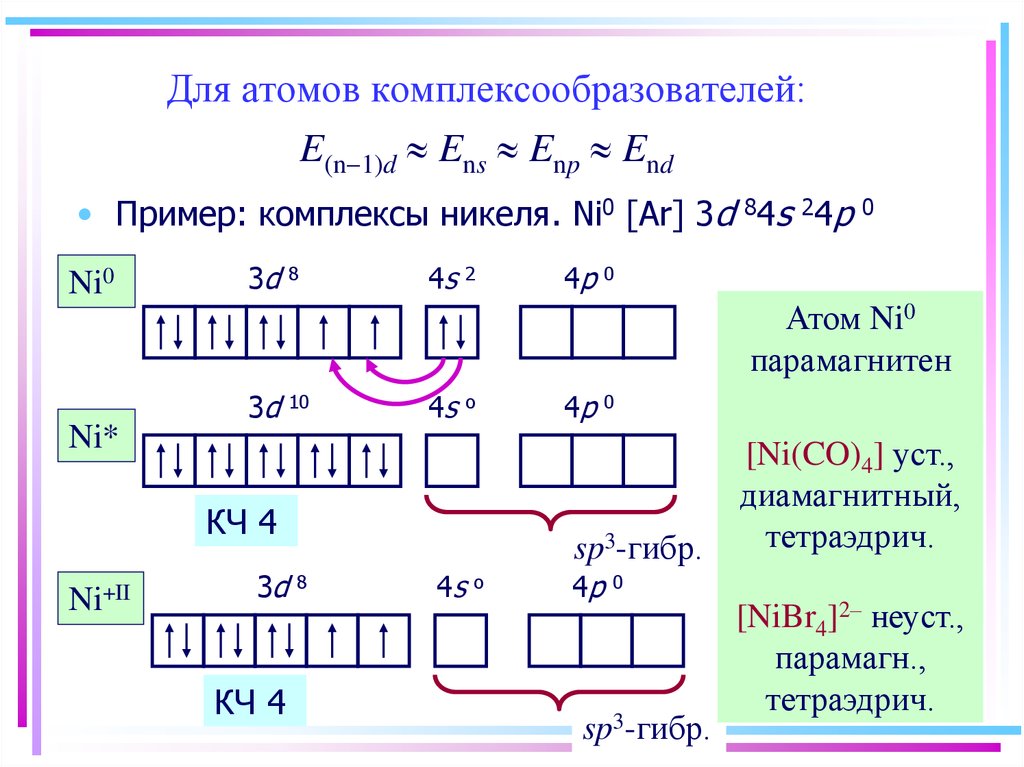
38. Для атомов комплексообразователей: E(n-1)d » Ens » Enp » End
Для атомов комплексообразователей:E(n-1)d Ens Enp End
• Пример: комплексы никеля. Ni0 [Ar] 3d 84s 24p
Ni0
3d
8
4s
2
4p
0
Атом Ni0
парамагнитен
3d
10
4s
o
4p
0
Ni*
КЧ 4
Ni+II
0
3d
КЧ 4
sp3-гибр.
8
4s
o
4p
[Ni(CO)4] уст.,
диамагнитный,
тетраэдрич.
0
sp3-гибр.
[NiBr4]2– неуст.,
парамагн.,
тетраэдрич.
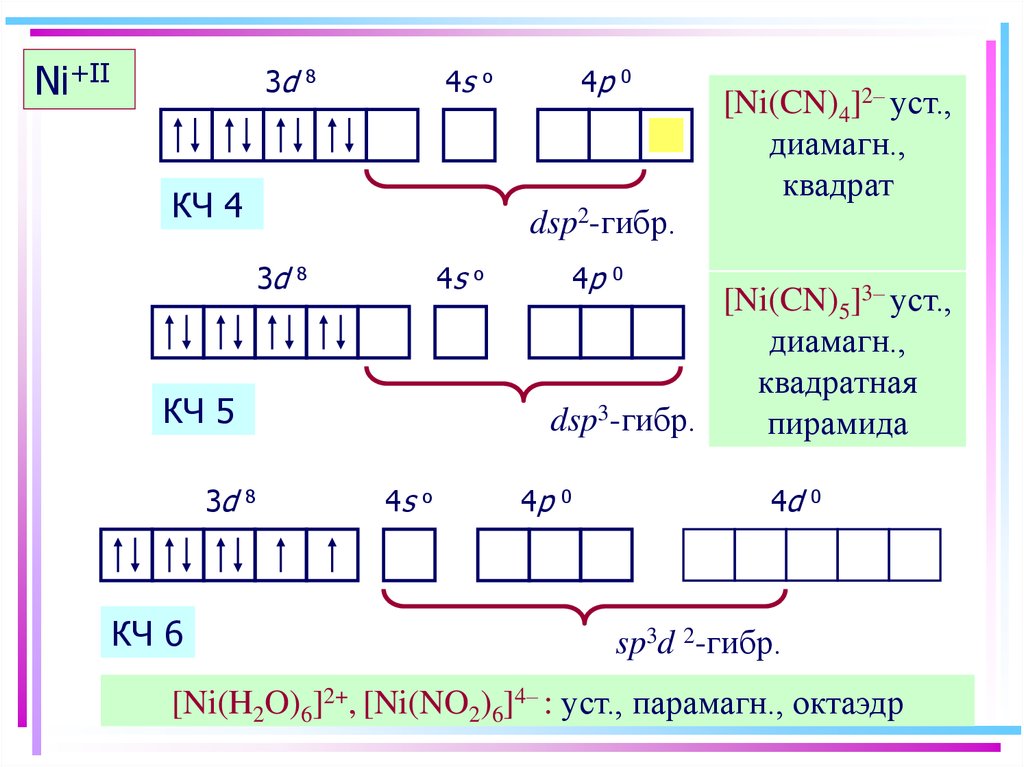
39. Ni+II
3dNi+II
4s
8
КЧ 4
4s
8
КЧ 5
КЧ 6
0
[Ni(CN)4]2– уст.,
диамагн.,
квадрат
dsp2-гибр.
3d
3d
4p
o
8
4s
o
o
4p
0
[Ni(CN)5]3– уст.,
диамагн.,
квадратная
dsp3-гибр.
пирамида
4p
0
4d
0
sp3d 2-гибр.
[Ni(H2O)6]2+, [Ni(NO2)6]4– : уст., парамагн., октаэдр
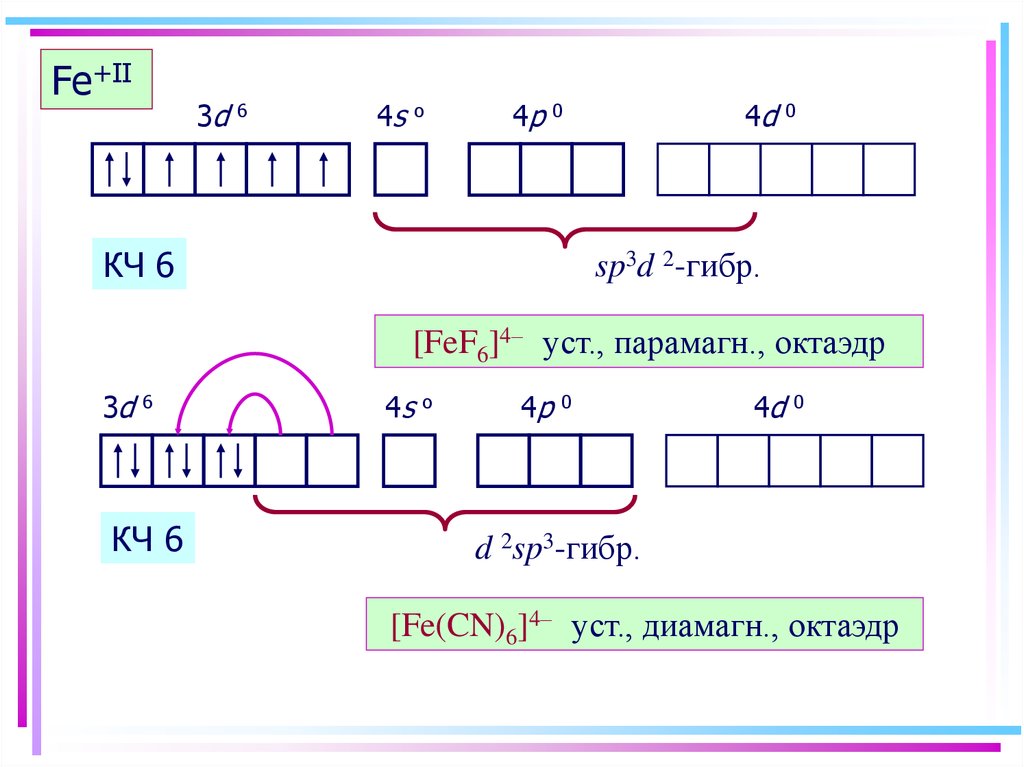
40. Fe+II
3d6
4s
o
4p
4d
0
КЧ 6
0
Fe+II
sp3d 2-гибр.
[FeF6]4– уст., парамагн., октаэдр
3d
6
КЧ 6
4s
o
4p
0
4d
0
d 2sp3-гибр.
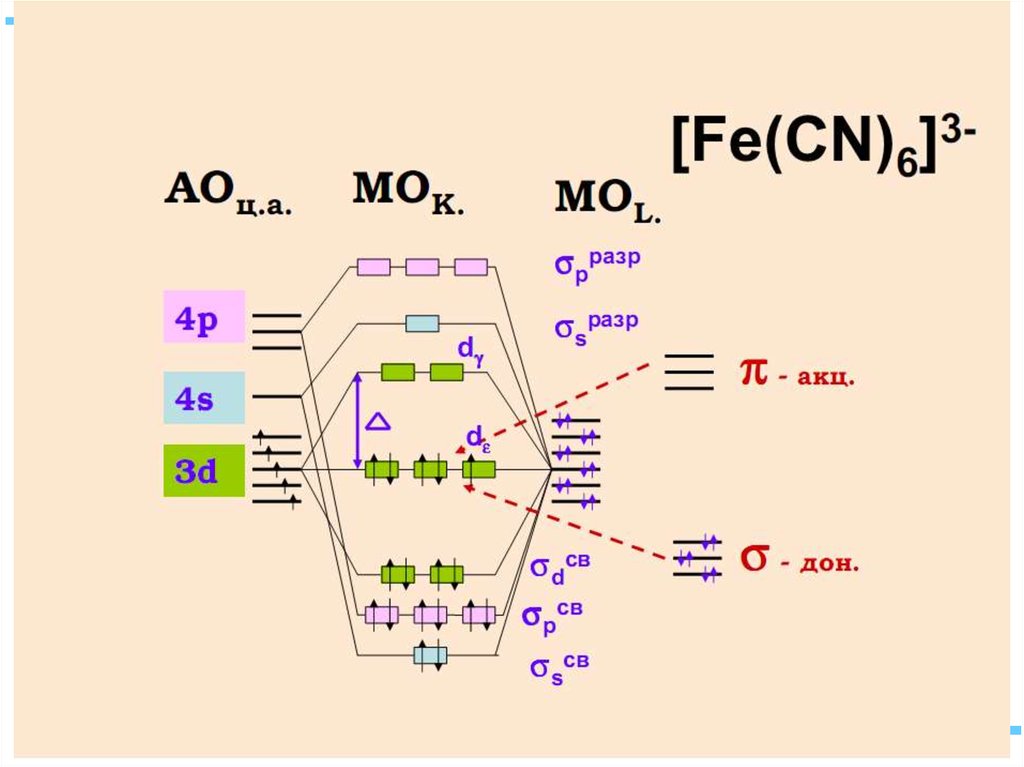
[Fe(CN)6]4– уст., диамагн., октаэдр
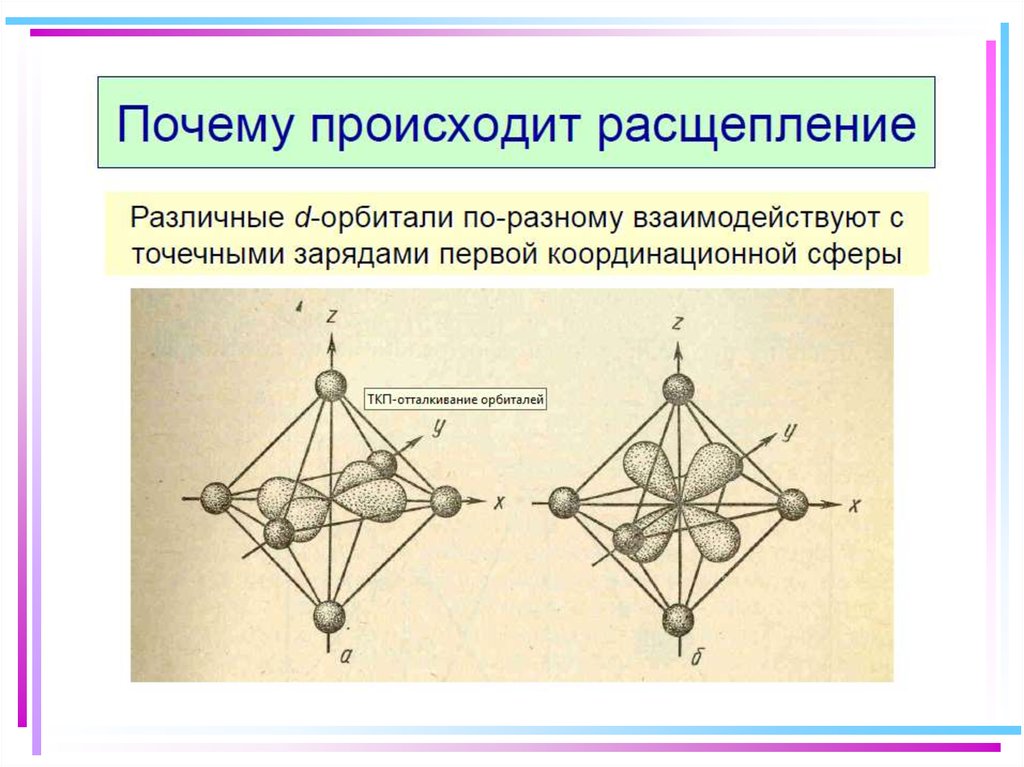
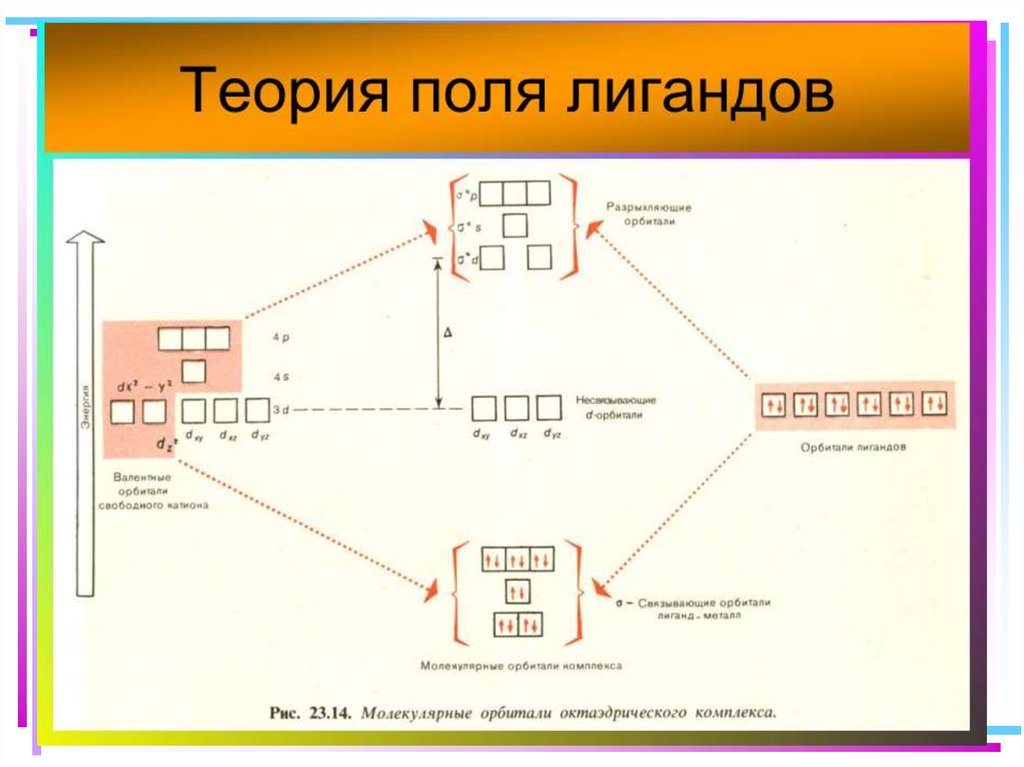
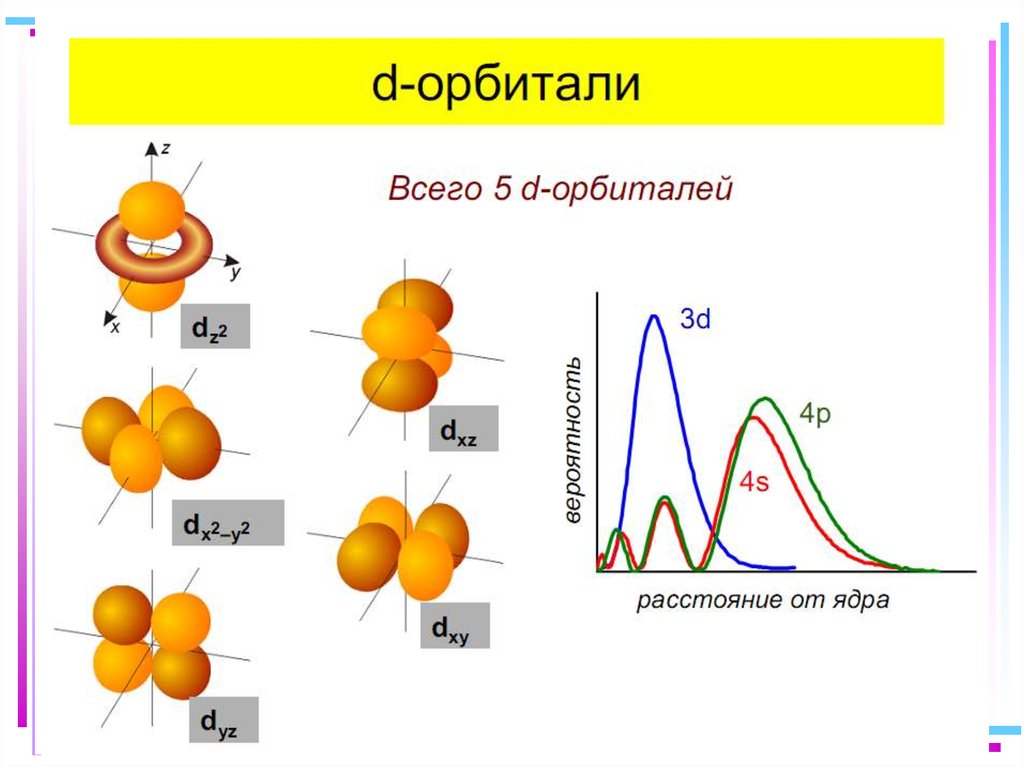
41. Основные положения теории кристаллического поля (поля лигандов)
• Связь комплексообразователя (центр. атома) Mес лигандами L считается чисто ионной
• Лиганды L – точечные заряды в вершинах
правильных полиэдров, т.е. на максимальном
расстоянии друг от друга
• Взаимодействие L между собой не рассматр.
• Детально рассматривается влияние
электростатич. поля лигандов на Mе, а именно,
на энергетич. подуровни (ЭПУ) центрального
атома
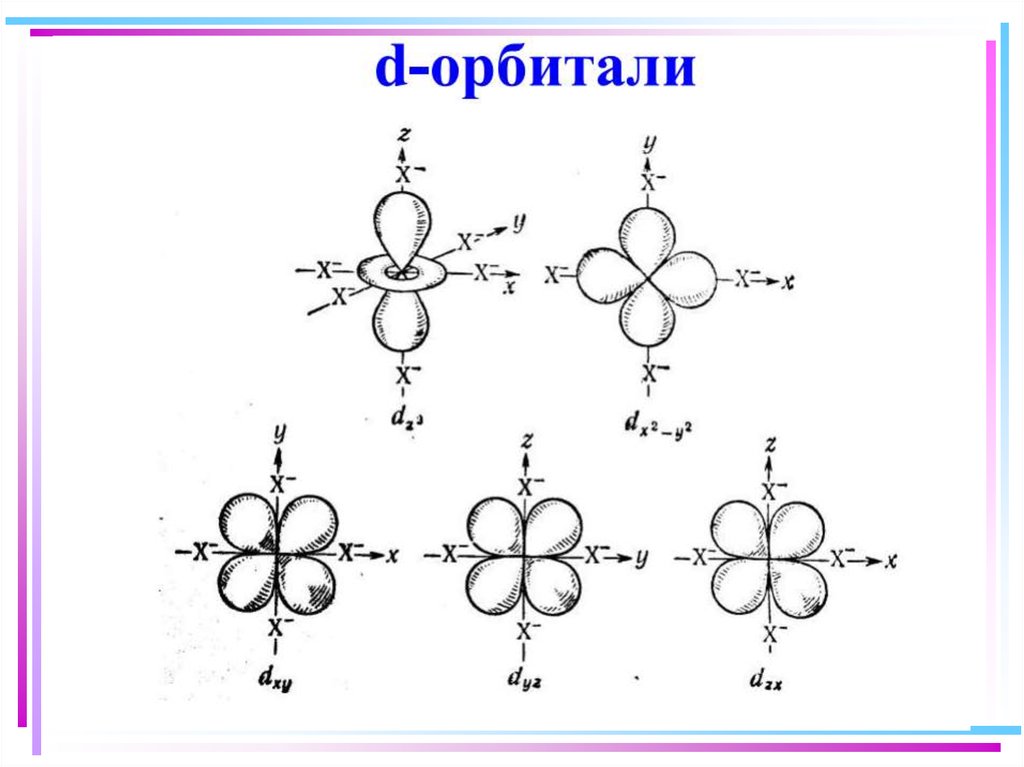
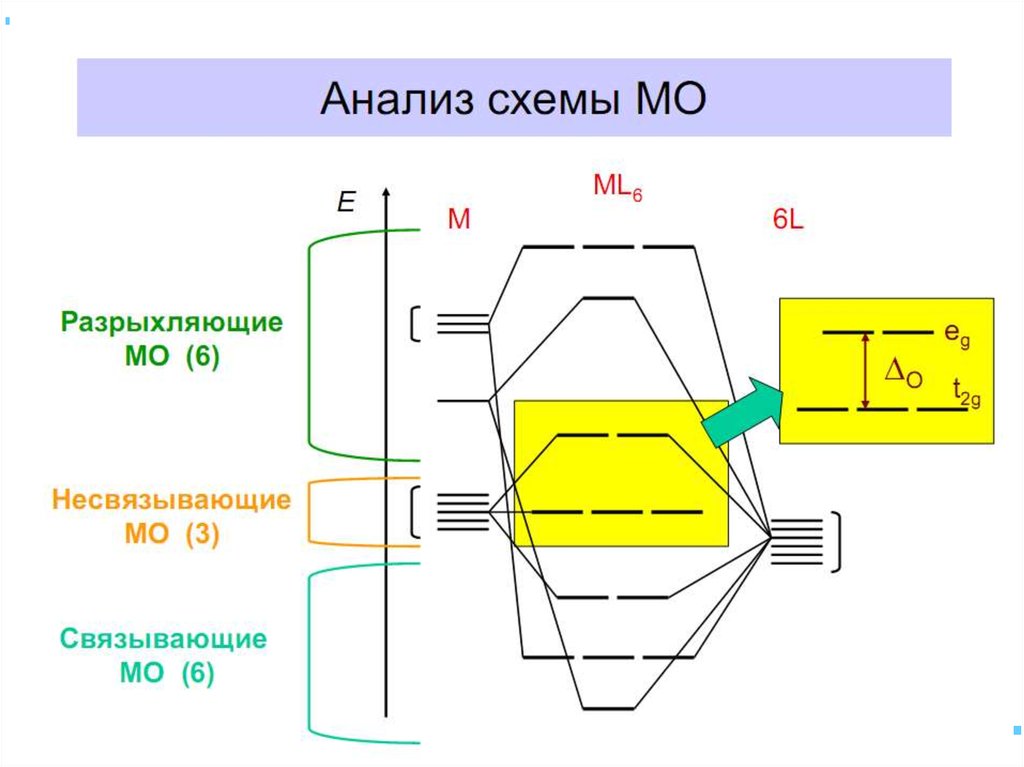
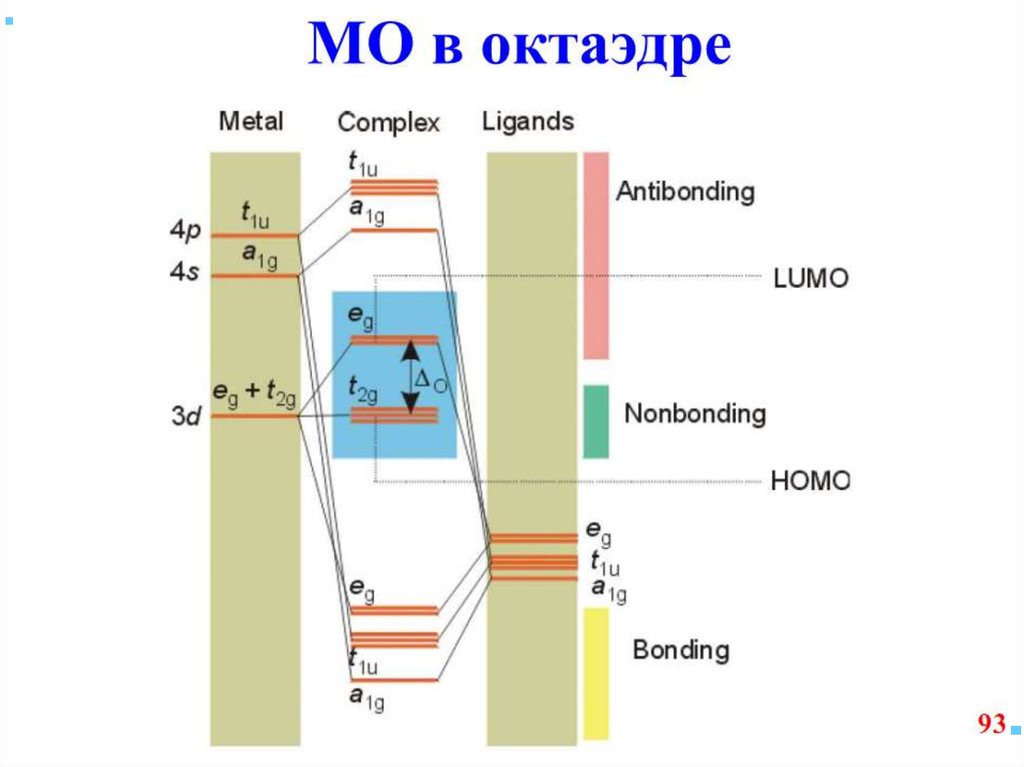
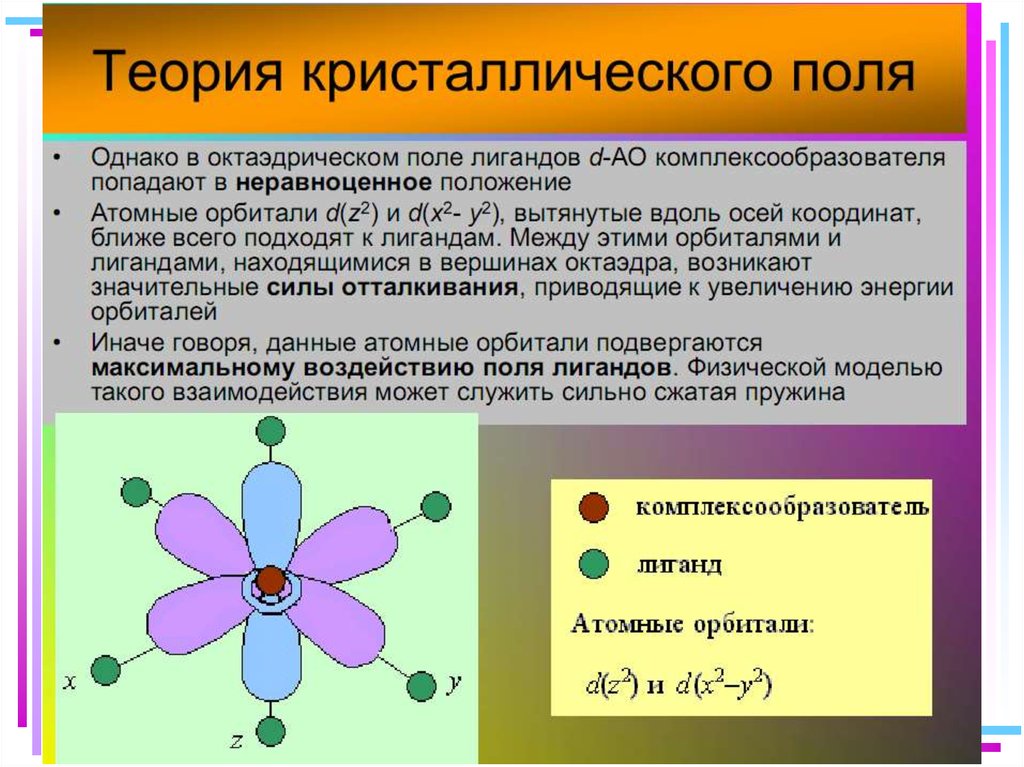
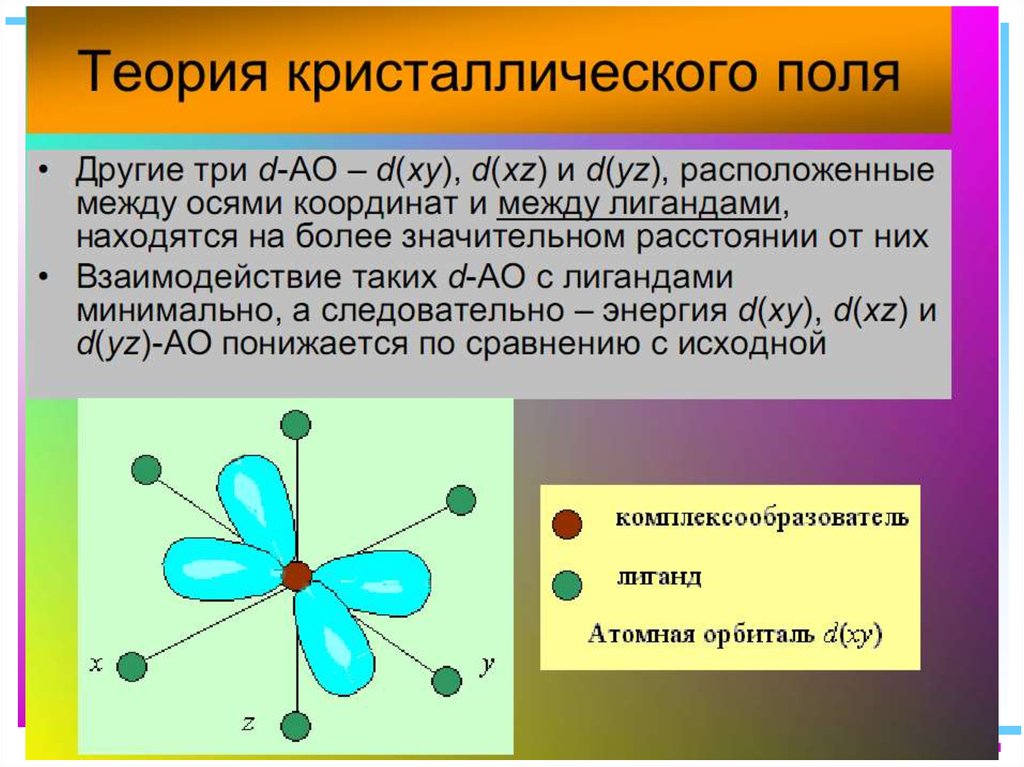
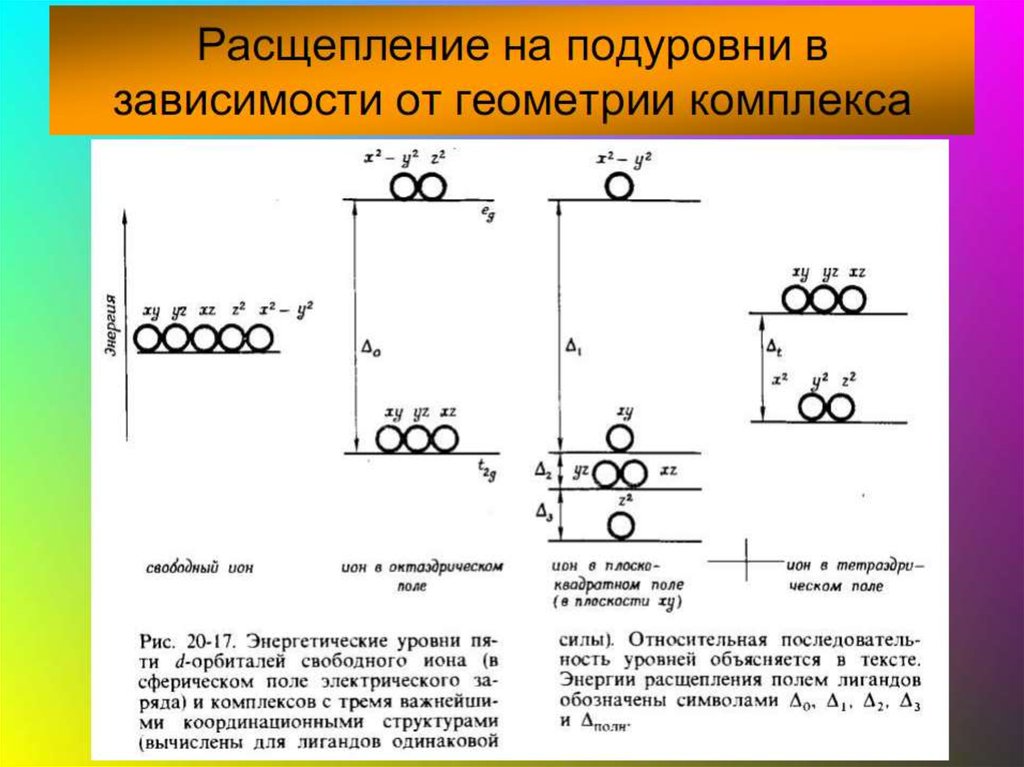
42. В случае [ML6]±,0 : октаэдрическое поле лигандов
В случае [ML6] ±,0 :октаэдрическое поле лигандов
• Поле слабо влияет (энергия
падает) в случае АО d(xy),
d(xz) и d(yz), располож.
между осей координат
(между лигандами)
Eо
d-АО
• Поле сильно влияет (энергия
растет) в случае АО d(z2) и
d(x2–y2), располож. вдоль
осей координат (ближе всего
к лигандам)
d
d
– параметр
расщепления
|E –Eо| = 3/5 ; |E –Eо| = 2/5
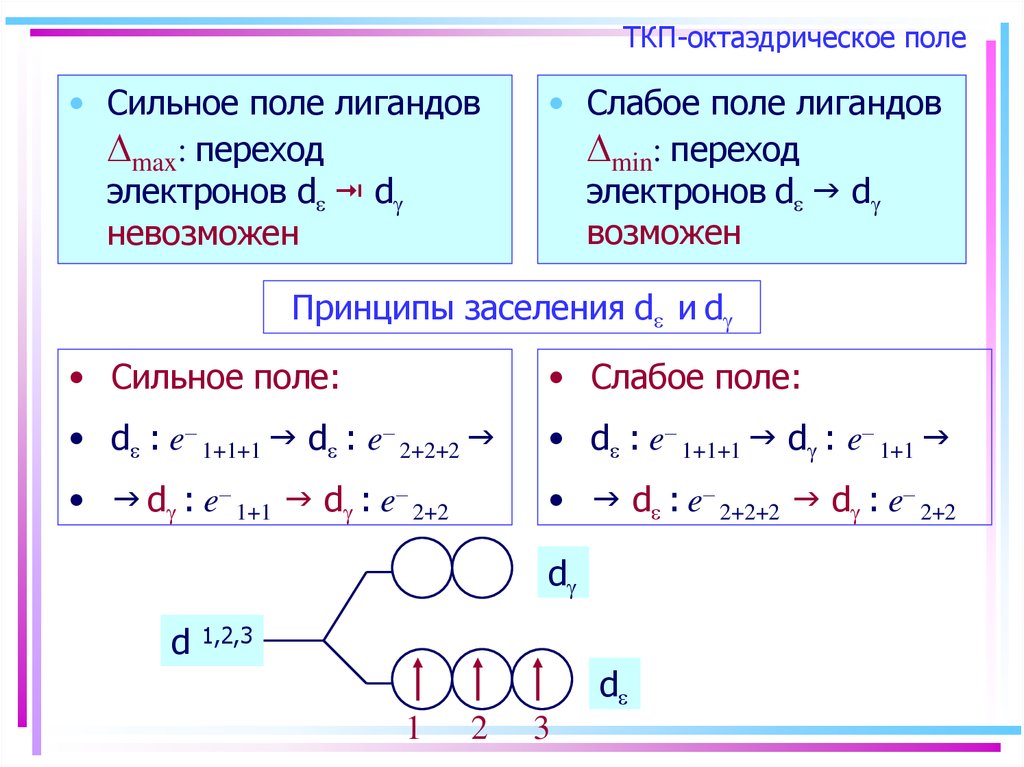
43. ТКП-октаэдрическое поле
• Сильное поле лигандовmax: переход
электронов d d
невозможен
• Слабое поле лигандов
min: переход
электронов d d
возможен
Принципы заселения d и d
• Сильное поле:
• Слабое поле:
• d : e– 1+1+1 d : e– 2+2+2
• d : e– 1+1+1 d : e– 1+1
• d : e– 1+1 d : e– 2+2
• d : e– 2+2+2 d : e– 2+2
d
d
1,2,3
d
1
2
3
44. Параметр расщепления и волновое число
Параметр расщепленияи волновое число
c
= h = h λ = hc
• 1 см–1 соответствует ок. 12 Дж/моль
• : 60 420 кДж/моль или 5000 35000
Примеры
см–1
FeSO4·7H2O
[Mn(H2O)6]2+ : 7800 см–1
[Fe(H2O)6]2+ : 10400 см–1
MnCl2·6H2O
: 21000
[Fe(H2O)6]3+ : 13700 см–1
Fe2(SO4)3·12H2O
[Mn(H2O)6
]3+
см–1
Fe(NO3)3·6H2O
FeCl3·6H2O
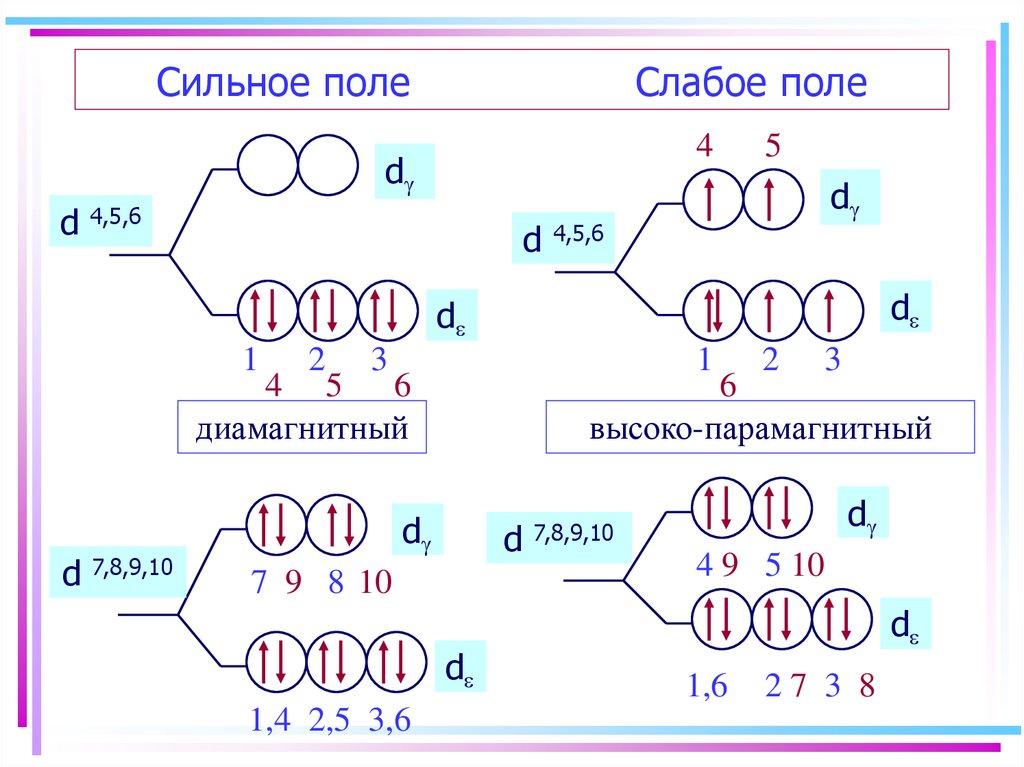
45. Сильное поле Слабое поле
4d
d
4,5,6
d
5
d
4,5,6
d
d
1
2
3
1
4 5
6
диамагнитный
d
7,8,9,10
3
6
высоко-парамагнитный
d
d
7 9 8 10
d
1,4 2,5 3,6
2
d
7,8,9,10
4 9 5 10
d
1,6
27 3 8
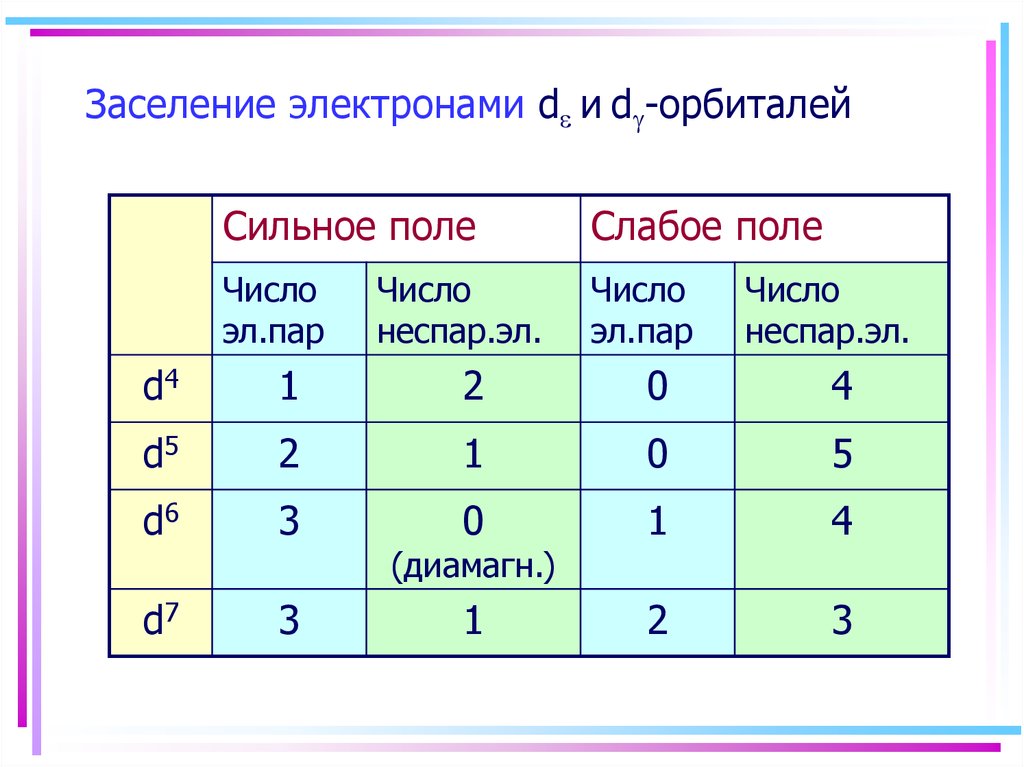
46. Заселение электронами d и d-орбиталей
Заселение электронами d и d -орбиталейСильное поле
Слабое поле
Число
эл.пар
Число
эл.пар
Число
неспар.эл.
Число
неспар.эл.
d4
1
2
0
4
d5
2
1
0
5
d6
3
0
1
4
d7
3
1
2
3
(диамагн.)
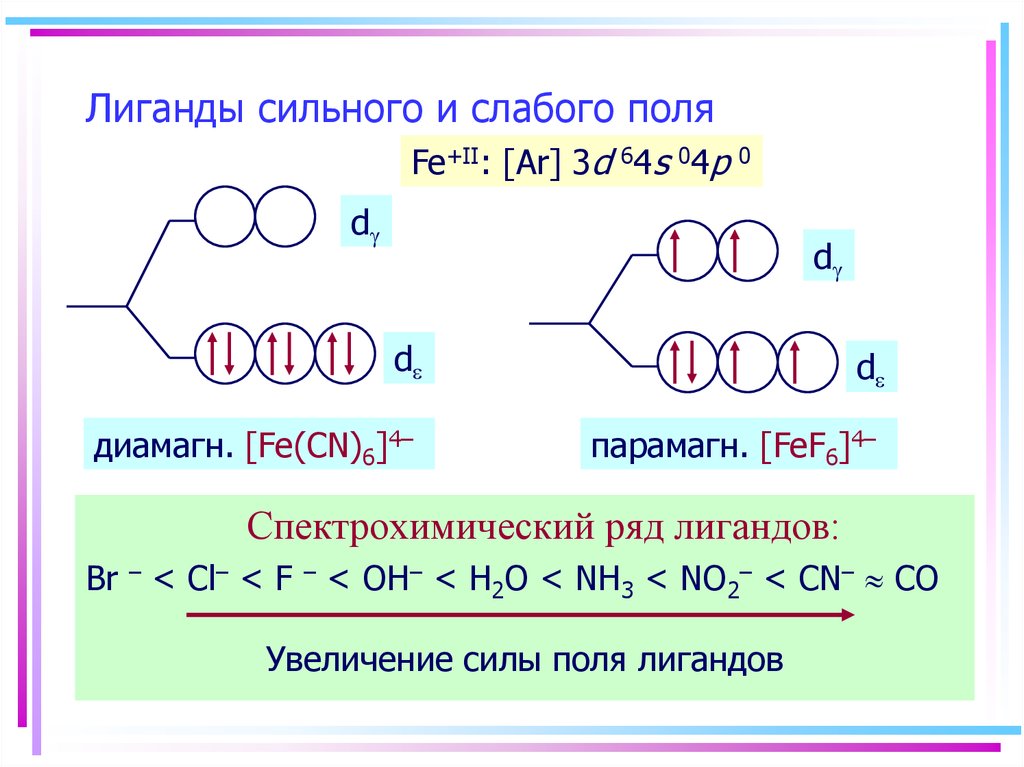
47. Лиганды сильного и слабого поля
Fe+II: [Ar] 3d 64s 04p0
d
d
d
d
диамагн. [Fe(CN)6]4–
парамагн. [FeF6]4–
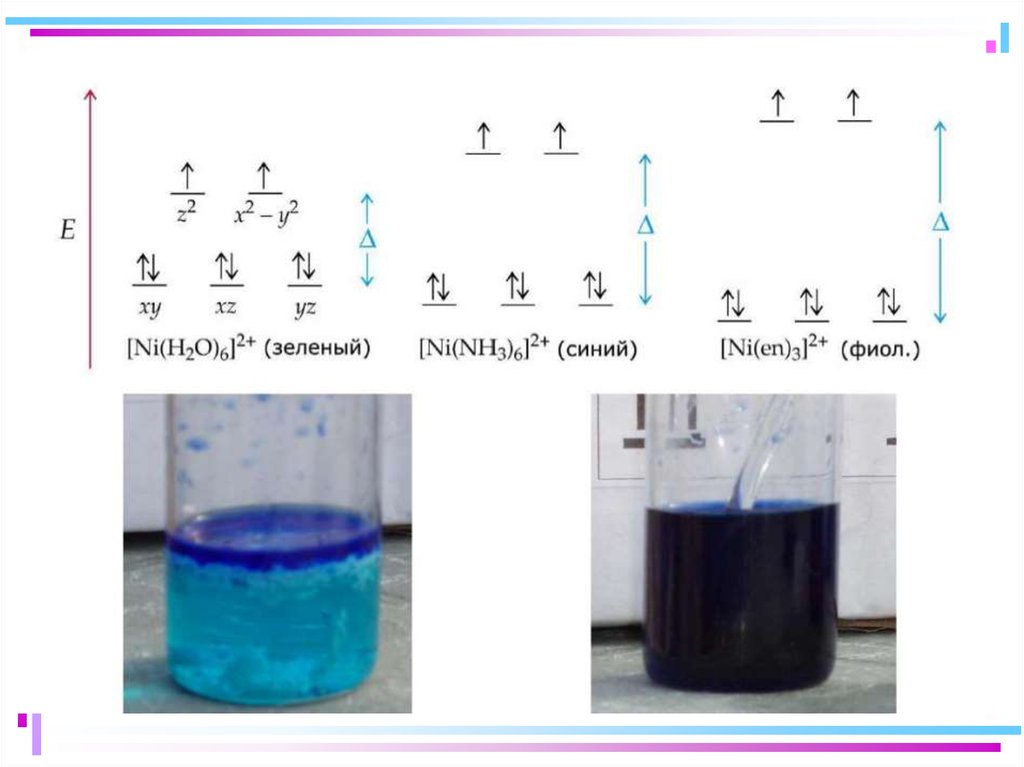
Спектрохимический ряд лигандов:
Br – < Cl– < F – < OH– < H2O < NH3 < NO2– < CN– CO
Увеличение силы поля лигандов
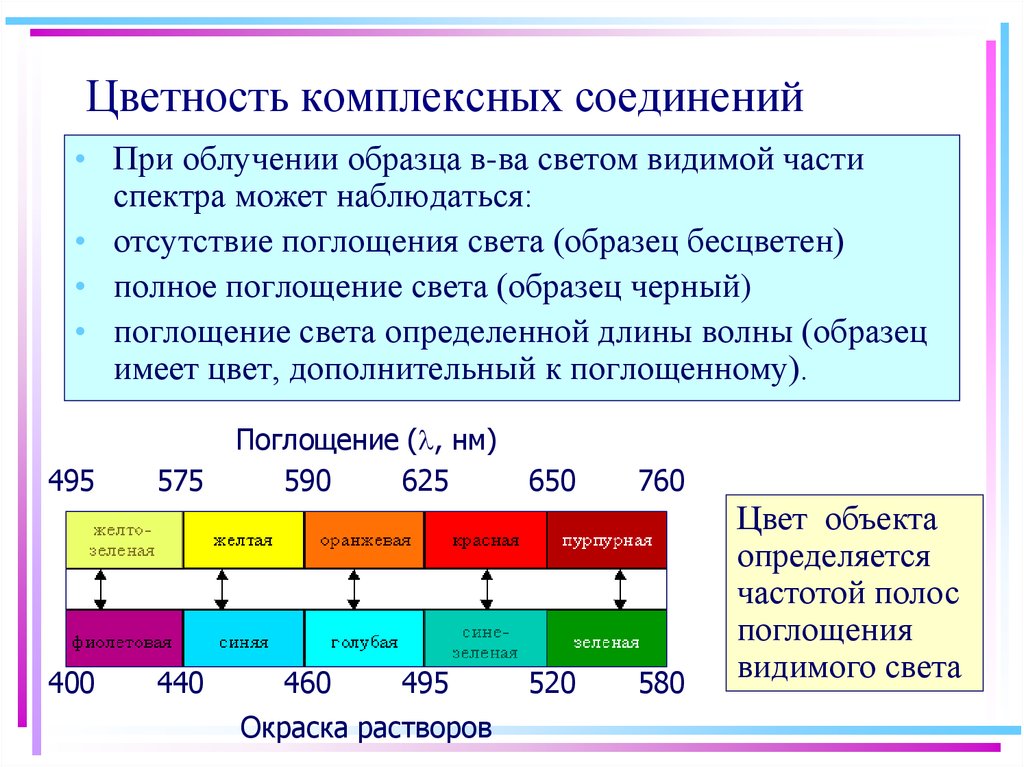
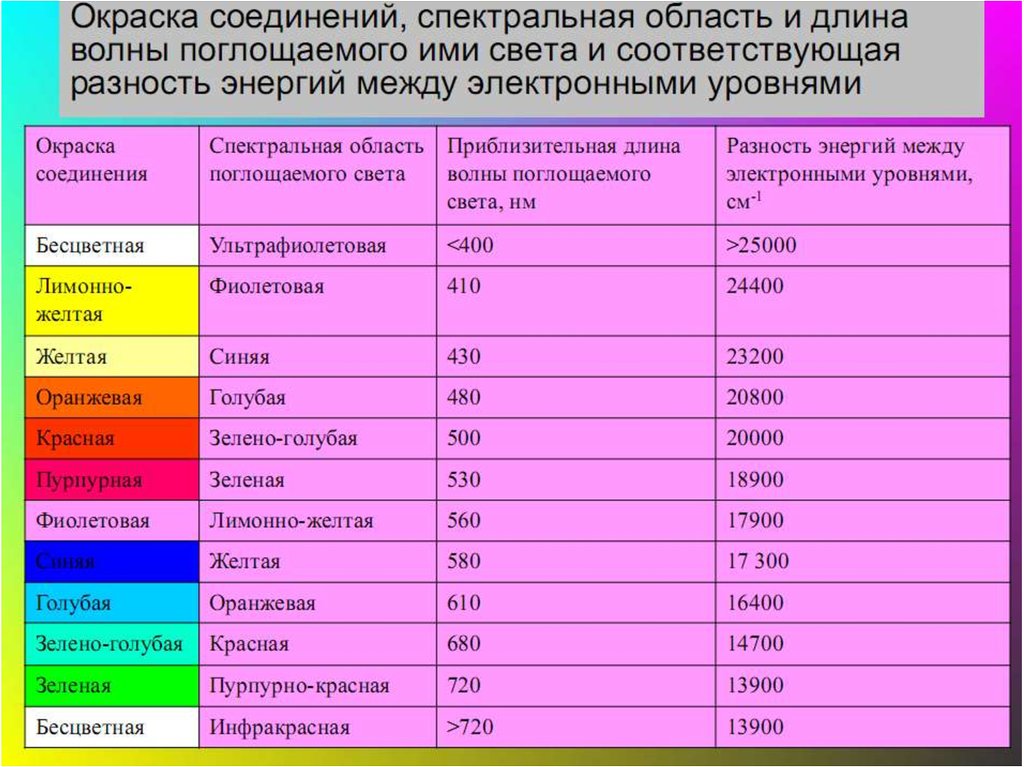
48. Цветность комплексных соединений
• При облучении образца в-ва светом видимой частиспектра может наблюдаться:
• отсутствие поглощения света (образец бесцветен)
• полное поглощение света (образец черный)
• поглощение света определенной длины волны (образец
имеет цвет, дополнительный к поглощенному).
495
400
575
440
Поглощение ( , нм)
590
625
460
495
Окраска растворов
650
520
760
580
Цвет объекта
определяется
частотой полос
поглощения
видимого света
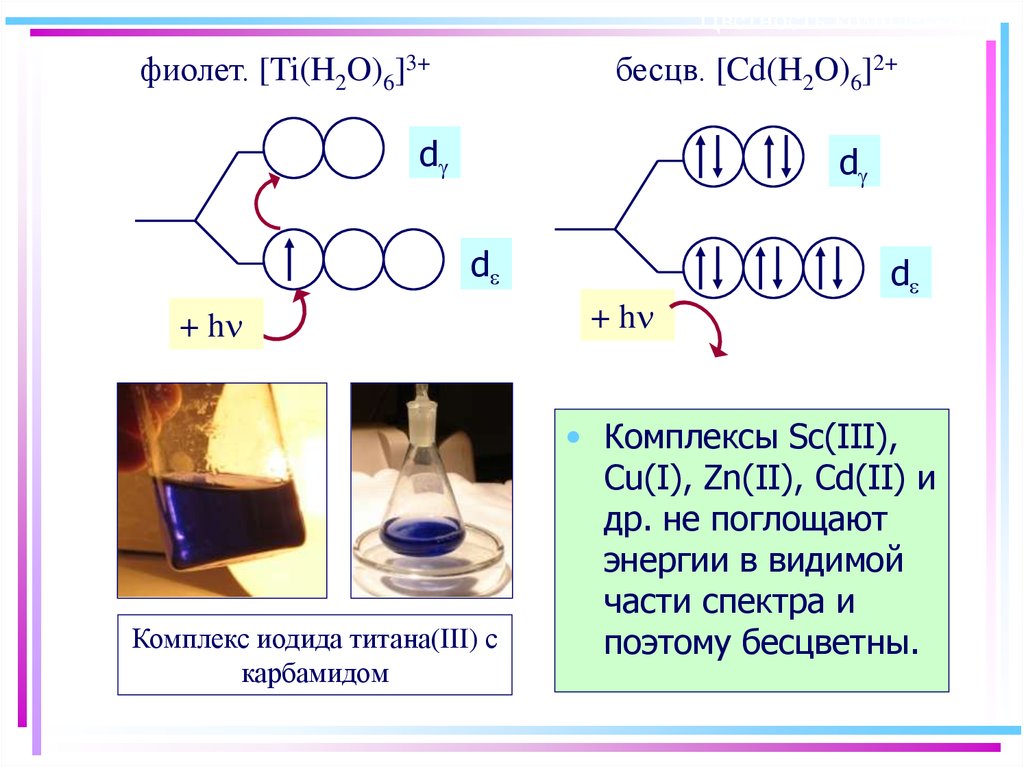
49. Цветность комплексов
фиолет. [Ti(H2O)6]3+бесцв. [Cd(H2O)6]2+
d
d
d
+ h
Комплекс иодида титана(III) с
карбамидом
d
+ h
• Комплексы Sc(III),
Cu(I), Zn(II), Cd(II) и
др. не поглощают
энергии в видимой
части спектра и
поэтому бесцветны.
50. Типы комплексных соединений. 1. Аквакомплексы
В водных растворах:• [Be(H2O)4]2+
• [Al(H2O)6]3+
• [Cr(H2O)6]3+ …
Кристаллогидраты:
• [Be(H2O)4]SO4
• [Al(H2O)6]Cl3
• [K(H2O)6][Cr(H2O)6](SO4)2
• [Cu(H2O)4]SO4·H2O
• [Ni(H2O)6]SO4·H2O
M
: OH2
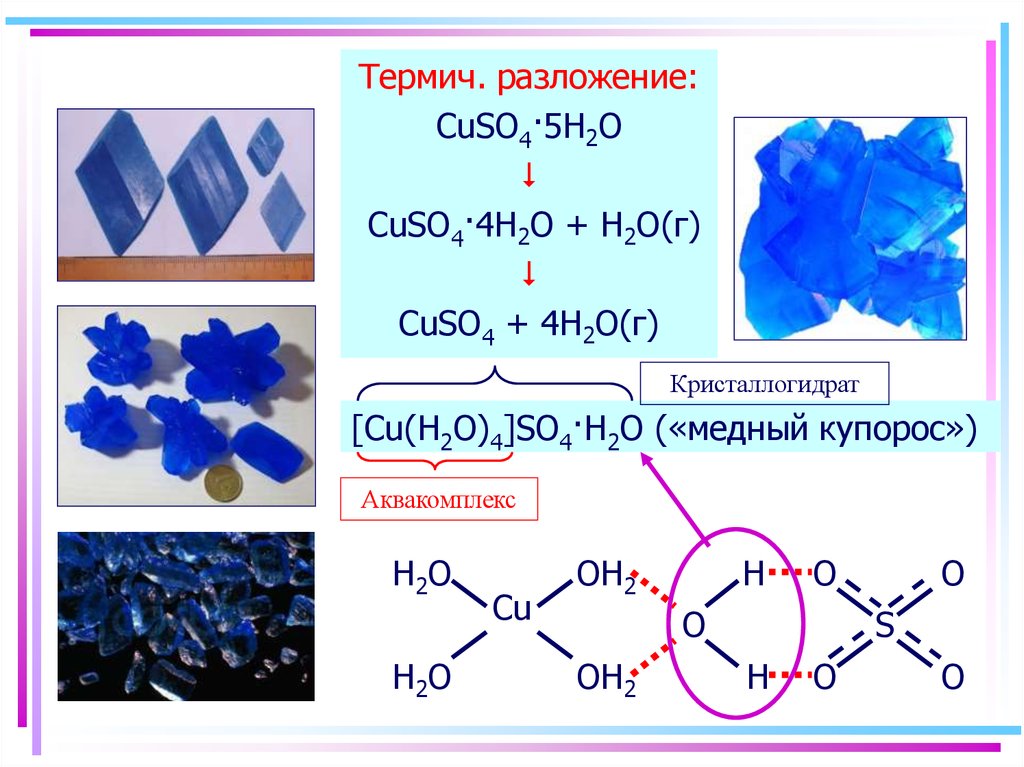
51. Аквакомплексы
Термич. разложение:CuSO4·5H2O
CuSO4·4H2O + H2O(г)
CuSO4 + 4H2O(г)
Кристаллогидрат
[Cu(H2O)4]SO4·H2O («медный купорос»)
Аквакомплекс
H2 O
H2 O
Cu
OH2
H
O
O
OH2
O
S
H
O
O
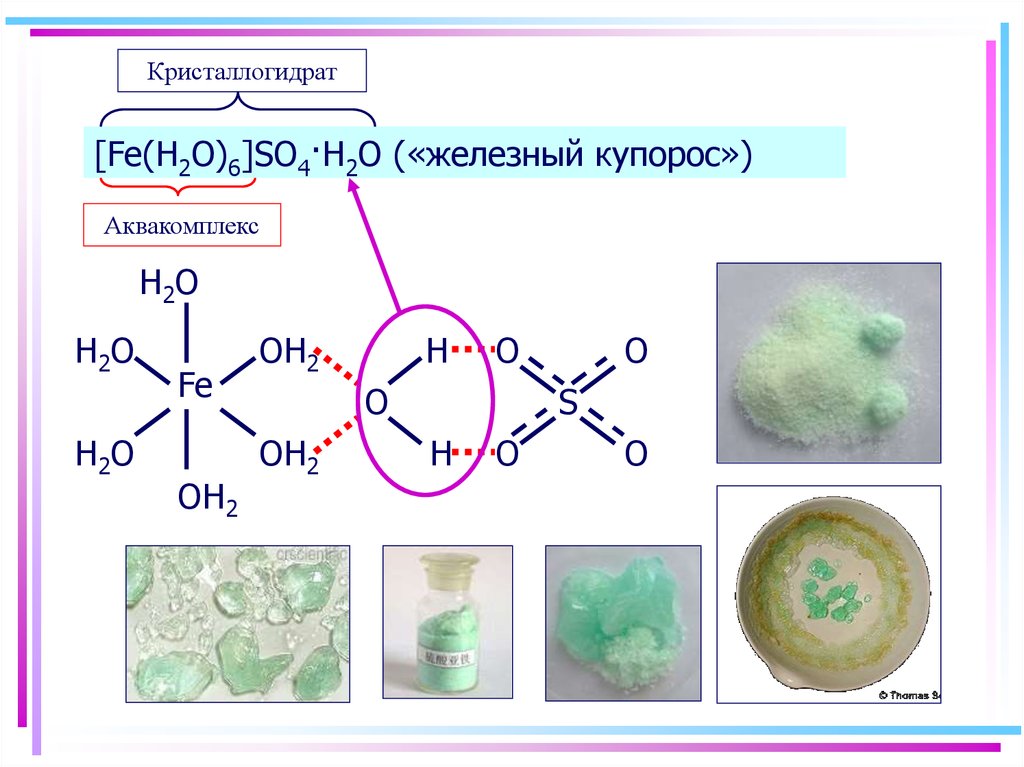
52. Аквакомплексы
Кристаллогидрат[Fe(H2O)6]SO4·H2O («железный купорос»)
Аквакомплекс
H2O
H2 O
H2 O
Fe
OH2
OH2
H
O
O
OH2
O
S
H
O
O
53. 2. Гидроксокомплексы
M: OH–
Получение:
• Zn(OH)2 + 2OH–(изб.) = [Zn(OH)4]2–; pH >> 7
Разрушение:
• [Zn(OH)4]2– (+H3O+)
+ CH3COOH; CO2; NH4+ (сл.к-ты, pH 7)
• Zn(OH)2(т)
+ H3O+ (сильн.к-ты, pH < 7)
• [Zn(H2O)4]2+
• Образование гидроксокомплексов характерно
для амфотерных элементов.
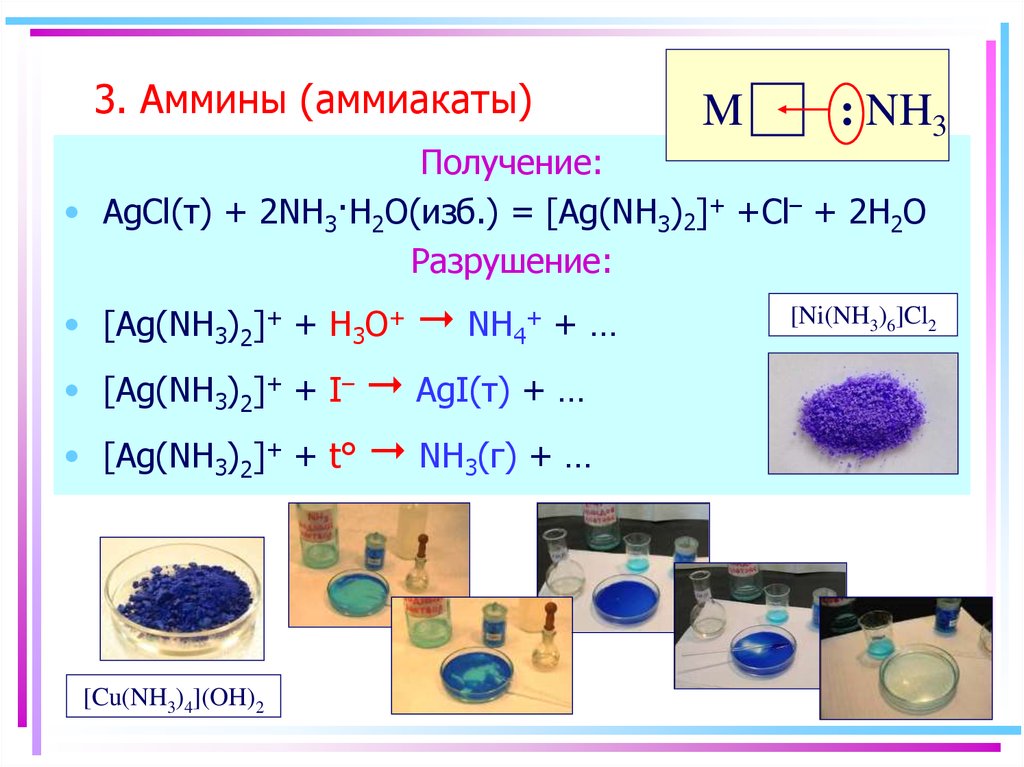
54. 3. Аммины (аммиакаты)
M: NH3
Получение:
• AgCl(т) + 2NH3·H2O(изб.) = [Ag(NH3)2]+ +Cl– + 2H2O
Разрушение:
• [Ag(NH3)2]+ + H3O+
AgI(т) + …
[Ag(NH3)2]+ + t° NH3(г) + …
• [Ag(NH3)2]+ + I–
NH4+ + …
[Cu(NH3)4](OH)2
[Ni(NH3)6]Cl2
55. 4. Ацидокомплексы
M
: Х–
Получение:
HgI2(т) + 2I–(изб.) = [HgI4]2–
[Fe(H2O)6]3+ + 6NCS−=[Fe(NCS)6]3− + 6H2O
Разрушение:
[HgI4]2– + S2– = HgS(т) + 4I–
[Fe(NCS)6]3− + 4F− = [FeF4]− + 6NCS−
Получение и разрушение тиоцианатного к-са Fe(III)
K3[Fe(CN)6]
K4[Fe(CN)6]
56. 6. Анионгалогенаты M[ЭГ¢mГ²n] (Э, Г¢ и Г² – галогены)
6. Анионгалогенаты M[ЭГ mГ n] (Э, Г и Г –галогены)
Получение:
•KI + I2 = K[I(I)2];
CsCl + IBr = Cs[I(Br)(Cl)]
Разрушение:
• K[I(I)2] + t° = KI + I2(г)
• Cs[I(Br)(Cl)] + t° = CsCl + IBr(г)
7. Катионгалогены [ЭГ mГ n]Z (Э, Г и Г – галогены)
Получение:
• ICl3 + SbCl5 = [ICl2][SbCl6]; BrF3 + AsF5 = [BrF2][AsF6]
Свойства:
• Ag[BrF4](s) + [BrF2][SbF6](s) = Ag[SbF6](s) + 2BrF3(ж)
в среде BrF3(ж)
57. 5. Гидридокомплексы
M
: H–
Получение:
4 NaH + B(OCH3)3 = Na[BH4] + 3CH3ONa (при 250 C)
4 LiH + AlCl3 = Li[AlH4] + 3LiCl
3 Li[BH4] + AlCl3 = Al[BH4]3 + 3LiCl
Разрушение:
Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2 (ОВР)
2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2 (ОВР)
Li[AlH4]
Na[BH4]
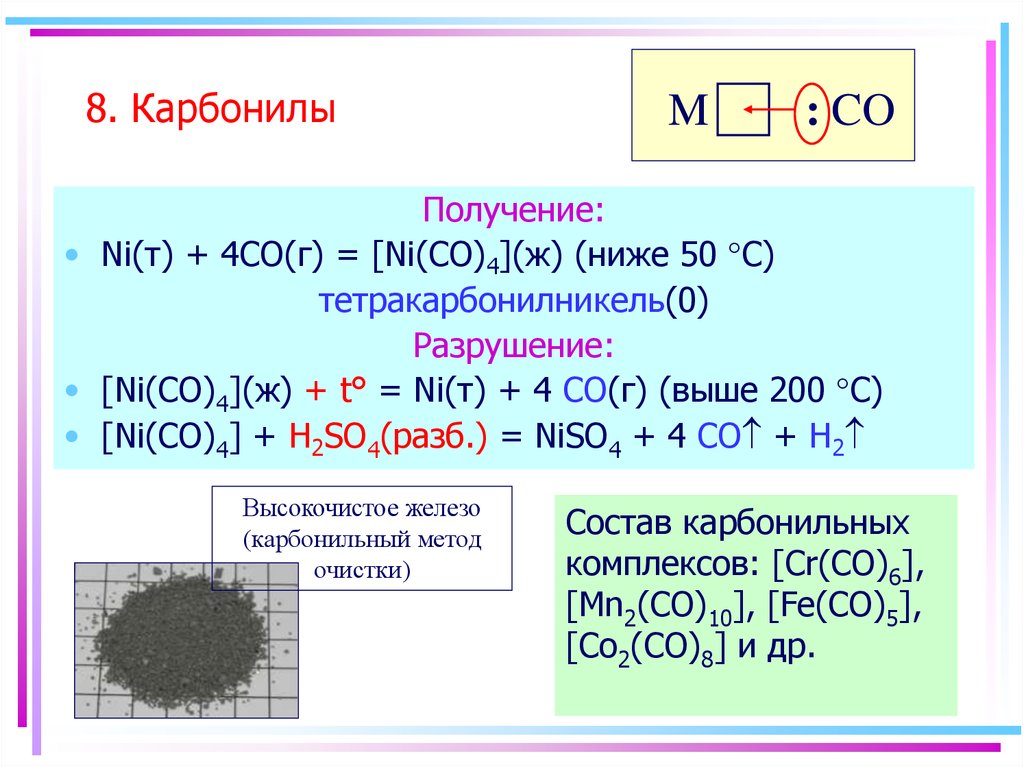
58. 8. Карбонилы
M: CO
Получение:
• Ni(т) + 4CO(г) = [Ni(CO)4](ж) (ниже 50 °С)
тетракарбонилникель(0)
Разрушение:
• [Ni(CO)4](ж) + t° = Ni(т) + 4 CO(г) (выше 200 °С)
• [Ni(CO)4] + H2SO4(разб.) = NiSO4 + 4 CO + H2
Высокочистое железо
(карбонильный метод
очистки)
Состав карбонильных
комплексов: [Cr(CO)6],
[Mn2(CO)10], [Fe(CO)5],
[Co2(CO)8] и др.
59. Правило Сиджвика для определения состава комплексов
• Устойчивым является комплекс, вкотором реализована 18-эл-ная
оболочка из s-, p- и d-электронов М и x
эл. пар лигандов (L)
Н.-В. Сиджвик
(1873 –1952)
0
26Fe
[Ar]3d64s2 ||
• 18 – 8 = 10e
36Kr
–
• или 36 – 26 = 10e
–
• x = 10/2 = 5 эл.пар (5 молекул CO)
• [Fe(CO)5] пентакарбонилжелезо
60. Правило Сиджвика (примеры)
**
*
*
*
0
7 2
27Co [Ar]3d 4s || 36Kr
18 – 9 = 9e –;
х = 9/2 = 4,5 (?)
радикал [·Co(CO)4]
тетракарбонилкобальт
(неуст.)
* димер [Co2(CO)8] (уст.)
октакарбонилдикобальт
0
23V
[Ar]3d34s2 ||
36Kr
• 18–5 = 13e –;
• х = 13/2 = 6,5 (?)
• радикал [·V(CO)6] (неуст.)
• или компл.соединение
состава K[:V–I(CO)6]
гексакарбонилванадат(-I)
калия (уст.)
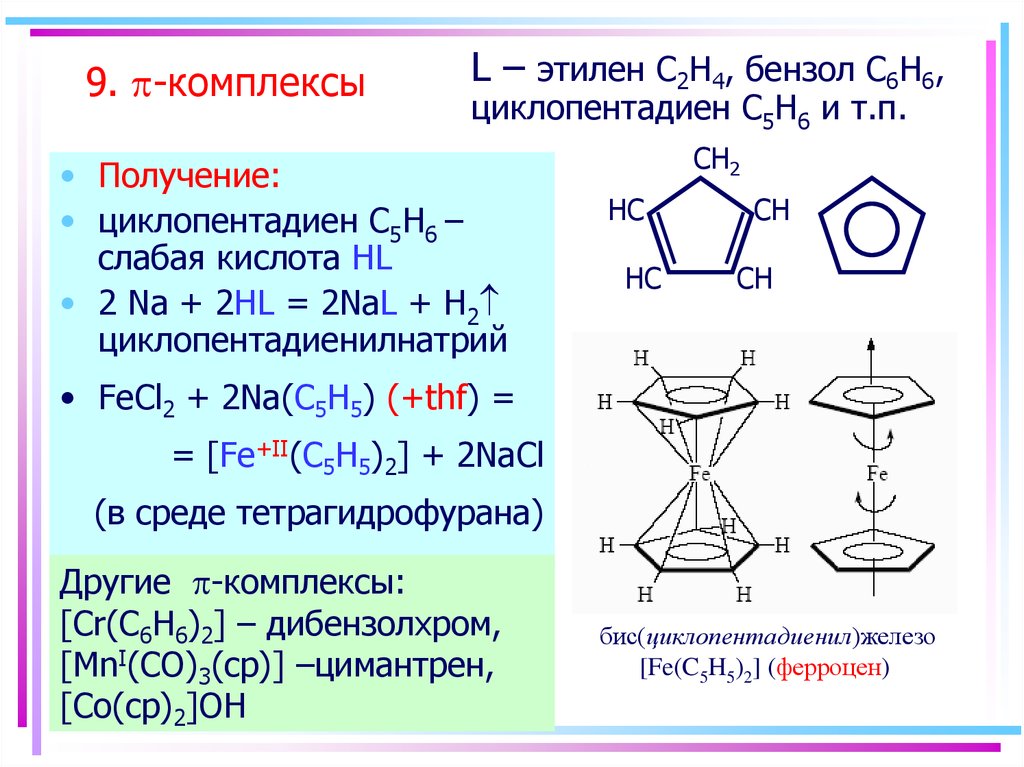
61. 9. p-комплексы
9. -комплексыL – этилен C2H4, бензол C6H6,
циклопентадиен С5H6 и т.п.
• Получение:
• циклопентадиен С5H6 –
слабая кислота HL
• 2 Na + 2HL = 2NaL + H2
циклопентадиенилнатрий
CH2
HC
HC
CH
CH
• FeCl2 + 2Na(C5H5) (+thf) =
= [Fe+II(C5H5)2] + 2NaCl
(в среде тетрагидрофурана)
Другие -комплексы:
[Cr(C6H6)2] – дибензолхром,
[MnI(CO)3(cp)] –цимантрен,
[Co(cp)2]OH
бис(циклопентадиенил)железо
[Fe(C5H5)2] (ферроцен)
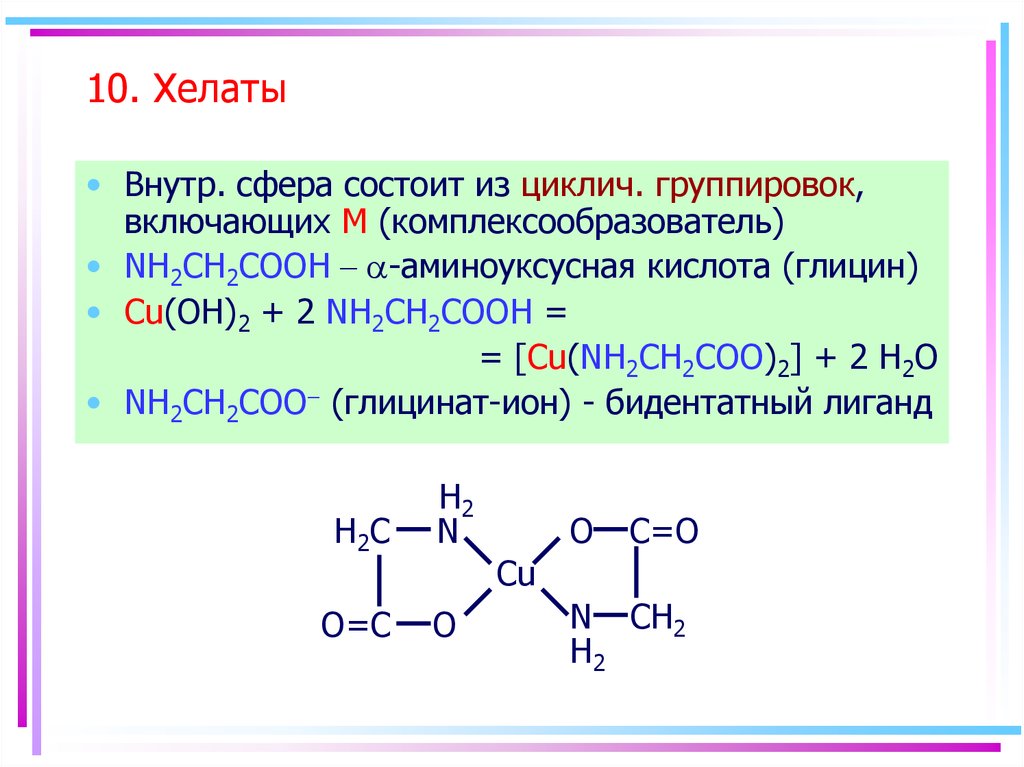
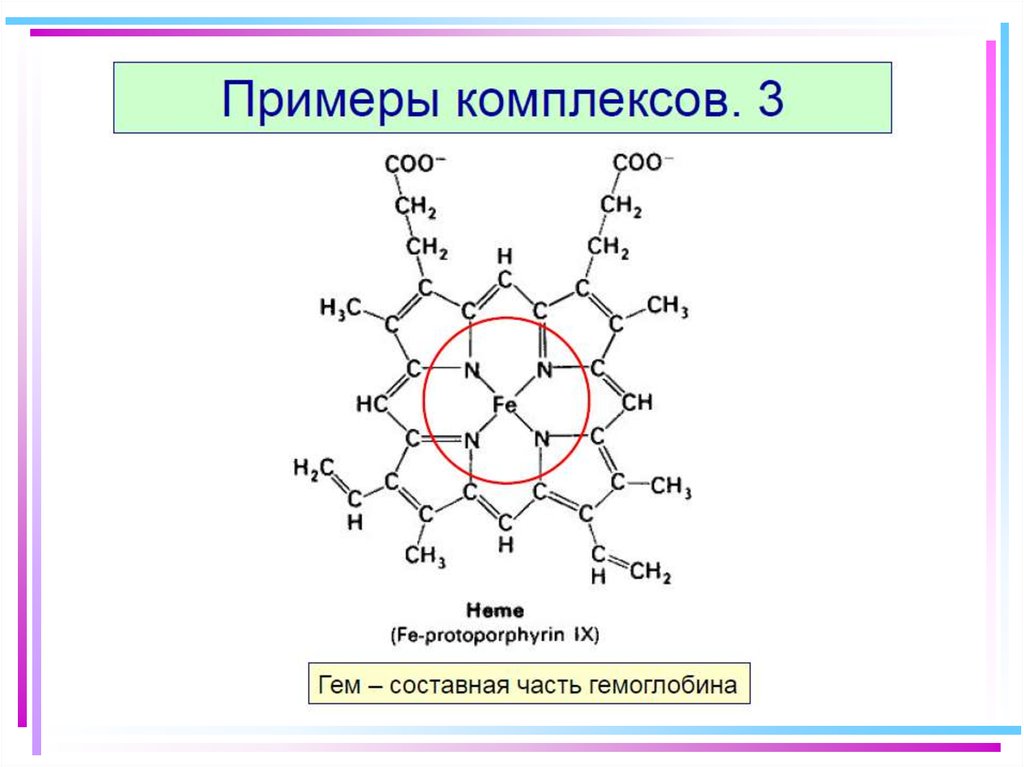
62. 10. Хелаты
• Внутр. сфера состоит из циклич. группировок,включающих M (комплексообразователь)
• NH2CH2COOH - a-аминоуксусная кислота (глицин)
• Cu(OH)2 + 2 NH2CH2COOH =
= [Cu(NH2CH2COO)2] + 2 H2O
• NH2CH2COO- (глицинат-ион) - бидентатный лиганд
H2C
O=C
H2
N
O
C=O
Cu
O
N CH2
H2
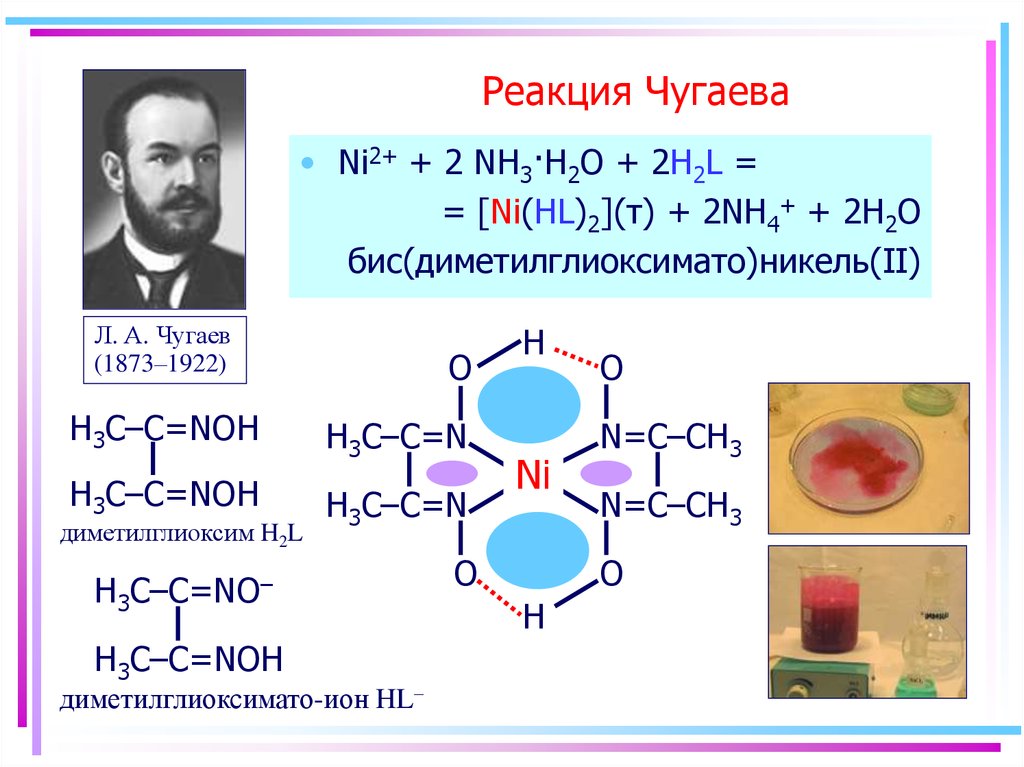
63. Реакция Чугаева
• Ni2+ + 2 NH3·H2O + 2H2L == [Ni(HL)2](т) + 2NH4+ + 2H2O
бис(диметилглиоксимато)никель(II)
Л. А. Чугаев
(1873–1922)
O
H3C–C=NOH
H3C–C=N
H3C–C=NOH
H3C–C=N
диметилглиоксим H2L
H3C–C=NO–
H3C–C=NOH
диметилглиоксимато-ион HL–
H
Ni
O
O
N=C–CH3
N=C–CH3
O
H
64. Методы синтеза комплексных соединений
• Реакция обмена лигандовА) в водном растворе (bобр, принцип Ле Шателье):
• [Сu(H2O)4]2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 8H2O
b(обр. прод.) > b(обр. исх.реаг.)
Б) в неводном растворителе:
• [Al(H2O)6]3+ + NH3·H2O
• [Al(H2O)6]3+(s) + 6NH3(ж) = [Al(NH3)6]3+(s) + 6H2O(s)
В) без растворителя:
• [Ni(H2O)6]Cl2(т) + 6NH3(г) = [Ni(NH3)6]Cl2(т) +6H2O(г)
Г) внутримол. обмен лигандов в тв. фазе:
• 2[Co(H2O)6]Cl2(т) + t° = Co[CoCl4](т) + 12H2O
розовый
синий
65. Методы синтеза комплексных соединений
Д) ОВР + реакции обмена лигандов+Ок.+ L
• [СoII(H2O)6]2+ [СoIIIL6]3+
• Ок.: H2O2, KNO2 … L – NH3, NO2– …
• Примеры:
• 2CoIICl2 + 12NH3 + H2O2 = 2[CoIII(NH3)6](OH)Cl2
• CoIICl2 + 7KNO2 + 2CH3COOH =
= K3[CoIII(NO2)6] + NO + 2KCl + 2CH3COOK + H2O
+ Вс
• [NiII(CN)4]2– [Ni0(CN)4]4–
66. Решение задач. 1. Растворение осадка при комплексообразовании
• AgBr(т) Ag+ + Br – ; ПРAgBr = 7,7·10–13• Ag+ + 2 SO3S2– [Ag(SO3S)2]3– ; bобр = 4·1013
• AgBr(т) + 2 SO3S2– [Ag(SO3S)2]3– + Br –;
• Kc = ?
Kc =
[Ag(SO3S)23–][Br –] [Ag+]
[SO3
S2–]2
[Ag+]
= ПРAgBr bобр
Kc = ПРAgBr bобр = 7,7·10–13 4·1013 = 30,8 >> 1
Наблюдается растворение осадка (смещение
равновесия вправо )
67. Решение задач. 2. Реакция обмена лигандов
• [Co(NH3)6]3+ + 6 CN– [Co(CN)6]3– + 6 NH3 ;• Kc = ?
• Co3+ + 6 NH3 [Co(NH3)6]3+ ; bобр(1) = 1,6·1035
• Co3+ + 6 CN– [Co(CN)6]3– ; bобр(2) = 1,0·1064
Kc =
[Co(CN)63–] [NH3]6 [Co3+]
[Co(NH3)6
3+]
[CN–]6
[Co3+]
=
bобр(2)
bобр(1)
Kc = bобр(2) / bобр(1) = (1,0·1064)/(1,6·1035) = 6,2·1029 >> 1
Наблюдается смещение равновесия вправо
68. Решение задач. 3. Разрушение комплекса
• [Cu(NH3)4]2+ + 4 H3O+ [Cu(H2O)4]2+ + 4 NH4+ ;• Kc = ?
• Cu2+ + 4 NH3 [Cu(NH3)4]2+ ; bобр = 7,9·1012
• NH4+ + 2H2O NH3·H2O + H3O+ ; Kк = 5,75·10–10
Kc =
[Cu2+] [NH4+]4 [NH3]4
[Cu(NH3)4
2+]
[H3
O +] 4
[NH3
]4
=
1
bобр Kк
4
Kc = 1 / (7,9·1012·5,754·10–40 ) = 1,16·1020 >> 1
Наблюдается разрушение аммиачного комплекса в
кислотной среде (смещение равновесия вправо )
69. Решение задач. 4. Направление реакции
• CuCN(т) + H2O + HCN [Cu(CN)2]– + H3O+• Kc = ?
• Cu+ + 2CN– [Cu(CN)2]– ; bобр = 1,0·1024
• HCN + H2O CN– + H3O+ ; Kк = = 4,93·10–10
• CuCN(т) Cu+ + CN– ; ПРCuCN = 3,2·10–20
Kc =
[Cu(CN)2–][H3O+] [CN–][Cu+][CN–]
[HCN] [CN–]2
[Cu+]
= bобр·Kк·ПРCuCN
Kc = 1,0·1024 · 4,93·10–10 · 3,2·10–20 = 1,6·10–6 << 1
Растворение осадка не наблюдается (равновесие
смещено влево )
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
85.
86.
87.
88.
89.
90.
91.
92.
93.
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104.
105.
106.
107.
108.
109.
110.
111.
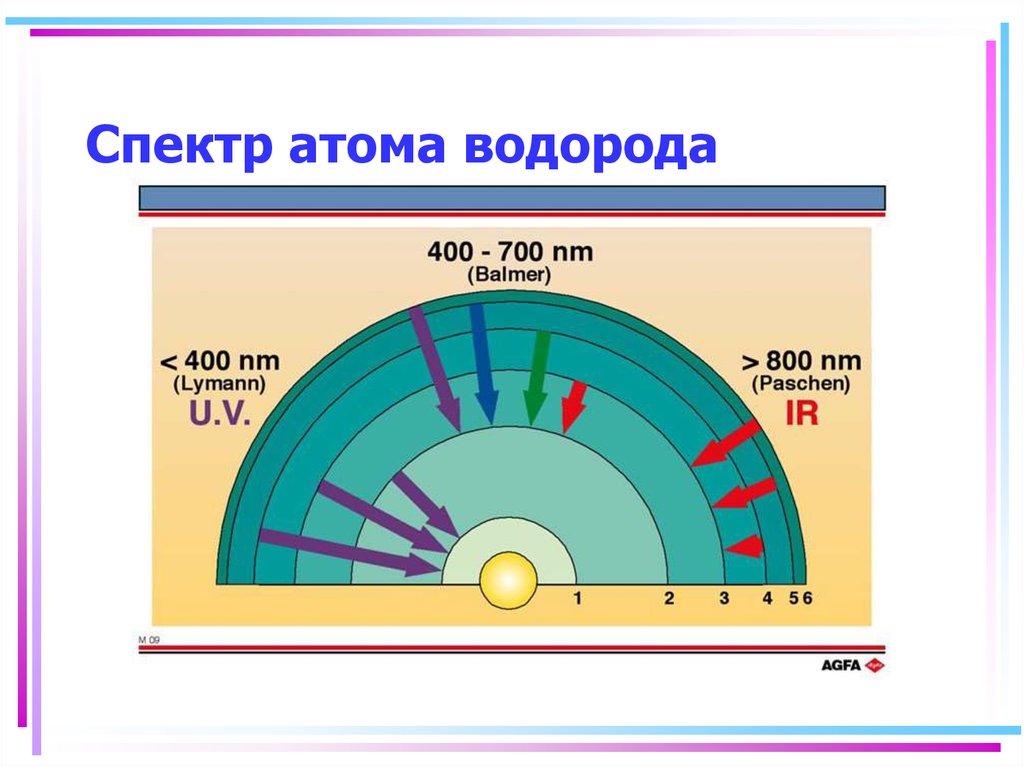
112. Спектр атома водорода
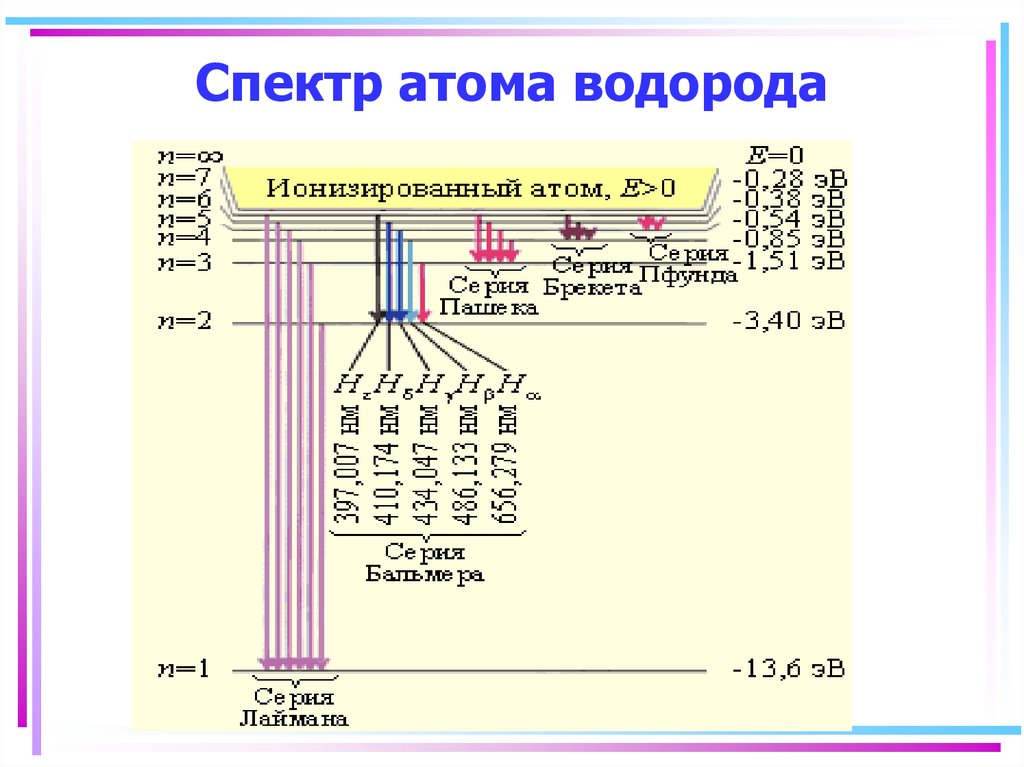
113. Спектр атома водорода
114.
115.
116.
117.
118.
119.
120.
121.
122.
123.
124.
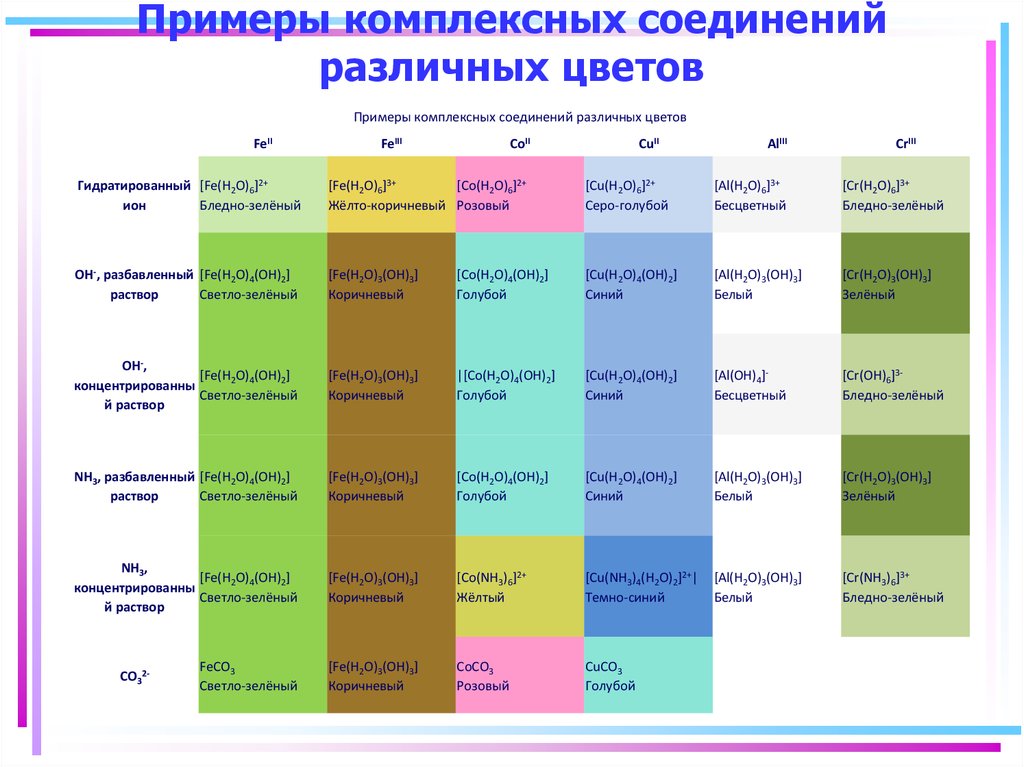
125. Примеры комплексных соединений различных цветов
Примеры комплексных соединений различных цветовFeII
FeIII
CoII
CuII
AlIII
CrIII
Гидратированный [Fe(H2O)6]2+
ион
Бледно-зелёный
[Fe(H2O)6]3+
[Co(H2O)6]2+
Жёлто-коричневый Розовый
[Cu(H2O)6]2+
Серо-голубой
[Al(H2O)6]3+
Бесцветный
[Cr(H2O)6]3+
Бледно-зелёный
OH-, разбавленный [Fe(H2O)4(OH)2]
раствор
Светло-зелёный
[Fe(H2O)3(OH)3]
Коричневый
[Co(H2O)4(OH)2]
Голубой
[Cu(H2O)4(OH)2]
Синий
[Al(H2O)3(OH)3]
Белый
[Cr(H2O)3(OH)3]
Зелёный
OH-,
[Fe(H2O)4(OH)2]
концентрированны
Светло-зелёный
й раствор
[Fe(H2O)3(OH)3]
Коричневый
|[Co(H2O)4(OH)2]
Голубой
[Cu(H2O)4(OH)2]
Синий
[Al(OH)4]Бесцветный
[Cr(OH)6]3Бледно-зелёный
NH3, разбавленный [Fe(H2O)4(OH)2]
раствор
Светло-зелёный
[Fe(H2O)3(OH)3]
Коричневый
[Co(H2O)4(OH)2]
Голубой
[Cu(H2O)4(OH)2]
Синий
[Al(H2O)3(OH)3]
Белый
[Cr(H2O)3(OH)3]
Зелёный
NH3,
[Fe(H2O)4(OH)2]
концентрированны
Светло-зелёный
й раствор
[Fe(H2O)3(OH)3]
Коричневый
[Co(NH3)6]2+
Жёлтый
[Cu(NH3)4(H2O)2]2+|
Темно-синий
[Al(H2O)3(OH)3]
Белый
[Cr(NH3)6]3+
Бледно-зелёный
FeCO3
Светло-зелёный
[Fe(H2O)3(OH)3]
Коричневый
CoCO3
Розовый
CuCO3
Голубой
CO32-
126.
127.
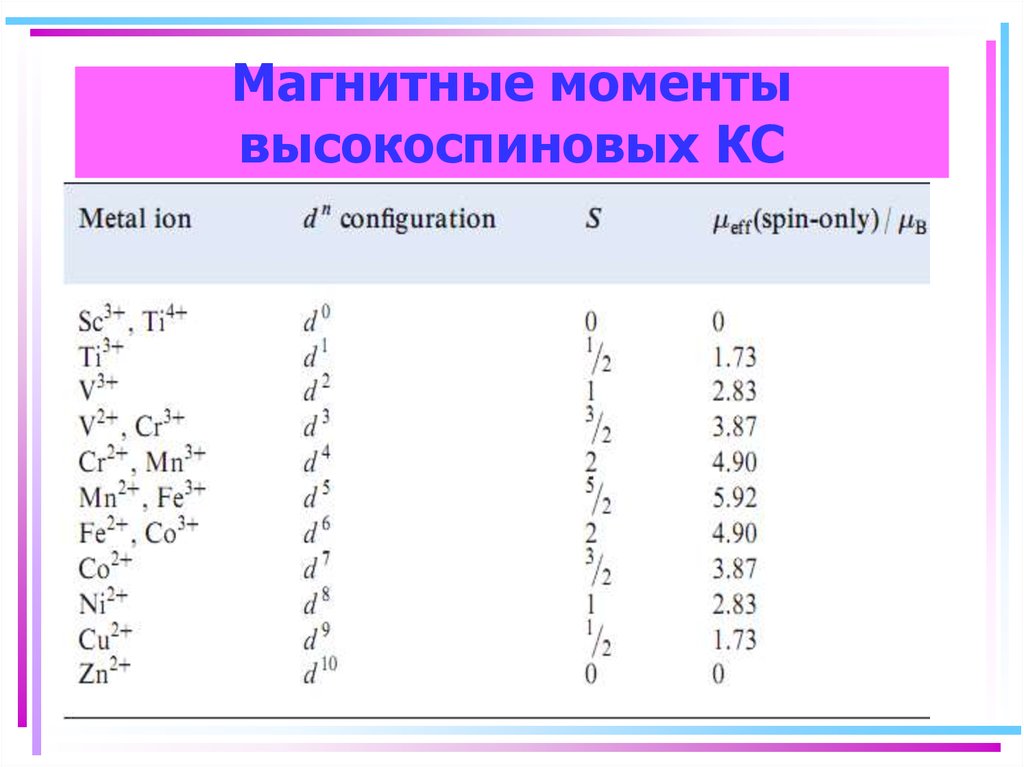
128. Магнитные моменты высокоспиновых КС
129.
СодержаниеВведение
Комплексные ионы
Комплексные соединения
Реакции комплексообразования
Координационные соединения
Глава 1. Основные понятия координационной теории
1.1. Комплексообразователь
1.2. Лиганды
1.3. Дентатность
1.4. Координационное число
1.5. Внутренняя и внешняя сфера
1.6. Многоядерные комплексы
Глава 2. Номенклатура комплексных соединений
2.1.
2.2.
2.3.
2.4.
2.5.
2.6.
2.7.
Названия лигандов
Порядок перечисления лигандов
Нейтральные комплексы
Комплексные катионы
Комплексные анионы
Мостиковые группы и многоядерные комплексы
Геометрические изомеры
3.1.
3.2.
3.3.
3.4.
3.5.
Координационное
Координационное
Координационное
Координационное
Координационное
Глава 3. Строение комплексных соединений
число
число
число
число
число
2
3
4
5
6 и выше
130.
• Глава 4. Изомерия комплексных соединений4.1. Изомерия лигандов
4.2. Геометрическая изомерия
4.3. Оптическая изомерия
4.4. Сольватная (гидратная) изомерия
4.5. Ионная изомерия
Вопросы к 4 главе
• Глава 5. Устойчивость комплексных соединений в
растворе
5.1. Комплексные соединения без внешней сферы
5.2. Отщепление ионов внешней сферы
5.3. Обратимая диссоциация комплексов
5.4. Ступенчатая и полная константы образования
5.5. Прочность комплексов
5.6. Константы нестойкости
5.7. Примеры образования и разрушения комплексов
Вопросы к 5 главе
• Глава 6. Квантовомеханические теории строения
комплексов
6.1.
6.2.
6.3.
6.4.
6.5.
Теория валентных связей
Гибридизация орбиталей и структура комплексов
Теория кристаллического поля
Цветность
ММО для комплексных соединений
131.
• Глава 7. Типы комплексных соединений7.1. Аквакомплексы
7.2. Гидроксокомплексы
7.3. Аммиакаты
7.4. Ацидокомплексы
7.5. Анионгалогенаты
7.6. Катионгалогены
7.7. Гидридные комплексы
7.8. Карбонильные комплексы
7.9. p-комплексы
7.10. Хелаты
7.11. Многоядерные комплексы
• Глава 8. Элементы Периодической системы Д.И.
Менделеева: способность к образованию комплексов
8.1.
8.2.
8.3.
8.4.
Элементы s-секции
Элементы p-секции
Элементы d-секции
Лантаноиды и актиноиды





![Внутренняя сфера [комплекс] Внешняя сфера (противоион) Внутренняя сфера [комплекс] Внешняя сфера (противоион)](https://cf.ppt-online.org/files/slide/c/cwgLmKXrvZ4SzkqYt78li520BPFM9ne3uDNGfR/slide-7.jpg)


![2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0 2. Формулы и названия компл. соединений. [M(L+)(L0)(L–)]±,0](https://cf.ppt-online.org/files/slide/c/cwgLmKXrvZ4SzkqYt78li520BPFM9ne3uDNGfR/slide-12.jpg)
















![В случае [ML6]±,0 : октаэдрическое поле лигандов В случае [ML6]±,0 : октаэдрическое поле лигандов](https://cf.ppt-online.org/files/slide/c/cwgLmKXrvZ4SzkqYt78li520BPFM9ne3uDNGfR/slide-41.jpg)




![6. Анионгалогенаты M[ЭГ¢mГ²n] (Э, Г¢ и Г² – галогены) 6. Анионгалогенаты M[ЭГ¢mГ²n] (Э, Г¢ и Г² – галогены)](https://cf.ppt-online.org/files/slide/c/cwgLmKXrvZ4SzkqYt78li520BPFM9ne3uDNGfR/slide-55.jpg)













































 chemistry
chemistry








