Similar presentations:
Влияние комплексообразования на химическую активность металлов
1. ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ХИМИЧЕСКУЮ АКТИВНОСТЬ МЕТАЛЛОВ
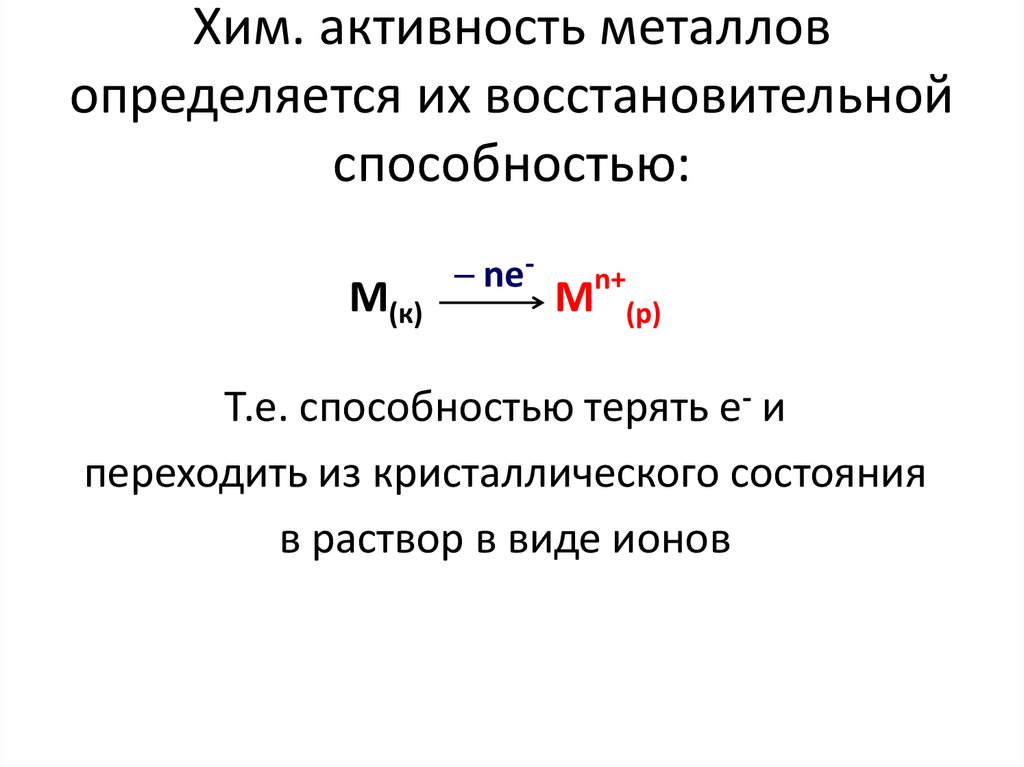
2. Хим. активность металлов определяется их восстановительной способностью:
М(к)─ ne-
n+
М
(р)
Т.е. способностью терять е- и
переходить из кристаллического состояния
в раствор в виде ионов
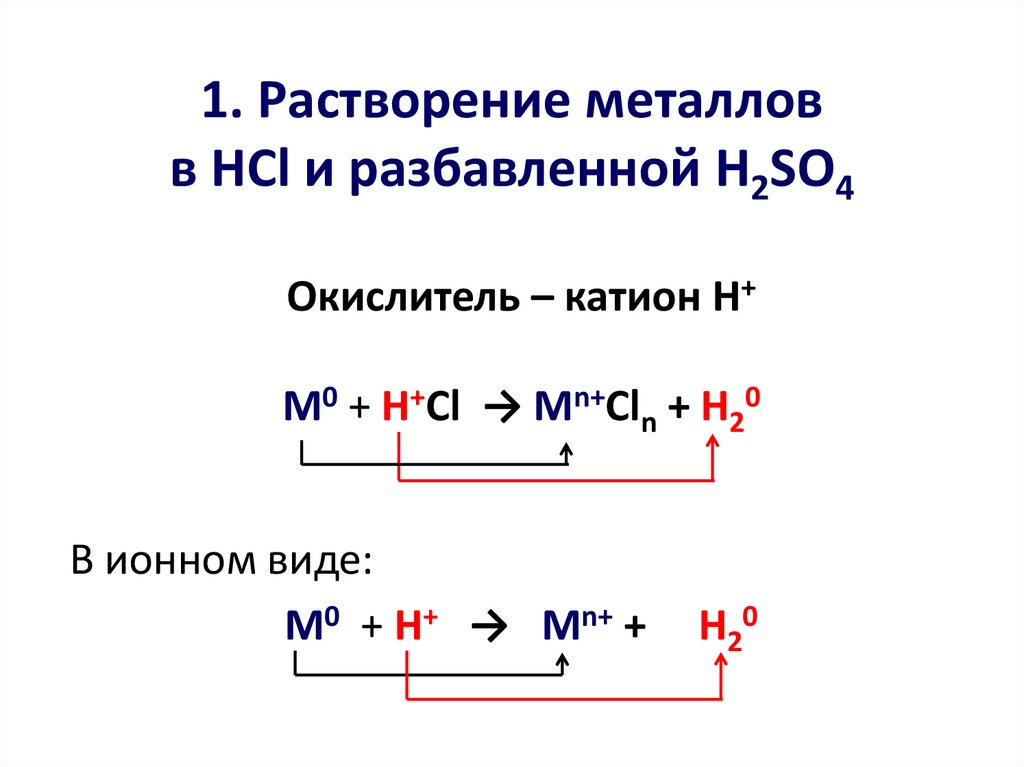
3. 1. Растворение металлов в HCl и разбавленной H2SO4
Окислитель – катион Н+М0 + H+Cl → Mn+Cln + H20
В ионном виде:
М0 + H+ → Mn+ +
H20
4.
Mn+Cln –условная запись аквакомплекса
[M(OH2)6]n+Cln
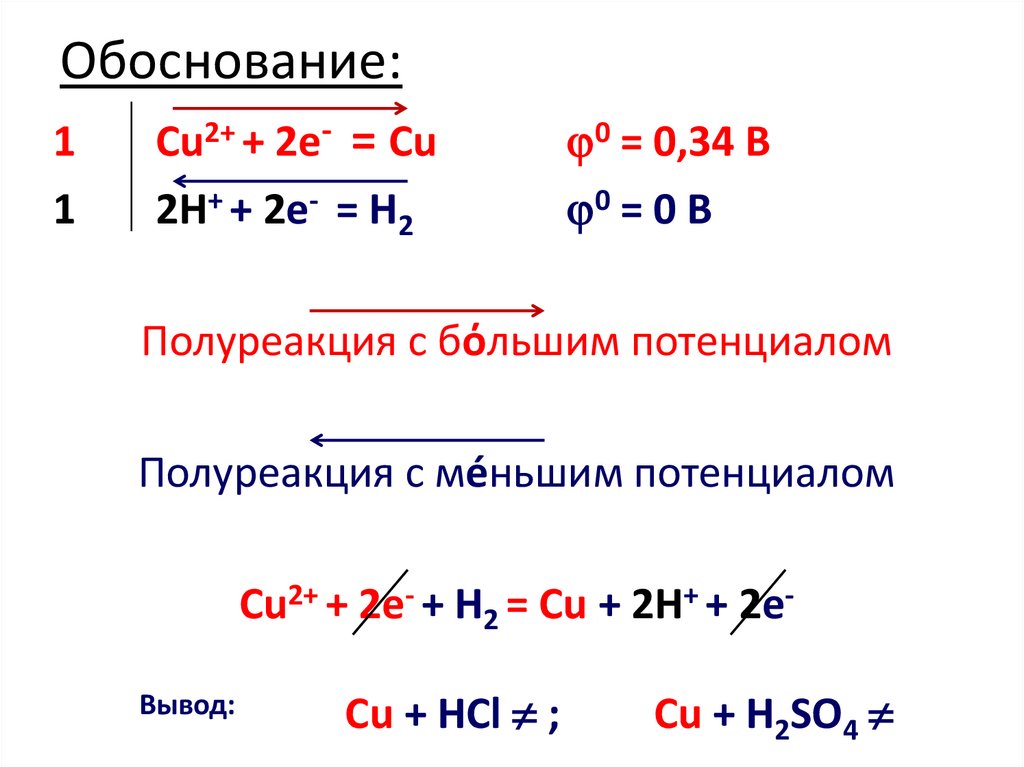
5. Обоснование:
11
Cu2+ + 2e- = Cu
2H+ + 2e- = H2
0 = 0,34 B
0 = 0 B
Полуреакция с бόльшим потенциалом
Полуреакция с мéньшим потенциалом
Cu2+ + 2e- + H2 = Cu + 2H+ + 2eВывод:
Cu + HCl ;
Cu + H2SO4
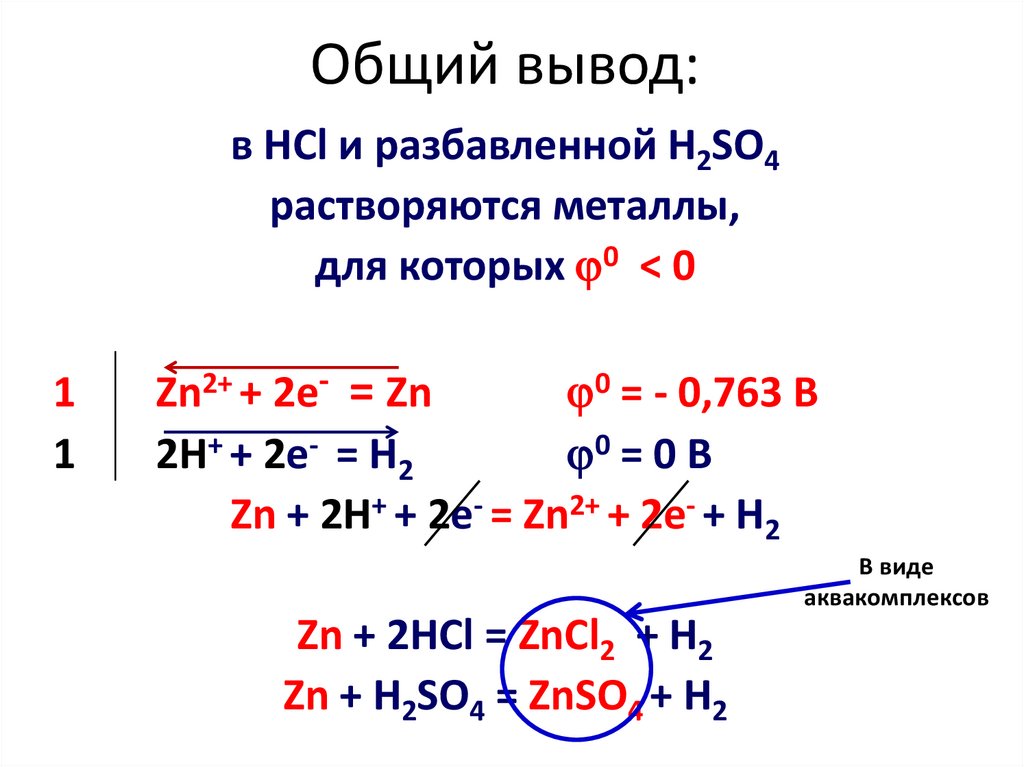
6. Общий вывод:
в HCl и разбавленной H2SO4растворяются металлы,
для которых 0 < 0
1
1
Zn2+ + 2e- = Zn
0 = - 0,763 B
2H+ + 2e- = H2
0 = 0 B
Zn + 2H+ + 2e- = Zn2+ + 2e- + H2
В виде
аквакомплексов
Zn + 2HCl = ZnCl2 + H2
Zn + H2SO4 = ZnSO4 + H2
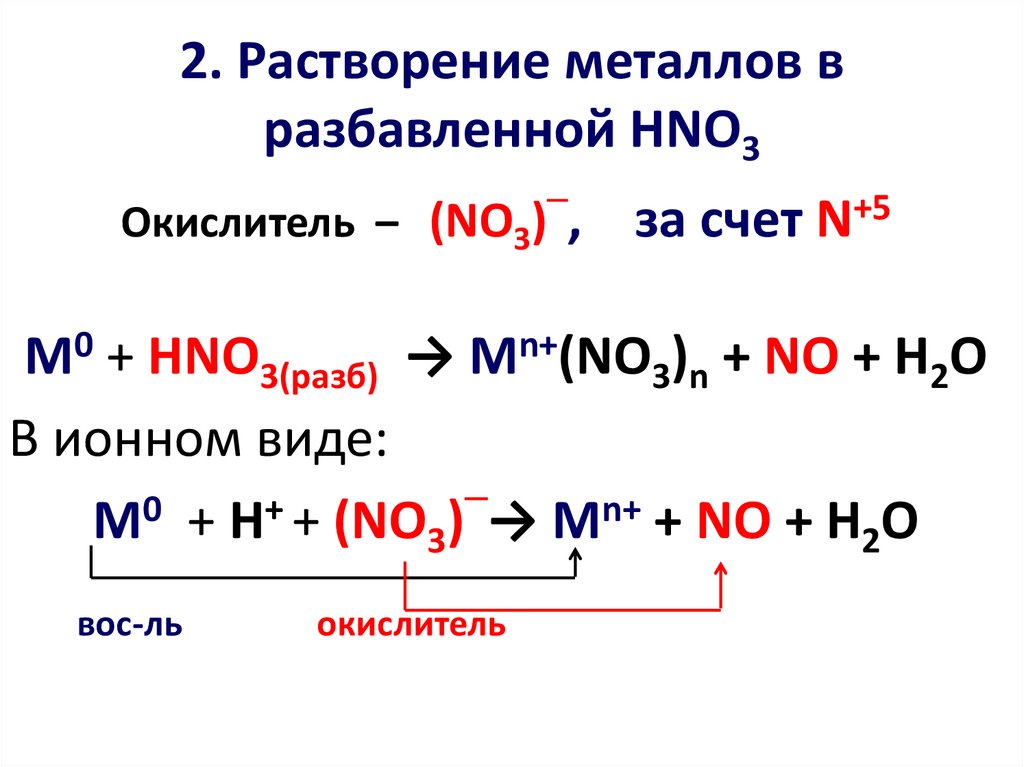
7. 2. Растворение металлов в разбавленной HNO3
─Окислитель – (NO3)
, за счет N+5
М0 + HNO3(разб) → Mn+(NO3)n + NO + H2O
В ионном виде:
─
0
+
М + H + (NO3) → Mn+ + NO + H2O
вос-ль
окислитель
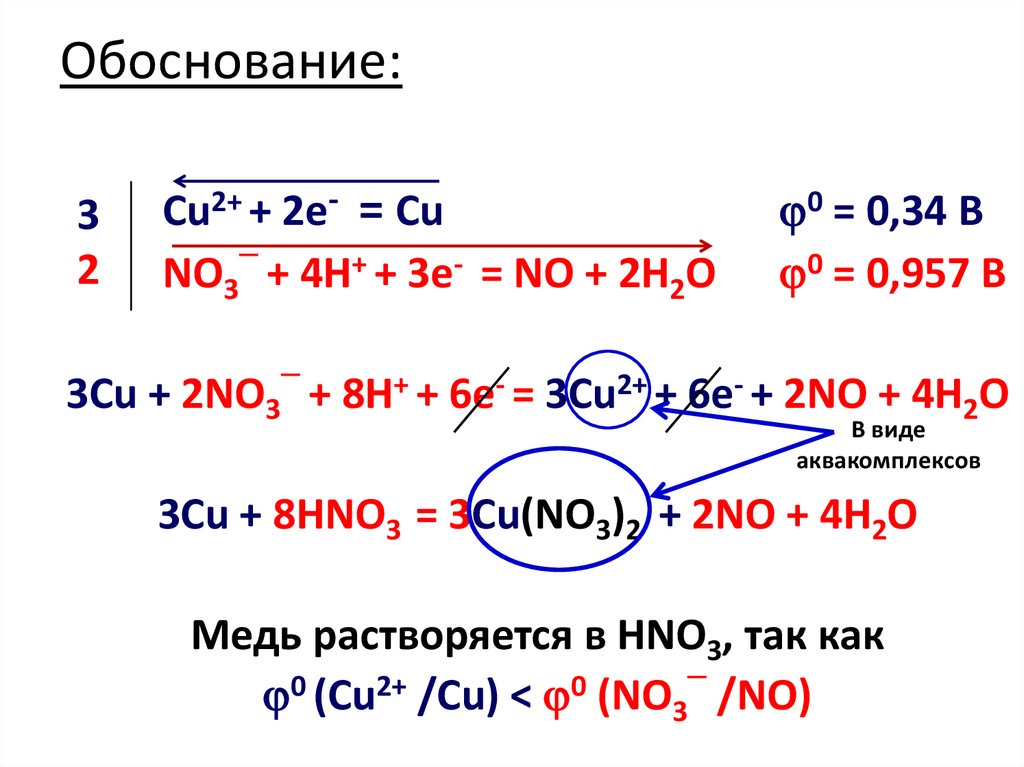
8. Обоснование:
32
Cu2+ + 2e- = Cu
─
NO3 + 4H+ + 3e- = NO + 2H2O
0 = 0,34 B
0 = 0,957 B
─
3Cu + 2NO3 + 8H+ + 6e- = 3Cu2+ + 6e- + 2NO + 4H2O
В виде
аквакомплексов
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Медь растворяется в HNO3, так как
─
0
2+
0
(Сu /Cu) < (NO3 /NO)
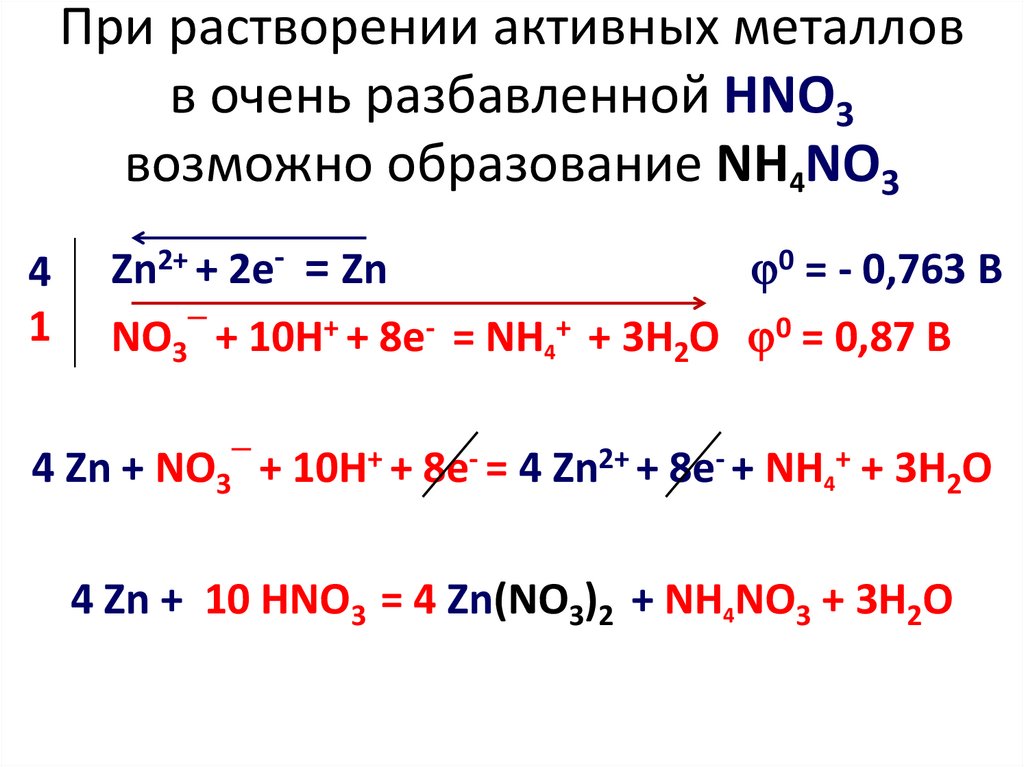
9. При растворении активных металлов в очень разбавленной HNO3 возможно образование NH4NO3
41
Zn2+ + 2e- = Zn
0 = - 0,763 B
─
NO3 + 10H+ + 8e- = NH4+ + 3H2O 0 = 0,87 B
─
4 Zn + NO3 + 10H+ + 8e- = 4 Zn2+ + 8e- + NH4+ + 3H2O
4 Zn + 10 HNO3 = 4 Zn(NO3)2 + NH4NO3 + 3H2O
10. 3. Растворение металлов в водном растворе аммиака
М(к)─ ne-
М(NH3)m
n+
(р)
Для окисления металла необходим окислитель,
например, O2 воздуха
11. 3. Растворение металлов в водном растворе аммиака
21
2+
Cu(NH3)4
+ 2e- = Cu + 4 NH3
O2 + 2H2O + 4e- = 4 ОH-
0 = -0,07 B
0 = 0,401 B
2 Сu + 8 NH3 + O2 + 2H2O + 4e- =
2+
= 2 Cu(NH3)4 + 4e- + 4 ОH2 Сu + 8 NH3 + O2 + 2H2O = 2 Cu(NH3)4(ОH)2
12. Cравнение растворимости в растворе NH3 Сu и Ag
2+Cu(NH3)4 + 2e+
Ag(NH3)2 + e-
= Cu + 4 NH3
= Ag + 2 NH3
2+
Cu(NH3)4
+
Ag(NH3)2
lg Kуст
12,03
7,24
0 = -0,07 B
0 = +0,37 B
более устойчивый
Ag растворяется в растворе NH3 труднее, чем Cu
13. 4. Растворение металлов в растворах, содержащих цианид-ионы
М(к)─ ne-
М(CN)m
n─
(р)
Для окисления металла
необходим окислитель
14. 4. Растворение металлов в растворах, содержащих цианид-ионы
41
─
e-
Au(CN)2 + = Au + 2 CN
O2 + 2H2O + 4e- = 4 ОH-
─
0 = -0,43 B
0 = 0,61 B
─
4 Au + 8CN + O2 + 2H2O + 4e- =
─
= 4 Au(CN)2 + 4e- + 4 ОH4 Au + 8 KCN + O2 + 2H2O = 4 K[Au(CN)2] + 4 KОH
15.
4 Au + 8 KCN + O2 + 2H2O = 4 K[Au(CN)2] + 4 KОHCпособ извлечения золота из породы –
способ П.Р. Багратиона (1843 г.)
Далее Au вытесняется из комплекса
цинковой пылью:
2 K[Au(CN)2] + Zn = 2 Au + K2[Zn(CN)4]
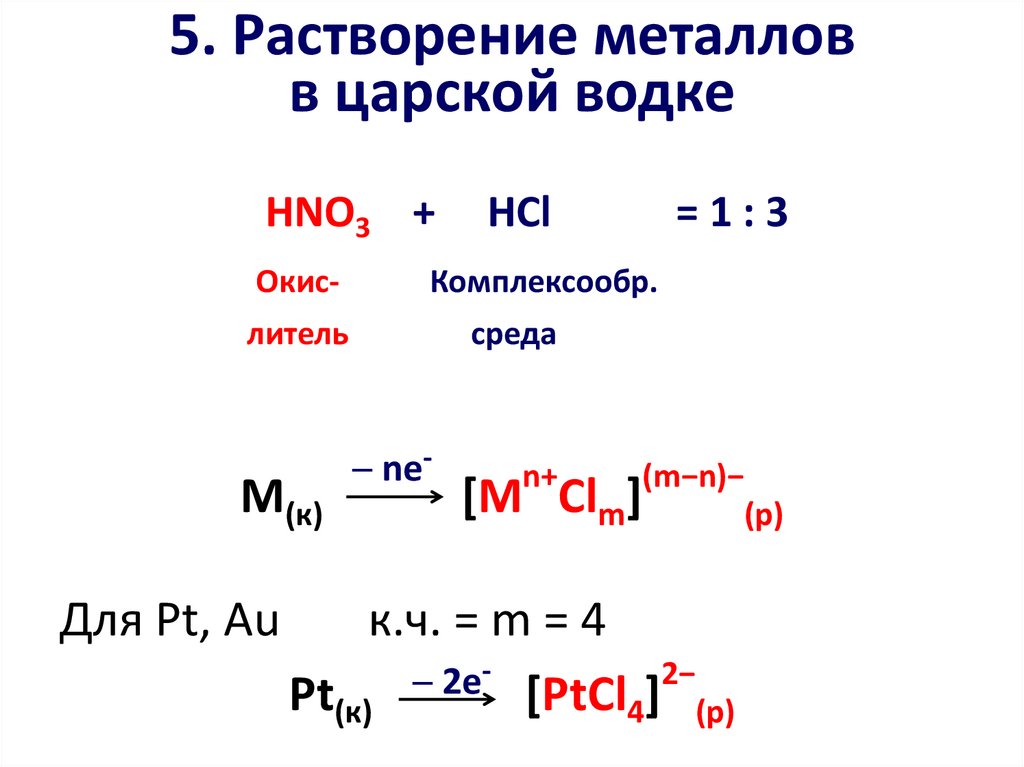
16. 5. Растворение металлов в царской водке
HNO3 +Окис-
Для Pt, Au
=1:3
Комплексообр.
литель
М(к)
HCl
среда
─ ne-
n+
(m−n)−
[М Clm]
к.ч. = m = 4
2−
─
2e
Pt(к)
[PtCl4] (р)
(р)
17. Pt(к) [PtCl4]2-(р)
5. Растворение металловв царской водке
─ 2e-
Pt(к)
3
2
2PtCl4
[PtCl4]
2-
─
+ 2e = Pt + 4 Cl 0 = 0,73 B
─
NO3 + 4H+ + 3e- = NO + 2H2O
─
(р)
0 = 0,957 B
─
3 Pt + 12 Cl + 2 NO3 + 8 H+ + 6e- =
2= 3 PtCl4 + 6e- + 2NO + 4H2O
3 Pt + 12 HCl + 2 HNO3 = 3 H2[PtCl4] + 2NO + 4H2O
18. Выводы
I. При составлении уравнений растворенияметаллов в различных средах нужно:
1. Определить вещество-окислитель и веществокомплексообразователь
2. Составить формулу предполагаемого
комплекса, образующегося при растворении
3. Выписать полуреакцию с участием этого комплекса
4. Выписать полуреакцию с участием окислителя
5. Сравнить потенциалы полуреакций
6. Записать суммарные ионное и молекулярное
уравнения
19.
ВыводыII. d-металлы элементов IV периода (кроме Cu)
растворяются
в HCl и разбавленной H2SO4
с образованием катионного аквакомплекса
Мn + 2HCl + 6 H2O → [Mn(OH2)6]Cl2 + H20
Мn + H2SO4 + 6 H2O → [Mn(OH2)6]SO4 + H20
20. Выводы
III. d-металлы элементов V и VI периодовв HCl и разбавленной H2SO4,
обычно не растворяются.
Они растворяются в смесях кислот
HNO3 + HCl , HNO3 + HF
c образованием анионных комплексов
d-элементов в высшей степени окисления
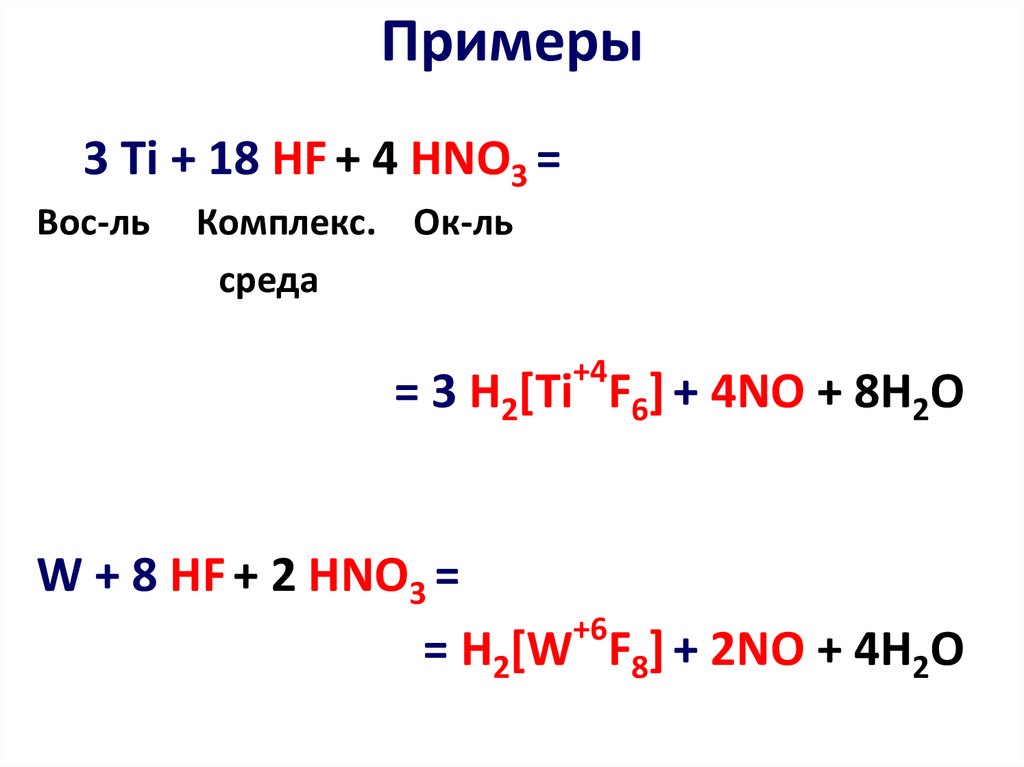
21. Примеры
3 Ti + 18 HF + 4 HNO3 =Вос-ль
Комплекс. Ок-ль
среда
+4
= 3 H2[Ti F6] + 4NO + 8H2O
W + 8 HF + 2 HNO3 =
+6
= H2[W F8] + 2NO + 4H2O








![Pt(к) [PtCl4]2-(р) Pt(к) [PtCl4]2-(р)](https://cf3.ppt-online.org/files3/slide/b/BXERGiFs0LPTbSOkzUtqYcQaelMoKZ1gu7hCyJ/slide-16.jpg)



 chemistry
chemistry








