Similar presentations:
Химические свойства металлов. Коррозия металлов
1. ОБЩАЯ ХИМИЯ
Омский государственный технический университетКафедра «Химия»
Новгородцева Л.В.
ОБЩАЯ ХИМИЯ
Химические свойства металлов.
Коррозия металлов.
Лекция
Мультимедийная слайд-лекция
©ОмГТУ, 2014
2. Распространение металлов в природе
3. МЕТАЛЛЫ В ПРИРОДЕ. КЛАРК.
Клаа́рковое числоа́ (или кларки элементов, ещё чаще говорятпросто кларк элемента) — числа, выражающие среднее
содержание химических элементов в земной
коре, гидросфере, Земле, космических
телах, геохимических или космохимических системах и др.,
по отношению к общей массе этой системы.
Выражается в % или г/кг.
Наиболее
распространены из
металлов в земной
коре
Алюминий
Al –
8,45 % (масс.)
Железо
Fe -
4,4 % (масс.)
Кальций
Ca -
3,3 % (масс.)
Натрий
Na -
2,6 % (масс.)
Магний
Mg -
2,1 % (масс.)
Титан
Ti -
0,61 % (масс.)
4. НАИБОЛЕЕ РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ МЕТАЛЛОВ В ПРИРОДЕ
Из природных соединений металлов наиболеераспространенными являются оксиды.
Fe2O3 - гематит; Fe3O4 – магнитный железняк, магнетит;
Cu2O - куприт; Al2O3 - корунд; TiO2 – рутил, анатаз, брукит;
MnO2 - пиролюзит; SnO2 – касситерит и др.
Широко распространены сульфиды малоактивных
металлов: NiS; CuS; ZnS; PbS; FeS2.
В виде галидов:- фторидов, хлоридов - встречаются щелочные и
щелочноземельные металлы.
В виде карбонатов – легкие металлы - Mg, Ca (CaCO3).
В виде сульфатов – активные металлы Na, Ca, Ba, Mg (Na2SO4).
Растворимые соли металлов встречаются в воде океанов, морей, озер.
5. Получение металлов
6. Добывание металлов из руд
Большинство металлов находятся в природе в видесоединений с другими элементами, в основном в виде руд.
В свободном состоянии (самородки)
встречаются золото и платина, а
серебро и медь – отчасти; иногда
попадается самородная ртуть
некоторые другие металлы.
Au и Pt добывают посредством
механического отделения от породы,
в которой они заключены (например
промывкой), или путем извлечения
их из породы различными реагентами
с последующим выделением из
раствора
7. ПИРОМЕТАЛЛУРГИЯ
Получение металлов из руд ихвосстановлением при высоких
температурах
Восстановители
Углерод (кокс)
PbO + C = Pb + CO
Оксид углерода
(II)
Fe2O3 + 3CO = 2Fe + 3CO2
Водород
MnO2 + 2H2 = Mn + 2H2O
гидротермия
Более активный
металл
(металлотермия)
Fe2O3 + 2Al = 2Fe + Al2O3
алюмотермия
TiCl4 + 2Mg = Ti + 2MgCl2
магниетермия
карботермия
8. ГИДРОМЕТАЛЛУРГИЯ
Растворение природногосоединения в виде водных
растворов с помощью различных
реагентов с последующим
выделением металла из
раствора. Процесс идет при
обычных температурах.
Восстановители – активные
металлы или электроны
Из руд золото извлекают с помощью цианида калия, а
затем восстанавливают порошкообразным цинком
2K[Au(CN)2] + Zn→ K2[Zn(CN)4] + 2Au
Металл получают в мелкораздробленном состоянии
9. ЭЛЕКТРОМЕТАЛЛУРГИЯ
Электрометаллургия – получение металлов из водныхрастворов или расплавов с помощью электрического тока
(электролизом)
Электролиз водных растворов: для получения малоактивных металлов
CuSO4 + H2O→ Cu0 + H2SO4 + O2
Катод (-): Cu2+ + 2e- → Cu0
Анод (+): 2H2O - 4e- → O2 + 4Н+
Электролиз расплавов: для
получения активных металлов
2NaClрасплав→ 2Na0 + Cl20
Катод (-): Na+ + 1e- → Na0
Анод (+): 2Cl- - 2e- → Cl20
10. ФЛОТАЦИОННЫЙ МЕТОД
Флотация – метод основанный наразличной смачиваемости поверхности
минерала водою.
Пример: руду, состоящую из сернистого металла и пустой
породы, измельчают, заливают водой, прибавляя малополярное
органическое вещество (для образования пены) и небольшое
количество реагента «коллектора», который адсорбируется
поверхностью минерала. Через смесь снизу пропускают струю
воздуха. В результате частицы минерала со слоем молекул
«коллектора» прилипают к пузырькам воздуха, а частицы пустой
породы, смоченные водой, опускаются на дно. Затем пену
собирают, отжимают и получают руду с большим содержанием
металла.
11. МАГНИТНЫЙ СПОСОБ
Магнитная сепарация применяется для обогащения руд, содержащихминералы с относительно высокой магнитной восприимчивостью. К ним
относятся магнетит, франклинит, ильменит и пирротин, а также
некоторые другие минералы железа, поверхности которых могут быть
приданы нужные свойства путем низкотемпературного обжига.
Сепарация производится как в водной,
так и в сухой среде. Сухая сепарация
больше подходит для крупных зерен,
мокрая — для тонкозернистых песков и
шламов. Обычный магнитный сепаратор
представляет собой устройство, в котором
слой руды толщиной в несколько зерен
перемещается непрерывно в магнитном
поле. Магнитные частицы вытягиваются
из потока зерен лентой и собираются для
дальнейшей переработки; немагнитные
частицы остаются в потоке.
12. Природа химической связи в металлах
13. ОБЩИЕ ФИЗИЧЕСКИЕ СВОЙСТВА
Высокая электропроводность, высокая теплопроводность,пластичность, т.е. способность подвергаться деформации при
обычных и повышенных температурах, не разрушаясь.
Благодаря этому свойству металлы
поддаются ковке, прокатке,
вытягиванию в проволку (волочению),
штамповке.
Металлам присущи
также металлический
блеск, обусловленный
их способностью
хорошо отражать свет.
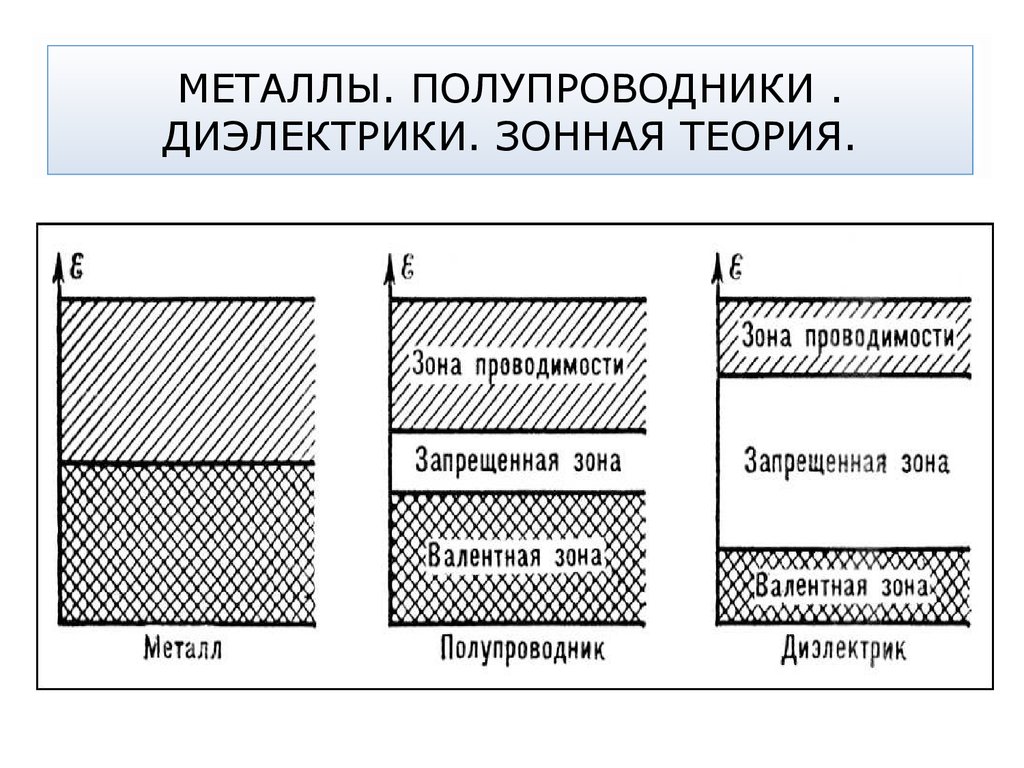
14. МЕТАЛЛЫ. ПОЛУПРОВОДНИКИ . ДИЭЛЕКТРИКИ. ЗОННАЯ ТЕОРИЯ.
15. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
Способность электронов свободно передвигаться по кристаллуи переносить энергию из одной ее части в другую служит
причиной высокой тепло- и электропроводимости металлов
Валентные электроны, осуществляющие химическую связь,
принадлежат не двум или нескольким определенным атомам,
а всему кристаллу металла. При этом валентные электроны
способны свободно перемещаться в объеме кристалла.
Образованную таким образом
химическую связь называют
металлической связью.
Совокупность «свободных»
электронов в металле электронным газом
16. Химические свойства металлов
17. Стандартный водородный электрод
Для построения численной шкалы электродныхпотенциалов нужно потенциал какого-либо электродного
процесса принять равным нулю. В качестве эталона для
создания такой шкалы принят электродный процесс:
2Н+ +2е- = Н2
Водородный электрод
Платиновая пластина,
электролитически покрытая
губчатой платиной и погруженная
в 1М раствор серной кислоты,
через который барботируется
газообразный водород по
давлением 1 атмосфера.
На поверхности соприкосновения
платины с раствором кислоты
устанавливается равновесный
процесс:
2Н+ +2е- ⇆ Н2
18. ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ
Потенциал водородного электрода воспроизводится с очень высокойточностью. Поэтому водородный электрод и принят в качестве
эталона при создании шкалы электродных потенциалов.
Для определения потенциала того
или иного электродного процесса
нужно составить гальванический
элемент
из
испытуемого
и
стандартного
водородного
электрода и измерить его ЭДС.
Поскольку потенциал стандартного
водородного электрода равен нулю,
то
измерение
ЭДС
будет
представлять
собою
потенциал
электродного процесса.
Таким образом получают электрохимический ряд напряжения
металлов. Т.к. измерения проводят относительно водородного
электрода этот ряд называют водородной шкалой.
19. ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА. ЭНЕРГИЯ ИОНИЗАЦИИ
Ослабление восстановительных свойств, активностиЭтот ряд называется электрохимическим рядом напряжения
металлов. Энергия ионизации, определяется положением
металла в периодической системе. В электрохимическом
ряду напряжения металл, стоящий левее, может вытеснять
из растворов или расплавов солей металл, стоящий правее.
20. АКТИВНОСТЬ МЕТАЛЛОВ В СООТВЕТСТВИИ С РЯДОМ НАПРЯЖЕНИЯ МЕТАЛЛОВ
Пользуясь этим рядом, можно предсказать, как металл будетсебя вести в паре с другим.
В электрохимический ряд напряжения включен также
водород. Это позволяет сделать заключение о том, какие
металлы могут вытеснить водород из растворов кислот.
Так, например, железо вытесняет водород из растворов
кислот, так как находится левее его;
медь же не вытесняет водород, так как находится правее
его в ряду напряжения металлов.
21. АКТИВНОСТЬ МЕТАЛЛОВ В СООТВЕТСТВИИ С РЯДОМ НАПРЯЖЕНИЯ МЕТАЛЛОВ
Li, K, Ba, Na, La, Mg, Lu, Be, Sc, Ti, Hf, Al, Zr, V, Mn, Cr, Zn, Fe, Cd,Co, Mo, Sn, W, Pb, H
Ge, Sb, Bi, Cu, Re, Ag, Pd, Hg, Pt, Au.
Все металлы можно разделить на группы:
активные металлы стоят в ряду активности перед Cd;
средней активности – находятся в ряду от Cd до Н;
малоактивные металлы стоят в ряду активности после Н.
22. ОБЩИЕ ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Химические свойства металлов определяются:строением их атомов,
типом кристаллической решетки.
Главное и наиболее общее свойство металлов – хорошие
восстановители, т.е. легко отдают электроны:
Ме0 - ne-→ Меn+
На основании ряда стандартных электродных потенциалов
можно сделать вывод о химической активности металлов
С солями более активный металл (стоящий левее в ряду
напряжения металлов) вытесняет менее активный из его
соли: Zn + CuCl2 → ZnCl2 + Cu
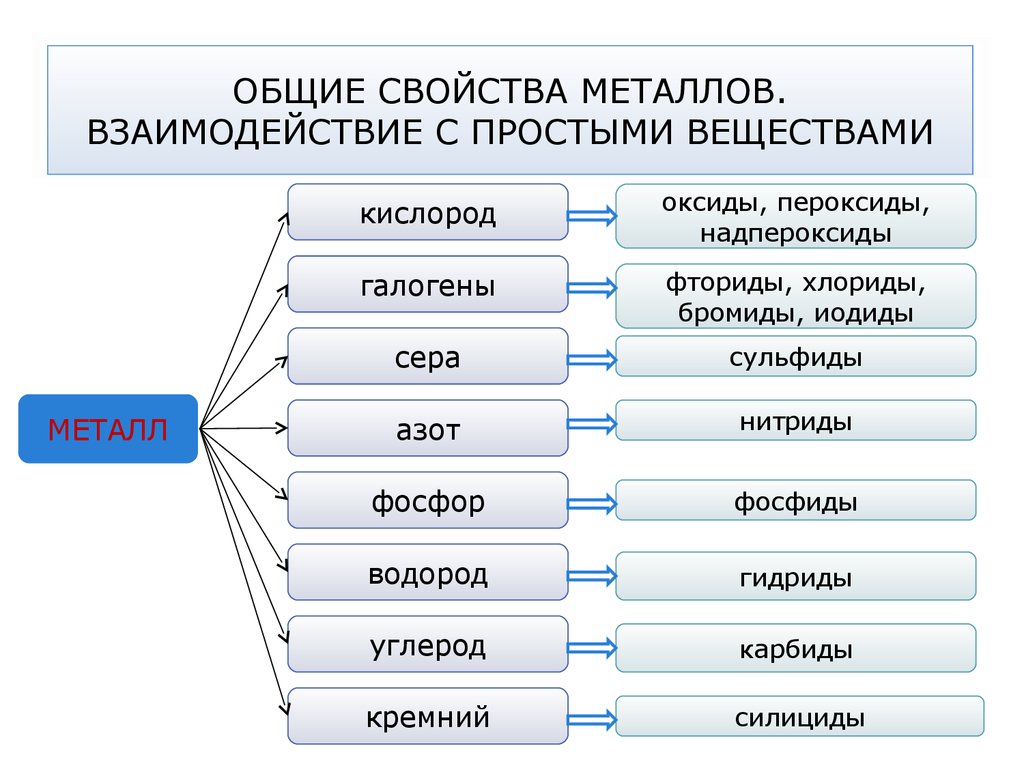
23. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
МЕТАЛЛкислород
оксиды, пероксиды,
надпероксиды
галогены
фториды, хлориды,
бромиды, иодиды
сера
сульфиды
азот
нитриды
фосфор
фосфиды
водород
гидриды
углерод
карбиды
кремний
силициды
24. Взаимодействие металлов с водой
25. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ С ТЕРМОДИНАМИЧЕСКОЙ ТОЧКИ ЗРЕНИЯ
Взаимодействие металлов с водой идет по реакции:Ме0 + Н2О = МеОН + 1/2 H2↑
Восстановитель: Ме0 - ne-→ Меn+
Ϥ0Red
Окислитель:
2H+ + 2e- → H2
Ϥ0Ох
Е= Ϥ0Ох - Ϥ0Red > 0
Ϥ0Ох > Ϥ0Red
Стандартный электродный потенциал ионов водорода в воде
(рН = 7):
Ϥ0Ох = -0,59.рН = -0,41 В
Поэтому условие восстановления металла водой можно
записать в виде:
Ϥ0Red < -0,41 В
Т.е. с водой, вытесняя из нее водород, взаимодействуют все
металлы, стоящие до Сd, стандартный электродный
потенциал которых ниже -0,41 В.
26. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ
Активные металлы (металлы от начала ряда активности до Mg) сводой дают гидроксиды и водород:
2Na + 2H2O = 2NaOH + H2↑
Металлы средней активности (от Mg до Н2) дают оксиды и
водород (при нагревании):
С горячей водой реагируют металлы стоящие в ряду от Mg до Cd:
Mg + 2H2O = Mg(OH)2 + H2↑
3Fe + 4H2O = Fe3O4 + 4H2↑
Температура реакции t = 100 °С
Температура реакции t = 700 °С
Некоторые из металлов, расположенные
между Mg и Cd, например, Zn, Al покрыты защитными окисными
плёнками (ZnO, Al2O3) и не растворяются в воде, т.е. металл не
активен (пассивен). Явление называется пассивацией металла.
Неактивные металлы с водой не реагируют.
27. Взаимодействие металлов с кислотами
28. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ
Разбавленные кислоты являются окислителями за счетводорода
Восстановитель: Ме0 - ne-→ Меn+
Ϥ0Red
Окислитель:
2H+ + 2e- → H2
Ϥ0Ох = Ϥ0 2H+/H2 = 0
Е= Ϥ0Ох - Ϥ0Red > 0
Ϥ0Ох > Ϥ0Red
Ϥ0Red < 0 В
Mg0 + 2HСl → МgCl2 + H2↑
Металлы , находящиеся в ряду напряжения металлов до
водорода вытесняют его из кислот (исключения:
концентрированная серная кислота, азотная кислота любой
концентрации).
29. ПАССИВАЦИЯ МЕТАЛЛОВ КИСЛОТАМИ
Иногда образуются нерастворимые или малорастворимыепродукты, которые тормозят реакцию.
Например, свинец Pb не растворяется в разбавленной серной
кислоте и соляной, т.к. образуются PbSO4 и PbCl2, которые не
растворяются в воде и тормозят окисление.
Pb + 2HCl = PbCl2 + H2↑
Эффект пассивации из-за образования защитной пленки на
поверхности, приводящий к замедлению реакции,
наблюдаются у некоторых других металлов.
Чаще всего продукты образуются при взаимодействии со
следующими кислотами: H3PO4, H2SO3, H2CO3, HCN, HF.
30. ТАБЛИЦА РАСТВОРИМОСТИ
31. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТОЙ
В концентрированной серной кислоте в роли окислителявыступает сера в степени окисления +6, входящая в
состав сульфат-иона SO42-.
Концентрированная серная кислота окисляет все
металлы, стандартный электродный потенциал которых
меньше 0,36 В, максимального значения электродного
потенциала в электродных процессах с участием сульфатиона SO42-.
Концентрированная серная кислота восстанавливается до
следующих продуктов
H2S+6O4 (к) → S+4O2 → S0 → H2S2-
32. ВЛИЯНИЕ АКТИВНОСТИ МЕТАЛЛОВ ПРИ ВЗАИМОДЕЙСТВИИ С КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТОЙ
Активные металлы реагируют с кислотой, восстанавливая еедо сероводорода
5H2S6+O4(k) + 4Zn = 4ZnSO4 + H2S↑ +4H2O
Малоактивные металлы реагируют с кислотой, восстанавливая
ее до SO2
2H2S6+O4(k) + Cu0 = CuSO4 + SO2 + 2H2O
Концентрированная серная кислота пассивирует металлы
средней активности : Fe, Be, Cr, Co, Al. На поверхности
металла образуются плотные пленки оксида:
3H2SO4(k) +2Fe = Fe2O3 + 3H2O +3SO2
Металлы Re, Mo, Tc, Ti, V взаимодействуют в соответствии с
уравнением
2V +5H2SO4(k) =2HVO3+5SO2↑ + 4H2O
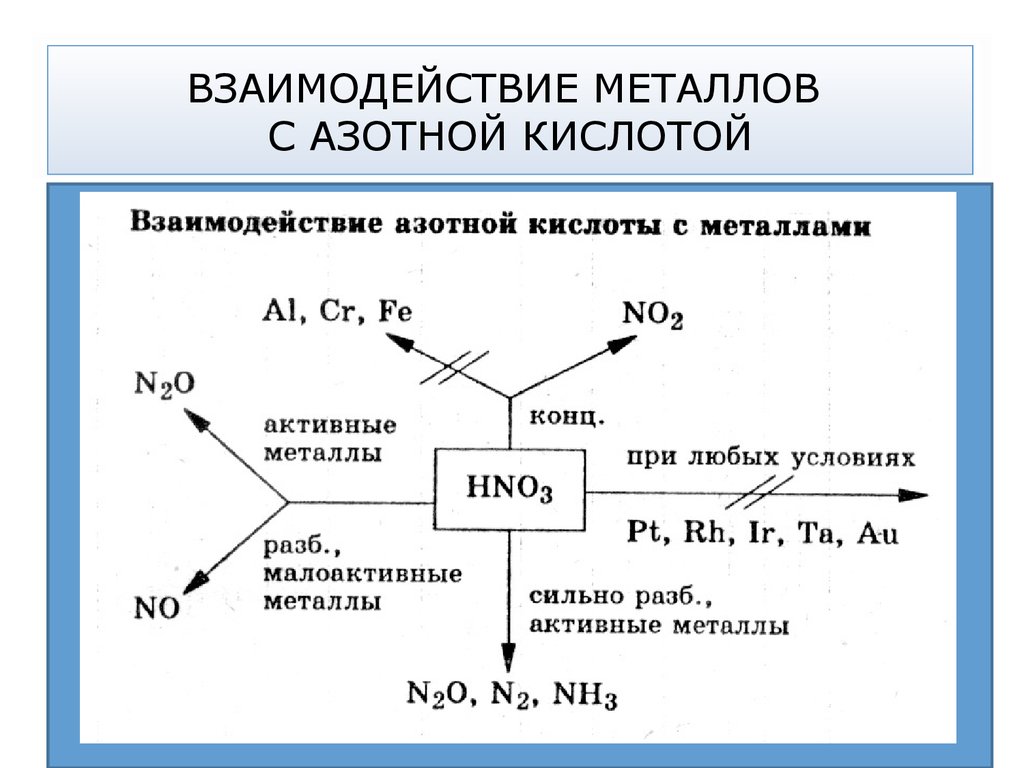
33. ОКИСЛИТЕЛЬНАЯ СПОСОБНОСТЬ АЗОТНОЙ КИСЛОТЫ
Кислотный остаток азотной кислоты (любой концентрации)обладает высокой окислительной способностью.
В азотной кислоте в роли окислителя выступает азот в
степени окисления +5.
Восстанавливается кислота до следующих продуктов:
HN5+O3 → N4+O2 → N2+O → N+2O → N20 → N3-H3
Степень восстановления растет
Чем более концентрированная кислота тем более глубоко
она восстанавливается.
Характер продуктов реакции зависит как от концентрации
кислоты, так и от активности металла
34. ТЯЖЕЛЫЕ МЕТАЛЛЫ
Известнооколо
сорока
различных
определений
термина тяжелые металлы, и невозможно указать на одно из
них, как наиболее принятое.
Используемым критерием может быть атомный вес свыше
50,
к тяжелым металлам относят более 40 металлов
периодической системы Д.И. Менделеева: V, Cr, Mn, Fe, Co,
Ni, Cu, Zn, Mo, Cd, Sn, Hg, Pb, Bi и др.
Другим часто используемым критерием является плотность,
примерно равная или большая плотности железа (8 г/см3),
классификация Н. Реймерса: Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn,
Bi, Hg.
Существуют классификации, основанные и на других
значениях пороговой плотности или атомного веса. Некоторые
классификации делают исключения для благородных и
редких металлов, не относя их к тяжелым, некоторые
исключают нецветные металлы (железо, марганец).
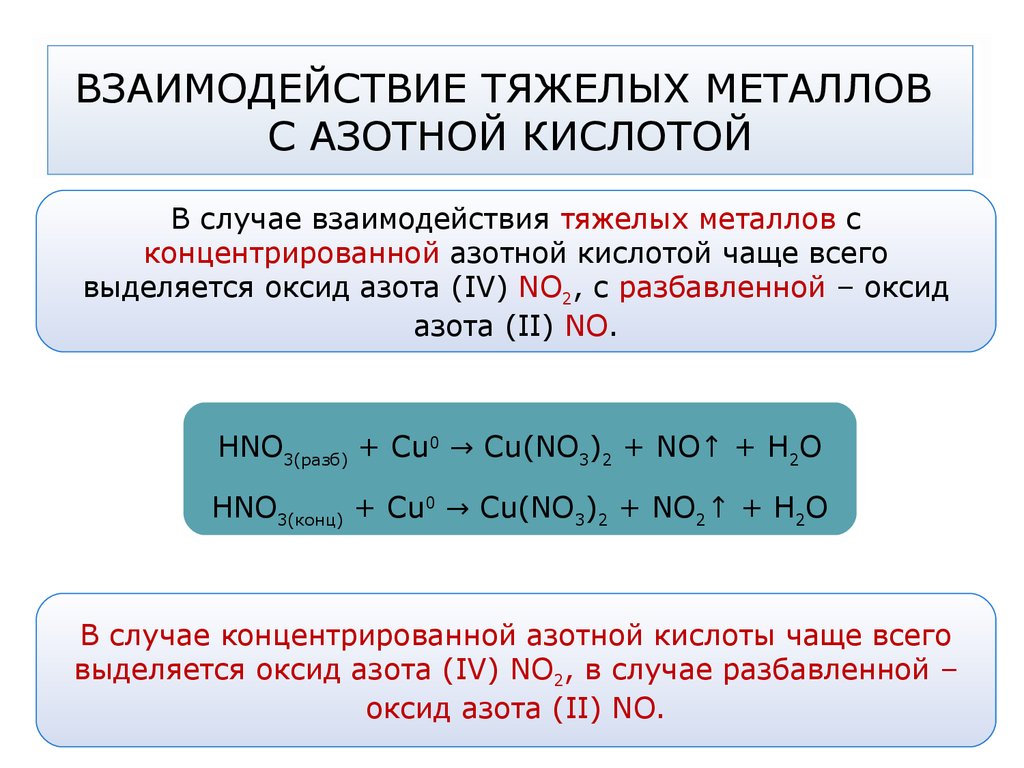
35. ВЗАИМОДЕЙСТВИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ С АЗОТНОЙ КИСЛОТОЙ
В случае взаимодействия тяжелых металлов сконцентрированной азотной кислотой чаще всего
выделяется оксид азота (IV) NO2, с разбавленной – оксид
азота (II) NO.
HNO3(разб) + Cu0 → Cu(NO3)2 + NO↑ + H2O
HNO3(конц) + Cu0 → Cu(NO3)2 + NO2↑ + H2O
В случае концентрированной азотной кислоты чаще всего
выделяется оксид азота (IV) NO2, в случае разбавленной –
оксид азота (II) NO.
36. ВЗАИМОДЕЙСТВИЕ ЩЕЛОЧНЫХ И ЩЕЛОЧНО-ЗЕМЕЛЬНЫХ МЕТАЛЛОВ С АЗОТНОЙ КИСЛОТОЙ
Концентрированная азотная кислота при взаимодействии сщелочными (элементы 1 группы главной подгруппы: Li, Na,
K, Rb, Cs, Fr) и щелочно-земельными металлами (элементы 2
группы главной подгруппы (кроме Be, Mg): Ca, Sr, Ba, Ra)
восстанавливается до оксида азота (I) N2O
HNO3(конц) + Ca0 → Ca+2(NO3)2 + N+2O↑ + H2O
HNO3(разб) + Ca0 → N-3H4NO3 + Ca(NO3)2+ H2O
Разбавленная азотная кислота при взаимодействии с
щелочными, щелочно-земельными металлами, Zn, Fe
восстанавливается до нитрата аммония NH4NO3.
37. ВЛИЯНИЕ СТЕПЕНИ ОКИСЛЕНИЯ МЕТАЛЛА. ПАССИВАЦИЯ
В зависимости от химической природы металла отмечены следующиезакономерности:
металлы, у которых устойчива низкая степень окисления,
образуют соответствующие ионы:
Mg0 + HNO3 (разб) → Mg(NO3)2 + NO↑ + H2O
металлы (W, Ti, V, Re, Tc ), для которых наиболее характерна
высокая степень
кислоты:
окисления,
образуются
кислородсодержащие
W0 + 2HNO3 (разб) → H2WO4 + NO↑
W0 + 6HNO3 (конц) → H2WO4 + 6NO2↑ + 2H2O
3Tc + 7HNO3 (разб) → 3HTcO4 +7NO ↑ + 2H2O
Азотная кислота любой концентрации пассивирует
металлы: Fe, Cr, Al, Be, Bi, Ni на холоде.
38. ВЗАИМОДЕЙСТВИЕ СО СМЕСЯМИ КИСЛОТ
Окислительная способность азотной кислоты усиливаетсядобавлением к ней фтороводородной
или хлороводородной кислот.
Эти смеси растворяют самые малоактивные металлы.
21HF + 5HN+5O3 + Ta → 3H2[Ta+5F7]-2 + 5NO ↑ + 10H2O
«Царская водка» - смесь
концентрированных кислот HNO3
и HCl в соотношении 1:3.
Представляет из себя жидкость
желтого цвета с запахом хлора и
оксидов азота.
39. ВЗАИМОДЕЙСТВИЕ СО СМЕСЯМИ КИСЛОТ
«Царская водка» растворяет золото и платину. Действие ееобъясняется тем, что азотная кислота окисляет соляную
с
выделением свободного хлора и образованием хлористого
нитрозила N+3OCl:
HN+5O3 + 3HCl = Cl2↑ + N+3OCl + 2H2O
Хлористый нитрозил является промежуточным продуктом реакции и
разлагается:
2N+3OCl = 2NO ↑ + Cl2 ↑
Хлор в момент выделения состоит из атомов, что и обусловливает
высокую окислительную способность царской водки.
Au+ HN+5O3 + 3HCl →AuCl3 + NO ↑ + 2H2O
3Pt+ 4HN+5O3 + 12HCl →3PtCl3 + 4NO ↑ + 8H2O
С избытком HCl хлорид золота (III) и хлорид платины (IV)
образуют комплексные соединения H[AuCl4] и H2[AuCl6]
Au+ HN+5O3 + 4HCl → H[AuCl4] + NO ↑ + 2H2O
40. Взаимодействие металлов с водными растворами щелочей
41. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДНЫМИ РАСТВОРАМИ ЩЕЛОЧЕЙ
С растворами щелочей взаимодействуют металлысклонные к образованию анионных комплексов, т.е. те
металлы, у которых оксиды и гидроксиды имеют
амфотерный характер:
Это амфотерные металлы – Zn, Al, Be, Ga, Sn, Pb.
Механизм протекания реакции (окисление идет
за счет молекул воды):
Zn +2 H2O = Zn(OH)2↓ + H2↑
Zn(OH)2↓ +2 NaOH = Na2[Zn+2(OH)4]-2.
42. УСТОЙЧИВОСТЬ АНИОННЫХ КОМПЛЕКСОВ
Чем устойчивее комплексные анионы типа [Э(ОН)n]x-,тем легче идет реакция. Замечено, что такие анионы
наиболее
устойчивы
у
таких
металлов
как
цинк,
алюминий, бериллий, поэтому они легко растворяются
в водных растворах щелочей. Для железа, кобальта,
титана,
марганца
комплексы
медленно.
не
и
ряда
устойчивы
других
и
металлов
взаимодействие
такие
идет
43. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВЫСОКИМИ СТЕПЕНЯМИ ОКИСЛЕНИЯ С ВОДНЫМИ РАСТВОРАМИ ЩЕЛОЧЕЙ
Взаимодействуют со щелочами и некоторые d-элементы,которые в присутствии окислителей образуют соединения с
высокими степенями окисления. Ванадий, вольфрам, хром,
например,
в
расплавленных
щелочах
окисляются
кислородом в ванадаты – Me3VO4, в вольфраматы – Me2WO4
и в хроматы – Me2СrO4, соответственно:
2W + 4NaOH + 3O2 = 2Na2WO4 + 2 H2O
44. РАСТВОРЕНИЕ АЛЮМИНИЯ В ВОДНОМ РАСТВОРЕ ЩЕЛОЧИ
Алюминий с водой не взаимодействует, хотя является активнымметаллом. Причиной инертности алюминия является образование
на его поверхности под действием кислорода воздуха в обычных
условиях оксидной пленки Al2O3, обладающей очень сильным
защитным действием. Добавленная щелочь растворяет оксидную
пленку с образованием гидроксоалюмината и создает возможность
непосредственного взаимодействия алюминия с водой.
Реакция идет по схеме:
1.Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
2. 2Al + 6H2O → 2Al(OH)3 + 3H2 ↑
3. Al(OH)3 + NaOH → Na[Al(OH)4]
45. Коррозия металлов
46. КОРРОЗИЯ МЕТАЛЛОВ.
Коррозия – этосамопроизвольно
протекающий
процесс разрушения
металла в
результате
взаимодействия с
окружающей средой.
47. МАТЕРИАЛЬНЫЕ ПОТЕРИ.
Материальные потери прикоррозии:
Разрушение трубопроводов,
металлических частей машин,
корпусов судов, морских
сооружений (более 10 %
ежегодной выплавки металлов
теряется из-за коррозии).
Стоимость потерянного
продукта через
прокорродированную систему
труб.
Простои предприятий на
период замены
металлических конструкций
подвергшихся коррозии.
48. МЕХАНИЗМ ПРОЦЕССА КОРРОЗИИ.
Процесс идет с выделением энергии и рассеивания вещества(энтропия системы возрастает ∆S > 0).
Получение металлов в чистом виде всегда сопровождается
затратой энергии.
Эта энергия накапливается в них как свободная энергия
Гиббса, и делает их химически активными веществами.
Металлургический процесс:
_
Коррозионный процесс:
_
Меn+ + ne → Me0
Me0 - ne → Меn+
∆G0х.р. >0
∆G0х.р. < 0
(идет с затратой энергии)
(самопроизвольный процесс)
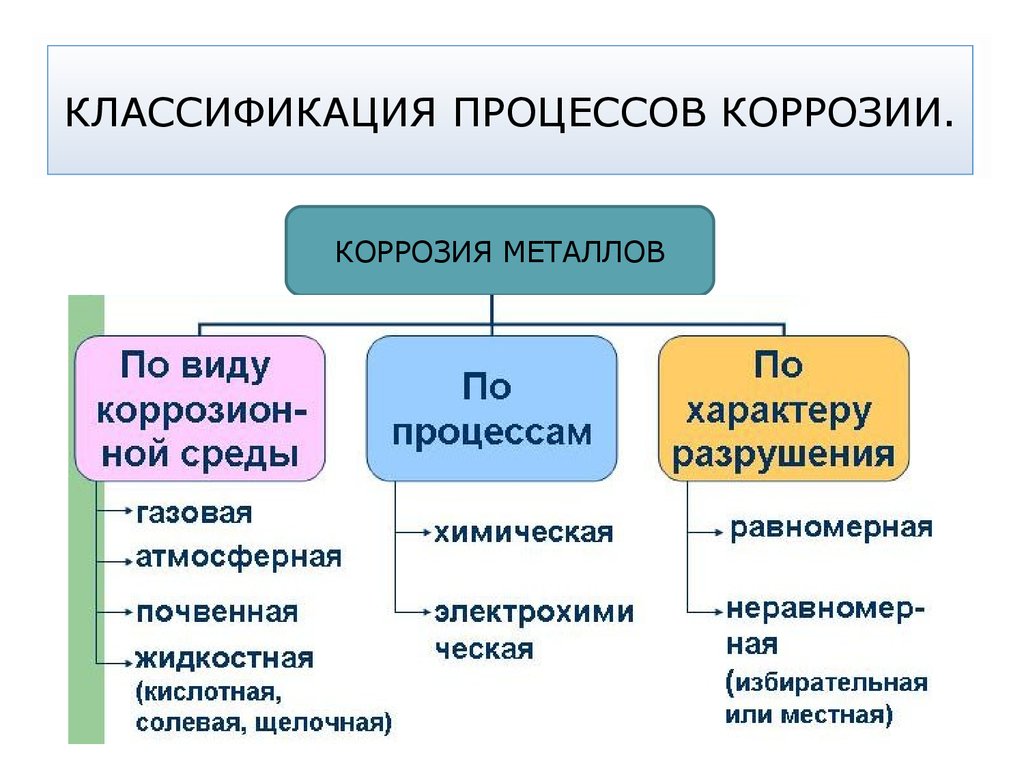
49. КЛАССИФИКАЦИЯ ПРОЦЕССОВ КОРРОЗИИ.
КОРРОЗИЯ МЕТАЛЛОВ50. Химическая коррозия металлов
51. СУЩНОСТЬ ХИМИЧЕСКОЙ КОРРОЗИИ.
Химическая коррозия характерна для сред, не проводящихэлектрический ток.
Сущность процесса химической коррозии сводится к
окислительно-восстановительным
реакциям,
причем
наблюдается непосредственный переход электронов металла
на окислитель.
Она представляет собой самопроизвольное разрушение
металлов в среде окислительного газа (O2, SO2, H2S,
галогены) или в жидких неэлектролитах (органические
жидкости – сернистая нефть).
52. ХИМИЧЕСКАЯ КОРРОЗИЯ В ГАЗОВОЙ СРЕДЕ
В общем виде для газовой коррозии:1.2Ме0 (т) + О2 (г) ⇄ 2 Ме+2О (т)
Образование оксида на поверхности металла в
результате взаимодействия с кислородом воздуха.
2. МеО (т) → [МеО] (р)
Растворение оксидной пленки в самом металле,
равновесие будет сдвинуто вправо, т.к. оксиды большинства
металлов способны растворяться в металле и уходить из
системы равновесия.
Механизм такой коррозии сводится к диффузии ионов
металла сквозь пленку продуктов коррозии с одной стороны,
и с другой стороны встречной диффузии атомов кислорода
вглубь пленки.
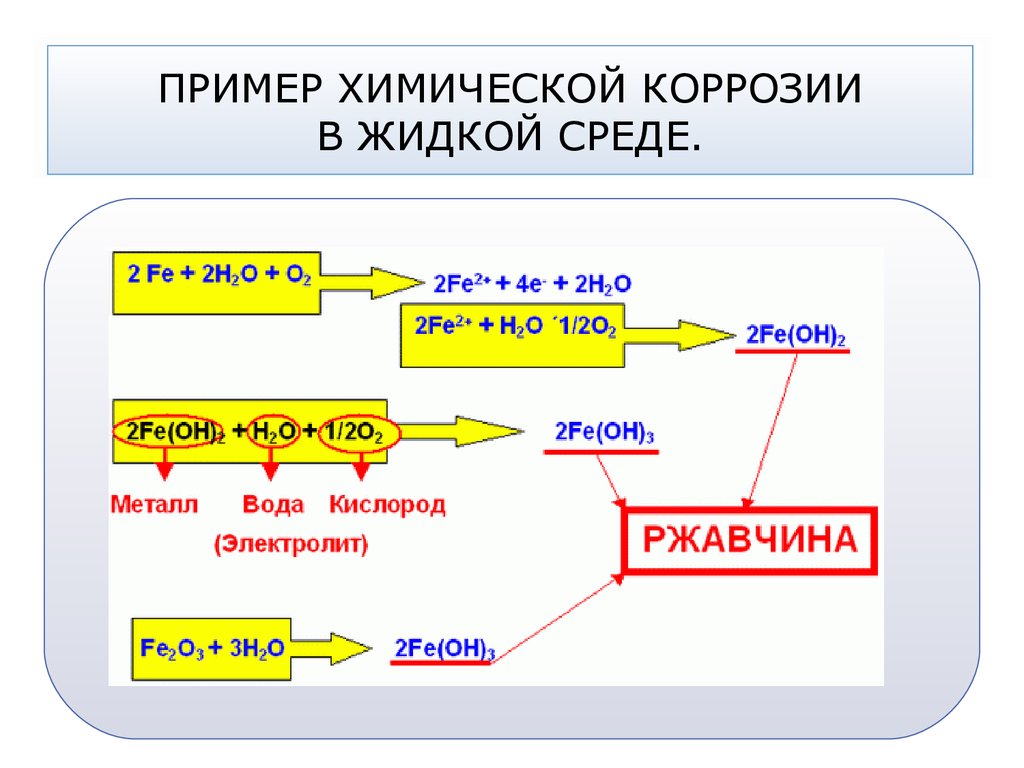
53. ПРИМЕР ХИМИЧЕСКОЙ КОРРОЗИИ В ЖИДКОЙ СРЕДЕ.
54. СКОРОСТЬ ОКИСЛЕНИЯ
Определяется свойствами оксидной пленки наповерхности металла:
сплошность пленки;
диффузионная способность пленки;
строение оксидной пленки.
Сплошность пленки ( ) оценивается отношением объема
образовавшегося оксида к объему металла,
израсходованного на образование этого оксида (фактор
Пиллинга-Бэдвордса)
Значения для
металлов приведены в справочниках.
55. СПЛОШНОСТЬ ПЛЕНКИ
Если< 1, то образующаяся пленка не сплошная. Толщина
оксидной пленки растет пропорционально времени окисления.
С повышением температуры процесс коррозии резко
ускоряется из-за плохого отвода тепла, идет разогрев металла
и скорость реакции возрастает.
Если
= 1,2 – 1,6, то образующаяся оксидная пленка
сплошная. Такая пленка тормозит диффузию окислителя. И по
мере утолщения пленки ее дальнейший рост все время будет
замедляться. Сплошные пленки образуются на поверхности
таких металлов как Со, Ni, Mn, Ti.
При
> 1,6 оксидные пленки
также не сплошные и легко
отделяются
от
поверхности
металла (железная окалина)
56. ВОРОНЕНИЕ СТАЛИ
Воронеа́ниестали (оксидирование, чернение,
синение) —
процесс
получения
на
поверхности
углеродистой
или
низколегированной стали или чугуна слоя
окислов
железа толщиной 1-10 мкм. От толщины этого слоя зависит его
цвет — так называемые цвета побежалости, сменяющие друг
друга по мере роста плёнки (жёлтый, бурый, вишнёвый,
фиолетовый, синий, серый).
Структура покрытия мелкокристаллическая,
микропористая. Для придания блеска, а также
улучшения защитных свойств окисной плёнки
её также пропитывают маслом (минеральным
или растительным).
Сейчас воронение применяется
преимущественно в качестве декоративной
отделки, а раньше — в основном — для
уменьшения коррозии металла.
57. ВЛИЯНИЕ СТРОЕНИЯ ОКСИДНОЙ ПЛЕНКИ НА СКОРОСТЬ КОРРОЗИИ
Для металлов с переменной степенью окисления строениепленки по толщине будет различное, так, например, при
воронении стали образуются следующие оксидные слои:
Fe|диффузный слой|FeO|диффузный слой|Fe3O4
Такое строение оксидной пленки
обеспечивает прочную связь
оксидного слоя с поверхностью
металла.
Экспериментально доказано, что
оксидные пленки со структурой
шпинели RO.R2O3 (FeO.Cr2O3 или
NiO.Cr2O3) служат надежной
защитой от коррозии.
58. КОЛИЧЕСТВЕННАЯ ОЦЕНКА СКОРОСТИ КОРРОЗИИ
Количественно скорость любого вида коррозии измеряется вединицах массы потерянного металла (∆m) с единицы
площади (S) в единицу времени (t):
Скорость коррозии может измеряться и толщиной слоя
потерянного металла за единицу времени.
Для определения скорости коррозии используют весовые,
объемные и физические методы.
59. АГРЕССИВНЫЕ СРЕДЫ И УСТОЙЧИВОСТЬ РАЗЛИЧНЫХ МЕТАЛЛОВ
Кроме кислорода сильным агрессивным свойством обладаюти другие газы. Наиболее активными являются фтор (F),
диоксид серы (SO2), хлор (Cl2), сероводород (Н2S). Их
агрессивность по отношению к металлам, а следовательно и
скорость коррозий, не одинакова.
Например, алюминий и его сплавы,
хром и стали с высоким содержанием
хрома, неустойчивы в атмосфере,
содержащей
хлор,
хотя
по
отношению
к
кислороду
они
устойчивы.
Никель не устойчив в атмосфере
диоксида серы (SO2), а медь вполне
устойчива.
60. Электрохимическая коррозия металлов
61. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Электрохимическая коррозия характерна для сред, имеющихионную проводимость, т.е. для электролитов
В этом случае реакция взаимодействия металла с
окислителем протекает в несколько стадий:
1. Анодное
окисление
металла.
Металл в виде ионов переходит в
раствор,
а
эквивалентное
количество электронов остается в
_
металле: Me0 - ne → Меn+
2. Катодный процесс – ассимиляция
(удерживание)
избыточных
электронов в металле.
3. Движение ионов в растворе.
62. УСЛОВИЯ, СПОСОБСТВУЮЩИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Положение металла в ряду активности металлов: чемдальше расположены друг от друга, тем быстрее
происходит коррозия.
Чистота металла: примеси ускоряют коррозию.
Неровности поверхности металла, трещины.
Грунтовые воды, морская вода, раствор электролита
(ионы: Н+, Сl-, Br-, I-, для амфотерных металлов ОН-).
Повышение температуры.
Действие
микроорганизмов
(грибов,
бактерий,
лишайников): воздействуют на металлы с высокой
коррозионной устойчивостью.
63. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ. АНОДНЫЙ ПРОЦЕСС.
Механизмэлектрохимической
коррозии
определяется
разностью потенциалов катодных и анодных участков и
сводится к работе газового гальванического элемента.
Основным отличием процессов электрохимической коррозии
от процессов гальваническом элементе является отсутствие
внешней цепи. Электроны в этом случае не выходят из
корродирующего металла, а движутся внутри металла.
Так как, любой металл всегда содержит примеси других
металлов, то на его поверхности в среде электролита
образуется много короткозамкнутых микрогальванических
элементов.
Анодом в них будет основной металл, который окисляется по
_
реакции: Me0 - ne → Меn+
64. КАТОДНЫЙ ПРОЦЕСС ДЕПОЛЯРИЗАЦИИ.
Катодный процесс, чаще всего, идет с кислородной иливодородной деполяризацией.
Деполяризатор – это вещество удерживающее электроны.
Кислородная деполяризация происходит с участием
растворенного кислорода, который является
деполяризатором:
при
: О2 + 2Н2О + 4е- → 4ОНпри
: О2 + 2Н+ + 4е- → 2Н2О
Водородная деполяризация происходит с участием катионов
водорода среды (деполяризатор – водород):
при
: 2Н+ + 2е- → Н20
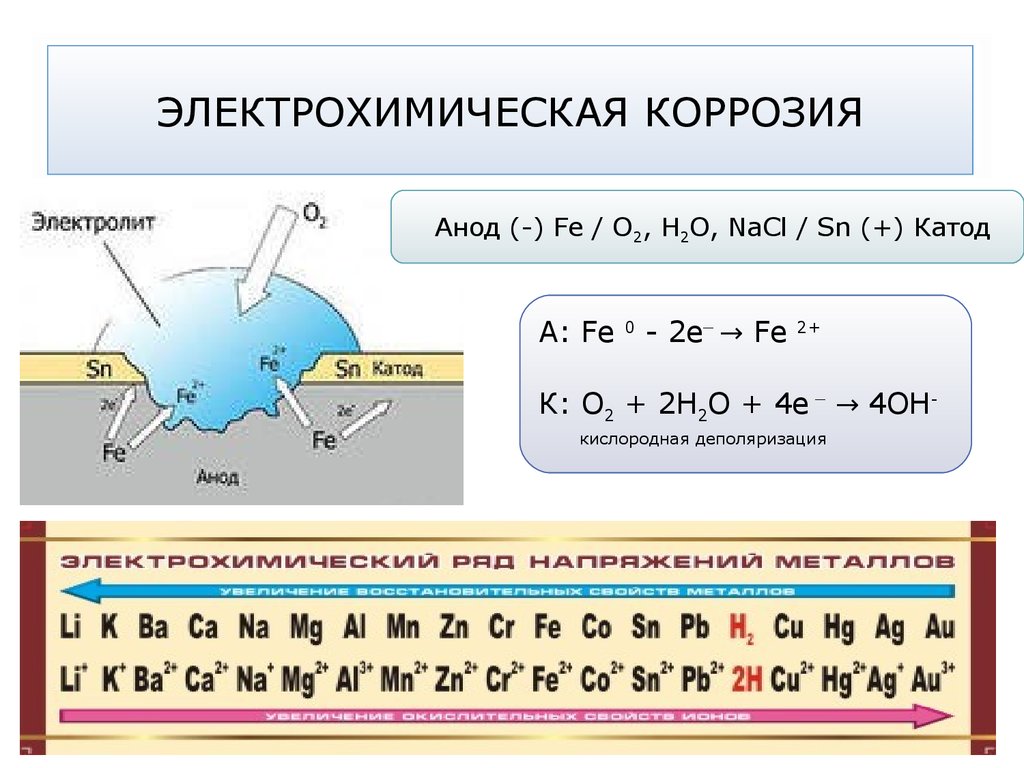
65. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Анод (-) Fe / О2, Н2О, NaCl / Sn (+) КатодA: Fe
0
_
- 2e → Fe
2+
_
К: О2 + 2Н2О + 4е → 4ОНкислородная деполяризация
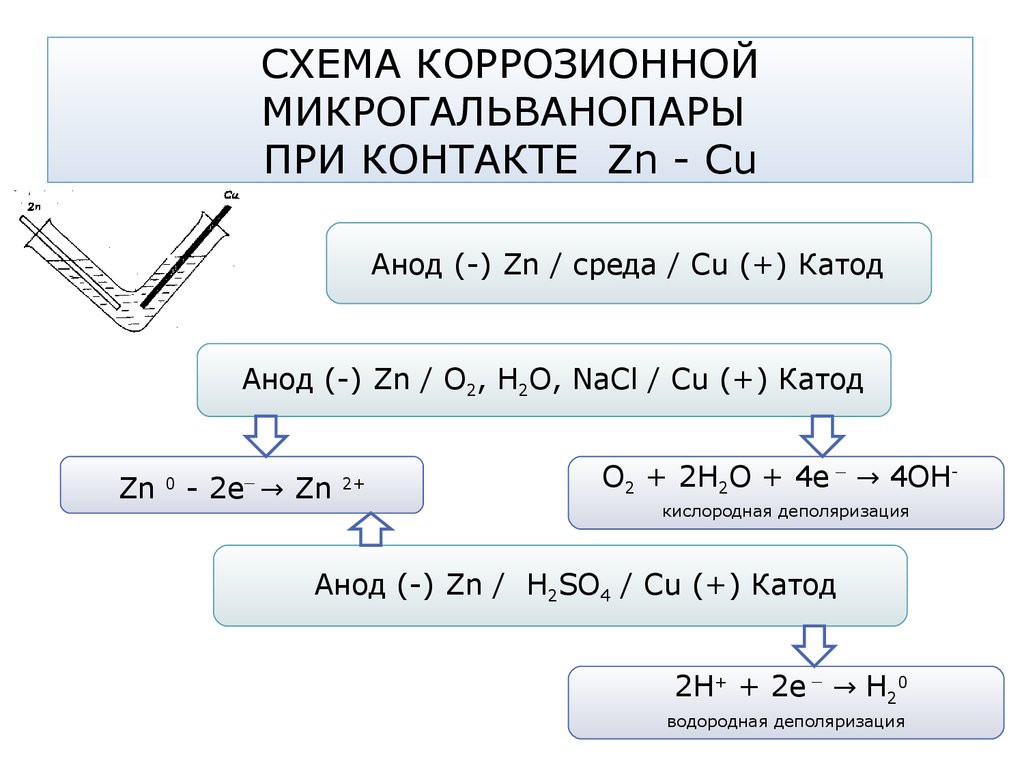
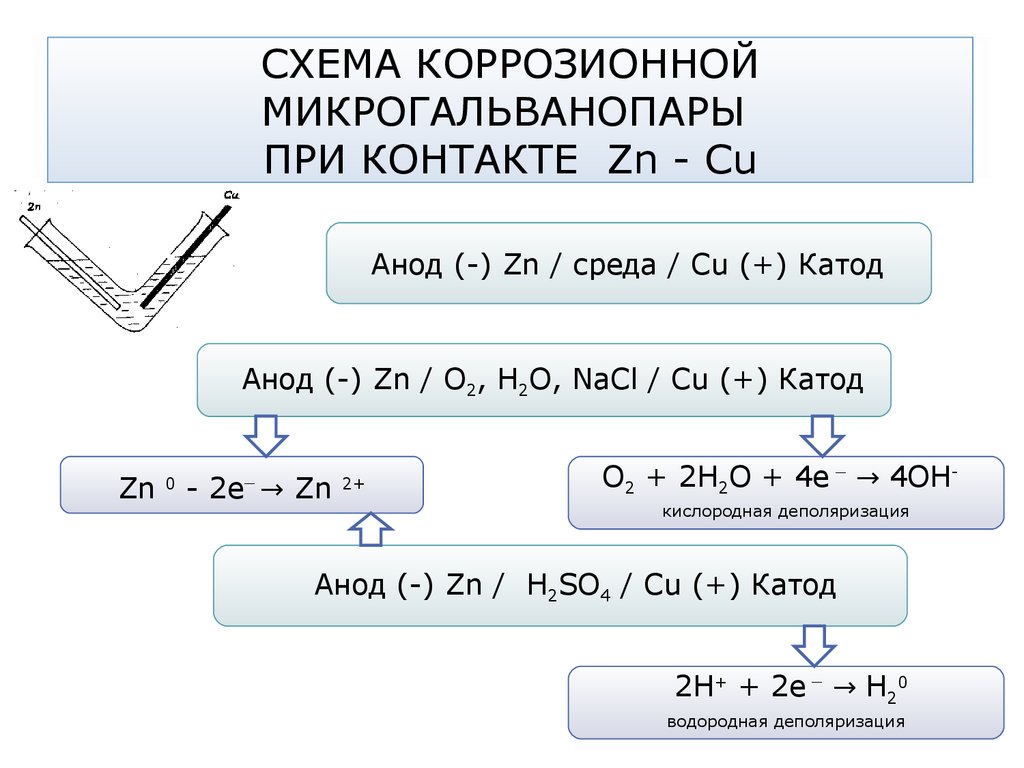
66. СХЕМА КОРРОЗИОННОЙ МИКРОГАЛЬВАНОПАРЫ ПРИ КОНТАКТЕ Zn - Cu
Анод (-) Zn / среда / Сu (+) КатодАнод (-) Zn / О2, Н2О, NaCl / Сu (+) Катод
Zn
0
_
- 2e → Zn
2+
_
О2 + 2Н2О + 4е → 4ОНкислородная деполяризация
Анод (-) Zn / Н2SO4 / Сu (+) Катод
_
2Н+ + 2е → Н20
водородная деполяризация
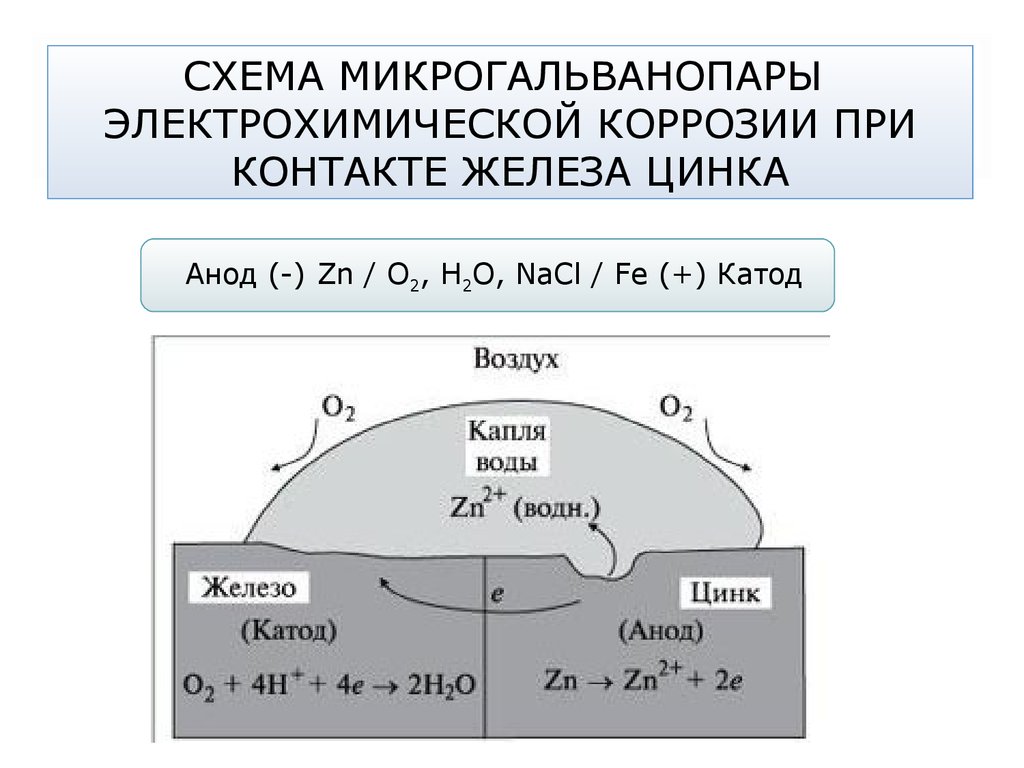
67. СХЕМА МИКРОГАЛЬВАНОПАРЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ ПРИ КОНТАКТЕ ЖЕЛЕЗА ЦИНКА
Анод (-) Zn / О2, Н2О, NaCl / Fe (+) Катод68. АЭРАЦИОННАЯ КОРРОЗИЯ
Процессы окисления и восстановления идут на разныхучастках поверхности металла и сопровождаются появлением
электрического тока.
При неодинаковом доступе кислорода
к
поверхности
металла
на
ней
возникают
гальваническая
пара
особого
рода:
участок
более
адсорбирующий кислород является
катодом, а менее адсорбирующий
анодом.
Вследствие
сферической
сплющенности капли воды кольцевая
зона под ее краями окажется катодом,
а под центральной частью - анодом.
Анод (-) Fe (центр) / О2, Н2О, NaCl / Fe (край) (+) Катод
А: Fe2+ + K3[Fe3+(CN)6] = 3K+ + Fe2+[Fe3+(CN)6]
гексацианоферрат (III) калия
«турнбулевая синь»
69. ПАССИВАЦИЯ МЕТАЛЛОВ ПРИ КОРРОЗИЯ
Иногда скорость коррозии может лимитироваться аноднымпроцессом. Это характерно для металлов, способных
пассивироваться (Cr, Al, Ti, Ni, Zr, Ta и др.)
Пассивность металла называется
состояние его повышенной
коррозионной устойчивости,
вызванное торможением
анодного процесса.
Пассивирование связано с образованием на поверхности
металла адсорбированных или фазовых слоев (иногда тех и
других), которые тормозят процесс растворения металла.
Сильные окислители обычно способствуют пассивированию
металла.
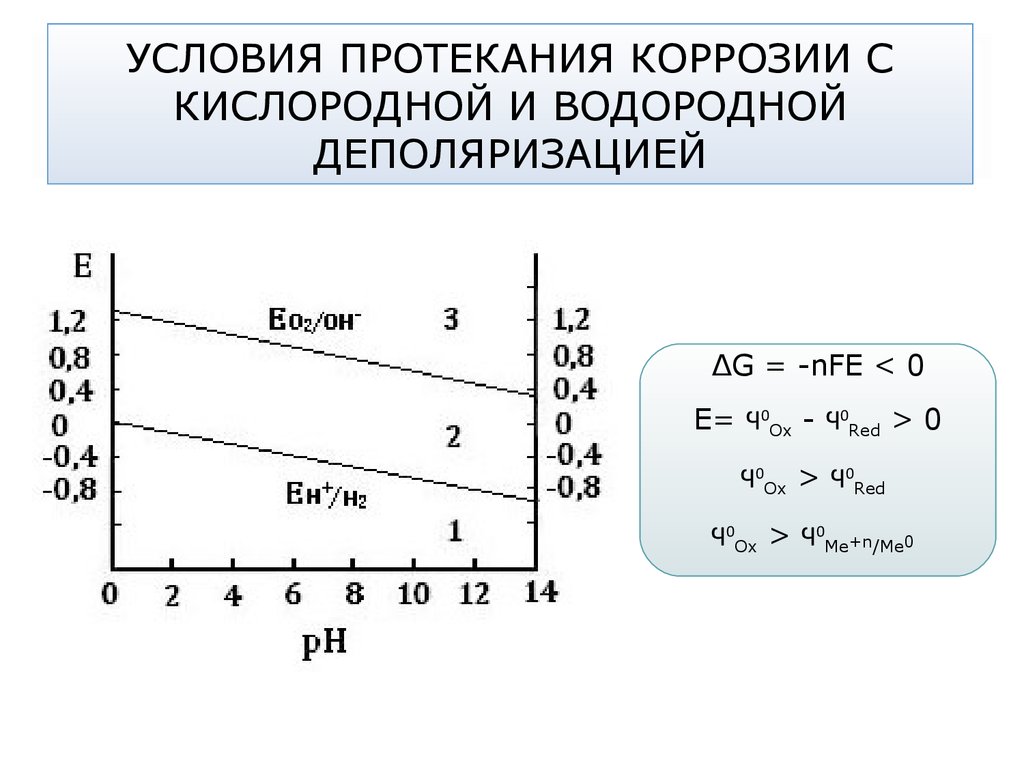
70. УСЛОВИЯ ПРОТЕКАНИЯ КОРРОЗИИ С КИСЛОРОДНОЙ И ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ
∆G = -nFE < 0Е= Ϥ0Ох - Ϥ0Red > 0
Ϥ0Ох > Ϥ0Red
Ϥ0Ох > Ϥ0Me+n/Me0
71. УСЛОВИЯ ПРОТЕКАНИЯ КОРРОЗИИ С КИСЛОРОДНОЙ И ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ
Если E0Me+n/Me0 < E0Н+/Н2 меньше потенциала водородногоэлектрода (область 1), возможна коррозия и с поглощением
кислорода, и с выделением водорода (щелочные и щелочноземельные металлы, цинк, алюминий)
Если E0Me+n/Me0 меньше потенциала кислородного электрода,
но больше потенциала водородного электрода (область 2),
тогда коррозия возможна только с участием кислорода.
_
E0Н+/Н2 < E0Me+n/Me0 < E0О2/ОН-
А (-): Ме0 - ne → Me+n
_
К (+): О2 + 2Н2О + 4е → 4ОН-
72. УСЛОВИЯ ПРОТЕКАНИЯ КОРРОЗИИ С КИСЛОРОДНОЙ И ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ
Если E0Me+n/Me0 > E0О2/ОН- потенциала кислородного электрода(область 3), то коррозия металла невозможна.
Пример: золото – в отсутствии комплексообразователя не
корродирует с поглощением кислорода или выделением
водорода.
Потенциалы многих металлов лежат во второй области.
73. Методы защиты металлов от коррозии
74. МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
Все методы защиты условно делятся на следующие группы:1.Легирование металлов;
2.Защитные покрытия (металлические и неметаллические);
3.Электрохимическая защита;
4.Изменение свойств коррозионной среды.
Выбор того или иного способа защиты от коррозии
определяется:
с одной стороны его эффективностью,
с другой стороны его экономической целесообразностью.
75. ЛЕГИРОВАНИЕ МЕТАЛЛОВ
Это метод защиты, связанный сизменением свойств корродирующего
металла. Эффективный, хотя обычно
дорогой метод защиты. При
легировании в состав сплава обычно
вводят компоненты, вызывающие
пассивирование металла (введение
хрома, никеля, вольфрама и т.д.)
Для жаростойких сплавов легирующими
добавками являются хром, алюминий,
никель, кремний – они улучшают свойства
защитных пленок, образующихся при
окислении металлов.
76. ЗАЩИТНЫЕ ПОКРЫТИЯ. МЕТАЛЛИЧЕСКИЕ ПОКРЫТИЯ
Защитные покрытия - это слои, искусственно создаваемыена поверхности металла для предохранения от коррозии.
Металлические покрытия
Материалами для покрытия могут
быть как чистые металлы (Zn, Cd,
Al, Ni, Cu, Cr, Ag), так и их сплавы
(бронза, латунь).
По характеру поведения эти
покрытия делятся
на катодные и анодные
77. КАТОДНЫЕ МЕТАЛЛИЧЕСКИЕ ПОКРЫТИЯ
К катодным покрытиям относятся покрытия, электродныепотенциалы которых в данной среде имеют более
положительное значение, чем потенциал основного металла.
Для стали (Fe) катодным покрытием будет медное,
никелевое, серебренное.
Анод (-) Fe / О2, Н2О, NaCl / Сu (+) Катод
_
A: Fe 0 - 2e → Fe 2+
_
К: О2 + 2Н2О + 4е → 4ОН-
При повреждении катодного
покрытия возникает
кислородная деполяризация
гальванический элемент в
_
+
0
2Н + 2е → Н2
котором идет окисление
водородная деполяризация
основного материала.
Следовательно, катодное покрытие может защищать изделия
только при отсутствии пор и трещин, т.е. когда не нарушена
целостность покрытия.
78. АНОДНЫЕ МЕТАЛЛИЧЕСКИЕ ПОКРЫТИЯ
Анодные покрытия имеют более отрицательный потенциал,чем потенциал основного металла.
Например: покрытие
стали (Fe) цинком – основной металл в этом случае будет
катодом и корродировать не будет.
Анод (-) Zn / О2, Н2О, NaCl / Fe (+) Катод
_
A: Zn 0 - 2e → Zn 2+
_
К: О2 + 2Н2О + 4е → 4ОНкислородная деполяризация
_
2Н+ + 2е → Н20
водородная деполяризация
При
повреждении
анодного
покрытия
возникает
гальванический элемент в котором идет окисление
покрытия, а основной материал остается без изменения до
полного растворения покрытия.
79. СПОСОБЫ ПОЛУЧЕНИЯ МЕТАЛЛИЧЕСКИХ ЗАЩИТНЫХ ПОКРЫТИЙ
Электрохимический (гальванические покрытия).Металлизация (Погружение в расплавленный металл).
Термодиффузионный
способ
(для
получения
жаростойких покрытий: Al – алитирование, Si –
силицирование, Cr – хромирование, Ti - титанирование ).
При повышенной температуре изделие погружают в
порошок
металла,
который
является
покрытием.
Происходит диффузия наносимого металла в основной
металл.
Химический.
Изделие
помещают
в
раствор,
содержащий ионы металла-покрытия и восстановитель. В
результате
окислительно-восстановительной
реакции
идет восстановление ионов металла до свободного
металла. Таким образом на металлы и неметаллы наносят
покрытия из серебра, меди, никеля и палладия.
80. НЕМЕТАЛЛИЧЕСКИЕ ПОКРЫТИЯ
Защитные свойства неметаллических покрытий сводится кизоляции металла от окружающей среды.
В качестве таких покрытий могут
быть:
неорганические эмали,
лакокрасочные покрытия,
покрытия смолами,
пластмассами,
полимернами пленками,
резиной.
81. ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА. ПРОТЕКТОРЫ
Метод основан на торможении анодных или катодныхкоррозионных процессов.
Катодная защита – изделие подключается к (-) внешнего
источника тока, оно становится катодом, а анодом обычно
служит вспомогательный электрод (чаще всего стальной).
Если вспомогательный анод изготовлен из металла,
имеющего
более
отрицательный
потенциал,
чем
защищаемый металл, тогда ток не подключают. В
полученном гальваническом элементе растворяется анод, а
изделие не подвергается коррозии.
Такие электроды называются протекторами (магний и его
сплавы, цинк, алюминий).
Анодная защита – состоит в создании анодной поляризации
за счет приложенного извне тока (защита нержавеющий
стали в серной кислоте).
82. ИЗМЕНЕНИЕ СВОЙСТВ КОРРОЗИОННОЙ СРЕДЫ
Сцелью
снижения
коррозионной
активности
среды
проводят ее обработку.
Например:
удаление
кислорода
(кипячение
раствора;
барботаж инертным газом; восстановление его при помощи
соответствующих восстановителей – сульфиты, гидразин);
снижение концентрации ионов Н+
- подщелачиванием
раствора
В последние годы для защиты от коррозии широко
применяют ингибиторы.
83. ИНГИБИТОРЫ
Ингибитором – называется вещество, снижающее скоростькоррозии.
Ингибиторы используются в системах, работающих с
постоянным или малоизменяющимся объемом.
Наиболее четко ингибирующее действие выражено у
следующих типов соединений: амины, азотосодержащие
гетероциклические соединения, сульфиды, альдегиды,
меркаптаны.
По условиям применения ингибиторы делятся на:
ингибиторы для водных растворов (кислотные, щелочные
и для нейтральной сред);
«летучие ингибиторы» - для защиты от атмосферной
коррозии (соединения аминов с азотистой, угольной или
хромовой кислотами.)
84. МЕХАНИЗМ ДЕЙСТВИЯ ИНГИБИТОРОВ
Механизм действия ингибиторов заключается в адсорбцииих на корродирующей поверхности и последующем
торможении катодных и анодных процессов.
Анодные ингибиторы– окислители (NO2-, NO3-, CrO42-, PO43-).
Металл при этом переходит в устойчивое пассивное
состояние.
Катодные ингибиторы – снижают скорость катодного
процесса или сокращают площадь катодных участков.
Относятся органические вещества, содержащие серу, азот и
кислород (диэтиламин, уротропин, гидразин).
85. ВЫВОДЫ ПО ТЕМЕ: ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛА
Li K Ca Na MgБыстро
Взаимодействие
окисляются
при
с кислородом
обычной
воздуха
температуре
При
обычной
Взаимодействие
температуре
с водой
выделяется Н2 и
образуется
гидроксид
Взаимодействие
с кислотами
Нахождение в
природе
Способы
получения
Al Mn Zn Cr Fe Ni Sn Pb H2 Cu Hg Ag Pt
Медленно окисляются при обычной температуре
или при нагревании
При нагревании выделяется Н2
и образуются оксиды
Au
Не окисляются
Н2 из воды
не вытесняют
Не вытесняют водород
из разбавленных кислот
Реагируют с
С
конц. и
кислотами
разб. НNO3
не
Вытесняют кислород из разбавленных кислот (кроме НNO3)
реагируют,
и с конц.
H2SO4 при растворяют
ся в
нагревании
«царской
водке»
В
Только в соединениях
В соединениях и в
свободном
свободном виде
виде
Электролиз расплавов
Восстановление углем, оксидом углерода (II),
алюмотермия, электролиз водных растворов
солей
86. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С КИСЛОТАМИ
87. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С АЗОТНОЙ КИСЛОТОЙ
88. СХЕМА КОРРОЗИОННОЙ МИКРОГАЛЬВАНОПАРЫ ПРИ КОНТАКТЕ Zn - Cu
Анод (-) Zn / среда / Сu (+) КатодАнод (-) Zn / О2, Н2О, NaCl / Сu (+) Катод
Zn
0
_
- 2e → Zn
2+
_
О2 + 2Н2О + 4е → 4ОНкислородная деполяризация
Анод (-) Zn / Н2SO4 / Сu (+) Катод
_
2Н+ + 2е → Н20
водородная деполяризация
89. КОНТАКТНАЯ ИНФОРМАЦИЯ
Разработчик: к.х.н., доцентНовгородцева Л.В.
Кафедра «Химия»
пр. Мира, 11, гл. корпус,
каб. 426
тел.: (3812) 65-98-11
Email: phiscem@omgtu.ru








































































 chemistry
chemistry








