Similar presentations:
Коррозия металлов. Сущность процесса коррозии
1. Тема 2.4 Коррозия металлов
Сущность процесса коррозии1
2.
Термин коррозия происходит от латинского слова corrodere, чтоозначает разъедать, разрушать.
Коррозия – это самопроизвольный процесс разрушения
материалов и изделий из них под химическим воздействием
окружающей среды.
Коррозия металлов – разрушение металлов вследствие физикохимического воздействия внешней среды, при котором металл
переходит в окисленное (ионное) состояние и теряет присущие ему
свойства.
Делийская
железная колонна
Возраст 1600 лет
Высота 7, 2 м,
вес около 6 тонн
Монолит на 99,72 %
состоит из железа,
имея только 0,28%
примесей фосфора и
меди, при этом
колонна не заржавела
Эйфелева башня
Красили 18 раз,
отчего ее масса 9000 т
каждый раз увеличивалась на 70 т
3. Физико-химические основы коррозии и защиты металлов Основные понятия и определения
Коррозионная средаКоррозионные потери
Продукты коррозии
Коррозионная стойкость
Внутренние факторы коррозии
Внешние факторы коррозии
Электрохимическая коррозия
Химическая коррозия
Среда, в которой происходит коррозия металла
Количество металла, превращенного в продукты коррозии за
определенное время
Химические
соединения,
образующиеся
в
результате
взаимодействия металла и коррозионной среды
Способность металла сопротивляться коррозионному воздействию
среды
Факторы, влияющие на скорость, вид и распределение коррозии,
связанные с природой металла
Факторы, влияющие на скорость, вид и распределение коррозии,
связанные с составом коррозионной среды и условиями
коррозии
Взаимодействие металла с коррозионной средой (раствором
электролита), при котором ионизация атомов металла и
восстановление окислительной компоненты коррозионной среды
протекают не в одном акте и их скорости зависят от электродного
потенциала
Взаимодействие металла с коррозионной средой, при котором
окисление
металла
и
восстановление
окислительной
компоненты коррозионной среды протекают в одном акте
3
4. Физико-химические основы коррозии и защиты металлов
Прямые потери :- стоимость замены конструкций, механизмов и их частей,
пришедших в негодность вследствие коррозии;
- использование коррозионностойких легированных
материалов;
- применение лакокрасочных материалов, покрытий,
ингибиторов коррозии;
- применение протекторной и электрохимической защиты.
Прямые потери от коррозии ~ 4.2% GNP, $5.5 млрд. в год ил 10%
выплавленной стали
4
5. Физико-химические основы коррозии и защиты металлов
Косвенные потери :1. Простои оборудования.
2. Потеря полезного продукта (течь продуктопроводов).
3. Потеря производительности оборудования.
4. Загрязнение полезного продукта.
5. Завышенные допуски при проектировании деталей (увеличение
толщины изделия с припуском на коррозию).
6. Гибель людей в результате чрезвычайных ситуаций, вызванных
коррозией
Косвенные потери оцениваются как превышающие прямые
примерно в 3-4 раза
5
6.
По видукоррозионной
среды
По характеру
разрушения
Газовая
Сплошная
Жидкостная
Местная
Атмосферная
Почвенная
Блуждающими
токами
Межкристаллитная
По процессам
Химическая
Электрохимическая
7.
Классификация коррозионных процессов:По условиям протекания:
газовую коррозию - коррозию металлических материалов в атмосфере
раскаленных газов;
атмосферную коррозию - коррозию металлических материалов в атмосфере
влагосодержащих газов;
жидкостную коррозию - коррозию металлов в жидкостях (электролитах и не
электролитах);
подземную коррозию - коррозию в почвах и грунтах;
структурную коррозию - коррозию металлических материалов в связи с
неоднородностью их структуры;
биокоррозию - коррозию под влиянием микроорганизмов;
коррозию под действием блуждающих и внешних токов
коррозию под действием физических воздействий (под действием кавитации,
постоянных и переменных механических нагрузок, радиации и т.д.) .
7
8.
фреттинг-коррозия или коррозионная эрозия (при одновременномвоздействии коррозионной среды и сил трения);
коррозия при кавитации (ударном воздействии коррозионной среды);
контактная коррозия (коррозия, возникающая при контакте металлов,
имеющих различные потенциалы);
щелевая коррозия (протекающую в узких щелях и зазорах между
отдельными деталями);
структурная коррозия (обусловленная структурной неоднородностью
сплава);
термоконтактная коррозия (возникающая за счет температурного
градиента, обусловленного неравномерным нагреванием поверхности
металла);
8
9. Сплошная коррозия
По характеру разрушенийСплошная коррозия
Равномерная
Неравномерная
10. Местная коррозия
ЯзвеннаяТочечная
Пятнами
11. Причины возникновения местной коррозии
Соль на дорогахМорская вода
Межкристаллитная коррозия
12. По механизму протекания коррозия делится на : химическую и электрохимическую
1213.
Химическая коррозияХимическая коррозия металлов – процесс, при котором
окисление металла и восстановление окислителя происходят
одновременно при их непосредственном взаимодействии
Mes + O2 → MexOy
Изменение свободной энергии при образовании оксидов металлов
13
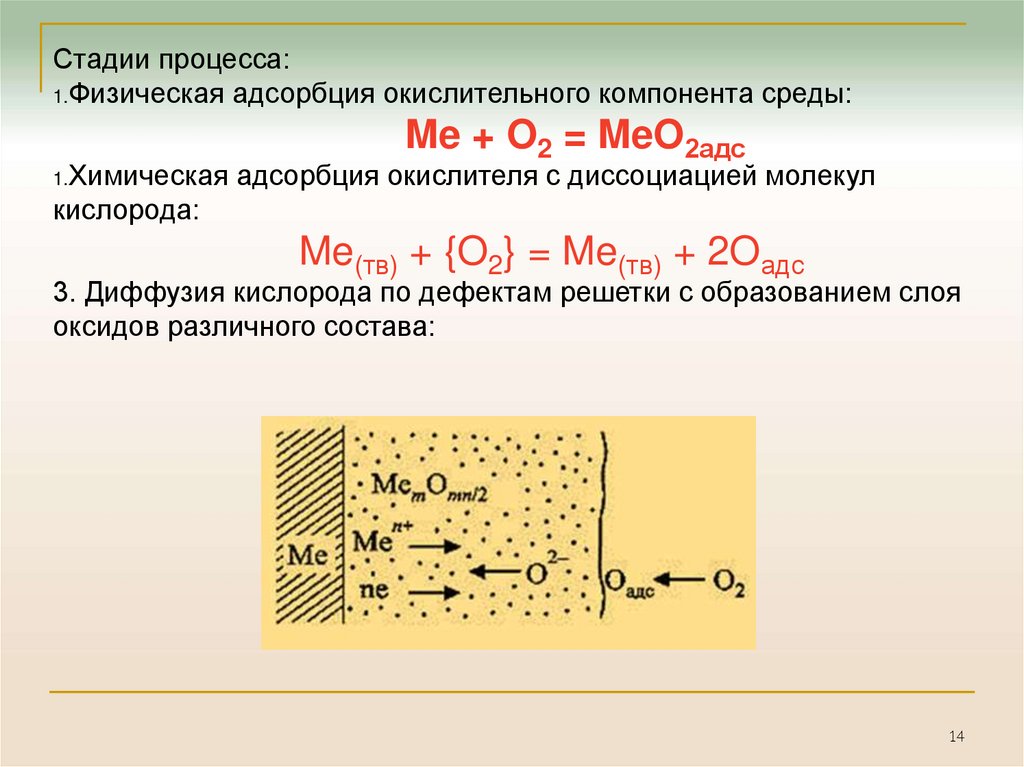
14.
Стадии процесса:1.Физическая адсорбция окислительного компонента среды:
1.Химическая
Me + O2 = MeO2адс
адсорбция окислителя с диссоциацией молекул
кислорода:
Me(тв) + {O2} = Me(тв) + 2Oадс
3. Диффузия кислорода по дефектам решетки с образованием слоя
оксидов различного состава:
14
15. Химическая коррозия
Газовая2Fe + 3Cl2 = 2FeCl3
4Fe + 3О2 = 2Fe2 О3
В жидких
не электролитах
• В нефти
• В сере
• В органических веществах
Cu + S = CuS
2 Ag + S = Ag2S
2Al + 6ССl4 = 3C2Cl6 + 3AlCl3
16.
Оксидные слои на железе:16
17.
Характеристики оксидов железа:FeO – вюстит – черный порошок, не обладает защитными
свойствами. При высокотемпературной газовой коррозии
образуется Fe0,8-0,9O, по вакансиям кристаллической решетки
кислород проникает под слой оксида.
Fe2O3 – гематит – желто-коричневого цвета. Существует в
широком интервале температур, но выше 1100 ° С частично
диссоциирует, используется в качестве пигмента.
FeO• Fe2O3 или Fe3O4 – магнетит, обладает магнитными
свойствами и электронной проводимостью, дефекты в
структуре оксида обеспечивает легкость перехода электрона
от одного катионного узла к другому. Магнетит устойчив во
всем интервале температур от комнатной до точки плавления
железа (1538 °С). Обладает высокими защитными свойствами.
17
18.
Защитные свойства оксидных пленокКритерий сплошности Пиллинга-Бедворса: молярный объем оксида,
возникающего на поверхности металла (Vok), должен быть больше
молярного объема металла (VMe), израсходованного на образование одного
моля оксида:
Vok/VMe > 1
Ржавчина может быть и полезной. Так, любопытную технологию превращения слоя
ржавчины в … защитное покрытие удалось разработать индийским ученым. Для этого на
стальное изделие, покрытое густым налетом ржавчины, наносят специальный состав,
благодаря которому слой оксидов становится прочным панцирем черного цвета. Затем на
него наносят краску, которая, кстати, держится на этом защитном слое надежнее, чем
непосредственно на металлической поверхности. Теперь изделию коррозия не страшна.
18
19. Влияние внешних факторов на химическую коррозию металлов
1. ТемператураK = K0 * exp (-E*хp/RT),
где К0 - константа; Е*хp –
энергия
активации химической
реакции;
D = D0 * exp (-E*д/RT),
где D0 –
константа;
Е*д –
энергия
активации диффузии.
пленки на стали:
От температуры зависит состав
оксидной
19
20.
2. Состав газовой фазыВажнейшие окислители металлов при высоких температурах – О2, СО2,
Н2О(пар), SO2:
2Me + O2 → 2MeO,
Me + CO2 → MeO + CO,
Me + H2O → MeO + H2,
3Me + SO2 → 2MeO + MeS,
В атмосферах, содержащих O2, CO2 и Н2О, может происходить
обезуглероживание (декарбонизация):
Fe3C + 1/2 O2 → 3Fe + CO,
Fe3C + CO2 → 3Fe + 2CO,
Fe3C + H2O → 3Fe + CO + H2
V2O5 способен офлюсовывать (переводить в жидкое состояние) химические
соединения золы и окалины:
4Fe + 3V2O5 = 2Fe2O3 + V2O3,
V2O3 + O2 = V2O5,
V2O5 + Fe2O3 = 2FeVO4.
20
21.
3. Давление окислителяТак как поверхность металла покрыта слоем оксида, то зависимость
скорости окисления от величины парциального давления окисляющей
газа может быть различной в зависимости от строения защитной
пленки.
Например, при окислении железа при 700-950оС скорость окисления
не зависит от Po2.
4. Скорость движения газовой фазы
Окисление, как гетерогенный процесс, определяется скоростью
подвода и отвода реагентов в зону реакции. Поэтому, чем больше
скорость движения потока газа, тем больше и скорость окисления
металла.
5. Режим нагрева металла
Влияние режима нагрева металла может быть рассмотрено в
контексте влияния колебаний температуры. То есть переменные
нагрев и охлаждение увеличивают скорость окисления ввиду
нарушения сохранности защитной пленки.
21
22. Влияние внутренних факторов на химическую коррозию металлов
1. Состав сплаваПри высоких температурах (более 800оС) с увеличением
содержания C в стали скорость ее окисления и
обезуглероживания уменьшается вследствие более активного
образования СО, что снижает окислительный потенциал
газовой фазы.
S, P, Ni, Mn практически не влияют на скорость окисления
железа.
Ti, Cu, Co, Be заметно снижают скорость окисления железа.
Cr, Al, Si сильно замедляют окисление железа.
V, W и Mo могут значительно ускорить окисление стали,
которое иногда носит катастрофический характер.
22
23.
Влияние внутренних факторов на химическую коррозию металлов2. Структура сплава
Чем меньше в сплаве структурных составляющих, тем выше его
жаростойкость.
Применительно к сплавам железо – углерод, наиболее устойчивой
является аустенитная структура, обладающая более плотной
упаковкой. Стали с двухфазной аустенитно – ферритной структурой
менее устойчивы против окисления. Их меньшая жаростойкость
связывается с большей неоднородностью образующейся защитной
пленки, что приводит к ее разрушению при росте (неоднородность
возникающих внутренних напряжений).
Хромо - никелевые стали с однофазной аустенитной структурой
более устойчивы против окисления, чем двухфазные: Х12Н12М2Т,
Х12Н9Т ведут себя лучше, чем ОХ21Н5МД2Т, 1Х21Н5Т.
Чугуны с шаровидной форме графита более стойкие, чем с
пластинчатой.
23
24.
Методы защиты от газовой коррозии1. Контролируемые и защитные атмосферы
газовые среды из технически чистого азота, гелия, аргона и других
инертных газов;
азот и влажный водород(N2+H2/H2O); эту газовую смесь получают
диссоциацией аммиака и дожиганием образовавшегося при
диссоциации водорода;
азот, моно- и диоксид углерода(N2+СO/CO2); данную газовую смесь
получают в древесноугольных генераторах;
азот, влажный водород, моно – и диоксид углерода
(N2+H2/H2O+СO/CO2):эта атмосфера - продукт неполного сгорания
углеводородов;
азот, моно- и диоксид углерода, метан, водород (N2,СO/CO2,CH4/H2);
эта науглероживающая атмосфера, выполняющая кроме защитных
функций и роль науглероживающей.
24
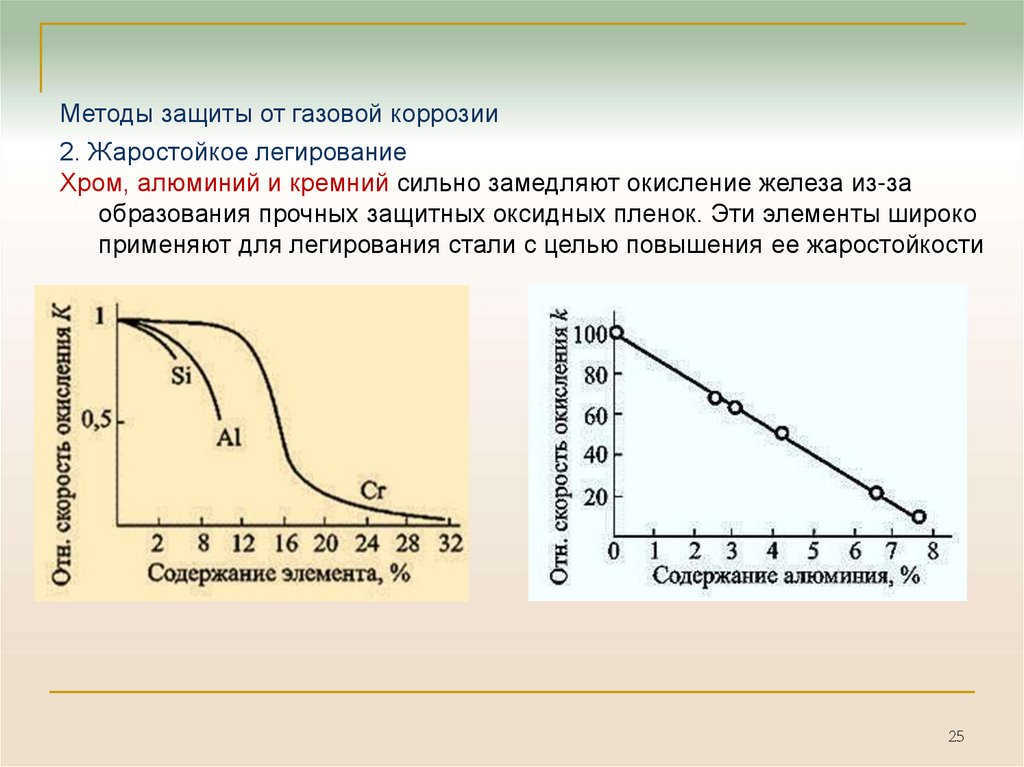
25.
Методы защиты от газовой коррозии2. Жаростойкое легирование
Хром, алюминий и кремний сильно замедляют окисление железа из-за
образования прочных защитных оксидных пленок. Эти элементы широко
применяют для легирования стали с целью повышения ее жаростойкости
25
26.
Методы защиты от газовой коррозии3. Поверхностное легирование
Поверхностное легирование – термодиффузионное насыщение
легирующим элементом поверхности защищаемого металла.
3.1. Алитирование - процесс насыщения поверхностного слоя защищаемого
материала алюминием. Покрываемый металл загружают в реактор,
засыпают реакционной смесью (50%Al-порошка ,45-48% Al2O3 и 2-5%
NH4Cl) и помещают в нагревательное устройство (печь). Время выдержки
3-4 часа, температура 950-1000оС.
3.2. Термохромирование - процесс насыщения поверхностного слоя
защищаемого материала хромом. Покрываемый металл засыпают
реакционной смесью (Cr-порошка , каолина (Al2O3•2SiO2•2H2O) и NH4Cl) и
нагревают при температуре 1000-1500оС. Процесс продолжается 8—16
часов. За это время получают слой толщиной 50-200 мкм. Содержание
хрома во внешнем слое покрытия превышает 50 % и состав слоя
представляет собой твердый раствор Fe-Cr.
26
27.
Методы защиты от газовой коррозии3. Поверхностное легирование
3.3. Силицирование - процесс насыщения поверхностного слоя защищаемого
материала кремнием. Силицирование осуществляется при температуре 10001200оС. Активная среда – смесь порошкообразного кремния или ферросилиция с
NH4Cl. Силицирование – надежный способ предохранения от газовой коррозии
тугоплавких металлов (Nb,W,Mo,Ta и др.). Стойкость образующегося покрытия
объясняется образованием плотных силицидных покрытий (WSi2, MoSi2),
обладающих эффектом самозалечивания.
4. Неорганические металлические покрытия
Из неметаллических неорганических покрытий для защиты стали и чугуна особенно
большое значение имеет эмаль. Современные легкоплавкие эмали пригодны также
для алюминия и иногда их используют в строительстве для деталей фасадов.
Эмаль - это силикатное стекло с добавками оксидов металлов. Ее наносят на
очищенную поверхность материала в виде порошка или взвеси и обжигают при
1000 °С. Температура плавления эмали для алюминия, содержащей много свинца,
около 500 °С. Для хорошего прилипания, а значит, и устойчивости покрытий важно
сблизить коэффициенты объемного расширения основного материала и покрытия.
В последнее время получают развития ситалловые защитные покрытия, а также
керамические на основе оксидной (Al2O3 , ZnO2) или бескислородной керамики (SiC,
BN, MoSi2).
27
28. Электрохимическая коррозия
Электрохимическаякоррозия
взаимодействие металла с коррозионной
средой (раствором электролита), при котором
ионизация атомов металла и восстановление
окислительной
компоненты
коррозионной
среды
протекают
не
в
одном
акте
(пространственно разделены) и их скорости
зависят от электродного потенциала (ГОСТ
5272-68)
Этот тип коррозии наиболее распространен. Он
реализуется при взаимодействии металлических
материалов с электролитами: водными растворами
солей, кислот, щелочей, расплавами солей и щелочей.
28
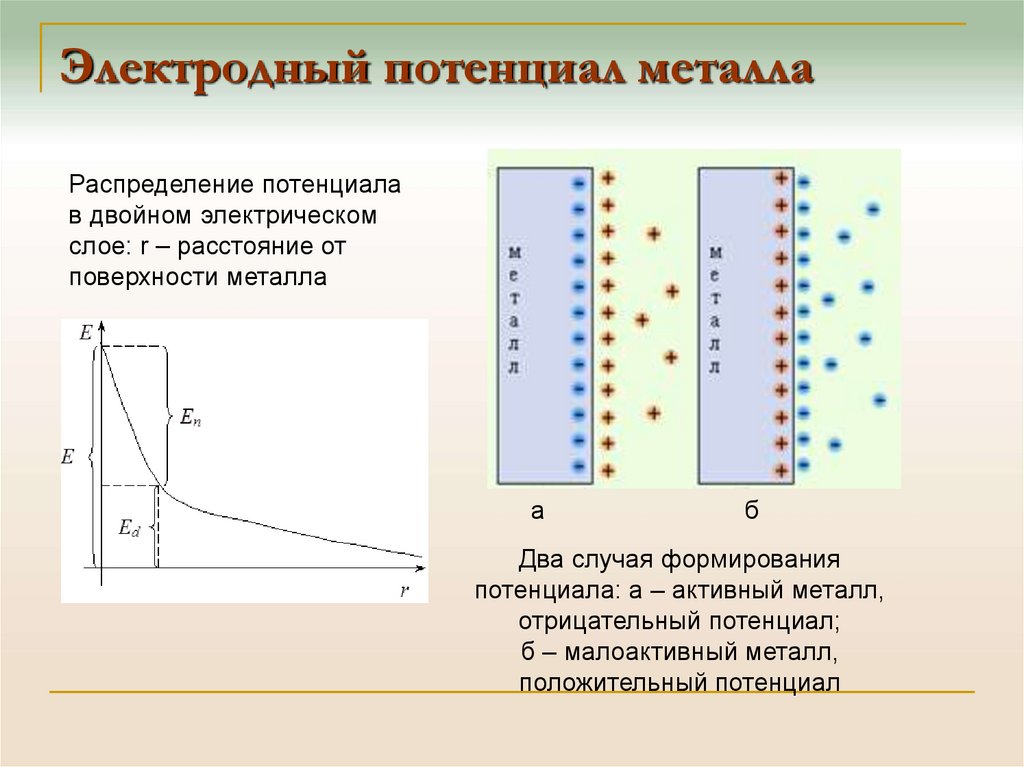
29. Электродный потенциал металла
Распределение потенциалав двойном электрическом
слое: r – расстояние от
поверхности металла
а
б
Два случая формирования
потенциала: а – активный металл,
отрицательный потенциал;
б – малоактивный металл,
положительный потенциал
30.
Анодный процесс – окислительный, проходит срастворением металла;
Катодный процесс – восстановительный,
обусловлен электрохимическим восстановлением
компонентов среды. Современная теория коррозии
металлов не исключает совместного протекания
химической и электрохимической коррозии, так как в
электролитах при определенных условиях возможен
перенос массы металла по химическому механизму.
30
31. Электрохимическая коррозия
Me – ne = Me +n2Сu + O2+ 2H2O + CO2= CuCO3∙Cu(OH)2
2Fe + O2 + 2H2O = 2Fe(OH)2
О2 О 2
О2
Fe - 2е- → Fe2+
32. Гальванический элемент Дж. Даниэля – Якоби (1836).
33. Гальванические элементы
В элементе происходит переход электронов отвосстановителя к окислителю:
Zn + CuSO4 = Cu + ZnSO4
Окисление
Zn:
Zn – 2e = Zn2+
Восстановление Cu: Cu2+ + 2e = Cu
В электрохимических системах процессы окисления и
восстановления пространственно разделены,
электроны переходят от восстановителя (Zn) к
окислителю (Cu) по внешнему проводнику (идет
электрический ток).
34.
При работе ГЭ происходят реакции:Анод: Zn – 2e = Zn2+ (окисление)
Катод: Cu2+ + 2e = Cu (восстановление)
Схема записи ГЭ:
е-
A(–) Zn l ZnSO4 ll CuSO4 l Cu (+) K
E = φK – φA = 0,34 – (-0,76) = 1,1 В
Z
n
ZnSO4
C
u
CuSO4
Zn окисляется, т.к. его катионы
переходят в раствор.
Cu восстанавливается, т.к. катионы
меди превращаются в
металлическую медь
35. Методы защиты металла от электрохимической коррозии
Все методы защиты условно делятся наследующие группы:
а) легирование металлов;
б) защитные покрытия (металлические,
неметаллические), электрохимическая защита;
в) изменение свойств коррозионной среды;
г) рациональное конструирование изделий.
36. Антикоррозионные покрытия металлов
По виду материалов защитные покрытия дляметаллических конструкций могут быть
классифицированы как лакокрасочные,
металлические, оксидные, изоляционные.
Возможны комбинации различных видов покрытий.
По механизму защитного действия покрытия могут
быть классифицированы как барьерные, т.е.
обеспечивающие только изоляцию, протекторные
и с комбинированным барьерно-протекторным
действием.
37. Катодное и анодное металлические покрытия
Металл анодных покрытий имеет электродный потенциалболее отрицательный, чем потенциал защищаемого металла.
Анодные покрытия на железе, как правило, обладают
сравнительно низкой стойкостью.
Катодные металлические покрытия, электродный потенциал
которых более электроположителен, чем потенциал основного
металла, могут служить надёжной защитой от коррозии только
при условии отсутствия в них сквозных пор, трещин и других
дефектов, так как они механически препятствуют
проникновению агрессивной среды к основному металлу.
38. Электрохимические методы защиты металлов от коррозии
Для электрохимической защиты от коррозииприменяют подключение постоянного тока
(источник постоянного тока или протектор).
Электрический ток на поверхности защищаемого
изделия создает катодную поляризацию
электродов микрогальванических пар. Результатом
этого является то, что анодные участки на
поверхности металла стают катодными. А
вследствии воздействия коррозионной среды идет
разрушение не металла конструкции, а анода.




































 chemistry
chemistry








