Similar presentations:
Коррозия металлов
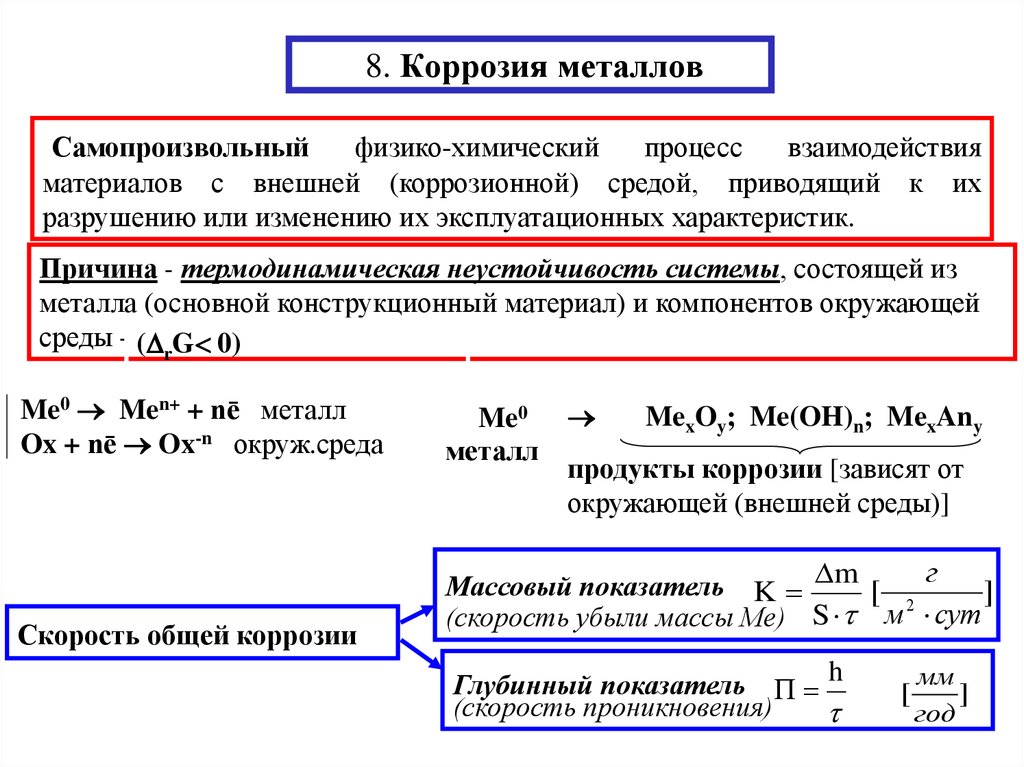
1. 8. Коррозия металлов
Самопроизвольныйфизико-химический
процесс
взаимодействия
материалов с внешней (коррозионной) средой, приводящий к их
разрушению или изменению их эксплуатационных характеристик.
Причина - термодинамическая неустойчивость системы, состоящей из
металла (основной конструкционный материал) и компонентов окружающей
среды - ( rG 0)
Me0 Men+ + nē металл
Ox + nē Ox-n окруж.среда
Скорость общей коррозии
Me0
металл
MexOy; Me(OH)n; MexAny
продукты коррозии [зависят от
окружающей (внешней среды)]
г
Массовый показатель K m [
]
2
(скорость убыли массы Ме) S м сут
Глубинный показатель П h
(скорость проникновения)
[
мм
]
год
2. 10-балльная шкала для оценки общей коррозионной стойкости металлов
Группа стойкостиСкорость коррозии металла,
мм/год
Менее 0,001
Свыше 0,001 до 0,005
0,005 до 0,01
0,01 до 0,05
0,05 до 0,1
0,1 до 0,5
0,5 до 1,0
1,0 до 5,0
5,0 до 10,0
Свыше 10,0
Совершенно стойкие
Весьма стойкие
Стойкие
Пониженно-стойкие
Малостойкие
Нестойкие
Балл
1
2
3
4
5
6
7
8
9
10
20% НCl
20% KOH
Морская вода
9-10
10
5
Магний
10
3-4
10
Сталь 3
9-10
1-2
6-7
Платина
1-2
1-2
1
Алюминий
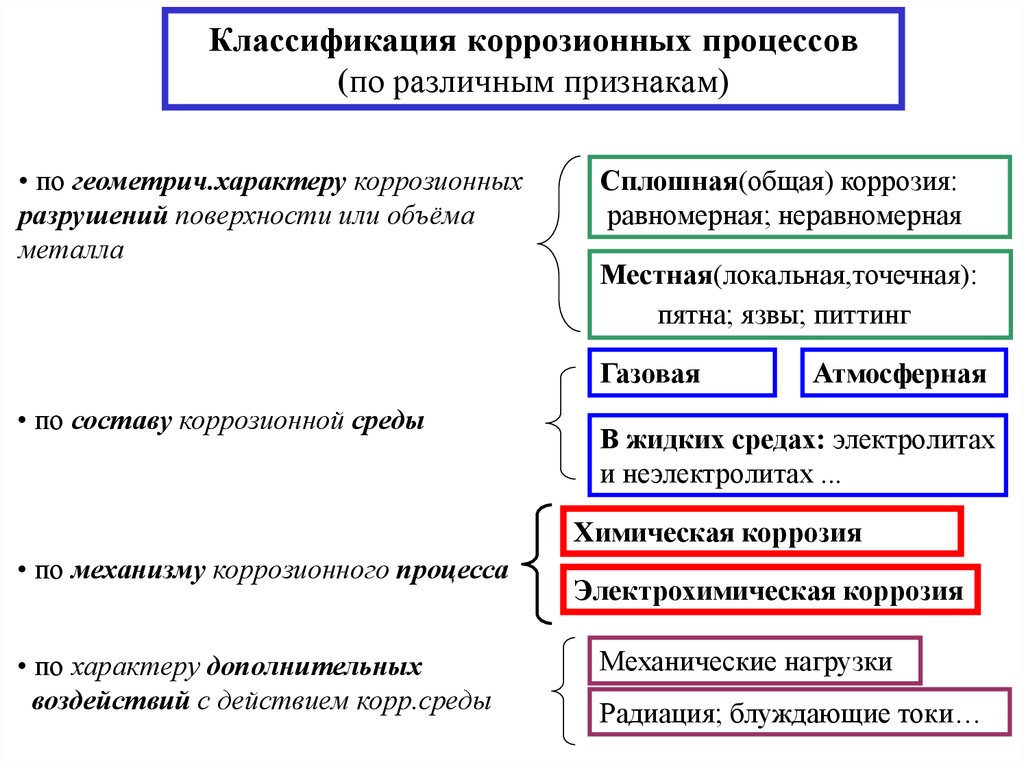
3. Классификация коррозионных процессов (по различным признакам)
• по геометрич.характеру коррозионныхразрушений поверхности или объёма
металла
Сплошная(общая) коррозия:
равномерная; неравномерная
Местная(локальная,точечная):
пятна; язвы; питтинг
Газовая
• по составу коррозионной среды
Атмосферная
В жидких средах: электролитах
и неэлектролитах ...
Химическая коррозия
• по механизму коррозионного процесса
• по характеру дополнительных
воздействий с действием корр.среды
Электрохимическая коррозия
Механические нагрузки
Радиация; блуждающие токи…
4. 8.1 Химическая коррозия
Гетерогенная окислительно-восстановительная реакция (между Ме иокислителем). Окисление металла и восстановление окислителя
окружающей среды протекает в одном акте при непосредственном переходе
электронов металла на окислитель с образованием продуктов коррозии.
Коррозионная среда не проводит электрический ток →
коррозия газовая и в неэлектропроводных жидкостях
Высокотемпературная газовая коррозия (нет конденсации паров окислителя)
окислитель - газ: атмосферный кислород (О2); СО2; пары воды; SO2; Cl2; …
Для большинства Ме ∆G < 0 при взаимодействии с О2 – самопризв.окисление
xMe + y/2 O2 = MexOy - оксидная пленка
тв.
газ
тв.
• это гетерогенная химическая реакция с изменением поверхности:
на границе раздела металл-газовая среда возникает пленка твёрдых
продуктов окисления (продукт окисления - оксидная плёнка MexOy)
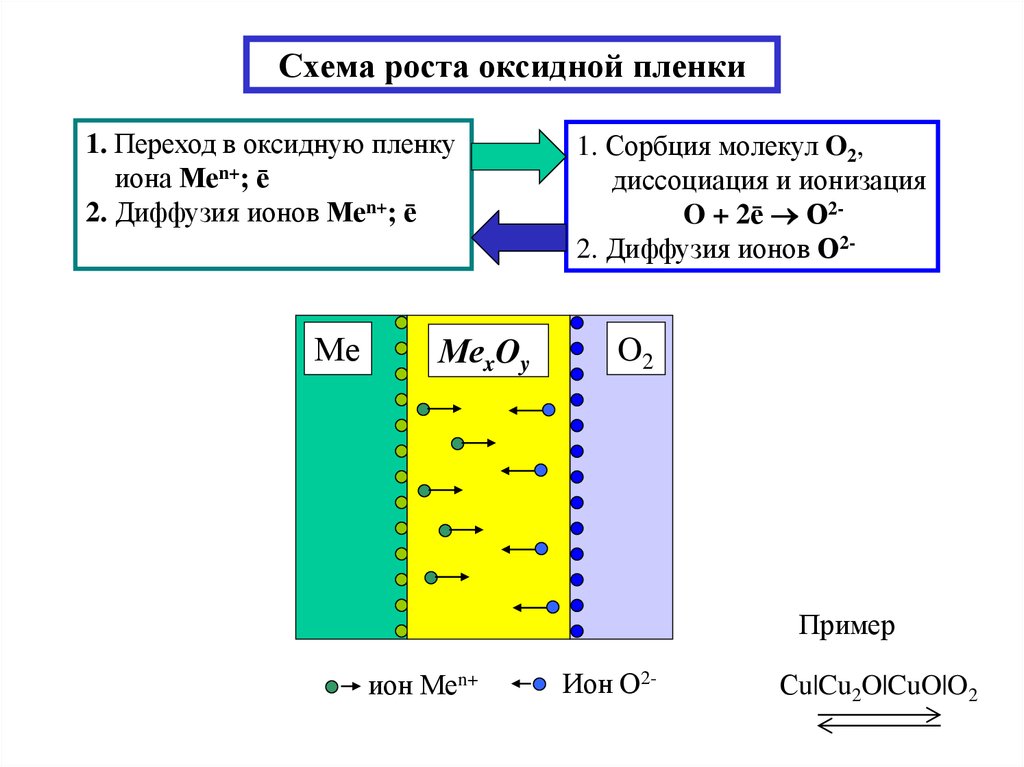
5. Схема роста оксидной пленки
1. Переход в оксидную пленкуиона Меn+; ē
2. Диффузия ионов Меn+; ē
Ме
МеxOy
1. Сорбция молекул O2,
диссоциация и ионизация
O + 2ē О22. Диффузия ионов О2-
O2
Пример
ион Меn+
Ион О2-
Сu|Cu2O|CuO|O2
6. Кинетика роста оксидных пленок (определяется свойствами оксидной пленки и температурой)
Кинет. уравн. роста оксидной пленки( xMe + y/2 O2 = MexOy ) для газ. коррозиизависимость толщины пленки ( ) от времени(t); (r –скорость газовой коррозии)имеют две формы:
дифференциальное уравнение - r =
интегральное уравнение
-
d
dt
=f(t)
Коррозия - гетерогенная хим.реакция (может протекать в кинетич. или
диффузионном режиме - разные законы изменения во времени
- лимитируется скоростью подвода(отвода) регентов или
- лимитируется скоростью химической реакции
1.
Лимитирующая стадия химическая реакция (плёнка несплошная,
пористая).Закон действующих масс (ЗДМ) для реакции окисления Ме:
d
r
k pO2 k
dt
pO2 const
d k dt
(t) k t const
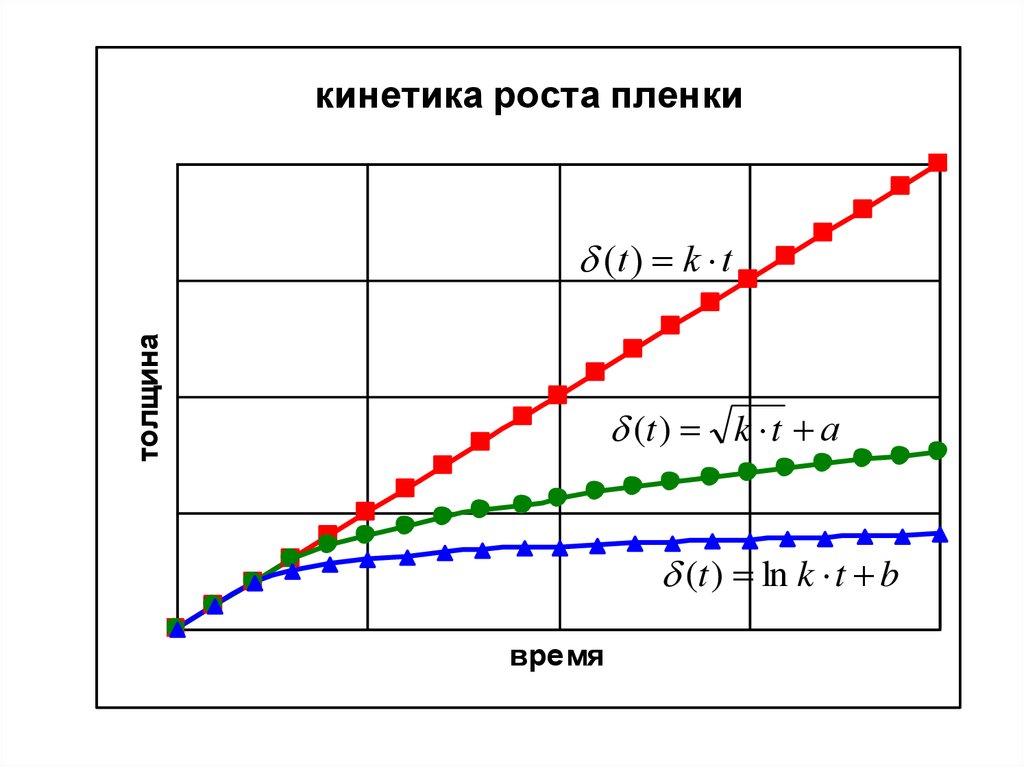
Линейный закон роста
(щелочные и щ/з Ме)
7. Кинетика роста оксидной пленки
2. Лимитирующая стадия диффузия (наличие сплошной оксидной плёнки).Скорость коррозии (роста пленки) определяется законами диффузии(С-конц.О2):
d
k"
D grad C
dt
grad C
d k" dt
Ссреда
С Cпов Ссреда
x
Спов 0
1 2
k " t const
2
(t ) k t const
Параболический закон роста
(Fe, Co, Ni, Cu и др.)
3. D 0
(t ) max const
40 нм – тонкие, невидимые пленки
~ 40 - 500 нм – «цвета побежалости»
500 нм – «окалина»
(t ) ln k t b
Логарифмический закон
роста
(Al, Cr)-замедление диффузии
при росте толщины плёнки
8.
кинетика роста пленкитолщина
(t ) k t
(t ) k t а
(t ) ln k t b
время
9. Факторы, влияющие на скорость газовой коррозии (определяется св-вами оксидной пленки)
1. Защитные свойства пленок – определяет природа Ме•сплошность
• адгезия (сцепление с поверхностью Ме)
•механические свойства
•коэффициент линейного расширения
ЗАЩИТА :
•легирование Ме
•защитные покрытия
(высокотемпературные)
2. Температура (возрастание скорости газ.коррозии с ростом Т-экспонента)
Ea
RT
• e
•изменение кинетического закона роста пленок;
•разрушение пленок при колебании Т (термич.напряжения→трещины)
3. Состав газовой среды
•рост концентрации (парциальное давление) газаокислителя→рост скорости коррозии(диффузии)
•пары H2O, соединен. S и др.рост → скорости коррозии
•защитные среды
(инертные газы,
вакуум)
10. 8.2 Водородная коррозия (охрупчивание)
Уменьшение пластичности металла (охрупчивание) в газовойсреде содержащий водород (Н2) из-за растворения водорода в
металле => разрушение Ме конструкций
Протекают процессы:
Сорбция водорода на поверхности Ме с последующей диссоциацией: Н2 2 Н
Диффузия атомов Н в объём Ме и возможные процессы:
•Fe3C + 4H 3Fe + CH4
•Me + nH MeHn (гидриды металлов)
• Образование газовых полостей («пузырей») [рекомбинация 2 Н
Н2, ] =>равновесие : газ(Н2 ) в полость<=>газ (Н2 ) из полости
(при давлении 2000 ат – большие внутренние напряжения в объёме
металла, потеря пластичности(охрупчивание)
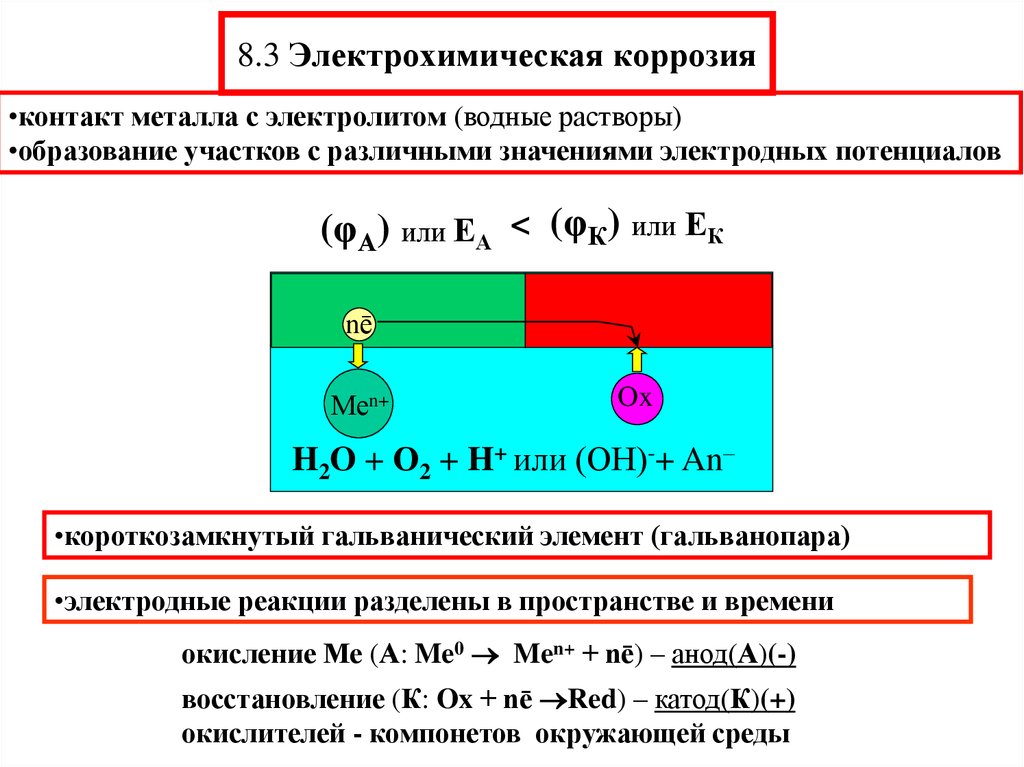
11. 8.3 Электрохимическая коррозия
•контакт металла с электролитом (водные растворы)•образование участков с различными значениями электродных потенциалов
(φА) или ЕА < (φК) или ЕК
Меnē
Меn+
Ox
H2O + О2 + H+ или (ОН)-+ An–
•короткозамкнутый гальванический элемент (гальванопара)
•электродные реакции разделены в пространстве и времени
окисление Ме (А: Me0 Men+ + nē) – анод(А)(-)
восстановление (К: Ox + nē Red) – катод(К)(+)
окислителей - компонетов окружающей среды
12. Электродные реакции анодные – окисления Ме, катодные –восстановления (деполяризации) А: Me0 Men+ + nē
Электродные реакциианодные – окисления Ме, катодные –восстановления
(деполяризации) А: Me0 Men+ + nē
Деполяризация – компенсация заряда в катодном процессе
электролит: H2O + О2 + H+ + An–
Водородная деполяризация
К: 2H+ + 2ē → H2
pH 7
К: 2H2O + 2ē →H2 + 2OH- pH 7
Кислородная деполяризация
К: О2 + 4H+ + 4ē → 2H2O pH 7
К: О2 + 2H2O + 4ē → 4OH- pH 7
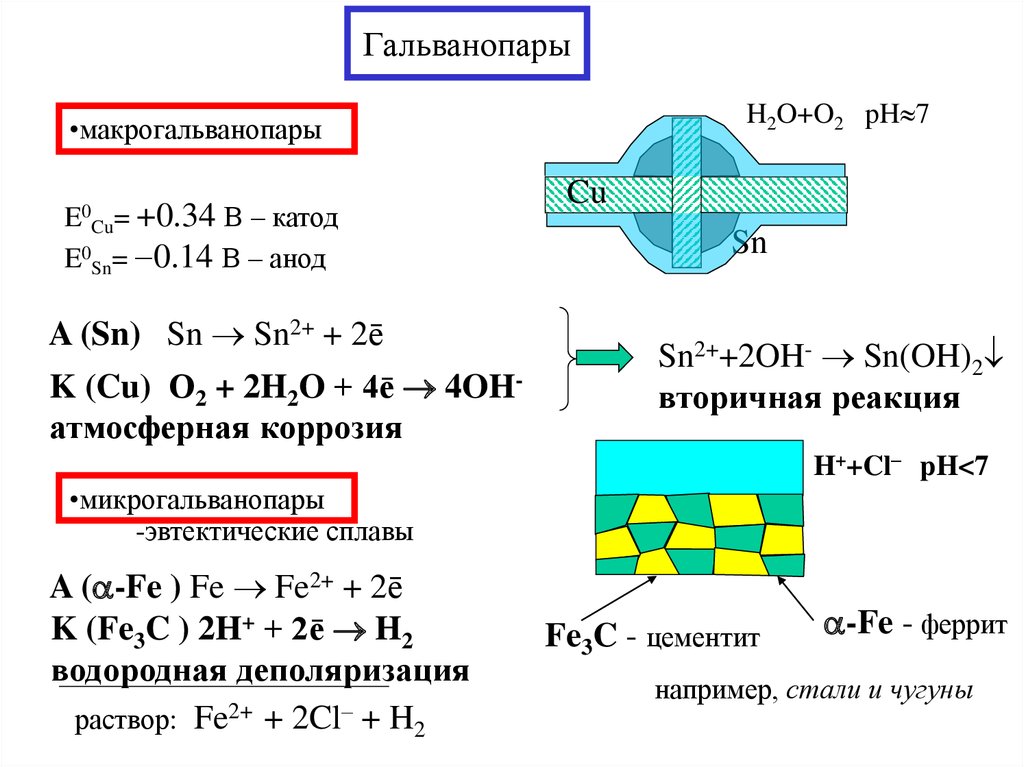
13. Гальванопары
H2O+O2 pH 7•макрогальванопары
+0.34 В – катод
E0Sn= 0.14 В – анод
E0
Cu=
A (Sn) Sn Sn2+ + 2ē
K (Cu) О2 + 2H2O + 4ē 4OHатмосферная коррозия
Cu
Sn
Sn2++2OH- Sn(OH)2
вторичная реакция
H++Cl– pH<7
•микрогальванопары
-эвтектические сплавы
A ( -Fe ) Fe Fe2+ + 2ē
K (Fe3C ) 2H+ + 2ē H2
водородная деполяризация
раствор: Fe2+ + 2Cl– + H2
Fe3C - цементит
-Fe - феррит
например, стали и чугуны
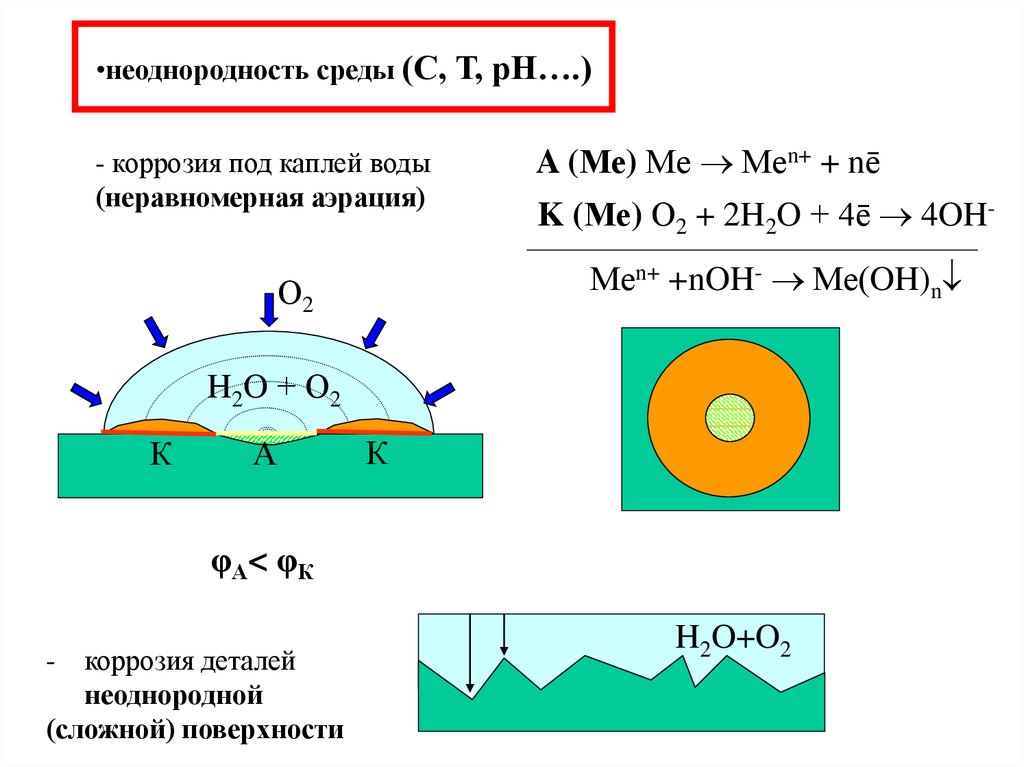
14. неоднородность среды (С, Т, рН….)
•неоднородность среды (С, Т, рН….)- коррозия под каплей воды
(неравномерная аэрация)
A (Ме) Ме Меn+ + nē
K (Ме) О2 + 2H2O + 4ē 4OHМеn+ +nOH- Ме(OH)n
О2
H2O + О2
К
А
К
φА< φК
коррозия деталей
неоднородной
(сложной) поверхности
-
H2O+O2
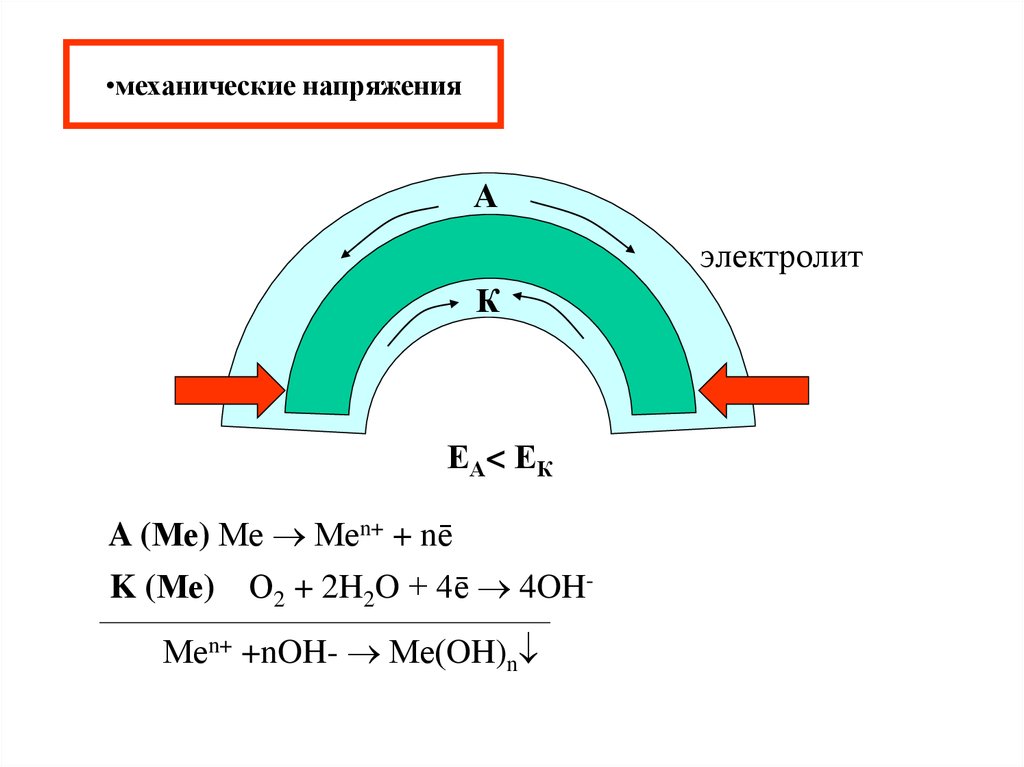
15. механические напряжения
•механические напряженияА
электролит
К
ЕА< ЕК
A (Ме) Ме Меn+ + nē
K (Ме) О2 + 2H2O + 4ē 4OHМеn+ +nOH- Ме(OH)n
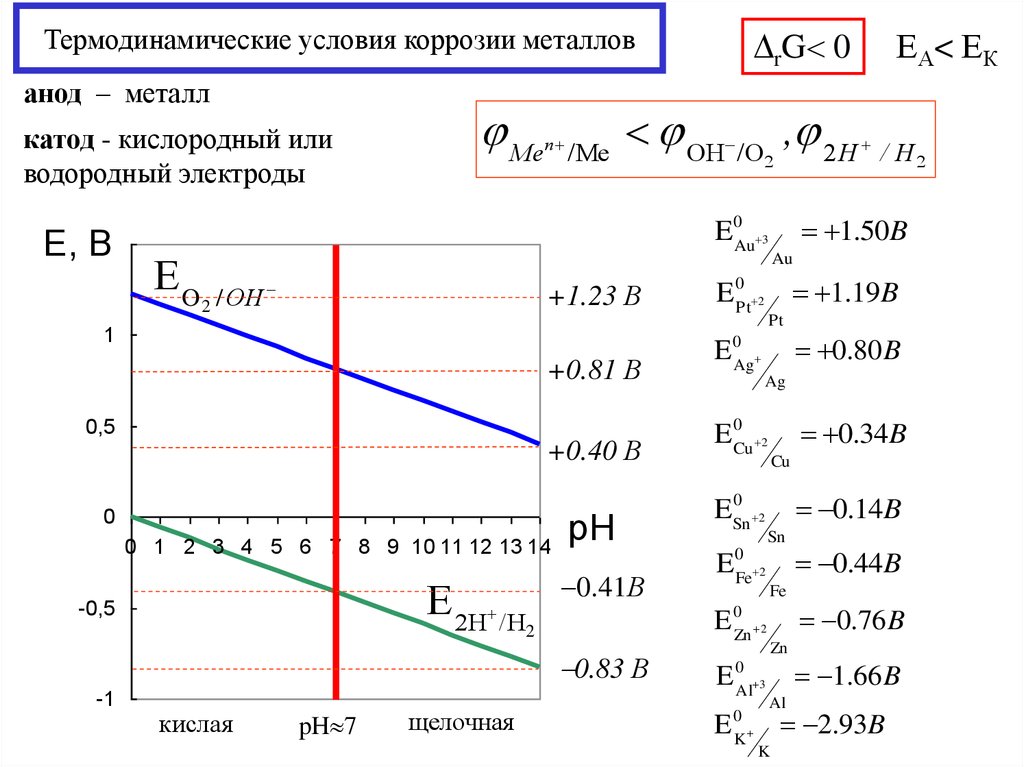
16. Термодинамические условия коррозии металлов
rG 0Термодинамические условия коррозии металлов
анод – металл
катод - кислородный или
водородный электроды
Е, 1,5
В
ЕO
Me
n
/Me
OH /O , 2 H / H
+1.23 В
1.50B
0,5
E 0Pt 2 1.19B
+0.40 В
E 0Cu 2
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Е 2Н /Н
-0,5
pH
0.41В
щелочная
Ag
0
ESn
2
E
0
Fe 2
0.34B
Cu
0.14B
Sn
E 0Al 3
E
0
K
0.44B
Fe
0.76 B
E 0Zn 2
2
0.83 В
pH 7
0.80 B
+0.81 В
E 0Ag
0
кислая
Au
Pt
1
-1
2
E0Au 3
2 / ОН
ЕА< ЕК
Zn
Al
1.66 B
2.93B
K
2
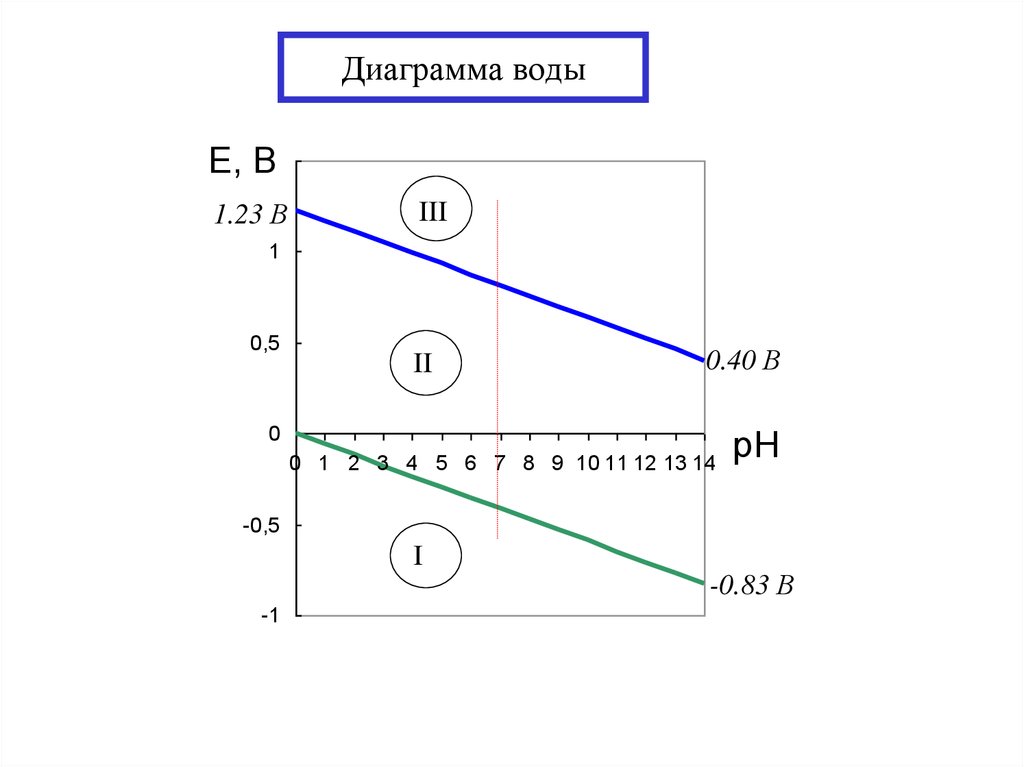
17. Диаграмма воды
Е, 1,5В
1.23 В
III
1
0,5
II
0.40 В
0
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
pH
-0,5
I
-1
-0.83 В
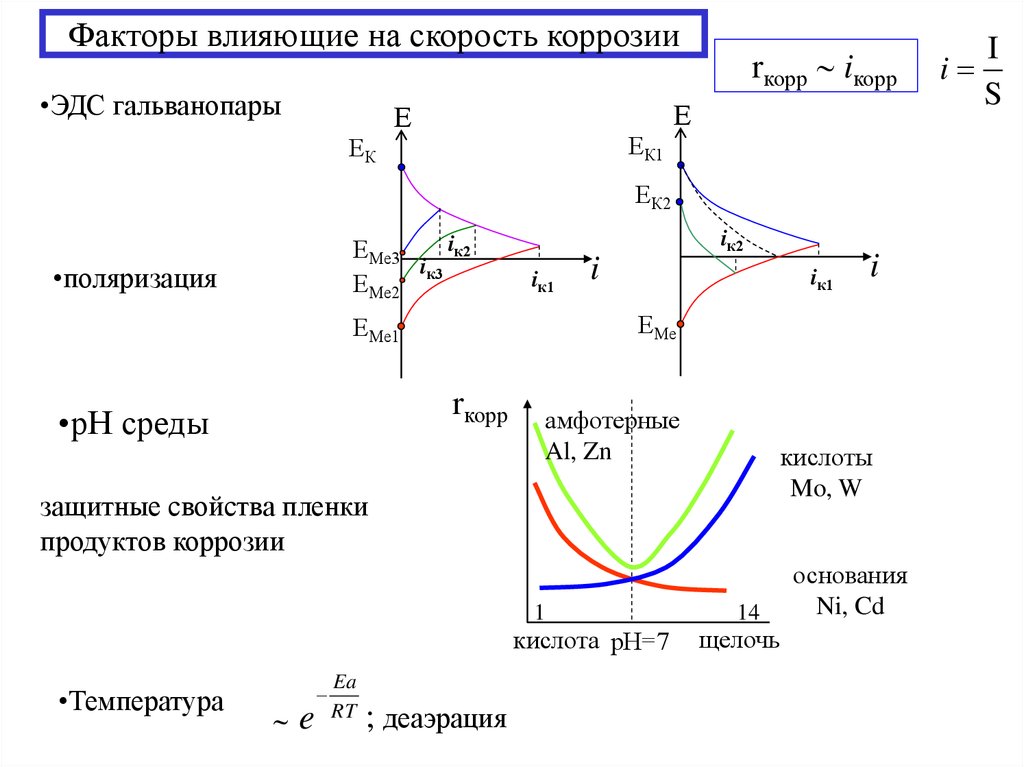
18. Факторы влияющие на скорость коррозии
•ЭДС гальванопарыrкорр iкорр
Е
Е
ЕК1
ЕК
ЕК2
iк2
ЕМе3
i
ЕМе2 к3
•поляризация
iк2
iк1
iк1
rкорр
амфотерные
Al, Zn
кислоты
Mo, W
защитные свойства пленки
продуктов коррозии
1
кислота рН=7
•Температура
e
Ea
RT
i
ЕМе
ЕМе1
•рН среды
i
; деаэрация
14
щелочь
основания
Ni, Cd
I
i
S







 chemistry
chemistry








