Similar presentations:
Коррозия
1.
Экзаменационные вопросы7. Коррозия металлов
1. Причина коррозионной неустойчивости металлов. Массовый и глубинный показатель скорости
коррозии. Оценка коррозионной стойкости металлов. Классификация коррозионных процессов.
2. Химическая коррозия. Высокотемпературная газовая коррозия. Схема роста оксидной пленки.
Законы роста оксидной пленки. Защитные свойства пленки.
3. Факторы, влияющие на скорость газовой коррозии. Водородная коррозия
4. Электрохимическая коррозия. Анодные и катодные реакции.
5. Случаи возникновения гальвано-пар, приводящих к электрохимической коррозии. Способы
защиты от коррозии.
2. 8. Коррозия металлов ( Ме - один из основных конструкционных материалов)
Самопроизвольныйфизико-химический
процесс
взаимодействия
материалов с внешней (коррозионной) средой, приводящий к их
разрушению или изменению их эксплуатационных характеристик.
Причина коррозии - термодинамическая неустойчивость системы,
состоящей из металла (Ме) и компонентов окружающей среды - ( rG 0)
Me0 MexOy; Me(OH)n; MexAny
металл:
Me0 Men+ + nē
окруж.среда: Ox + nē Ox-n
продукты коррозии
В основном, коррозия - это окисление Ме
[зависят от окружающей
компонентами-окислителями (Ox) газ. или
(внешней среды)]
жидкой окруж.среды и образование
продуктов коррозии (~20% потери Ме)
г
m
Массовый показатель K
[ 2
]
(скорость убыли массы Ме) S м сут
Скорость общей коррозии
(включ.скорость хим.реакции
так и диффузию реагентов
через продукты корроз. к Ме
h
Глубинный показатель П
(скорость проникновения)
[
мм
]
год
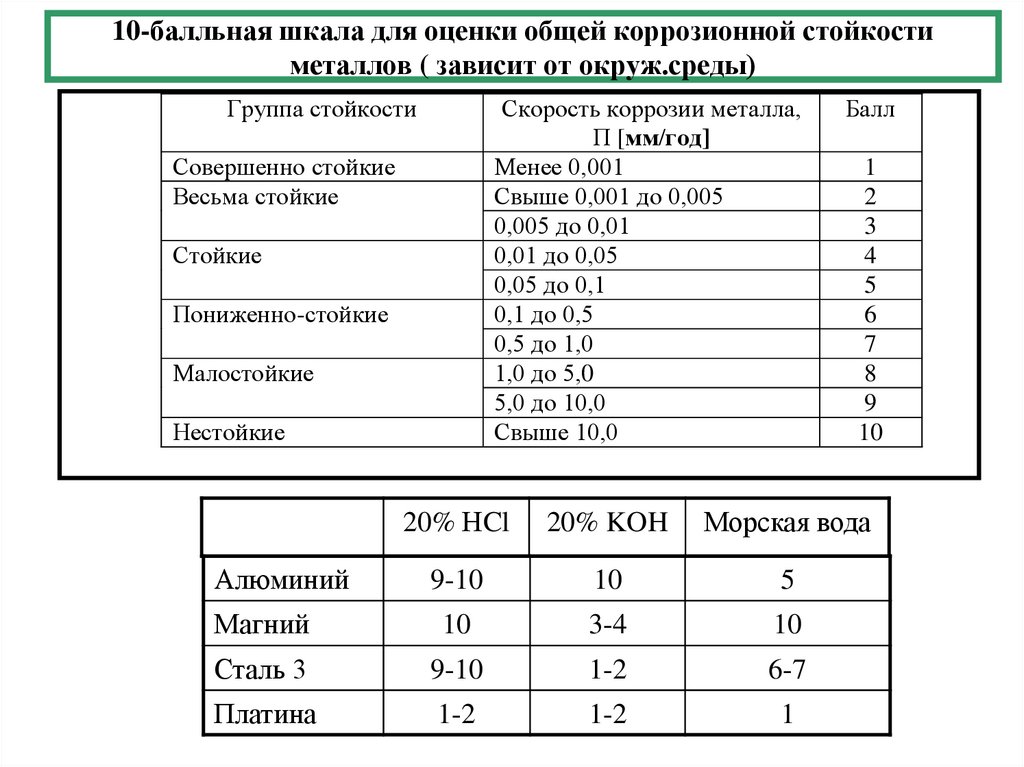
3. 10-балльная шкала для оценки общей коррозионной стойкости металлов ( зависит от окруж.среды)
Группа стойкостиСкорость коррозии металла,
П [мм/год]
Менее 0,001
Свыше 0,001 до 0,005
0,005 до 0,01
0,01 до 0,05
0,05 до 0,1
0,1 до 0,5
0,5 до 1,0
1,0 до 5,0
5,0 до 10,0
Свыше 10,0
Совершенно стойкие
Весьма стойкие
Стойкие
Пониженно-стойкие
Малостойкие
Нестойкие
Балл
1
2
3
4
5
6
7
8
9
10
20% НCl
20% KOH
Морская вода
9-10
10
5
Магний
10
3-4
10
Сталь 3
9-10
1-2
6-7
Платина
1-2
1-2
1
Алюминий
4. Классификация коррозионных процессов - по различным признакам, в частности:
Классификация коррозионных процессов по различным признакам, в частности:• по геометрическому характеру
коррозионных разрушений поверхности
или объёма металла. Различают:
Сплошная (или общая) коррозия:
равномерная; неравномерная
Местная (локальная или
точечная): пятна; язвы; питтинг
Газовая
• по составу коррозионной среды:
Атмосферная
В жидких средах: электролитах
и неэлектролитах ...(Почвенная)
Химическая коррозия
• по механизму коррозионного процесса:
• по характеру дополнительных
воздействий с действием корр.среды:
Электрохимическая коррозия
Механические нагрузки
Радиация; блуждающие токи…
5. 8.1 Химическая коррозия
Гетерогенная окислительно-восстановительная реакция (между Ме иокислителем окруж.среды). Окисление металла и восстановление окислителя
окружающей среды протекает в одном акте при непосредственном переходе
электронов металла на окислитель с образованием продуктов коррозии.
Коррозионная(окруж.) среда при хим.корр. не проводит электрический ток
→От вида среды - коррозия газовая и корр.в жидкостях (неэлектропроводных)
Высокотемпературная газовая коррозия [нет конденсации паров окислителя]
окислитель - газ: атмосферный кислород (О2); [СО2; пары воды; SO2; Cl2; …]
Для большинства Ме при взаимодействии с О2 ∆G < 0 – самопризв.окисление:
*) xMe + y/2 O2 = MexOy - оксидная пленка Ме – (МехОу)
тв.
газ
тв.
*) это гетерогенная химическая реакция с изменением поверхности Ме
на границе раздела металл-газовая среда. При этом возникает пленка
твёрдых продуктов окисления - так наз. оксидная плёнка Ме – (MexOy)
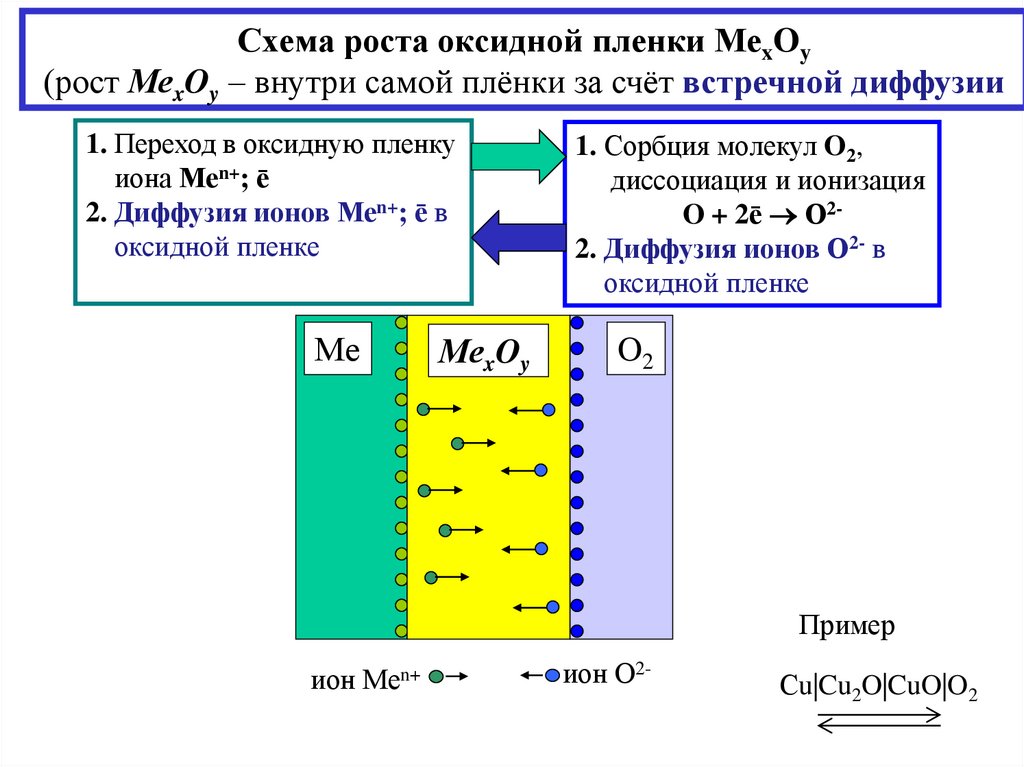
6. Схема роста оксидной пленки МеxOy (рост МеxOy – внутри самой плёнки за счёт встречной диффузии
1. Переход в оксидную пленкуиона Меn+; ē
2. Диффузия ионов Меn+; ē в
оксидной пленке
Ме
МеxOy
1. Сорбция молекул O2,
диссоциация и ионизация
O + 2ē О22. Диффузия ионов О2- в
оксидной пленке
O2
Пример
ион Меn+
ион О2-
Сu|Cu2O|CuO|O2
7. Кинетика роста оксидных пленок (определяется свойствами оксидной пленки и температурой)
Уравн.роста оксидной пленки для газ. коррозии: xMeтв. + y/2 O2 газ = MexOy тв. (*)Скорость коррозии r - это зависимость толщины окс. пленки ( ) от времени(t);
r –скорость газовой коррозии, имеет две формы кинетического уравнения:
d
дифференциальное уравнение - r =
dt
интегральное уравнение
-
= f(t)
Коррозия - гетерогенная хим.реакция (может протекать в кинетич. или
диффузионном режиме → разные законы изменения во времени
- лимитируется скоростью химической реакции - (ЗДМ) или
- лимитируется скоростью диффузии – подвода (отвода) регентов – (з-н Фика)
Если лимитирующая стадия - химическая реакция (плёнка несплошная,
пористая). Закон действующих масс (ЗДМ) для реакции окисления Ме[см.(*)]:
d
r k p
dt
pO2 const
у/2
O2
k
d k dt
(t) k t const
Линейный закон роста
(щелочные и щ/з Ме)
8. Кинетика роста оксидных пленок
2. Лимитирующая стадия диффузия (наличие сплошной оксидной плёнки).Скорость коррозии (роста пленки) определяется законами диффузии(С-конц.О2):
d
k " d k " dt
D grad C
“
dt
k = -D ‧ С среда – пост.
D – конст.диффузии
С среда – пост. С О2
Ссреда
С Cпов Ссреда
grad C
x
Спов 0
3. D 0 при ↑ (t),
(t ) max const
40 нм – тонкие, невидимые пленки
~ 40 - 500 нм – «цвета побежалости»
500 нм – «окалина»,
где - толщина плёнки
1 2 k " t const
2
(k=2k“)
(t ) k t const
Параболический закон роста
плёнки (Fe, Co, Ni, Cu и др.)
(t ) ln k t b
Логарифмический закон роста
(Al, Cr)-замедление диффузии
при росте толщины плёнки
9.
кинетика роста пленкитолщина
(t ) k t
(t ) k t а
(t ) ln k t b
время
10. Факторы, влияющие на скорость газовой коррозии (определяется св-вами оксидной пленки)
1. Защитные свойства пленок – определяет природа Ме• сплошность [α = VMeO / V Me ; 1,2<α<1,6] ЗАЩИТА :
фактор Бэдвордса-Пиллинга
•легирование Ме
• адгезия (сцепление с поверхностью Ме)
•защитные покрытия
• механические (прочностные) свойства
(высокотемпературные)
• коэффициент линейного расширения Ме и МеО
2. Температура (возрастание скорости газ.коррозии с ростом Т (по экспоненте)
e
Ea
RT
•изменение кинетического закона роста пленок от Т (линейный↔параболич);
•разрушение пленок при колебании Т (термич.напряжения→трещины)
3. Состав газовой среды
•рост концентрации (парциальное давление) газаокислителя→рост скорости коррозии(диффузии)
• примеси - пары H2O, соединен. S, СО2 и др. → рост
скорости коррозии
•защитные среды
(инертные газы,
вакуум)
11. 8.2 Водородная коррозия (охрупчивание)
Уменьшение пластичности металла (охрупчивание) в газовой средесодержащий водород (Н2) из-за растворения водорода в металле =>
разрушение Ме конструкций при эксплуатации (механич.напряжениях)
Протекают процессы:
1. Сорбция водорода на поверхн-ти Ме с последующей диссоциацией: Н2 2 Н
2. Диффузия атомов Н в объём Ме (растворение Н в Ме)
Возможные процессы, приводящие к разрушению:
• Fe3C + 4H 3Fe + CH4 (но и в неуглеродистых сплавах – разрушение)
• Me + nH MeHn (теория «гидридов Ме», но и с Не2 - разрушение Ме)
• Теория «пузырей» - образование газовых микрополостей («пузырей») в
объеме металла [в полости рекомбинация: 2Н Н2, ] => устанавливается
равновесие : газ(Н2 ) в полость<=>газ (Н2 ) из полости при давлении 2000
ат → большие внутренние напряжения в объёме металла → потеря
пластичности (охрупчивание) → разрушение Ме при эксплуатации.
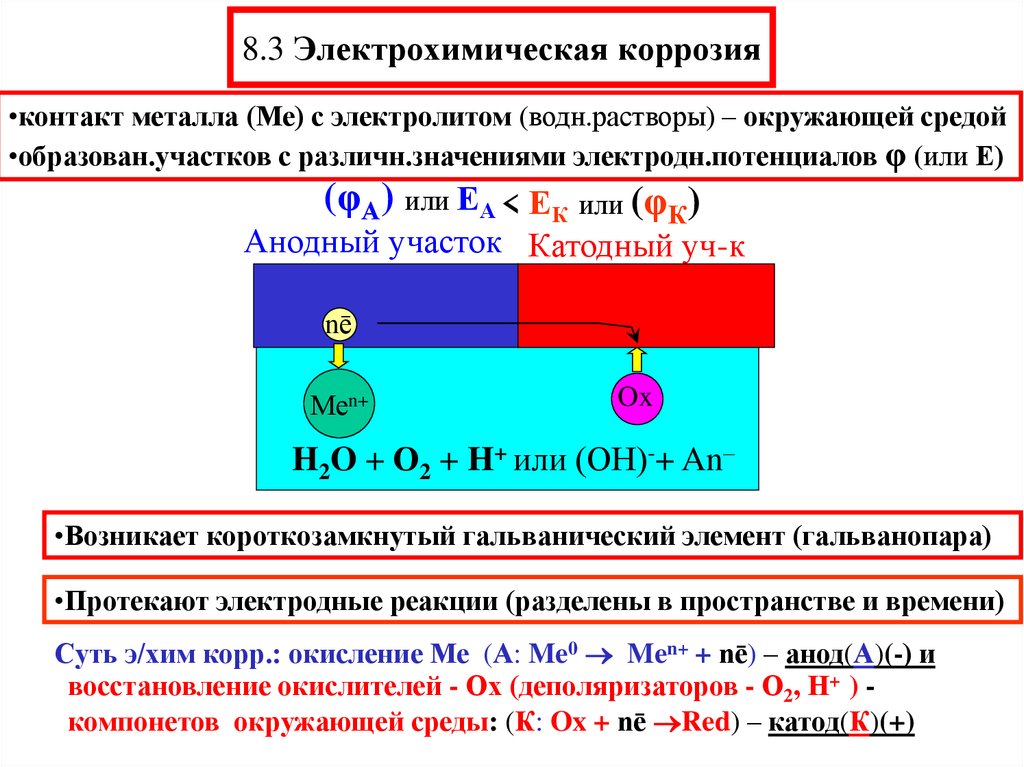
12. 8.3 Электрохимическая коррозия
•контакт металла (Ме) с электролитом (водн.растворы) – окружающей средой•образован.участков с различн.значениями электродн.потенциалов φ (или Е)
(φА) или ЕА < ЕК или (φК)
Анодный участок Катодный уч-к
Ме
nē
Меn+
Ox
H2O + О2 + H+ или (ОН)-+ An–
•Возникает короткозамкнутый гальванический элемент (гальванопара)
•Протекают электродные реакции (разделены в пространстве и времени)
Суть э/хим корр.: окисление Ме (А: Me0 Men+ + nē) – анод(А)(-) и
восстановление окислителей - Ох (деполяризаторов - О2, Н+ ) компонетов окружающей среды: (К: Ox + nē Red) – катод(К)(+)
13. Электродные реакции эл.хим.коррозии анодные – окисление Ме (А: Me0 Men+ + nē); катодные – восстановл. Ох окруж.среды
Электродные реакции эл.хим.коррозиианодные – окисление Ме (А: Me0 Men+ + nē); катодные –
восстановл. Ох окруж.среды (деполяризация) (К: Ox + nē Red)*)
Деполяризация – компенсация заряда в катодном процессе
(нет деполяризации катодного участка гальванопары – нет коррозии)
Окружающая среда - электролит: H2O + О2 + H+ + An– содержит Ох
От вида окислителя Ox (деполяризатора) окружающей среды могут
протекать следующие катодные реакции деполяризации (см.*):
Водородная деполяризация (Ох ≡ Н +)
К: 2H+ + 2ē → H2
pH 7 кисл.среда
φ= 0 В
К: 2H2O + 2ē →H2 + 2OH- pH 7 нейтр. или щелочн. φ=-0,41В
(2Н+ОН- + 2ē →H2 + 2OH-)
Кислородная деполяризация (Ох ≡ О2) К: О2 + 4H+ + 4ē → 2H2O pH 7 кислая среда
φ= +0,80 В
К: О2 + 2H2O + 4ē → 4OH- pH 7 нейтр.или щелочн.φ=+1,23 В
- (атмосферная коррозия или в воде, насыщенной кислородом )
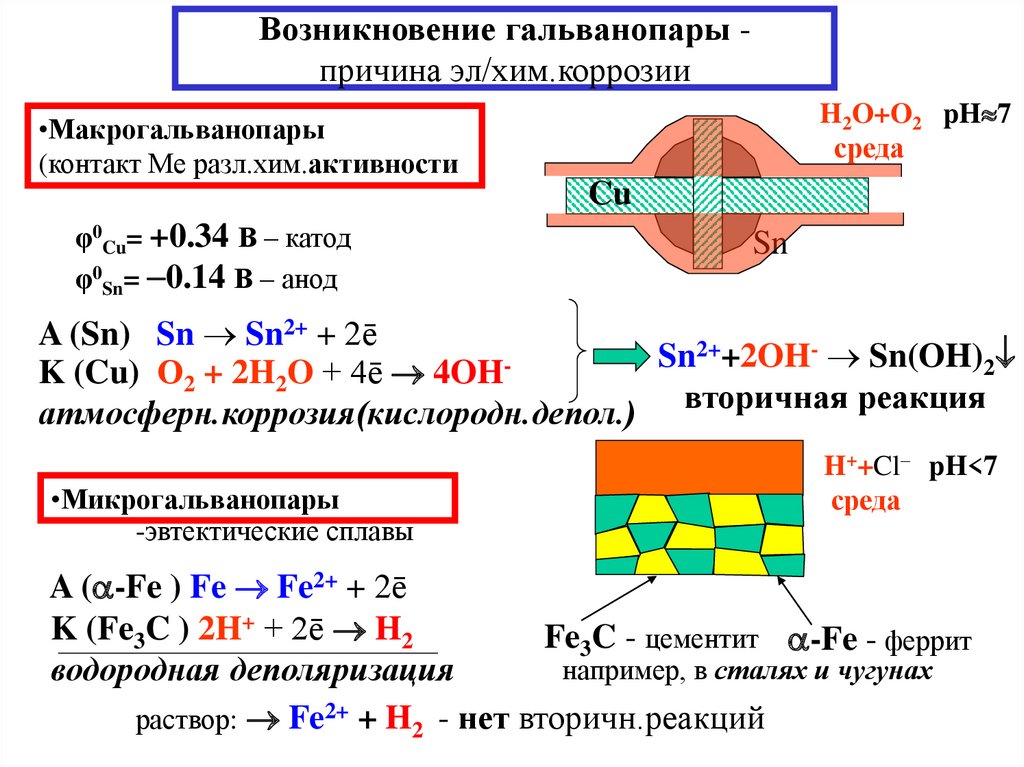
14. Возникновение гальванопары - причина эл/хим.коррозии
Возникновение гальванопары причина эл/хим.коррозииH2O+O2 pH 7
среда
•Макрогальванопары
(контакт Ме разл.хим.активности
Cu
φ0Cu= +0.34 В – катод
φ0Sn= 0.14 В – анод
Sn
A (Sn) Sn Sn2+ + 2ē
2++2OH- Sn(OH)
Sn
2
K (Cu) О2 + 2H2O + 4ē 4OH
атмосферн.коррозия(кислородн.депол.) вторичная реакция
•Микрогальванопары
-эвтектические сплавы
H++Cl– pH<7
среда
A ( -Fe ) Fe Fe2+ + 2ē
K (Fe3C ) 2H+ + 2ē H2
Fe3C - цементит -Fe - феррит
например, в сталях и чугунах
водородная деполяризация
раствор: Fe2+ + H2 - нет вторичн.реакций
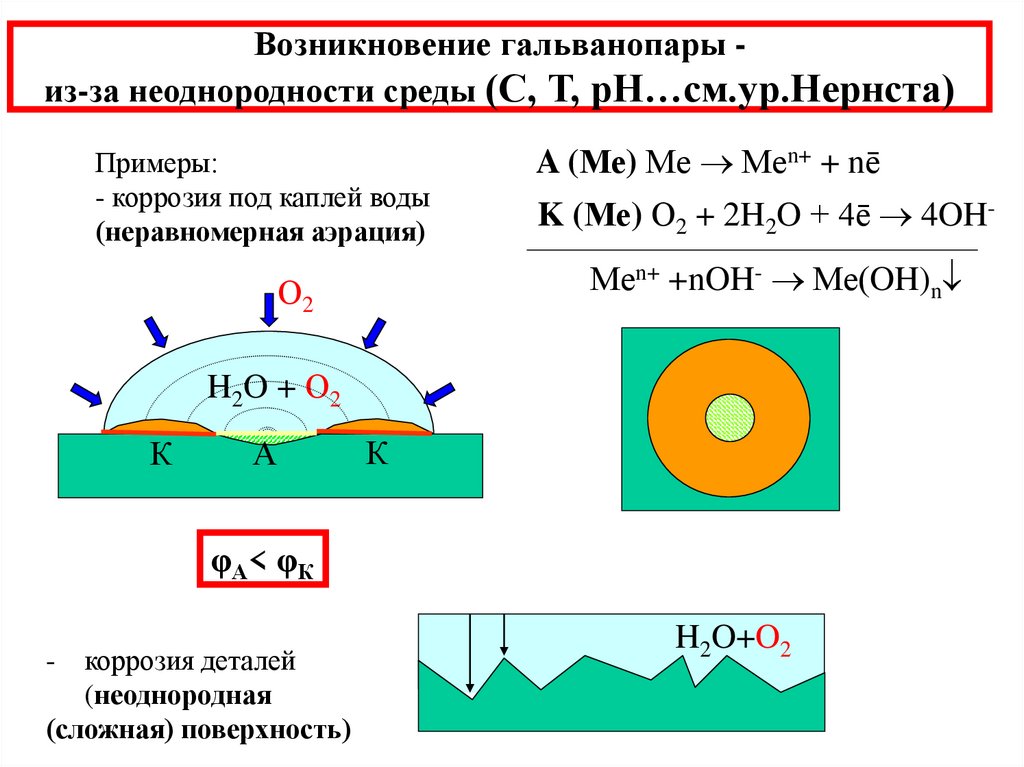
15. Возникновение гальванопары - из-за неоднородности среды (С, Т, рН…см.ур.Нернста)
Возникновение гальванопары из-за неоднородности среды (С, Т, рН…см.ур.Нернста)Примеры:
- коррозия под каплей воды
(неравномерная аэрация)
A (Ме) Ме Меn+ + nē
K (Ме) О2 + 2H2O + 4ē 4OHМеn+ +nOH- Ме(OH)n
О2
H2O + О2
К
А
К
φА< φК
коррозия деталей
(неоднородная
(сложная) поверхность)
-
H2O+O2
16. Возникновение гальванопары - из-за различия механических напряжений и обработки
Возникновение гальванопары из-за различия механических напряжений и обработкиА
электролит
К
ЕА< ЕК
A (Ме) Ме Меn+ + nē
K (Ме) О2 + 2H2O + 4ē 4OHМеn+ +nOH- Ме(OH)n
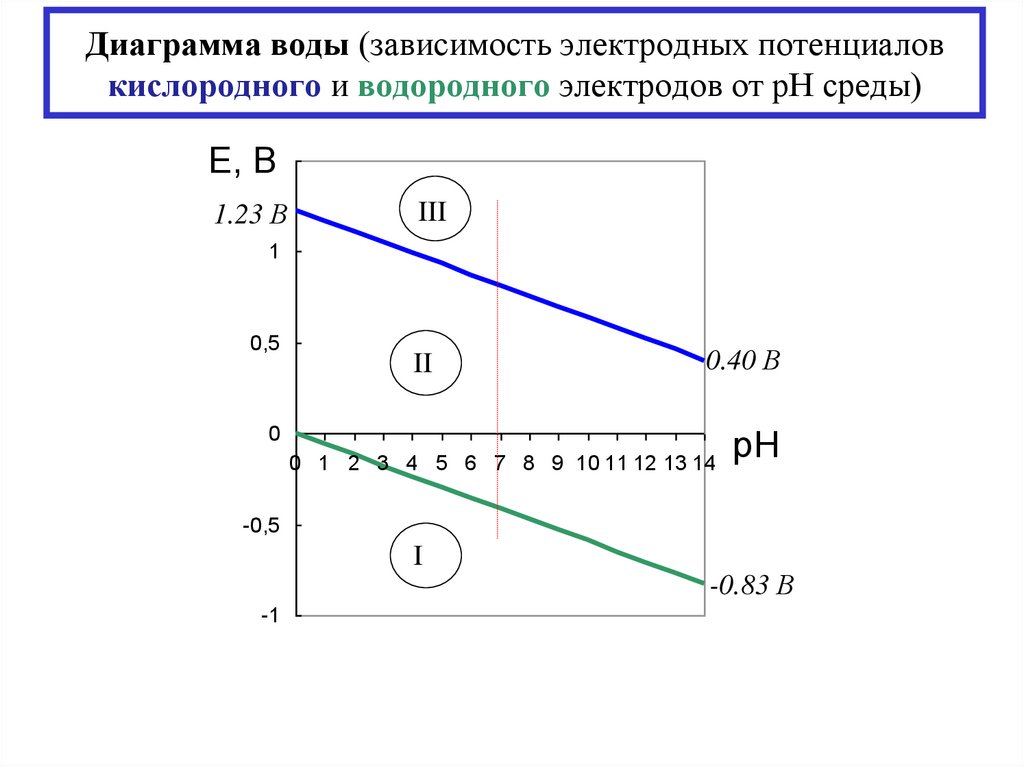
17. Диаграмма воды (зависимость электродных потенциалов кислородного и водородного электродов от рН среды)
Е, 1,5В
1.23 В
III
1
0,5
II
0.40 В
0
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
pH
-0,5
I
-1
-0.83 В
18. Термодинамические условия коррозии металлов
rG 0Термодинамические условия коррозии металлов
анод – металл
катод – кислородный или водородн. электроды
(протекают процессы кислородной или
водородной деполяризации)
Е, 1,5
В
ЕO
2
/ ОН
Men /Me OH /O , 2 H / H
+1.23 В
III
1
0,5
II
-0,5
-1
кислая
среда
pH 7
нейтр.
2
0.83 В
I
щелочная
среда
Pt
0.80 B
+0.40 В
0.41В
Au
1.19 B
E 0Pt 2
E 0Cu 2
pH
1.50 B
E 0Au 3
+0.81 В
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Е 2Н /Н
2
E 0Ag
0
ЕА< ЕК
Ag
0
ESn
2
E
E
0
Fe 2
0
Zn 2
0.34B
Cu
0.14 B
Sn
Fe
0.76 B
Zn
E 0Al 3
E 0K
0.44 B
1.66 B
Al
2.93B
K
2
19. Факторы влияющие на скорость эл.химической коррозии
rк U/R к = E/R к == Ек – ЕаМе /R к, где
Ек, ЕаМе – эл.потенц-л
ЕК1
Ек
ЕК2
iк3
• поляризация электродов
• рН среды
rк Iк i к
Е
Е
катодн.и анодн.участка; ЕаМе3
ЕаМе2
I к, i k, U, Е, R к ЕаМе1
ток, плотн.тока,
напряжение, ЭДС,
электрич.сопротивление
коррозии соответственно
• температура
Скорость
коррозии (rк)
e
Ea
RT
iк2
iк2
iк1
i
iк1
i
ЕаМе
• защитные свойства
пленки, продуктов коррозии
свойства среды
(защита от коррозии деаэрация среды)













 chemistry
chemistry








