Similar presentations:
Закон действующих масс и его применение к различным типам равновесий
1. ЗАКОН ДЕЙСТВУЮЩИХ МАСС И ЕГО ПРИМЕНЕНИЕ К различным типам РАВНОВЕСИЙ лектор – проф. Васюк С. А. 2016
ЗАКОН ДЕЙСТВУЮЩИХ МАСС И ЕГОПРИМЕНЕНИЕ К РАЗЛИЧНЫМ ТИПАМ
РАВНОВЕСИЙ
лектор – проф. Васюк С. А.
2016
2. План
1. Закон действующих масс. Константаравновесия
2. Типы констант равновесия.
Кислотно-основные реакции.
Реакции комплексообразования.
Реакции осаждения
Реакции окисления-восстановления.
3.
Закон действующих масс (ЗДМ):«Скорость химической реакции при
постоянной температуре
прямопропорциональна произведению
концентраций реагирующих веществ в
степени их стехиометрических
коэффициентов».
4.
Для равновесной химической реакции:aA + bB cC + dD
Скорость прямой реакции:
Скорость обратной реакции:
V1 = k1[A]a ∙ [B]b;
V2 = k2[C]c ∙ [D]d ,
где k1, k2 – константы скоростей прямой и обратной
реакции, постоянные при данной температуре;
[A], [B], [C], [D] – концентрации исходных веществ и
продуктов реакции, моль/л;
a, b, c, d – стехиометрические коэффициенты.
5.
k 1 С DK равн. К С
a
b
k 2 [A] [B]
с
d
6.
K0
равн.
К
0
Т
a
a
a a
c
C
a
A
d
D
b
B
где a , a , a , a - активности исходных веществ А и В и
продуктов реакции С и D.
A
B
C
D
7. Теория сильных электролитов
Активность (а) - это мера реального поведения вещества врастворе. Ее значение связано с молярной концентрацией иона:
а = f ∙ СМ,
где f – коэффициент активности, характеризующий степень
отклонения свойств реальных растворов от свойств идеальных
растворов.
Для бесконечно разбавленных растворов f=1, для реальных
растворов а< СМ.
Ионная сила раствора (I) равна полусумме произведений
концентраций отдельных ионов на квадрат их зарядов:
1
2
I Ci Zi
2
где Ci –концентрация иона, моль/л;
Zi – величина заряда иона.
8. Протолитическая теория кислот и оснований
НА Н+ + Аа1b1
В + Н+ НВ+
b2
а2
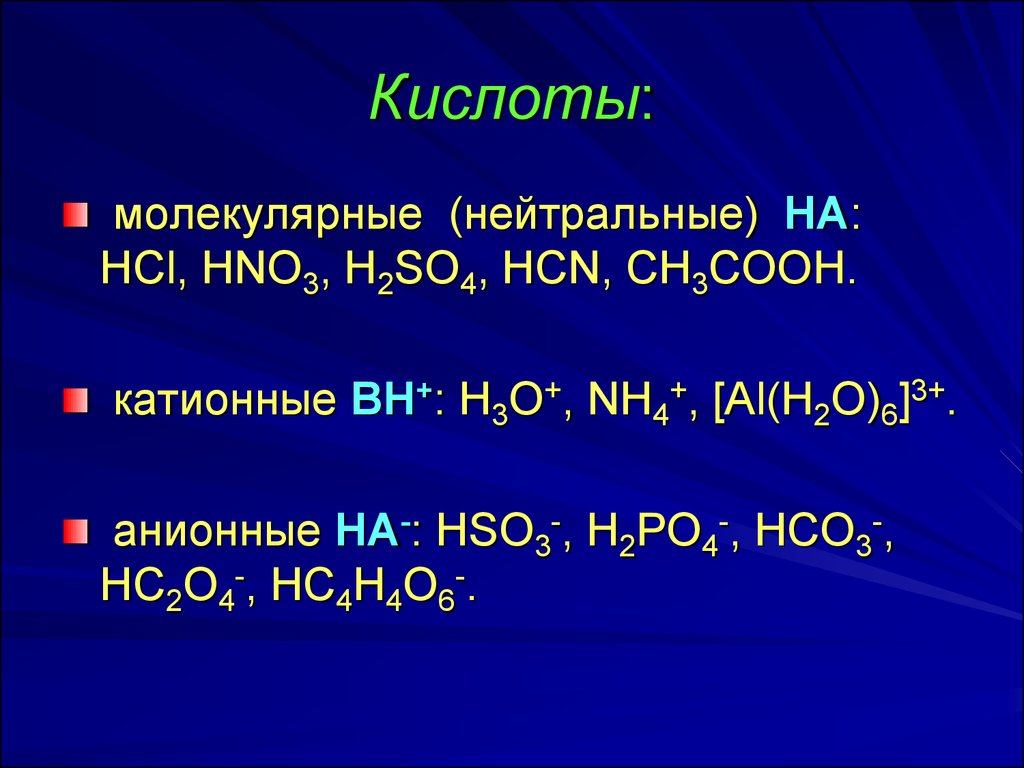
9. Кислоты:
молекулярные (нейтральные) НА:HCl, HNO3, H2SO4, HCN, CH3COOH.
катионные ВН+: H3O+, NH4+, [Al(H2O)6]3+.
анионные НА-: HSO3-, H2PO4-, HCO3-,
HC2O4-, HC4H4O6-.
10. Основания:
молекулярные (нейтральные) В: NH3,CH3-NH2, C6H5N, NaOH, H2N-NH2.
катионные В+: H2N-NH3+, [Zn(OH)(H2O)3]+.
анионные А-: Сl-, OH-, CN-, CH3СOO-, CO32-,
SO42-.
11. Амфолиты:
анионные кислоты, они же анионныеоснования НА-: HSO3-, H2PO4-, HCO3-.
нейтральные молекулы В: [Zn(OH)2(H2O)2].
катионные основания, они же катионные
кислоты В+: H2N-NH3+, [Zn(OH)(H2O)3]+.
12. Протолитические равновесия в воде
H2О H+ + OH-[ H ] [OH ]
KС
[H 2O]
В разбавленных растворах концентрация воды как растворителя
постоянна и равна 1000,0/18,0 = 55,56 моль/л.
[ H ] [OH ]
16
KС
1,86 10
[H 2O]
(при 25°С, табличные данные)
13. Протолитические равновесия в воде
КС∙[Н2О] = КН О = Кw = 1,86∙10-16 ∙55,56 =10-142
Kw = [H+] ∙ [OH-]
14. Протолитические равновесия в воде
рКw = - lg Kw = -lg 10-14 = 14рKw = рН + рОН
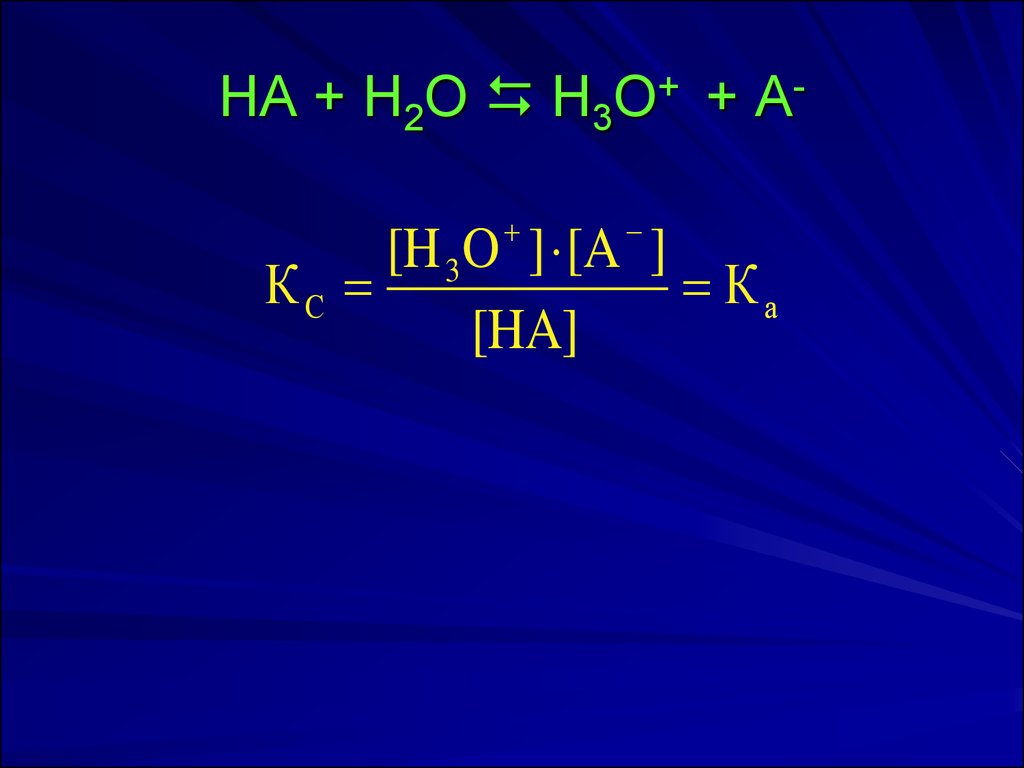
15. HA + H2О H3O+ + A-
HA + H2О H3O+ + A[H 3O ] [A ]
КС
Ка
[HA]
16. B + H2O BH+ + OH-
B + H2O BH+ + OH[BH ] [OH ]
Кb
[B]
17. закон разбавления (закон разведения) Оствальда:
CКi
1-
2
При α<<1
Кi C
2
18. Расчет рН
Для сильных кислот: HCl, HBr, HI, HNO3,H2SO4, HClO4.
pH = -lg[H+]
Для сильных оснований: КОН, NaOH, Ba(OH)2
pOH = -lg[OH-]
pH = pKw – pOH.
19. Расчет рН
Для слабых кислот:рН = ½ рKа – ½ lgСа
Для слабых оснований:
pН = 7 + ½ рКа + ½ lgCb
Для буферных систем :
C
рН = рКа + lg b
Cа
20. Константа образования или устойчивости β:
M + L ↔ [ML][ML]
1
[M] [L]
[ML] + L ↔ [ML2]
[ML 2 ]
2
[ML] [L]
M + nL ↔ [MLn]
[ML n ]
β
[M] [L] n
β = β1·β2…βn.
21. Ag+ + NH3 [AgNH3]+ [AgNH3]+ + NH3 [Ag(NH3)2]+
Ag+ + NH3 [AgNH3]+[AgNH3]+ + NH3 [Ag(NH3)2]+
[[AgNH 3 ] ]
β1
[Ag ] [NH 3 ]
[[Ag(NH 3 ) 2 ] ]
β2
[[AgNH 3 ] ] [NH 3 ]
[[Ag(NH 3 ) 2 ] ]
β
[Ag ] [NH 3 ]2
22. Константа нестойкости Кнест.
[Ag(NH3)2]+ Ag+ + 2 NH32
K нест.
[Ag ][NH 3 ]
[[Ag(NH 3 ) 2 ] ]
K нест.
1
;
β
β
1
К нест.
23.
Для электролитаКnАm ↔ nКm+ + mАn-
К равн.
а
n
K m
a
m
A n
a KnAm
a KnAm 1
ПР т а nК m а mА n
24.
Концентрационное произведение растворимости:ПРс = [Кm +]n ∙ [А n-]m
25.
Для BaSO4 – электролита однотипногосостава (бинарного электролита)
ПР BaSO 4 a Ba 2 a SO 2 4
2
ПР BaSO 4 [Ba ] [SO ]
24
26.
Для Cа3(РО4)2 – электролита неоднотипногосостава
ПР Ca 3 (P O4 ) 2 a
3
Ca 2
a
2
P O34 -
ПР Ca 3 (P O4 ) 2 [Ca 2 ] 3 [PO 34- ] 2
27.
Для бинарных электролитов:Р КА ПР КА
Для любых осадков:
Р КnАm n m
ПР К n А m
nn mm
ПР = mm ∙ nn ∙ Pm+n
28.
ПР Ca 3 (P O 4 ) 2 [Ca 2 ] 3 [PO 34- ] 2 2 ,0 10 29Р Ca 3 (P O4 ) 2 3 2
-29
ПР
2,0
10
7
5
7,13
10
моль/л
3
2
3 2
108
29. Реакции окисления-восстановления
Ox + nē RedE E
0
ox/red
Оx + nē + mH+ Red
RT a ox
ln
nF a red
30. Реакции окисления-восстановления
E EE E
0
0
ox/red
ox/red
RT a ox a
ln
nF
a red
m
H
0,0592 a ox a
lg
n
a red
ΔE = E01 - E0 2
m
H
31. Реакции окисления-восстановления
Fe3+ + ē Fe2+2I- - 2ē I2
E 0Fe 3 /Fe2 0,771 B
E
0
I 2 /2I
0,535 B
ΔE = 0,771 – 0,535 = + 0,236 B
32.
K р 10K р 10
(E 0Ox E 0R ed ) n 1 n 2
0,059
(E 0Ox E 0Red ) n 1 n 2
0,059
10
( 0 , 771 0 , 535) 2 1
0 , 059
10 1,2 10
8 ,1
8













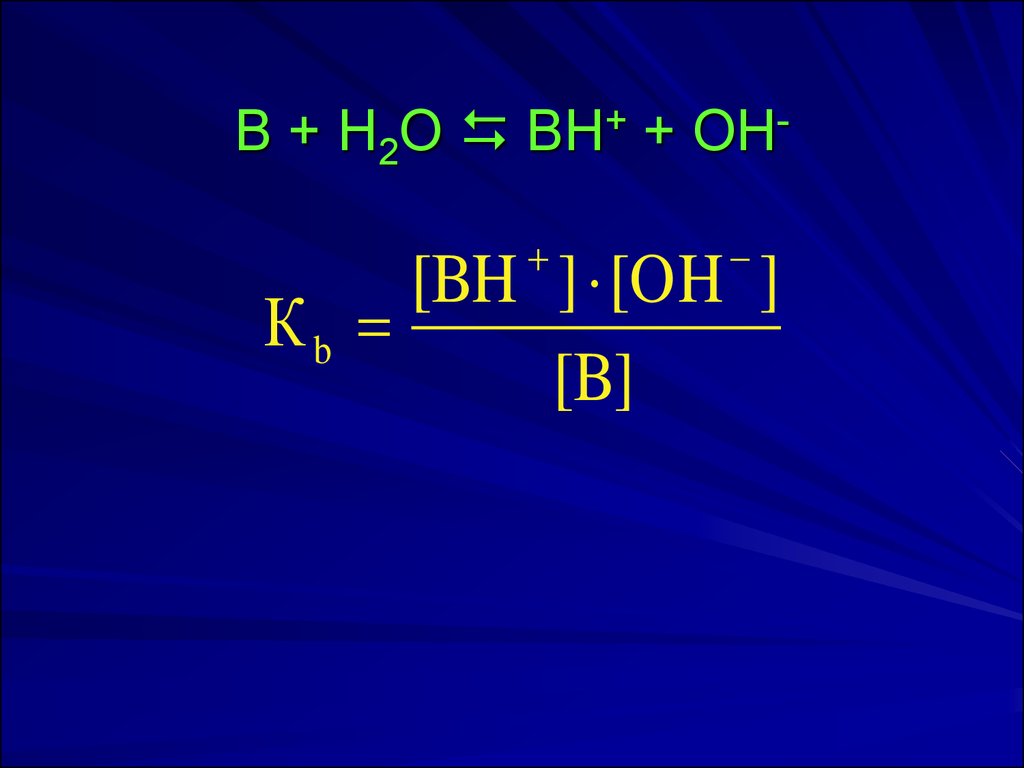




![Ag+ + NH3 [AgNH3]+ [AgNH3]+ + NH3 [Ag(NH3)2]+ Ag+ + NH3 [AgNH3]+ [AgNH3]+ + NH3 [Ag(NH3)2]+](https://cf.ppt-online.org/files/slide/0/0UxPZcH2zOj7Gt3MdJLW8NbDea9QIknCquflvA/slide-20.jpg)











 chemistry
chemistry








