Similar presentations:
(6 колл) Индигоидные ч1
1. Индигоидные красители
Часть 12.
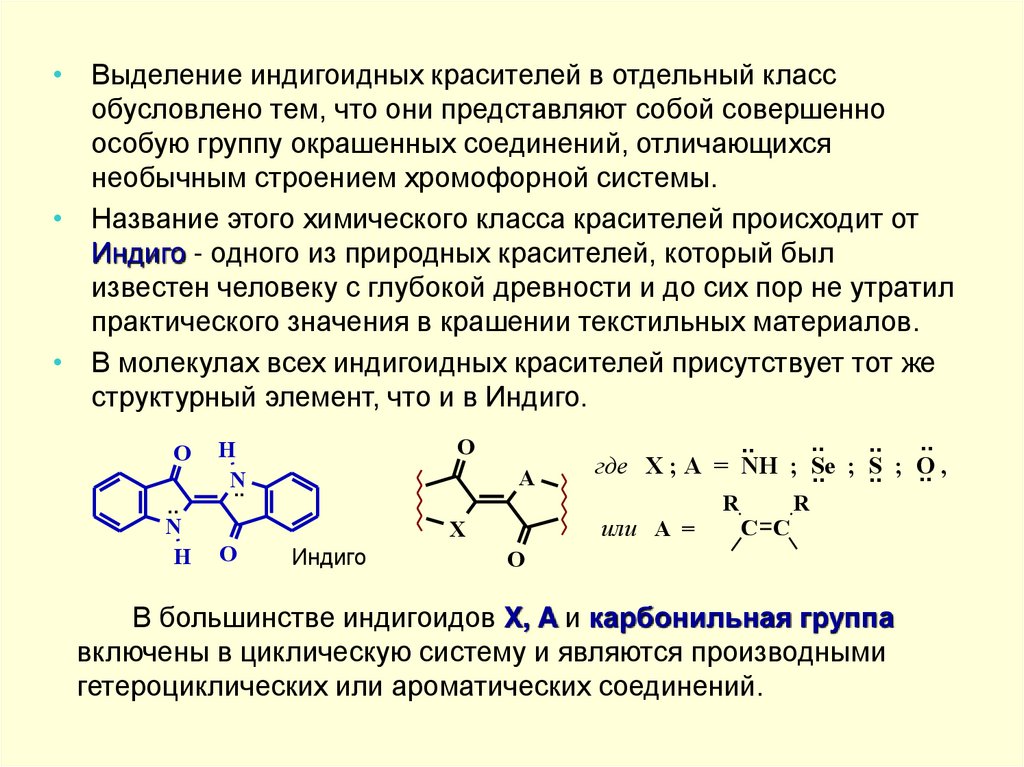
• Выделение индигоидных красителей в отдельный классобусловлено тем, что они представляют собой совершенно
особую группу окрашенных соединений, отличающихся
необычным строением хромофорной системы.
• Название этого химического класса красителей происходит от
Индиго - одного из природных красителей, который был
известен человеку с глубокой древности и до сих пор не утратил
практического значения в крашении текстильных материалов.
• В молекулах всех индигоидных красителей присутствует тот же
структурный элемент, что и в Индиго.
O
..
N
H
O
H
N
..
O
A
или A =
X
Индиго
..
..
..
..
где X ; A = NH ; Se
.. ,
.. ; S
.. ; O
R
C C
R
O
В большинстве индигоидов X, A и карбонильная группа
включены в циклическую систему и являются производными
гетероциклических или ароматических соединений.
3.
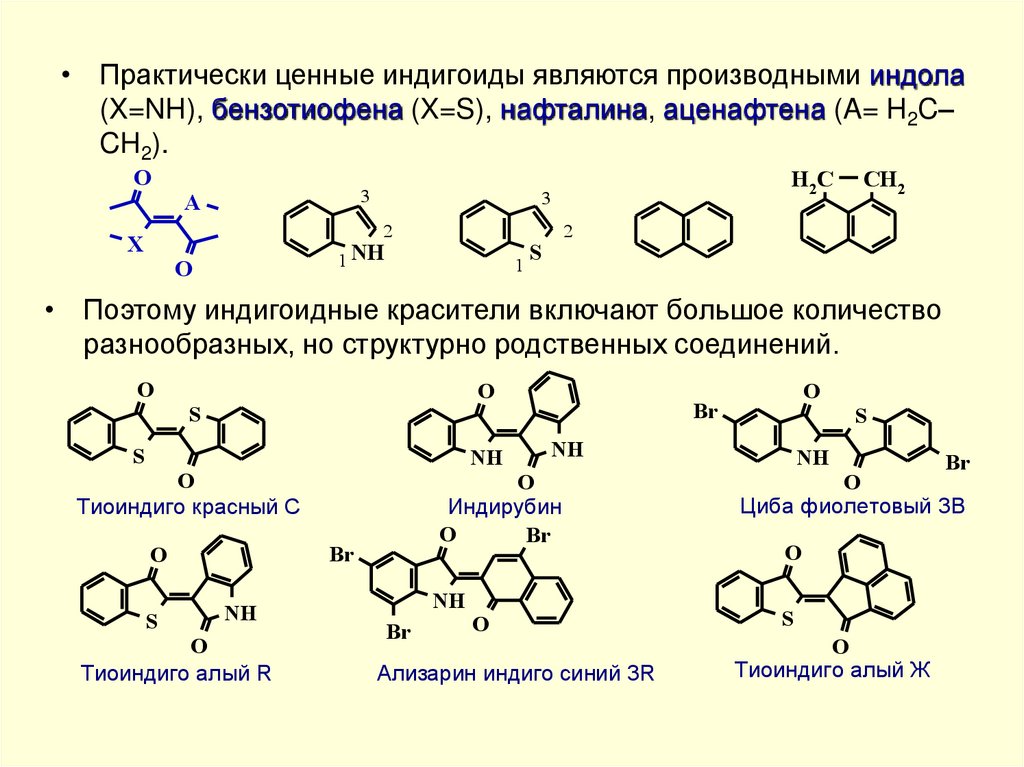
• Практически ценные индигоиды являются производными индола(X=NH), бензотиофена (X=S), нафталина, аценафтена (A= H2C–
CH2).
O
3
A
3
2
X
1 NH
O
H2C
1
CH2
2
S
• Поэтому индигоидные красители включают большое количество
разнообразных, но структурно родственных соединений.
O
O
S
S
NH
O
Тиоиндиго красный С
S
NH
O
Тиоиндиго алый R
NH
Br
S
NH
O
Индирубин
O
Br
Br
O
O
Br
O
Ализарин индиго синий 3R
NH
Br
O
Циба фиолетовый 3B
O
S
O
Тиоиндиго алый Ж
4.
OO
S
S
NH
O
Тиоиндиго красный С
S
NH
O
Тиоиндиго алый R
NH
Br
S
NH
O
Индирубин
O
Br
Br
O
O
Br
O
Ализарин индиго синий 3R
NH
Br
O
Циба фиолетовый 3B
O
S
O
Тиоиндиго алый Ж
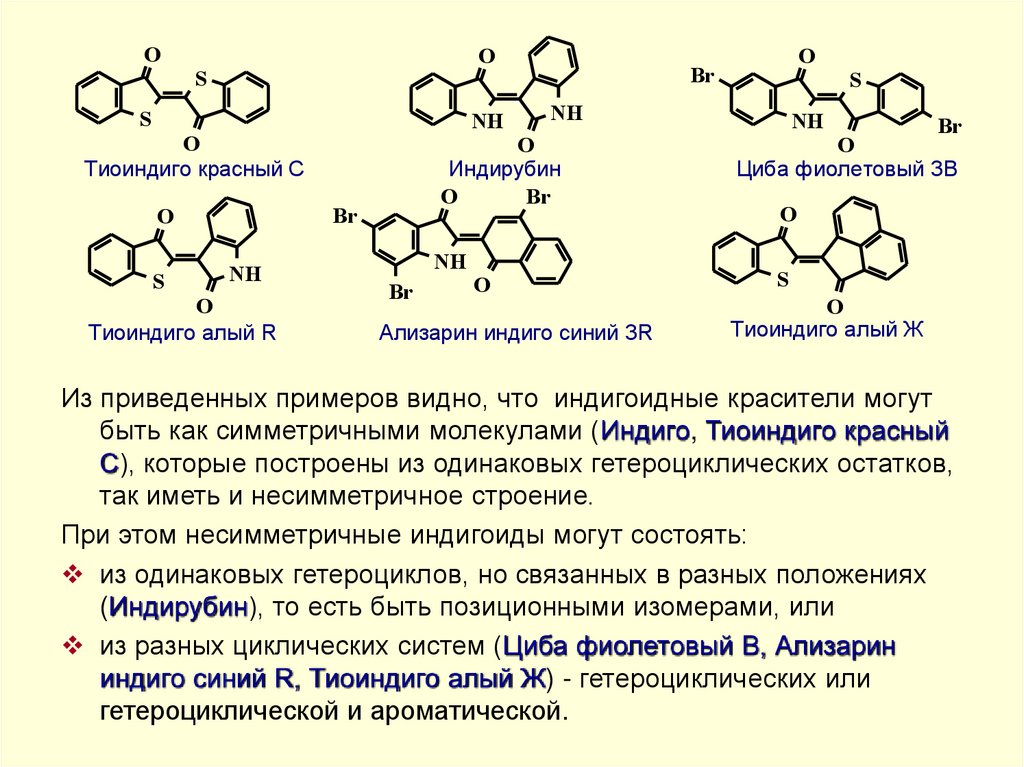
Из приведенных примеров видно, что индигоидные красители могут
быть как симметричными молекулами (Индиго, Тиоиндиго красный
С), которые построены из одинаковых гетероциклических остатков,
так иметь и несимметричное строение.
При этом несимметричные индигоиды могут состоять:
из одинаковых гетероциклов, но связанных в разных положениях
(Индирубин), то есть быть позиционными изомерами, или
из разных циклических систем (Циба фиолетовый B, Ализарин
индиго синий R, Тиоиндиго алый Ж) - гетероциклических или
гетероциклической и ароматической.
5.
• Химические названия индигоидов очень сложны, например,Индиго следует обозначить как (2E)-2-(3-оксо-1,3-дигидро2H-индол-2-илиден)-1,2-дигидро-3H-индол-3-он , поэтому
традиционно используют условные названия.
• Условные названия индигоидных красителей принято составлять путем перечисления гетероциклических и ароматических
систем, которые образуют краситель, с добавлением слова
«индиго». Кроме того, цифрами обозначаются положения, в
которых остатки исходных соединений связаны друг с другом
двойной связью.
• Очень важно, что в названии красителя указываются название
“родительского” цикла, а не производного, остатки которого
фактически входят в молекулу красителя:
– индол, а не индоксил,
– бензотиофен, а не гидроксибензотиофен,
– аценафтен, а не аценафтенхинон.
6.
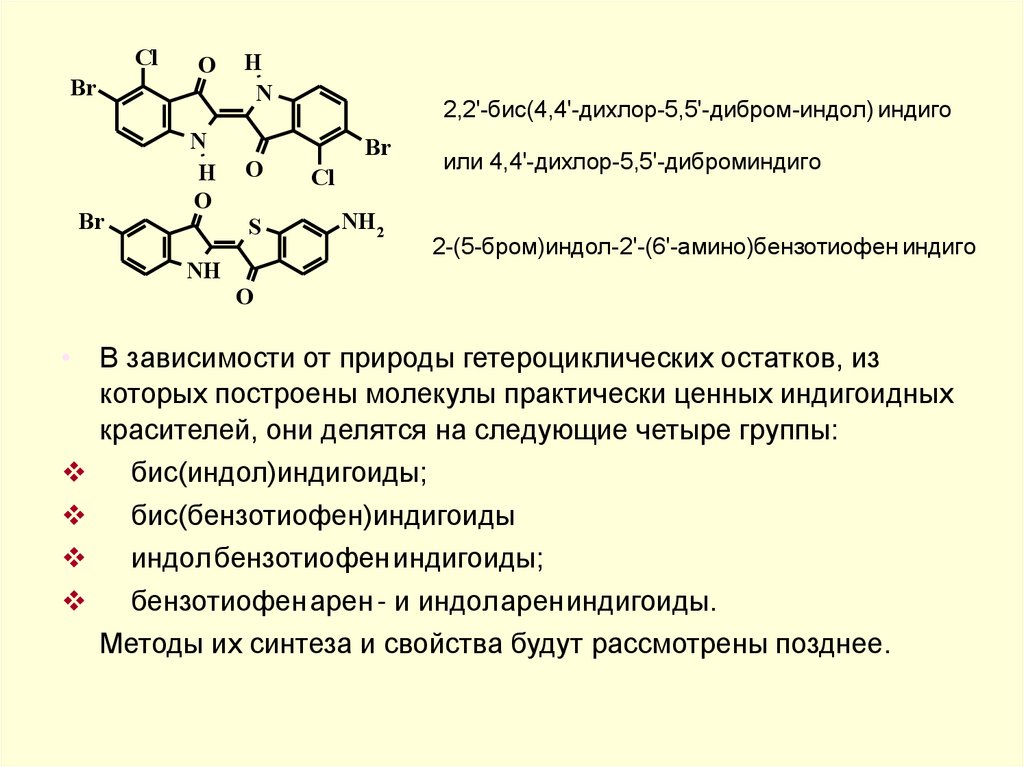
Тогда в соответствии с этими правилам вышеприведенныекрасители называются:
Индиго
2,2’-бис(индол)индиго
Индигорубин
2,3’-бис(индол)индиго
Циба фиолетовый 3B
2-индол-2’-бензотиофениндиго
Тиоиндиго красный С
2,2’-бис(бензотиофен)индиго
Ализарин индиго синий R 2-индол-2’-нафталининдиго
Тиоиндиго алый Ж
2-бензотиофен-2’-аценафтениндиго
Если в молекуле индигоида имеются заместители, их название
и положение указывают в скобках перед названием данного
гетероциклического фрагмента, например
7.
ClBr
Br
O
N
H
O
H
N
O
S
NH
2,2'-бис(4,4'-дихлор-5,5'-дибром-индол) индиго
Br
Cl
NH2
или 4,4'-дихлор-5,5'-диброминдиго
2-(5-бром)индол-2'-(6'-амино)бензотиофен индиго
O
• В зависимости от природы гетероциклических остатков, из
которых построены молекулы практически ценных индигоидных
красителей, они делятся на следующие четыре группы:
бис(индол)индигоиды;
бис(бензотиофен)индигоиды
индол бензотиофениндигоиды;
бензотиофен арен - и индоларениндигоиды.
Методы их синтеза и свойства будут рассмотрены позднее.
8. 10.1. Строение и хромофорная система Индиго
9.
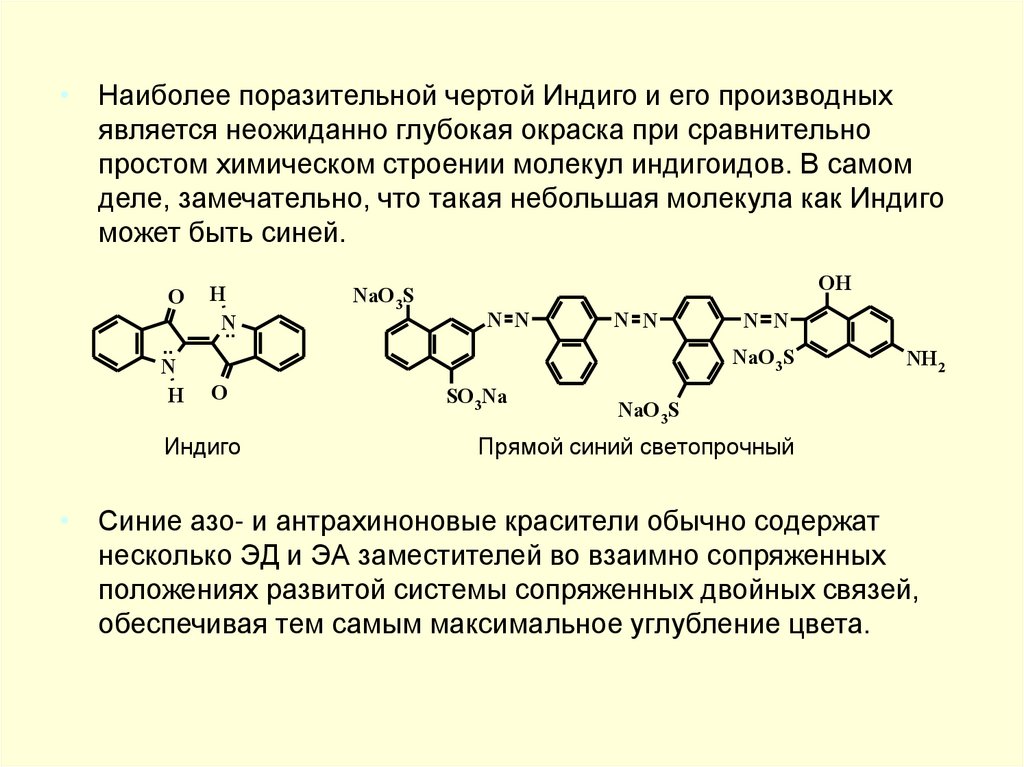
• Наиболее поразительной чертой Индиго и его производныхявляется неожиданно глубокая окраска при сравнительно
простом химическом строении молекул индигоидов. В самом
деле, замечательно, что такая небольшая молекула как Индиго
может быть синей.
O
..
N
H
H
N
..
NaO3S
OH
N N
N N
N N
NaO3S
O
Индиго
SO3Na
NH2
NaO3S
Прямой синий светопрочный
• Синие азо- и антрахиноновые красители обычно содержат
несколько ЭД и ЭА заместителей во взаимно сопряженных
положениях развитой системы сопряженных двойных связей,
обеспечивая тем самым максимальное углубление цвета.
10.
Многочисленные исследования показали, что феномен глубокойокраски Индиго объясняется:
особенным строением хромофорной системы индигоидов,
высокой полярностью молекул этих красителей,
значительным влиянием межмолекулярных взаимодействий,
способствующих углублению цвета.
существованием молекул в энергетически выгодной трансконформации,
Вклад этих факторов при формировании окраски различных групп
индигоидных красителей не одинаков и зависит:
от природы гетероатомов, входящих в состав хромофорной
системы, и
от дополнительных структурных элементов, которые влияют
на чувствительность молекул красителей к изменению среды и
агрегатного состояния.
Рассмотрим влияние этих факторов подробнее.
11. 10.1.1. Строение хромофора
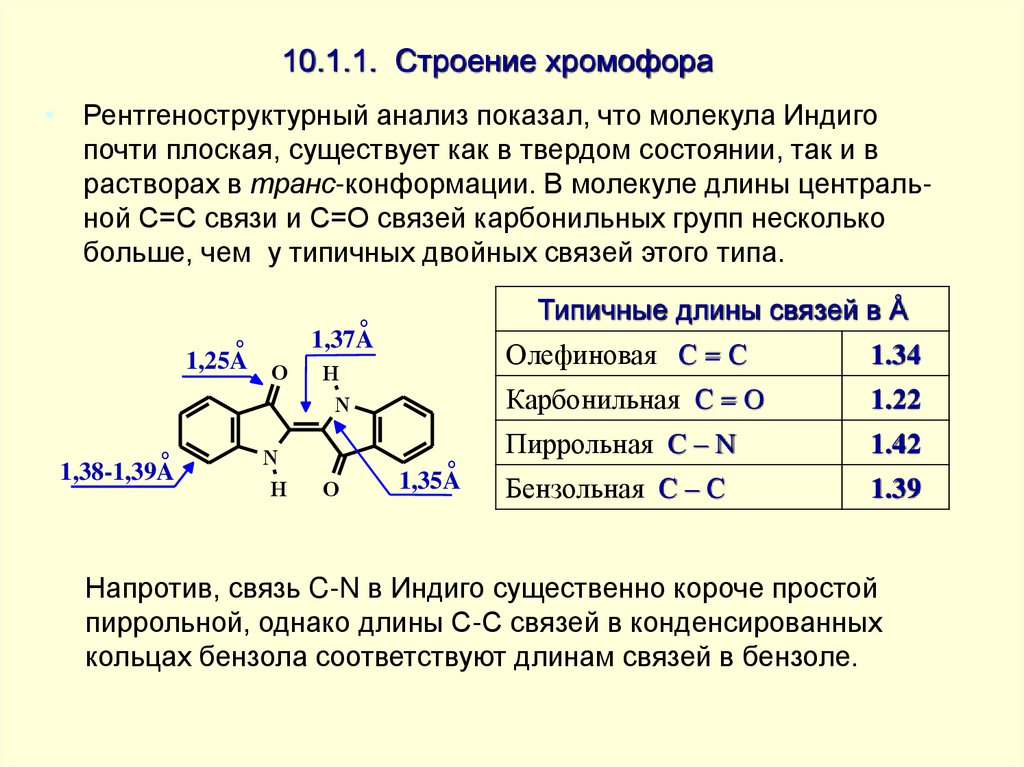
• Рентгеноструктурный анализ показал, что молекула Индигопочти плоская, существует как в твердом состоянии, так и в
растворах в транс-конформации. В молекуле длины центральной С=С связи и C=O связей карбонильных групп несколько
больше, чем у типичных двойных связей этого типа.
°
1,25A O
°
1,38-1,39A
Типичные длины связей в Å
°
N
H
1,37A
H
N
O
°
1,35A
Олефиновая С = С
1.34
Карбонильная С = O
1.22
Пиррольная C – N
1.42
Бензольная С – С
1.39
Напротив, связь C-N в Индиго существенно короче простой
пиррольной, однако длины С-С связей в конденсированных
кольцах бензола соответствуют длинам связей в бензоле.
12.
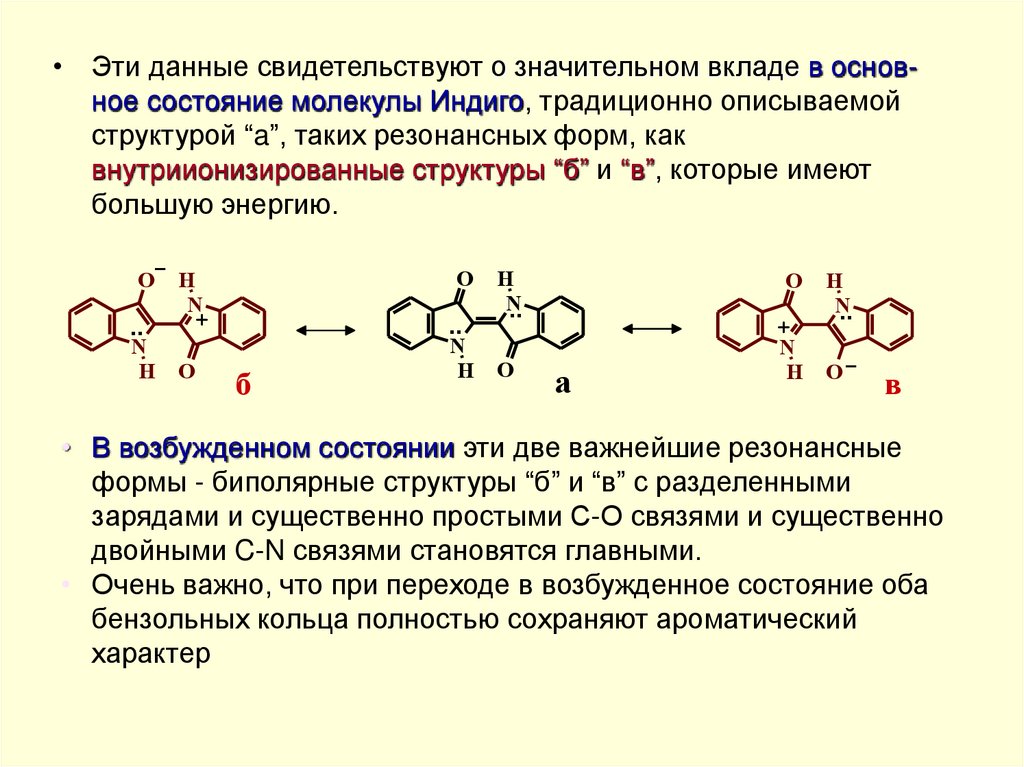
• Эти данные свидетельствуют о значительном вкладе в основное состояние молекулы Индиго, традиционно описываемойструктурой “a”, таких резонансных форм, как
внутриионизированные структуры “б” и “в”, которые имеют
большую энергию.
- H
O
+
..
O
..
N
H
N
O
б
N
H
H
N
..
O
O
+
а
N
H
H
N
..
O-
в
• В возбужденном состоянии эти две важнейшие резонансные
формы - биполярные структуры “б” и “в” с разделенными
зарядами и существенно простыми С-О связями и существенно
двойными C-N связями становятся главными.
• Очень важно, что при переходе в возбужденное состояние оба
бензольных кольца полностью сохраняют ароматический
характер
13.
Eб+в
E
O
..
N
H
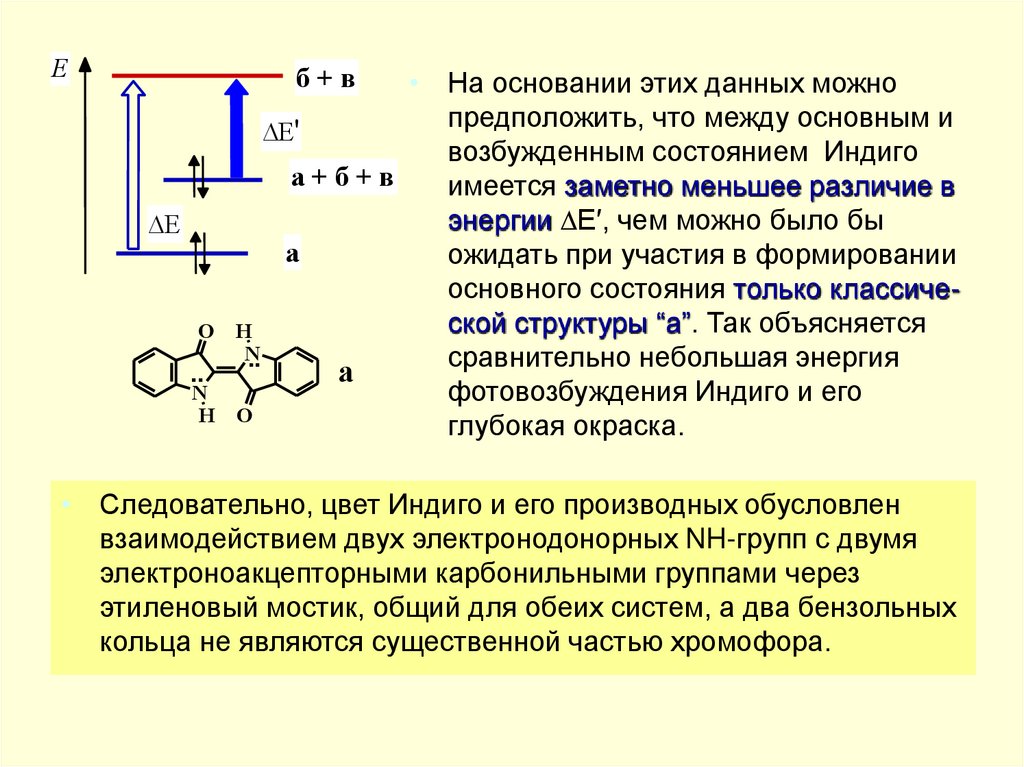
• На основании этих данных можно
предположить, что между основным и
E'
возбужденным состоянием Индиго
a+б+в
имеется заметно меньшее различие в
энергии E′, чем можно было бы
a
ожидать при участия в формировании
основного состояния только классической структуры “a”. Так объясняется
H
N
..
сравнительно небольшая энергия
а
фотовозбуждения Индиго и его
O
глубокая окраска.
• Следовательно, цвет Индиго и его производных обусловлен
взаимодействием двух электронодонорных NH-групп с двумя
электроноакцепторными карбонильными группами через
этиленовый мостик, общий для обеих систем, а два бензольных
кольца не являются существенной частью хромофора.
14.
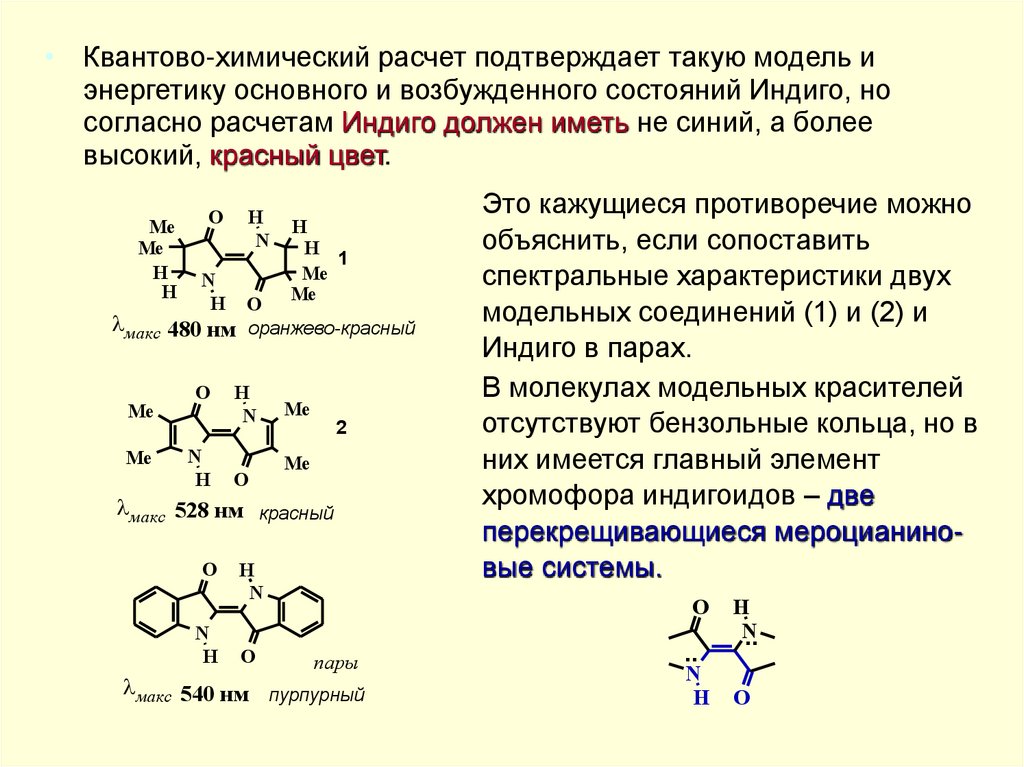
• Квантово-химический расчет подтверждает такую модель иэнергетику основного и возбужденного состояний Индиго, но
согласно расчетам Индиго должен иметь не синий, а более
высокий, красный цвет.
Me
Me
H
H
O
H
N
N
H
H
H
1
Me
Me
O
макс 480 нм оранжево-красный
Me
Me
O
N
H
H
N
O
Me
2
Me
макс 528 нм красный
O
N
H
H
N
O
Это кажущиеся противоречие можно
объяснить, если сопоставить
спектральные характеристики двух
модельных соединений (1) и (2) и
Индиго в парах.
В молекулах модельных красителей
отсутствуют бензольные кольца, но в
них имеется главный элемент
хромофора индигоидов – две
перекрещивающиеся мероцианиновые системы.
O
пары
макс 540 нм пурпурный
..
N
H
H
N
..
O
15.
MeMe
H
H
O
H
N
N
H
H
H
1
Me
Me
O
макс 480 нм оранжево-красный
Me
Me
O
N
H
H
N
O
Me
2
Me
макс 528 нм красный
O
N
H
H
N
O
пары
макс 540 нм пурпурный
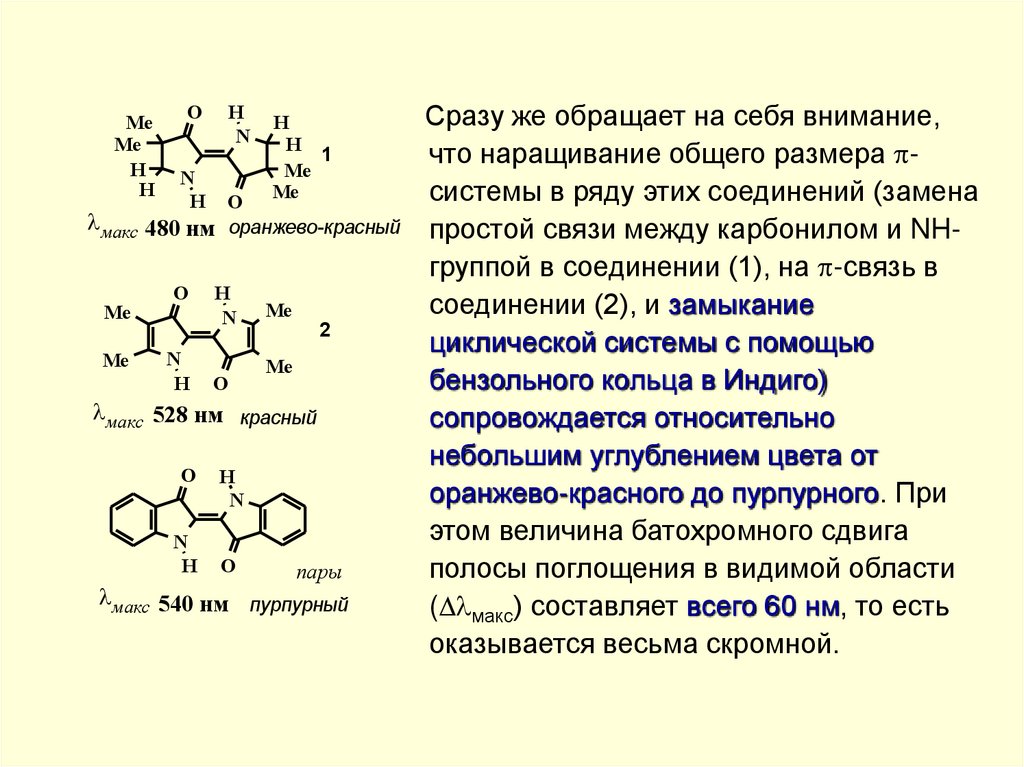
Сразу же обращает на себя внимание,
что наращивание общего размера системы в ряду этих соединений (замена
простой связи между карбонилом и NHгруппой в соединении (1), на -связь в
соединении (2), и замыкание
циклической системы с помощью
бензольного кольца в Индиго)
сопровождается относительно
небольшим углублением цвета от
оранжево-красного до пурпурного. При
этом величина батохромного сдвига
полосы поглощения в видимой области
( макс) составляет всего 60 нм, то есть
оказывается весьма скромной.
16.
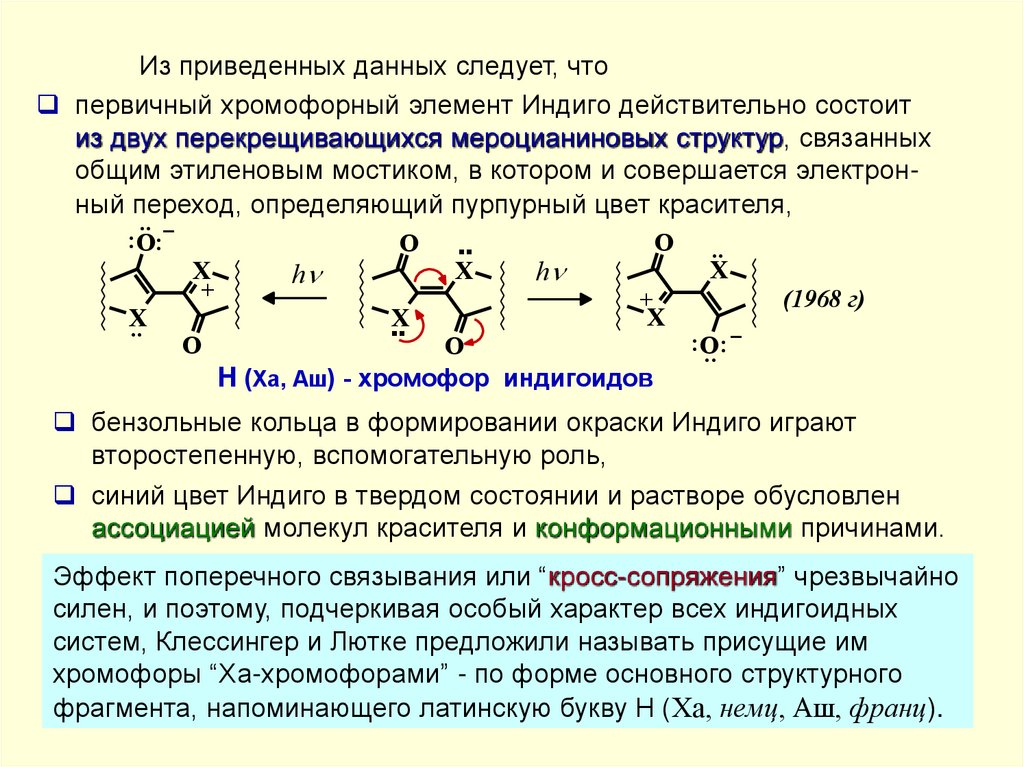
Из приведенных данных следует, чтопервичный хромофорный элемент Индиго действительно состоит
из двух перекрещивающихся мероцианиновых структур, связанных
общим этиленовым мостиком, в котором и совершается электронный переход, определяющий пурпурный цвет красителя,
..
:O:-
X
+
X
..
O
h
O
X
..
..
X
h
O
+
X
O
H (Ха, Аш) - хромофор индигоидов
..
X
(1968 г)
:O
.. :
бензольные кольца в формировании окраски Индиго играют
второстепенную, вспомогательную роль,
синий цвет Индиго в твердом состоянии и растворе обусловлен
ассоциацией молекул красителя и конформационными причинами.
Эффект поперечного связывания или “кросс-сопряжения” чрезвычайно
силен, и поэтому, подчеркивая особый характер всех индигоидных
систем, Клессингер и Лютке предложили называть присущие им
хромофоры “Ха-хромофорами” - по форме основного структурного
фрагмента, напоминающего латинскую букву H (Ха, немц, Аш, франц).
17. 10.1.2. Межмолекулярные взаимодействия
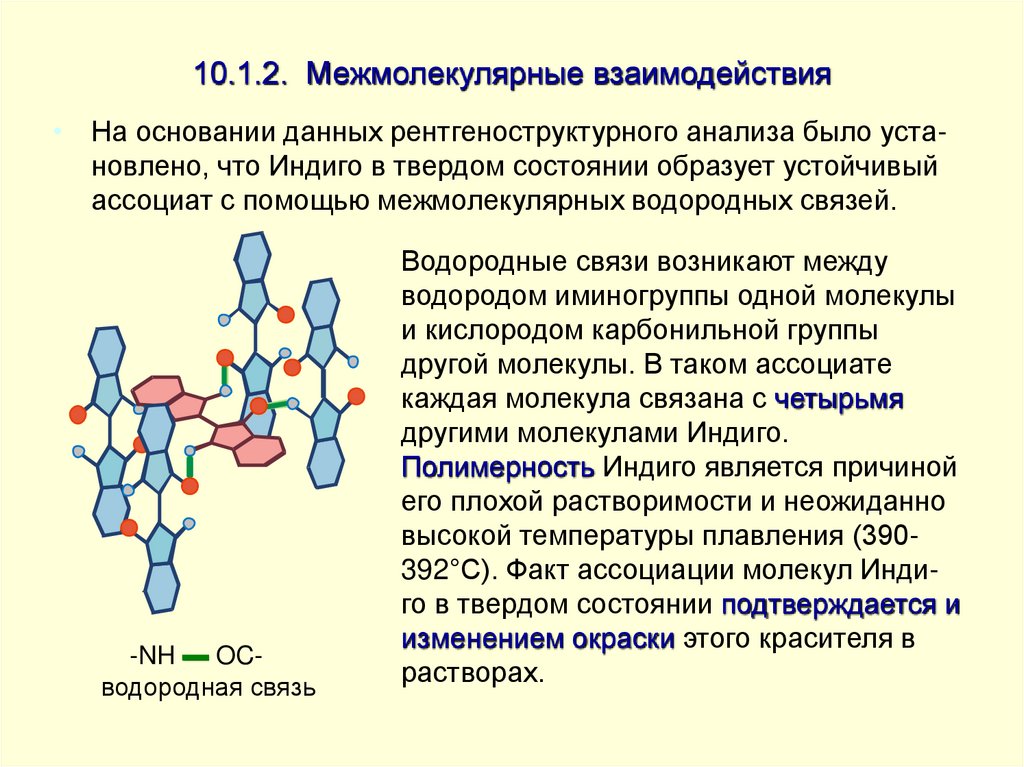
• На основании данных рентгеноструктурного анализа было установлено, что Индиго в твердом состоянии образует устойчивыйассоциат с помощью межмолекулярных водородных связей.
-NH ▬ OCводородная связь
Водородные связи возникают между
водородом иминогруппы одной молекулы
и кислородом карбонильной группы
другой молекулы. В таком ассоциате
каждая молекула связана с четырьмя
другими молекулами Индиго.
Полимерность Индиго является причиной
его плохой растворимости и неожиданно
высокой температуры плавления (390392°С). Факт ассоциации молекул Индиго в твердом состоянии подтверждается и
изменением окраски этого красителя в
растворах.
18.
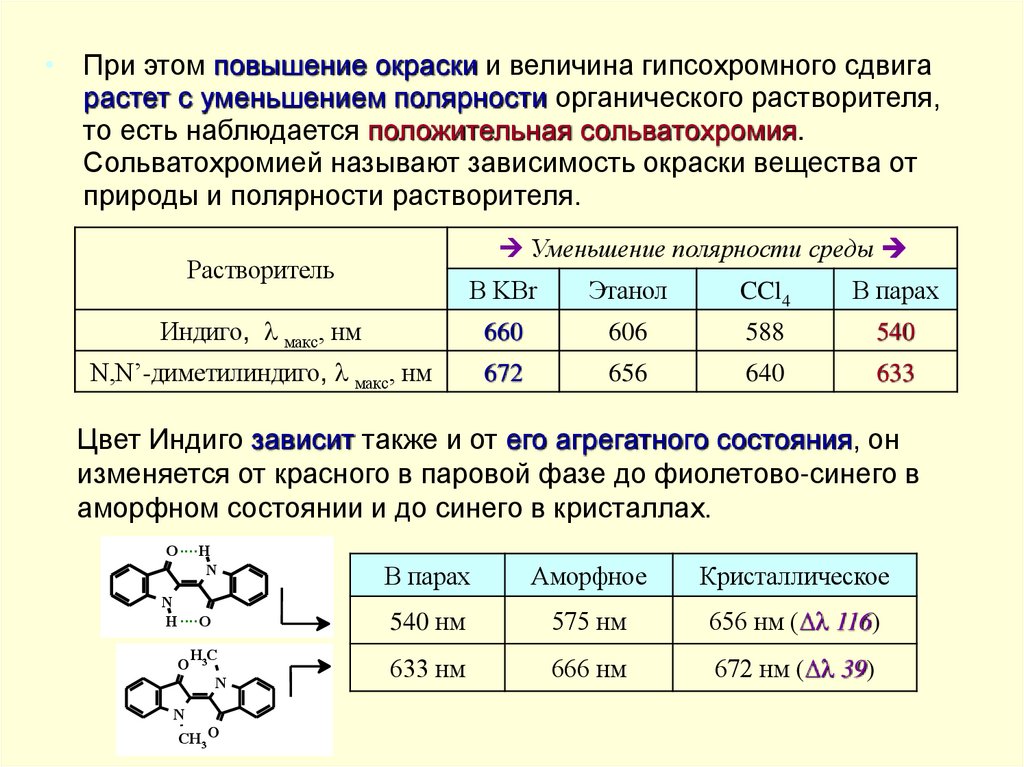
• При этом повышение окраски и величина гипсохромного сдвигарастет с уменьшением полярности органического растворителя,
то есть наблюдается положительная сольватохромия.
Сольватохромией называют зависимость окраски вещества от
природы и полярности растворителя.
Уменьшение полярности среды
Растворитель
В KBr
Этанол
CCl4
В парах
Индиго, макс, нм
660
606
588
540
N,N’-диметилиндиго, макс, нм
672
656
640
633
Цвет Индиго зависит также и от его агрегатного состояния, он
изменяется от красного в паровой фазе до фиолетово-синего в
аморфном состоянии и до синего в кристаллах.
O ....H
N
N
H ....O
O
H3C
N
N
CH3 O
В парах
Аморфное
Кристаллическое
540 нм
575 нм
656 нм ( 116)
633 нм
666 нм
672 нм ( 39)
19.
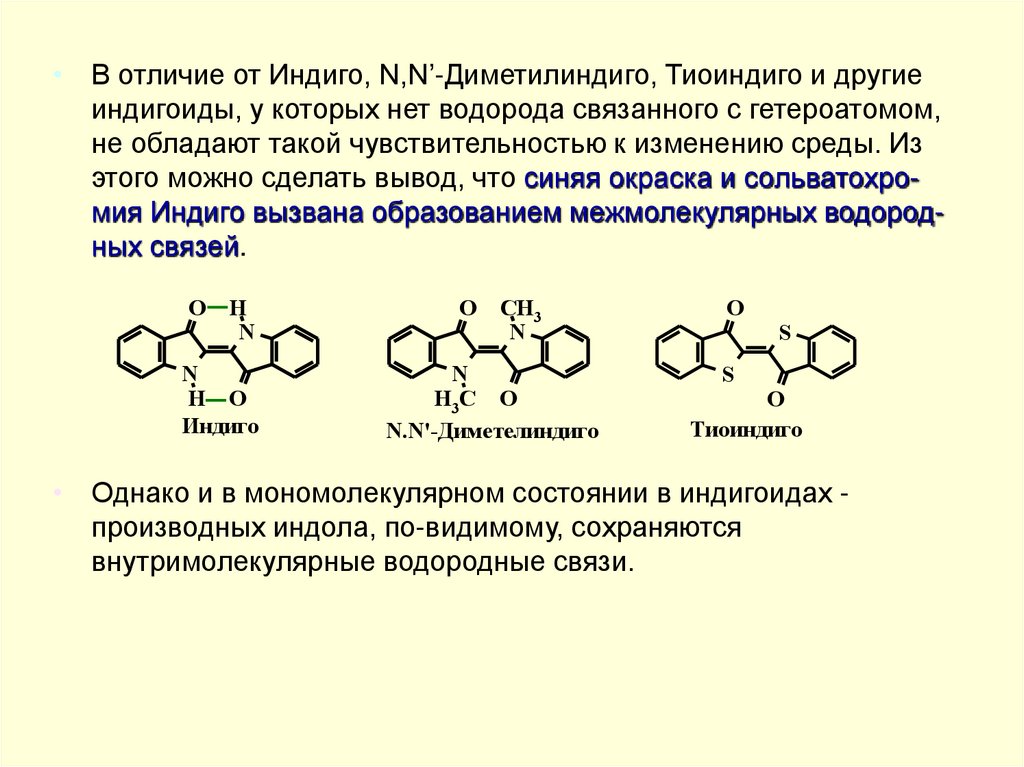
• В отличие от Индиго, N,N’-Диметилиндиго, Тиоиндиго и другиеиндигоиды, у которых нет водорода связанного с гетероатомом,
не обладают такой чувствительностью к изменению среды. Из
этого можно сделать вывод, что синяя окраска и сольватохромия Индиго вызвана образованием межмолекулярных водородных связей.
O
H
N
N
H O
Индиго
O
CH3
N
N
H3C O
N.N'-Диметелиндиго
O
S
S
O
Тиоиндиго
• Однако и в мономолекулярном состоянии в индигоидах производных индола, по-видимому, сохраняются
внутримолекулярные водородные связи.
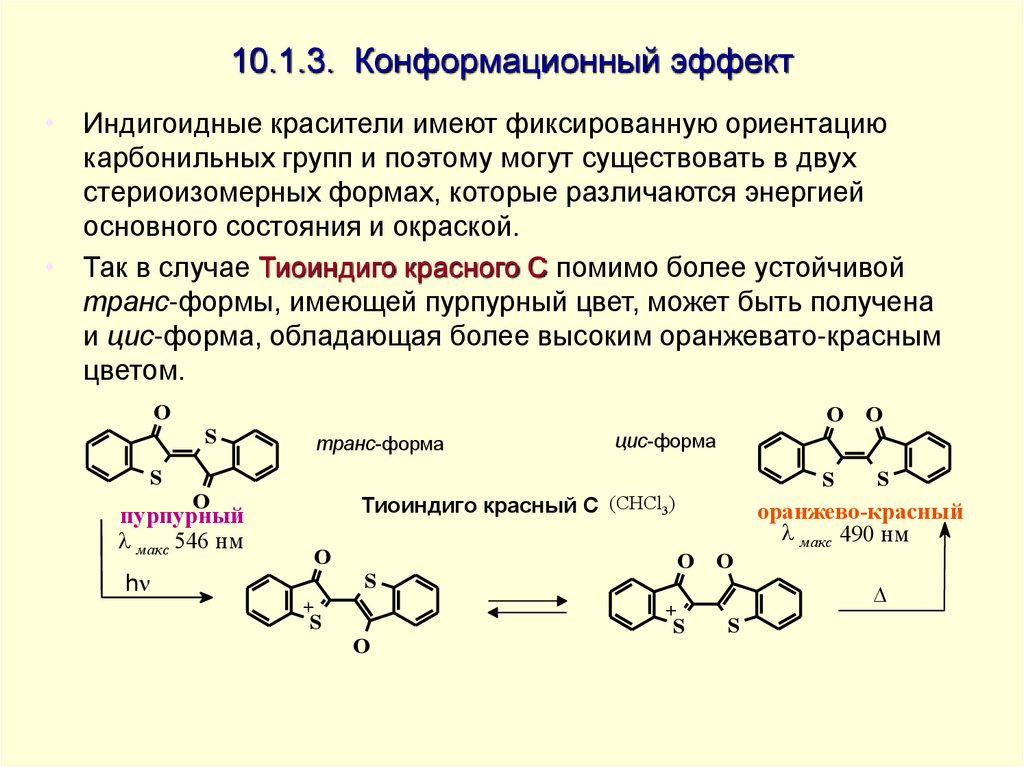
20. 10.1.3. Конформационный эффект
• Индигоидные красители имеют фиксированную ориентациюкарбонильных групп и поэтому могут существовать в двух
стериоизомерных формах, которые различаются энергией
основного состояния и окраской.
• Так в случае Тиоиндиго красного С помимо более устойчивой
транс-формы, имеющей пурпурный цвет, может быть получена
и цис-форма, обладающая более высоким оранжевато-красным
цветом.
O
S
транс-форма
O
Тиоиндиго красный С (CHCl3)
O
S
h
+
O
+
S
O
O
S
S
цис-форма
S
пурпурный
макс 546 нм
O
S
O
оранжево-красный
макс 490 нм
S
21.
• Этот переход в цис-форму совершается в результатепоглощения красителем энергии света, переводящего молекулу
в возбужденное состояние, в котором происходит поворот одной
половины молекулы вокруг простой С-С связи с после-дующей
дезактивацией. Обратный переход в транс-форму совершается
при выдерживании образца в темноте.
• Однако явление фотохромии не наблюдается в случае Индиго и
индолиндигоидов, в которых транс-форма стабилизируется
внутримолекулярной водородной связью. Этот пример
убедительно показывает, что транс-конформация также вносит
определенный вклад в углублении цвета Индиго, хромофор
которого обусловливает лишь пурпурную окраску этой
молекулы.
22. 10.2. Закономерности цвета в производных Индиго
23. 10.2.1. Природа гетероатома
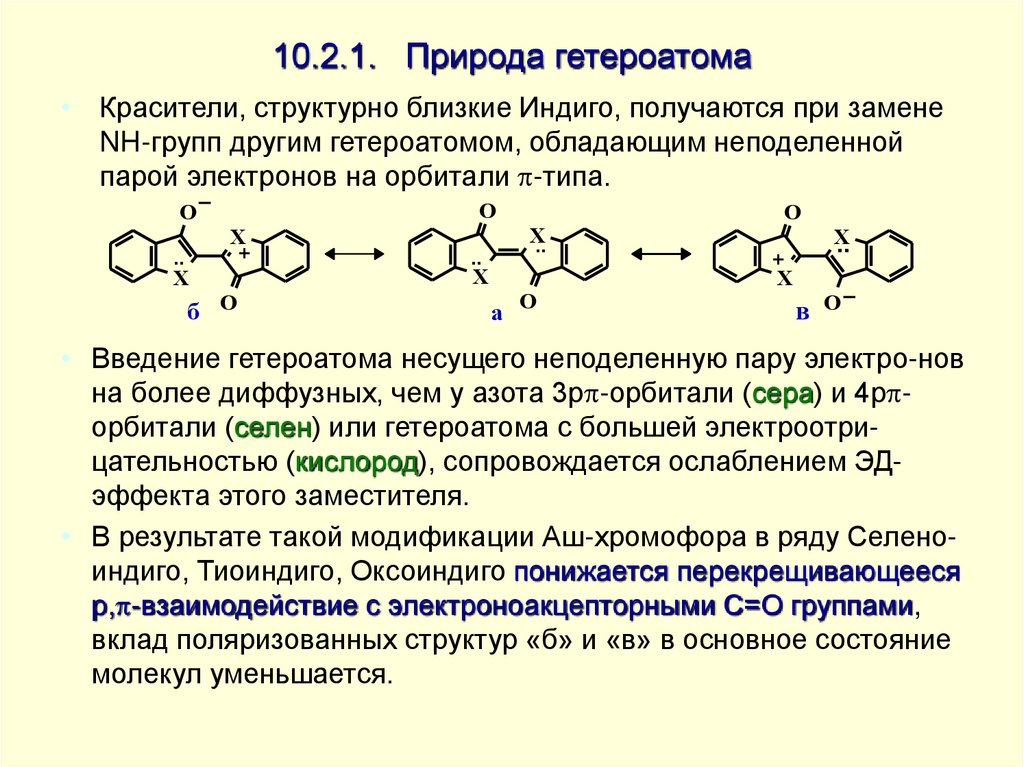
• Красители, структурно близкие Индиго, получаются при заменеNH-групп другим гетероатомом, обладающим неподеленной
парой электронов на орбитали -типа.
O
..
O
X
+
X
б O
..
X
а
X..
O
O
+
X
X
..
в O
• Введение гетероатома несущего неподеленную пару электро-нов
на более диффузных, чем у азота 3p -орбитали (сера) и 4p орбитали (селен) или гетероатома с большей электроотрицательностью (кислород), сопровождается ослаблением ЭДэффекта этого заместителя.
• В результате такой модификации Аш-хромофора в ряду Селеноиндиго, Тиоиндиго, Оксоиндиго понижается перекрещивающееся
p, -взаимодействие с электроноакцепторными C=O группами,
вклад поляризованных структур «б» и «в» в основное состояние
молекул уменьшается.
24.
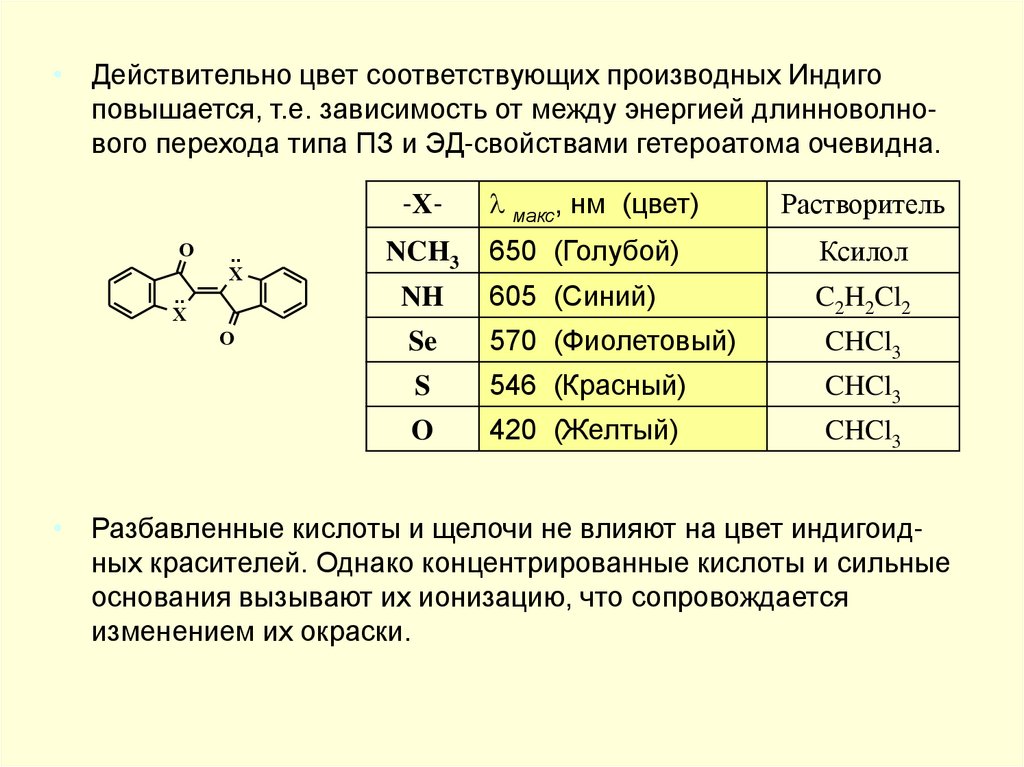
• Действительно цвет соответствующих производных Индигоповышается, т.е. зависимость от между энергией длинноволнового перехода типа ПЗ и ЭД-свойствами гетероатома очевидна.
O
..
X
..
X
O
-X-
макс, нм (цвет)
Растворитель
NCH3
650 (Голубой)
Ксилол
NH
605 (Синий)
C2H2Cl2
Se
570 (Фиолетовый)
CHCl3
S
546 (Красный)
CHCl3
O
420 (Желтый)
CHCl3
• Разбавленные кислоты и щелочи не влияют на цвет индигоидных красителей. Однако концентрированные кислоты и сильные
основания вызывают их ионизацию, что сопровождается
изменением их окраски.
25.
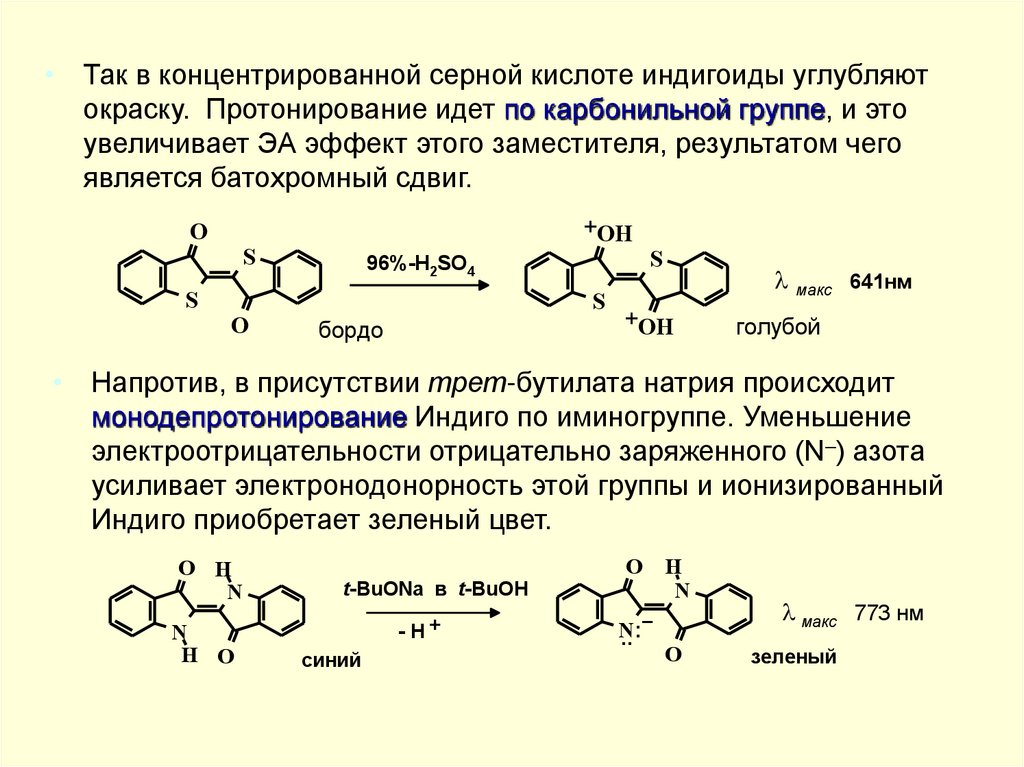
• Так в концентрированной серной кислоте индигоиды углубляютокраску. Протонирование идет по карбонильной группе, и это
увеличивает ЭА эффект этого заместителя, результатом чего
является батохромный сдвиг.
O
S
+OH
S
O
96%-H2SO4
S
бордо
S
макс 641нм
+OH
голубой
• Напротив, в присутствии трет-бутилата натрия происходит
монодепротонирование Индиго по иминогруппе. Уменьшение
электроотрицательности отрицательно заряженного (N–) азота
усиливает электронодонорность этой группы и ионизированный
Индиго приобретает зеленый цвет.
O H
N
N
H O
t-BuONa в t-BuOH
- H+
синий
O
N
.. :
H
N
O
макс 773 нм
зеленый
26. 10.2.2. Несимметричные индигоиды
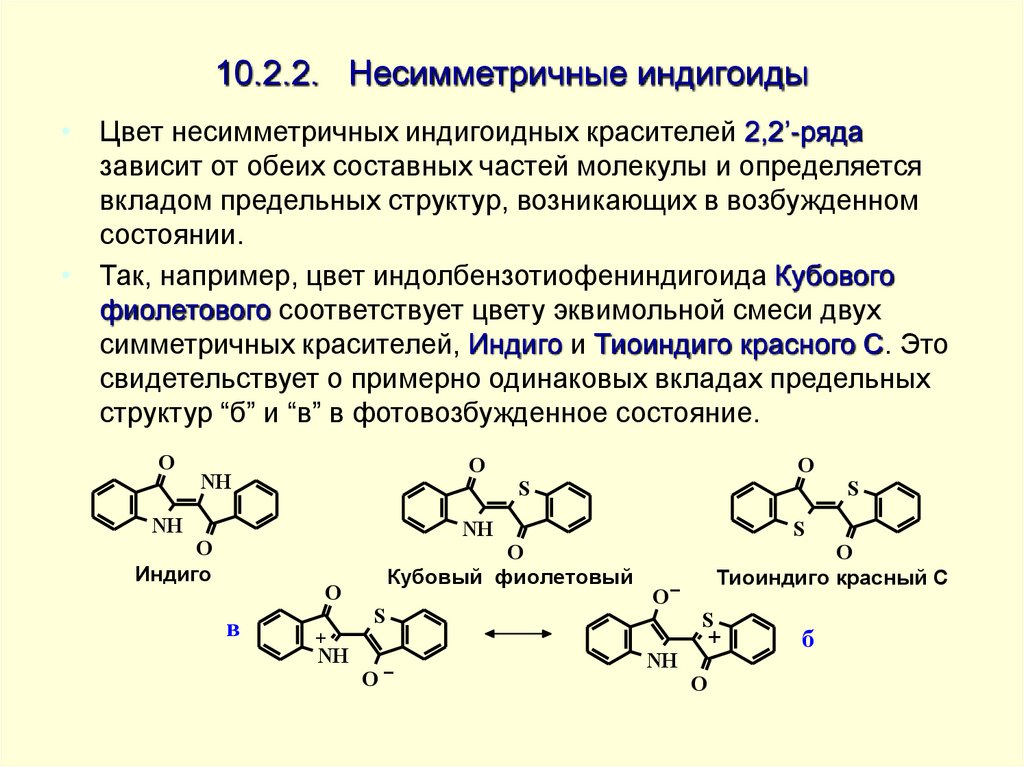
• Цвет несимметричных индигоидных красителей 2,2’-рядазависит от обеих составных частей молекулы и определяется
вкладом предельных структур, возникающих в возбужденном
состоянии.
• Так, например, цвет индолбензотиофениндигоида Кубового
фиолетового соответствует цвету эквимольной смеси двух
симметричных красителей, Индиго и Тиоиндиго красного С. Это
свидетельствует о примерно одинаковых вкладах предельных
структур “б” и “в” в фотовозбужденное состояние.
O
O
NH
NH
O
S
NH
O
Индиго
O
в
+
NH
O
Кубовый фиолетовый
S
O-
S
ONH
S
O
Тиоиндиго красный С
S
+
O
б
27.
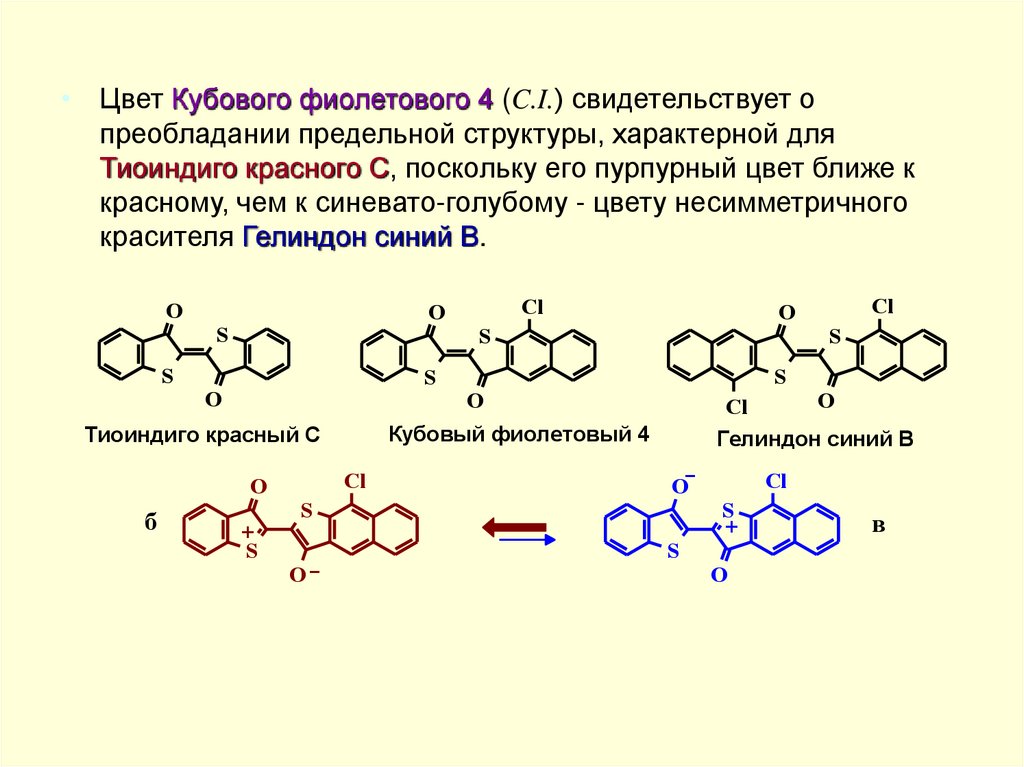
• Цвет Кубового фиолетового 4 (C.I.) свидетельствует опреобладании предельной структуры, характерной для
Тиоиндиго красного С, поскольку его пурпурный цвет ближе к
красному, чем к синевато-голубому - цвету несимметричного
красителя Гелиндон синий B.
O
O
S
S
O
S
S
S
O
Cl
Гелиндон синий B
O
Кубовый фиолетовый 4
Cl
O
+
S
-
Cl
O
S
O-
Cl
O
S
Тиоиндиго красный С
б
Cl
S
S
+
O
в
28.
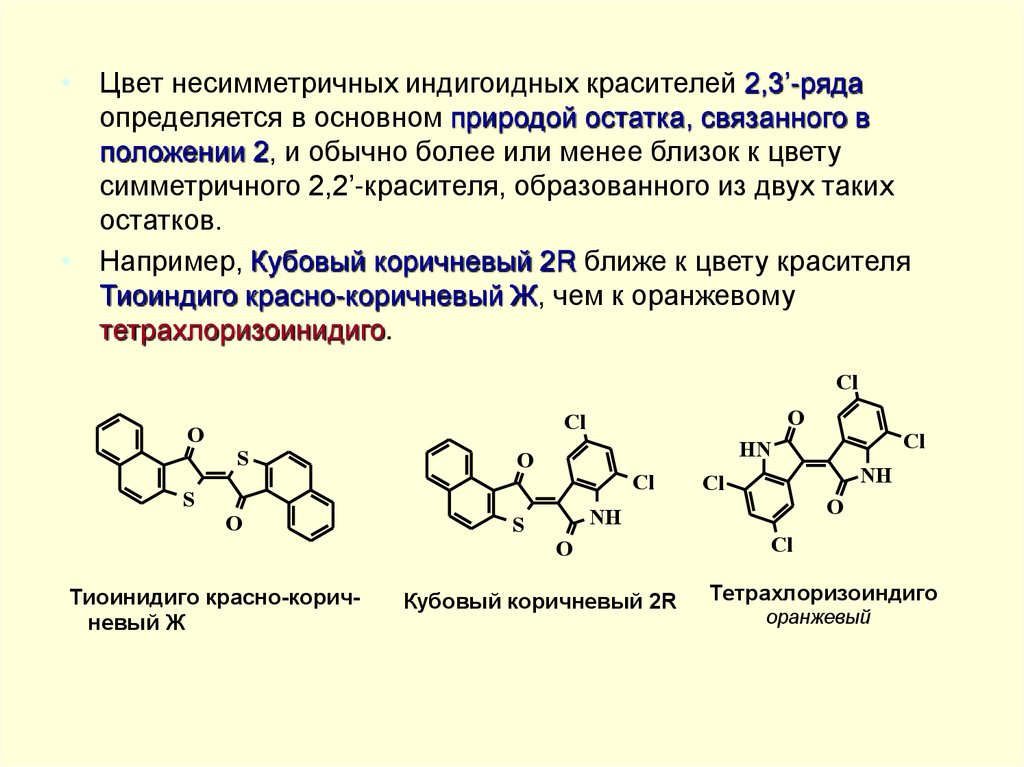
• Цвет несимметричных индигоидных красителей 2,3’-рядаопределяется в основном природой остатка, связанного в
положении 2, и обычно более или менее близок к цвету
симметричного 2,2’-красителя, образованного из двух таких
остатков.
• Например, Кубовый коричневый 2R ближе к цвету красителя
Тиоиндиго красно-коричневый Ж, чем к оранжевому
тетрахлоризоинидиго.
Cl
O
S
O
Cl
S
O
Тиоинидиго красно-коричневый Ж
O
S
Cl
HN
Cl
NH
Cl
O
NH
O
Кубовый коричневый 2R
Cl
Тетрахлоризоиндиго
оранжевый
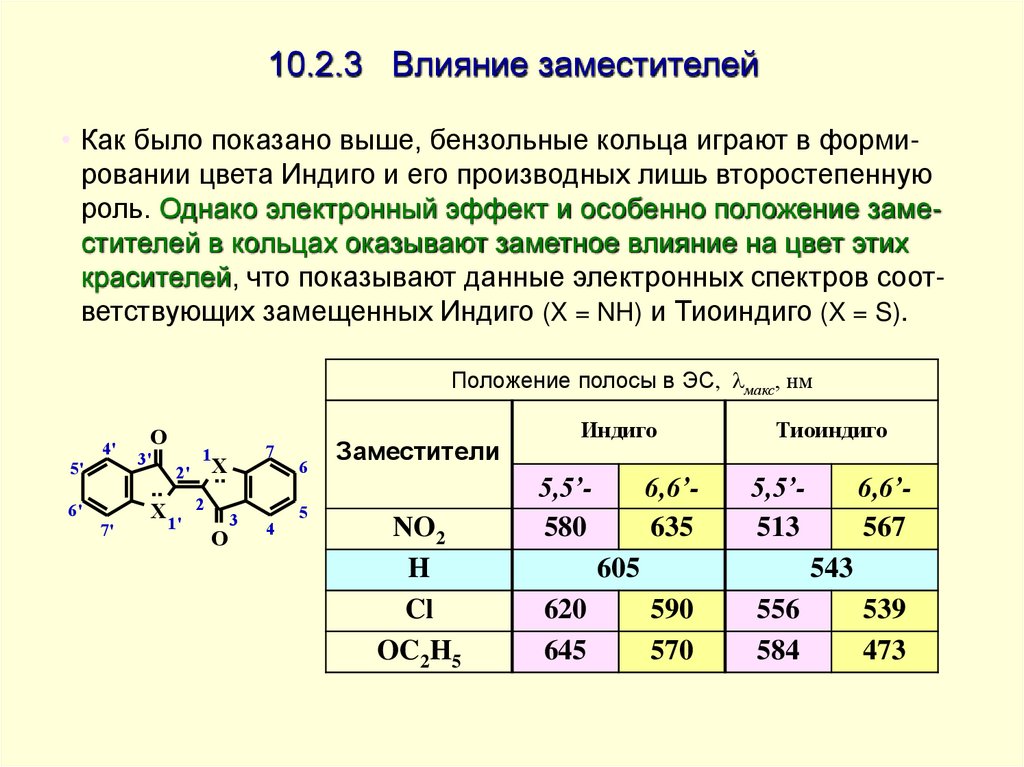
29. 10.2.3 Влияние заместителей
• Как было показано выше, бензольные кольца играют в формировании цвета Индиго и его производных лишь второстепеннуюроль. Однако электронный эффект и особенно положение заместителей в кольцах оказывают заметное влияние на цвет этих
красителей, что показывают данные электронных спектров соответствующих замещенных Индиго (X = NH) и Тиоиндиго (X = S).
Положение полосы в ЭС, макс, нм
4'
5'
6'
7'
O
3'
7
1
2' X
..
..
X 1' 2
O
3
4
6
5
Заместители
NO2
H
Cl
OC2H5
Индиго
5,5’580
6,6’635
Тиоиндиго
5,5’513
605
620
645
6,6’567
543
590
570
556
584
539
473
30.
4'5'
6'
7'
O
3'
2'
7
1
..
X 1' 2
X
..
O
3
4
6
5
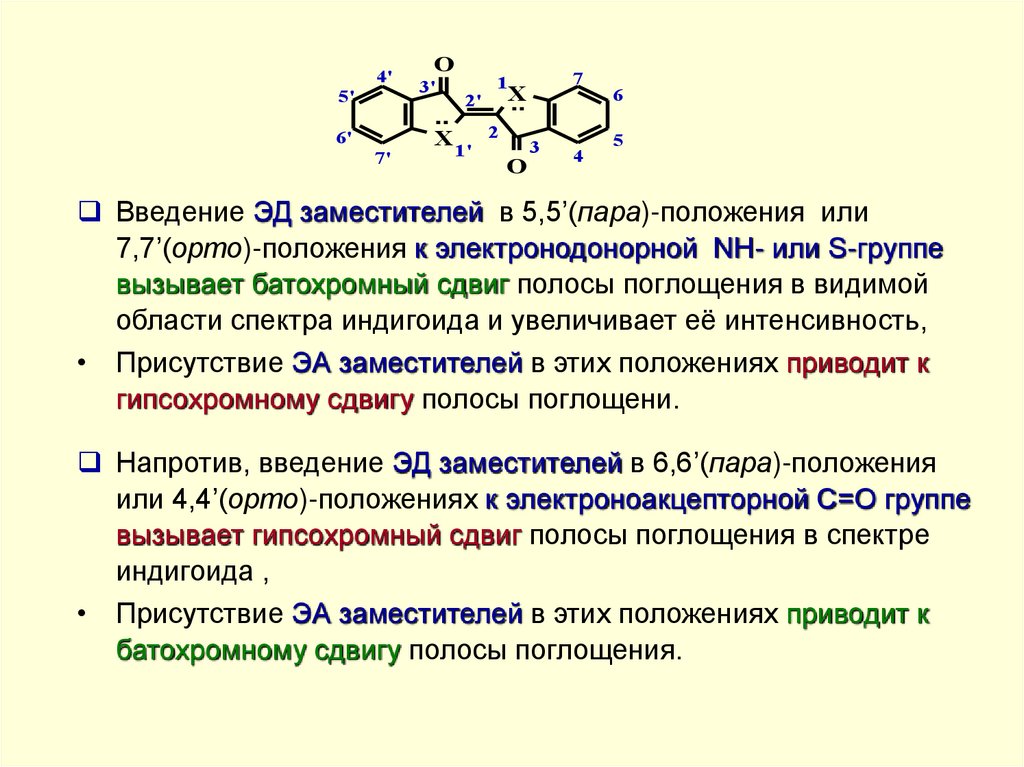
Введение ЭД заместителей в 5,5’(пара)-положения или
7,7’(орто)-положения к электронодонорной NH- или S-группе
вызывает батохромный сдвиг полосы поглощения в видимой
области спектра индигоида и увеличивает её интенсивность,
• Присутствие ЭА заместителей в этих положениях приводит к
гипсохромному сдвигу полосы поглощени.
Напротив, введение ЭД заместителей в 6,6’(пара)-положения
или 4,4’(орто)-положениях к электроноакцепторной C=O группе
вызывает гипсохромный сдвиг полосы поглощения в спектре
индигоида ,
• Присутствие ЭА заместителей в этих положениях приводит к
батохромному сдвигу полосы поглощения.
31.
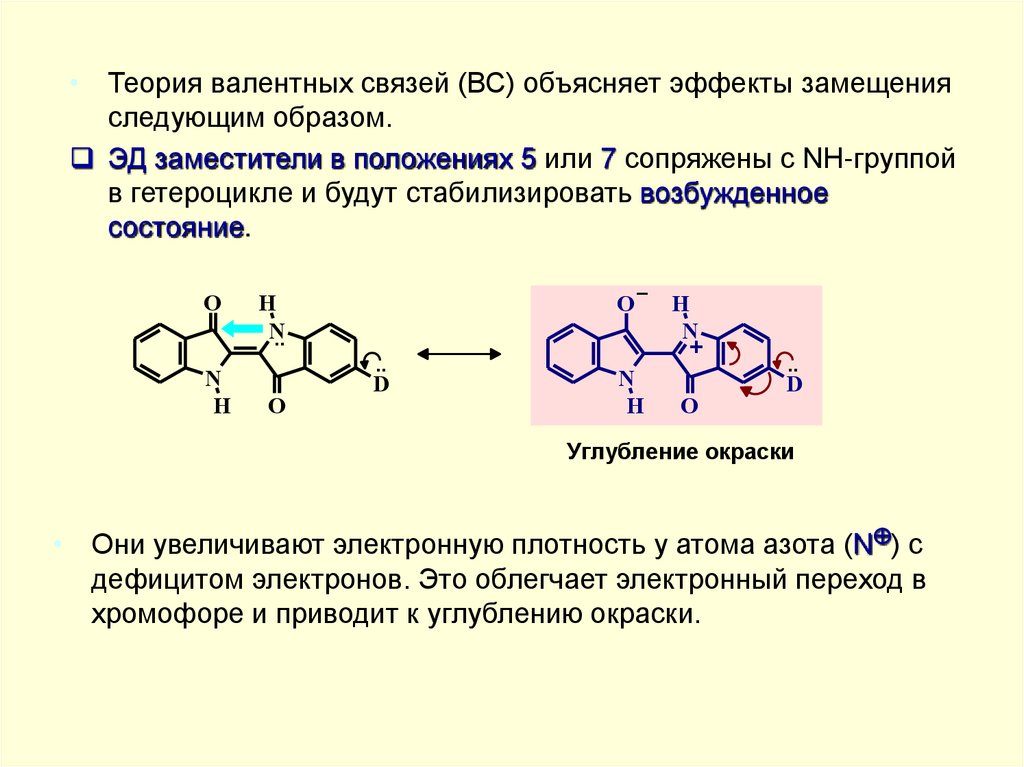
• Теория валентных связей (ВС) объясняет эффекты замещенияследующим образом.
ЭД заместители в положениях 5 или 7 сопряжены с NH-группой
в гетероцикле и будут стабилизировать возбужденное
состояние.
O
N
H
O- H
N
H
N..
..
O
D
+
N
H
O
..
D
Углубление окраски
• Они увеличивают электронную плотность у атома азота (N ) с
дефицитом электронов. Это облегчает электронный переход в
хромофоре и приводит к углублению окраски.
32.
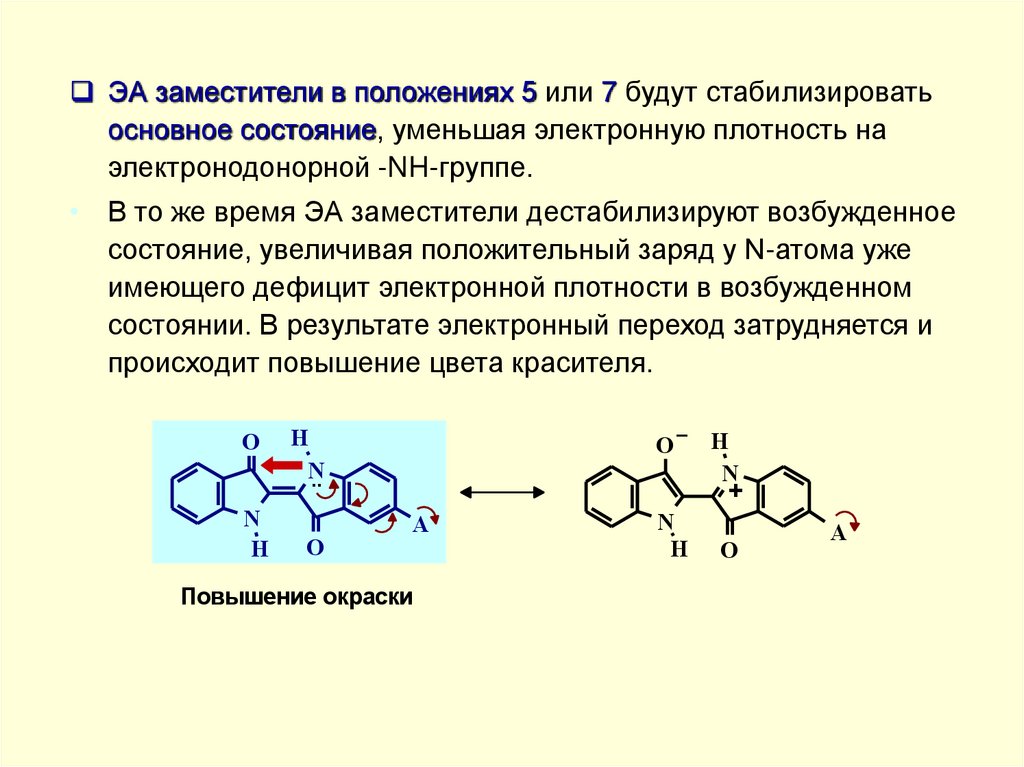
ЭА заместители в положениях 5 или 7 будут стабилизироватьосновное состояние, уменьшая электронную плотность на
электронодонорной -NH-группе.
• В то же время ЭА заместители дестабилизируют возбужденное
состояние, увеличивая положительный заряд у N-атома уже
имеющего дефицит электронной плотности в возбужденном
состоянии. В результате электронный переход затрудняется и
происходит повышение цвета красителя.
O
N
H
O- H
N
H
N
..
O
+
A
Повышение окраски
N
H
O
A
33.
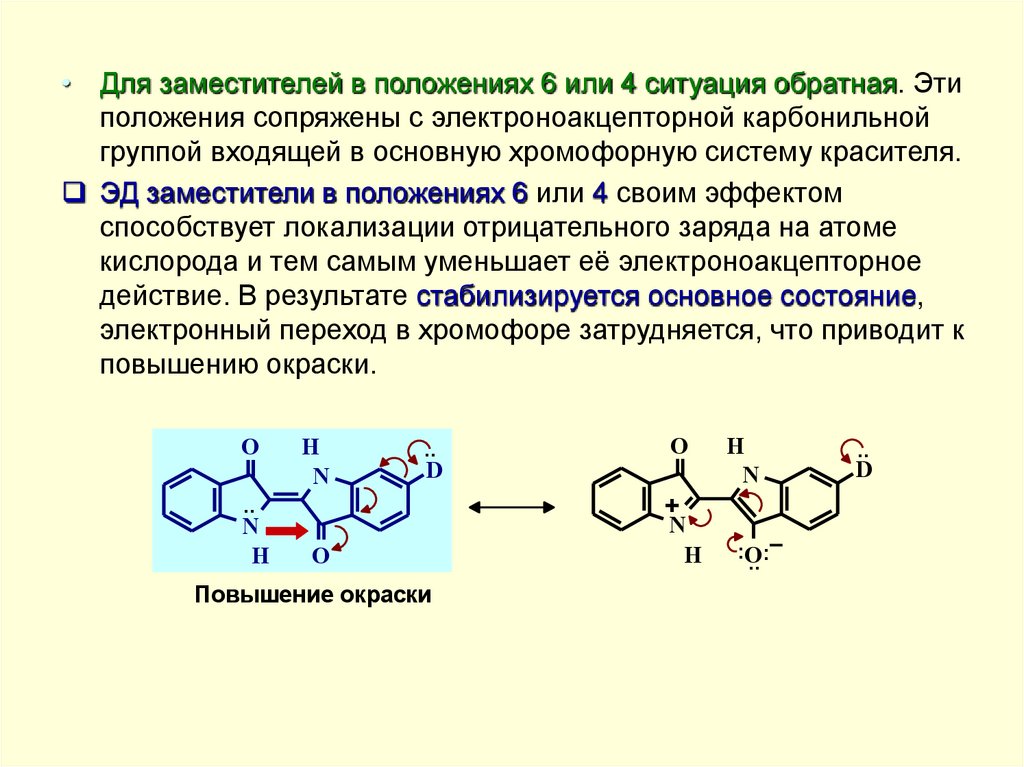
• Для заместителей в положениях 6 или 4 ситуация обратная. Этиположения сопряжены с электроноакцепторной карбонильной
группой входящей в основную хромофорную систему красителя.
ЭД заместители в положениях 6 или 4 своим эффектом
способствует локализации отрицательного заряда на атоме
кислорода и тем самым уменьшает её электроноакцепторное
действие. В результате стабилизируется основное состояние,
электронный переход в хромофоре затрудняется, что приводит к
повышению окраски.
O
H
N
..
D
H
N
+
..
N
H
O
O
Повышение окраски
N
H
:O :
..
..
D
34.
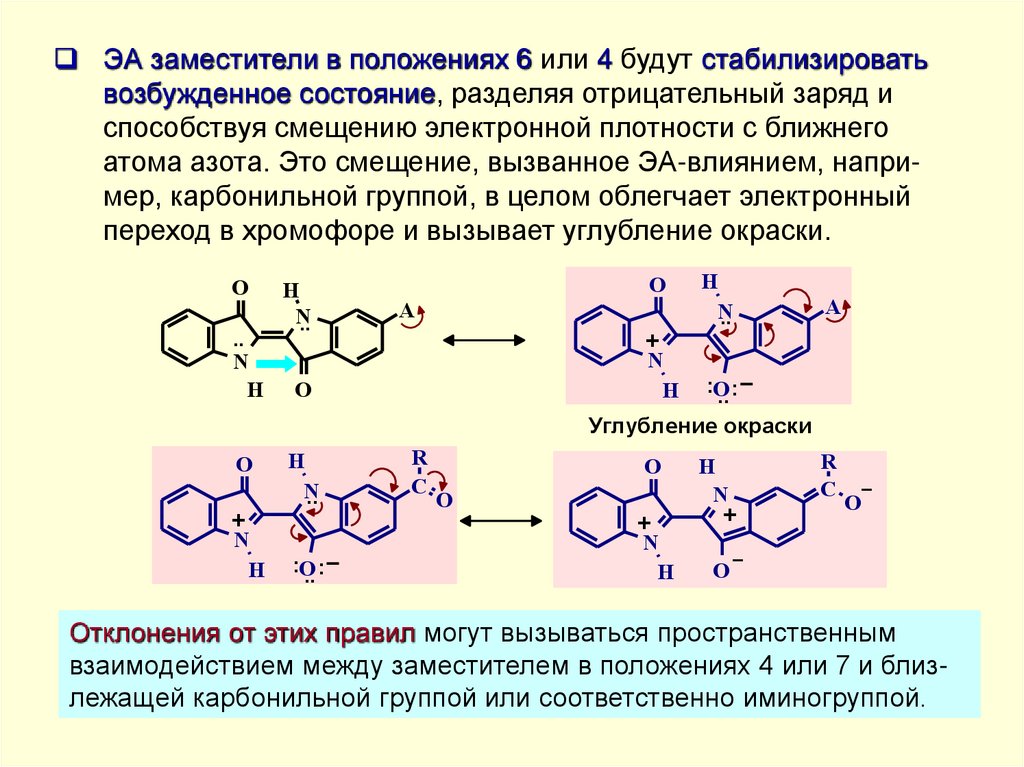
ЭА заместители в положениях 6 или 4 будут стабилизироватьвозбужденное состояние, разделяя отрицательный заряд и
способствуя смещению электронной плотности с ближнего
атома азота. Это смещение, вызванное ЭА-влиянием, например, карбонильной группой, в целом облегчает электронный
переход в хромофоре и вызывает углубление окраски.
O
..
N
H
H
N
..
O
A
+
N
H
O
H
N
..
A
:O :
..
Углубление окраски
O
+
N
H
H
N
..
:O :
..
R
C
O
O
+
N
H
H
N
+
O
R
C
-
O
-
Отклонения от этих правил могут вызываться пространственным
взаимодействием между заместителем в положениях 4 или 7 и близлежащей карбонильной группой или соответственно иминогруппой.
35. 10.3. Области применения индигоидов
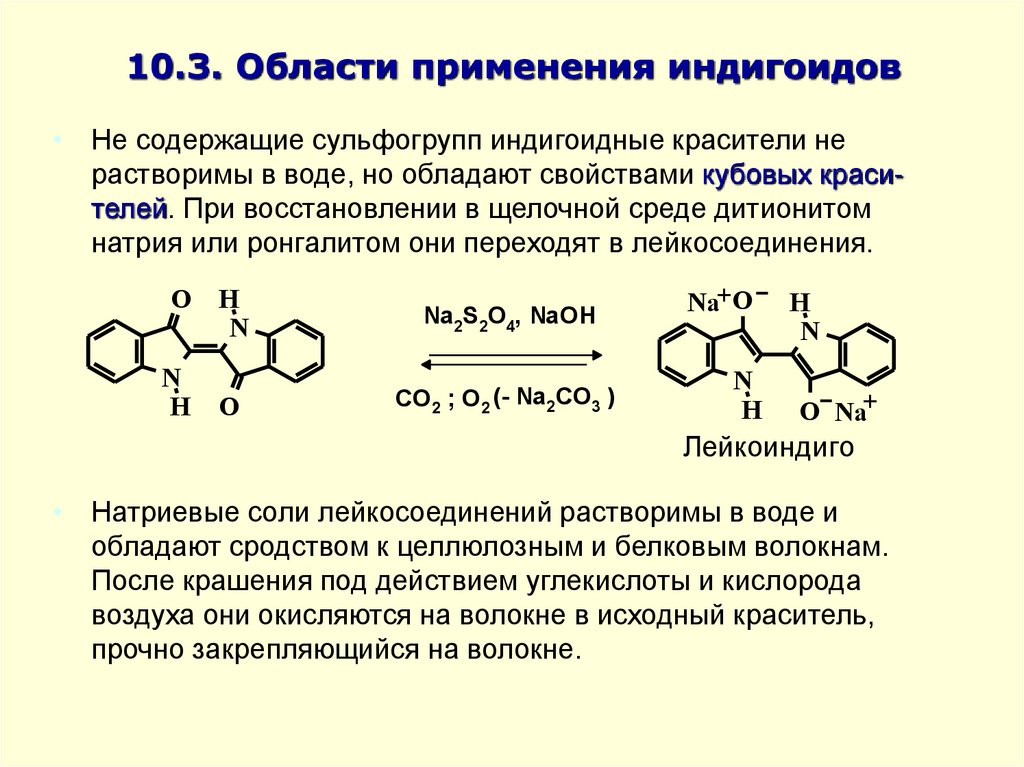
• Не содержащие сульфогрупп индигоидные красители нерастворимы в воде, но обладают свойствами кубовых красителей. При восстановлении в щелочной среде дитионитом
натрия или ронгалитом они переходят в лейкосоединения.
O
N
H
H
N
Na2S2O4, NaOH
O
CO2 ; O2 (- Na2CO3 )
Na+O
N
H
H
N
O Na+
Лейкоиндиго
• Натриевые соли лейкосоединений растворимы в воде и
обладают сродством к целлюлозным и белковым волокнам.
После крашения под действием углекислоты и кислорода
воздуха они окисляются на волокне в исходный краситель,
прочно закрепляющийся на волокне.
36.
• Восстановление Индиго и большинства индигоидов можнопроводить в слабо-щелочной или аммиачной среде,
поэтому растворы их лейкосоединений можно применять
для крашения не только целлюлозных волокон, но также
шерсти, шелка и меха.
• Окраски индигоидными красителями, как правило, не
очень ярки, обычно умерено устойчивы к мокрым
обработкам, но довольно светостойки. Некоторые
представители мало устойчивы к трению и действию
хлора и окислителей.
• Тиоиндигоиды в целом обладают более высокими
прочностными показателями, чем индолиндигоиды.
37.
• Наиболее интенсивно окрашенные индигоидыприменяются в качестве пигментов для приготовления
типографских и акварельных красок, для крашения
резины и пластмасс. Так как молекулы большинства
индигоидов невелики по размерам, то при введении в них
сложноэфирных групп (-COOCH3), облегчающих
диффузию и образование твердых растворах в
волокнообразующих полимерах, они используются в
качестве дисперсных красителей.
• Некоторые индигоиды обладают фотохромными
свойствами, что позволило использовать их в качестве
светофильтров и для оптической записи и хранения
информации.
38. 10.4. Бис(индол)индигоиды
39.
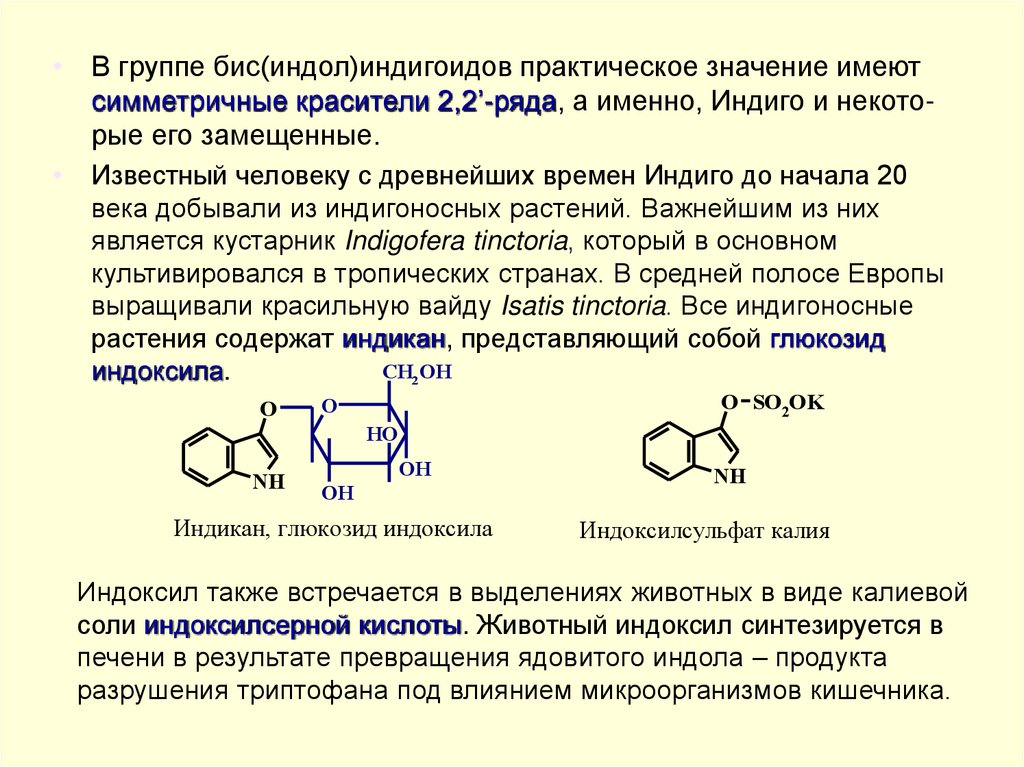
• В группе бис(индол)индигоидов практическое значение имеютсимметричные красители 2,2’-ряда, а именно, Индиго и некоторые его замещенные.
Известный человеку с древнейших времен Индиго до начала 20
века добывали из индигоносных растений. Важнейшим из них
является кустарник Indigofera tinctoria, который в основном
культивировался в тропических странах. В средней полосе Европы
выращивали красильную вайду Isatis tinctoria. Все индигоносные
растения содержат индикан, представляющий собой глюкозид
CH2 OH
индоксила.
O
O SO2OK
O
HO
NH
OH
OH
Индикан, глюкозид индоксила
NH
Индоксилсульфат калия
Индоксил также встречается в выделениях животных в виде калиевой
соли индоксилсерной кислоты. Животный индоксил синтезируется в
печени в результате превращения ядовитого индола – продукта
разрушения триптофана под влиянием микроорганизмов кишечника.
40.
• Получение Индиго основывалось на ферментативномрасщеплении индикана на глюкозу и индоксил, который при
дальнейшем окислении на волокнистом материале кислородом
воздуха легко превращался в устойчивый синий краситель.
• Ценность Индиго, долгое время не имевшего себе равных по
устойчивости окрасок, привлекла к нему внимание многочисленных исследователей, поставивших своей целью найти
химические способы его получения. Первое место среди этих
исследователей принадлежит Адольфу Байеру, который не
только установил строение Индиго, но в 1883 г. разработал
полный метод его синтеза из 2-нитробензальдегида и ацетона. В
результате последующих работ Байера, его сотрудников и
других исследователей (Хойман, Зандмайер) были найдены и
другие способы синтеза индиго, что позволило, начиная с 1897 г.
организовать в Германии, а в 1916 г. в США производство
синтетического Индиго, который благодаря низкой цене и
прекрасному качеству быстро вытеснил с рынка натуральный
Индиго.
41.
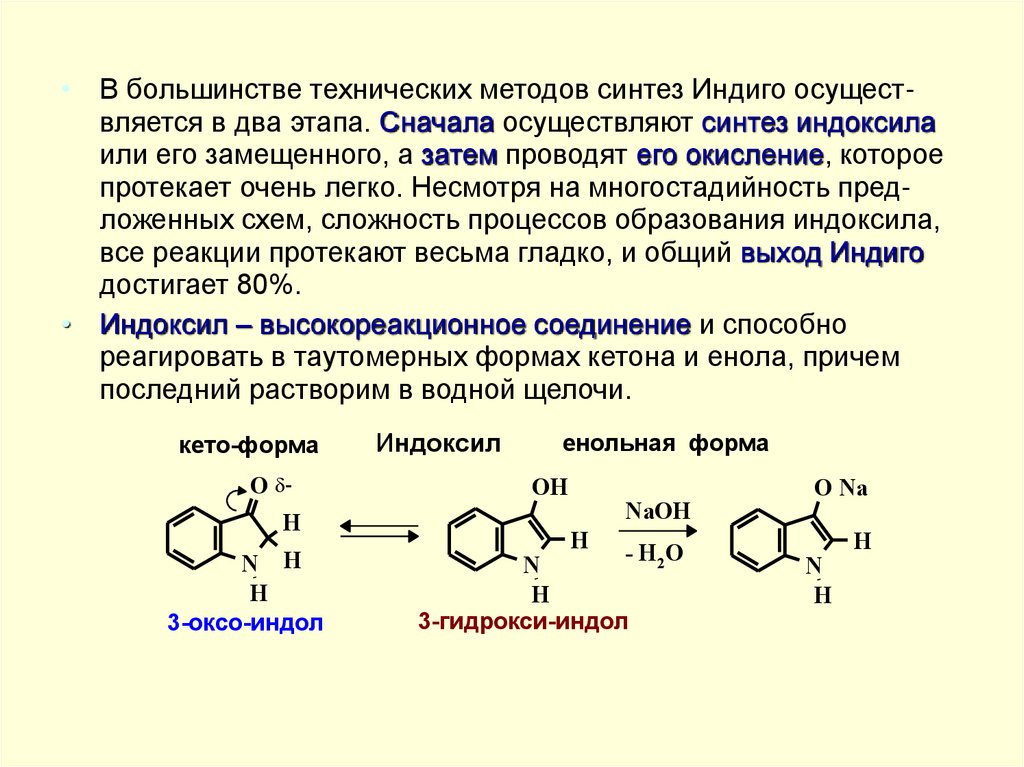
• В большинстве технических методов синтез Индиго осуществляется в два этапа. Сначала осуществляют синтез индоксилаили его замещенного, а затем проводят его окисление, которое
протекает очень легко. Несмотря на многостадийность предложенных схем, сложность процессов образования индоксила,
все реакции протекают весьма гладко, и общий выход Индиго
достигает 80%.
• Индоксил – высокореакционное соединение и способно
реагировать в таутомерных формах кетона и енола, причем
последний растворим в водной щелочи.
кето-форма
O H
H
N
H
3-оксо-индол
Индоксил
енольная форма
OH
NaOH
H
- H 2O
N
H
3-гидрокси-индол
O Na
N
H
H
42.
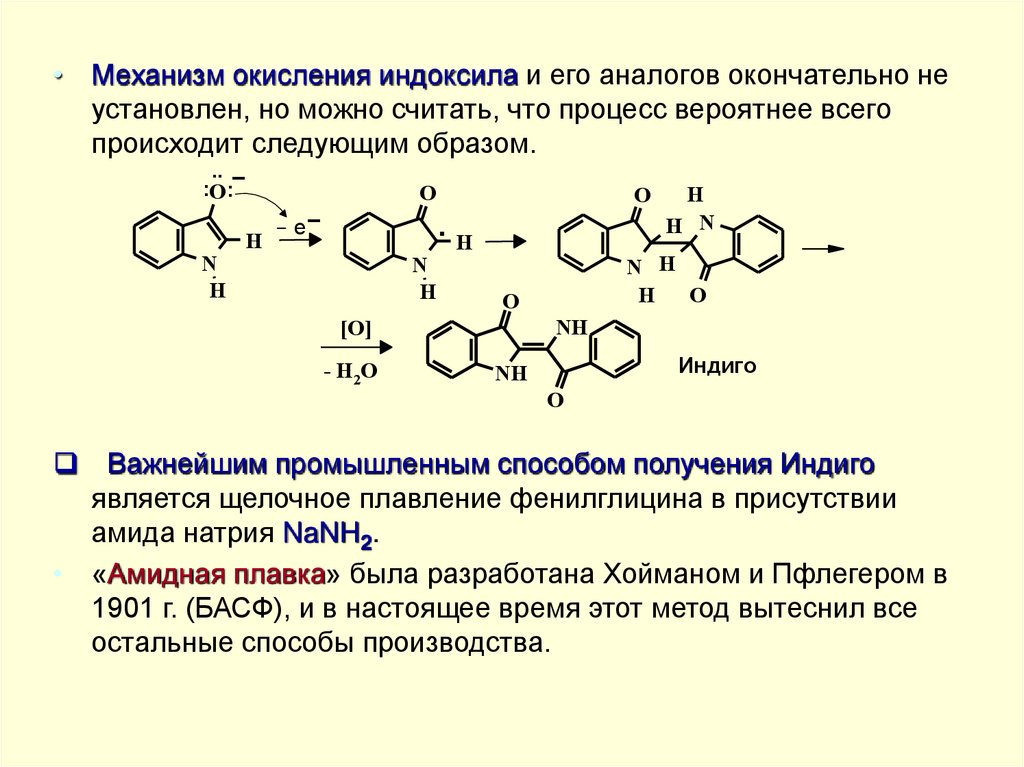
• Механизм окисления индоксила и его аналогов окончательно неустановлен, но можно считать, что процесс вероятнее всего
происходит следующим образом.
..
:O:O
H
O
H N
- e.
N
H
H
N
H
H
O
NH
[O]
- H2O
N H
O
H
Индиго
NH
O
Важнейшим промышленным способом получения Индиго
является щелочное плавление фенилглицина в присутствии
амида натрия NaNH2.
• «Амидная плавка» была разработана Хойманом и Пфлегером в
1901 г. (БАСФ), и в настоящее время этот метод вытеснил все
остальные способы производства.
43.
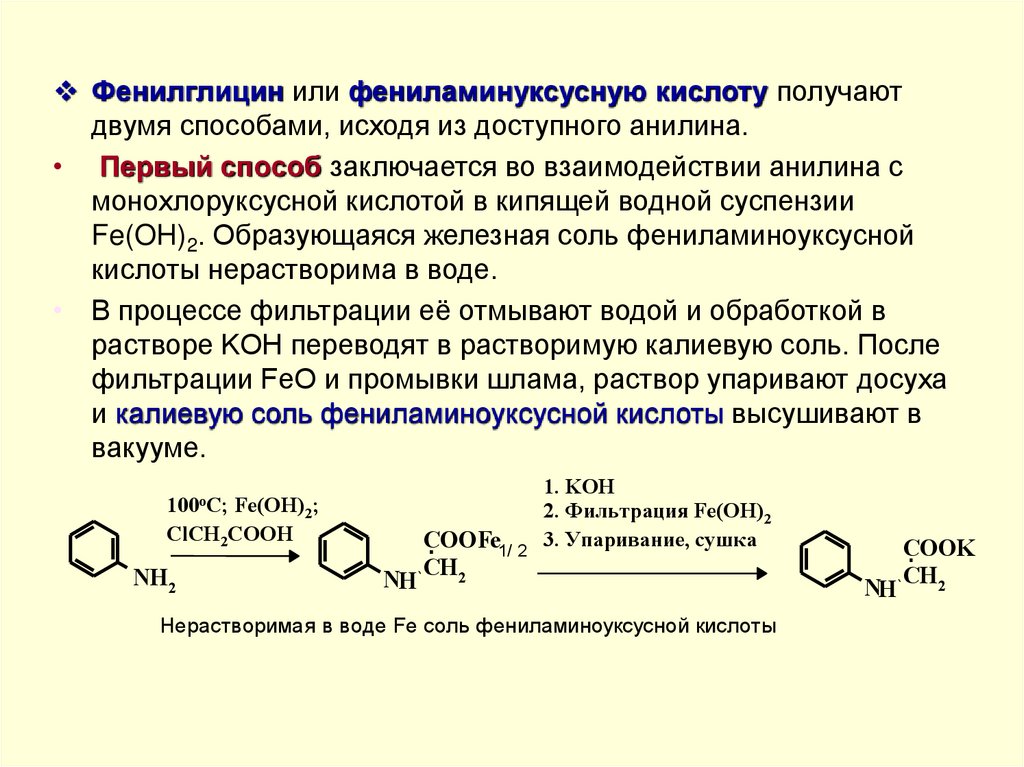
Фенилглицин или фениламинуксусную кислоту получаютдвумя способами, исходя из доступного анилина.
• Первый способ заключается во взаимодействии анилина с
монохлоруксусной кислотой в кипящей водной суспензии
Fe(OH)2. Образующаяся железная соль фениламиноуксусной
кислоты нерастворима в воде.
• В процессе фильтрации её отмывают водой и обработкой в
растворе KOH переводят в растворимую калиевую соль. После
фильтрации FeO и промывки шлама, раствор упаривают досуха
и калиевую соль фениламиноуксусной кислоты высушивают в
вакууме.
100oC; Fe(OH)2;
ClCH2COOH
NH2
NH
COOFe1/ 2
CH2
1. KOH
2. Фильтрация Fe(OH)2
3. Упаривание, сушка
Нерастворимая в воде Fe соль фениламиноуксусной кислоты
NH
COOK
CH2
44.
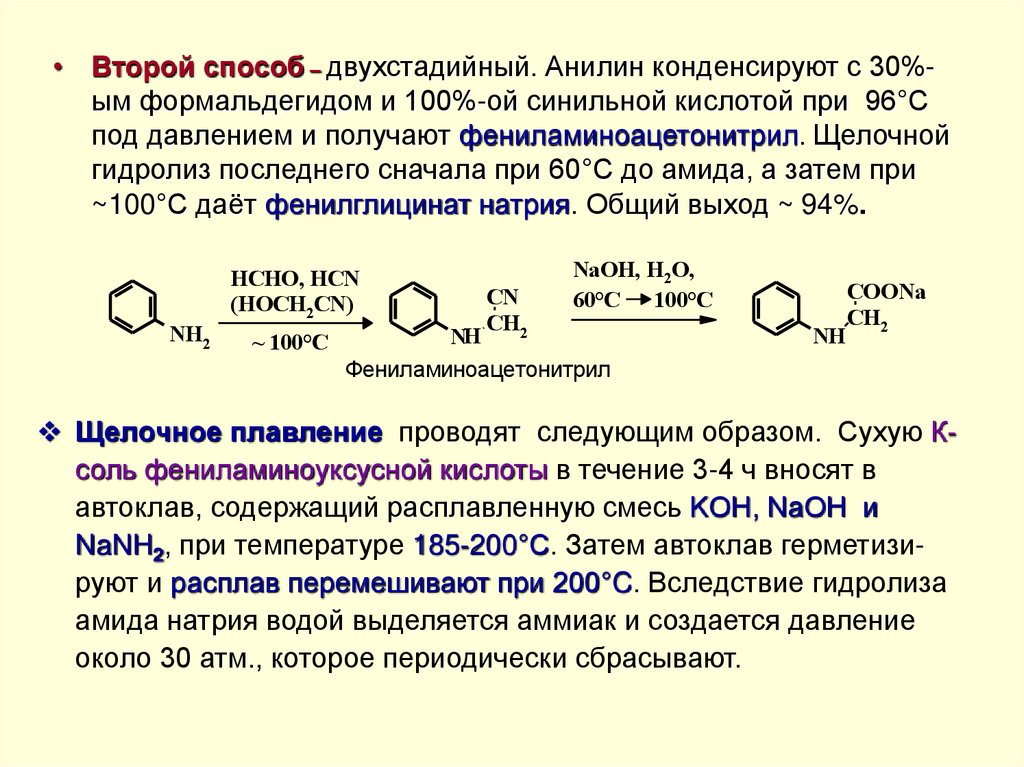
• Второй способ – двухстадийный. Анилин конденсируют с 30%ым формальдегидом и 100%-ой синильной кислотой при 96°Спод давлением и получают фениламиноацетонитрил. Щелочной
гидролиз последнего сначала при 60°С до амида, а затем при
~100°С даёт фенилглицинат натрия. Общий выход ~ 94%.
HCHO, HCN
(HOCH2CN)
NH2
~ 100°C
CN
CH2
NaOH, H2O,
60°C 100°C
NH
Фениламиноацетонитрил
NH
COONa
CH2
Щелочное плавление проводят следующим образом. Сухую Ксоль фениламиноуксусной кислоты в течение 3-4 ч вносят в
автоклав, содержащий расплавленную смесь KOH, NaOH и
NaNH2, при температуре 185-200°С. Затем автоклав герметизируют и расплав перемешивают при 200°C. Вследствие гидролиза
амида натрия водой выделяется аммиак и создается давление
около 30 атм., которое периодически сбрасывают.
45.
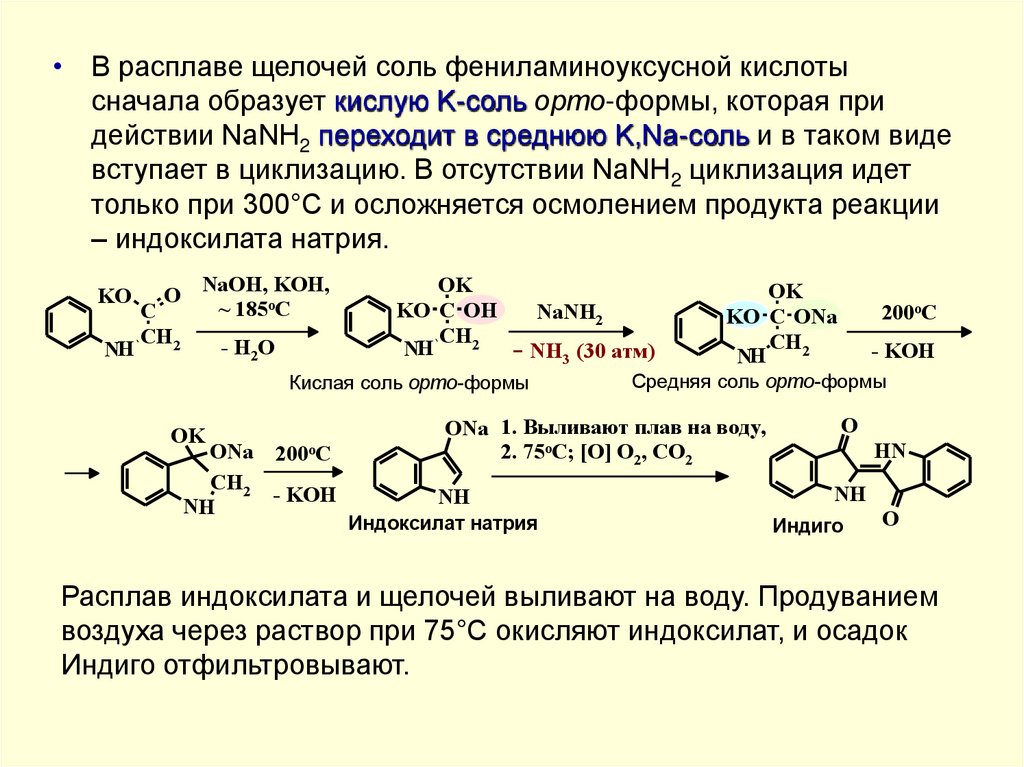
• В расплаве щелочей соль фениламиноуксусной кислотысначала образует кислую K-соль орто-формы, которая при
действии NaNH2 переходит в среднюю K,Na-соль и в таком виде
вступает в циклизацию. В отсутствии NaNH2 циклизация идет
только при 300°C и осложняется осмолением продукта реакции
– индоксилата натрия.
KO
NH
O
C
CH2
NaOH, KOH,
~ 185oC
- H2O
OK
KO C OH
NaNH2
CH2
NH
- NH3 (30 атм)
Кислая соль орто-формы
OK
ONa
CH2
- KOH
NH
200oC
OK
KO C ONa
CH2
NH
200oC
- KOH
Средня
яя соль орто-формы
ONa 1. Выливают плав на воду,
2. 75oC; [O] O2, CO2
O
NH
NH
Индоксилат натрия
HN
Индиго
O
Расплав индоксилата и щелочей выливают на воду. Продуванием
воздуха через раствор при 75°C окисляют индоксилат, и осадок
Индиго отфильтровывают.
46.
Индиго окрашивает ткани в приятный синий цвет, показателиустойчивости к свету, особенно к трению, средние. Однако он
выцветает равномерно, не меняя оттенка, что является ценным
преимуществом. Он выдерживает конкуренцию с другими
синими кубовыми красителями благодаря своей дешевизне.
• Индиго вступает в реакции электрофильного замещения, при
этом реакционноспособными положениями (в порядке убывания
их активности) являются 5,5’> 7,7’> 4,4’. Прямым замещением
можно ввести заместители только в такой последовательности.
Производные с иным расположением получают из
соответствующих промежуточных продуктов.
• Галогензамещенные Индиго представляют особый практический интерес. Введение атомов хлора и брома немного углубляет
окраску до голубовато-синей, но при этом заметно возрастает
яркость и чистота цвета, увеличивается сродство к целлюлозе и
устойчивость мокрым обработкам, трению и окислительным
воздействиям.
47.
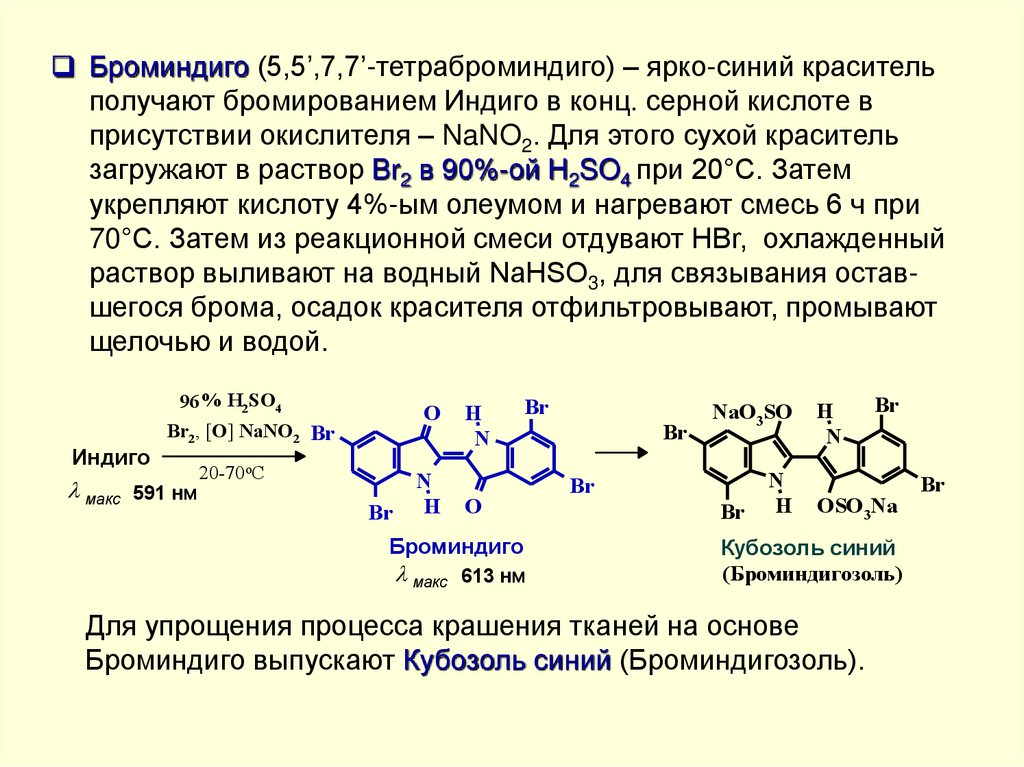
Броминдиго (5,5’,7,7’-тетраброминдиго) – ярко-синий красительполучают бромированием Индиго в конц. серной кислоте в
присутствии окислителя – NaNO2. Для этого сухой краситель
загружают в раствор Br2 в 90%-ой H2SO4 при 20°С. Затем
укрепляют кислоту 4%-ым олеумом и нагревают смесь 6 ч при
70°C. Затем из реакционной смеси отдувают HBr, охлажденный
раствор выливают на водный NaHSO3, для связывания оставшегося брома, осадок красителя отфильтровывают, промывают
щелочью и водой.
Индиго
96 % H2SO4
Br2, [O] NaNO2 Br
макс 591 нм
O
20-70oC
Br
N
H
H
N
Br
O
Броминдиго
макс 613 нм
Br
NaO3SO
Br
Br
N
H
H
N
Br
OSO3Na
Кубозоль синий
(Броминдигозоль)
Для упрощения процесса крашения тканей на основе
Броминдиго выпускают Кубозоль синий (Броминдигозоль).
Br
48.
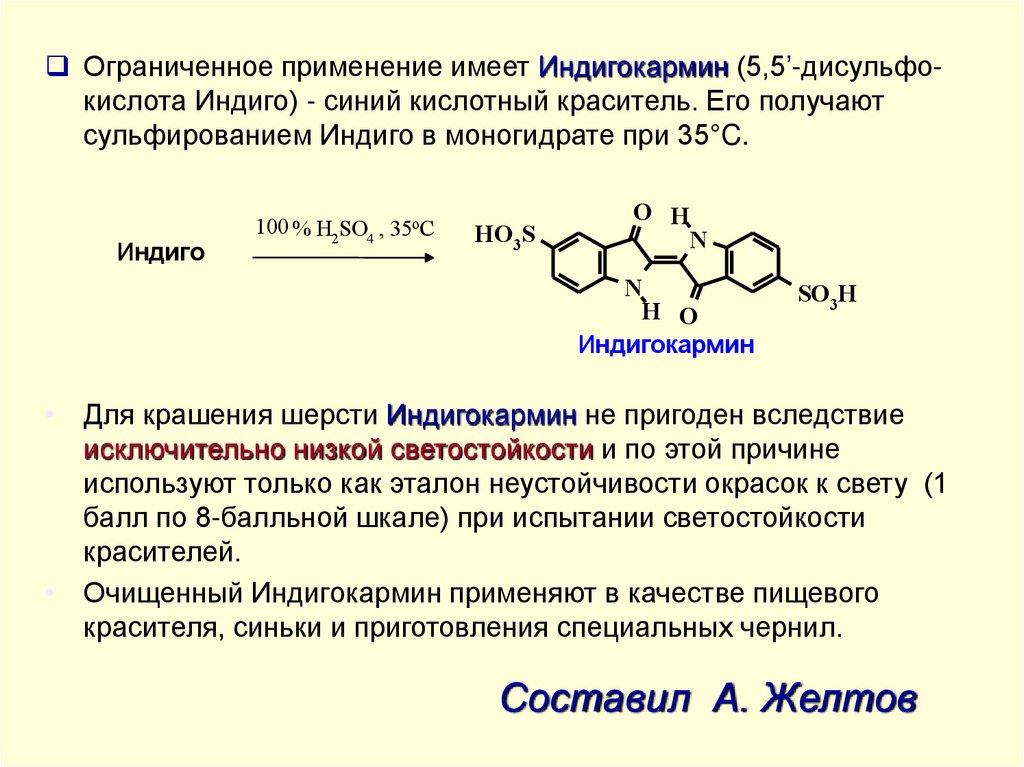
Ограниченное применение имеет Индигокармин (5,5’-дисульфокислота Индиго) - синий кислотный краситель. Его получаютсульфированием Индиго в моногидрате при 35°C.
Индиго
100 % H2 SO4 , 35oC
HO3S
O H
N
N
H O
Индигокармин
SO3H
• Для крашения шерсти Индигокармин не пригоден вследствие
исключительно низкой светостойкости и по этой причине
используют только как эталон неустойчивости окрасок к свету (1
балл по 8-балльной шкале) при испытании светостойкости
красителей.
• Очищенный Индигокармин применяют в качестве пищевого
красителя, синьки и приготовления специальных чернил.
Составил А. Желтов













 chemistry
chemistry








