Similar presentations:
Оксиды серы (IV и VI). Серная кислота
1.
Оксиды серы (IV и VI).Серная кислота.
2.
SO2 – сернистый газХарактеристика и свойства
o Бесцветный газ с резким запахом
o Ядовит
o Тяжелее воздуха
o Хорошо растворим в воде
3.
Получение.В лаборатории:
Горение серы
S + O2 → SO2↑
Действие кислот на соли сернистой кислоты
Na2SO3 + 2HCl → 2NaCl + SO2 ↑ + H2O
4.
Химические свойства1).SO2 + H2O ↔ H2SO3
SO2 – восстановитель:
2).2 SO2 + O2 → 2 SO3
SO2 – окислитель:
3).SO2 + С → S + СO2
5.
Характеристика и свойстваSO3 – серный
ангидрид
Бесцветная жидкость
o При температуре <17 – белая кристаллическая
масса
o Гигроскопичен
o на воздухе «дымит», сильно поглощает влагу
(хранят в запаянных сосудах
o
6.
Физические свойствасерного ангидрида
Бесцветная, летучая, маслянистая
жидкость,
t° пл. = 17°C;
t° кип. = 45°С;
на воздухе «дымит», сильно поглощает
влагу (хранят в запаянных сосудах
7.
Химические свойстваI. -
SO3 кислотный оксид
1) SO3 + H2O
2) SO3 + 2KOH
3) CaO + SO3
Д\З Дописать уравнения, во 2 уравнении написать
ионное полное и сокращенное уравнение
8.
Получение оксида серы (VI)1. Окисление оксида серы (IV)
SO2 + O2
Д\З Дописать уравнения, уравнять с
помощью электронного баланса
9.
H SO2
4
серная кислота
Дать классификацию
серной кислоте.
10.
H2SO4классификация
По основности: двухосновная
По наличию кислорода:
кислородосодержащая
По силе: сильный электролит
11.
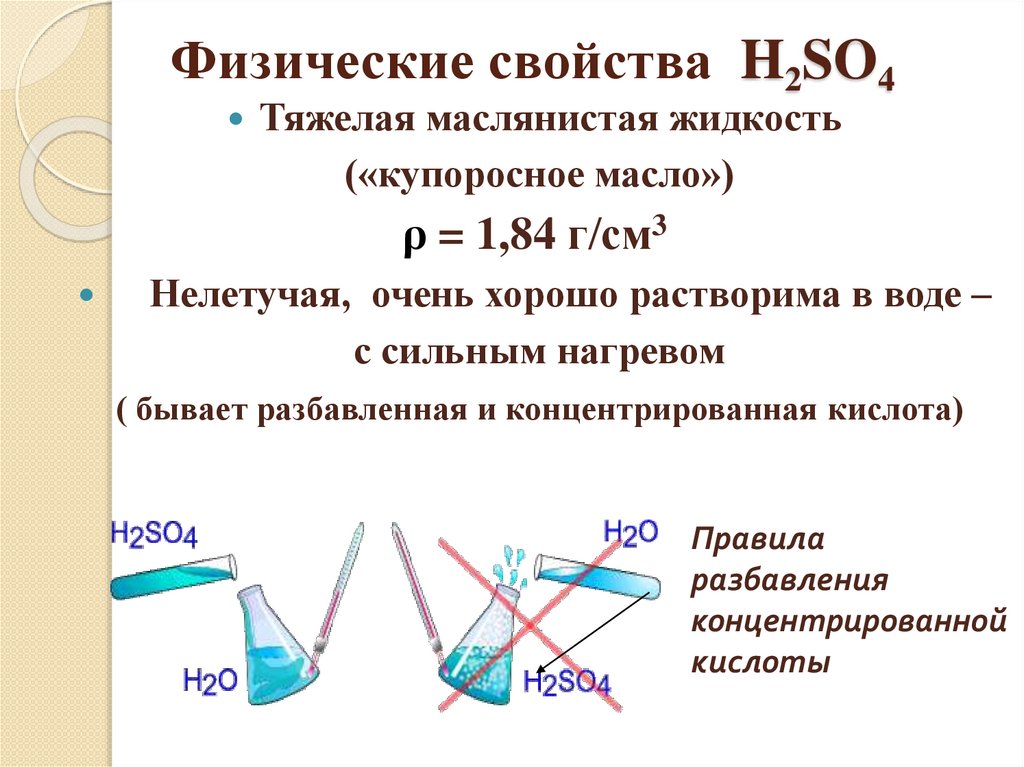
Физические свойства H2SO4Тяжелая маслянистая жидкость
(«купоросное масло»)
ρ = 1,84 г/см3
Нелетучая, очень хорошо растворима в воде –
с сильным нагревом
( бывает разбавленная и концентрированная кислота)
Правила
разбавления
концентрированной
кислоты
12.
Химические свойства H2SO4 (разбавл.)1. С металлами (в ряду активности металлов до Н):
H2SO4+Zn = … + …
2. С оксидами металлов:
H2SO4+K2O=… + …
3. С гидроксидами металлов:
H2SO4+2NaOH=… + …
4. С солями:
H2SO4+MgCO3=… +… + …
13.
Химические свойства H2SO41. С металлами (в ряду активности металлов до Н):
H2SO4+Zn=ZnSO4 + H2
2. С оксидами металлов:
H2SO4+K2O=K2SO4+H2O
3. С гидроксидами металлов:
H2SO4+2NaOH=Na2SO4+2H2O
4. С солями:
H2SO4+MgCO3=MgSO4+H2O+CO2
Д\З Дописать уравнения, в 1 уравнении написать электронный баланс,
2,3,4 написать полное ионное и сокращенное уравнение
14.
Качественная реакцияРеактивом на ион SO42 является катион Ва2++, т.к. с
ионами бария сульфат ион
образует белый нерастворимый
сульфат бария, выпадающий в
осадок.
Ва2++SO42- = BaSO4↓
15.
Концентрированная серная кислота1. Железо и алюминий пассивируются с серной
кислотой, т.е покрываются защитной пленкой,
поэтому кислоту(конц) можно перевозить в
стальных и алюминиевых цистернах.
2.Отнимает воду из молекул органических
веществ, обугливая их.
16.
Автоцистерна для перевозкисерной кислоты
17.
Применение серной кислоты.1. В производстве минеральных
удобрений
2. Как электролит в свинцовых
аккумуляторах
3. Для получения различных
минеральных кислот и солей
4. В нефтяной, металлообрабатывающей,
текстильной, кожевенной и др. отраслях
промышленности
5. В пищевой промышленности (пищевая
добавка Е513)















 chemistry
chemistry