Similar presentations:
Оксиды серы (IV) и (VI). Производство серной кислоты
1. Оксиды серы (IV) и (VI). Производство серной кислоты
2. Сероводород H2S
Физические свойства:1) газ без цвета, с
характерным запахом
гниющего белка,
сладковатым вкусом;
2)немного тяжелее воздуха;
3) Ткип = –60,3°C,
Тпл= –85,6°C;
4) на воздухе сероводород
горит голубоватым
пламенем;
5) очень ядовит;
6) растворяется в воде
(сероводородная вода);
7) зрывоопасны его смеси
с воздухом.
3. Сероводород H2S
Получение:t
1) S + H2 = H2S
2) FeS + 2HCl = FeCl2 + H2S↑
Химические свойства:
t
1) 2H2S + 3O2 = 2H2O + 2SO2 (при избытке кислорода)
2H2S + O2 = 2H2O + 2S (при недостатке кислорода)
2) 4Ag + 2H2S + O2 = 2Ag2S + 2H2O
3)Хороший восстановитель
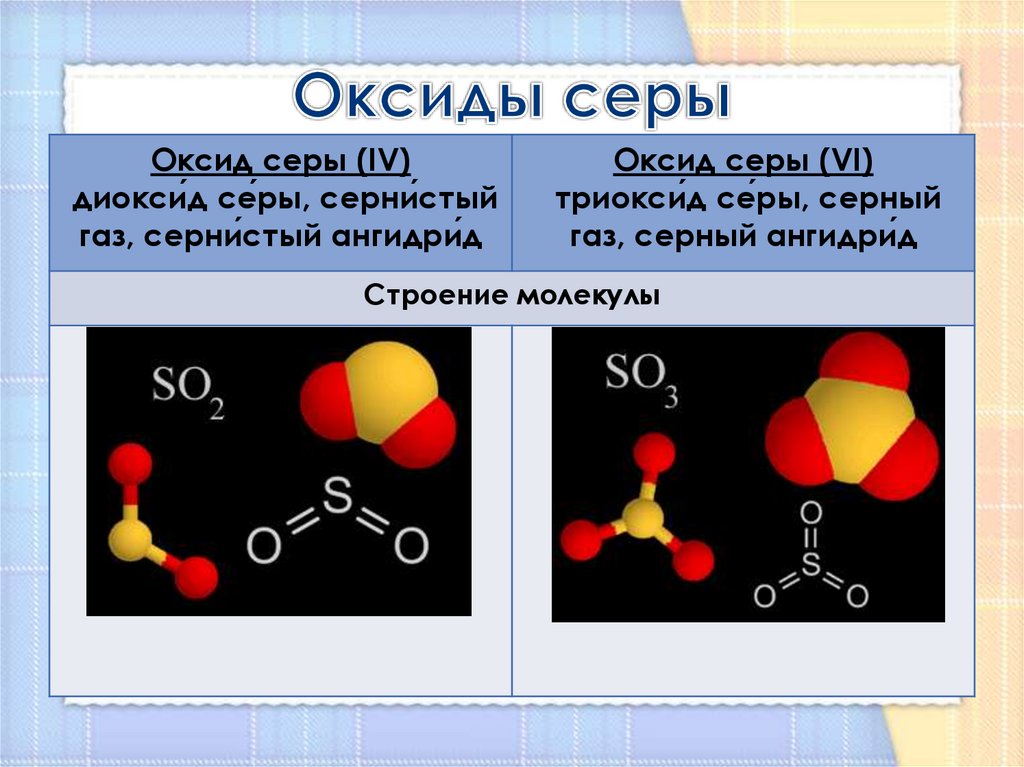
4. Оксиды серы
Оксид серы (IV)диокси́д се́ры, серни́стый
газ, серни́стый ангидри́д
Оксид серы (VI)
триокси́д се́ры, серный
газ, серный ангидри́д
Строение молекулы
5.
Оксид серы (IV)Оксид серы (VI)
Получение
В промышленности:
обжиг сульфидов:
t
ZnS + O2 = ZnO + SO2
1) Окисление SO2
2SO2 + O2
, V2O5
t
2SO3
2) Разложение
t
4FeS2 + 11O2 →
сульфатов (для
2Fe2O3 + 8SO2↑ металлов средней
активности):
t
Fe2(SO4)3 → Fe2O3 + 3SO3
6.
Оксид серы (IV)Оксид серы (VI)
Получение
В лаборатории:
действием сильных
кислот на сульфиты
и гидросульфиты:
Na2SO3 + H2SO4 →
Na2SO4 + H2O + SO2↑
7.
Оксид серы (IV)Оксид серы (VI)
Физические свойства
1) бесцветный газ с
характерным резким
удушливым запахом (запах
загорающейся спички);
1) в обычных условиях
легколетучая бесцветная
жидкость с удушающим
запахом;
2) хорошо растворяется в
воде с образованием
нестойкой сернистой
кислоты;
2) при температурах ниже
16,9 °C застывает;
3) под давлением сжижается
при комнатной температуре;
4) ядовит;
5) обесцвечивает многие
красители, убивает
микроорганизмы.
3) гигроскопичен.
8.
Оксид серы (IV)Оксид серы (VI)
Химические свойства
Проявляет как
1) Проявляет только
свойства окислителя, свойства окислителя:
так и восстановителя: 3SO3 + H2S → 4SO2 + H2O
SO2 + 2H2S = 3S + 2H2O 2) Растворяется в 100%-й
серной кислоте, образуя
олеум:
H2SO4 (100 %) + SO3 → H2S2O7
олеум
9.
Оксид серы (IV)Оксид серы (VI)
Химические свойства
Проявляют свойства типичного кислотного
оксида:
1) + вода → сернистая кислота
2) + основный оксид, + основание
3) + амфотерный оксид, гидроксид
Сульфит
SO32-
Сульфат
SO42-
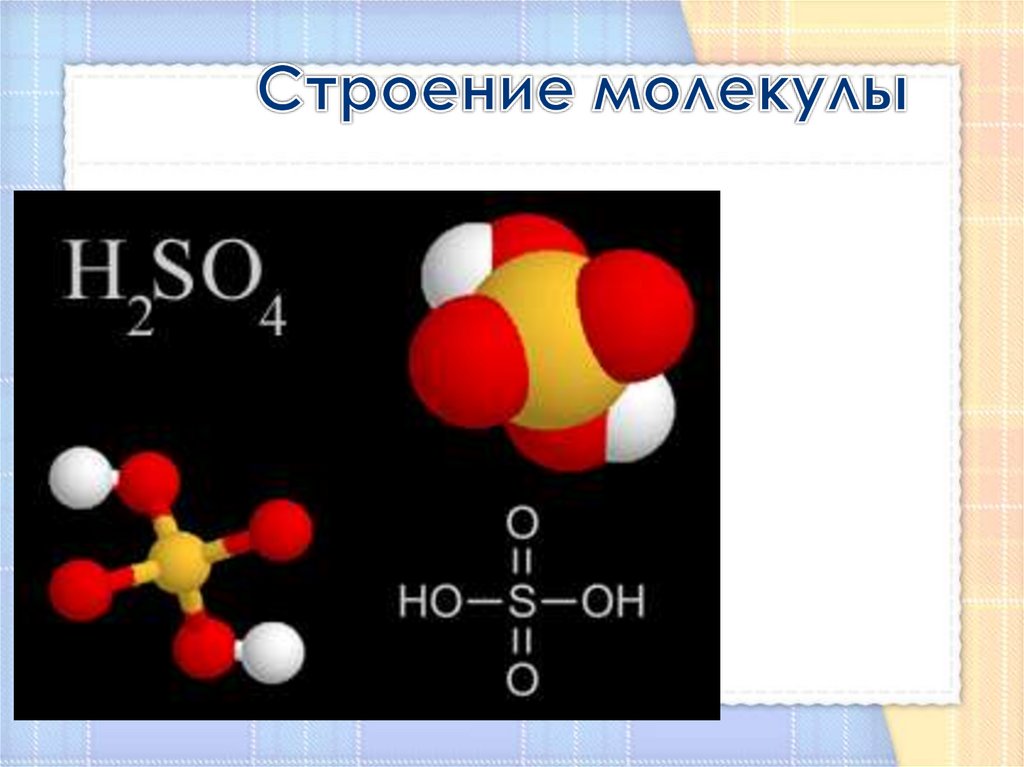
10. Строение молекулы
11. Химические свойства
Общие с другими кислотами Специфические1) разб. H2SO4 + Ме = соль
+ H2
1) конц. H2SO4 + Me
2) + основный оксид
+ основание
2) конц. H2SO4 + неМе
3) + амфотерный оксид
+ амфотерный
гидроксид
3) обугливание органических
веществ
конц. H2SO4
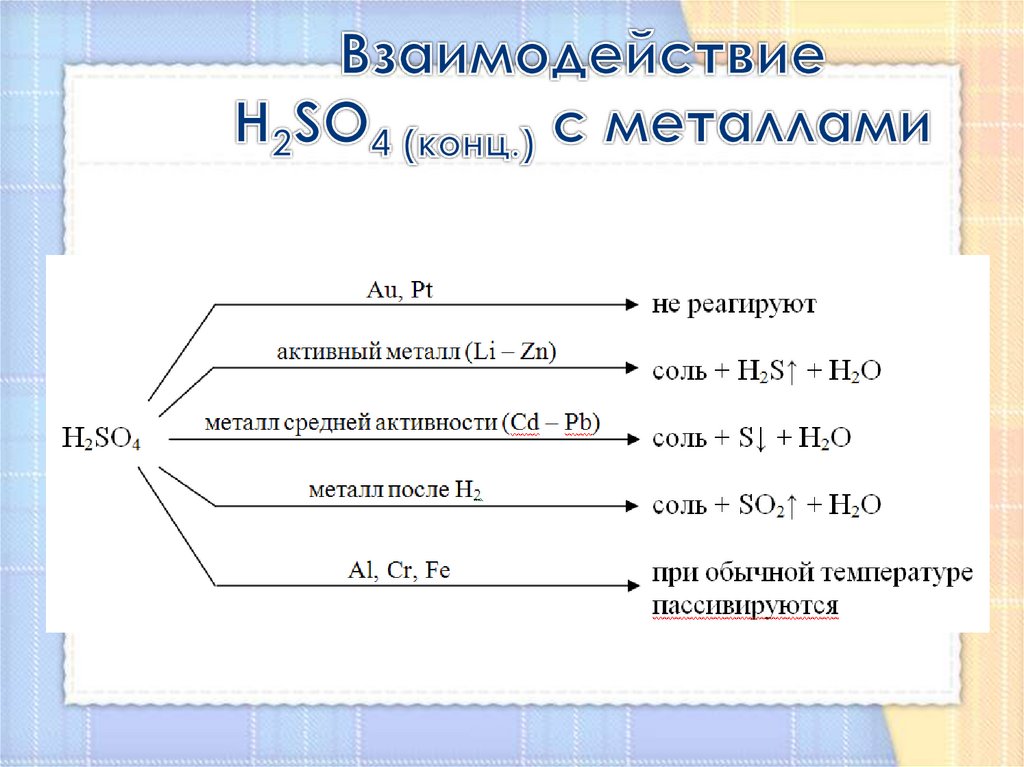
Взаимодействие H2SO4 (конц.) с
металлами
С + 2H2SO4 (конц.) = 2SO2 + CO2 + 2H2O
S + 2H2SO4 (конц.) = 3SO2 + 2H2O
2P + 5H2SO4 (конц.) = 2H3PO4 + 5SO2 +
2H2O
С12Н22О11 + 2H2SO4 (конц.) =
11С + 2SO2 + CO2
+ 13H2O
4) + соль
4) Качественная реакция на H2SO4 и
ее соли – взаимодействие с
растворимыми солями бария
12. Взаимодействие H2SO4 (конц.) с металлами
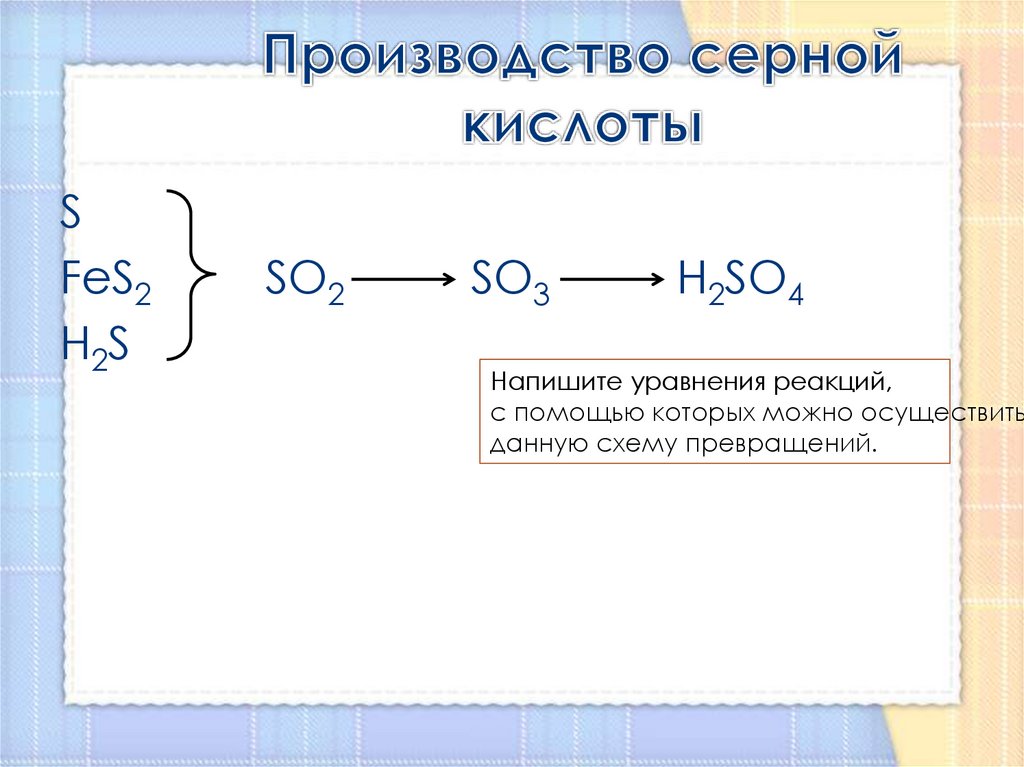
13. Производство серной кислоты
SFeS2
H2S
SO2
SO3
H2SO4
Напишите уравнения реакций,
с помощью которых можно осуществить
данную схему превращений.








 chemistry
chemistry