Similar presentations:
Оксид серы. Серная кислота
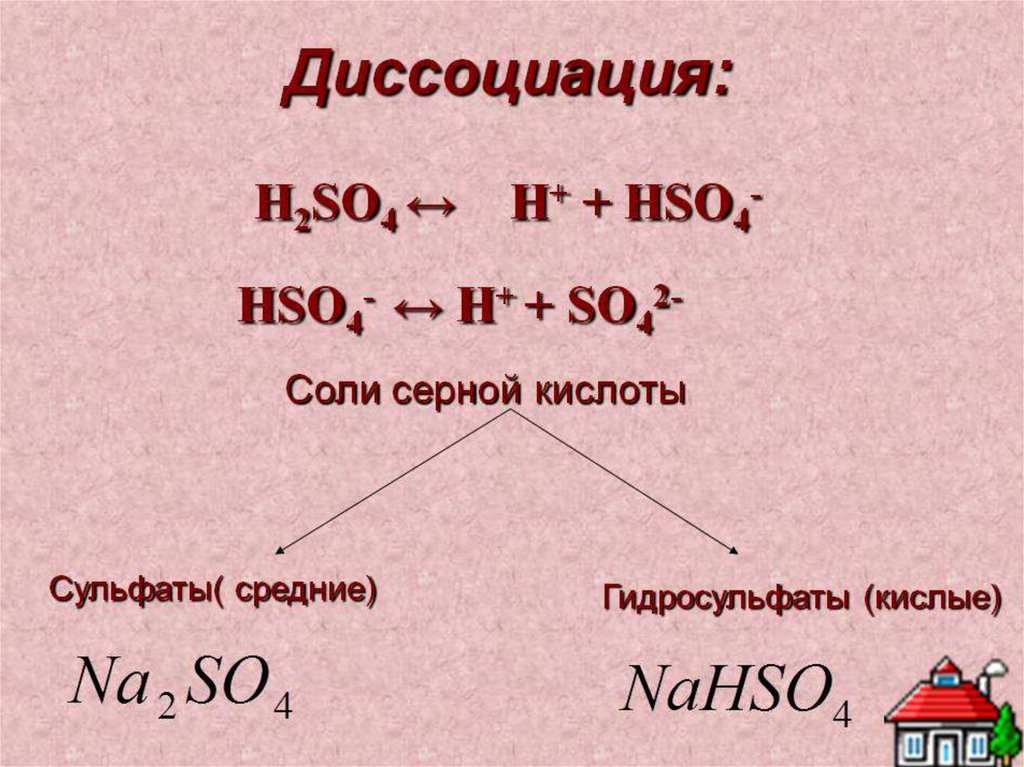
1.
Оксид серы .Серная кислота.
2.
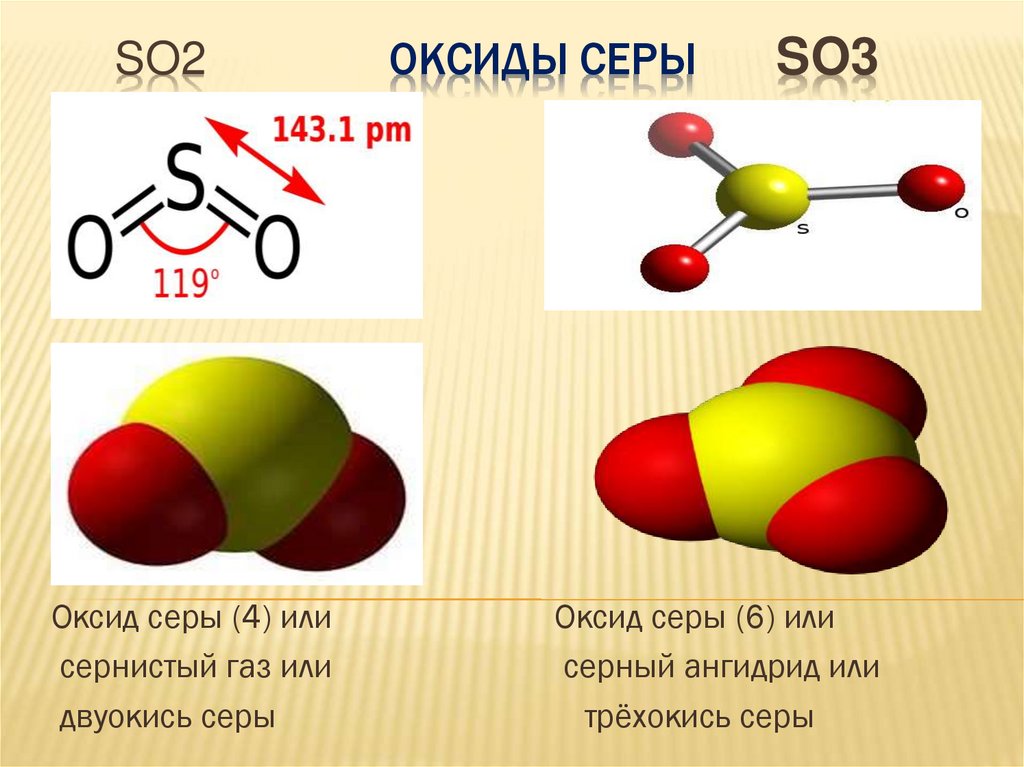
SO2Оксид серы (4) или
сернистый газ или
двуокись серы
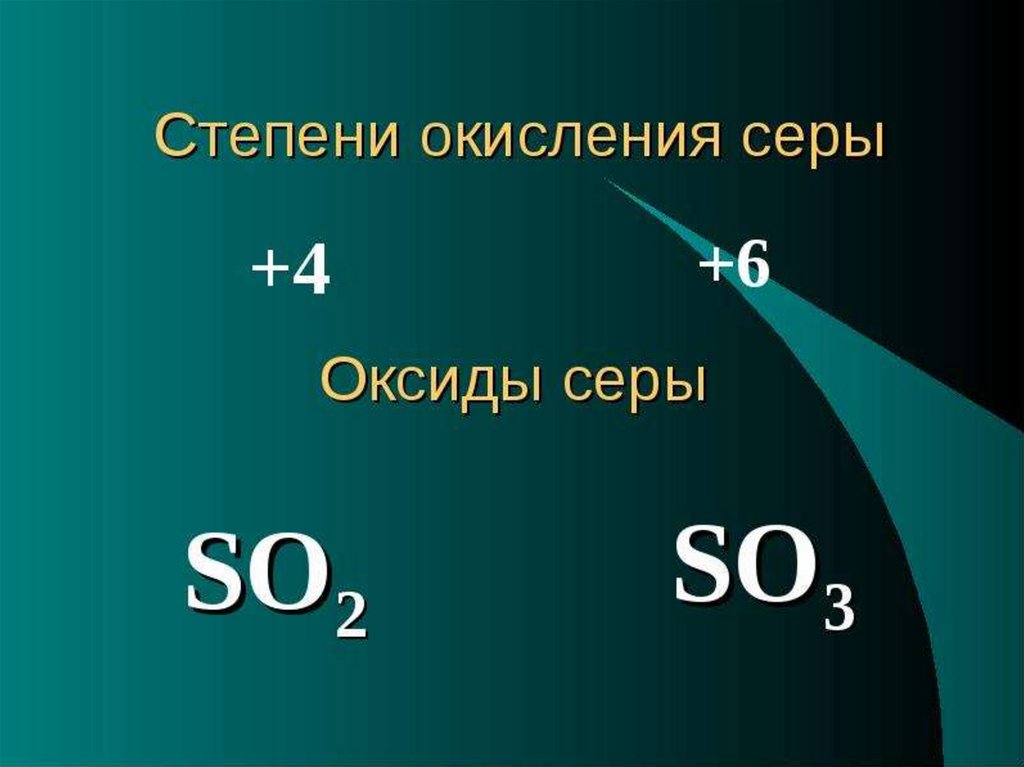
ОКСИДЫ СЕРЫ
SO3
Оксид серы (6) или
серный ангидрид или
трёхокись серы
3.
4.
5.
6.
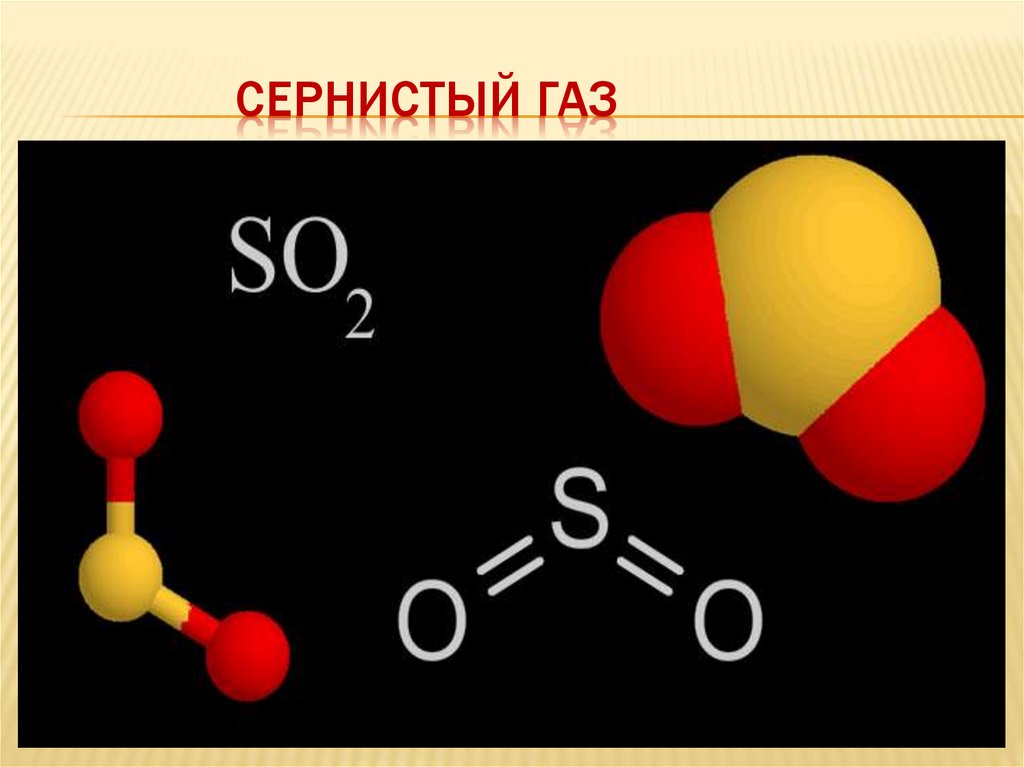
СЕРНИСТЫЙ ГАЗ7.
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДА СЕРЫ(4)Газ без цвета, с резким
характерным запахом жжённых
спичек tкип. = -10 ̊ С, tпл. = - 75 ̊С,
растворяется в воде
(растворимость 11,5 г в 100г. воды).
SO2 очень токсичен. При
кратковременном вдыхании
оказывает сильное раздражающее
действие, вызывает кашель и
першение в горле. Оказывает
негативное влияние на зелёные
растения и животные ткани.
8.
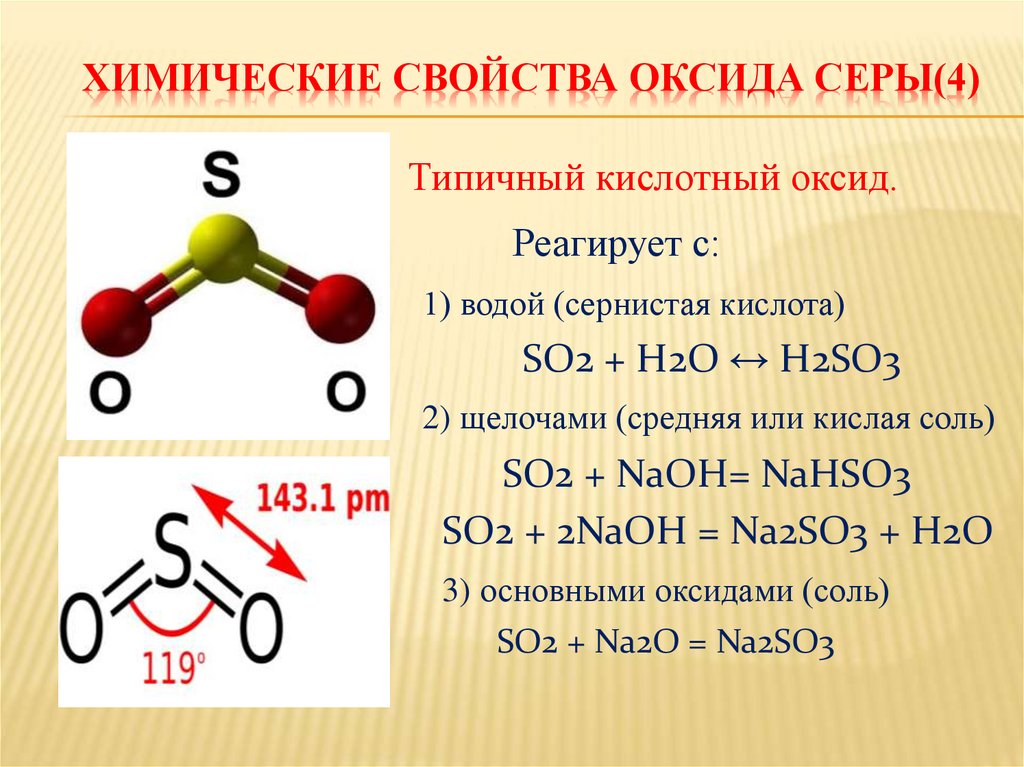
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДА СЕРЫ(4)Типичный кислотный оксид.
Реагирует с:
1) водой (сернистая кислота)
SO2 + H2O ↔ H2SO3
2) щелочами (средняя или кислая соль)
SO2 + NaOH= NaHSO3
SO2 + 2NaOH = Na2SO3 + H2O
3) основными оксидами (соль)
SO2 + Na2O = Na2SO3
9.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДА СЕРЫ(4)4. В химических реакциях
способен выступать как в
роли окислителя, так и в роли
восстановителя, причём
преобладают восстановительные
свойства
а) S+4O2 + 2H2S-2 = 3S0 + 2H2O
б) S+4O2 + I20 + 2H2O = H2S+6O4 + 2HIв)
2S+4O2 + O2 = 2S+6O3
10.
11.
ПОЛУЧЕНИЕ ОКСИДА СЕРЫ(4)1. В промышленности получают
обжигом пирита FeS2 в кипящем слое
4FeS2 + 11O2 = 2Fe2O3 + 8 SO2↑
2. В лабораториях взаимодействием
сильных кислот с сульфитами металлов
Na2SO3 + 2HCl = 2NaCl + H2SO3
причём слабая, неустойчивая
сернистая кислота разлагается при
нагревании на воду и сернистый газ.
H2SO3 ↔ H2O + SO2↑
12.
13.
ОКСИД СЕРЫ (6)В обычных условиях легколетучая
бесцветная жидкость с
удушающим
запахом. При температурах ниже
16,9 °C застывает с образованием
смеси различных кристаллических
модификаций твёрдого SO3.
α-форма SO3 состоит преимущественно из молекул триме́ра.
При охлаждении из пара сначала образуется бесцветная,
похожая на лёд, неустойчивая α-форма, которая постепенно
переходит в присутствии влаги в устойчивую β-форму —
белые «шёлковистые» кристаллы, похожие на асбест Обе
модификации на воздухе «дымят» (образуются
капельки H2SO4) вследствие высокой гигроскопичности SO3
14.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДА СЕРЫ(6)SO3 — типичный кислотный оксид.
1) Взаимодействует с водой образует серную
кислоту:
SO3 + H2O = H2SO4
Однако в данной реакции серная
кислота образуется в виде аэрозоля, и
поэтому в промышленности оксид
cеры (VI) растворяют в серной кислоте с
образованием олеума, который далее растворяют в воде до
образования серной кислоты нужной концентрации.
2) Взаимодействует с основаниями:
2NaOH + SO3 = Na2SO4 + H2O
3) Основными оксидами: СaO + SO3 = CaSO4
4) SO3 растворяется в 100%-й серной кислоте, образуя
олеум: H2SO4 + nSO3 = H2SO4 × nSO3
15.
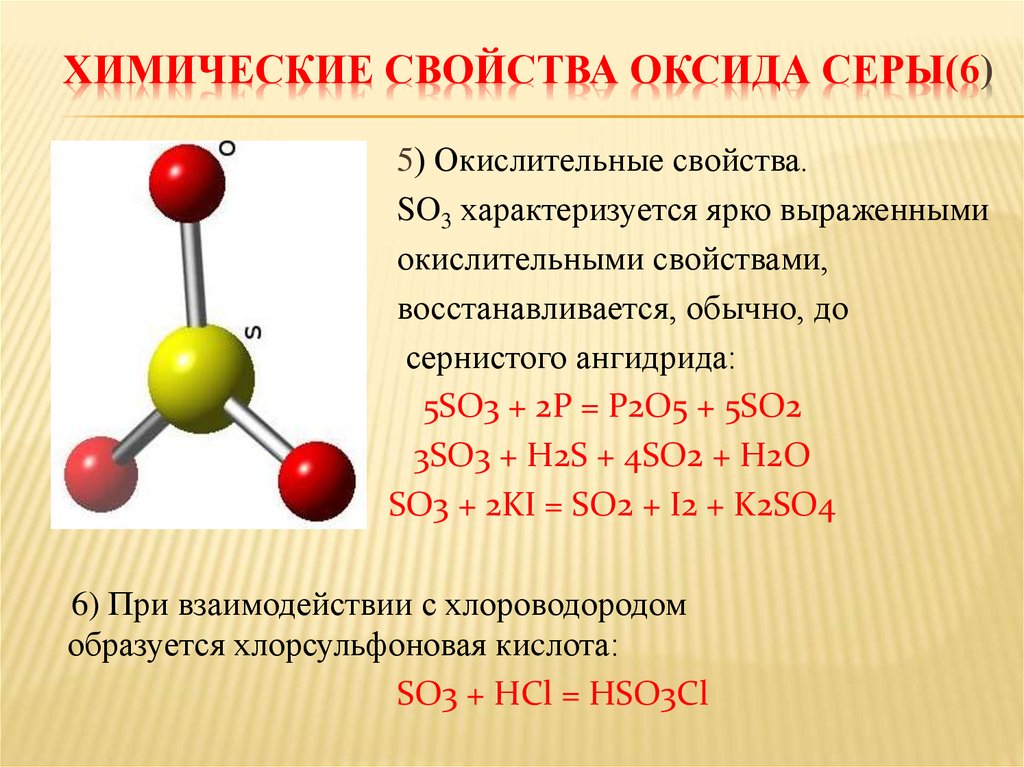
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДА СЕРЫ(6)5) Окислительные свойства.
SO3 характеризуется ярко выраженными
окислительными свойствами,
восстанавливается, обычно, до
сернистого ангидрида:
5SO3 + 2P = P2O5 + 5SO2
3SO3 + H2S + 4SO2 + H2O
SO3 + 2KI = SO2 + I2 + K2SO4
6) При взаимодействии с хлороводородом
образуется хлорсульфоновая киcлота:
SO3 + HCl = HSO3Cl
16.
ПОЛУЧЕНИЕ ОКСИДА СЕРЫ (6)Получают, оксид серы (6) окисляя оксид
серы(4) кислородом воздуха при
нагревании , в присутствии катализатора
(V2O5, Pt, или оксид железа (3) ( Fe2O3).
2SO2 + O2 = 2SO3 + Q
Можно получить термическим
разложением сульфатов: Fe2(SO4)3 = Fe2O3 + 3SO3↑
или взаимодействием SO2 с озоном: SO2 + O3 = SO3 + O2
Для окисления SO2 используют также NO2:
SO2 + NO2 = SO3 + NO
Эта реакция лежит в основе исторически первого, нитрозного
способа получения серной кислоты.
17.
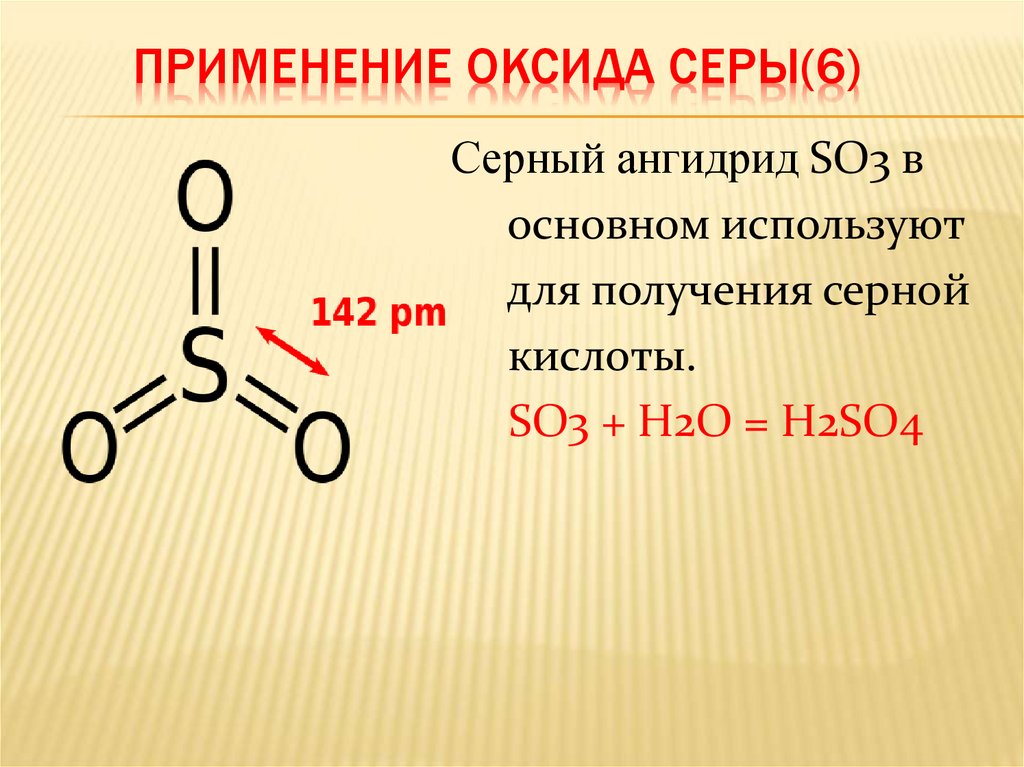
ПРИМЕНЕНИЕ ОКСИДА СЕРЫ(6)Серный ангидрид SO3 в
основном используют
для получения серной
кислоты.
SO3 + H2O = H2SO4
18.
СЕРНАЯ КИСЛОТА (КУПОРОСНОЕ МАСЛО)19.
СЕРНАЯ КИСЛОТА H2SO4Серная кислота H2SO4 – очень сильная
двухосновная кислота, отвечающая
высшей степени окисления серы +6.
При обычных условиях
концентрированная серная кислота –
тяжёлая маслянистая жидкость без
цвета, без запаха, с кислым медным
вкусом. tпл. = 10,40С, tкип. = 279,60С.
Продажная концентрированная кислота содержит
примерно 96, 5% H2SO4; плотность её составляет 1, 84 г/см3.
Неразбавленная кислота чувствуется по весу: 1 литр весит
почти 2 кг.
20.
СЕРНАЯ КИСЛОТА ИСТОРИЧЕСКАЯ СПРАВКАСерная кислота известна с древности,
встречаясь в природе в свободном
виде, например в виде озёр вблизи
вулканов. Возможно первое
упоминание о кислых газах
получаемых при прокаливании
квасцов или железного купороса
«зелёного камня», встречается в
сочинениях, приписываемых
арабскому алхимику Джабир ибн
Хайяну.
В 9 веке, персидский химик Ар-Рази,
получил серную кислоту прокаливая смесь железного и
медного купороса.
21.
Химические свойства H2SO41. С металлами (в ряду активности металлов до Н):
H2SO4+Zn = … + …
2. С оксидами металлов:
H2SO4+K2O=… + …
3. С гидроксидами металлов:
H2SO4+2NaOH=… + …
4. С солями:
H2SO4+MgCO3=… +… + …
22.
Химические свойства H2SO41. С металлами (в ряду активности металлов до Н):
H2SO4+Zn=ZnSO4 + H2
2. С оксидами металлов:
H2SO4+K2O=K2SO4+H2O
3. С гидроксидами металлов:
H2SO4+2NaOH=Na2SO4+2H2O
4. С солями:
H2SO4+MgCO3=MgSO4+H2O+CO2
23.
Качественная реакцияна ион SO42 Реактивом на серную кислоту и ее
соли является катион бария , т.к. с
ионами бария сульфат ион
образует белый нерастворимый
сульфат бария, выпадающий в
осадок.
Ва2++SO42- = BaSO4↓
24.
Концентрированная серная кислотаСерная кислота(конц) восстанавливается до
(Н2S,S,SO2) в зависимости от активности металла и условий
протекания реакции.
Железо и алюминий пассивируются кислотой, т.е покрываются
защитной пленкой, поэтому кислоту(конц) можно перевозить в
стальных и алюминиевых цистернах.
Сu+2H2SO4(конц)→CuSO4+2H2O+SO2
4Zn+5H2SO4(конц)→4ZnSO4+4H2O+H2S
Отнимает воду из молекул органических веществ, обугливая их.
Взаимодействие кислоты с сахарозой(C12H22O11)
C12H22O11 +2H2SO4(конц)=11C + 13H2O↑+2SO2↑+ CO2↑
25.
Автоцистерна для перевозкисерной кислоты

















 chemistry
chemistry








