Similar presentations:
Оксид серы (VI). Серная кислота
1. Оксид серы (VI). Серная кислота.
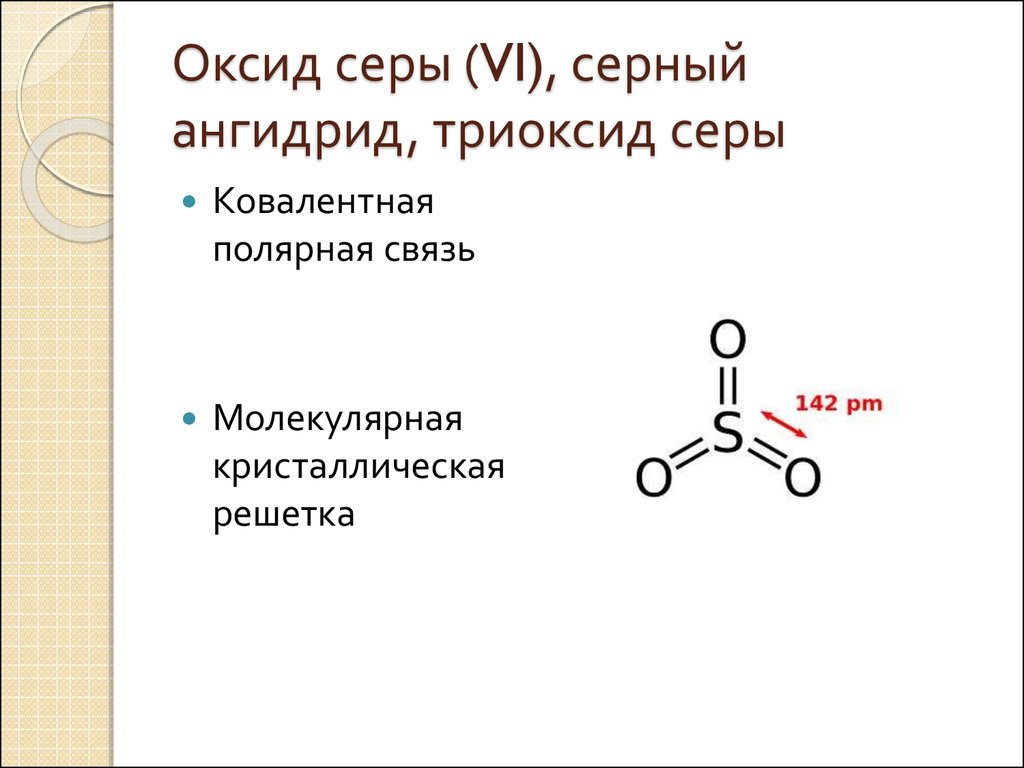
2. Оксид серы (VI), серный ангидрид, триоксид серы
Ковалентнаяполярная связь
Молекулярная
кристаллическая
решетка
3. Физические свойства серного ангидрида
Бесцветная, летучая, маслянистаяжидкость, t° пл. = 17°C; t° кип. =
45°С; на воздухе "дымит", сильно
поглощает влагу (хранят в
запаянных сосудах
4. Химические свойства
I. SO - представитель кислотныхоксидов
1)
2)
3)
3
5. Получение оксида серы (VI)
1. Окисление оксида серы (IV)6. H2SO4 серная кислота
H SO серная кислота2
4
Дать классификацию серной кислоте.
7. Разбавление серной кислоты
Относительно смешиваниясерной кислоты с водой с давних
пор существует строгое правило:
«Сначала вода, потом кислота,
иначе произойдет ужасное».
Если же сделать наоборот, то
первые же порции воды,
оставшись наверху (вода легче
кислоты) и взаимодействуя с
кислотой, разогреваются так
сильно, что вскипают и
разбрызгиваются вместе с
кислотой; могут попасть в глаза,
на лицо и одежду.
8. Химические свойства серной кислоты разбавленная серная кислота проявляет все характерные свойства кислот:
С оксидами металлов.(реакция обмена)Н SO4+MeO→MeSO +H O
2. С основаниями.(реакция обмена, реакция нейтрализации)
Н SO4+Me(OН)n→MeSO +H O
3. С металлами.
Н SO4+Me(до Н)→MeSO (р)+H ↑(реакция замещения)
1.
2
4
2
4
2
2
4
2
2
4.С солями( реакция обмена)
Н SO4+MeR(Р)→MeSO
2
4
(Р)+HR
(протекает в том случае, если образуется осадок или газ)
9.
Качественная реакция на ион –SO42 Реактивом на серную кислоту и ее солиявляется катион бария , т.к. с ионами
бария сульфат ион образует белый
нерастворимый сульфат бария,
выпадающий в осадок.
Ва2++SO42- = BaSO4↓
10. Концентрированная серная кислота
Ме+Н2SO4(кoнц)→МеSO4+H2O+(Н2S,S,SO2)Серная кислота(конц) восстанавливается до
(Н2S,S,SO2) в зависимости от активности металла и условий
протекания реакции.
Железо и алюминий пассивируются кислотой, т.е покрываются защитной пленкой, поэтому
кислоту(конц) можно перевозить в стальных и алюминиевых цистернах.
Сu+2H2SO4(конц)→CuSO4+2H2O+SO2
4Zn+5H2SO4(конц)→4ZnSO4+4H2O+H2S
Концентрированная серная кислота способна отнимать воду из молекул
органических веществ, обугливая их.
Взаимодействие кислоты с сахарозой(C12H22O11)
C12H22O11 + 2H2SO4(конц) = 11C + 13H2O↑ +2SO2↑
+CO2↑
11.
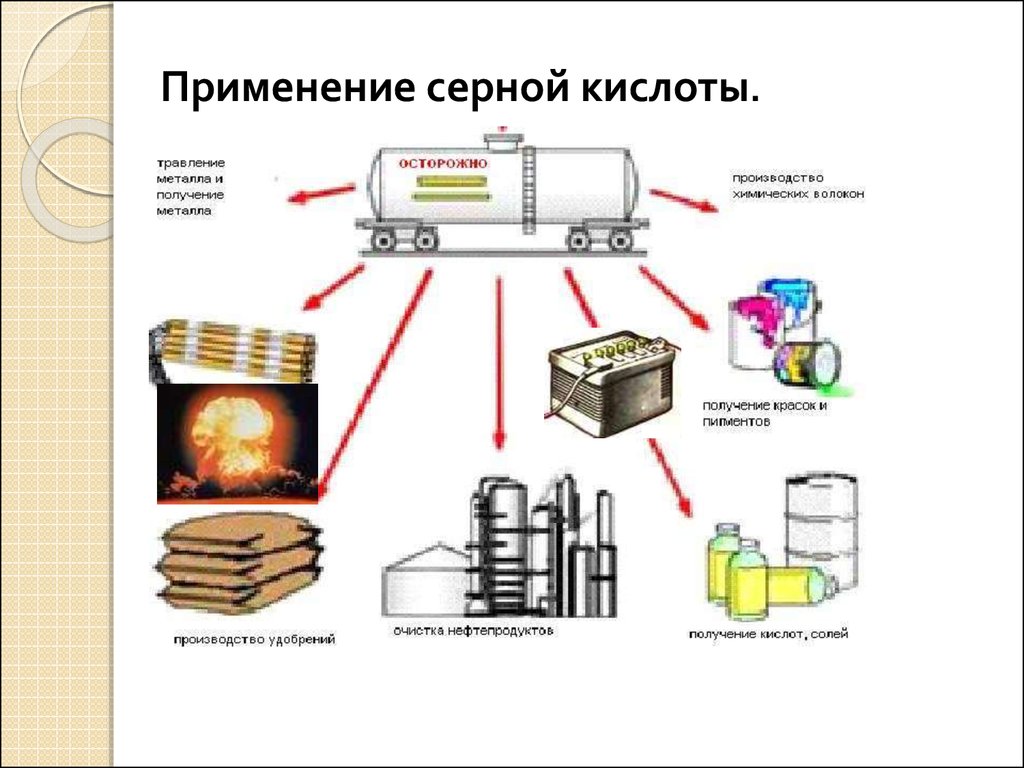
Применение серной кислоты.12.
Кислотные озераВулкан Малый Семячик
Вулканический хребет длиной
около 3 км., на гребне которого
имеются три кратера.
В южном (кратер Троицкого) на
глубине 170м. находится
необычное кислое озеро.
Температура этого
непрозрачного озера
колеблется от +270С до
+420С, а уровень
минерализации
соответствует раствору
серной и соляной кислот
средней концентрации.
Поражают размеры озера:
ширина около полукилометра, а
глубина - до 140м.
Существуют предположения,
что кислотное озеро возникло
сравнительно недавно в
результате извержения вулкана,
произошедшего незаметно для
людей.
12










 chemistry
chemistry








