Similar presentations:
Рак пищевода. Клиническая анатомия
1.
Кафедра онкологии сгематологией
Рак
пищевода
{
ЯГМА 2012 г.
2.
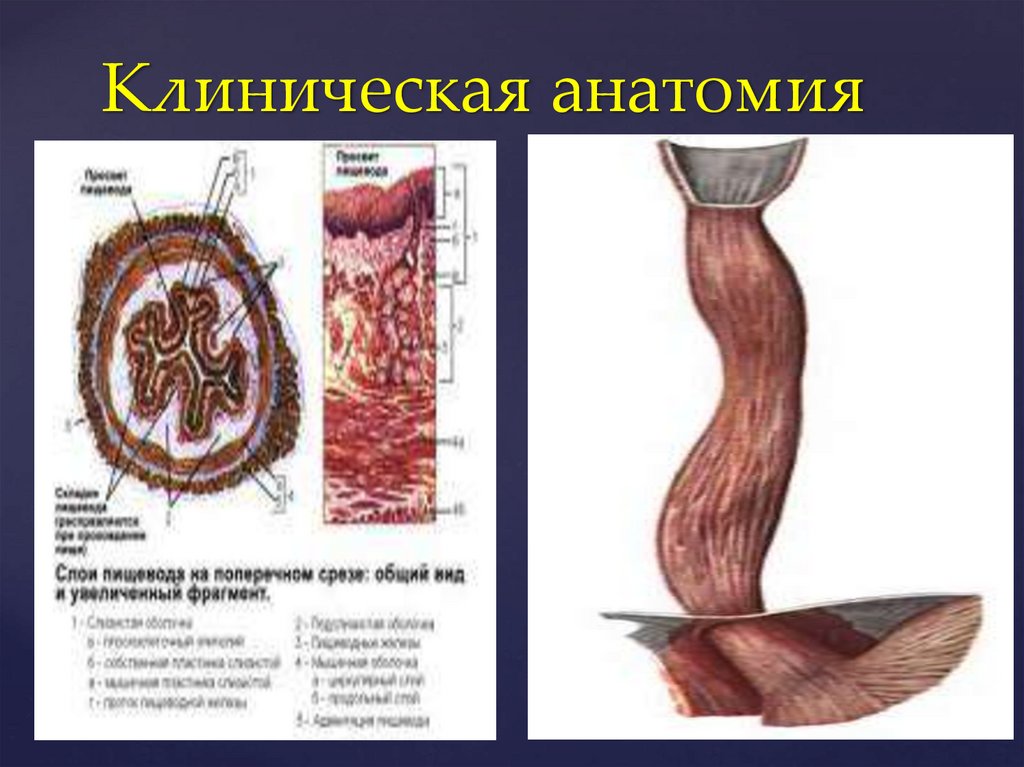
Клиническая анатомия3.
РАК ПИЩЕВОДА (2010г.)Ежегодно в мире этой патологией болеет около
400 тысяч человек, а умирает - 300 тысяч.
В России – 1.5% среди всех злокачественных
новообразований (14 место в структуре
онкозаболеваемости) (оба пола).
Стандартизованный показатель заболеваемости –
3.22 на 100 000 населения (оба пола).
Соотношение мужчин и женщин – 3:1.
Возрастной интервал с наиболее высокой
заболеваемостью 55-70 лет.
4.
Заболеваемость раком пищеводав мире
Высокая
ТУРКМЕНИЯ
КАЗАХСТАН…..
КИТАЙ
ИРАН
ИНДИЯ
ЯПОНИЯ КОРЕЯ
Низкая
АРМЕНИЯ
ВЬЕТНАМ
ИЗРАИЛЬ
5.
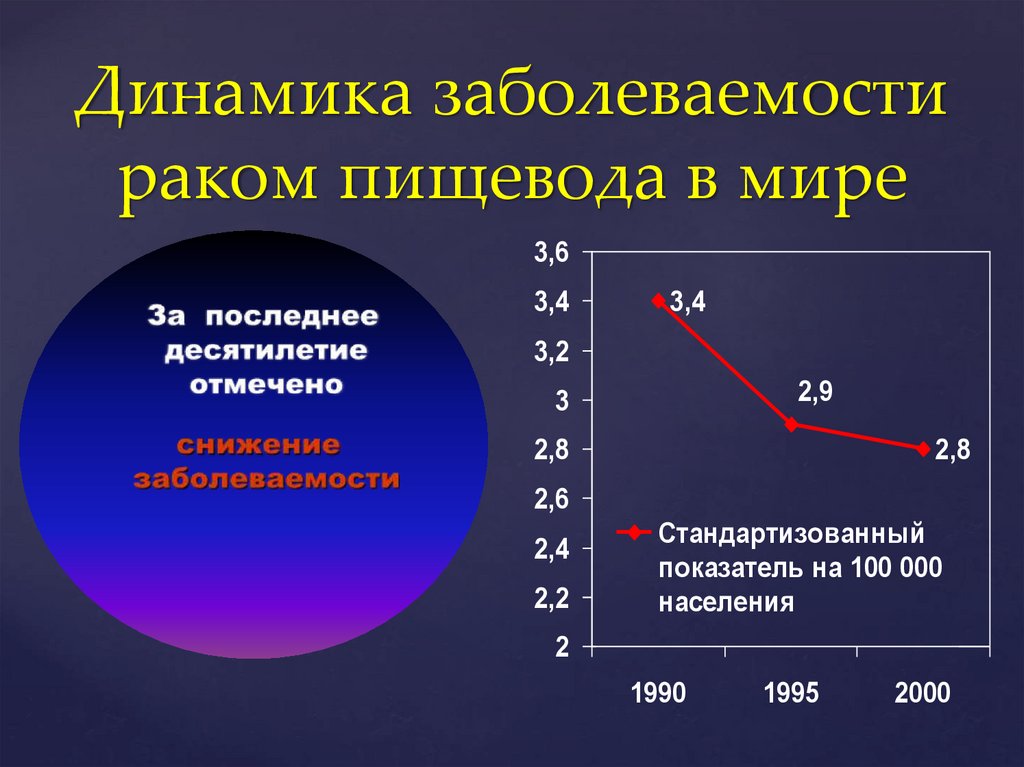
Динамика заболеваемостираком пищевода в мире
3,6
3,4
3,4
3,2
2,9
3
2,8
2,8
2,6
2,4
2,2
Стандартизованный
показатель на 100 000
населения
2
1990
1995
2000
6.
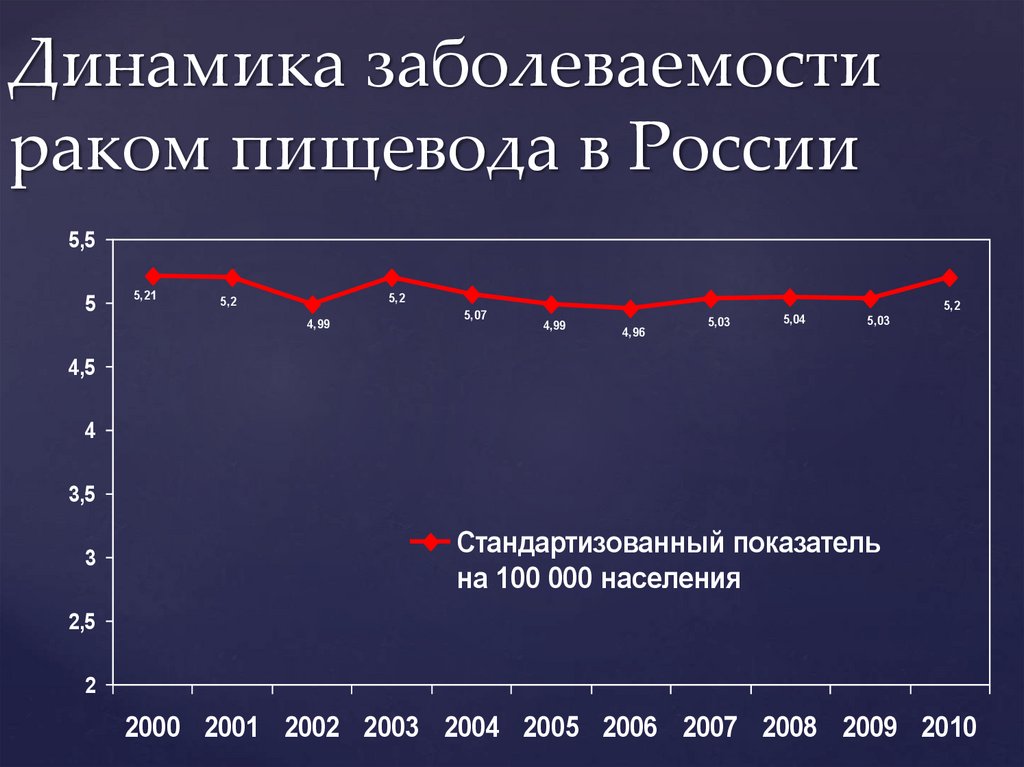
Динамика заболеваемостираком пищевода в России
5,5
5
5,21
5,2
5,2
4,99
5,07
5,2
4,99
4,96
5,03
5,04
5,03
4,5
4
3,5
3
Стандартизованный показатель
на 100 000 населения
2,5
2
2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010
7.
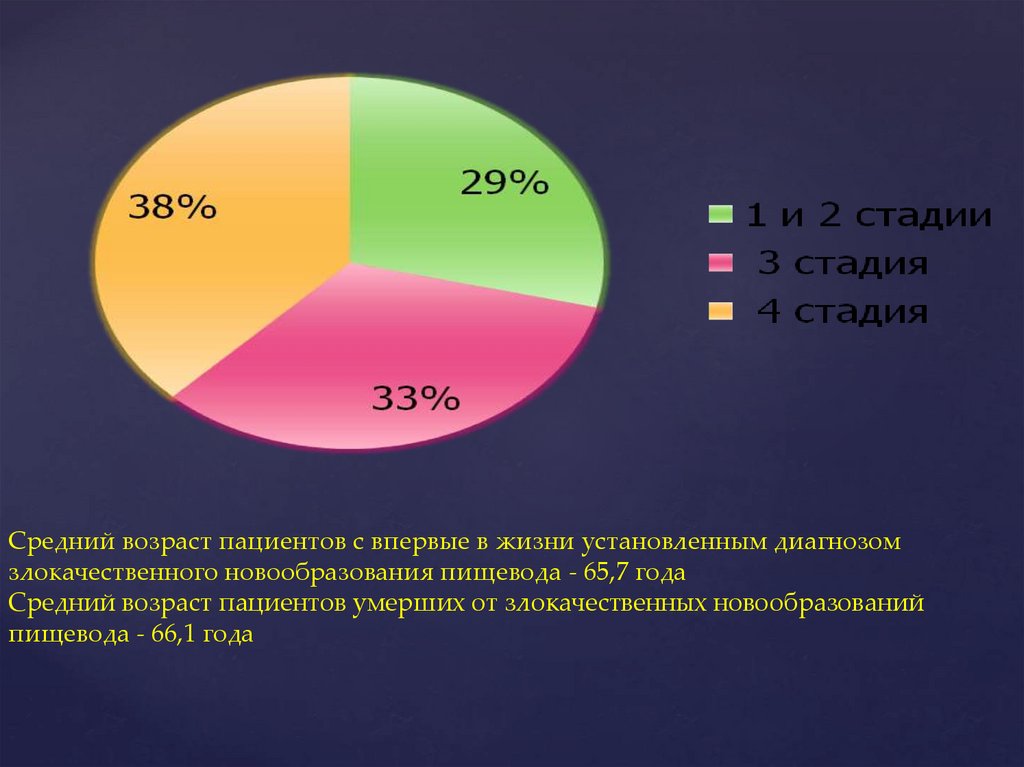
Средний возраст пациентов с впервые в жизни установленным диагнозомзлокачественного новообразования пищевода - 65,7 года
Средний возраст пациентов умерших от злокачественных новообразований
пищевода - 66,1 года
8.
РАК ПИЩЕВОДА в РОССИИ(2011г.)
При профилактических
осмотрах выявлено
2,2%
пациентов из вновь
заболевших
9.
Одногодичная летальность вРоссии
при раке пищевода
составляет 65,2%.
10.
5-летняя выживаемость по всемстадиям рака пищевода
колеблется от 2 до 8%
11.
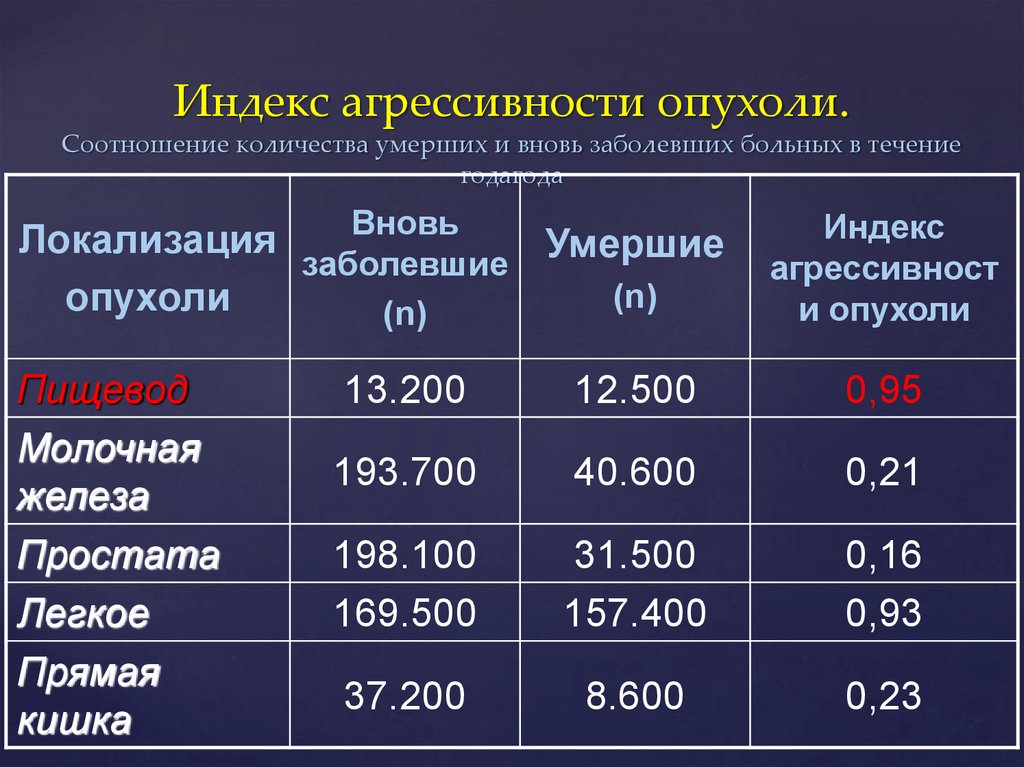
Индекс агрессивности опухоли.Соотношение количества умерших и вновь заболевших больных в течение
годагода
Вновь
Локализация
Умершие
заболевшие
(n)
опухоли
(n)
Пищевод
Молочная
железа
Простата
Легкое
Прямая
кишка
Индекс
агрессивност
и опухоли
13.200
12.500
0,95
193.700
40.600
0,21
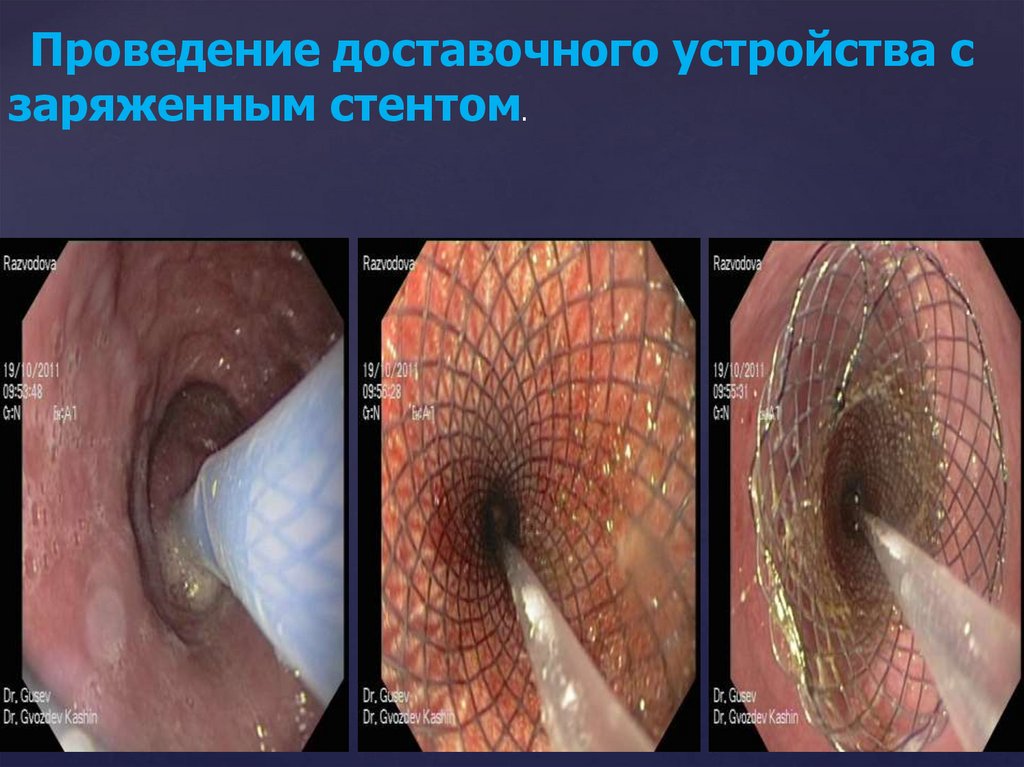
198.100
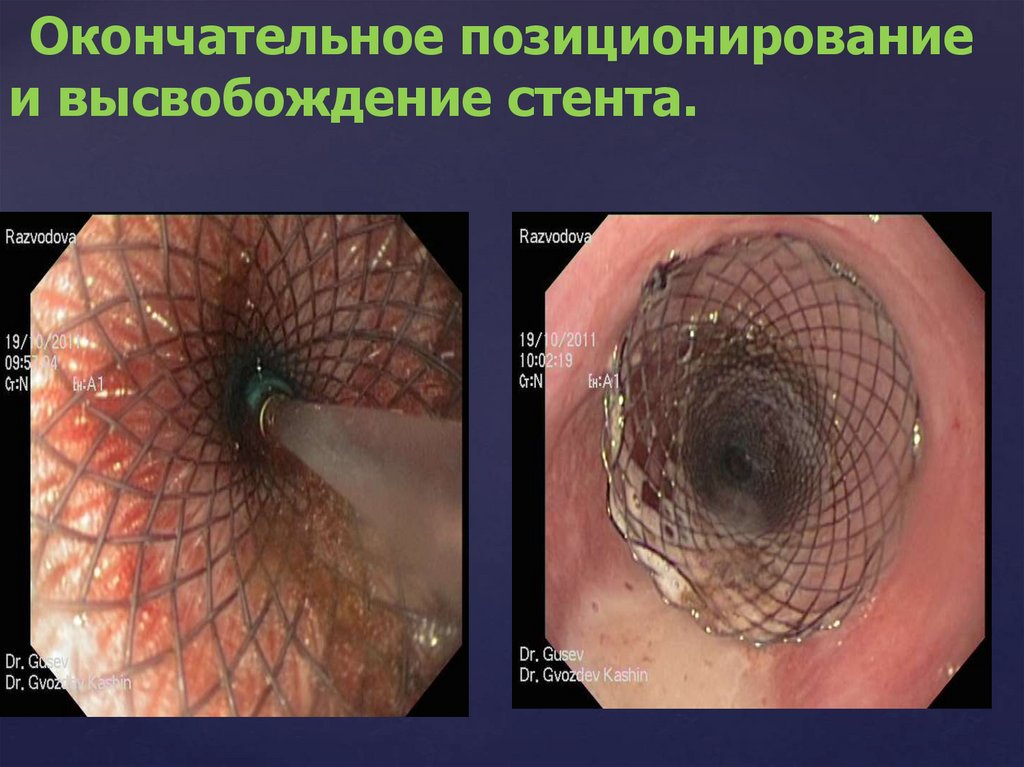
169.500
31.500
157.400
0,16
0,93
37.200
8.600
0,23
12.
Факторы рискакурение табака
употребление крепких алкогольных напитков;
особенности питания (прием горячей пищи и
жидкостей, еда в сухомятку, употребление отрубей
или проса с высоким содержанием кремнезема, пища с
высоким содержанием танина, низкое содержание
витаминов, особенно группы В и С)
лейкоплакия слизистой оболочки пищевода
синдром Пламмера–Винсона (триада: нарушение
глотания, железодефицитная анемия и глоссит)
ожоги пищевода
ахалазия пищевода
пищевод Барретта
тилоз (генетически детерминированный аутосомно–
доминантный признак, определяющий развитие
ладонно–подошвенного гиперкератоза).
13.
Длительное курение увеличивает риск развитияплоскоклеточного РП в 5 раз, а аденокарциномы в
2 раза.
у пациентов, куривших более 20 лет, но
бросивших, риск возникновения
плоскоклеточного РП в течении последующих 30
лет остается увеличенным в три раза.
У лиц, употребляющих крепкие алкогольные
напитки, риск развития плоскоклеточного РП
увеличивается в 3 раза.
Однако, употребление вина снижает риск
развития аденокарциномы пищевода
(приблизительно на 40% процентов).
пищевода Барретта увеличивает риск развития
аденокарциномы пищевода в 30–40 раз (Stein H.J.,
1996 Давыдов М.И. и соавт., 2003). Однажды
появившись, цилиндроклеточная метаплазия в
дистальных отделах пищевода не подвержена
обратному развитию (реверсии).
14.
Пребластоматозныесостояния
15.
Многократно повторяющееся воздействиевредных факторов приводит к возникновению
хронического эзофагита, который является
предраковым заболеванием пищевода.
Причины его возникновения различны:
16.
Пищевод Барретта приобретенное патологическоесостояние, характеризующееся
метапластическим замещением
плоскоклеточного эпителия пищевода
на cпециализирован-ный цилиндрический
эпителий кишечного типа
на
фоне хронического
дуоденогастроэзофагеального рефлюкса.
17.
Пищевод Барретта –облигатный предрак
3-4% населения
земного шара страдает
ГЭРБ
Развивается у 20%
пациентов с
хроническим д-г-э
рефлюксом
Риск злокачественной
трансформации –
до 30%
-
-
-
Предрасполагающие
факторы:
грыжа пищеводного
отверстия диафрагмы,
хронический дуоденогастроэзофагеальный
рефлюкс
ожирение
18.
Клинические проявленияпищевода Баррета
изжога
кислая отрыжка
ощущение жжения в эпигастра-льной
области и за грудиной по-сле еды или в
ночное время, а так же при наклоне
туловища вперед (симптом шнурков)
19.
Гистологическая характеристикаРП
Плоскоклеточный рак (около 90% наблюдений).
Наиболее часто встречается в средней трети пищевода.
Аденокарционома (около 10%). Преимущественно
поражает дистальную треть пищевода.
Редкие гистологические формы злокачественных
опухолей (1–2%): различные разновидности
плоскоклеточного рака (веретеноклеточный рак,
карциносаркома, верукозный рак), меланома,
недифференцированные опухоли (мелкоклеточный
рак), первичная лимфосаркома пищевода, а также
мезенхимальные и нейроэндокринные опухоли.
20.
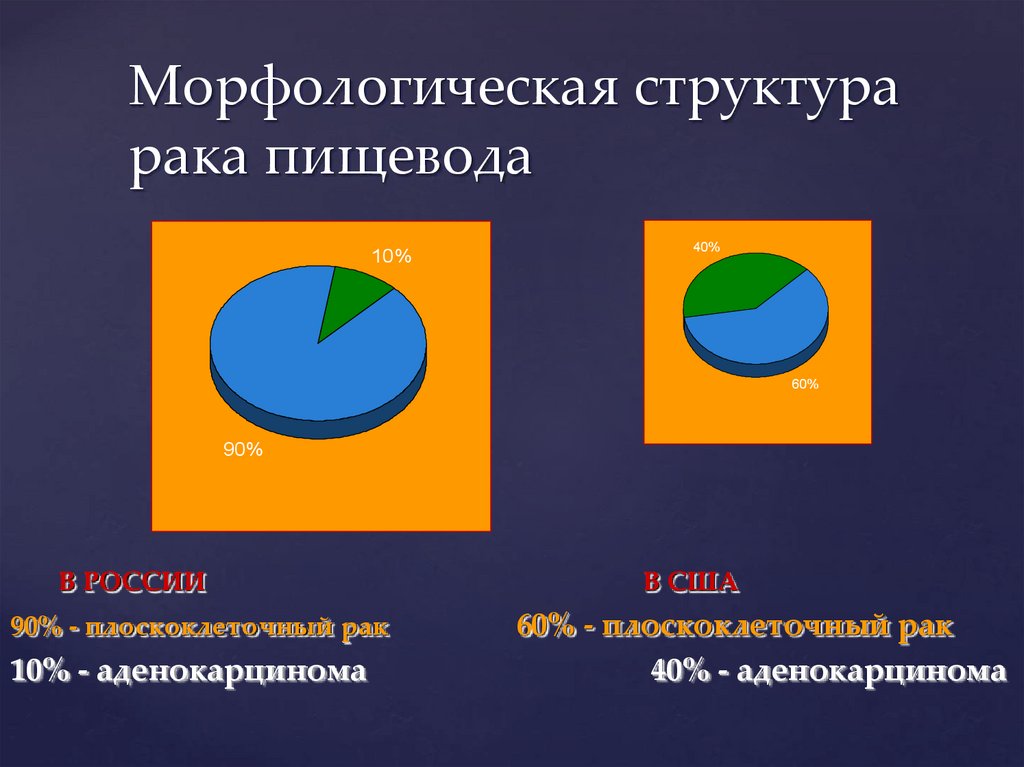
Морфологическая структурарака пищевода
10%
40%
60%
90%
В РОССИИ
90% - плоскоклеточный рак
10% - аденокарцинома
В США
60% - плоскоклеточный рак
40% - аденокарцинома
21.
Классификация22.
По локализации:Средняя треть грудного отдела
пищевода (40-60%)
Нижняя треть (25-40%)
Верхняя треть грудного и шейный
отделы (1-10%)
23.
По гистологическомустроению:
Плоскоклеточный рак (типичен для
пищевода) ороговевающий
неороговевающий.
Аденокарцинома(железистый рак)
Железисто-эпидермальный рак
24.
По форме роста:Экзофитная (узловая)
Эндофитный рак
Язвенно-инфильтративная форма
(встречается чаще всего)
Полиповидная опухоль (встречается
реже всего)
25.
TNM клиническаяклассификация
Т – первичная опухоль
Тх
Т0
Tis
Т1
Т2
Т3
Т4
Недостаточно данных для оценки первичной опухоли
Первичная опухоль не определяется
Преинвазивная карцинома
Опухоль инфильтрирует стенку пищевода до подслизистого слоя
Опухоль инфильтрирует стенку пищевода до мышечного слоя
Опухоль инфильтрирует стенку пищевода до адвентиции
Опухоль распространяется на соседние структуры
N – региорарные лимфатические узлы
Nх
N1
N2
Недостаточно данных для оценки регионарных лимфатических узлов
Нет признаков метастатического поражения регионарных лимфатических узлов
Имеется поражение регионарных лимфатических узлов
М – отдаленные метастазы
Мх
М0
М1
Недостаточно данных для определения отдаленных метастазов
Нет признаков отдаленных метастазов
Имеются отдаленные метастазы
26.
27.
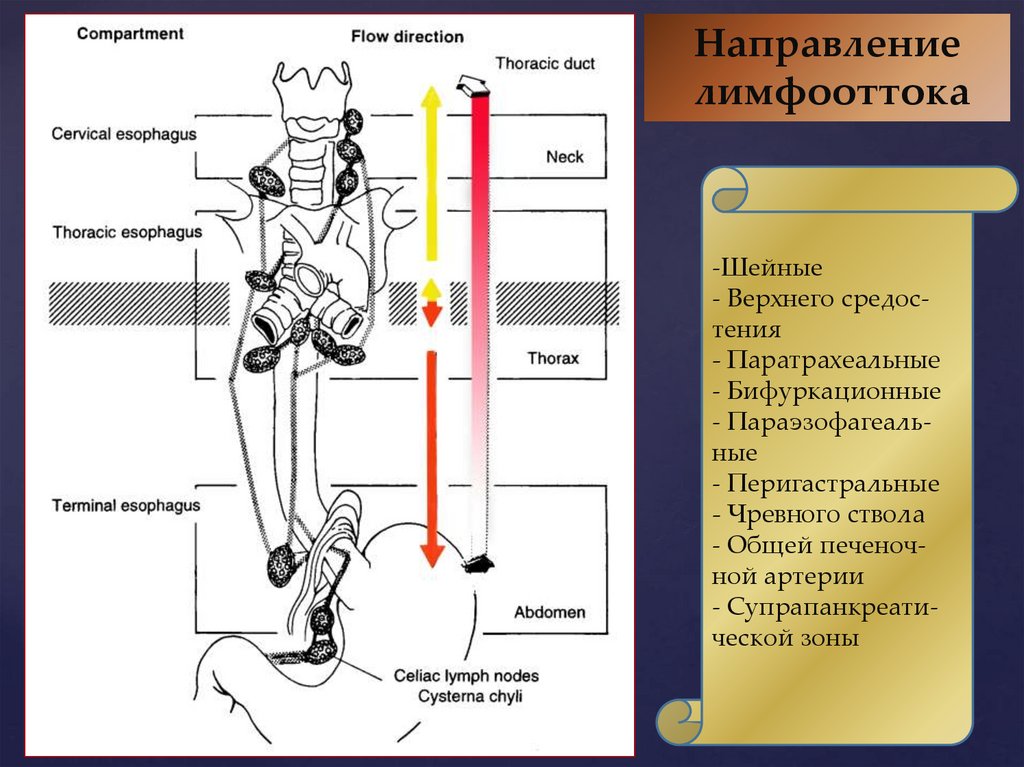
Направлениелимфооттока
-Шейные
- Верхнего средостения
- Паратрахеальные
- Бифуркационные
- Параэзофагеальные
- Перигастральные
- Чревного ствола
- Общей печеночной артерии
- Супрапанкреатической зоны
28.
Особенности лимфогенного метастазированиярака внутригрудного отдела пищевода
Значительная вариабельность направлений
метастазирования различных отделов;
Отсутствие сегментарности метастазирования;
Появление пылевидных внутристеночных метастазов в
пищеводе, часто на значительном расстоянии от
первичной опухоли (до 10 см);
Появление «прыгающих» метастазов («skip metastasis») в
лимфоузлах, которые выявляются до 30% случаев,
причем в 23% случаев это экстрамедиастинальные
лимфоузлы верхнего этажа брюшной полости и
шейно–надключичных зон.
29.
Именно глубина опухолевой инвазии стенкипищевода определяет частоту метастазирования в
лимфатические узлы.
при поверхностном раке, ограниченном
слизистой оболочкой, метастазы в
лимфатические узлы обнаруживаются до 10%
случаев.
при прорастании подслизистого слоя (рТ1) в
30 - 40%.
при прорастании мышечного слоя в 80%
случаев.
30.
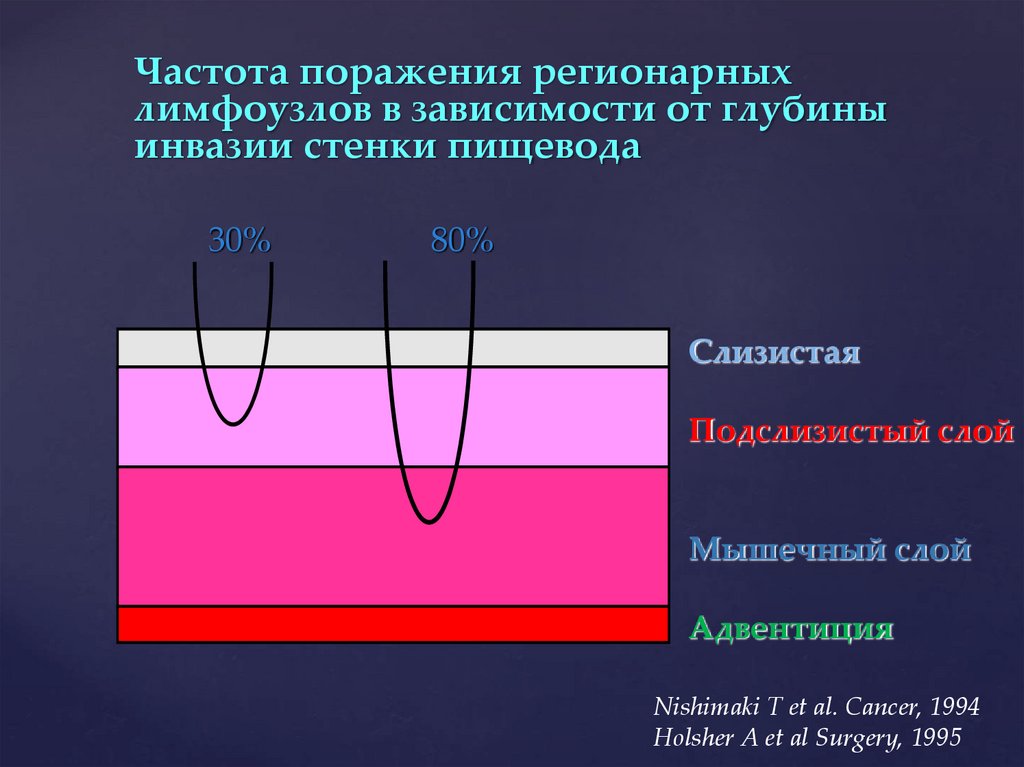
Частота поражения регионарныхлимфоузлов в зависимости от глубины
инвазии стенки пищевода
30%
80%
Слизистая
Подслизистый слой
Мышечный слой
Адвентиция
Nishimaki T et al. Cancer, 1994
Holsher A et al Surgery, 1995
31.
Рак верхнегрудного отдела пищевода наиболеечасто метастазирует в лимфатические узлы
верхнего средостения, а также шейно–
надключичной области;
Рак среднегрудного отдела пищевода
практически с одинаковой частотой
метастазирует как в медиастинальные, так и в
абдоминальные лимфоколлекторы;
Рак нижнегрудного отдела чаще метастазирует
в паракардиальные и забрюшинные
лимфатические узлы бассейна левой
желудочной артерии и чревного ствола, а
также лимфатические узлы заднего
средостения до уровня бифуркации трахеи
(Akiyama H. et al., 1990; Kato H., 1995; Sato T.,
Lizuka T., 1992, Тер–Ованесов М.Д., 1999).
32.
Особенности лимфогенного метастазированиярака внутригрудного отдела пищевода
– значительная вариабельность направлений
метастазирования различных отделов;
– отсутствие сегментарности
метастазирования;
– появление пылевидных внутристеночных
метастазов в пищеводе, часто на значительном
расстоянии от первичной опухоли (до 10 см);
– появление «прыгающих» метастазов («skip
metastasis») в лимфоузлах, которые выявляются
до 30% случаев, причем в 23% случаев это
экстрамедиастинальные лимфоузлы верхнего
этажа брюшной полости и шейно–
надключичных зон.
33.
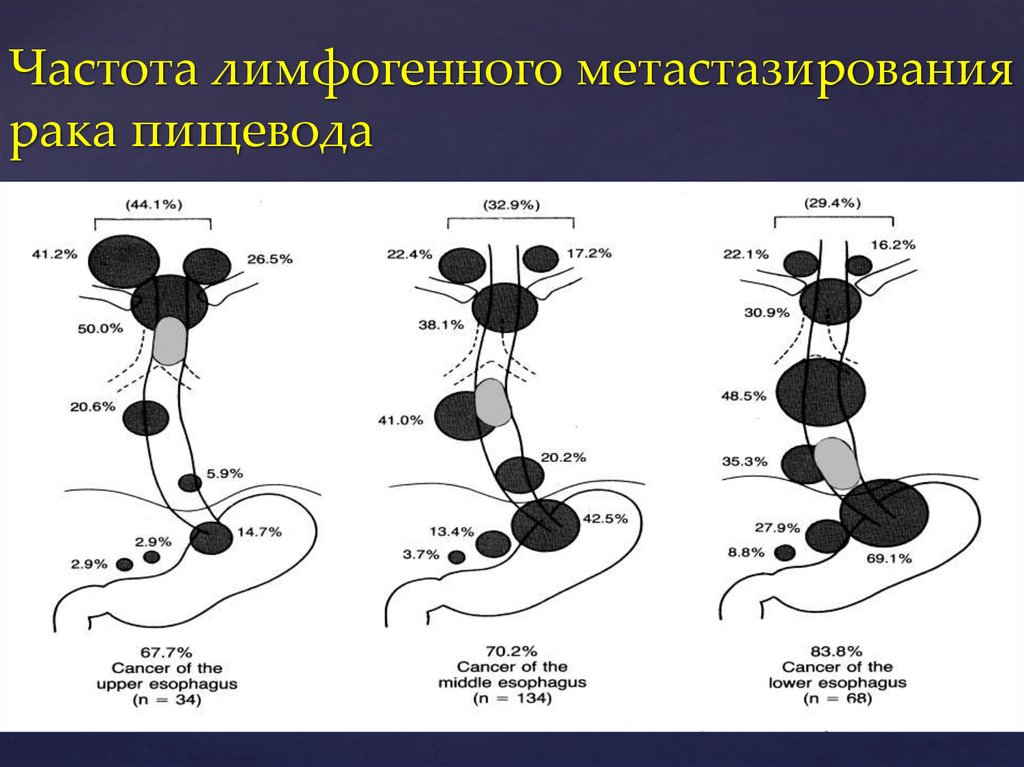
Частота лимфогенного метастазированиярака пищевода
Akiyama H., 1992
34.
Клиническаякартина
35.
Типичные симптомырака пищевода :
Дисфагия
Срыгивание и регургитация после
проглатывания пищи или жидкости
Гиперсаливация
Неприятный запах изо рта
36.
Дисфагия (в 75%)I степень - затруднение прохождения
твердой пищи по пищеводу (хлеб, мясо);
II степень - затруднения, возникающие
при приеме кашицеобразной и
полужидкой пищи (каши, пюре);
III степень - затруднения при глотании
жидкостей;
IV степень - полная непроходимость
пищевода.
37.
Механизмы возникновениядисфагии :
Механическая форма – связана с
сужением просвета органа расту-щей
опухолью;
Рефлекторная форма – зависит от
спазма в вышележащих частях пищевода (над опухолью);
Смешанная форма – причинами
дисфагии служат оба фактора.
38.
Другие симптомы ракапищевода:
Боли в грудной клетке (за грудиной)
Потеря веса, прогрессирующее
похудание вплоть до кахексии, общая
слабость, утомляемость.
Осиплость голоса и хронический
Триада Клода Бернара Горнера .
Расстройство сердечной
деятельности
39.
Диагностика40.
Общие правила диагностикиВыяснить время появления и динамику развития
симптомов;
Обратить внимание на стойкость или постепенное
прогрессирование дисфагии;
Установить особенности характера питания,
склонность к употреблению слишком горячей
пищи, приему алкоголя;
Спросить о перенесенных ранее заболеваниях
пищевода, употреблении мелкокостистой рыбы,
стаже курения
41.
Сигналы тревогиДисфагия любой выраженности, возникшая вне
зависимости от химического ожога пищевода,
• Ощущение прохождения пищевого комка, боль
или неприятное ощущение по ходу пищевода
при приеме пищи,
• Повторяющаяся регургитация пищи или рвота,
• Внезапная закупорка пищевода при приеме пищи,
• Беспричинная появившаяся осиплость голоса,
• Мучительный кашель, возникающий при приеме
жидкости.
42.
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ:Полипозиционное рентгенологическое исследование
пищевода с контрастом.
КТ грудной клетки с «раздуванием» пищевода, а также
верхних отделов брюшной полости и забрюшинного
пространства
ЭГДС с хромоэндоскопией и множественной
биопсией;
Бронхоскопия
Лапароскопия (при поражении н/3 пищевода);
Эндосонография
УЗИ брюшной полости, забрюшинного пространства,
шейно–надключичной зоны
43.
*Сцинтиграфия скелета (при болях в костях иповышении щелочной фосфатазы крови).
*ПЭТ (для определения местной и системной
распространенности процесса).
МОРФОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ:
Цитологическое
Гистологическое
44.
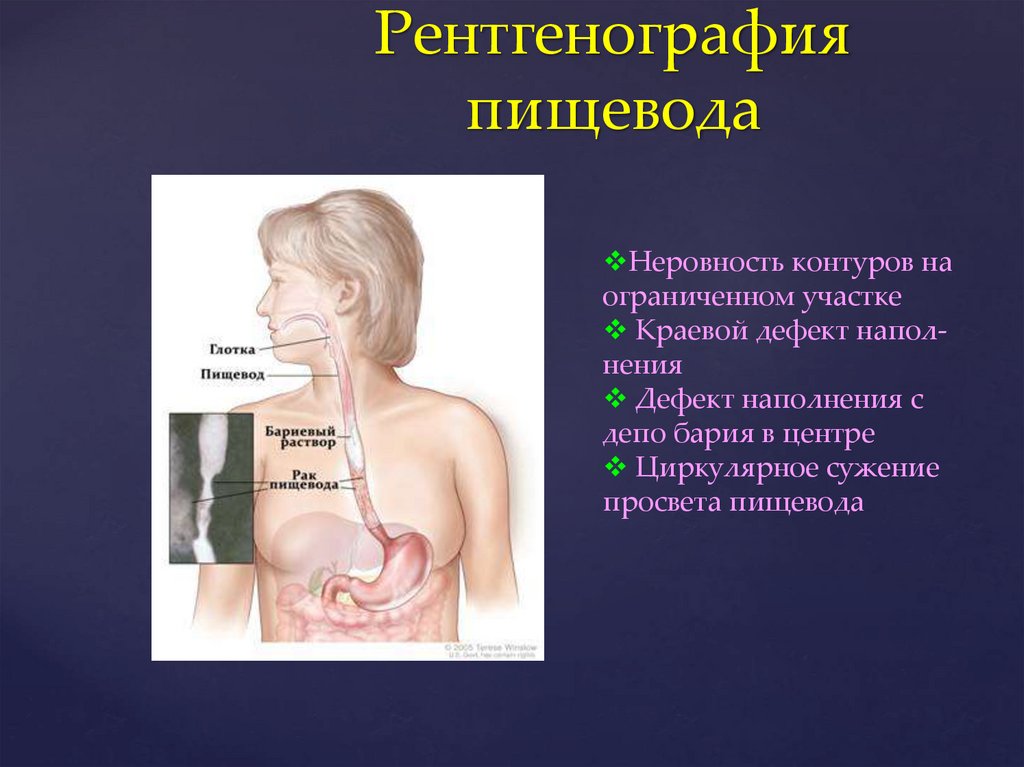
Рентгенографияпищевода
Неровность контуров на
ограниченном участке
Краевой дефект наполнения
Дефект наполнения с
депо бария в центре
Циркулярное сужение
просвета пищевода
45.
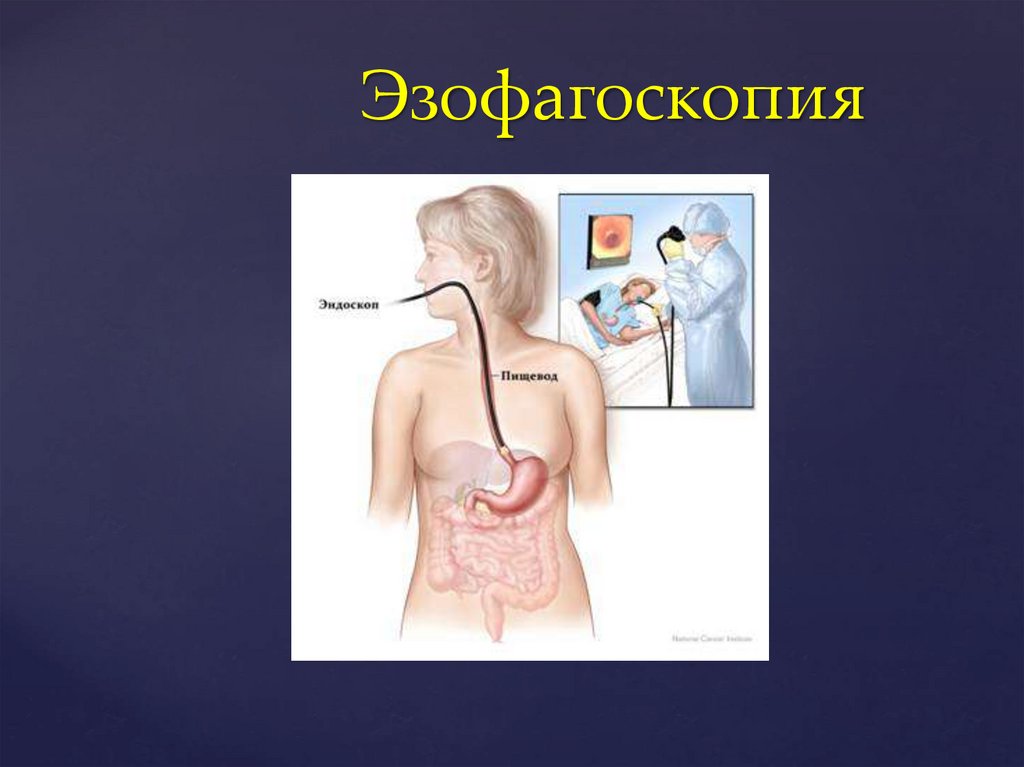
Эзофагоскопия46.
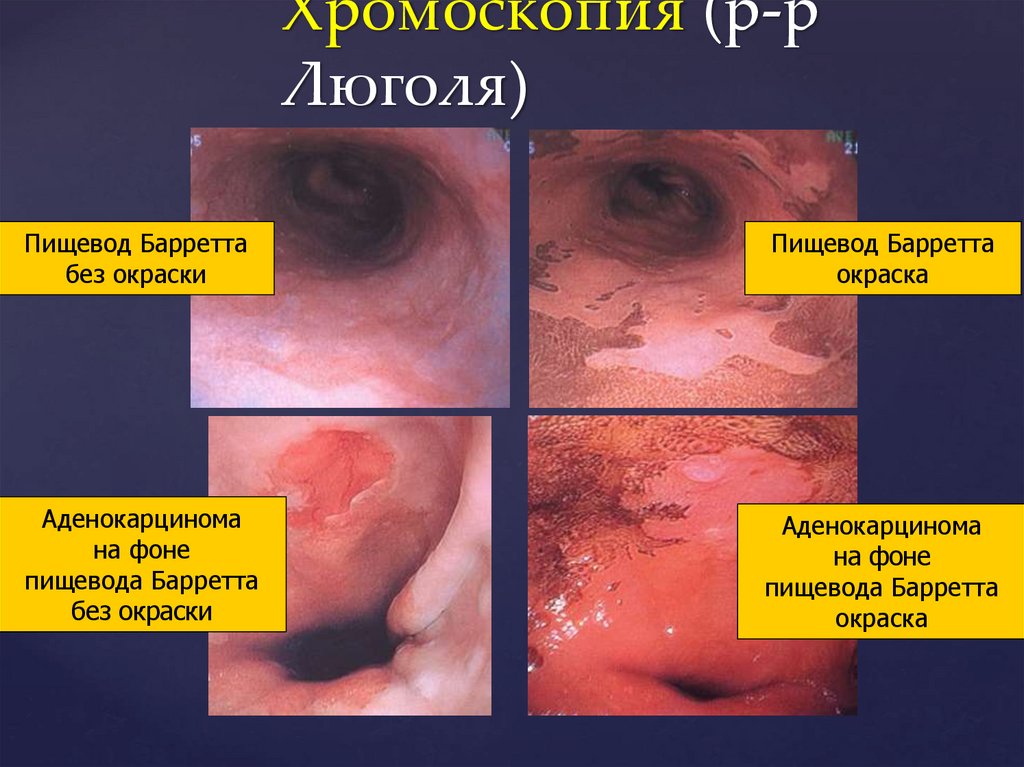
Хромоскопия (р-рЛюголя)
Пищевод Барретта
без окраски
Пищевод Барретта
окраска
Аденокарцинома
на фоне
пищевода Барретта
без окраски
Аденокарцинома
на фоне
пищевода Барретта
окраска
47.
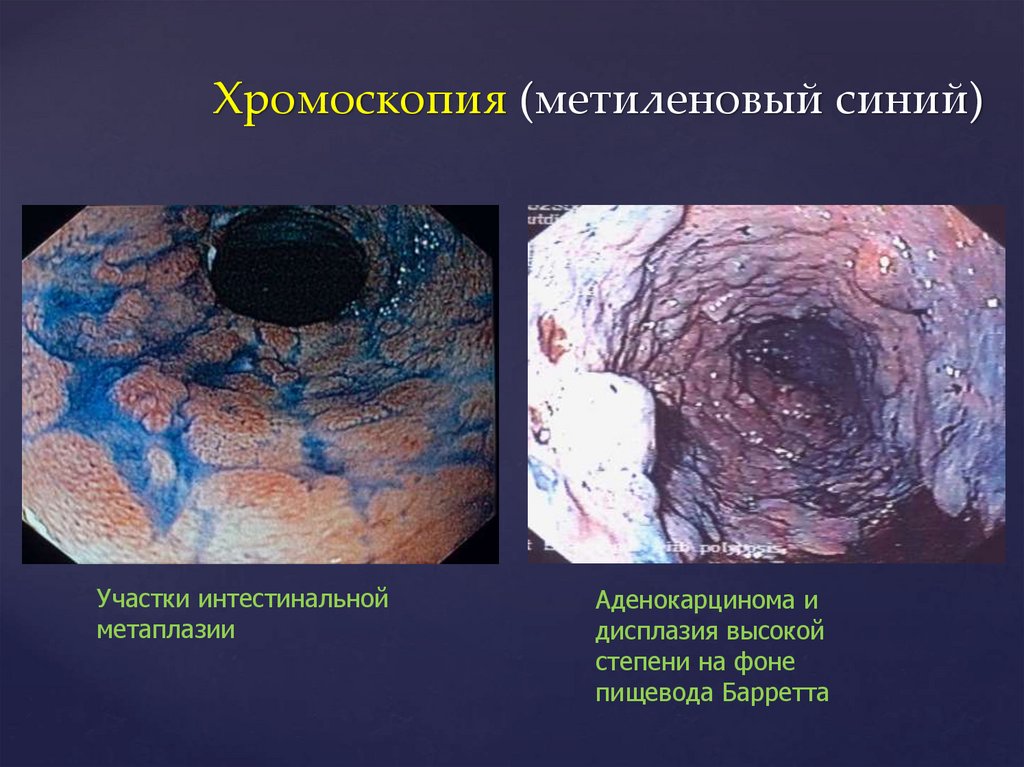
Хромоскопия (метиленовый синий)Участки интестинальной
метаплазии
Аденокарцинома и
дисплазия высокой
степени на фоне
пищевода Барретта
48.
Узко-спектральная эндоскопияЭндоскопия в обычном свете
49.
Извитые штопорообразныесосуды
Разрушение структуры слизистой при увеличительной
эндоскопии в 150 раз
50.
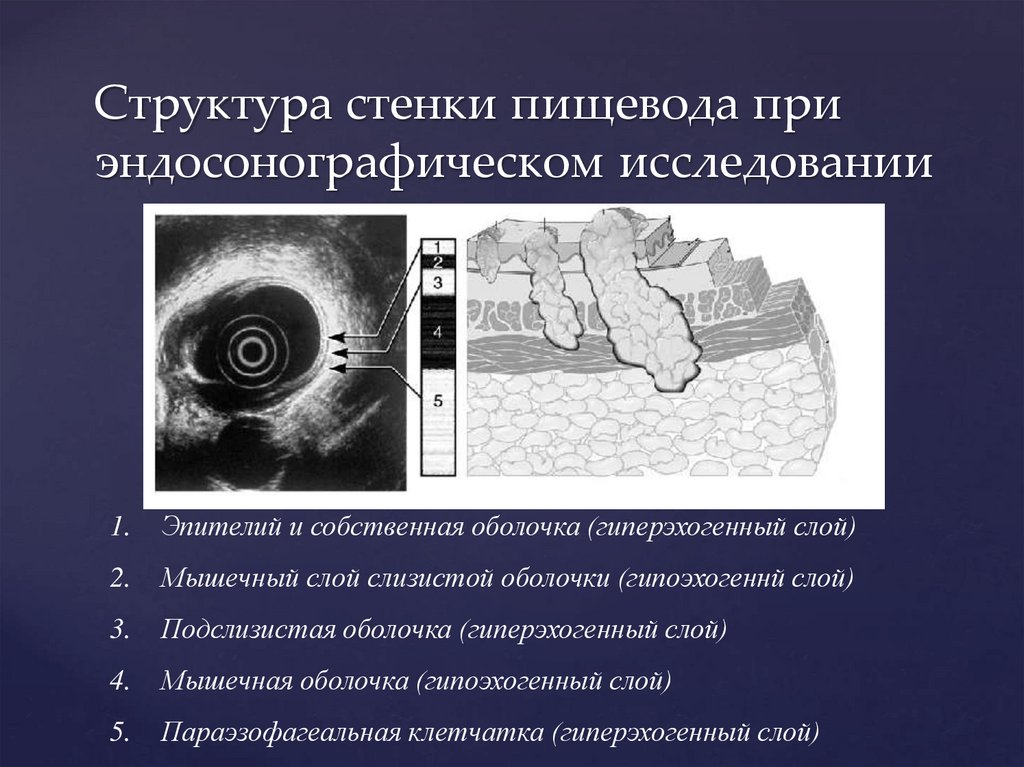
Структура стенки пищевода приэндосонографическом исследовании
1.
Эпителий и собственная оболочка (гиперэхогенный слой)
2.
Мышечный слой слизистой оболочки (гипоэхогеннй слой)
3.
Подслизистая оболочка (гиперэхогенный слой)
4.
Мышечная оболочка (гипоэхогенный слой)
5.
Параэзофагеальная клетчатка (гиперэхогенный слой)
51.
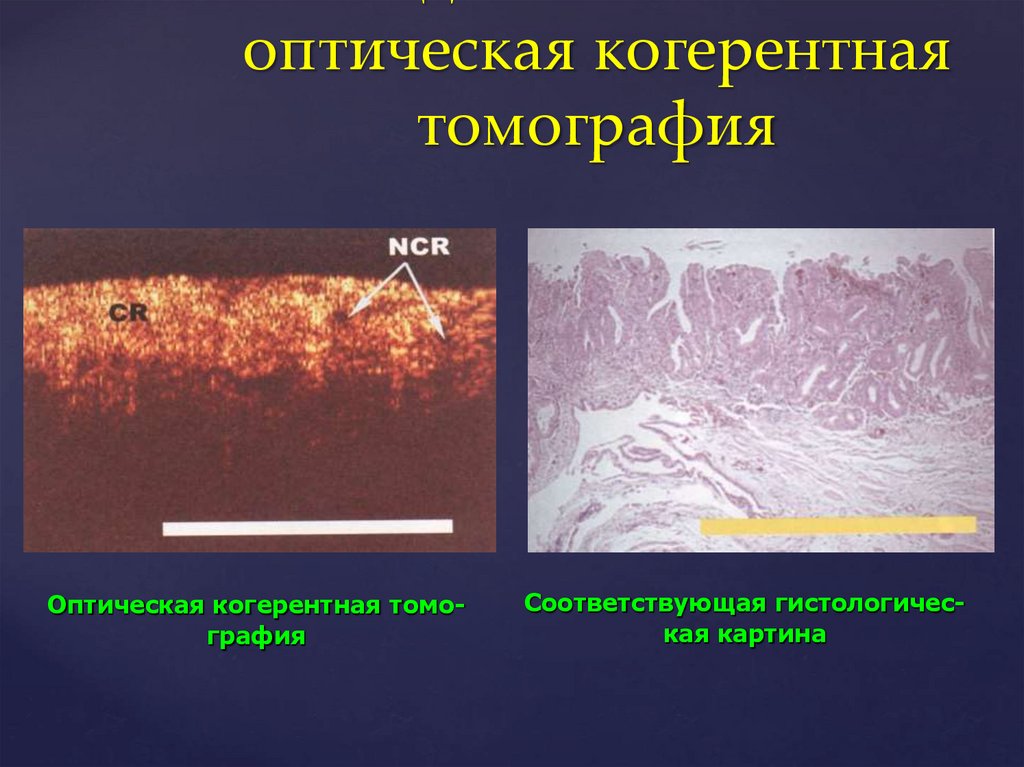
оптическая когерентнаятомография
Оптическая когерентная томография
Соответствующая гистологическая картина
52.
Дополнительные методыисследования
53.
Рентгенографиягрудной клетки
позволяет выявить отдаленные метастазы в легкие;
54.
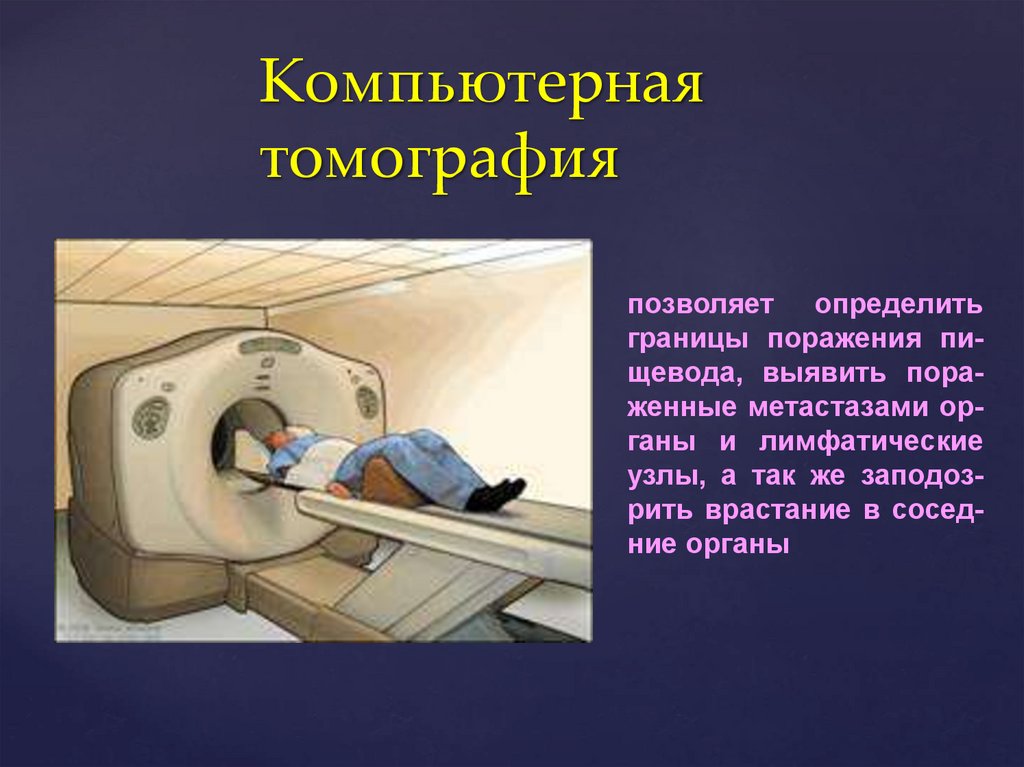
Компьютернаятомография
позволяет определить
границы поражения пищевода, выявить пораженные метастазами органы и лимфатические
узлы, а так же заподозрить врастание в соседние органы
55.
Ультразвуковоеисследование (УЗИ)
56.
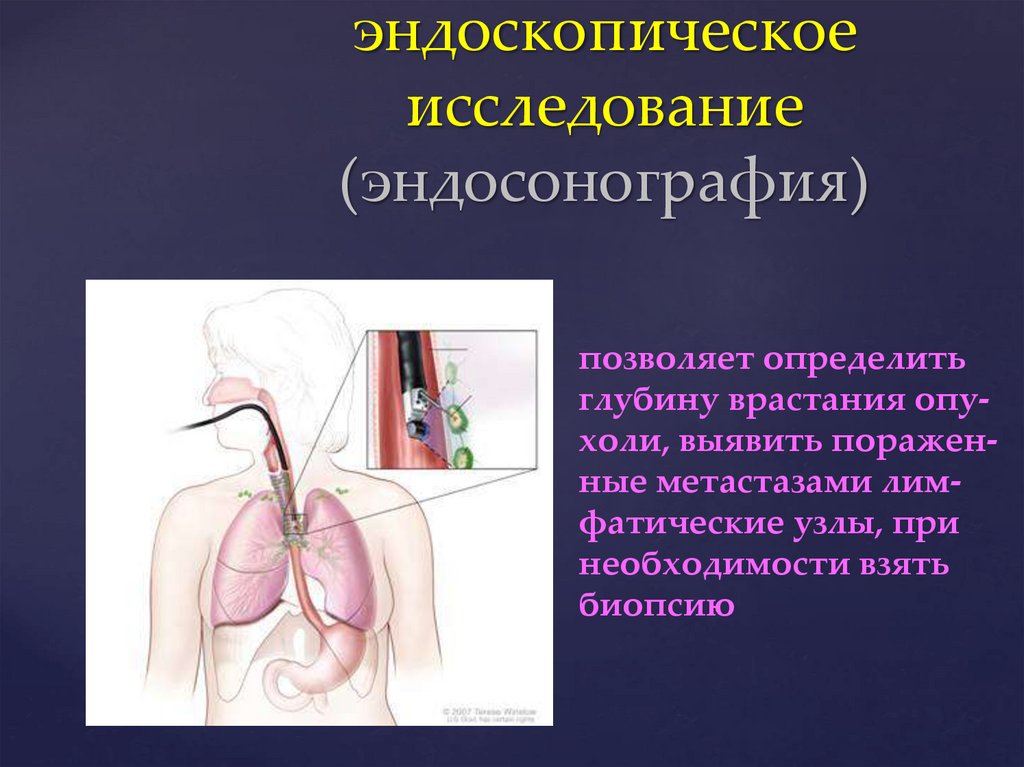
эндоскопическоеисследование
(эндосонография)
позволяет определить
глубину врастания опухоли, выявить пораженные метастазами лимфатические узлы, при
необходимости взять
биопсию
57.
Бронхоскопияпри раке пищевода
позволяет определить
распространение опухоли на трахею и
бронхи
58.
ПЭТ(позитронно-эмиссионная
томография)
59.
Дифференциальная диагностикаАномалии пищевода (врожденное сужение
пищевода)
Дивертикулы (дивертикулиты) пищевода
Функциональные расстройства пищевода
(гиперкинезия и гипокинезия)
Ахалазия кардии
Грыжи пищеводного отверстия диафрагмы
Эзофагиты и язвы пищевода
Аллергические и специфические поражения
пищевода
Травмы (ожоги) пищевода и их последствия
Болезни оперированного пищевода.
60.
Лечение рака пищевода61.
МетодыХирургический
Лучевой
ПХТ
Комбинированный
Комплексный
62.
Методы леченияРадикальное (хирургическое)
Паллиативное
лучевая терапия
химиотерапия
комбинированное и комплексное
иммунотерапия
Симптоматическое (восстановление
проходимости пищевода)
Альтернативные методы лечения «раннего»
рака пищевода и пищевода Баррета
Эндоскопическая резекция
Фотодинамическая терапия
63.
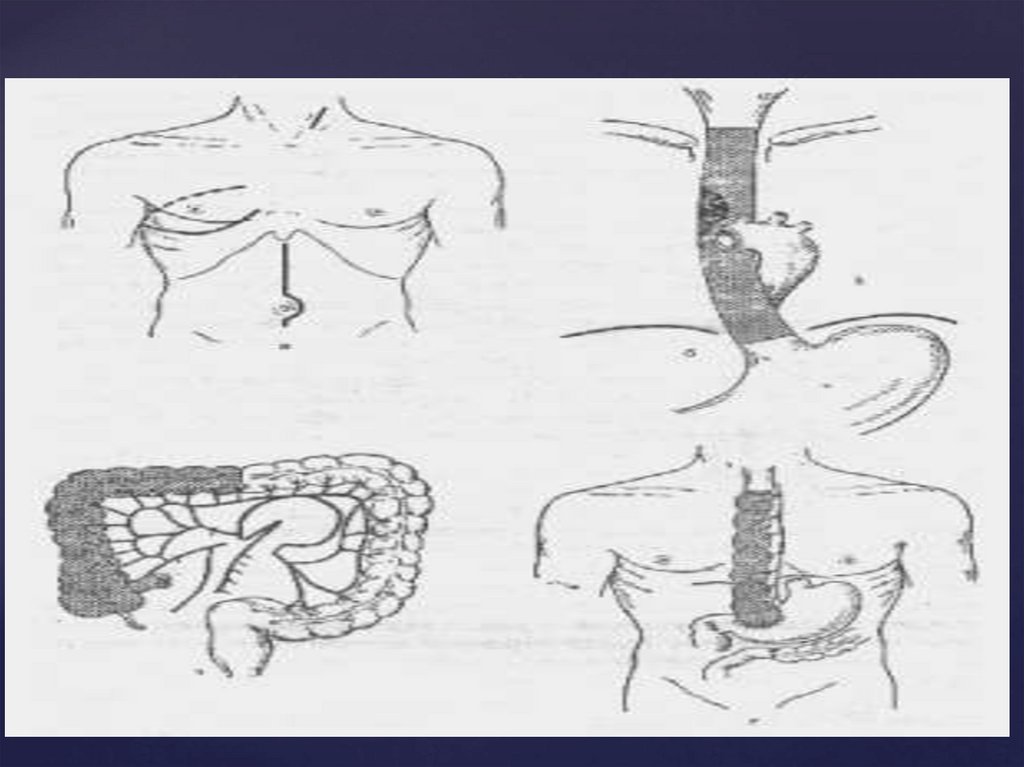
Основные типы операций прираке пищевода
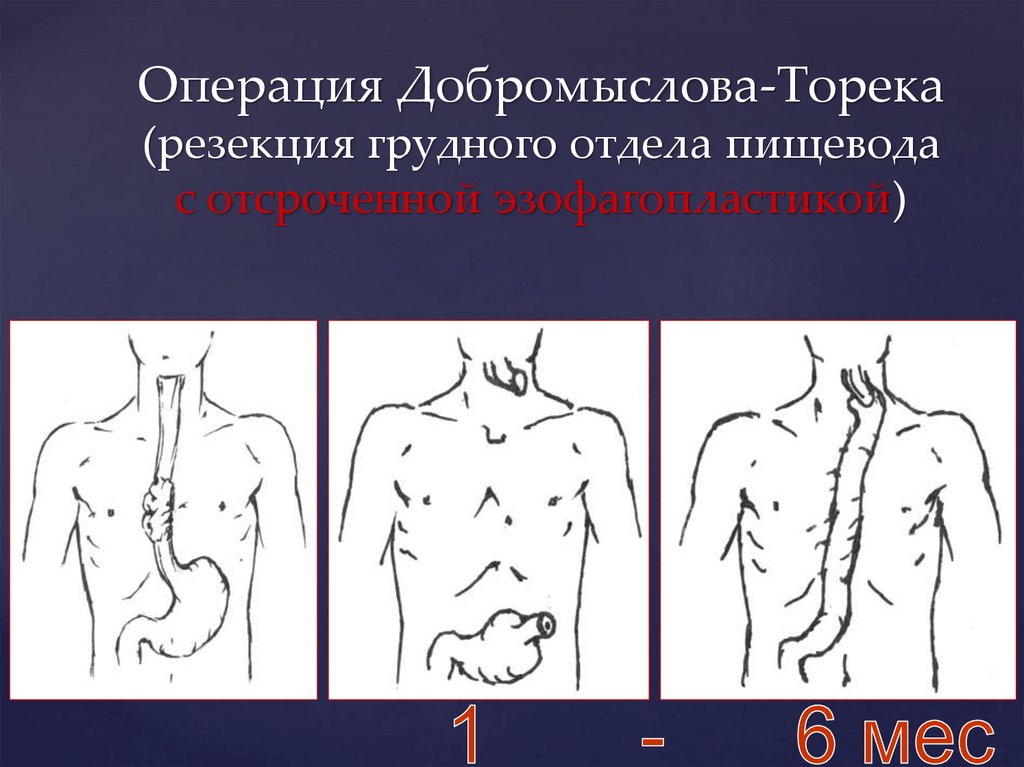
I. С отсроченной
эзофагопластикой
(от 1 до 6 мес.)
- операция
Добромыслова –
Торека с
отсроченной
пластикой:
а) желудком
б) толстой
кишкой
в) тонкой кишкой
(в настоящее время
не применяется)
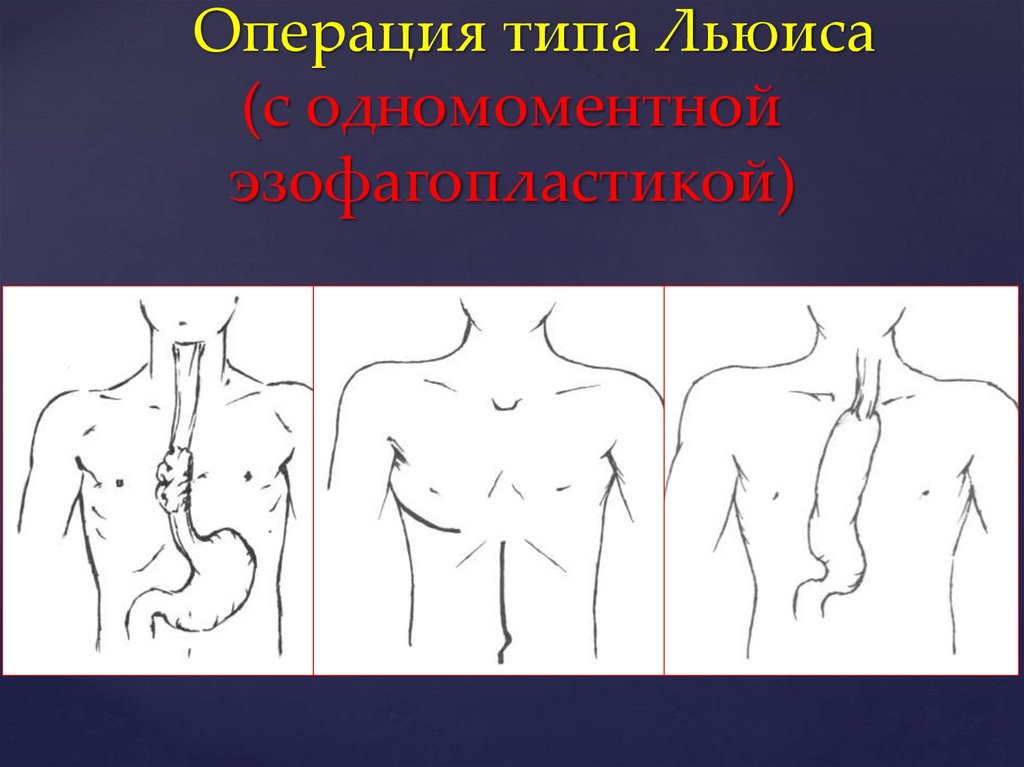
II. С одномоментной пластикой
- операция типа Льюиса
- субтотальная резекция
(экстирпация) пищевода
с
формированием
анастомоза на шее.
а) желудком
б) толстой кишкой
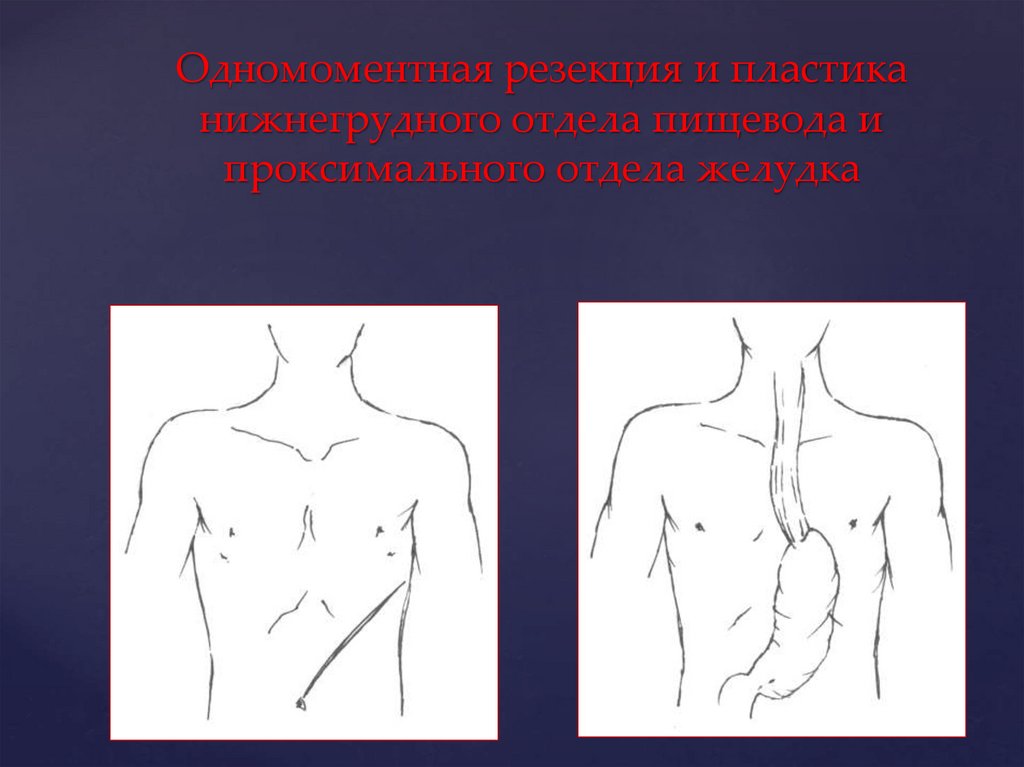
- одномоментная резекция и
пластика нижнегрудного
отдела пищевода.
- субтотальная резекция
(экстирпация) пищевода
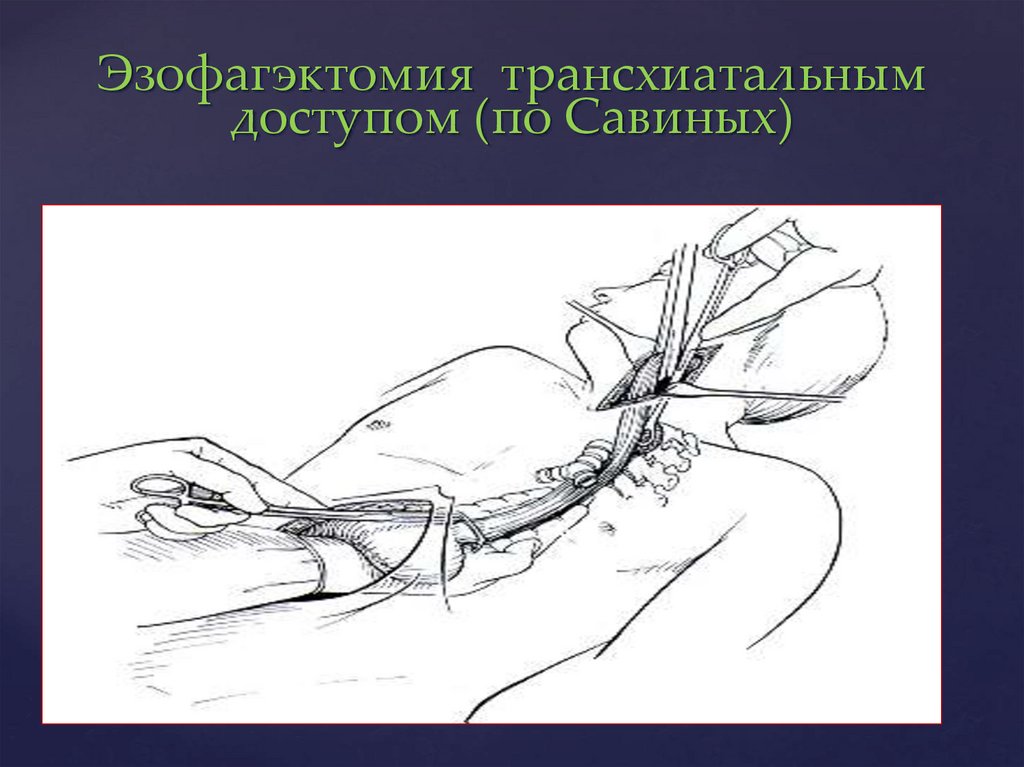
трансхиатальным
доступом (по Савиных).
- эндоскопическая резекция
и пластика пищевода.
64.
Операция Добромыслова-Торека(резекция грудного отдела пищевода
с отсроченной эзофагопластикой)
65.
Операция типа Льюиса(с одномоментной
эзофагопластикой)
66.
67.
Одномоментная резекция и пластиканижнегрудного отдела пищевода и
проксимального отдела желудка
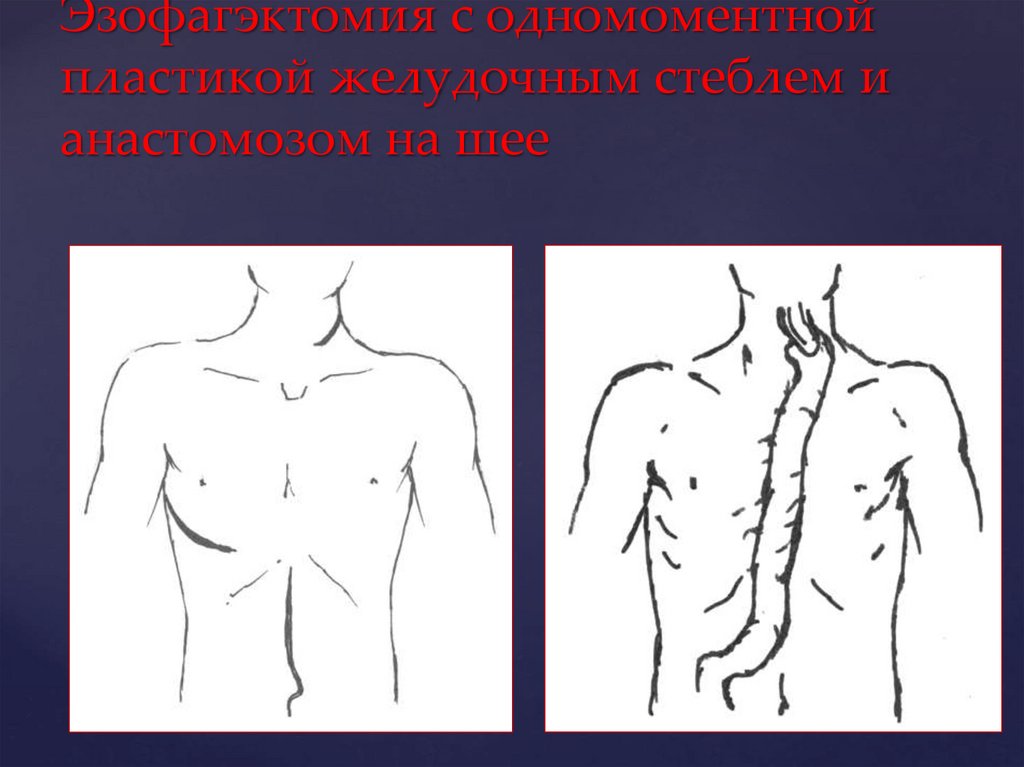
68.
Эзофагэктомия с одномоментнойпластикой желудочным стеблем и
анастомозом на шее
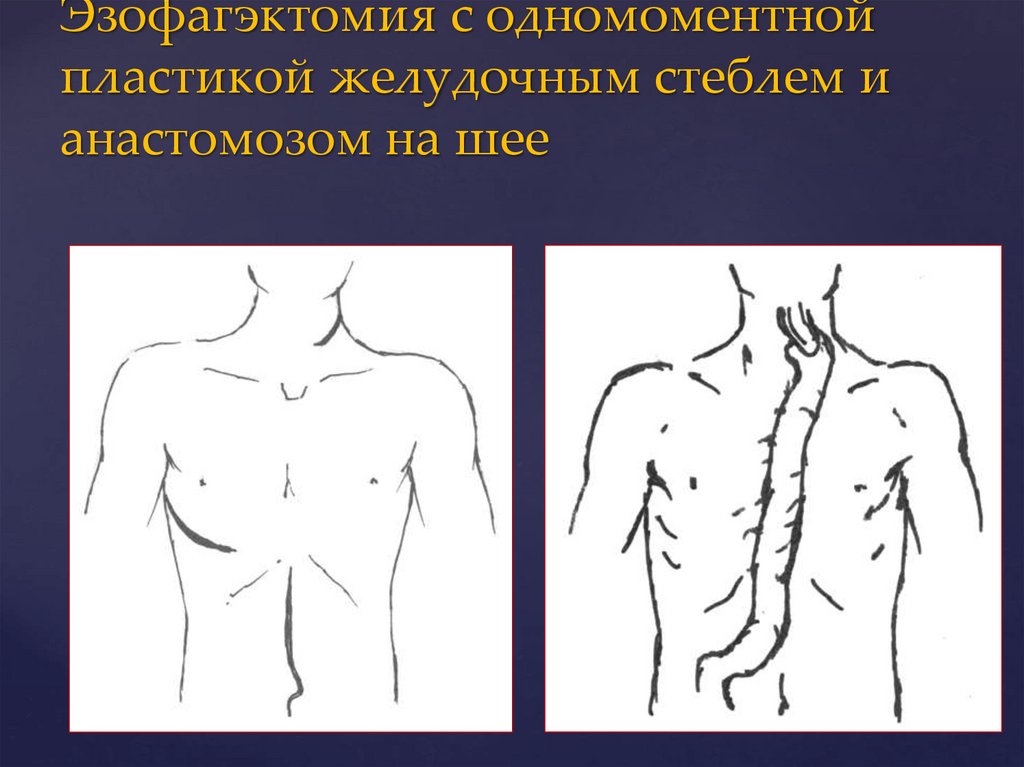
69.
Эзофагэктомия с одномоментнойпластикой желудочным стеблем и
анастомозом на шее
70.
71.
72.
Эзофагэктомия трансхиатальнымдоступом (по Савиных)
73.
Эзофагопластикатолстой кишкой с
анастомозом в
средостении
74.
75.
Вариантыпроведения
трансплантата в
средостении при
эзофагопластике
76.
Характеристика пищеводных анастомозовШейные анастомозы
- Несостоятельность – около 20%.
- Рубцовые стриктуры - (22-50%).
- Гастрофарингеальный рефлюкс и
аспирация
(30% больных в отдаленные сроки
погибают
от пневмонии)
Внутриплевральные анастомозы
- Несостоятельность – 3-8%;
- Хорошие функциональные результаты
77.
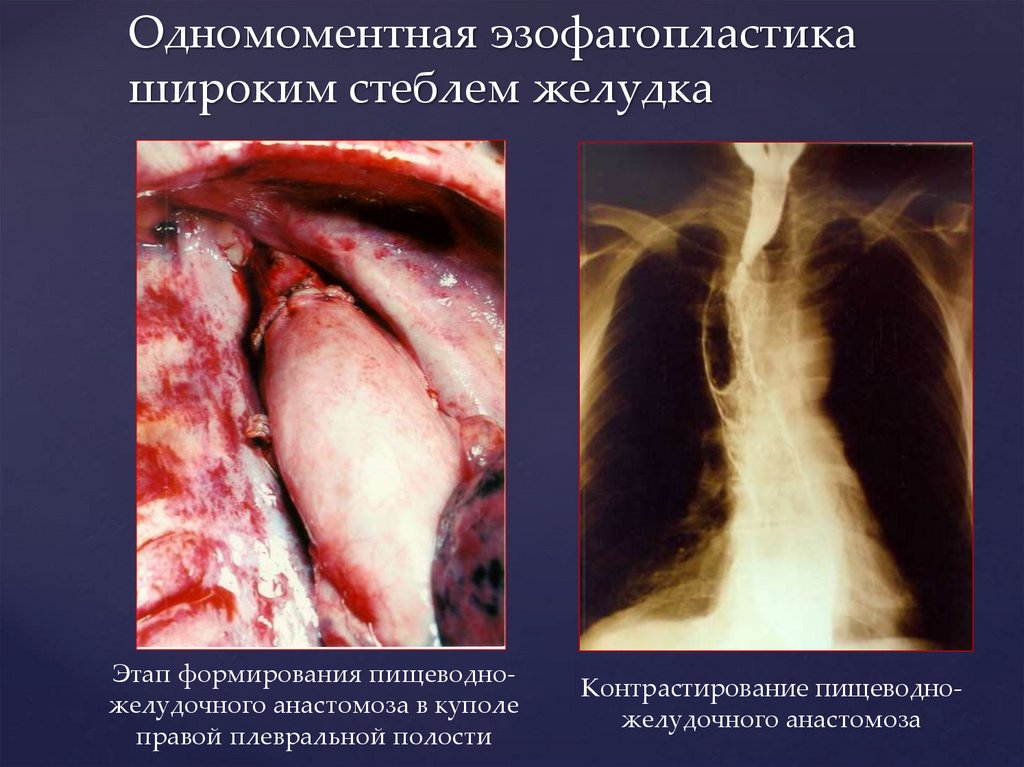
Одномоментная эзофагопластикашироким стеблем желудка
Этап формирования пищеводножелудочного анастомоза в куполе
правой плевральной полости
Контрастирование пищеводножелудочного анастомоза
78.
Одномоментная внутриплевральнаяколоэзофагопластика
Формирование пищеводного соустья над дугой аорты левосторонним
лапароторакотомным доступом
79.
Объемылимфодиссекций
стандартную двухзональную ЛД (абдоминальная и
медиастинальная лимфодиссекция до уровня
бифуркации трахеи) – 2S;
расширенную двухзональную ЛД (абдоминальная
D2, билатеральная медиастинальная
лимфодиссекция до уровня верхней апертуры) –
2F;
расширенная трехзональная ЛД (абдоминальная
D2, билатеральная медиастинальная и
билатеральная шейная лимфодиссекция) – 3F.
80.
Типы лимфодиссекциипри раке пищевода (Ide H., 1995)
81.
Обоснование 3-х зональной лимфодиссекцииМетастазы в лимфатические узлы шейно–
надключичной области в группе с
трехзональной лимфодиссекцией были
выявлены у 37,5% пациентов (более точное
стадирование).
Частота рецидива в лимфатических узлах
составляет 59%, причем в 54% поражаются
регионарные узлы шейно–надключичной
области, подлежащие обязательному удалению
при трехзональной лимфодиссекции.
82.
Показания к 3F операциямРак средне- и верхнегрудного отделов пищевода
Опухоли Т1- T2 - T3
Отсутствие отдаленных гематогенных метастазов
Возраст пациентов – не старше 70 лет
Радикальный характер операции на абдоминальном и
торакальном этапах.
Tabira Y. et al., J Thorac Cardiovasc Surg, 1999.
83.
Выживаемость при хирургическомлечении рака пищевода
n
1 год
3 года
5 лет
N(0)
188
92,6
79,3
73,1
N(1-3)
171
69,9
40,6
31,9
N(4-6)
84
50,0
13,3
8,9
N(7>)
81
38,6
7,8
5,9
T. Nagahama, M. Endo et al., 1998
84.
Выживаемость послерасширенных резекций пищевода
5-летняя выживаемость, %
АВТОР
Hosokawa
M. 1999
Matsubara
T. 1999
Стиллиди
И.С. 2003
N0
79,4%
N1
43,8%
89%
54%
54,8%
18,9%
85.
Факторы прогноза хирургическоголечения рака пищевода
Прогноз статистически достоверно более благоприятный при
выполнении радикального вмешательства R0, чем при
выполнении паллиативного вмешательства R1–R2;
У пациентов с меньшей глубиной инвазии – в пределах
подслизистого–мышечного слоев (Т1–2) прогноз лучше, чем при
прорастании адвентиции с выходом процесса в
периэзофагеальную клетчатку или врастании в окружающие
структуры (Т3–4);
Метастазы в регионарные лимфатические узлы ухудшают прогноз,
особенно при поражении более 5 узлов (Годжаманов Я.К., 2002,
Nishimaki T.);
Выживаемость снижается при поражении более проксимально
расположенных лимфоузлов (заднее средостение, верхнее средостение,
шейно–надключичная зона);
В случаях с тяжелыми послеоперационными осложнениями
выживаемость снижается.
86.
При раке пищевода фактор метастазированияоказывает большее влияние на отдаленные
результаты лечения, чем протяженность опухоли
по пищеводу или глубина инвазии стенки
Показатели 5-летней выживаемости при
появлении регионарных метастазов снижаются в 34 раза).
87.
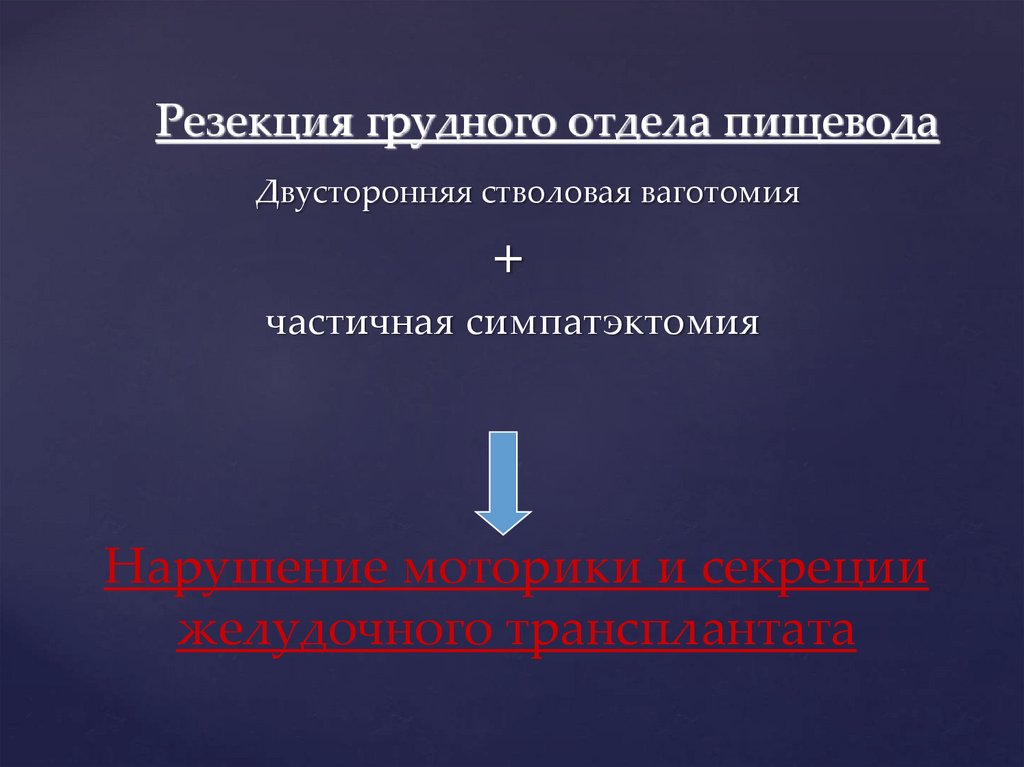
Резекция грудного отдела пищеводаДвусторонняя стволовая ваготомия
+
частичная симпатэктомия
Нарушение моторики и секреции
желудочного трансплантата
88.
Вагус-зависимые“командные” ганглии
расположены,
преимущественно, по
малой кривизне
Резекция
проксимальных трех
четвертых малой
кривизны разрушает
как интрамуральное
желудочно-кишечное
сплетение, так и
гладкую мускулатуру
антрального отдела
желудка
89.
Показания к вагус-сохранным операциямпри раке пищевода
Т1-Т2 N0-1
Молодой возраст больного
Стволовой тип строения блуждающих нервов
90.
Опыт хирургическоголечения рака пищевода
ГБУЗ ЯО ОКОБ за период
2004-2011гг
n=115
91.
Выполнены следующие операцииоперация типа Льюиса – 54 ( 46,9%),
экстирпация пищевода с пластикой узким
желудочным стеблем и формированием ЭГА
на шее- 45 (39,1 %)
экстирпация пищевода с одномоментной
пластикой участком толстой кишки – у 3(2,6%)
пациентов
операция Торека – у 13( 11,4%)пациентов с
последующей реконструкцией участком
толстой кишки у 3 пациентов.
92.
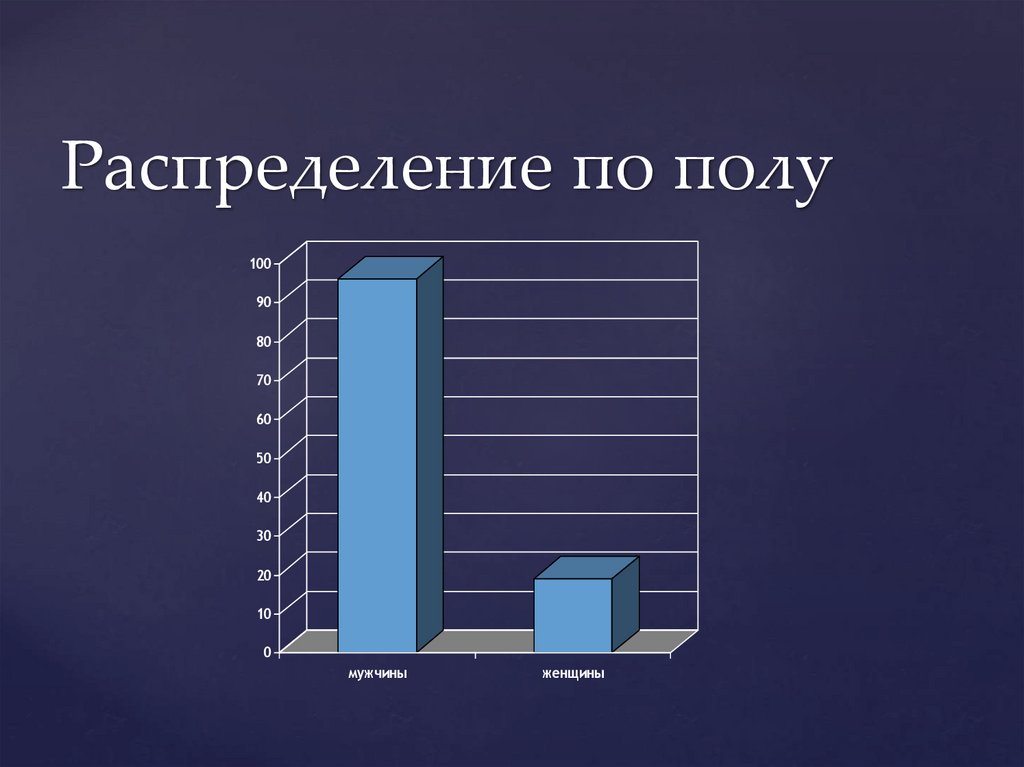
Распределение по полу100
90
80
70
60
50
40
30
20
10
0
мужчины
женщины
93.
6050
40
30
20
10
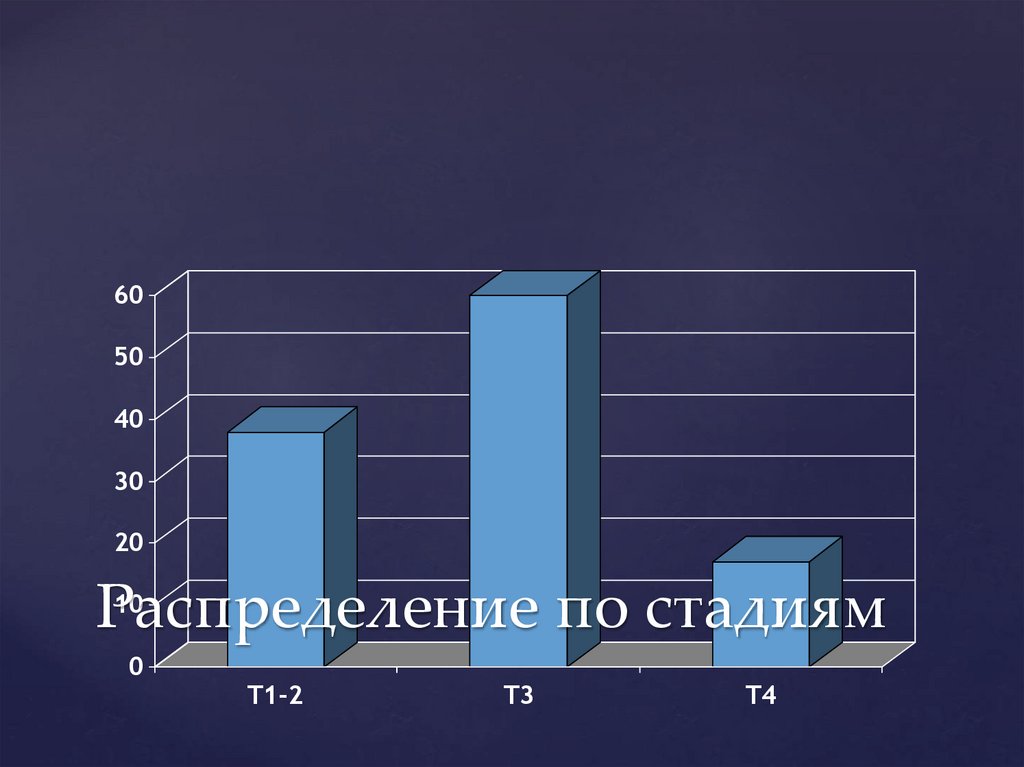
Распределение
по стадиям
0
T1-2
T3
T4
94.
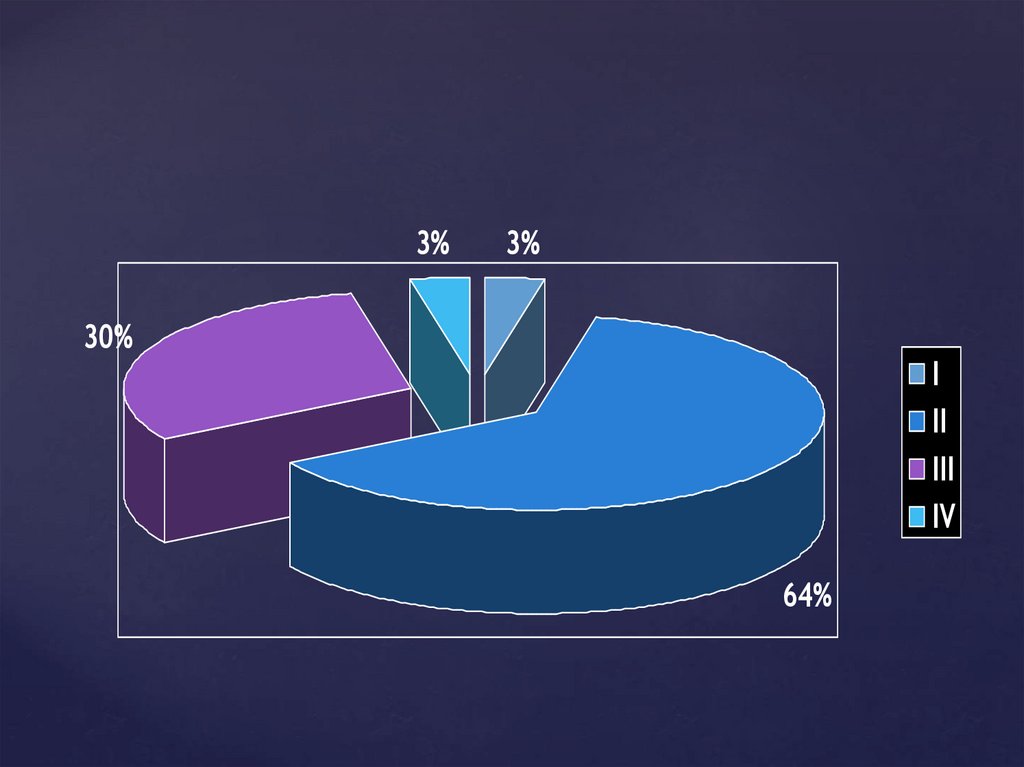
3%3%
30%
I
II
III
IV
64%
95.
10090
80
70
60
50
40
30
20
10
0
Гистологическая
характеристика
плоскоклеточный рак
аденокарцинома
96.
Результаты и ихобсуждение
неосложненный
послеоперационный период в 56,5%
случаях.
97.
Структура послеоперационныхосложнений
• пневмония
• несостоятельность анастомоза
• острый инфаркт миокарда
• тромбоэмболия легочной артерии
• острый артериальный тромбоз
• пилороспазм
• некроз трансплантата
• спаечная кишечная непроходимость
• острая почечная недостаточность
34 (35,1%)
11 (10,3%)
2(2,08%)
1 (1,04%)
1 (1,04%)
1 (1,04%)
1 (1,04%)
1 (1,04%)
1 (1,04%)
98.
ЛетальностьИз 115 оперированных пациентов летальный исход имел место у
8. Послеоперационная летальность составила (7,2%) .
Причинами летального исхода:
В 3 наблюдениях несостоятельность внутригрудного
пищеводно-желудочного анастомоза
В 1 наблюдении некроз желудочного трансплантата
В 2 острый инфаркт миокарда и острая сердечная
недостаточность
В 1 острая почечная недостаточность.
99.
Результаты и их обсуждениеВ последние четыре года методом выбора
при опухолях средней и н/з пищевода считаем
операцию типа Льюиса.
Этот доступ позволяет безопасно выполнить
адекватную резекцию пищевода с полноценной,
онкологически адекватной абдоминальной и
внутригрудной лимфодиссекцией с
формированием наиболее функционального
соустья.
100.
Паллиативное лечениеУ 70% пациентов впервые обратившихся за
медицинской помощью, рак пищевода выявляется
в 3-4 стадии.
Значительная часть больных, несмотря на
локализованный характер заболевания, имеет
низкий функциональный статус, что не позволяет
провести им хирургическое лечение.
Вывод: паллиативное лечение на сегодняшний
день остается основным - оно проводится в 5070% случаев РП.
101.
Лучевая терапия(один из главных методов паллиативного лечения РП)
Только у 20–40% больных отмечается местный эффект.
При проведении лучевой терапии у пациентов с
небольшими опухолями, 5-летняя выживаемость составляет
лишь 10 до 15%.
С целью купирования дисфагии лучевая терапия может
применяться с достаточной эффективностью и дает
возможность 7-10% больных прожить более года.
Попытки совершенствования вариантов дистанционного
лучевого воздействия (расщеплённый курс, применение
модификаторов и протекторов) оказались
малоэффективными.
брахитерапия с шагающим источником излучения
улучшает результаты паллиативного лечения опухолей
пищевода.
102.
БрахитерапияГлубина референтной изодозы не превышает 10 мм от
источника, что минимизирует воздействие на прилегающие
к пищеводу жизненно важные органы. Режимы облучения: 3
процедуры по 7 Гр с недельным интервалом (СОД=21 Гр) или 2
процедуры по 10 Гр с недельным интервалом (СОД-20 Гр).
Местный терапевтический эффект в сочетании с
дистанционным облучением у 56–71% больных.
Средняя продолжительность жизни - 13 мес.
Осложнения сочетанной лучевой терапии – до 80%.
эзофагиты (до 30%)
рубцовые стриктуры (от 5 до 30 %)
пищеводно-трахеальные или пищеводно-бронхиальные свищи (от 5
до 10%).
103.
Задачи лучевоголечения
Регрессия опухоли
Уменьшение дисфагии
Продление жизни
Иногда выздоровление (особенно используя
комбинированный метод, при котором пред – и
послеопера-ционное облучение дополняет
хирургическое вмешательство.
104.
Комбинированное и комплексноелечение рака пищевода
Неоадьювантная лучевая терапия не влияет на резектабельность,
послеоперационую летальность и 5-летнюю выживаемость
Максимальный прирост эффективности от использования
лучевой терапии не превышает 3-4%.
Неоадъювантная радиохимиотерапия обеспечивает выраженный
местный эффект.
Полная регрессия опухолей отмечается в 30-40%.
Эффективность лечения 40% - 80%.
Улучшение отдаленных результатов остается спорным (Arnott SJ,
et al. Int J Radiat Oncol Biol Phys 1998).
Адьювантная лучевая терапия
не улучшает отдаленные результаты,
ухудшает качество жизни пациентов
увеличивает частоту стриктур анастомоза может уменьшить
частоту локорегионарных рецидивов (Yamamoto M, 1997).
105.
ПХТ-
-
ВИДЫ
Адъювантная
Неоадъювантная
-
-
ПРЕПАРАТЫ
Платины
Блеомицин
Адриамицин
Фторурацил
Метотрексат
Гемзар
Виндезин
106.
Химиолучевое лечениеМожет быть проведено 60–70% больным РП.
У 2/3 больных отмечается 50% регрессия опухоли, при этом
средняя выживаемость составляет 15–20 мес.
полный регресс опухоли, наблюдается в 20–25% случаев
При отсутствии отдалённых метастазов отмечается
очевидная корреляция между полным регрессом опухоли и
выживаемостью больных.
При использовании химиолучевого лечения удаётся
снизить в 2–3 раза лучевую нагрузку, необходимую для
регрессии 50% опухоли.
107.
ХимиотерапияЭффективность низка – 10–30%, непродолжительна (от 2 до
4 месяцев) и не сопровождается улучшением выживаемости.
Тяжелые побочные эффекты.
Наиболее эффективна при лечении
недифференцированного и мелкоклеточного рака.
При 20% потери массы тела невозможна, а при 10% –
проблематична.
Наиболее оптимальное соотношение
безопасность/эффективность отмечается при сочетании 5фторурацила и цисплатины.
Эффект при применение производных таксанов получен у
32% больных. Однако, отдаленные результаты
незначительно отличаются от лечения традиционными
препаратами. (Моисеенко В.М., 2003).
Заслуживает внимания эндоскопическое интратуморальное
введение цитотоксических препаратов. В предварительных
результатах отмечено ослабление дисфагии, увеличение
среднего времени прогрессирования опухоли и
выживаемости больных.
108.
Неоадьювантная, как иадьювантная химиотерапия, не
улучшают отдаленные
результаты лечения (Оgino T.
1995, Enzinger P. 2003).
109.
ИммунотерапияВнутри- и перитуморальное введение
неспецифических антигенов на основе
бактериальных препаратов (стрептококковая
суспензия ОК432) в комбинации с лучевой
терапией обеспечивает полный регресс опухоли у
70% больных, а 5-летняя выживаемость достигает
33% в общей группе и 45% – с полным регрессом.
Недостаток – сложнось приготовления и высокая
стоимость вакцин.
110.
Симптоматическое лечениеОсновная цель - восстановление полноценного энтерального
питания (восстановление проходимости пищевода).
Пациентам с удовлетворительным функциональным
статусом возможно применение методов эндоскопической
реканализации опухоли, эндоскопического стентирования
и даже выполнение шунтирующих операций.
Выполнение паллиативных резекций пищевода
нецелесообразно, ввиду высоких цифр осложнений и
летальности после таких вмешательств.
111.
К симптоматическим хирургическимвмешательствам относятся:
гастростомия
бужирование
баллонная дилятация
стентирование пищевода
112.
Механические способывосстановления
проходимости пищевода
бужирование
дилатация опухолевых стриктур
применение эндоскопических стентов
113.
Метод балонной дилатацииИдентичен бужированию,
Применяется при коротких (до 2–3 см) стенозах.
Как подготовительный этап для последующего
использования других методов паллиативного лечения или
у пациентов с коротким прогнозом оставшейся жизни.
Преимущества: низкая стоимость, возможность применения
амбулаторно, непосредственный эффект после применения.
Недостатки: быстрый возврат дисфагии, что требует повторения
процедуры каждые 3–4 недели, вероятность разрыва стенок
пищевода - в 6–13% случаев.
114.
Типы эндоскопических стентов– ригидные пластиковые стенты (типа
Альгорна);
– саморасправляющиеся металлические
стенты (с памятью формы).
115.
Ригидные пластиковые стентыВысокий риск осложнений при их
применении:
перфорации при установке (до 10%);
кровотечения;
частые миграции стента.
Паллиативное лечение злокачественных
пищеводно–трахеальных/бронхиальных свищей с
целью прикрытия зоны дефекта опухоли.
116.
Саморасправляющиеся стенты спамятью формы (СРС)
Преимущества:
простота установки
более низкая частота осложнений и последующей миграции
уменьшение степени дисфагии у 86–99% пациентов.
Недостатки:
высокая стоимость;
невозможность коррекции позиции стента после установки
частые случаи неполного раскрытия стента (в 30–40%).
высокая частота реокклюзии стентов без покрытия на фоне
прорастания их опухолью (в16–66% случаев).
вероятность рестеноза пищевода из-за продольной прогрессии
опухоли за пределами стента .
117.
118.
• стенозирующий рак пищевода с выраженнойдисфагией III–IV степени перед хирургическим,
химиотерапевтическим, лучевым лечением, а у
инкурабельных больных — как самостоятельный
метод симптоматического лечения;
• рак пищевода с формированием пищеводнотрахеального, пищеводно-бронхиального,
пищеводно-плеврального или пищеводномедиастинального свища;
Показания
119.
Этапы установки пищеводного стентавключают в себя:
1. Выполнение эзофагоскопии с внутрипросветным
введением водорастворимого контраста и
нанесением рентгеноконтрастных меток (накожные
рентгеноконтрастные метки,
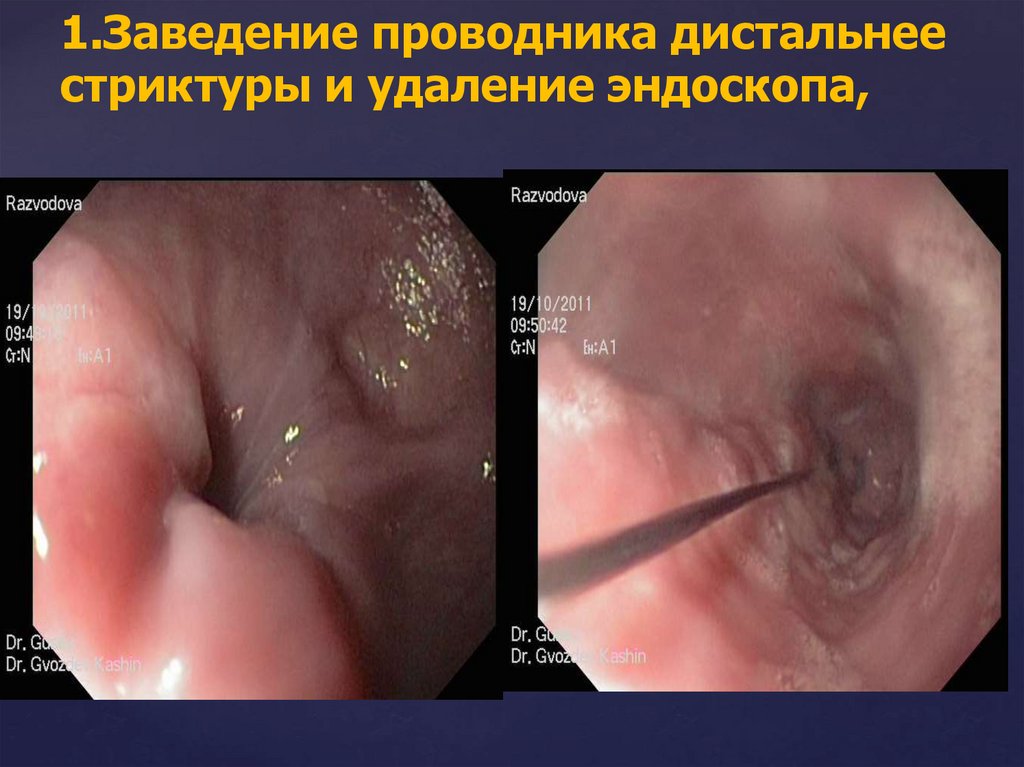
2.Заведение проводника дистальнее стриктуры и
удаление эндоскопа,
3.Проведение доставочного устройства с заряженным
стентом.
4.Окончательное позиционирование и
высвобождение стента.
5.Эндоскопический и рентгенологический контроль
положения стента.
120.
1.Заведение проводника дистальнеестриктуры и удаление эндоскопа,
121.
Проведение доставочного устройства сзаряженным стентом.
122.
Окончательное позиционированиеи высвобождение стента.
123.
На 5-7 сутки проводитсярентгенологический, а возможно и
эндоскопический, контроль стояния и
раскрытия стента.
При этом пациенту дается глоток
водорастворимого контраста или
жидкого бария для контроля
проходимости стента и далее
назначается специальная диета.
124.
Возможные осложненияэндопротезирования верхних отделов
пищеварительного тракта:
• Боль
• Ощущение инородного тела
• Миграция
• Изъязвление слизистой оболочки
• Кровотечение
• Перфорация
• Сдавление и/или прорастание опухолью
• Рефлюкс-эзофагит
125.
Прегабалин(лирика) показал высокую эффективностьв терапии НБС у онкологических пациентов на всех
ступенях «лестницы ВОЗ»
Прегабалин обладает более высоким профилем безопасности,
что делает его предпочтительным для сочетанной терапии с
опиоидами в амбулаторной практике
Применение прегабалина повышает эффективность и
безопасность терапии НБС у онкологических больных:
предотвращает раннее назначение сильных опиоидов,
способствует снижению их дозы,
стабилизирует
анальгезию на протяжении
длительного времени.
126.
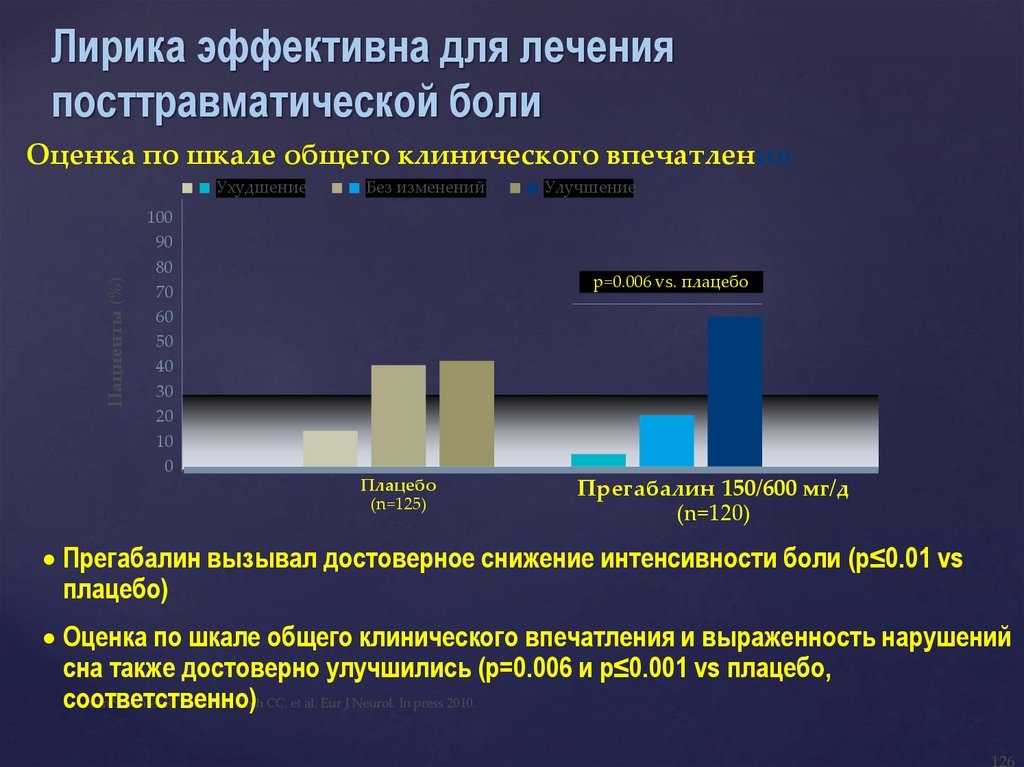
Лирика эффективна для леченияпосттравматической боли
Оценка по шкале общего клинического впечатления
Пациенты (%)
Ухудшение
Без изменений
100
90
80
70
60
50
40
30
20
10
0
Улучшение
p=0.006 vs. плацебо
Плацебо
(n=125)
Прегабалин 150/600 мг/д
(n=120)
Прегабалин вызывал достоверное снижение интенсивности боли (p≤0.01 vs
плацебо)
Оценка по шкале общего клинического впечатления и выраженность нарушений
сна также достоверно улучшились (p=0.006 и p≤0.001 vs плацебо,
van Seventer R, Bach FW, Toth CC, et al. Eur J Neurol. In press 2010.
соответственно)
126
127.
ПЕРЕЧЕНЬ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯТЕРАПИИ УМЕРЕННОГО И СИЛЬНОГО ХБС У
ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ
Ноцицептивная боль
ТРАМАДОЛ капсулы,
таблетки ретард
ПРОСИДОЛ защечные
таблетки
ТТС БУПРЕНОРФИНА
МОРФИН в табл.
продленного действия
ТТС ФЕНТАНИЛА
Нейропатическая боль
Первая линия
• Габапентин
• Прегабалин
Вторая линия
• Опиоидные
анальгетики
128.
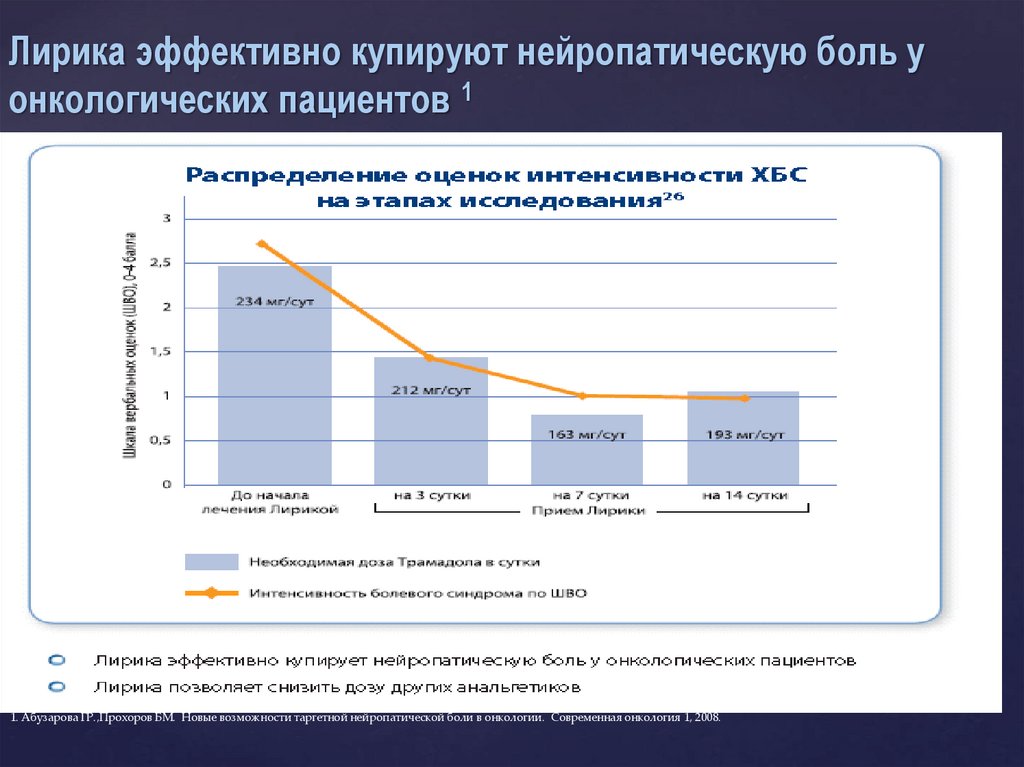
Лирика эффективно купируют нейропатическую боль уонкологических пациентов 1
Причины возникновения нейропатической боли в онкологии
1. Urch CE, Dickenson AH. Eur J Cancer. 2008;
129.
Лирика эффективно купируют нейропатическую боль уонкологических пациентов 1
1. Абузарова ГР.,Прохоров БМ. Новые возможности таргетной нейропатической боли в онкологии. Современная онкология 1, 2008.
130.
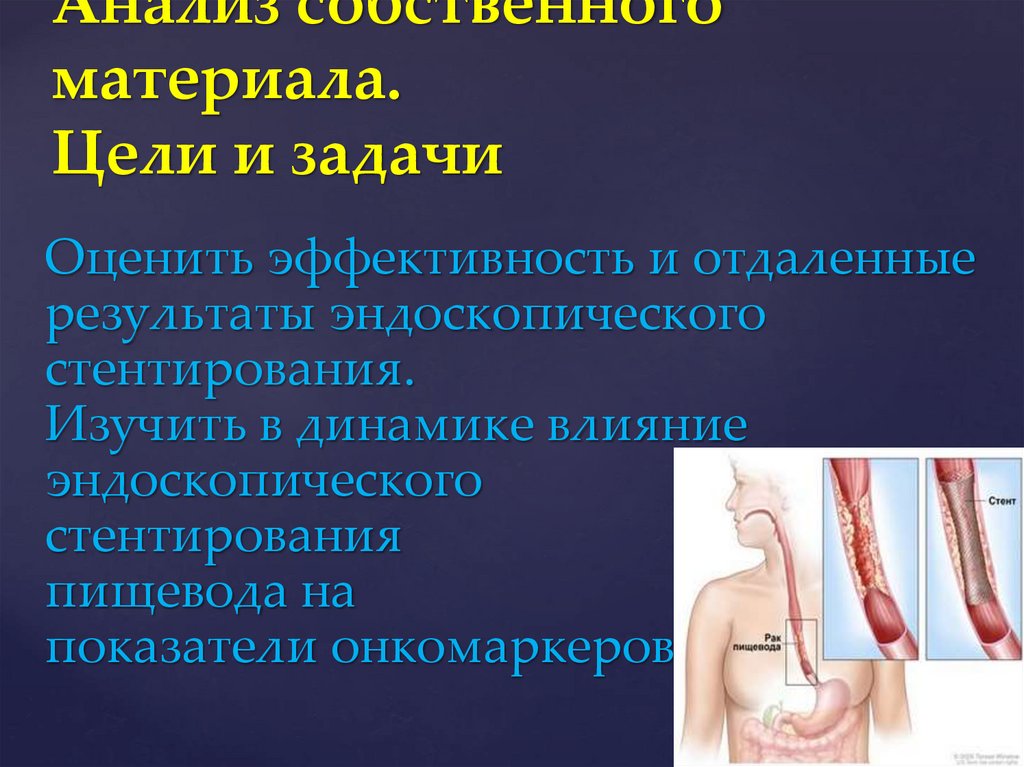
Анализ собственногоматериала.
Цели и задачи
Оценить эффективность и отдаленные
результаты эндоскопического
стентирования.
Изучить в динамике влияние
эндоскопического
стентирования
пищевода на
показатели онкомаркеров.
131.
В период с июля 2010 г. по апрель 2012 г.стентирование опухолевой стриктуры пищевода
выполнено 35 пациентам:
мужчины
женщины
Материалы и методы
Возраст пациентов от 57 лет до 89 лет,
средний возраст - 73 года.
132.
Всего установлено – 37 стентовЛокализация злокачественного новообразования
12
10
8
6
4
2
0
10
7
6
6
2
1
133.
автоматическийиммуноферментный
анализатор «Personal Lab»
Опухолевые маркеры СА19-9, РЭА
и опухолевая М2-пируваткиназа
134.
РЕЗУЛЬТАТЫВосстановление питания через рот после
стентирования пищевода и кардии отмечено у
всех пациентов,
у 72% больных была стабилизация или
увеличение веса тела с улучшением общего
самочувствия. 30-дневная летальность
больных со стенозирующими формами рака
пищевода и кардии после эндоскопического
лечения и стентирования составила 5,7%,
медиана выживаемости - 14 мес.
Максимальная выживаемость составила 18
135.
Ранние послеоперационныеосложнения:
Ощущение инородного тела за
грудиной или боль – 93%;
Поздние осложнения – 30%:
Результаты
Летальность - 5,7% (2).
Кровотечение – 2,85% (1).
Пневмония – 2,85% (1)
136.
8,6% (3) - миграция стента.Эндоскопическая репозиция стента.
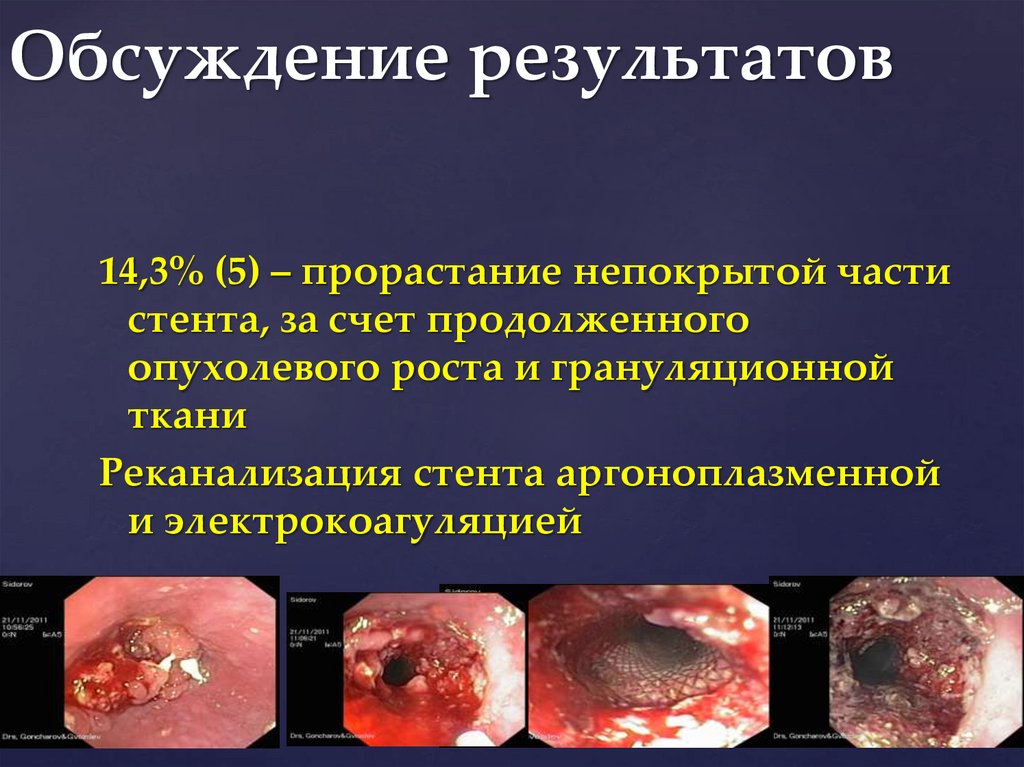
Обсуждение результатов
137.
Обсуждение результатов14,3% (5) – прорастание непокрытой части
стента, за счет продолженного
опухолевого роста и грануляционной
ткани
Реканализация стента аргоноплазменной
и электрокоагуляцией
138.
Установка 2-го стента по типу « стент в стент»при продолженном опухолевом росте
Обсуждение
результатов
139.
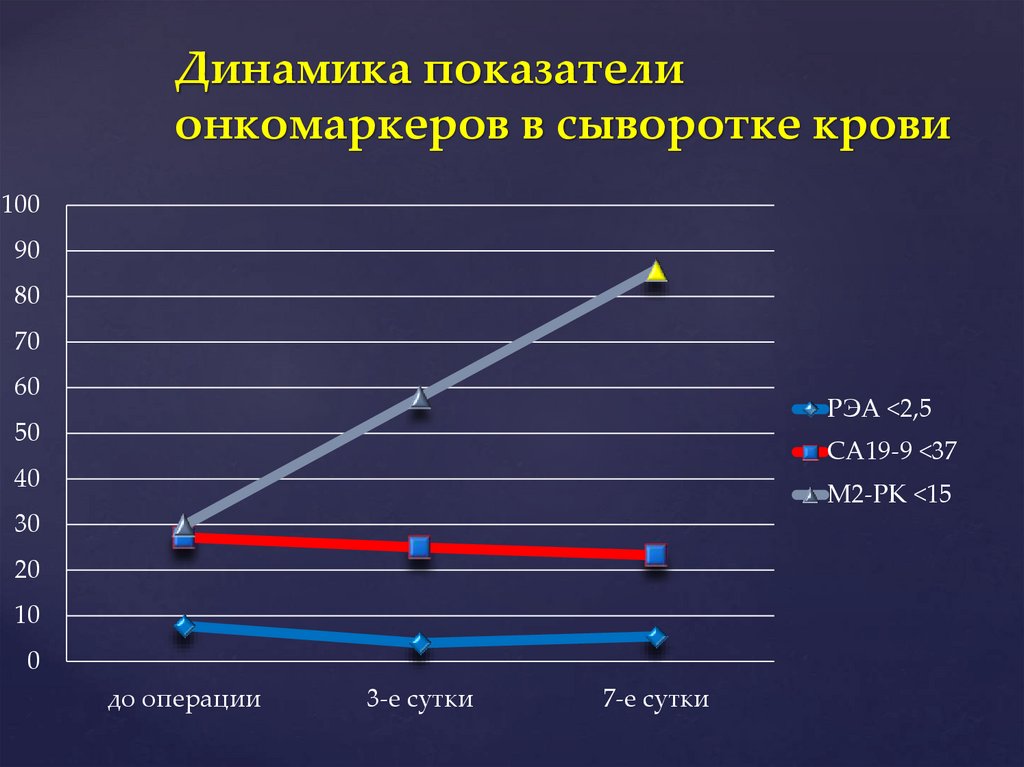
Динамика показателионкомаркеров в сыворотке крови
100
90
80
70
60
РЭА <2,5
50
СА19-9 <37
40
М2-РК <15
30
20
10
0
до операции
3-е сутки
7-е сутки
140.
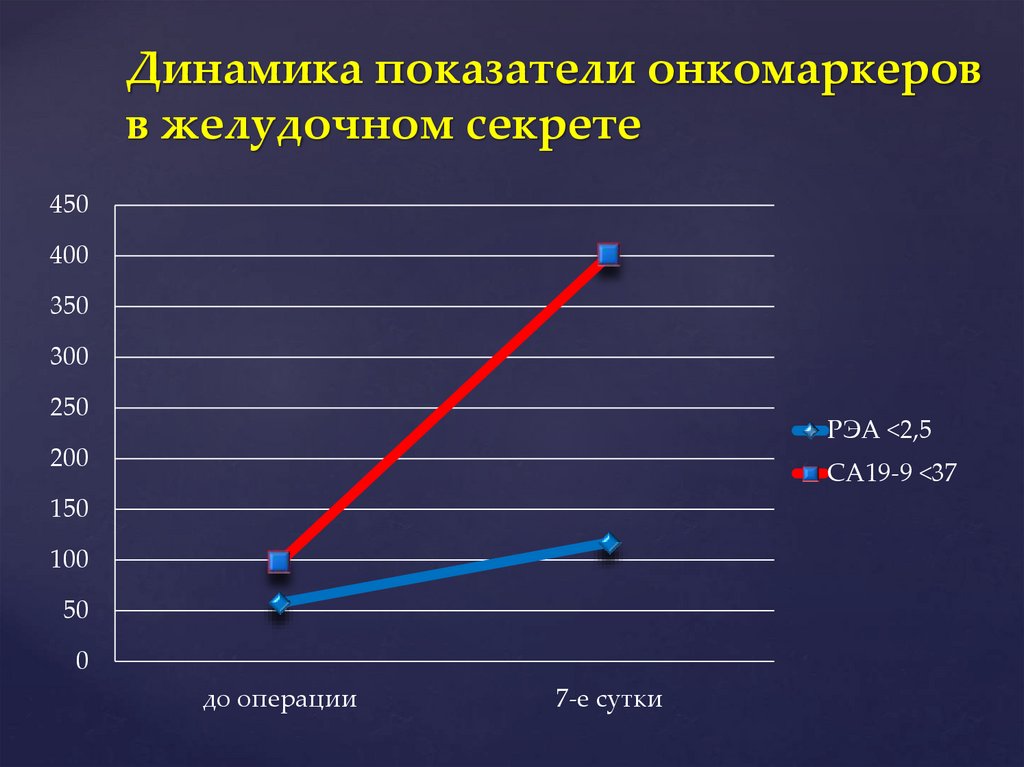
Динамика показатели онкомаркеровв желудочном секрете
450
400
350
300
250
РЭА <2,5
200
СА19-9 <37
150
100
50
0
до операции
7-е сутки
141.
Стентирование пищевода – наименеетравматичное и весьма эффективное
вмешательство, значительно улучшающие
качество жизни пациентов и дающие
хороший лечебный эффект. Явление
дисфагии удалось купировать у всех
пациентов
Выводы
142.
Рост выброса М2-РК в плазму крови иповышение СА19-9 и РЭА в
желудочном секрете, указывает на
необходимость назначения
энтеросорбентов для исключения их
из энтерогепатической циркуляции,
и в/в введения насыщенных и
Выводы
мононенасыщенных
жирных кислот
для их ингибирования
143.
химический некролиз опухоли.электрохирургическая высокочастотная коагуляция и
резекция.
вапоризация термальными лазерами
аргоноплазменная коагуляция
фотодинамическая терапия
Эндоскопическая
деструкция опухоли
144.
Электрохирургическаявысокочастотная коагуляция и
резекция
Восстанавливает проходимость пищевода у 83–98%
больных на период в среднем до 36 дней.
Обеспечивает среднюю выживаемость до 18 мес.
Высокая вероятность осложнений:
кровотечения
перфорации стенки пищевода в 5–9% случаев с
летальным исходом у 1–1,2 % пациентов.
145.
Вапоризация термальнымилазерами
Позволяет реканализировать протяжённые опухолевые
стенозы.
Более производительна, чем электрокоагуляция.
Непосредственная эффективность устранения дисфагии
составляет 78–93%.
Средняя длительность безрецидивного периода 57 дней, а
выживаемость 128 дней.
Дополнение лазертерапии внутрипросветной
брахитерапией позволяет увеличить безрецидивный
период до 83 дней, а в сочетании с химиотерапией – до 117
дней.
Перфорация пищевода отмечена в 2–6%.
146.
Аргоноплазменная коагуляцияПозволяет получать гомогенные зоны коагуляции и
десикации (высушивания) при контролируемой глубине
проникновения, не более 3 мм, что практически исключает
риск перфорации.
При сочетании с лучевой терапией (брахитерапия +
дистанционное облучение) непосредственная
эффективность лечения - 93,5%.
Недостаток - в сравнении с лазерной фотокоагуляцией
необходимо большее количество сеансов для достижения
лечебной цели, особенно при опухолях с выраженным
экзофитным компонентом.
Возможно использование для лечения через установленный
саморасправляющийся металлический стент.
147.
Фотодинамическая терапияСредняя длительность безрецидивного периода 88 дней, а выживаемость - 145 дней.
При распространенных опухолевых стенозах –
эффективность низкая.
В комбинации с электро-лазерной деструкцией
эффективость - 94,6%.
Предоставляет возможность лечения через
установленный саморасправляющийся
металлический стент.
148.
Альтернативные и перспективные методы лечения«раннего» рака пищевода и пищевода Баррета.
Эндоскопическая резекция слизистой (EMR)
Фотодинамическая терапия
Процедуры основанные на абляции (лечение
пищевода Баррета)
Аргоновая плазменная коагуляция
Мультиполярная электрокоагуляция (продолжаются
исследования)
Лазеры (продолжаются исследования)
Криотерапия (продолжаются исследования)
149.
Эндоскопическая резекцияслизистой (EMR)
Дает возможность получения целого образования
для последующего морфологического
исследования.
Уровень осложнений и смертности у пациентов
после EMR ниже чем после эзофагэктомии (7 % на
69 % и 0 % на 14 % соответственно).
5-летняя выживаемость при EMR такая же как и
эзофагэктомии.
Не исключает дальнейшего использования другой
терапии (возможно сочетание с фотодинамической
терапией и т.д.).
150.
151.
Фотодинамическая терапияРезультат лечения зависит от размера опухоли.
при опухоли размером до 1 см полная регрессия получена в 100%.
до 1,5 см – в 72%
до 2 см – в 65%
до 3 см – в 55%
до 5 см – в 53% наблюдений (р 0,01).
Не отмечено значительных различий в результатах ФДТ при
плоскоклеточном раке и аденокарциноме.
Предшествовавшая дистанционная лучевая терапия на
результат лечения не влияет.
Осложнения наблюдались в12,2 % (Radu).
Медиана выживаемости в группе больных ранним раком
пищевода составила – 4,6 года.
152.
ВыводыТолько комплексное обследование лиц входящих в «группы
риска» может способствовать выявлению РП на ранней
стадии.
Расширенные лимфодиссекций при радикальных
операциях значительно улучшает результаты 5-летней
выживаемости, существенно не влияя на показатели
осложнений и летальности.
Необходимы проспективные исследования, оценивающие
исход терапии, прежде чем эндоскопическое лечение
ранних форм рака пищевода может быть рекомендовано
как стандарт лечения.
Поскольку основная часть больных РП не подлежит
радикальному лечению, необходим поиск новых, более
эффективных методов паллиативной терапии.
153.
СПАСИБО ЗА{ВНИМАНИЕ!













































































































 medicine
medicine