Similar presentations:
Рак пищевода. Об этиологии, клинических проявлениях, патогенезе рака пищевода
1.
Рак пищеводаДоцент кафедры онкологии, ФГБОУ ВО НГМУ, Минздрава РФ,
к.м.н. Ткачук Ольга Анатольевна
2.
Актуальность темы:Рак пищевода среди всех патологических
процессов в пищеводе составляет до 90 %.
Пищевод относится к органам, весьма часто
поражаемым раком, поэтому проблема рака
пищевода находится в центре внимания
онкологов.
Рак пищевода – злокачественная опухоль,
формирующаяся
из
разросшегося
и
переродившегося
эпителия
стенки
пищевода
3.
Цель лекции• Познакомить слушателей с онкоэпидемиологией
рака пищевода;
• Рассказать об этиологии, клинических
проявлениях, патогенезе рака пищевода;
• Обозначить алгоритмы обследования, лечения,
прогноза, реабилитации больных раком пищевода.
4.
План лекции• Введение
• Цель лекции
• Актуальность темы
• Анатомия пищевода
• Онкоэпидемиология
• Клиника
• Классификация по системе ТNМ
• Инструментальные методы обследования
• Методы лечения
• Прогноз
5.
Анатомия пищеводаРегионарные лимфатические узлы:
для верхней трети пищевода - надключичные,
паратрахеальные, верхние параэзофагеальные,
паракардиальные;
для средней трети - паратрахеальные, бифуркационные,
параэзофагеальные, паракардиальные;
для нижней трети - параэзофагеальные, паракардиальные,
бифуркационные, узлы малого сальника.
6.
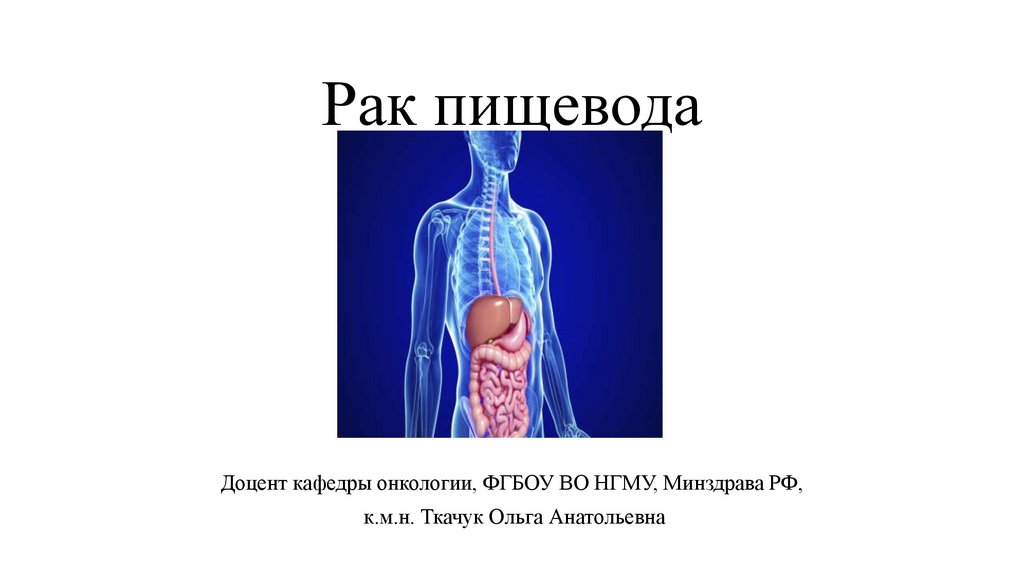
Анатомия пищевода7.
Общая длина его в среднем равна 25 см.Пищевод фиксирован лишь в шейном
отделе и в области диафрагмы, остальные
его отделы довольно подвижны как в
вертикальном,
так
и
в
боковых
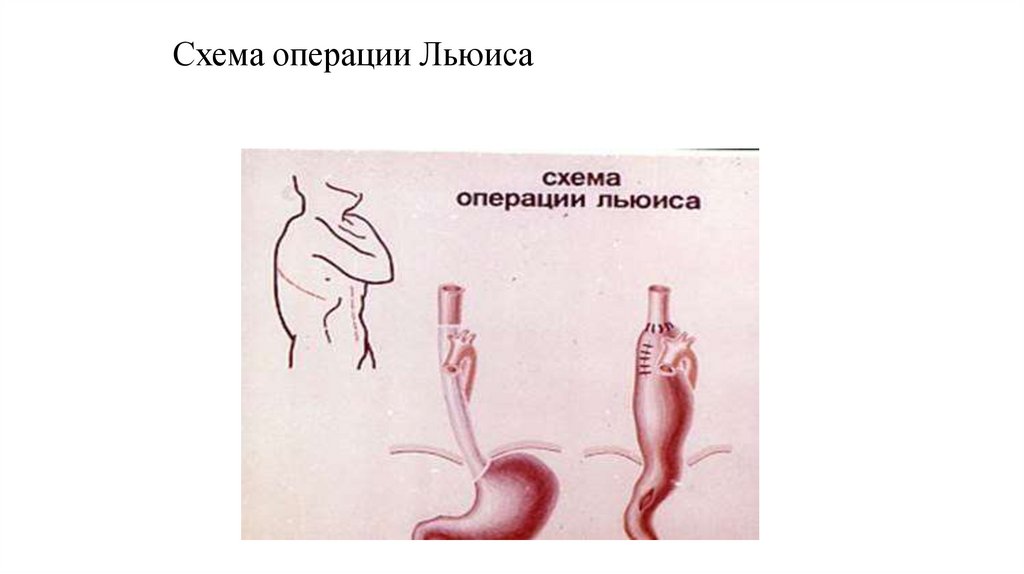
направлениях.
Он имеет три сужения: в начальном отделе,
на уровне бифуркации трахеи и при
переходе через диафрагму.
8.
Кровоснабжениешейного
отдела
пищевода
осуществляется ветвями нижних щитовидных артерий,
в средней трети – из бронхиальных и непарных,
идущих
непосредственно
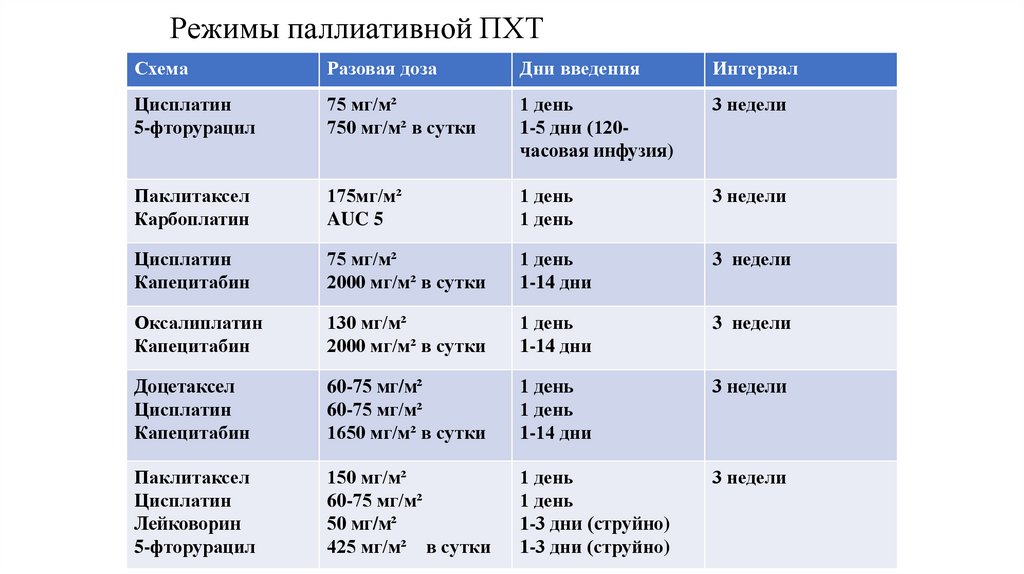
из
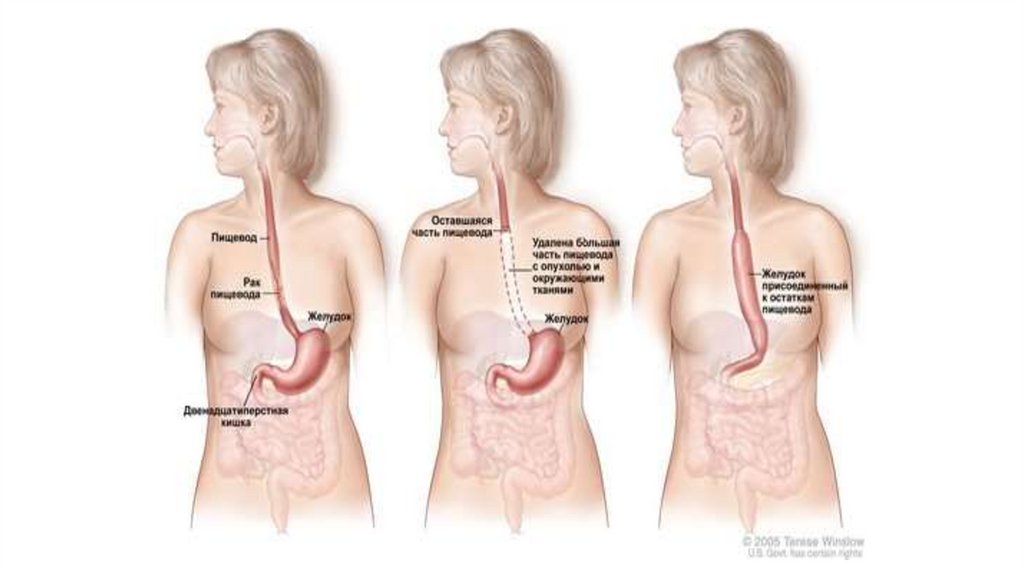
аорты,
мелких
пищеводных артерий, и внизу – из пищеводных ветвей
левой желудочной артерии и диафрагмальных артерий.
В области пищевода имеются венозные анастомозы
между воротной веной печени и верхней полой веной.
Физиологическая функция пищевода складывается
главным образом из произвольного и непроизвольного
актов.
9.
Различают три отдела пищевода:• шейный (5-6 см),
• грудной (15-16 см) (верхне-, средне-, нижне-)
• абдоминальный (1-4 см).
10.
Самой уязвимой считается средняя треть(уровень 4-7 грудных позвонков).
На ее долю приходится до 60% всех
случаев развития опухоли.
Менее часто страдают отделы:
верхнегрудной в 15%
нижнегрудной в 25%
11.
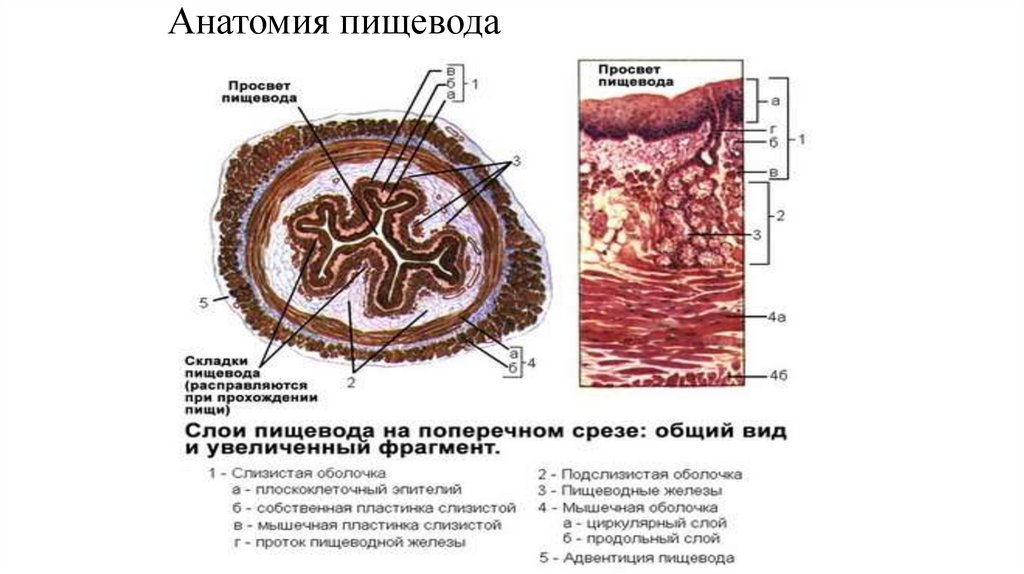
Локализация верхнего полюса опухоли• Шейный отдел:
20 см от резцов
• Верхнегрудной отдел:
20-25 см от резцов
• Среднегрудной отдел:
25-30 см от резцов
• Нижне-грудной отдел:
30-40 см от резцов
12.
Типы опухоли пищеводно-желудочного соустья, согласноклассификации Siewert.
• I тип –аденокарцинома дистального отдела пищевода,
центр располагается в пределах от 1 до 5 см выше Zлинии
• II тип – истинная аденокарцинома зоны пищеводножелудочного перехода (истинный рак кардии), центр в
пределах 1 см выше и 2 см ниже Z –линии
• III тип –рак с локализацией основного массива
опухоли в субкардиальном отделе желудка (от2 до 5 см
от Z-линии) и возможным вовлечением дистальных
отделов пищевода.
13.
Опухоли пищеводно-желудочного соустья, согласноклассификации Siewert I и II типов подлежат
алгоритмам лечения, соответствующим раку пищевода
14.
Сегментарное деление пищевода, исходя изанатомических взаимоотношений его с
соседними органами, различают 9 сегментов:
1. трахеальный сегмент — от входа в пищевод до
верхнего края дуги аорты,
2.аортальный — соответствует диаметру дуги
аорты,
3.бронхиальный — проекции левого главного
бронха,
4. межаортобронхиальный — от нижнего края
дуги аорты до верхнего края левого главного
бронха,
15.
5. подбронхиальный — от бифуркациитрахеи до левого предсердия,
6. ретроперикардиальный
(ретрокардиальный) — проекции
левого предсердия и желудочка,
7. наддиафрагмальный — высоте купола
диафрагмы справа,
8. внутридиафрагмальный,
9. поддиафрагмальный (абдоминальный).
16.
Регионарные лимфатические узлыпрескаленные;
внутренние яремные;
верхние и нижние шейные;
шейные околопищеводные;
надключичные (билатеральные);
претрахеальные (билатеральные);
лифоузлы корня легкого (билатеральные);
верхние параэзофагеальные (выше v. azygos);
бифуркационные;
нижние параэзофагеальные (ниже v. azygos);
задние медиастинальные;
диафрагмальные;
перигастральные (правые и левые кардиальные, лимфоузлы вдоль малой кривизны, вдоль
большой кривизны, супрапилорические, инфрапилорические, лимфоузлы вдоль левой
желудочной артерии).
17.
Метастазыв
надключичные
лимфатические узлы (Vb), лимфатические
узлы по ходу сосудистого шейного пучка
(III, IV), узлы ворот селезенки и
печеночно- двенадцатиперстной связки
должны расцениваться как метастазы в
нерегионарные
лимфатические
узлы
M1(Lymph).
18.
Поражение чревных л/узловне
является
противопоказанием
к
проведению химиолучевой терапии и
решению вопроса об оперативном
лечении.
19.
Наиболее часто встречающающаяся форма плоскоклеточный рак (60%). Примерно15% встречается в шейном отделе, 45% - в
среднем, и 40% - в нижне –грудном отделах.
На втором месте по частоте находится
аденокарцинома, чаще всего развивающаяся
у пациентов с пищеводоа Баррета (40%).
Редкие
опухоли
пищевода
мукоэпидермоидная
карцинома
и
аденокистозная карцинома.
20.
Международная гистологическая классификация злокачественных опухолей пищевода (2010)КОД
Описание
Плоскоклеточные опухоли
8077/2
Плоскоклеточная интраэпителиальная
неоплазия (дисплазия) (high grade)
8070/3
Плоскоклеточный рак
8083/3
Базалоидный плоскоклеточный рак
8560/3
Аденосквамозный рак и т.д.
21.
Формы рака пищевода• Опухоль равномерно инфильтрирует стенку пищевода,
переходя в нормальную ткань без видимой границы.
Такая форма называется скиррозным или
инфильтративным раком.
• Опухоль разрастается в просвет пищевода,
усугубляется метастазами в регионарные и отдаленные
лимфоузлы уже на ранних стадиях, легко распадается.
Это язвенный (мозговидный) рак.
• Легко распадающаяся кровоточащая опухоль
и ее экзофитный рост характеризуют бородавчатопапилломатозный рак, еще называемый узловатым.
• Смешанные формы опухолей.
22.
Онкоэпидемиология• Рак пищевода является одним из самых агрессивных
злокачественных новообразований и занимает восьмое
место в структуре смертности в мире.
• седьмое место среди злокачественных новообразований
всех органов и тканей.
• Около 6% от всех злокачественных новообразований у
мужчин и 3,5% у женщин.
• В некоторых областях северного Ирана, на юге России и
на севере Китая заболеваемость раком пищевода
составляет 30-800 случаев на 100,000 населения.
• Чаще всего опухоль развивается в средней трети
пищевода, реже – в нижней трети и совсем редко – в
верхней трети.
• Мужчины болеют в 3 раза чаще женщин.
• С возрастом уровень заболеваемости повышается.
23.
ОнкоэпидемиологияПовышена частота рака пищевода во Франции, Бразилии. Индии,
а также в США среди негритянского населения. В большинстве
европейских стран опухоль встречается относительно редко
(мужчины — 4–7, женщины 1–2 на 100 000 населения).
На территориях с высоким уровнем заболеваемости рак пищевода
в 5–10 раз чаще встречается у лиц коренной национальности, чем
у некоренного населения.
Столь существенные различия могут быть связаны с
особенностями характера питания, но нельзя исключить и
влияния
генетических
факторов.
24.
Причины развития рака пищеводаСиндром
Пламмера-Винсона
(сидеропеническая
дисфагия),
который
включает
симптомы:
сидеропеническая анемия, глоссит, эзофагит. Проявлением
этого синдрома являются мембраны в верхней трети
пищевода, обычно у людей среднего возраста, как правило
у женщин с выраженной адентией, атрофичной слизистой
оболочкой полости рта, анемией и дисфагией. Чаще
мембраны расположены сразу ниже входа в пищевод.
Лечение заключается в дилатации пищевода, применении
препаратов железа. При этом синдроме частота
возникновения рака пищевода примерно 10%.
Синдром чаще встречается в Швеции.
25.
•Постоянное употребление горячей пищи инапитков (кипяток);
• Употребление алкоголя (особенно чистого
или слаборазбавленного спирта)
и табака
являются независимыми факторами риска,
однако, в сочетании увеличивают риск;
• Стриктуры пищевода, обусловленные ожогом
щелочью, кислотой, горячей жидкостью;
•Недостаточное
употребление
витаминов А, В, С;
в
пищу
26.
•Длительно существующая ахалазия пищевода(риск возникновения рака пищевода -5%).
Лечение ахалазии путем миотомии не снижает
риск заболевания;
•Среди коренных народов Севера, Сибири и
Дальнего Востока широко распространено
употребление очень горячего «кирпичного»
чая, замороженной рыбы и мяса, жестких
лепешек, которые в зимнее время иногда тоже
хранятся в замороженном виде;
27.
•Упациентов
с
аутосомно-доминатным
заболеванием, характеризующемся гиперкератозом
ладоней и стоп риск развития рака пищевода
составляет 37%. Развивается как правило,
плоскоклеточный рак;
•Пищевода Баррета (Barrett's esophagus) состояние при котором желудочный эпителий
(однослойный, однорядный, цилиндрический)
находится более чем на 3 см выше кардии, в
дистальном отделе пищевода. Риск возникновения
рака пищевода у таких пациентов примерно в 30
раз выше чем в популяции.
28.
Гастроэзофагеальнаярефлюксная
болезнь
(ГЭРБ) – это хроническое рецидивирующее
заболевание, обусловленное спонтанным, регулярно
повторяющимся
забросом
желудочного
содержимого в пищевод, что приводит к поражению
нижнего отдела пищевода.
Развитие пищевода Баррета связано с гастроэзофагеальной
рефлюксной болезнью и является ее осложнением
29.
Классификация рака пищевода по МКБ-10C15
Злокачественное новообразование пищевода
C15.0
C15.1
Шейного отдела пищевода
Грудного отдела пищевода
C15.2
Абдоминального отдела пищевода
C15.3
C15.4
C15.5
Верхней трети пищевода
Средней трети пищевода
Нижней трети пищевода
Поражение пищевода, выходящее за
пределы одной и более вышеуказанных
локализаций
Пищевода неуточненное
C15.8
C15.9
30.
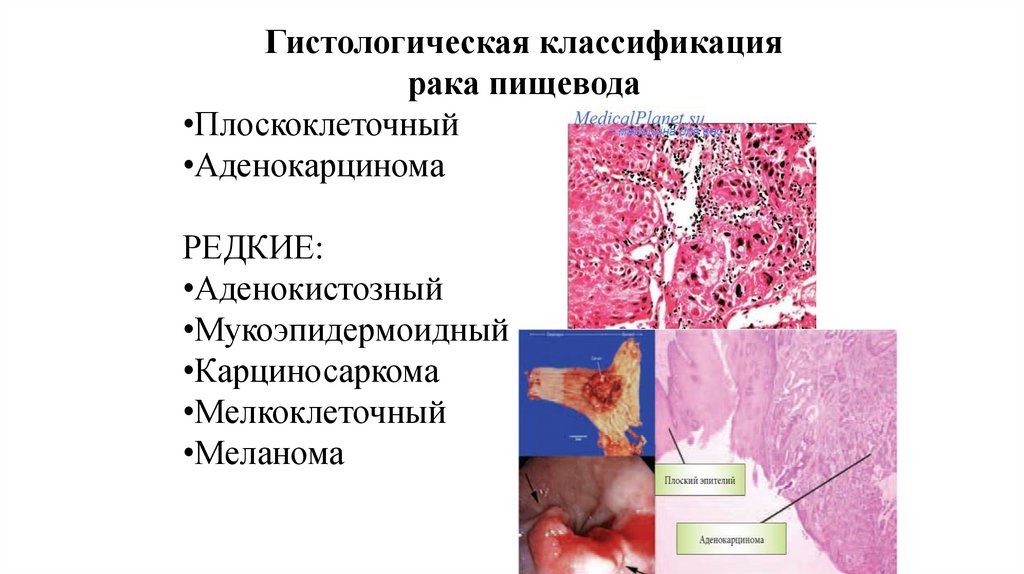
Гистологическая классификациярака пищевода
•Плоскоклеточный
•Аденокарцинома
РЕДКИЕ:
•Аденокистозный
•Мукоэпидермоидный
•Карциносаркома
•Мелкоклеточный
•Меланома
31.
Степень дифференцировки опухолиGx
Не может быть определена
G1
Высокодифференцированная опухоль
G2
Умеренно дифференцированная
опухоль
G3
Низкодифференцированная опухоль
G4
Недифференцированная опухоль
32.
Стадирование критерия T. Классификация Американскогопротиворакового комитета (AJCC) 8Ed – 2017
Первичная
опухоль, Т
Определение
Tx
Первичная опухоль не может быть оценена
T0
Нет признаков первичной опухоли
Tis
Карцинома in situ / дисплазия высокой степени
T1
Опухоль поражает собственную пластинку, мышечную пластинку слизистой
оболочки или подслизистый слой
T1a
Опухоль поражает собственную пластинку слизистой оболочки или мышечную
пластинку слизистой оболочки
T1b
Опухоль поражает подслизистый слой
33.
Стадирование критерия T. Классификация Американскогопротиворакового комитета (AJCC) 8Ed – 2017
Регионарные
метастазы, N
Определение
Nx
Регионарные лимфатические узлы не могут быть оценены
N0
Нет метастазов в регионарных лимфатических узлах
N1
Поражение 1–2 регионарных лимфатических узлов
N2
Поражение от 3 до 6 регионарных лимфатических узлов
N3
Поражение 7 или более регионарных лимфатических узлов
34.
ОпределениеОтдаленные
метастазы, М
ОтдаленОтдаленные метаные
метастазы,
М
стазы, М
Мх
Мх
М0
М0
М1
М1
Определение
Определение
Нет данных для оценки отдаленных метастазов
Нет данных для оценки отдаленных метастазов
Нет отдаленных метастазов
Нет отдаленных метастазов
Наличие отдаленных метастазов
Наличие отдаленных метастазов
Мх
Нет данных для оценки отдаленных метастазов
М0
Нет отдаленных метастазов
М1
Наличие отдаленных метастазов
35.
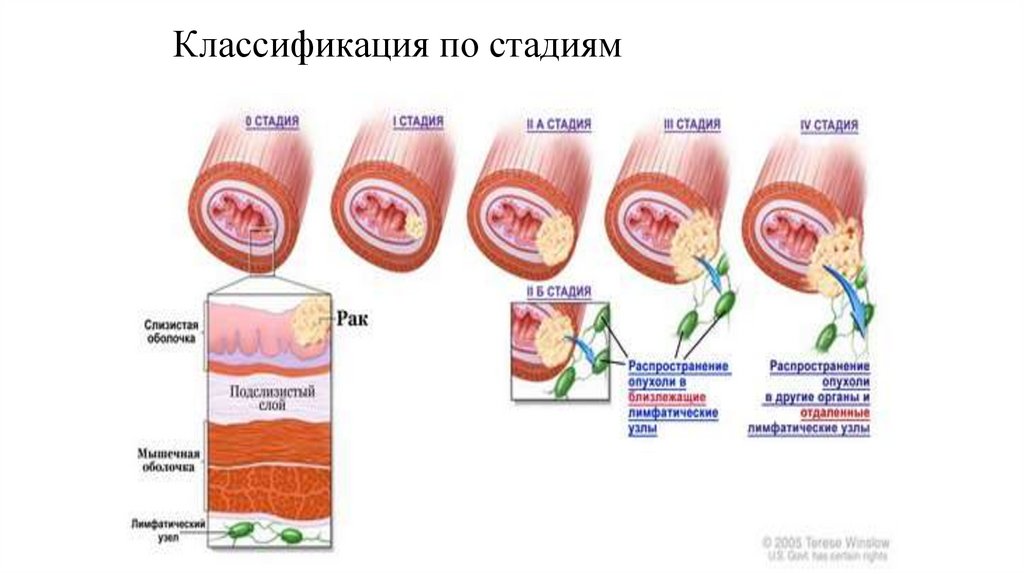
Классификация по стадиям36.
Основные отличия TNM 8Ed от TNM 7Ed.Изменения
Описание изменений
Плоскоклеточный рак
Анатомия/ локализация
Граница между классификацией опухоли как опухоль пищевода или желудка:
эпицентр
опухоли
более
2
см
от
пищеводно-
желудочного
перехода
классифицируется как рак желудка, даже если пищеводно-желудочный
переход вовлечен
Группировка
При стадировании учитывается разделение на pT1a и pT1b
на стадии
Группировка
pT2-3 учитываются отдельно как pT2 и pT3 для I-III стадий
на стадии
Группировка
Выделено отдельное разделение на стадии для cTNM, pTNM и
на стадии
ypTNM
37.
Основные отличия TNM 8Ed от TNM 7Ed.Изменения
Описание изменений
Аденокарцинома
Анатомия/
Граница между классификацией опухоли как опухоль пищевода или
локализация
желудка: эпицентр опухоли более 2 см от пищеводно- желудочного перехода
классифицируется как рак желудка, даже
если пищеводно-желудочный переход вовлечен
Группировка
стадии
Группировка
стадии
на
на
При стадировании учитывается разделение на pT1a и pT1b
Выделено отдельное разделение на стадии для cTNM, pTNM и ypTNM
38.
Клинические проявленияДисфагия - затрудненное глотание.
Различают несколько степеней дисфагии:
1 степень- затруднение прохождения твердой пищи (вторые блюда)
;
2 степень - затруднение прохождения кашицеобразной пищи
(первые блюда);
3 степень - затруднение прохождения жидкости;
4 степень – не проходит ничего (слюна).
!!! Дисфагия указывает на то, что от 50 до 75 % просвета пищевода
выполнены опухолью, занимающей до 2/3 окружности
39.
• Дисфагия при приеме жидкостей,кашель,
охриплость
голоса
и
кахексия - симптомы запущенной
карциномы пищевода;
• Кахексия;
• Повышенная саливация;
40.
• Регургитация (срыгивания, "пищеводнаярвота");
• Боли при глотании. Боль
распространение опухоли за
стенки пищевода;
означает
пределы
• При
поражении
органов
полости: тупые боли в груди;
грудной
• Синдром верхней полой вены.
41.
•Кашель - при образовании пищеводнотрахеальной фистулы,• Синдром
Горнера
симпатического ствола),
(поражение
• Паралич
диафрагмы
диафрагмального нерва),
(поражение
42.
•Выпот в плевральную полость;• Массивная
рвота
кровью
при
образовании
пищеводно-аортальной
фистулы (абсолютно летальна);
• Общие неспецифические симптомы:
адинамия, утомляемость, безразличие,
похудание, беспричинный субфебрилитет.
43.
Критерии установлениядиагноза/состояния:
• данные анамнеза;
• данные физикального обследования и
инструментального исследования;
• данные патолого-анатомического
исследования биопсийного
(операционного) материала.
44.
• Жалобы больного.• Анамнез.
• Объективное исследование.
Инструментальные
и
лабораторные
методы исследования:
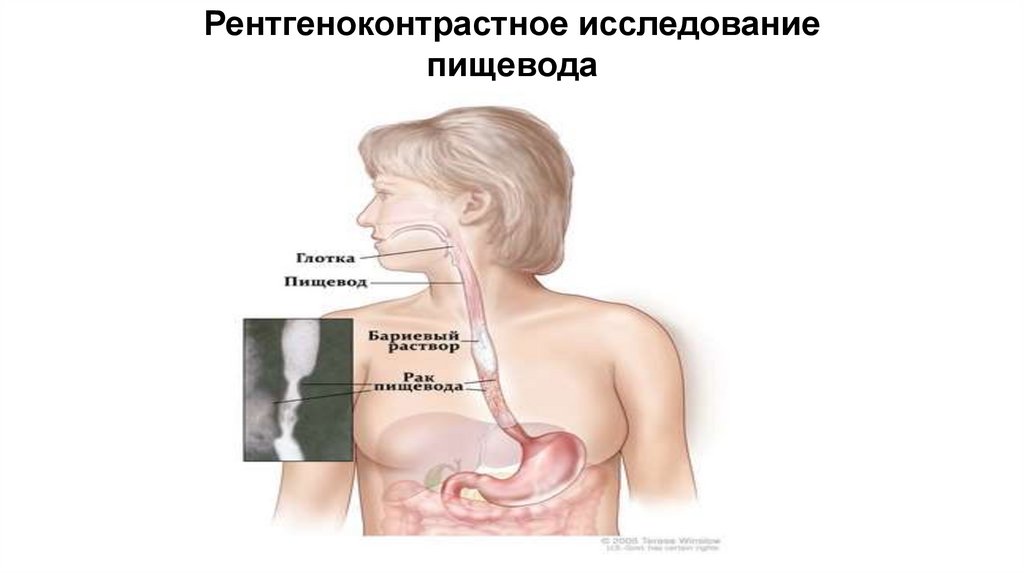
• Рентгеноконтрастное
исследование
пищевода позволяет установить диагноз,
определить локализацию и протяженность
опухоли.
45.
Физикальное обследованиеРекомендуется у всех пациентов с диагнозом рак пищевода и/или кардии
выполнить тщательное визуальное исследование, оценку общего состояния по
шкале ECOG и оценку нутритивного статуса пациента по шкале NRS 2002 с
целью определения тактики сопроводительной терапии и программы
нутритивной поддержки
Состояние питания
Удовлетворительное питание, критерии:
• ИМТ ≥ 18,5
• Снижение массы тела за последние 6 месяцев менее, чем на 5%
• Дисфагия I-III ст
Неудовлетворительное питание, критерии:
• ИМТ ≤ 18
• Снижение массы тела за последние 6 месяцев более, чем на 10%
• Дисфагия IV-V ст
46.
Рентгеноконтрастное исследованиепищевода
47.
Характерными признаками является:• сужение
пищевода
и
супрстенотическое
расширение,
• неровные ("изъеденные") края стенки,
• можно обнаружить пищеводно-трахеальный свищ,
• парез перистальтики,
• с-м «ниши»,
• дефект наполнения.
48.
Эзофагогастродуоденоскопия.Устанавливают характер роста опухоли, ее локализацию,
протяженность, выполняю биопсию.
49.
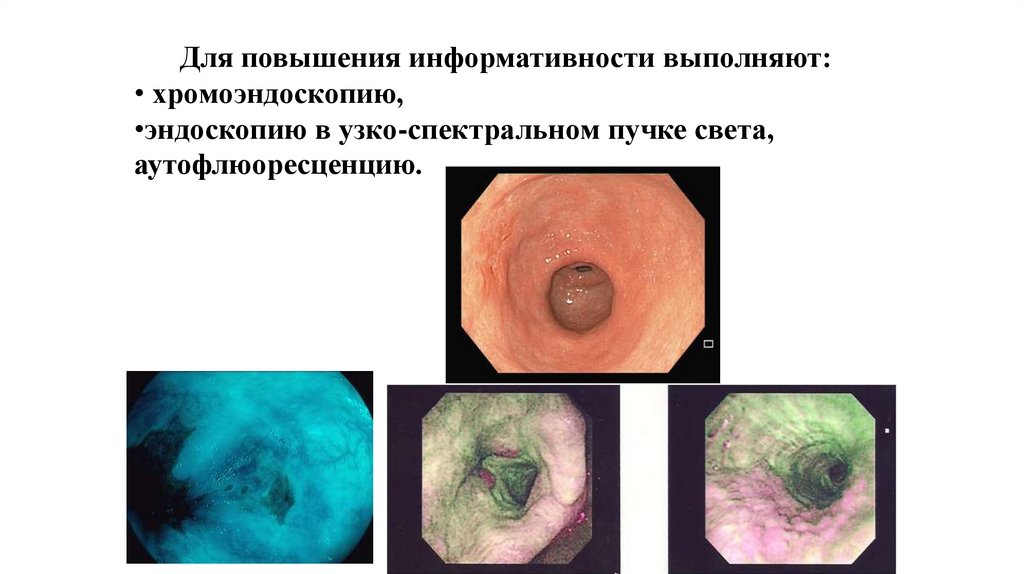
Для повышения информативности выполняют:• хромоэндоскопию,
•эндоскопию в узко-спектральном пучке света,
аутофлюоресценцию.
50.
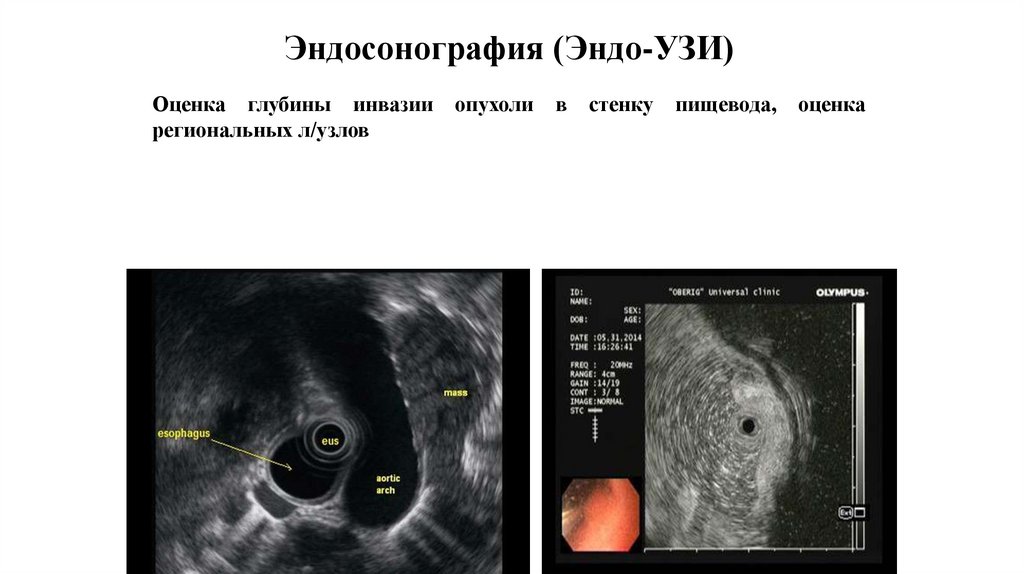
Эндосонография (Эндо-УЗИ)Оценка глубины инвазии
региональных л/узлов
опухоли
в
стенку
пищевода,
оценка
51.
Эндосонография является наиболее информативнымметодом в оценке глубины инвазии опухоли в стенку
пищевода (символ Т), а также позволяет с высокой
точностью (чувствительность 0,8 и специфичность
0,7)
оценить
состояние
регионарных
лимфоколлекторов (символа N). Для более точного
предоперационного стадирования и определения
тактики лечения возможно выполнение пункционной
биопсии медиастинальных лимфатических узлов под
контролем эндосонографии пищевода.
52.
КТ органов грудной клетки и брюшной полости св/в контрастированием
Выполняют для оценки регионарных л/узлов, исключения
отдаленных метастазов.
53.
Альтернативой КТ органов брюшной полости можетявляться МРТ органов брюшной полости с
внутривенным усилением. На практике данные
исследования могут быть отчасти заменены УЗИ
органов брюшной полости и рентгенографией
грудной клетки в двух проекциях у пациентов в
ситуациях, когда выявление метастазов не имеет
клинического значения (например, пациенты с
отдаленными
метастазами,
получающими
паллиативную химиотерапию).
54.
Совмещенная ПЭТ/КТВыполнение ПЭТ-КТ с внутривенным контрастированием является
альтернативой КТ органов грудной клетки, брюшной полости и УЗИ
шейно- надключичных лимфоузлов.
55.
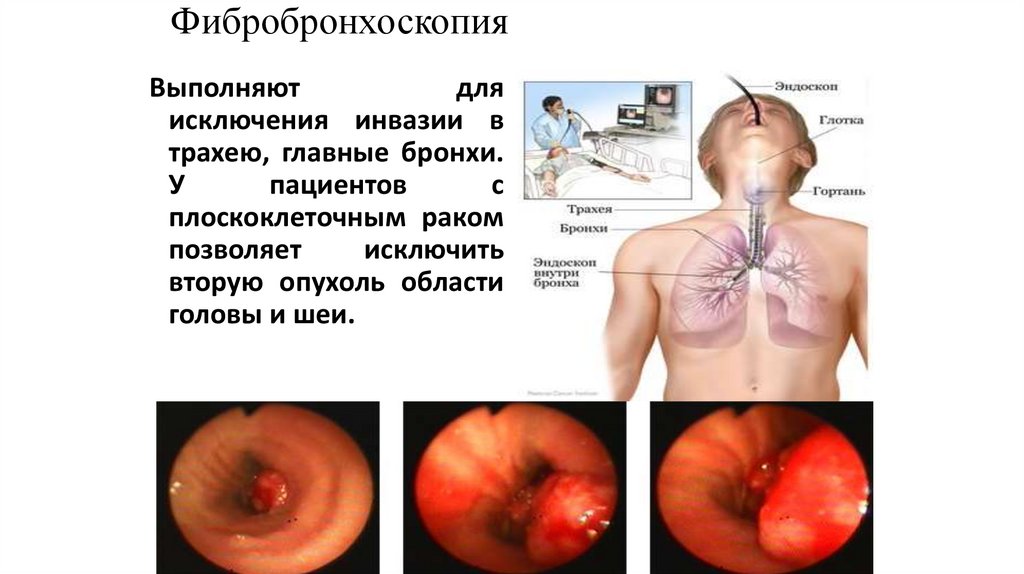
ФибробронхоскопияВыполняют
для
исключения инвазии в
трахею, главные бронхи.
У
пациентов
с
плоскоклеточным раком
позволяет
исключить
вторую опухоль области
головы и шеи.
56.
Патолого-анатомическое исследованиебиопсийного (операционного) материала
при исследовании биопсийного (операционного) материала у
неоперабельных пациентов с аденокарциномой – кандидатов для
противоопухолевой лекарственной терапии - рекомендуется
исследование белка к рецепторам HER2/neu с применением
иммуногистохимических методов, статуса микросателлитной
нестабильности (MSI) методом ПЦР или белков репарации
ошибочно
спаренных
нуклеотидов
с
применением
иммуногистохимических методов. У пациентов с неоперабельным
плоскоклеточным раком - кандидатов для иммунотерапии рекомендуется исследование белка к рецепторам PD-L1 в опухоли
с применением иммуногистохимических методов (оценка CPS).
57.
ЛечениеОсновным
методом
лечения
является
хирургический, однако неудовлетворительные
отдаленные
результаты
заставляют
комбинировать операцию с химиотерапией или
предоперационной химиолучевой терапией
58.
Лечение I – IIА (Т1-3N0M0)Оперативный:
радикальная
трансторакальная
субтотальная резекция пищевода с одномоментной
внутриплевральной пластикой стеблем желудка
или сегментом толстой кишки с билатеральной
двухзональной
медиастинальной
лимфодиссекцией
из
комбинированного
лапаротомного и правостороннего торакотомного
доступов (типа Льюиса).
59.
Схема операции Льюиса60.
Лечение I – IIА (Т1-3N0M0)• Для уменьшения числа хирургических осложнений
можно выполнять минимально инвазивные (тораколапароскопические) или гибридные (торакотомия +
лапароскопия или торакоскопия + лапаротомия)
эзофагэктомии или робот – ассистированные резекции
пищевода.
• При дисплазиях, Тis-1 – возможно выполнить
эндоскопическую резекцию в пределах слизистой
оболочки или подслизистого слоя.
При
невозможности
выполнения
радикального
эндоскопического лечения возможными вариантами
лечения при Tis и T1a являются эзофагэктомия,
химиолучевая терапия, брахитерапия, а при тяжелой
дисплазии и Tis – фотодинамическая терапия.
61.
Факторы негативного прогноза• дифференцировка ≥G3;
• наличие опухолевых клеток в краях резекции;
• лимфатическая, сосудистая или периневральная инвазия;
• уровень инвазии (вовлечение подслизистого слоя стенки
пищевода),> pT1sm1.
При определении тактики лечения надо учитывать факторы
прогноза. Предпочтение следует отдавать методике
эндоскопической диссекции подслизистого слоя.
62.
Лечение IIВ – III (Т1-2N1M0, Т3N1М0)• Хирургическое (5-летняя выживаемость 20%)
• Предоперационная химиотерапия+хирургическое
• Предоперационная химиолучевая терапия+хирургия
63.
Предоперационная (неоадъювантная) химиотерапия• Роль противоречива
• При аденокарциноме нижнегрудного отдела
пищевода при пищеводно-желудочном переходе
оправдано проведение периоперационной
химиотерапии 2-3 курса до и 3-4 после операции
• При выявлении HER2 neo –Транстузумаб
(Герцептин)
64.
Адъювантная ПХТ• Показана при аденокарциноме при условии
проведения неоадъювантной ПХТ
• При плоскоклеточном раке проведение не показано
• Проведение адъювантной ПХТ при
аденокарциноме в самостоятельном плане не
показано
65.
Лучевая терапияПроведение одной лучевой терапии без ПХТ до или
после хирургического лечения не показано, так как
малоэффективно.
Лучевое лечение дистанционное желательно
проводить на линейных ускорителях РОД – 1,8-2 Гр,
СОД – до 44-45 Гр.
Конформная 3D CRT дистанционная лучевая терапия
на линейных ускорителях энергией 6-18 Мев. РОД 1,8-2 Гр, СОД – до 50-55 Гр.
66.
Предоперационная химиолучевая терапия• Роль противоречива
• Перед терапией возможно проведение ПХТ 1-2 курса,
для уменьшения дисфагии, при выраженной дисфагии
наложение
пункционной
гастростомы,
эндоскопическая электрореканализация, аргонноплазменная реканализация.
• Оптимальный
режим
химиолучевой
терапии:
еженедельное введение Паклитаксела и Карбоплатина
на фоне 5 недель ЛТ (44-45 ГР). (выживаемость 47%)
67.
Послеоперационная ЛТ+ПХТ• Послеоперационная
химиолучевая
терапия
проводится пациентам в удовлетворительном
состоянии при наличии микро-макроскопической
резидуальной опухоли (после R1 или R2резекции).
Режимы
и
дозы
как
у
предоперационной.
68.
Схемы ПХТ для самостоятельного плана и совместно с ЛТСхема
Разовая доза
Дни введения
Интервал
Цисплатин
5-фторурацил
75 мг/м²
750 мг/м² в
сутки
1 день
1-4 дни (96-часовая
инфузия)
3-4 недели
Цисплатин
Капецитабин
75 мг/м²
1600 мг/м² в
сутки
1 день
1-5 дни каждой недели
3-4 недели
Паклитаксел
Карбоплатин
50 мг/м²
AUC 2
1 день
1 день
еженедельно
Доцетаксел
Цисплатин
25 мг/м²
25 мг/м²
1 день
1 день
еженедельно
69.
Периоперационная ПХТ при аденокарциноменижнегрудного отдела пищевода
Схема
Разовая доза
Дни введения
Интервал
Цисплатин
5-фторурацил
75 мг/м²
750 мг/м² в сутки
1 день
1-5 дни (120часовая инфузия)
3 недели
Эпирубицин
Цисплатин
Капецитабин
50 мг/м²
60 мг/м²
1300 мг/м² в сутки
1 день
1 день
1-21 дни
3 недели
Цисплатин
Капецитабин
75 мг/м²
2000 мг/м² в сутки
1 день
1-14 дни
3 недели
Доцетаксел
Цисплатин
Капецитабин
60-75 мг/м²
60-75 мг/м²
1650 мг/м² в сутки
1 день
1 день
1-14 дни
3 недели
70.
Режимы паллиативной ПХТСхема
Разовая доза
Дни введения
Интервал
Цисплатин
5-фторурацил
75 мг/м²
750 мг/м² в сутки
1 день
1-5 дни (120часовая инфузия)
3 недели
Паклитаксел
Карбоплатин
175мг/м²
AUC 5
1 день
1 день
3 недели
Цисплатин
Капецитабин
75 мг/м²
2000 мг/м² в сутки
1 день
1-14 дни
3 недели
Оксалиплатин
Капецитабин
130 мг/м²
2000 мг/м² в сутки
1 день
1-14 дни
3 недели
Доцетаксел
Цисплатин
Капецитабин
60-75 мг/м²
60-75 мг/м²
1650 мг/м² в сутки
1 день
1 день
1-14 дни
3 недели
Паклитаксел
Цисплатин
Лейковорин
5-фторурацил
150 мг/м²
60-75 мг/м²
50 мг/м²
425 мг/м² в сутки
1 день
1 день
1-3 дни (струйно)
1-3 дни (струйно)
3 недели
71.
Принципы леченияХирургическое лечение проводят при
поражениях нижней трети или дистальной
части средней трети пищевода.
Преимущество оперативного
вмешательства - восстановление
просвета органа.
Операционные доступы: правостороннаяя
торакотомия; лапаротомия,
диафрагмотомия, шейная
медиастинотомия слева.
Операция представляет собою резекцию или
полное удаление пищевода с
реконструктивной операцией.
72.
Для восстановления непрерывности ЖКТ ипластики пищевода используется либо желудок, либо
ободочная кишка.
Различают одно- и многоэтапные операции.
Чаще у сохранных больных, среднего возраста
производят
одноэтапные операции - резекция
пищевода с опухолью и анастомоз.
Одномоментные операции лучше выполнять при
локализации опухоли в дистальных отделах
пищевода.
73.
74.
Операция Доброыслова - Торека - первый этапхирургического лечения, заключается в резекции
пищевода с опухолью. Проксимальный конец
выводят на шею (эзофагостома) и накладывают
гастростому.
Второй этап хирургического лечения восстановление проходимости пищевода с
помощью создания искусственного пищевода по
Ру-Герцену: мобилизуют тощую кишку в 30-40
см от трейцевой связки, пересекают ее. Верхний
конец ее сшивают с пищеводом, нижний - с
кишкой. Кишку проводят под кожей на передней
грудной стенке. Полную проходимость пищевода
производят через 3-4 недели, когда нижний
конец кишки подшивают к желудку.
75.
Паллиативные операции выполняютсяпри
непроходимости
пищевода
и
нетолерантности
пациента
к
радикальному хирургическому лечению.
•Накладывают
гастростомы,
эзофагостомы;
•Реканализируют просвет пищевода;
производят стентирование.
•Разрушают опухоль в просвете пищевода
при помощи лазера, диатермокоагуляции,
криодеструкции.
•Фотодинамическая терапия
76.
Стентирование пищевода77.
Лечение нерезектабельного местнораспространенного рака пищевода Т4 (III стадия)• Самостоятельная химиолучевая терапия
• Комбинированные операции при пищеводных фистулах.
• При IV стадии рака пищевода (за исключением метастазов в
надключичные
лимфоузлы)
рекомендуется
проведение
паллиативной
химиоиммунотерапии,
химиотерапии
или
симптоматической терапии для улучшения качества жизни путем
устранения симптомов, обусловленных ростом опухоли, и
увеличения продолжительности жизни
78.
Стандартной химиотерапии второй линии не существует.Ее проведение возможно лишь у отдельных пациентов в
общем удовлетворительном состоянии, отвечавших на
ранее проводимую химиотерапию.
По данным рандомизированных исследований у
пациентов с плоскоклеточным раком пищевода с
экспрессией PD–L1 (CPS ≥ 10 для пембролизумаба или
TPS ≥1% для ниволумаба) применение пембролизумаба и
ниволумаба достоверно улучшило продолжительность
жизни по сравнению с терапией по выбору исследователя.
Другими вариантами второй линии является монотерапия
таксанами.
79.
Нутритивный статус пациентаПо шкале NRS-2002 НП назначается при сумме баллов ≥3.
Обширное вмешательство на органах брюшной полости – 2 балла.
Еще 1 балл при возрасте более 70 лет, или потере массы тела на 5 % за 3 мес (3,5 кг при
исход- ной массе тела 70 кг),
Удовлетворении нормальных пищевых потребностей на 70 % и менее.
Нутритивная поддержка назначается из расчета поступления белка 1 г/кг/сут и энергии
20-30 ккал/кг/сут.
Возможно применение специальных продуктов лечебного питания: питательных смесей
с высоким содержанием белка и энергии для энтерального питания – по 2-3 порции в
сутки путем сиппинга.
Необходимо выделять пациентов с выраженной нутритивной недостаточностью для
более раннего начала парентерального питания.
К данной группе относятся пациенты с индексом массы тела ИМТ <18,5;
потерей массы тела более 5 % за месяц или более 15 % за 3 месяца;
потреблением менее 25 % от должной нутритивной потребности,
пациенты с дисфагией ≥III степени.
80.
ПрогнозПри оперативном лечении 5-летняя выживаемость
для всех групп больных - 5-15%. У пациентов,
оперированных на ранних стадиях заболевания
(без видимого поражения лимфатических узлов), 5летняя выживаемость повышается до 30%, при
присоединении ПХТ+ЛТ до 47 %
81.
Диспансеризация• Первые 2 года –каждые 3-6 мес
• 3-5 лет – каждые 6-12 мес.
• С 6 года – ежегодно.
• При выполнении эндоскопической резекции – ЭГДС каждые 3 мес в 1 год, 2-3
годы – 1 раз в 6 мес, далее ежегодно.
• Анализы крови и инструментальные обследования назначаются только по
клиническим показаниям.
Объем обследования:
• анамнез и физикальное обследование;
• ЭГДС через 3 месяца после резекции первичной опухоли, в дальнейшем 2
раза в год в течение 3 лет, далее 1 раз в год до 5 лет;
• УЗИ органов брюшной полости и малого таза каждые 3-6 месяцев в
зависимости от риска прогрессирования;
• рентгенография органов грудной клетки каждые 6 месяцев;
• КТ органов грудной и брюшной полости с в/в контрастированием
однократно через 6-12 месяцев после операции (в зависимости от риска
прогрессирования).




































































 medicine
medicine