Similar presentations:
Карбоновые кислоты и их функциональные производные
1. Карбоновые кислоты и их функциональные производные
ЛекцияАвтор: доц. Оловянникова Р.Я.
2. Актуальность
• Карбоновые кислоты и ихфункциональные производные (сложные
эфиры и тиоэфиры, амиды, гидразиды
галогенангидриды и ангидриды) широко
распространены в природе.
• Работа функциональных групп этих
классов лежит в основе различных
процессов жизнедеятельности.
2
3. Актуальность
• Их взаимопревращаемость используетсяхимиками-органиками для получения
новых соединений.
• Функциональные группы карбоновых
кислот, сложных эфиров и тиоэфиров,
амидов являются составной частью
биомолекул и лекарственных веществ.
3
4. Актуальность
• Поэтому знание электронного строенияфункциональных групп вышеуказанных
классов органических соединений и на
этой основе прогнозирование
реакционной способности чрезвычайно
важно для понимания процессов,
протекающих в организме и
возможностей проведения синтезов.
4
5. Цель лекции
• На основе электронного строения Офункциональных групп типа
С
Х
где Х = -ОН, -ОR, -SR, -NH2,
-Hal, -OCOR и т.д.
рассмотреть основные закономерности
химического поведения карбоновых
кислот и их функциональных
производных.
5
6. План
• Реакционные центры карбоновых кислоти их функциональных производных …...10 мин
• Сравнительная кислотность
карбоновых кислот………………………20 мин
• Реакции нуклеофильного замещения SN у
тригонального атома углерода. Механизм в
общем виде и схема процесса………… 25 мин
• Реакции этерификаии и гидролиза. Условия
протекания………………………………35 мин
6
7. Общий вид карбоновых кислот и их функциональных производных
ОХ= -ОН
С
Х
О
-О С
О R
-О Р
R
карбоновые кислоты
- ОR
сложные эфиры
- SR
сложные тиоэфиры
- NH2
амиды
- NH-NH2
гидразиды
-Ангидриды
Hal
галогенангидриды
карбоновых
кислот
Смешанные карбофосфоангидриды
7
8. Реакционные центры
2 ..δ+
1С
О
2 - оснóвный, нуклеофильный
..
Х
3 - оснóвный, нуклеофильный
но более слабый, чем 2
3
δ+
1➊-электрофильный
- электрофильный
..
О
С ..
Х
-I, +M
Любая группа Х (кроме Cl и оксикарбонильной)
является электронодонором для оксогруппы и
ослабляет её электрофильный центр.
Поэтому атака нуклеофилом идет хуже, чем у
альдегидов и кетонов. Реакции АN не
характерны. См. механизм (слайд 11)
8
9. Кислотность карбоновых кислот
• В карбоновых кислотах существует ещёодин важный центр – ОН-кислотный.
δ+
О
R С
δ+
О←Н
С работой этого центра связаны
реакции образования солей при
взаимодействии кислот со щелочами
или основными оксидами
О
R С
OH
О
R С
R-COOH / RCOO–
O–
9
10. Кислотность карбоновых кислот
• Электроноакцепторные заместителиусиливают кислотность карбоновых
кислот, т.к. стабилизируют сопряженный
анион.
• Электронодоноры дестабилизируют
сопряженный анион и поэтому
ослабляют кислотность карбоновых
кислот.
10
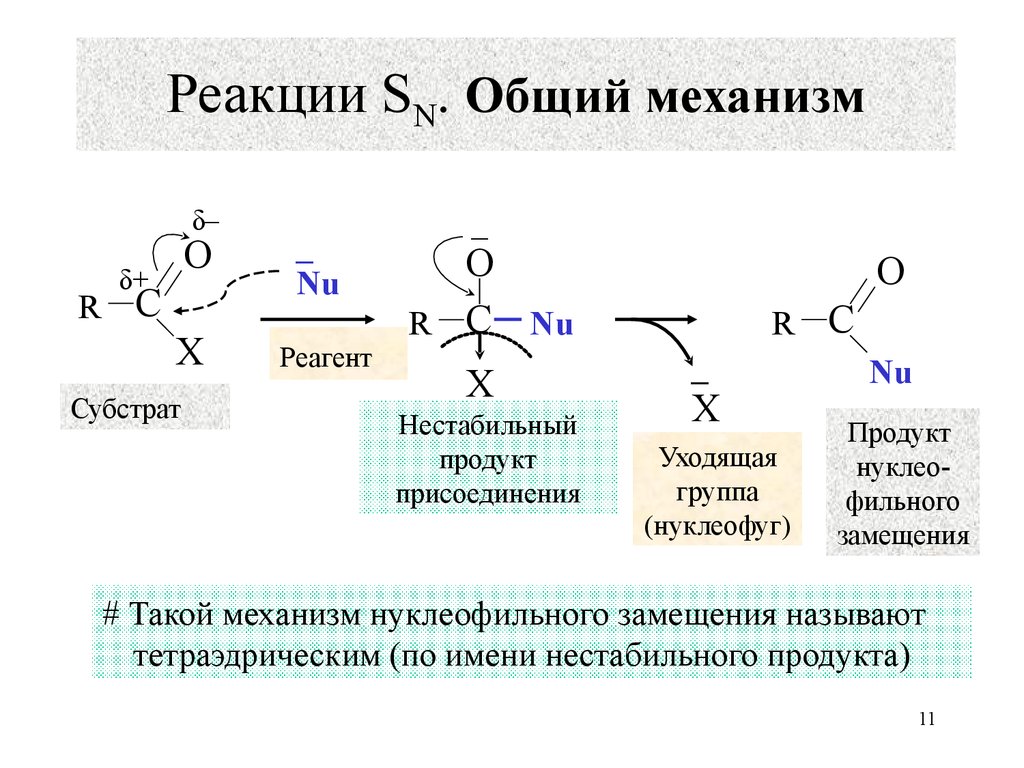
11. Реакции SN. Общий механизм
δ–О
δ+
R С
Х
Субстрат
–
Nu
Реагент
О
R С Nu
Х
Нестабильный
продукт
присоединения
О
R С
–
Х
Уходящая
группа
(нуклеофуг)
Nu
Продукт
нуклеофильного
замещения
# Такой механизм нуклеофильного замещения называют
тетраэдрическим (по имени нестабильного продукта)
11
12. Условия протекания реакции
• Наличие хорошей уходящей группы• Наличие сильного нуклеофильного
реагента или
• сильного электрофильного центра
# Если и нуклеофильный реагент, и
электрофильный центр являются
слабыми, то необходим катализатор.
12
13. Величина эффективного положительного заряда карбонильной группы
δ+• Зависит от соотношения –I и +Мэффектов группы Х:
О
С ..
Х
-I, +M
с увеличением –I-эффекта и
уменьшением +М-эффекта группы Х
эффективный положительный заряд
на атоме углерода увеличивается.
13
14.
Увеличение δ+ на карбонильном атоме углеродаδ+
О
R С
<
–
О
+I, +M
δ+
R С
..
< R С
<
-I, +M
Ангидриды
R С
NH2
-I≪ +M
-I < +M
Амиды
О
R′
<
<
Сложные эфиры
О
..
O-С
δ+
О
..
OR
Ацилат-ионы
+
δ+
О
δ+
δ+
R С
О
..
OH
-I < +M
Карбоновые
кислоты
О
С ..
Cl
-I > +M
Хлорангидриды
14
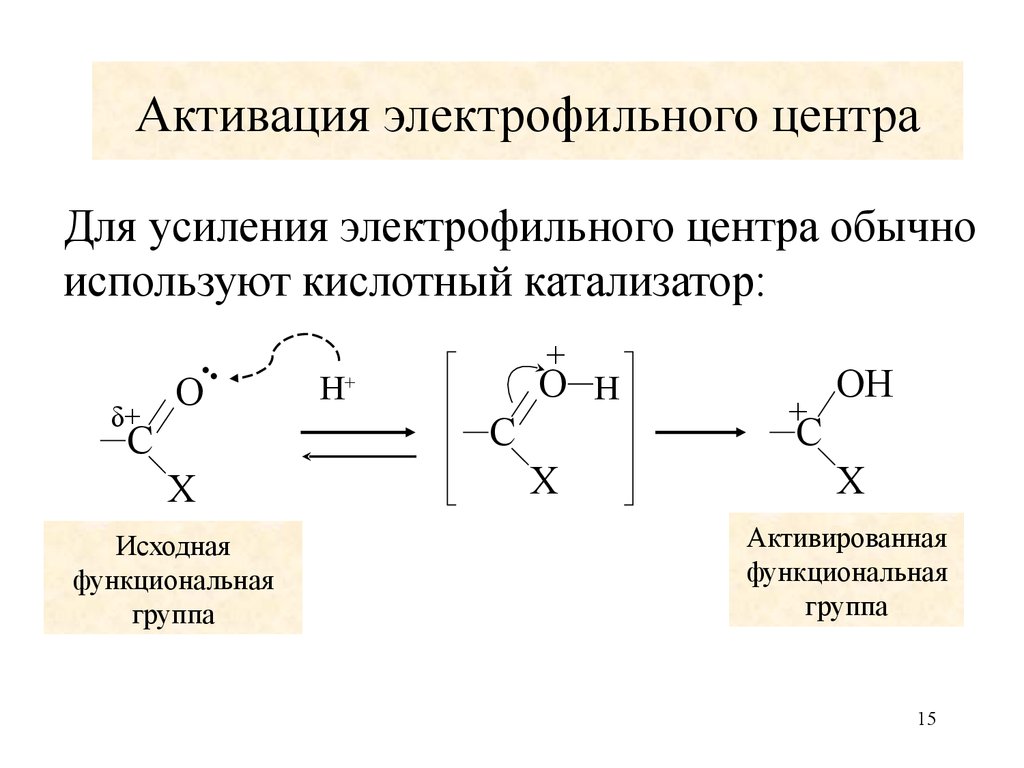
15. Активация электрофильного центра
Для усиления электрофильного центра обычноиспользуют кислотный катализатор:
δ+
..
О
С
Х
Исходная
функциональная
группа
+
О Н
Н+
С
+
ОН
С
Х
Х
Активированная
функциональная
группа
15
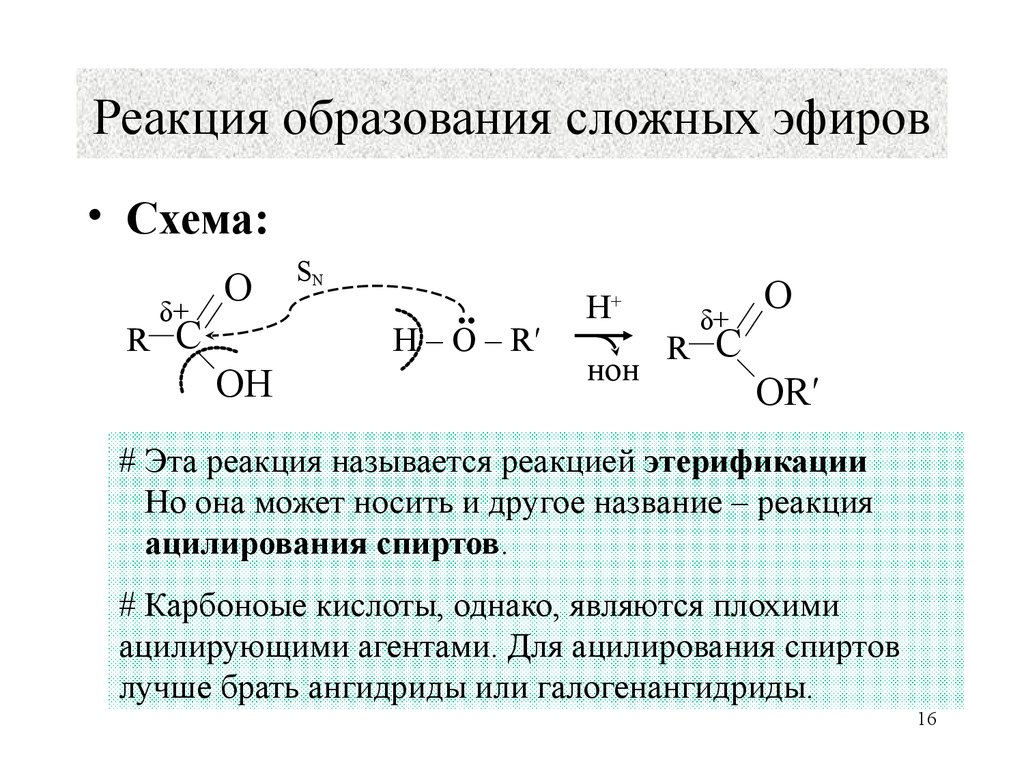
16. Реакция образования сложных эфиров
• Схема:δ+
О
R С
SN
..
H – O – R′
OH
H+
нон
δ+
О
R С
OR′
# Эта реакция называется реакцией этерификации
Но она может носить и другое название – реакция
ацилирования спиртов.
# Карбоноые кислоты, однако, являются плохими
ацилирующими агентами. Для ацилирования спиртов
лучше брать ангидриды или галогенангидриды.
16
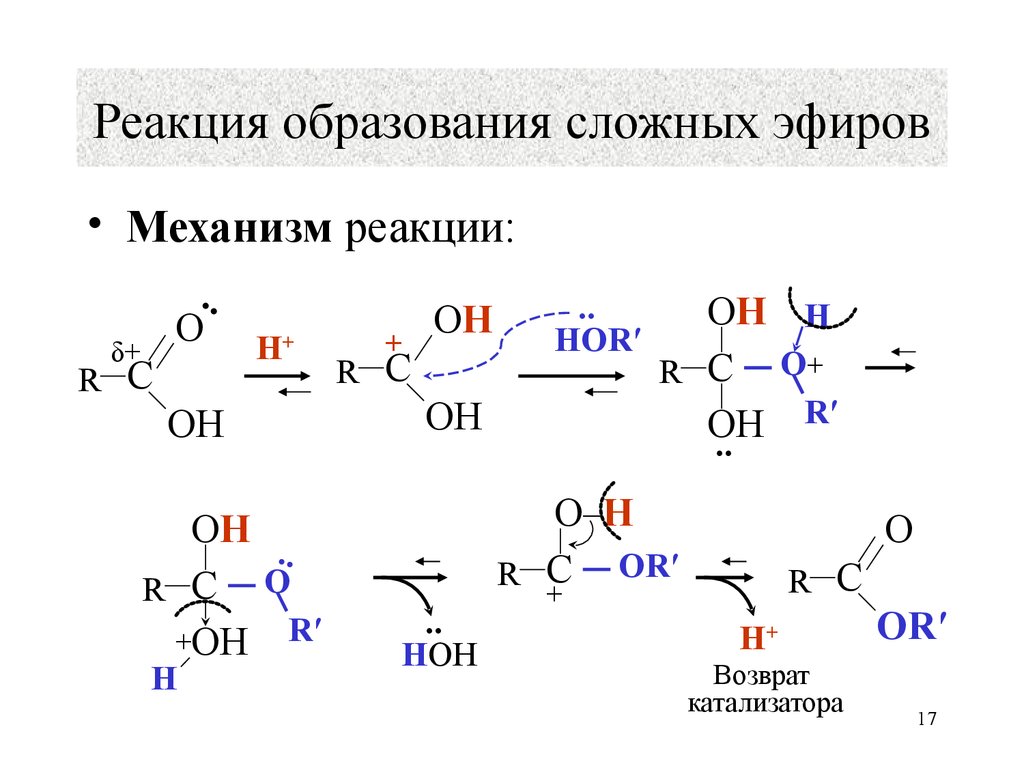
17. Реакция образования сложных эфиров
• Механизм реакции:δ+
R С
..
О H+
H
R С
OH
OH
ОH
R С
+OH
+
ОH
..
O
R′
..
HOH
..
HOR′
ОH H
R С O+
R′
OH
..
О–H
R С OR′
+
О
R С
H+
Возврат
катализатора
OR′
17
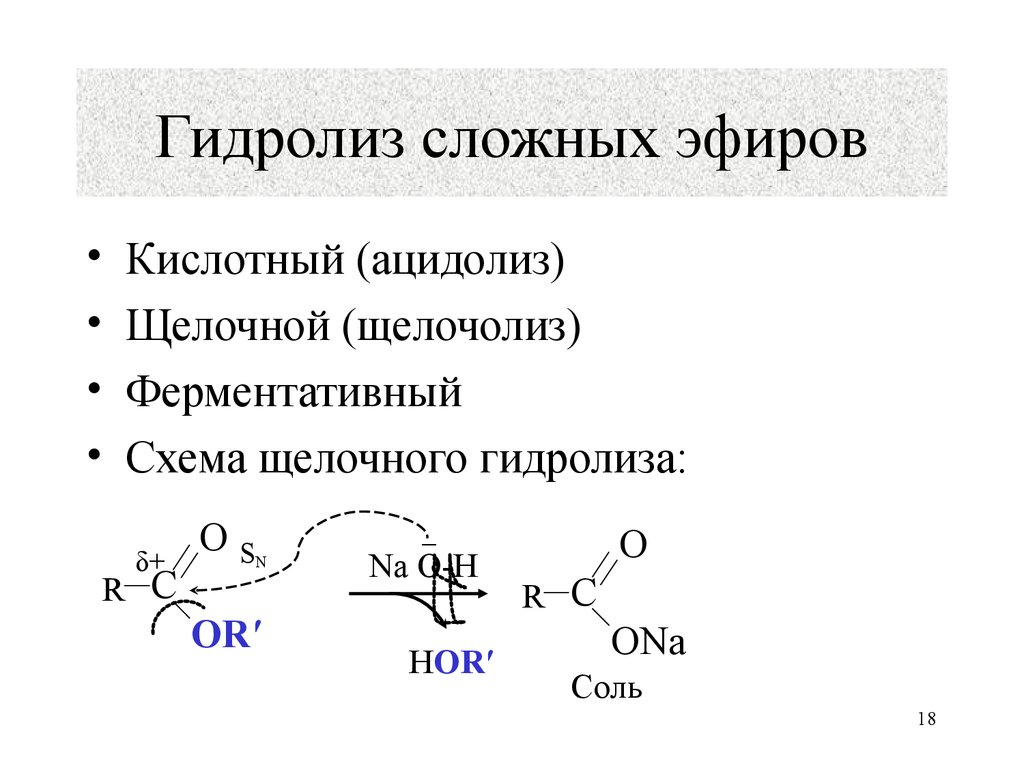
18. Гидролиз сложных эфиров
Кислотный (ацидолиз)
Щелочной (щелочолиз)
Ферментативный
Схема щелочного гидролиза:
δ+
R С
О SN
OR′
О
–
Na O-H
HOR′
R С
ONa
Соль
18
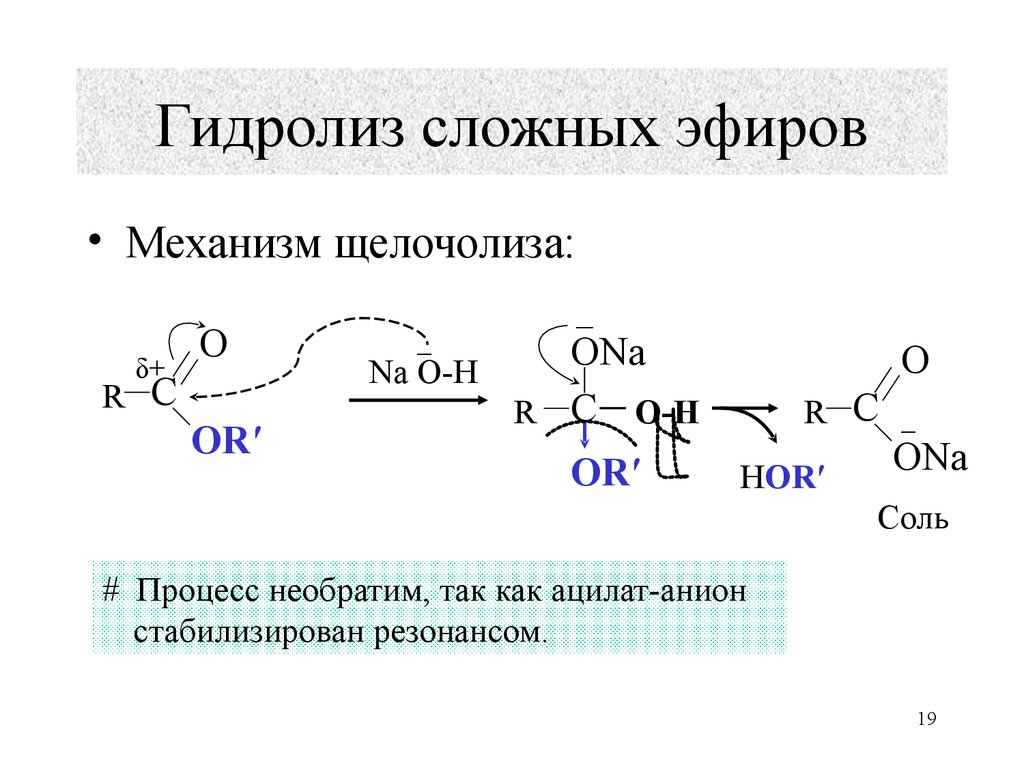
19. Гидролиз сложных эфиров
• Механизм щелочолиза:δ+
О
R С
OR′
–
Na O-H
ОNa
R С О-Н
ОR′
О
R С –
ONa
HOR′
Соль
# Процесс необратим, так как ацилат-анион
стабилизирован резонансом.
19
20. Значение гидролиза
• В организме по принципу кислотногогидролиза расщепляются жиры и
сложные омыляемые липиды, белки,
нуклеиновые кислоты и др. биомолекулы
• Но роль кислотных катализаторов здесь
выполняют ферменты.
20
21. Конец лекции
Благодарю за вниманиеОтветим на контрольный вопрос















 chemistry
chemistry








