Similar presentations:
Комплексонометрическое титрование
1.
АНАЛИТИЧЕСКАЯХИМИЯ
Лекция 6.
Комплексонометрическое
титрование
2. Комплексонометрическое титрование
HOC
O
O
CH2 C
H2C
O
N
C
HO
CH2
CH2
OH
N
CH2
CH2
O
C
OH
Этилендиаминтетрауксусная кислота,
ЭДТУ, H4Y, комплексон II
3.
HOC
O
O
CH2 C
H2C
O
N
C
Na O
CH2
CH2
O Na
N
CH2
CH2
O
C
OH
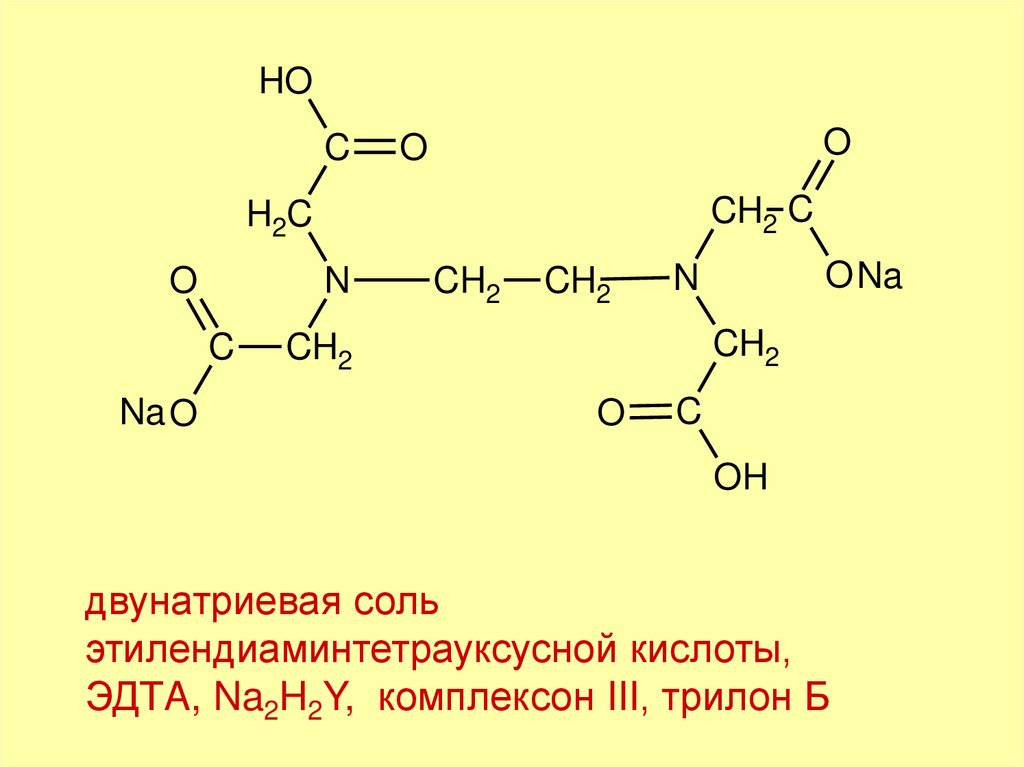
двунатриевая соль
этилендиаминтетрауксусной кислоты,
ЭДТA, Na2H2Y, комплексон III, трилон Б
4.
ЭДТА – гексадентатныйлиганд
Хелатный комплекс,
хелатный эффект
ЭДТА – самый
распространенный титрант
для
комплексонометрического
титрования
С большинством катионов
ЭДТА образует комплексы
состава 1: 1
5.
ЭДТУ – четырехосновная кислота6.
Равновесия реакций комплексообразования7.
Равновесия реакций комплексообразованияУчитывая состояние ЭДТА в средах с различной
кислотностью, уравнения реакций комплексообразования
можно записать так:
Mn+ + H2Y2- → MYn-4 + 2H+
при рН = 4,0 – 5,0
Mn+ + HY3- → MYn-4 + H+
при рН = 7,0 – 9,0
Mn+ + Y4- → MYn-4
при рН = 10,0 – 12,0
Конкурирующие реакции:
• протонирование ЭДТА;
• гидролиз катионов металла или связывание
катионов в другой комплекс (NH3)
8.
Выбор условий титрования9.
10.
11.
Логарифмы констант устойчивости комплексонатовнекоторых металлов lgβ(МY) и коэффициенты побочных
реакций lgα(M,OH), lgα(M,L) ионов металлов с различными
лигандами
12.
Логарифмы коэффициентов побочной реакциипротонирования ЭДТА lgα(Y,H) при различных рН раствора
рН
lgα(Y,H)
рН
lgα(Y,H)
1
18,0
8
2,3
2
13,5
9
1,3
3
10,6
10
0,45
4
8,4
11
0,07
5
5,5
12
0,01
6
4,7
13
0
7
3,3
14
0
13.
Зависимость логарифма условной константы устойчивостикомплексоната цинка от рН
14.
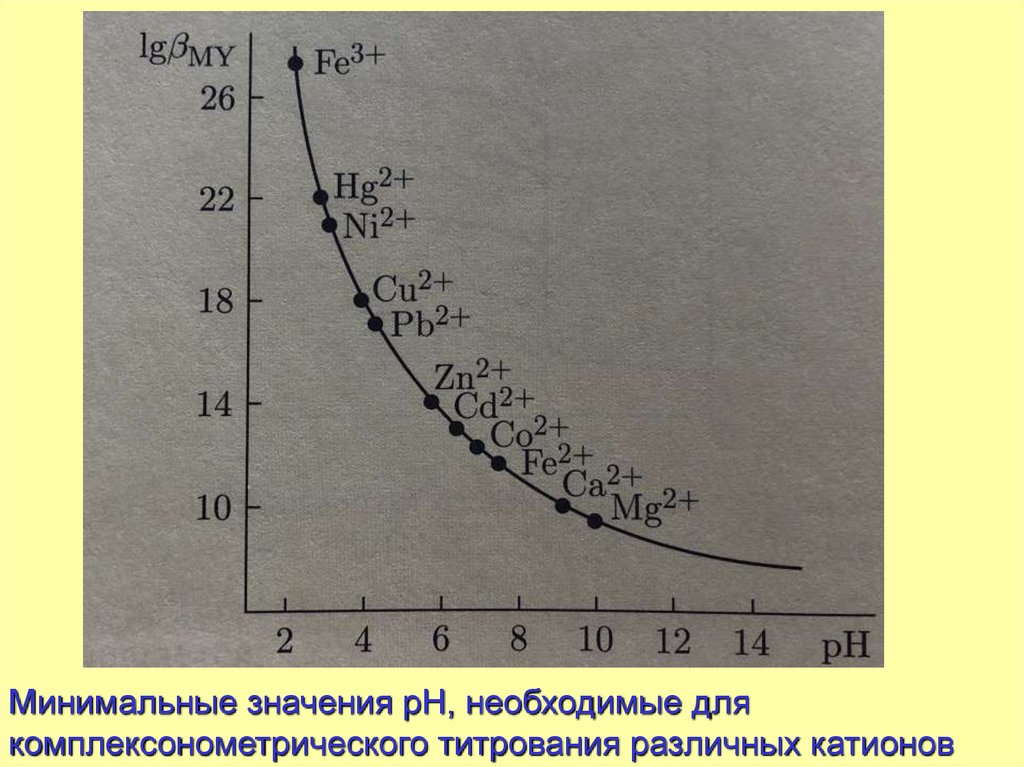
Минимальные значения рН, необходимые длякомплексонометрического титрования различных катионов
15.
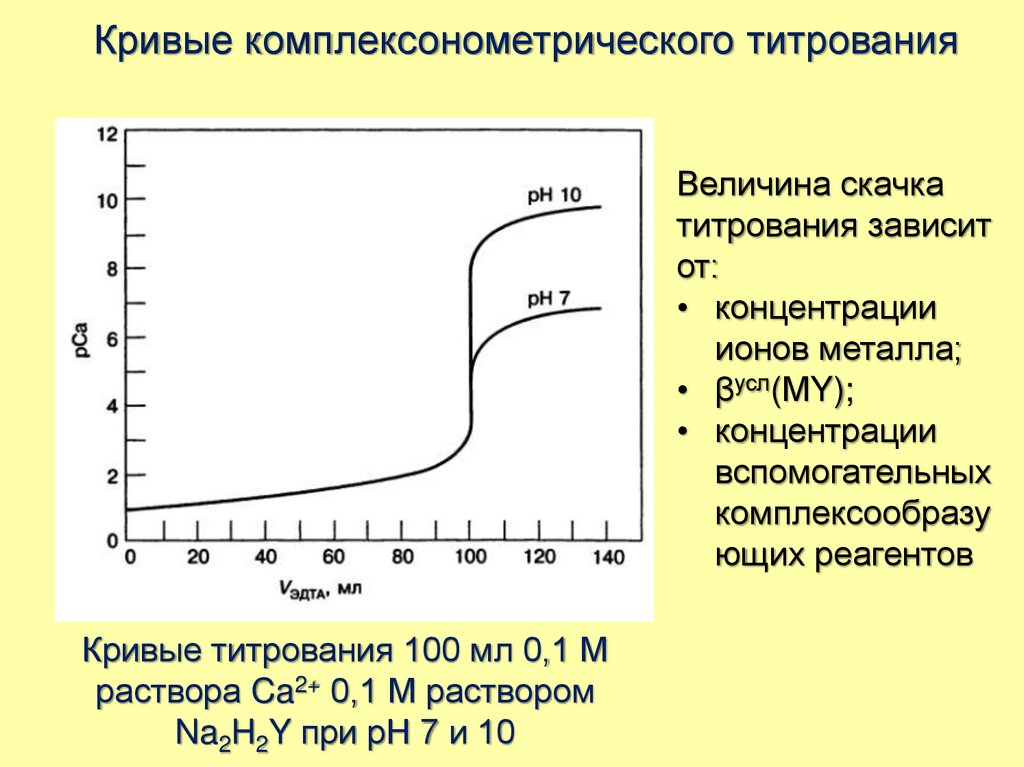
Кривые комплексонометрического титрованияВеличина скачка
титрования зависит
от:
• концентрации
ионов металла;
• βусл(МY);
• концентрации
вспомогательных
комплексообразу
ющих реагентов
Кривые титрования 100 мл 0,1 М
раствора Ca2+ 0,1 М раствором
Na2H2Y при рН 7 и 10
16.
Демонстрационный вариантконтрольной работы 3













 chemistry
chemistry








