Similar presentations:
Комплексиметрическое титрование. (Лекция 12)
1. Комплексиметрическое титрование
2. План
Сущность метода
Требования, предъявляемые к реакциям в
комплексиметрии
Классификация методов комплексиметрии
Комплексонометрия
Комплексоны
Комплексы с ЭДТА
Титранты метода
Кривые титрования
Индикаторы комплексонометрии.
Применение комплексонометрического титрования
Меркуриметрия
3. Требования, предъявляемые к реакциям
СтехиометричностьПолнота протекания реакции (β ≥ 108)
Реакции комплексообразования должны
протекать быстро
КТТ должна фиксироваться отчетливо
4. Классификация
МеркуриметрияФторометрия
Цианометрия
Комплексонометрия
5. Комплексоны
Комплексон I, нитрилотриуксусная кислота (НТК)CH2COOH
N
CH2COOH
CH2COOH
H3Y
3H+ + Y3-
Комплексон II, этилендиаминотетрауксусная кислота дигидрат (ЭДТУК)
CH2
CH2
N
N
CH2COOH
CH2COOH
CH2COOH
CH2COOH
2H2O
òðèëî í À, õåëàòî í
6.
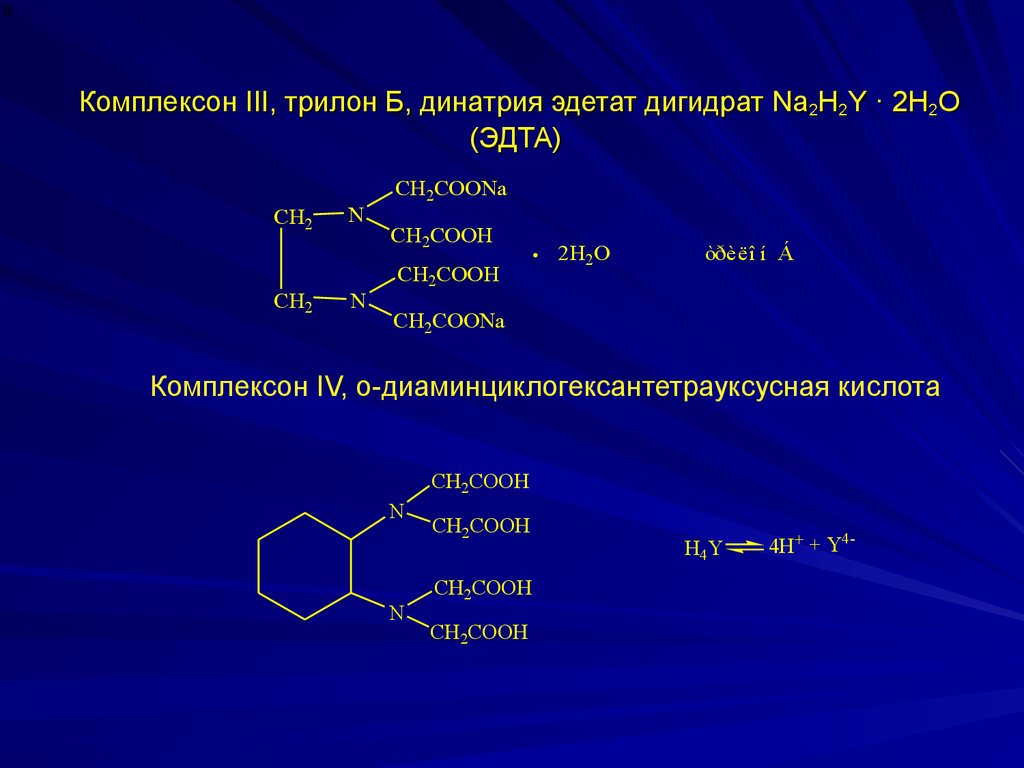
RКомплексон III, трилон Б, динатрия эдетат дигидрат Na2H2Y · 2H2O
(ЭДТА)
CH2
CH2
N
N
CH2COONa
CH2COOH
CH2COOH
2H2O
òðèëî í Á
CH2COONa
Комплексон IV, о-диаминциклогексантетрауксусная кислота
CH2COOH
N
N
CH2COOH
CH2COOH
CH2COOH
H4Y
4H+ + Y4-
7.
ЭДТУК - слабая 4-х основная кислотаH4Y H+ + H3Y-
рКа1 = 2,0
H3Y- H+ + H2Y2-
рКа2 = 2,67
H2Y2- H+ + HY3-
рКа3 = 6,16
HY3- H+ + Y4-
рКа4 = 10,26
При рН<1,6 она протонируется: ионы водорода присоединяются к
молекуле ЭДТУК, образуя ионы Н5Y+, Н6Y2+.
8.
ПрирН
3– 6
доминирующая форма Н2Y2-
6 – 10
-“ -
HY3-
>10
-“ -
Y4-
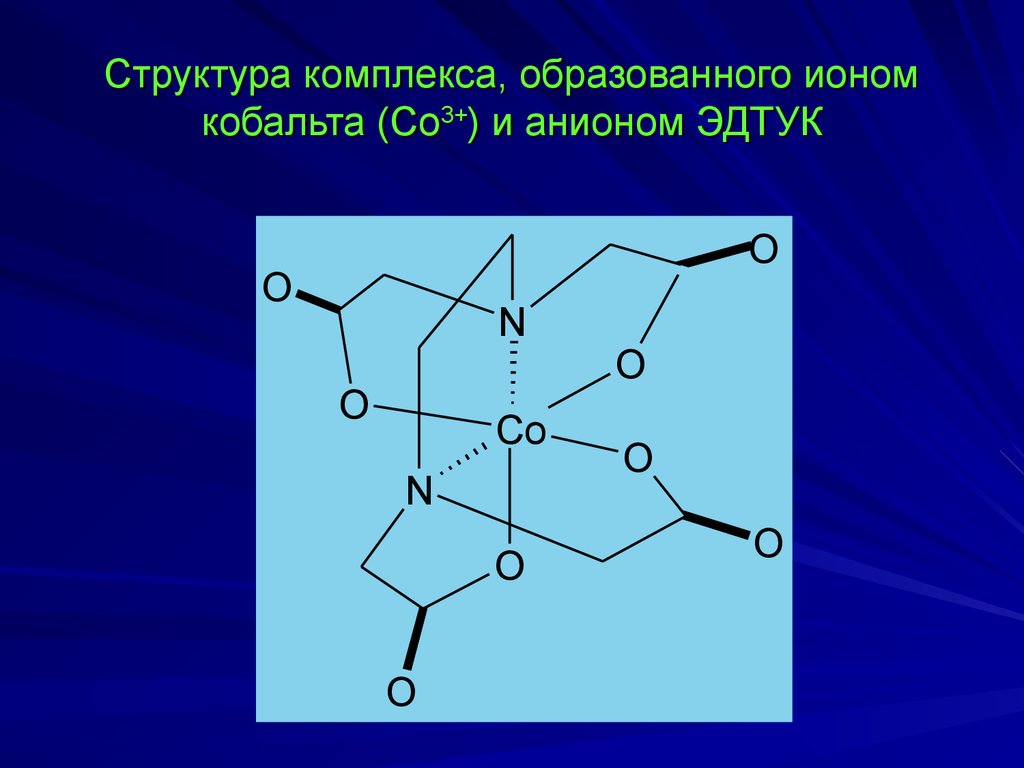
9. Структура комплекса, образованного ионом кобальта (Со3+) и анионом ЭДТУК
OO
N
O
Co
N
O
O
O
O
O
10.
комплексы состава MY(n-4)В умеренно кислых растворах :
Mn+ + H2Y2- [MY](n-4) + 2 H+
В нейтральных и умеренно щелочных растворах:
Mn+ + HY3- [MY](n-4) + H+
11.
Наиболее устойчивыми являются комплексы с ЭДТА:Bi3+ (lg β=27,9), Fe3+ (lg β=25,1), Cr3+ (lg β=23,0),
т.е. lg β >20, их определяют в кислой среде.
Менее устойчивые комплексы с ЭДТА образуют ионы
S2 – элементов: Ba2+ (lg β=7,8), Mg2+ (lg β=8,7), Ca2+ (lg β=10,7),
т.е. lg β < 10. Их можно определять только в щелочной среде.
12.
Первичные стандарты:металлический цинк, алюминий,
магний, ZnSO4∙7H2O, MgSO4∙7H2O.
13.
Кривая комплексиметрического титрования катионовCa2+ и Zn2+ раствором ЭДТА при рН = 14
14.
Принцип действия металлохромных индикаторовM2+ + H2Ind [MInd] + 2 H+
цвет 1
цвет 2
M2+ + H2Y2- [MY]2- + 2 H+
[MInd] + H2Y2- [MY]2- + H2Ind
цвет 2
цвет 1
15.
β MIYnd 2 10β[МInd] < β[MY]
2-
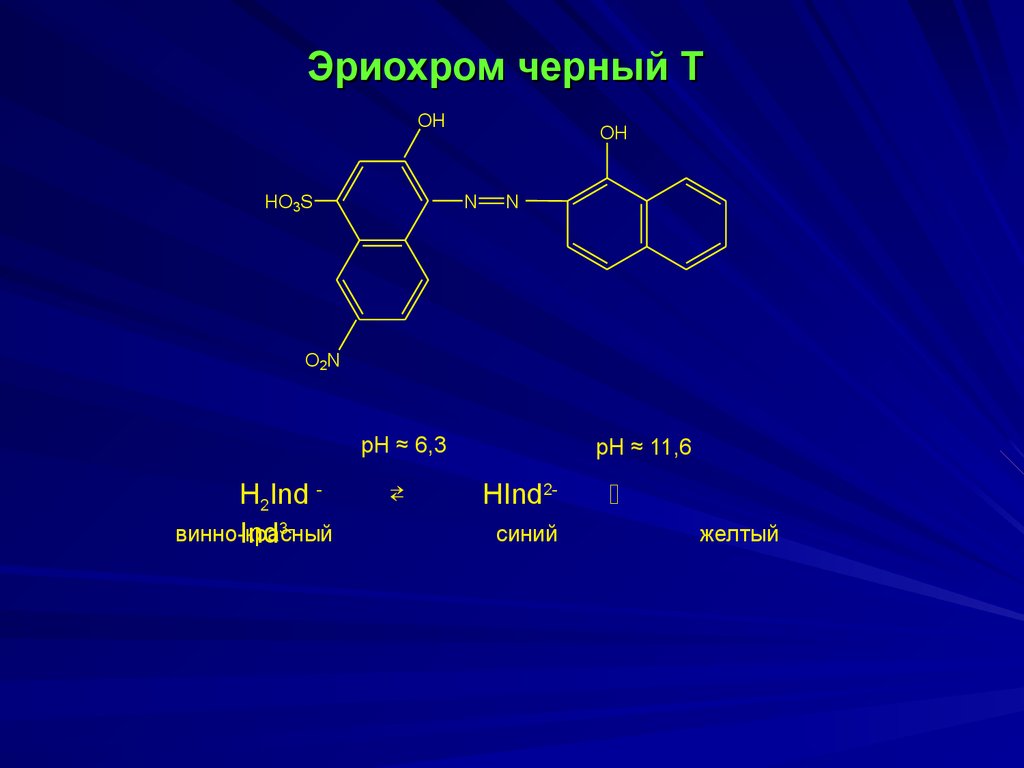
16. Эриохром черный Т
OHHO3S
OH
N
N
O2N
pH ≈ 6,3
H2Ind винно-красный
Ind3-
pH ≈ 11,6
HInd2синий
желтый
17.
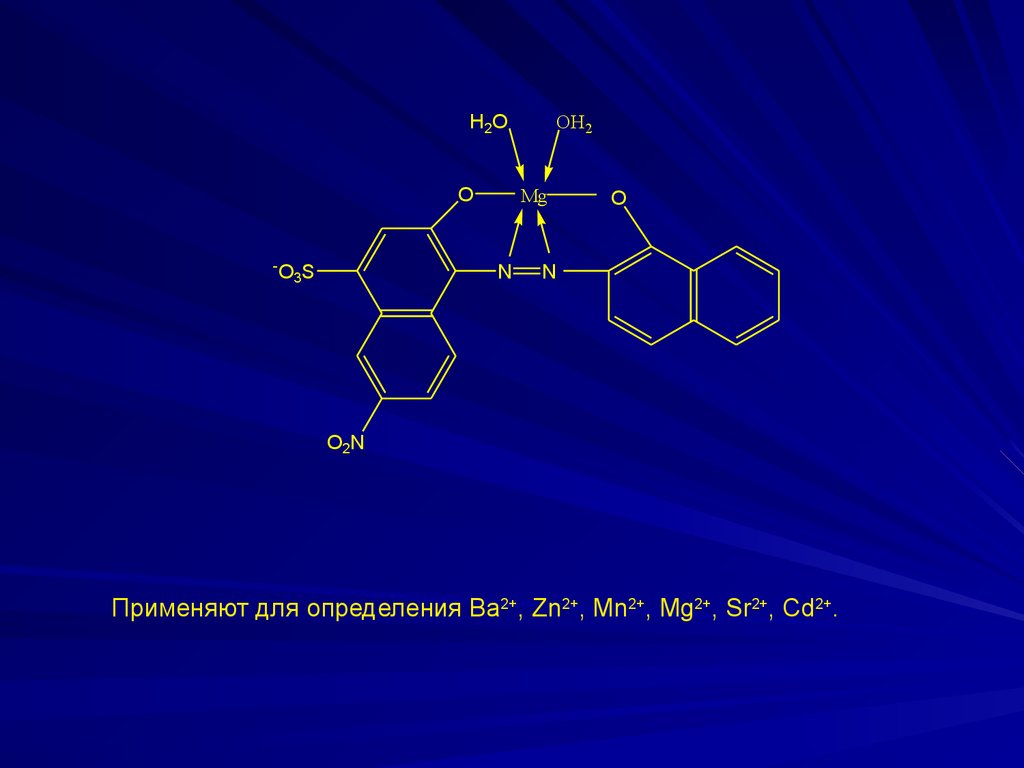
H2 OO
-
O3S
OH2
Mg
N
O
N
O2N
Применяют для определения Ва2+, Zn2+, Mn2+, Mg2+, Sr2+, Cd2+.
18.
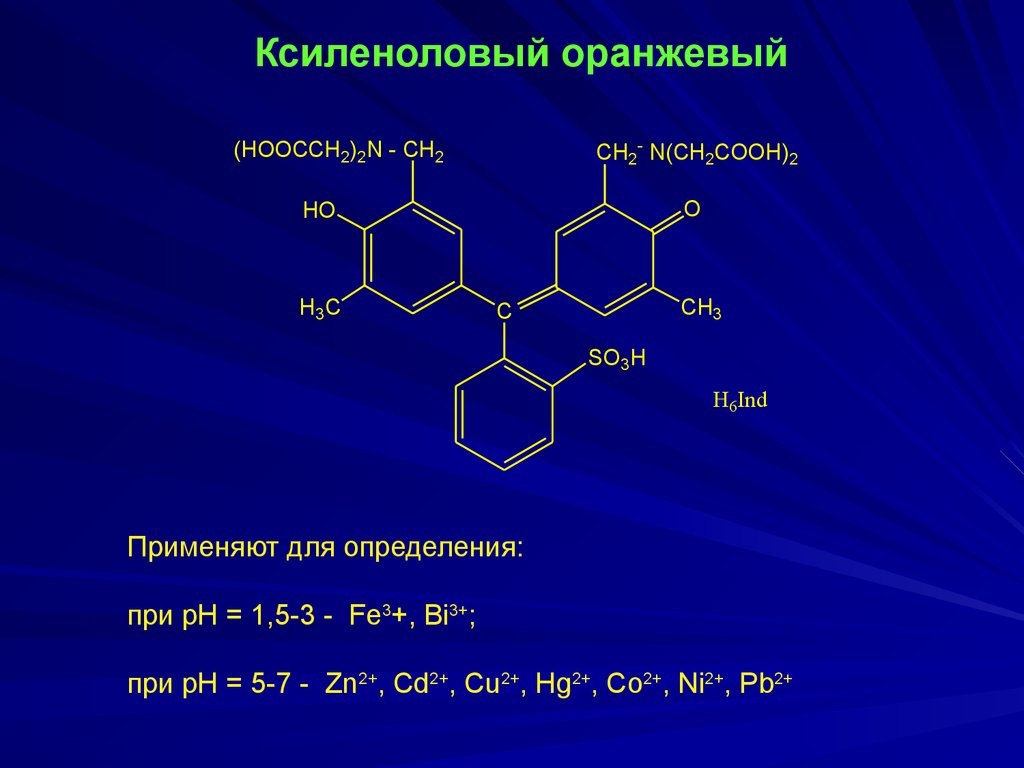
Ксиленоловый оранжевыйCH2- N(CH2COOH)2
(HOOCCH2)2N - CH2
O
HO
H3C
CH3
C
SO3H
H6Ind
Применяют для определения:
при рН = 1,5-3 - Fe3+, Bi3+;
при рН = 5-7 - Zn2+, Cd2+, Cu2+, Hg2+, Co2+, Ni2+, Pb2+
19.
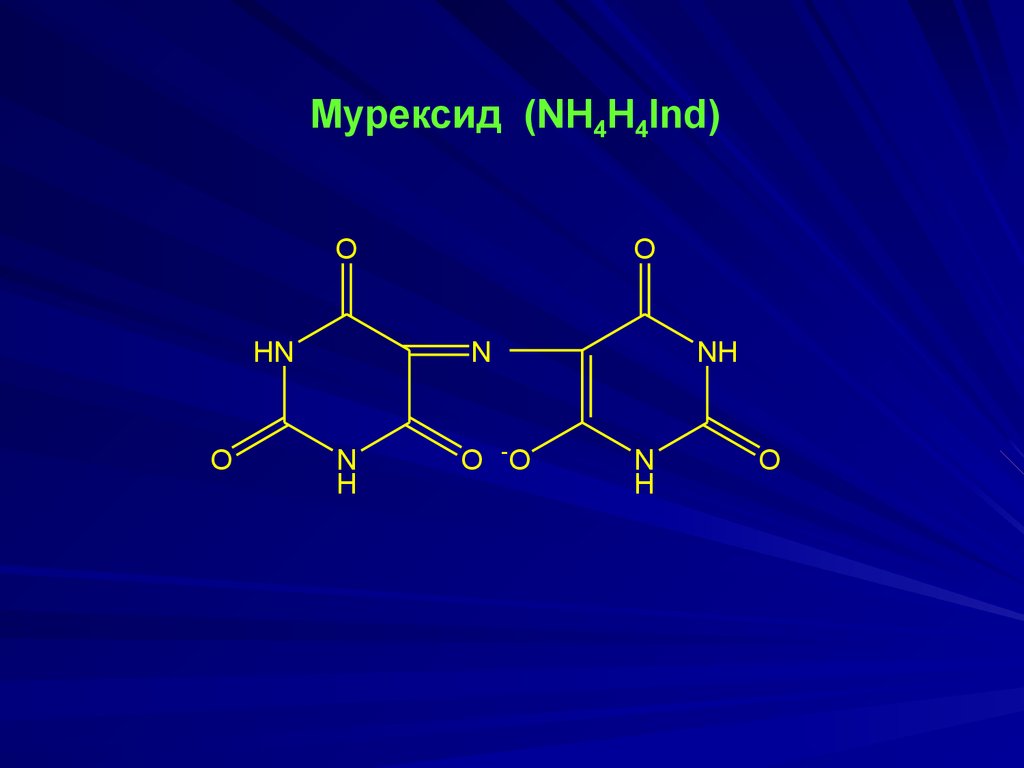
Мурексид (NH4H4Ind)O
HN
O
O
N
N
H
O -O
NH
N
H
O
20.
OO
HN
O
N
NH
N
O
O
N
H
O
Ca
H2O
H2O
H2O
Применяют при комплексонометрическом определении
Cu2+, Co2+, Ni2+, Zn2+ (рН = 8 – 9); Са2+ (рН >12)
21. Меркуриметрия
Для определения анионов Cl -, Br -, I -, CN -, SCN -.а) Hg2+ + 2 Cl - HgCl2
б) Hg2+ + 4 I - [HgI4]2В ТЭ появляется красный осадок
Hg2+ + [HgI4]2- 2 HgI2
в) Hg2+ + 2 SCN - Hg(SCN)2
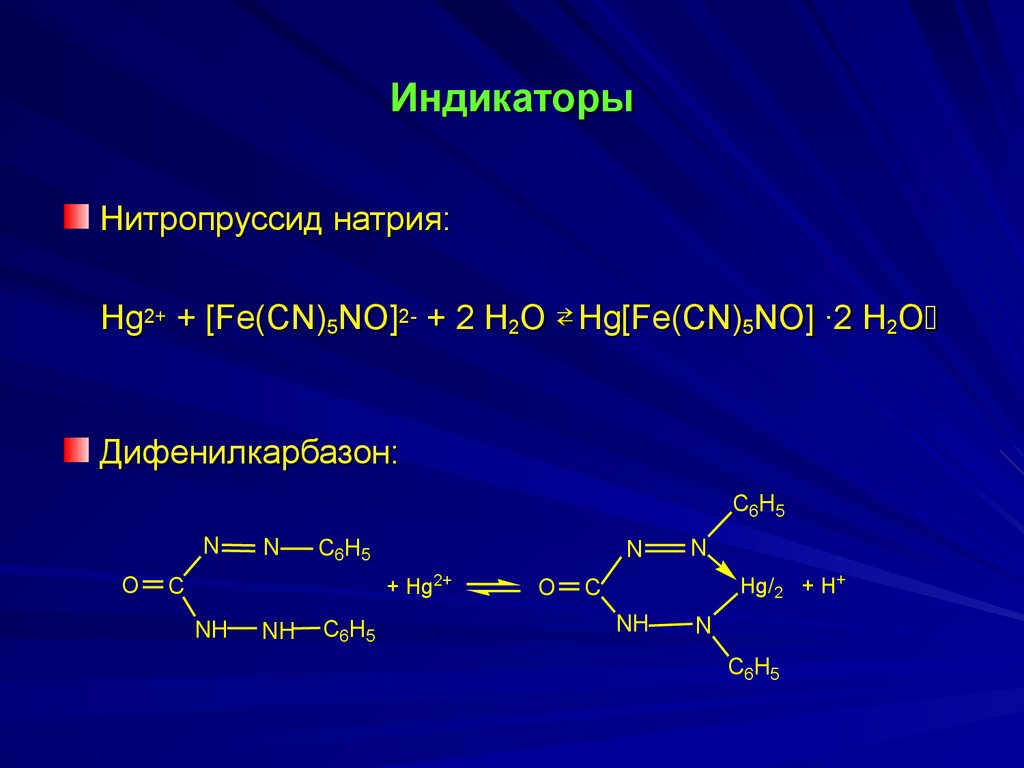
22. Индикаторы
Нитропруссид натрия:Hg2+ + [Fe(CN)5NO]2- + 2 H2O Hg[Fe(CN)5NO] ∙2 H2O
Дифенилкарбазон:
C6H5
N
O
N
C6H5
N
+ Hg2+
C
NH
NH
C6H5
O
N
Hg/2 + H+
C
NH
N
C6H5















 physics
physics chemistry
chemistry








