Similar presentations:
Комплексометрическое титрование
1.
Комплексометрическоетитрование
2.
План1. Сущность, общая характеристика и классификация
методов комплексометрического титрования.
2. Комплексонометрия.
Комплексоны
(полиаминокарбоновые
кислоты,
зтилендиаминтетрауксусная кислота и её динатриевая соль) как
реагенты в комплексометрии, их строение и свойства,
реакции взаимодействия комплексонов с ионами
металлов.
3. Кривые комплексонометрического титрования. Факторы,
влияющие на характер кри-вых титрования и величину
скачка.
4. Способы фиксирования конечной точки титрования в
комплексонометрии.
Ме-таллохромные
индикаторы,
механизм их действия, интервал перехода и правило выбора. Погрешности титрования.
3.
Вопрос 1.Сущность, общая характеристика и классификация
методов комплексометрического титрования.
Комплексометрическое титрование – группа титриметрических
методов анализа, основанных на реакциях образования
растворимых в воде комплексных соединений
Требования к реакциям, применяемым в
комплексометрическом титровании
1. большая константа равновесия
2. стехиометричность
3. протекание с приемлемой скоростью при обычных условиях
4. возможность обнаружения конечной точки титрования
4.
Внимание!!!Реакции
комплексообразование
ионов
металлов
с
монодентантными лигандами в титриметрии используются крайне
редко, т.к. при протекании этих реакций образуется не один, а
несколько комплексов. Если устойчивость этих комплексов
отличается незначительно, то в процессе титрования концентрация
катионов металла будет изменяться плавно, а значит, скачки
титрования будут отсутствовать. Для появления скачка титрования
необходимо, чтобы устойчивость одного из образующихся
комплексов заметно отличалась от устойчивости других.
Из всех реакций комплексообразования ионов металлов с
монодентатными лигандами лишь несколько подходят для
титриметрии
1. Реакции образования галогенидных и некоторых других комплексов
ртути (II)
2. Реакции образования цианидных комплексов некоторых металлов
3. Реакции образования фторидных комплексов некоторых металлов
5.
Меркуриметрическое титрованиеТитриметрический метод анализа, основанный
растворимых комплексных соединений ртути (II)
на
образовании
Основная область применения – определение галогенид-ионов
Основной недостаток метода – токсичность титранта
Меркуриметрическое определение хлорид- и бромид-ионов основано
на следующих реакциях:
Нg2+ + 2СI– = HgСI2
Нg2+ + 2Br– = HgBr2
lg β=13,22
lg β=17,33
В случае иодидов определение может быть основано как на
образовании малорастворимого в воде, но растворимого в
органических растворителях незаряженного комплекса HgI2, так и на
образовании хорошо растворимого в воде комплексного иона [HgI4]2–:
Нg2+ + 2I– = HgI2,
lg β=23,82
Нg2+ + 4I– → [HgI4]2– lg β=29,83
6.
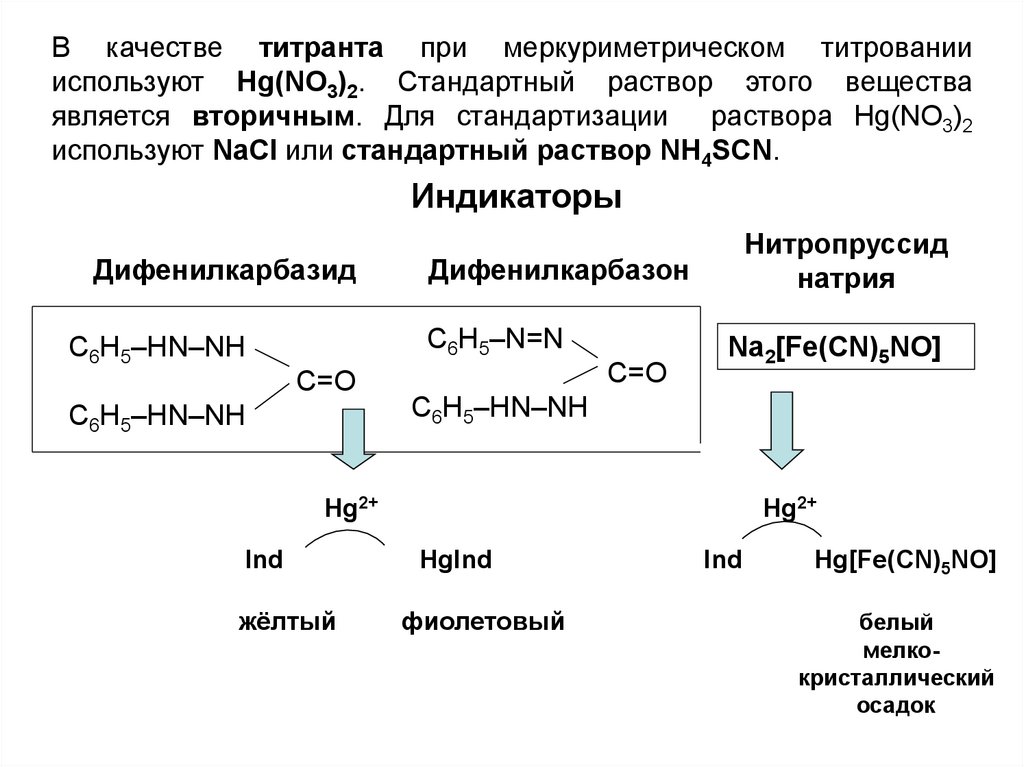
В качестве титранта при меркуриметрическом титрованиииспользуют Hg(NO3)2. Стандартный раствор этого вещества
является вторичным. Для стандартизации раствора Hg(NO3)2
используют NaCl или стандартный раствор NH4SCN.
Индикаторы
Дифенилкарбазид
С6Н5–НN–NН
C=О
С6Н5–HN–NH
Дифенилкарбазон
Нитропруссид
натрия
С6Н5–N=N
Na2[Fe(CN)5NO]
C=О
С6Н5–HN–NH
Hg2+
Ind
жёлтый
Hg2+
HgInd
фиолетовый
Ind
Hg[Fe(CN)5NO]
белый
мелкокристаллический
осадок
7.
Вопрос 2.Комплексонометрия. Комплексоны (полиаминокарбоновые
кислоты, зтилендиаминтетрауксусная кислота и её динатриевая
соль) как реагенты в комплексометрии, их строение и свойства,
реакции взаимодействия комплексонов с ионами металлов
Внимание!!!
В
отличие
от
монодентантных
лигандов
полидентатные
хелатообразующие лиганды, как правило, взаимодействуют с
катионами металлов с образованием единственного комплекса с
соотношением компонентов 1:1. Кроме того, вследствие хелатного
эффекта комплексы катионов металлов с такими лигандами более
устойчивы, чем комплексы с аналогичными монодентатными
лигандами.
Комплексонометрическом титрованием называется
титриметрический метод анализа, основанный на
образовании хелатов при взаимодействии катионов
металлов с комплексонами
8.
Комплексоны – органические соединения, в молекулах которыхсодержится большое число основных донорных центров и кислотных
функциональных
групп,
расположенных
так,
что
при
их
взаимодействии с катионами металлов образуются высокоустойчивые
внутрикомплексные соединения, содержащие не менее двух циклов.
В качестве основных донорных центров в молекулах комплексонов
выступают атомы азота, фосфора или серы; кислотные центры обычно
представлены карбоксильными или фосфоновыми группами.
Максимально возможная дентатность у различных комплексонов
может изменяться от 3 до 8.
В титриметрии наибольшее значение имеют комплексоны,
относящиеся
к
аминополикарбоновым
кислотам:
этилендиаминтетрауксусная кислота и её динатриевая соль.
9.
Свойства этилендиаминтетрауксусной кислоты и еёвзаимодействие с катионами металлов
Этилендиаминтетрауксусная кислота (ЭДТА) представляет собой
белое
кристаллическое
негигроскопичное
вещество,
малорастворимое в воде и этаноле. Растворимость ЭДТА в воде
минимальна при рН 1,6 - 1,8, когда молярная доля незаряженных
частиц ЭДТА достигает максимальных значений, и увеличивается при
уменьшении или увеличении рН, что связано с возрастанием степени
ионизации данного вещества.
ЭДТА (Н6Y) является четырехосновной кислотой, а если
рассматривать в качестве исходной протонированную структуру
Н6Y2+ , то шестиосновной кислотой
Н6Y2+ + Н2О ↔ Н5Y+ + Н3О+, pKa,1 ~ 0,8
Н5Y+ + Н2О ↔ Н4Y + Н3О+, pKa,2 ~ 1,6
Н4Y + Н2О ↔ Н3Y– + Н3О+, pKa,3 = 2,0
Н3Y– + Н2О ↔ Н2Y2–+ Н3О+, pKa,4 = 2,67
Н2Y2– + Н2О ↔ НY3– + Н3О+, pKa,5 = 6,16
НY3– + Н2О ↔ Y4– + Н3О+, pKa,6 = 10,26
10.
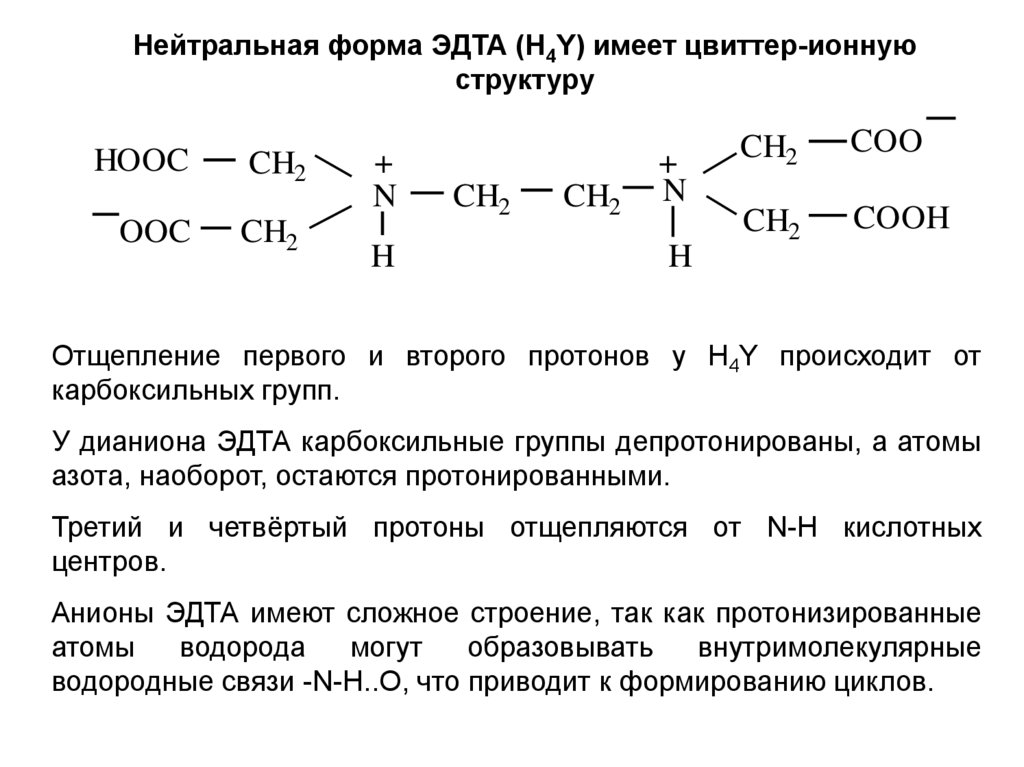
Нейтральная форма ЭДТА (H4Y) имеет цвиттер-ионнуюструктуру
HOOC
OOC
CH2
CH2
+
N
H
CH2
CH2
+
N
CH2
COO
CH2
COOH
H
Отщепление первого и второго протонов у H4Y происходит от
карбоксильных групп.
У дианиона ЭДТА карбоксильные группы депротонированы, а атомы
азота, наоборот, остаются протонированными.
Третий и четвёртый протоны отщепляются от N-H кислотных
центров.
Анионы ЭДТА имеют сложное строение, так как протонизированные
атомы
водорода
могут
образовывать
внутримолекулярные
водородные связи -N-H..О, что приводит к формированию циклов.
11.
Частицы Н6Y2+, Н5Y+, Н4Y и Н3Y– имеют близкие значения константкислотности, поэтому при рН 1–2 в растворе будет находиться их
смесь
При рН 3–6 в растворе преобладают анион Н2Y2–
При рН 6–10 – НY3–
При рН>10,5 – Y4–
При построении кривых комплексонометрического титрования и
выборе
индикатора
для
обнаружения
конечной
точки
комплексонометрического титрования необходима величина α(Y4–) для
различных значений рН
(Y )
4
K a ,1 K a , 2 ...K a , 6
[ H 3 O ]6 K a ,1 [ H 3 O ]5 K a ,1 K a , 2 [ H 3O ] 4 ... K a ,1 K a , 2 ...K a , 6
По мере увеличения рН формула для
расчёта a(Y4–) будет упрощаться.
Например, при рН > 8 можно
пренебречь присутствием в растворе
частиц Н6Y2+ – Н2Y2–
K a ,6
(Y )
[ H 3O ] K a ,6
4
12.
ЭДТА образует комплексы с катионами большинства металловMn+ + HmY(m – 4)- ↔ [MY](n – 4)+ + mH+
ЭДТА является гексадентатным лигандом и в подавляющем
большинстве случаев взаимодействует с катионами металлов в
молярном соотношении 1:1, поэтому использование понятия
«эквивалент» в комплексонометрии обычно не имеет смысла.
В структуре образующегося внутрикомплексного соединения
имеется 5 пятичленных циклов, что делает его очень устойчивым.
Устойчивость комплексов катионов металлов с ЭДТА удобно
описывать с помощью условных констант образования, которые
могут быть использованы лишь при тех условиях (рН, концентрация
постороннего лиганда), для которых они рассчитаны.
'
MY
MY M Y 4
Если ни катион, ни анион не
вступают в побочные реакции
M Y
4
'
1 MY MY
13.
Этилендиаминтетрауксусная кислота малорастворима в воде,поэтому в качестве титранта используют её динатриевую соль –
Na2H2Y·2H2O, называемую трилоном Б, динатрия эдетатом,
комплексаном III.
Для динатриевой соли этилендиаминтетрауксусной кислоты
допускается такая же аббревиатура, как и для самой кислоты –
ЭДТА.
Стандартные растворы ЭДТА могут быть как первичными, так и
вторичными. Стандартизацию проводят с помощью различных
металлов (Zn, Bi, Fe и др.), которые растворяют в кислоте, а
также CaCO3, железоаммонийных квасцов и т.д.
Внимание!!! В комплексонометрии используют все способы
титрование: прямое, обратное титрование заместителя и косвенное
титрование.
14.
Вопрос 3.Кривые комплексонометрического титрования.
Факторы, влияющие на характер кривых титрования
и величину скачка.
15.
Криваякомплексонометрического
титрования
обычно
представляют
собой
зависимость
равновесной
концентрации
ионов
металла
рM = – lg[M] от степени оттитрованности.
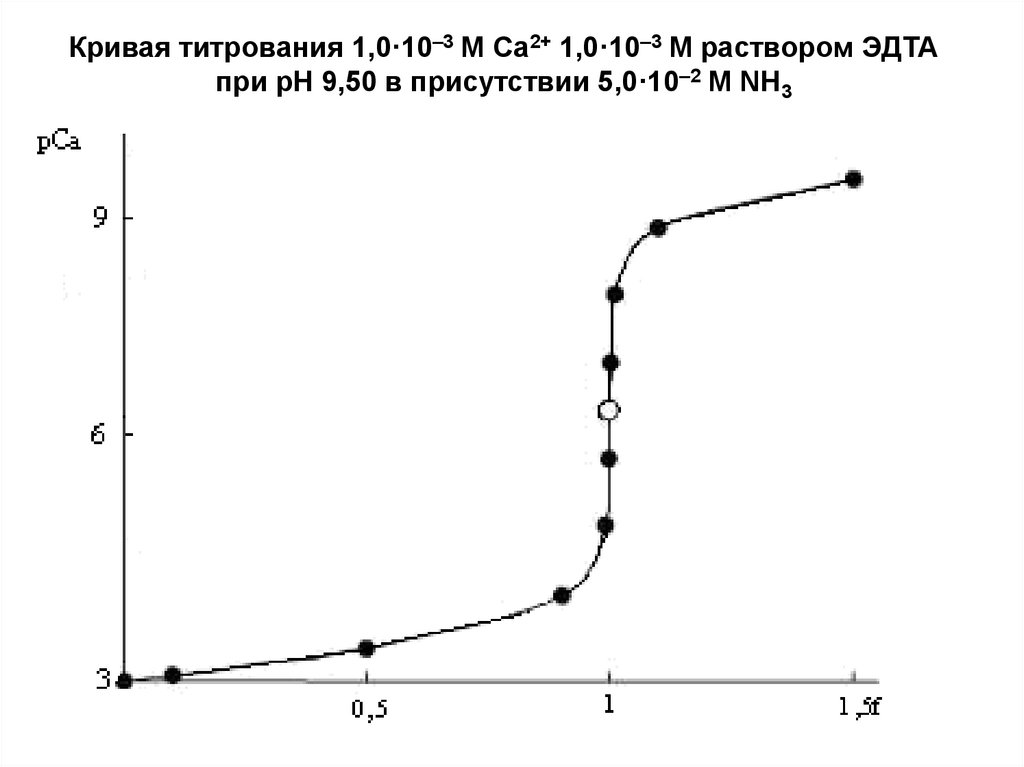
В качестве примера рассмотрим кривую титрования
1,0·10-3 М Са2+ 1,0·10-3 М раствором ЭДТА.
Титрование проводится в аммиачном буферном
растворе, рН которого равен 9,50, а концентрация NH3 –
5·10–2 моль/л.
Константа образования комплекса СаY2– равна 3,72·1010,
а её десятичный логарифм – 10,57. Катионы кальция не
образуют устойчивых аммиачных комплексов, поэтому
можно считать
M 1
'
lg СаY
lg Y 4 10,57 0,83 9,74
2 lg
СаY 2
16.
Расчёты для построения кривой титрования 1,0·10–3 М Cа2+ 1,0·10–3 Мраствором ЭДТА при рН 9,50 в присутствии 5,0·10–2 М NH3
f
Компонент,
определяющий рСа
Расчетная формула
рСа
0
начальная концентрация
ионов кальция
pСа = – lg C 0, Са
3,00
0,10
изменение
исходной
концентрации титруемого
вещества
1 f
1 f
3,09
рСа lg C0,Са lg
аналогично
3,48
0,90
аналогично
4,28
0,99
аналогично
5,30
0,999
аналогично
6,30
0,50
1,00
устойчивость
комплекса
металла
и
начальная
концентрация ионов кальция
1,001
устойчивость
металла
комплекса
рСа
1
1
1
'
lg СаY
lg
C
lg( 1 f )
2
0 ,Са
2
2
2
'
рСа lg СаY
2 lg( f 1)
6,52
6,74
1,01
аналогично
7,74
1,10
аналогично
8,74
1,50
аналогично
9,44
17.
Кривая титрования 1,0·10–3 М Са2+ 1,0·10–3 М раствором ЭДТАпри рН 9,50 в присутствии 5,0·10–2 М NH3
18.
На величину скачка титрования в комплексонометрии влияютследующие факторы
1. исходные концентрации титруемого иона, титранта,
вспомогательного реагента
2. устойчивость комплекса катиона металла с ЭДТА
3. величины α(Y4–) и αМ в условиях титрования
Молярная доля Y4- зависит от рН, а молярная доля
незакомплексованных
ионов
металла
–
от
концентрации
комплексообразующего реагента и устойчивости образующихся
комплексов.
К уменьшению скачка титрования приводит снижение исходной
концентрации титруемого иона и рН, а также увеличение
концентрации вспомогательного комплексообразователя. Величина
скачка титрования будет тем больше, чем выше устойчивость
образующегося комплекса катиона металла с ЭДТА.
19.
Вопрос 4.Способы фиксирования конечной точки титрования
в комплексонометрии. Металлохромные
индикаторы, механизм их действия, интервал
перехода и правило выбора. Погрешности
титрования
Для обнаружения конечной точки титрования используют
визуальные и инструментальные методы.
Визуальное обнаружение конечной точки титрования
чаще всего проводят с помощью металлоиндикаторов –
веществ, изменяющих окраску (или флуоресценцию) в
зависимости от концентрации катионов металла в
растворе.
20.
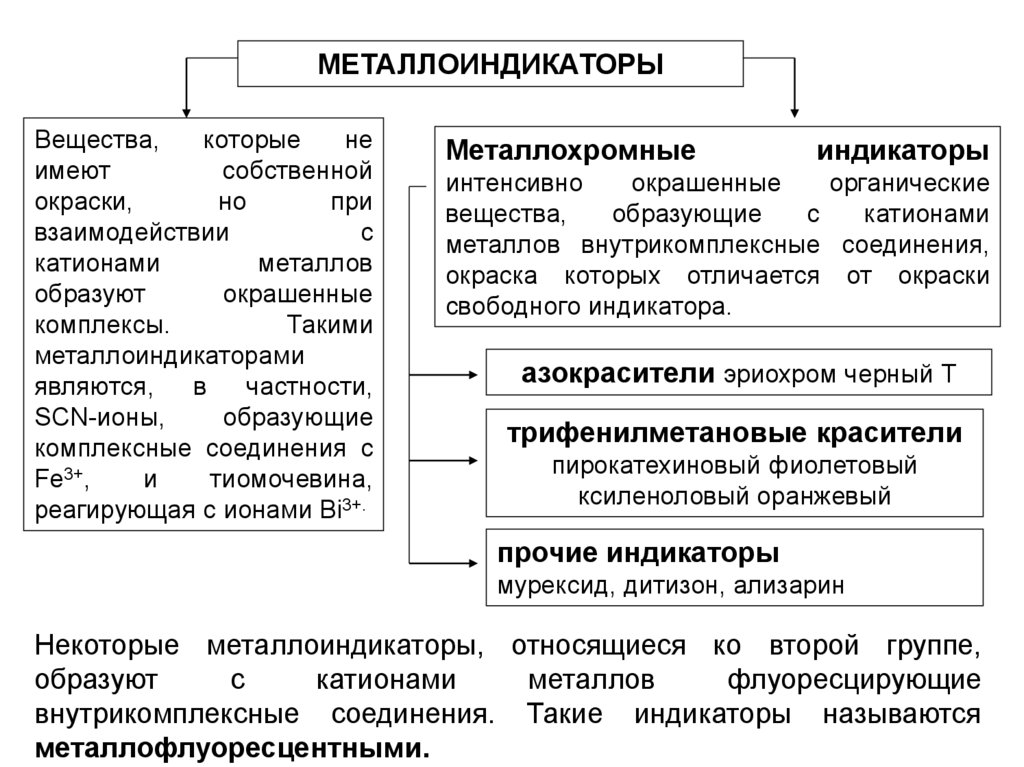
МЕТАЛЛОИНДИКАТОРЫВещества,
которые
не
имеют
собственной
окраски,
но
при
взаимодействии
с
катионами
металлов
образуют
окрашенные
комплексы.
Такими
металлоиндикаторами
являются,
в
частности,
SCN-ионы,
образующие
комплексные соединения с
Fe3+,
и
тиомочевина,
реагирующая с ионами Bi3+.
Металлохромные
индикаторы
интенсивно
окрашенные
органические
вещества,
образующие
с
катионами
металлов внутрикомплексные соединения,
окраска которых отличается от окраски
свободного индикатора.
азокрасители эриохром черный Т
трифенилметановые красители
пирокатехиновый фиолетовый
ксиленоловый оранжевый
прочие индикаторы
мурексид, дитизон, ализарин
Некоторые металлоиндикаторы, относящиеся ко второй группе,
образуют
с
катионами
металлов
флуоресцирующие
внутрикомплексные соединения. Такие индикаторы называются
металлофлуоресцентными.
21.
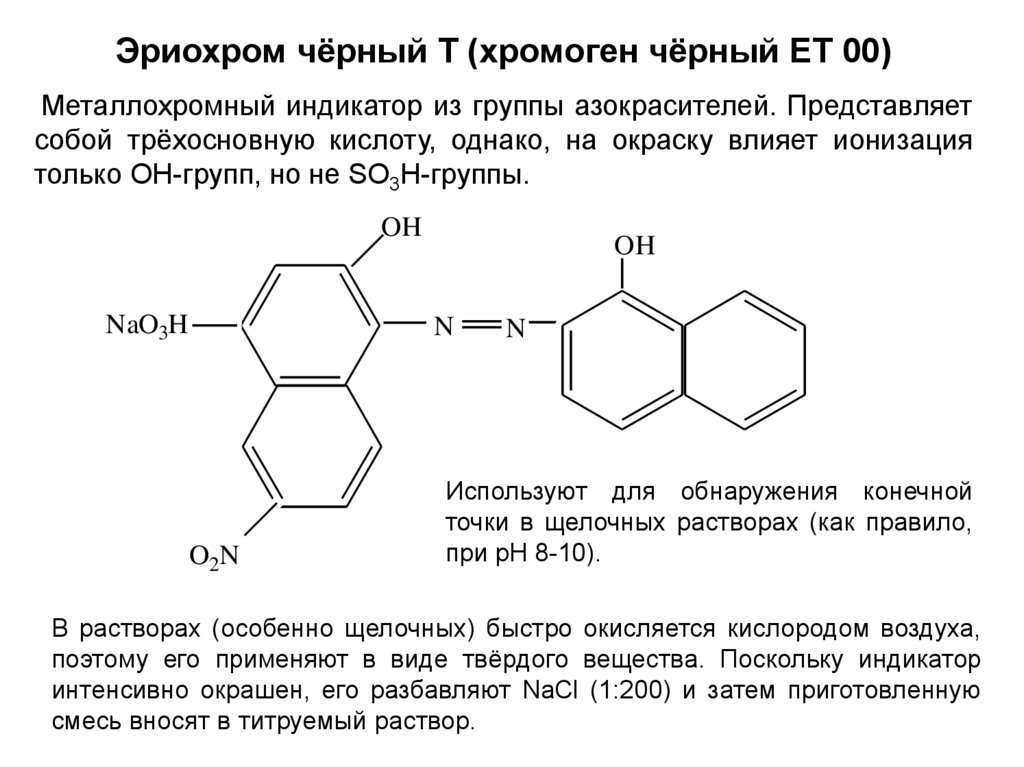
Эриохром чёрный Т (хромоген чёрный ЕТ 00)Металлохромный индикатор из группы азокрасителей. Представляет
собой трёхосновную кислоту, однако, на окраску влияет ионизация
только OH-групп, но не SO3H-группы.
OH
NaO3H
OH
N
O2N
N
Используют для обнаружения конечной
точки в щелочных растворах (как правило,
при рН 8-10).
В растворах (особенно щелочных) быстро окисляется кислородом воздуха,
поэтому его применяют в виде твёрдого вещества. Поскольку индикатор
интенсивно окрашен, его разбавляют NaCl (1:200) и затем приготовленную
смесь вносят в титруемый раствор.
22.
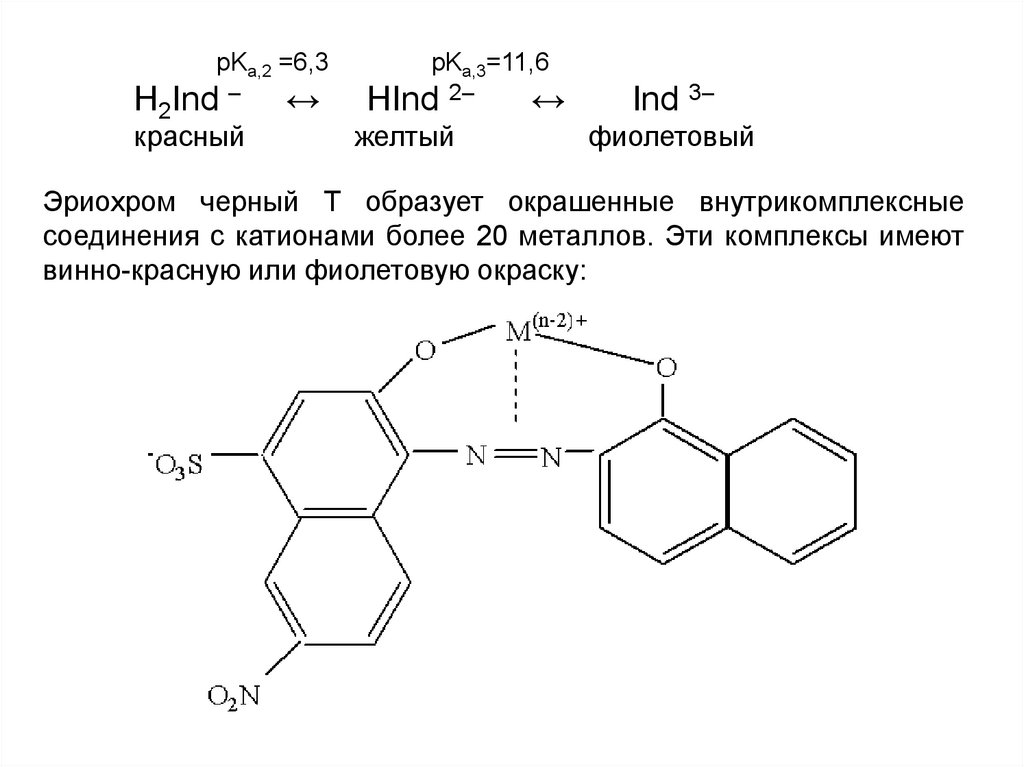
pKa,2 =6,3Н2Ind –
красный
↔
pKa,3=11,6
HInd 2–
желтый
↔
Ind 3–
фиолетовый
Эриохром черный Т образует окрашенные внутрикомплексные
соединения с катионами более 20 металлов. Эти комплексы имеют
винно-красную или фиолетовую окраску:
23.
Сущность обнаружения конечной точкикомплексонометрического титрования с помощью
металлохромного индикатора
При добавлении индикатора к исходному раствору
титруемого катиона металла образуется окрашенный
растворимый комплекс
M + Ind = MInd
В процессе титрования данного раствора ЭДТА в точке
эквивалентности или вблизи неё комплекс катиона металла
с индикатором разрушается, и окраска раствора становится
такой же, как и у раствора индикатора при данном значении
рН
MInd + Y = MY + Ind
24.
Для успешного обнаружения конечной точки титрования спомощью металлохромного индикатора необходимо, чтобы:
1. комплекс MInd был достаточно устойчив, и его образование
происходило бы уже при малых концентрациях индикатора
2. устойчивость комплекса MInd была бы меньше устойчивости
комплекса данного катиона металла с ЭДТА, но при этом такой, чтобы
разрушение комплекса MInd происходило в пределах скачка
титрования
3. комплекс MInd был кинетически лабильным, и его разрушение при
взаимодействии с ЭДТА происходило быстро
4. окраска комплекса MInd отличалась от окраски свободного
индикатора при данном значении рН
25.
Интервал перехода окраски металлохромного индикаторанаходится в следующем диапазоне величин
pC lg
'
M
pC
'
M
'
MInd
1
- концентрация всех форм существования ионов металла
При титровании катионов Ca2+ или Mg2+, не образующих
устойчивых аммиачных или гидроксокомплексов, можно считать,
что αМ = 1, при этом последнее уравнение будет иметь вид
pМ lg
'
MInd
1
26.
Индикаторные погрешностиПереход окраски металлохромного индикатора может происходить
раньше наступления эквивалентности либо позже его.
Первое приведёт к возникновению отрицательной систематической
индикаторной погрешности, а второе – положительной.
Величина индикаторной погрешности равна разности между
величиной степени оттитрованности, при которой заканчивается
титрование, и величиной степени оттитрованности, соответствующей
достижению эквивалентности (т.е. f = 1).
Например, если титрование заканчивается при f = 0,995, то величина
индикаторной погрешности будет равна –0,005 (или –0,5%), а если при
f = 1,02, то +0,02 (или 2%),
27.
Формула для расчета отрицательной индикаторнойпогрешности
С
1
1 f
' '
C0,M C M MY
'
M
Формула для расчета положительной индикаторной
погрешности
С
f 1 ' '
C M MY C0,M
1
'
M





















 chemistry
chemistry








