Similar presentations:
Комплексометрическое титрование. Окислительно-восстановительное титрование
1.
Комплексометрическоетитрование
Сущность метода заключается в реакции образования прочного
комплекса (Kуст ≥ 108) между реагентом и определяемым
компонентом.
Комплексометрическое титрование с использованием комплексонов
называется комплексонометрия.
Что такое комплексоны?
2.
В основе комплексонометрического метода титрования такжележит реакция комплексообразования между реактивом
(комплексоном) и определяемым ионом.
Факторы определения: рН, температура
Реактивы: Комплексоны относятся к классу
полиаминополикарбоновых кислот.
комплексон II
(этилендиаминтетрауксусная
кислота)
комплексон III (этилендиаминтетраацетат динатрия (ЭДТА)
или Na2[H2Y]), техническое название трилон Б
комплексон I
(нитрилотриуксусная кислота)
NaOOC
HOOC
CH2
CH2
N
CH2
CH2
N
CH2
COOH
CH2
COONa
· 2Н2О
Определяемые вещества: катионы металлов
(например: Са2+,Mg2+,Sr2+,Ва2+, Ni2+,Zn2+,Co2+,Cu2+, Al3+,Zr4+ и др.)
3.
Порядок титрования. В качестве титранта всегда используютраствор комплексона
Индикаторы. В комплексонометрии можно использовать
кислотно-основные индикаторы, но чаще применяют более
специфические индикаторы-комплексообразователи, которые
образуют окрашенные комплексы с катионами металла
(металл-индикаторы).
Кривые титрования представляют собой зависимость
логарифмического показателя концентрации определяемого
иона (рСМЕ) от объёма титранта - Трилона Б (V)
рСМЕ
Ind
νМе = νТрилона Б
МеInd
V
4.
Хромоген черный специальный ЕТ-00.В щелочной среде (рН ~8-10) индикатор образует с
катионами двухвалентных металлов (Са2+, Mg2+ и др.)
комплексы:
Ме2+ + НInd2- = МеInd¯ + Н+
В процессе титрования комплексоном III (Na2[H2Y]) катион
металла образует более прочное соединение с комплексоном:
МеInd¯ + Na2[H2Y] = Na2[МеY] + НInd2- + Н+
Мурексид (аммонийная соль пурпурной кислоты).
В сильно щелочной среде (рН >11) индикатор образует с
катионами двухвалентных металлов (Са2+, Ni2+, Cu2+ и др.)
комплексы:
Ме2+ + Ind- = МеInd+
В процессе титрования комплексоном III (Na2[H2Y]) катион
металла образует более прочное соединение с комплексоном:
МеInd+ + Na2[H2Y] = Na2[МеY] + Ind- + 2Н+
5.
Определение общей жёсткости воды, кальция и магнияв биологических жидкостях.
Под общей жёсткостью воды подразумевают содержание
в ней растворимых солей кальция и магния.
Общая жёсткость включает карбонатную (временную) и
некарбонатную (постоянную) жёсткости.
Определение содержания переходных металлов
6.
Окислительновосстановительноетитрование
7.
Окислительно-восстановительное титрование основано наокислительно-восстановительных реакциях типа:
aOx1 + bRed2 = cOx2 + dRed1
Ox1 + nē → Red1
Red2 - nē → Ox2
Окислительная активность вещества (титранта или аналита)
характеризуется величиной равновесного окислительновосстановительного потенциала:
Уравнение
Нернста
Величина окислительно-восстановительного потенциала
зависит от: природы вещества, концентрации, рН и
температуры
Титрант выбирают так, чтобы
Концентрацию веществ, рН и температуру подбирают так,
чтобы
8.
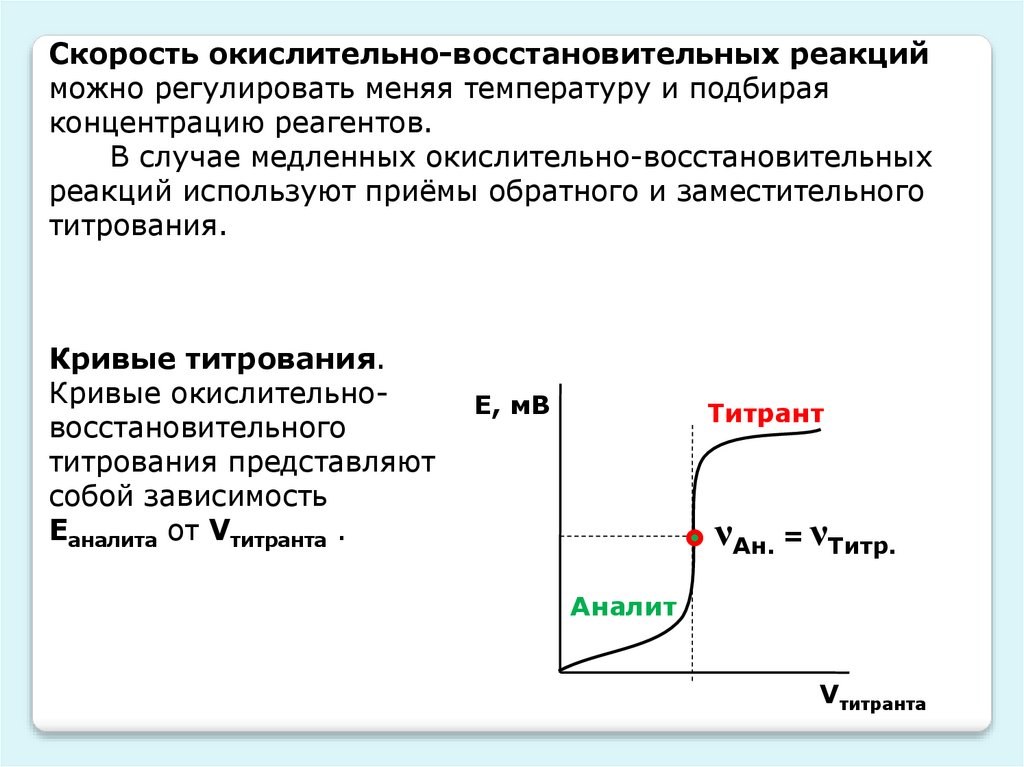
Cкорость окислительно-восстановительных реакцийможно регулировать меняя температуру и подбирая
концентрацию реагентов.
В случае медленных окислительно-восстановительных
реакций используют приёмы обратного и заместительного
титрования.
Кривые титрования.
Кривые окислительновосстановительного
титрования представляют
собой зависимость
Еаналита от Vтитранта .
Е, мВ
Титрант
νАн. = νТитр.
Аналит
Vтитранта
9.
Индикаторы. В окислительно-восстановительномтитровании используют окислительно-восстановительные и
специфические индикаторы.
Индикатор
Е0, В
ферроин
дифениламин
+ 1,06
+ 0,76
индигокармин
+ 0,29
(рН=0)
-0,16
(рН=7)
Окраска формы
Ind-Ox
Ind-Red
синий
фиолетовая
красный
нет
синяя
нет
или
слабожелтая
10.
Окислительно-восстановительное титрование поназванию реактивов подразделяют на методы:
перманганатометрия, иодометрия, хроматометрия и др.
Метод:
перманганатометрия
Реактивы
KMnO4 – титрант стандартизируют по Н2С2О4
или ее солям
Аналиты
восстановители
прямым титрованием: Fe+2, Cu+1, Mn+2, Sn+2, Са+2,
Cl-, Br-, I-, S2-, NO2-, альдегиды, полифенолы,
муравьиная кислота, аскорбиновая кислота и др.
Индикатор
без индикатора
Условия
рН может быть разным, но чаще рН<7
11.
иодометрияМетод:
Реактивы
I2, KI,
Na2S2O3·5H2O – титрант, который
стандартизируют по KMnO4
Аналиты
А) восстановители
прямым титрованием: Cr+2, As+3, Sn+2, S2-,
S2O32-, CN-, гидразин, гидроксиламин,
полифенолы, аскорбиновая кислота и др.
Б) окислители
методом замещения: NO2-, MnO4-, Cr2O72-,
перекиси и др.
В) реакции присоединения: непредельные
соединения
Индикатор
крахмал
Условия
рН ≤ 7,
реактивы хранят в темных склянках,
t≤25°C










 chemistry
chemistry








