Similar presentations:
Комплексометри́ческое, окислительно-восстановительное и осадительное титрование
1.
Комплексометрическое,окислительновосстановительное и
осадительное
титрование
2.
План1. Комплексометрическое титрование. Комплексонометрия. Кривые
комплексонометрического титрования. Способы фиксирования
конечной
точки
титрования
в
комплексонометрии.
Металлохромные индикаторы. Погрешности титрования
2. Окислительно-восстановительное
титрование.
Расчет
и
построение кривых титрования; способы обнаружения конечной
точки титрования; титранты и стандартные вещества; погрешности
титрования
3. Методы
окислительно-восстановительного
титрования.
Иодометрическое
титрование.
Перманганатометрия.
Дихроматометрия.
Первичные
и
вторичные
стандарты.
Индикаторы
4. Сущность, общая характеристика и классификация методов
осадительного титрования. Кривые осадительного титрования.
Способы фиксирования конечной точки в осадительном
титровании (метод Мора, метод Фольгарда, метод Фаянса).
Погрешности титрования.
3.
Вопрос 1.Комплексометрическое титрование. Комплексонометрия.
Кривые комплексонометрического титрования. Способы
фиксирования конечной точки титрования в
комплексонометрии. Металлохромные индикаторы.
Погрешности титрования
Комплексометрическое титрование – группа титриметрических
методов анализа, основанных на реакциях образования
растворимых в воде комплексных соединений
Требования к реакциям, применяемым в
комплексометрическом титровании
1. большая константа равновесия
2. стехиометричность
3. протекание с приемлемой скоростью при обычных условиях
4. возможность обнаружения конечной точки титрования
4.
Внимание!!!Реакции
комплексообразование
ионов
металлов
с
монодентантными лигандами в титриметрии используются крайне
редко, т.к. при протекании этих реакций образуется не один, а
несколько комплексов. Если устойчивость этих комплексов
отличается незначительно, то в процессе титрования концентрация
катионов металла будет изменяться плавно, а значит, скачки
титрования будут отсутствовать. Для появления скачка титрования
необходимо, чтобы устойчивость одного из образующихся
комплексов заметно отличалась от устойчивости других.
Из всех реакций комплексообразования ионов металлов с
монодентатными лигандами лишь несколько подходят для
титриметрии
1. Реакции образования галогенидных и некоторых других комплексов
ртути (II)
2. Реакции образования цианидных комплексов некоторых металлов
3. Реакции образования фторидных комплексов некоторых металлов
5.
Комплексонометрическое титрованиеВнимание!!!
В
отличие
от
монодентантных
лигандов
полидентатные
хелатообразующие лиганды, как правило, взаимодействуют с
катионами металлов с образованием единственного комплекса с
соотношением компонентов 1:1. Кроме того, вследствие хелатного
эффекта комплексы катионов металлов с такими лигандами более
устойчивы, чем комплексы с аналогичными монодентатными
лигандами.
Комплексонометрическом титрованием называется
титриметрический метод анализа, основанный на
образовании хелатов при взаимодействии катионов
металлов с комплексонами
6.
Комплексоны – органические соединения, в молекулах которыхсодержится большое число основных донорных центров и кислотных
функциональных
групп,
расположенных
так,
что
при
их
взаимодействии с катионами металлов образуются высокоустойчивые
внутрикомплексные соединения, содержащие не менее двух циклов.
В качестве основных донорных центров в молекулах комплексонов
выступают атомы азота, фосфора или серы; кислотные центры обычно
представлены карбоксильными или фосфоновыми группами.
Максимально возможная дентатность у различных комплексонов
может изменяться от 3 до 8.
В титриметрии наибольшее значение имеют комплексоны,
относящиеся
к
аминополикарбоновым
кислотам:
этилендиаминтетрауксусная кислота и её динатриевая соль.
7.
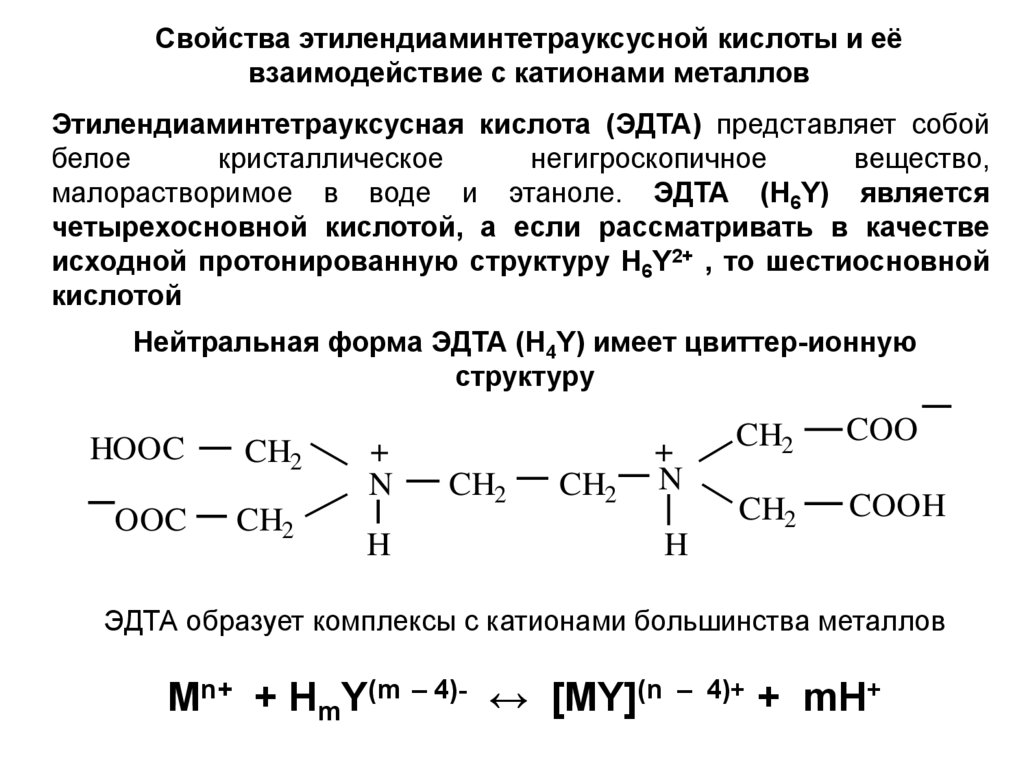
Свойства этилендиаминтетрауксусной кислоты и еёвзаимодействие с катионами металлов
Этилендиаминтетрауксусная кислота (ЭДТА) представляет собой
белое
кристаллическое
негигроскопичное
вещество,
малорастворимое в воде и этаноле. ЭДТА (Н6Y) является
четырехосновной кислотой, а если рассматривать в качестве
исходной протонированную структуру Н6Y2+ , то шестиосновной
кислотой
Нейтральная форма ЭДТА (H4Y) имеет цвиттер-ионную
структуру
HOOC
OOC
CH2
CH2
+
N
H
CH2
CH2
+
N
CH2
COO
CH2
COOH
H
ЭДТА образует комплексы с катионами большинства металлов
Mn+ + HmY(m – 4)- ↔ [MY](n – 4)+ + mH+
8.
Этилендиаминтетрауксусная кислота малорастворима в воде,поэтому в качестве титранта используют её динатриевую соль –
Na2H2Y·2H2O, называемую трилоном Б, динатрия эдетатом,
комплексаном III.
Для динатриевой соли этилендиаминтетрауксусной кислоты
допускается такая же аббревиатура, как и для самой кислоты –
ЭДТА.
Стандартные растворы ЭДТА могут быть как первичными, так и
вторичными. Стандартизацию проводят с помощью различных
металлов (Zn, Bi, Fe и др.), которые растворяют в кислоте, а
также CaCO3, железоаммонийных квасцов и т.д.
Внимание!!! В комплексонометрии используют все способы
титрование: прямое, обратное титрование заместителя и косвенное
титрование.
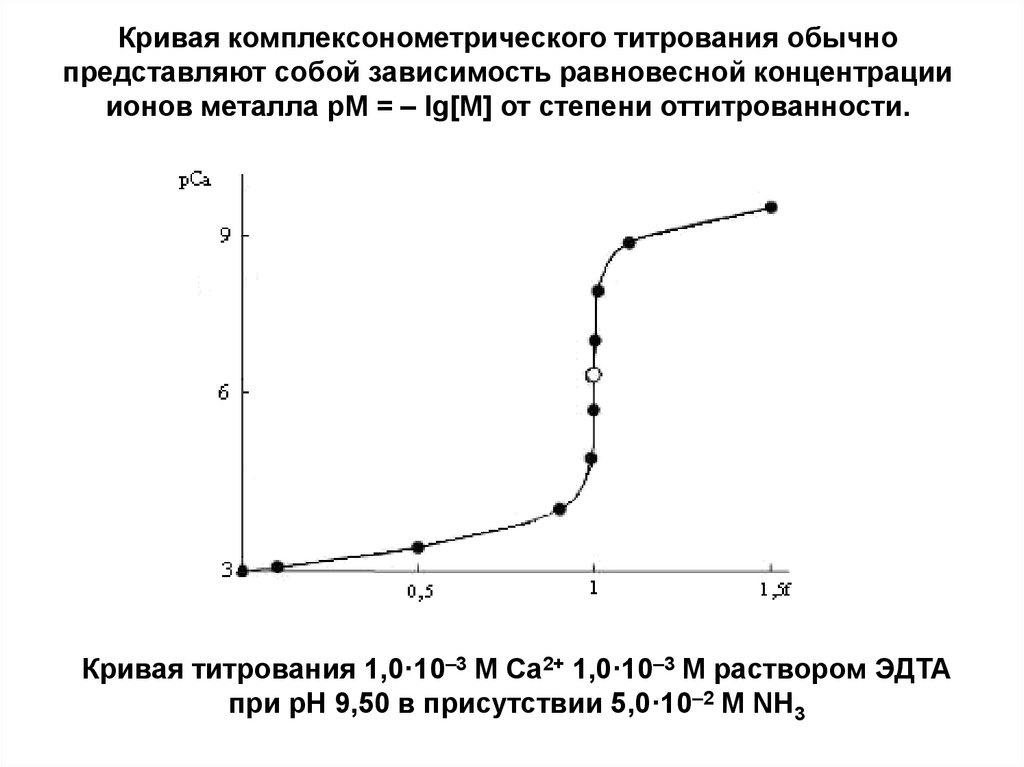
9.
Кривая комплексонометрического титрования обычнопредставляют собой зависимость равновесной концентрации
ионов металла рM = – lg[M] от степени оттитрованности.
Кривая титрования 1,0·10–3 М Са2+ 1,0·10–3 М раствором ЭДТА
при рН 9,50 в присутствии 5,0·10–2 М NH3
10.
На величину скачка титрования в комплексонометрии влияютследующие факторы
1. исходные концентрации титруемого иона, титранта,
вспомогательного реагента
2. устойчивость комплекса катиона металла с ЭДТА
3. величины молярных долей аниона ЭДТА и металла,
участвующих в образовании комплекса (α(Y4–) и αМ) в условиях
титрования
Молярная доля Y4- зависит от рН, а молярная доля
незакомплексованных
ионов
металла
–
от
концентрации
комплексообразующего реагента и устойчивости образующихся
комплексов.
К уменьшению скачка титрования приводит снижение исходной
концентрации титруемого иона и рН, а также увеличение
концентрации вспомогательного комплексообразователя. Величина
скачка титрования будет тем больше, чем выше устойчивость
образующегося комплекса катиона металла с ЭДТА.
11.
Способы обнаружения конечной точки титрования.Металлоиндикаторы
Для обнаружения конечной точки титрования используют
визуальные и инструментальные методы.
Визуальное обнаружение конечной точки титрования
чаще всего проводят с помощью металлоиндикаторов –
веществ, изменяющих окраску (или флуоресценцию) в
зависимости от концентрации катионов металла в
растворе.
12.
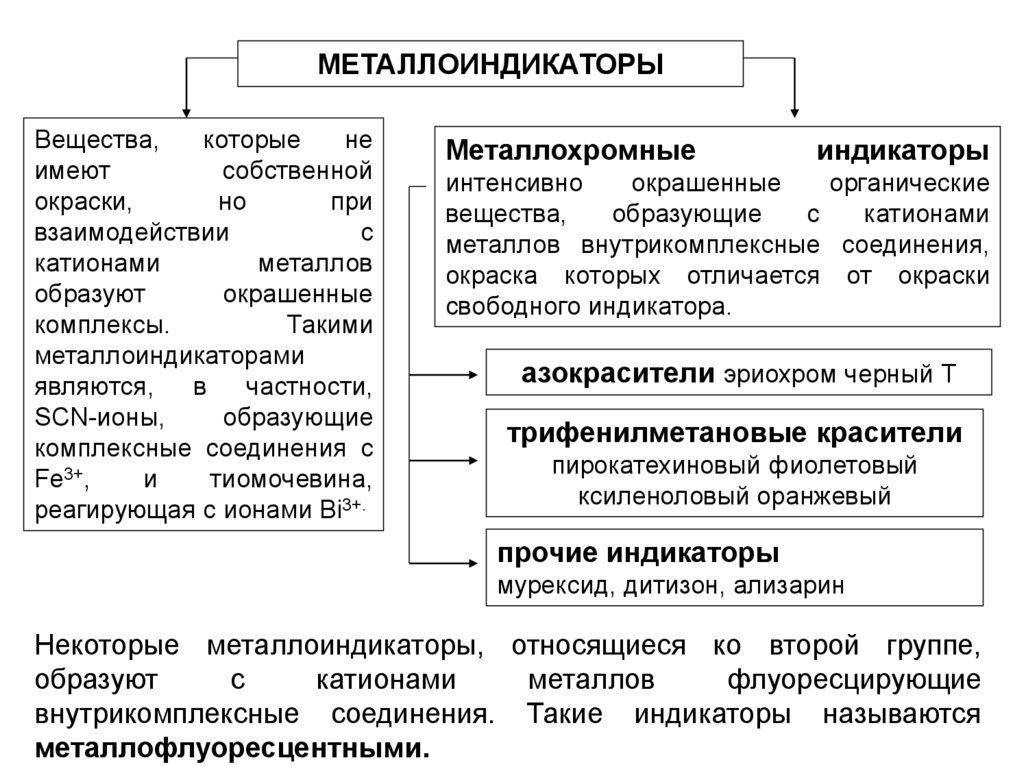
МЕТАЛЛОИНДИКАТОРЫВещества,
которые
не
имеют
собственной
окраски,
но
при
взаимодействии
с
катионами
металлов
образуют
окрашенные
комплексы.
Такими
металлоиндикаторами
являются,
в
частности,
SCN-ионы,
образующие
комплексные соединения с
Fe3+,
и
тиомочевина,
реагирующая с ионами Bi3+.
Металлохромные
индикаторы
интенсивно
окрашенные
органические
вещества,
образующие
с
катионами
металлов внутрикомплексные соединения,
окраска которых отличается от окраски
свободного индикатора.
азокрасители эриохром черный Т
трифенилметановые красители
пирокатехиновый фиолетовый
ксиленоловый оранжевый
прочие индикаторы
мурексид, дитизон, ализарин
Некоторые металлоиндикаторы, относящиеся ко второй группе,
образуют
с
катионами
металлов
флуоресцирующие
внутрикомплексные соединения. Такие индикаторы называются
металлофлуоресцентными.
13.
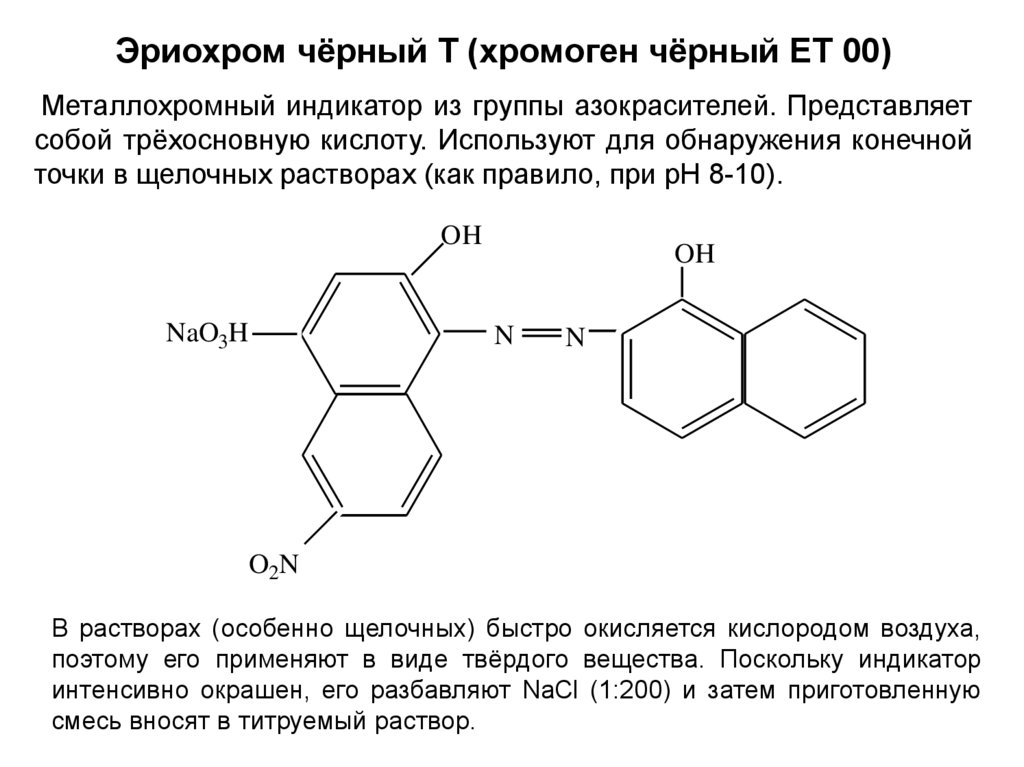
Эриохром чёрный Т (хромоген чёрный ЕТ 00)Металлохромный индикатор из группы азокрасителей. Представляет
собой трёхосновную кислоту. Используют для обнаружения конечной
точки в щелочных растворах (как правило, при рН 8-10).
OH
NaO3H
OH
N
N
O2N
В растворах (особенно щелочных) быстро окисляется кислородом воздуха,
поэтому его применяют в виде твёрдого вещества. Поскольку индикатор
интенсивно окрашен, его разбавляют NaCl (1:200) и затем приготовленную
смесь вносят в титруемый раствор.
14.
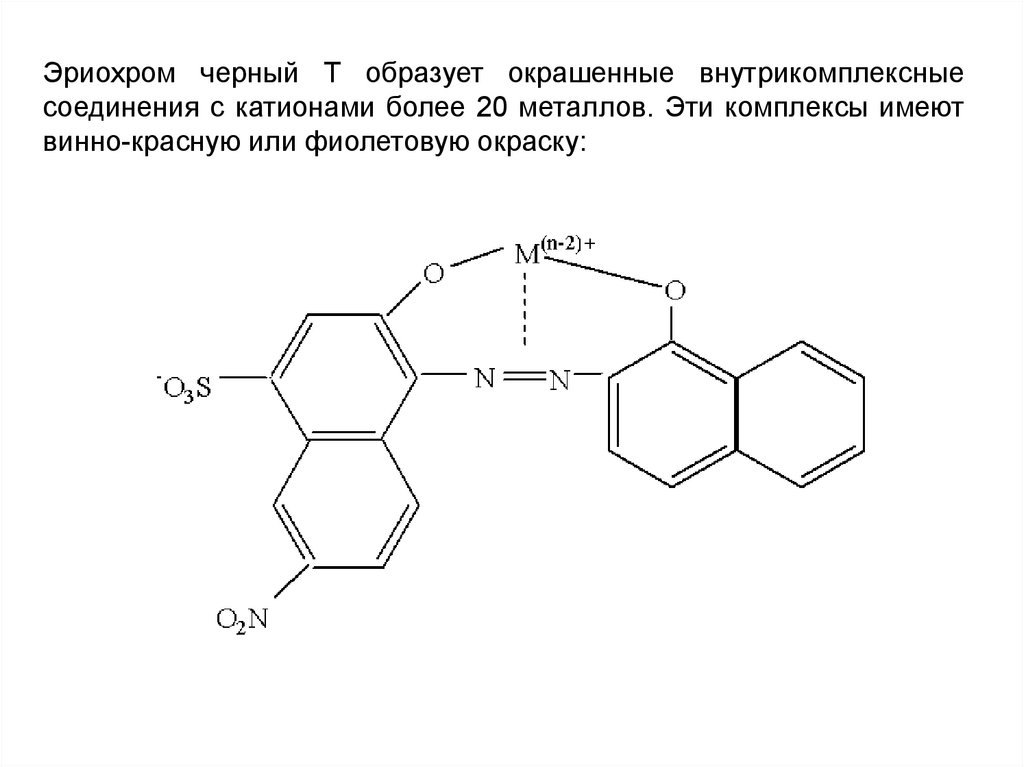
Эриохром черный Т образует окрашенные внутрикомплексныесоединения с катионами более 20 металлов. Эти комплексы имеют
винно-красную или фиолетовую окраску:
15.
Сущность обнаружения конечной точкикомплексонометрического титрования с помощью
металлохромного индикатора
При добавлении индикатора к исходному раствору
титруемого катиона металла образуется окрашенный
растворимый комплекс
M + Ind = MInd
В процессе титрования данного раствора ЭДТА в точке
эквивалентности или вблизи неё комплекс катиона металла
с индикатором разрушается, и окраска раствора становится
такой же, как и у раствора индикатора при данном значении
рН
MInd + Y = MY + Ind
16.
Индикаторные погрешностиПереход окраски металлохромного индикатора может происходить
раньше наступления эквивалентности либо позже его.
Первое приведёт к возникновению отрицательной систематической
индикаторной погрешности, а второе – положительной.
Формула для расчета отрицательной индикаторной
погрешности
С M'
1
1 f
' '
C0,M C M MY
Формула для расчета положительной индикаторной
погрешности
С M'
f 1 ' '
C M MY C0,M
1
17.
Вопрос 2.Окислительно-восстановительное титрование.
Расчет и построение кривых титрования; способы
обнаружения конечной точки титрования;
титранты и стандартные вещества; погрешности
титрования
Окислительно-восстановительным
титрованием
называется группа титриметрических методов анализа,
основанных
на
использовании
окислительновосстановительных реакций
18.
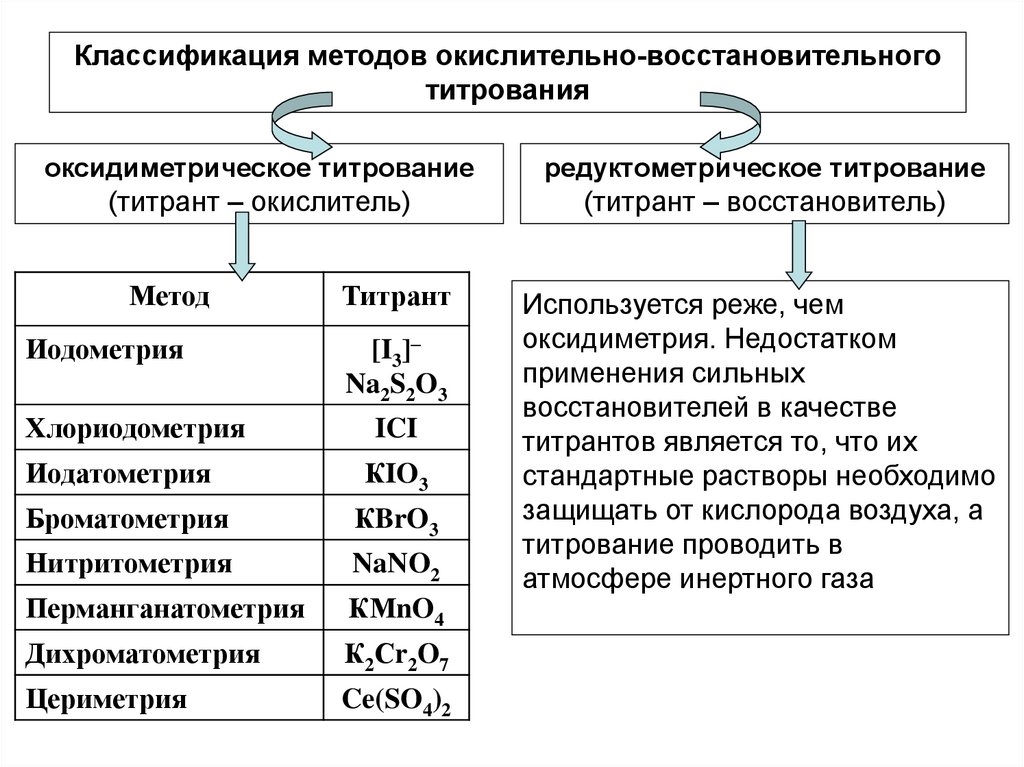
Классификация методов окислительно-восстановительноготитрования
оксидиметрическое титрование
редуктометрическое титрование
(титрант – окислитель)
(титрант – восстановитель)
Метод
Иодометрия
Титрант
[I3]–
Na2S2O3
Хлориодометрия
ICI
Иодатометрия
КIO3
Броматометрия
КBrO3
Нитритометрия
NaNO2
Перманганатометрия
КМnO4
Дихроматометрия
К2Сr2O7
Цериметрия
Ce(SO4)2
Используется реже, чем
оксидиметрия. Недостатком
применения сильных
восстановителей в качестве
титрантов является то, что их
стандартные растворы необходимо
защищать от кислорода воздуха, а
титрование проводить в
атмосфере инертного газа
19.
Требования к титрантам и реакциям, используемым вокислительно-восстановительном титровании
1. должны
быть
достаточно
сильными
окислителями
и
восстановителями
2. величина ЭДС реакции должна быть такой, чтобы реакция между
определяемым веществом и титрантом протекала количественно
3. титрант должен реагировать только с определяемым веществом, и
реакция
между
ними
должна
протекать
стехиометрично
4. реакция, используемая в прямом титровании, должна протекать
с приемлемой скоростью
5. должен существовать способ обнаружения конечной точки
титрования
В окислительно-восстановительном титровании
используют все способы титрования
20.
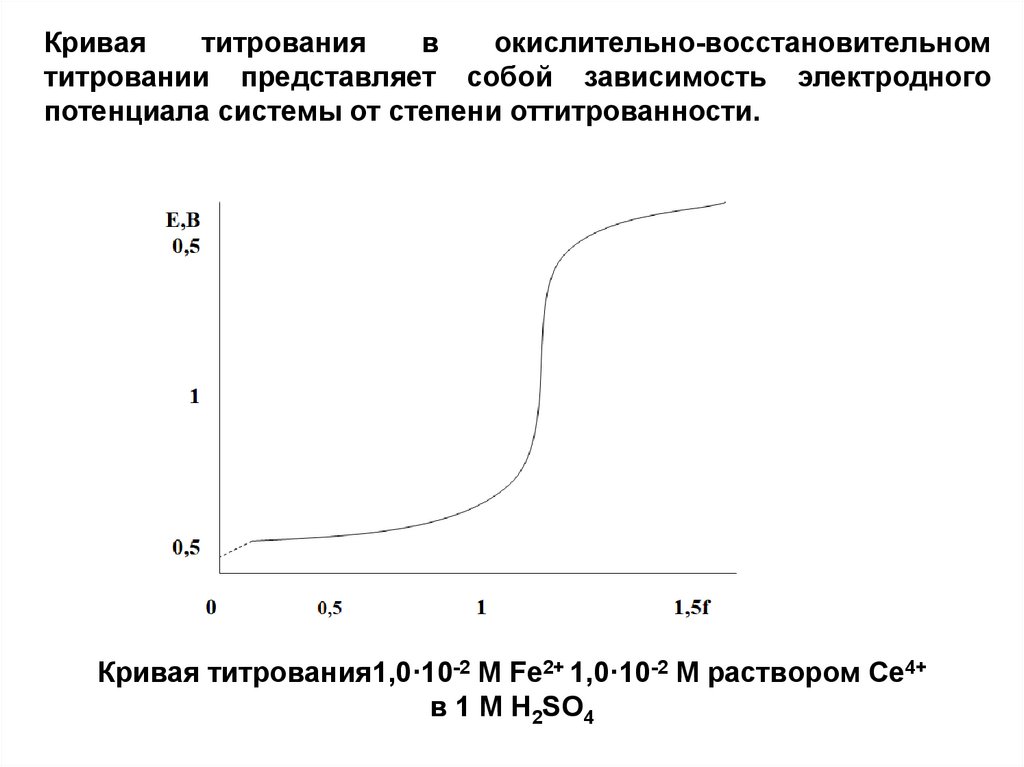
Криваятитрования
в
окислительно-восстановительном
титровании представляет собой зависимость электродного
потенциала системы от степени оттитрованности.
Кривая титрования1,0·10-2 М Fe2+ 1,0·10-2 М раствором Се4+
в 1 М Н2SO4
21.
Внимание!!! В исходный момент, до начала титрования,величина электродного потенциала системы является
неопределенной.
Концентрация ионов Fe3+ в исходный момент времени не равна нулю,
но точная ее величина неизвестна. Некоторое количество ионов Fe3+
может содержаться в исходном образце титруемого вещества. Эти
ионы могут образоваться также в результате взаимодействия Fe2+ с
кислородом воздуха или серной кислотой. Из-за того, что
концентрация окисленной формы определяемого вещества, если
само оно является восстановителем, либо, наоборот, его
восстановленной формы, если определяемое вещество – окислитель,
в
нулевой
точке
неизвестна,
кривые
окислительновосстановительного титрования начинают строить с некоторого
ненулевого значения f.
22.
Способы обнаружения конечной точки титрованияДля обнаружения конечной точки титрования используют
визуальные и инструментальные методы.
Визуальное обнаружение конечной точки титрования
может быть проведено по изменению окраски
непосредственно одного из участников протекающей при
титровании химической реакции либо с помощью
индикаторов.
Индикаторы, используемые для обнаружения конечной
точки окислительно-восстановительного титрования,
могут быть специфическими либо окислительновосстановительными.
23.
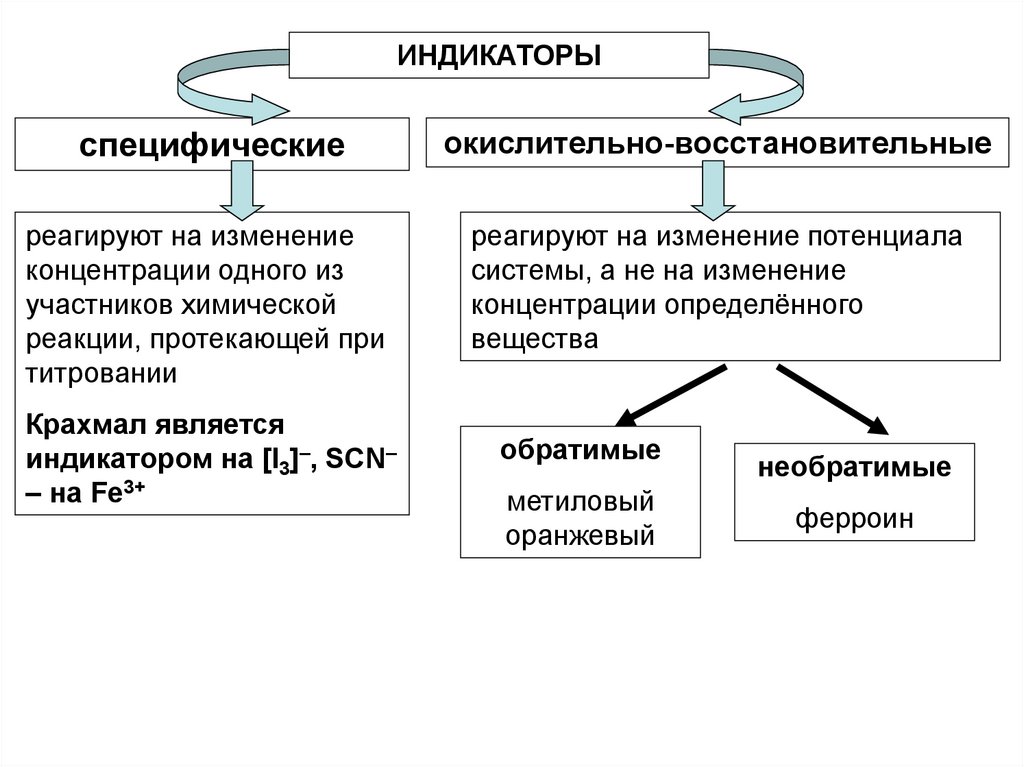
ИНДИКАТОРЫспецифические
окислительно-восстановительные
реагируют на изменение
концентрации одного из
участников химической
реакции, протекающей при
титровании
реагируют на изменение потенциала
системы, а не на изменение
концентрации определённого
вещества
Крахмал является
индикатором на [I3]–, SCN–
– на Fe3+
обратимые
метиловый
оранжевый
необратимые
ферроин
24.
Погрешности титрованияПринцип оценки систематической индикаторной погрешности при
окислительно-восстановительном
титровании
заключается
в
сравнении потенциалов в точке эквивалентности и в конечной точке
титрования и определении величины f для конечной точки
титрования.
Формула для расчета отрицательной индикаторной погрешности
1 f
ПТ
10
f
0'
0' n
( EOx
E
Ind )
1 / Re d1
0 , 059
25.
Формула для расчета положительной индикаторнойпогрешности
ПТ 1 f 10
0'
0'
n
( EIn d EOx2 / Re d 2 )
0 , 059
26.
Вопрос 3.Методы окислительно-восстановительного титрования.
Иодометрическое титрование. Перманганатометрия.
Дихроматометрия. Первичные и вторичные стандарты.
Индикаторы.
Иодометрическое титрование
Титриметрический метод анализа, основанный на определении
количества иода, затраченного для реакции с веществом,
обладающим восстановительными свойствами, или выделившегося в
результате реакции KI с веществом, обладающим окислительными
свойствами.
Растворимость иода в воде при 200С составляет примерно 1,3·10–3
моль/л. В присутствии KI за счёт протекания реакции образования
трииодид-иона [I3]– растворимость иода заметно увеличивается.
Поэтому в основе иодометрических определений лежит равновесие
[I3]–+ 2ē ↔ 3I–; Е0 = + 0,545 В
27.
Внимание!!!Величина стандартного электродного потенциала системы [I3]–/3I–
относительно невелика, поэтому [I3]– – это средней силы окислитель,
а I– – средней силы восстановитель. Таким образом, при
иодометрических определениях могут быть использованы как
окислительные свойства иода, так и восстановительные
свойства иодид-иона.
Все иодометрические определения можно разделить на два вида:
1. титрование определяемого вещества иодом (прямое и обратное)
2. титрование иода, образовавшегося
определяемого вещества с КI
при
взаимодействии
Первый вид определений иногда называют иодиметрическим, а
второй – собственно иодометрическим.
28.
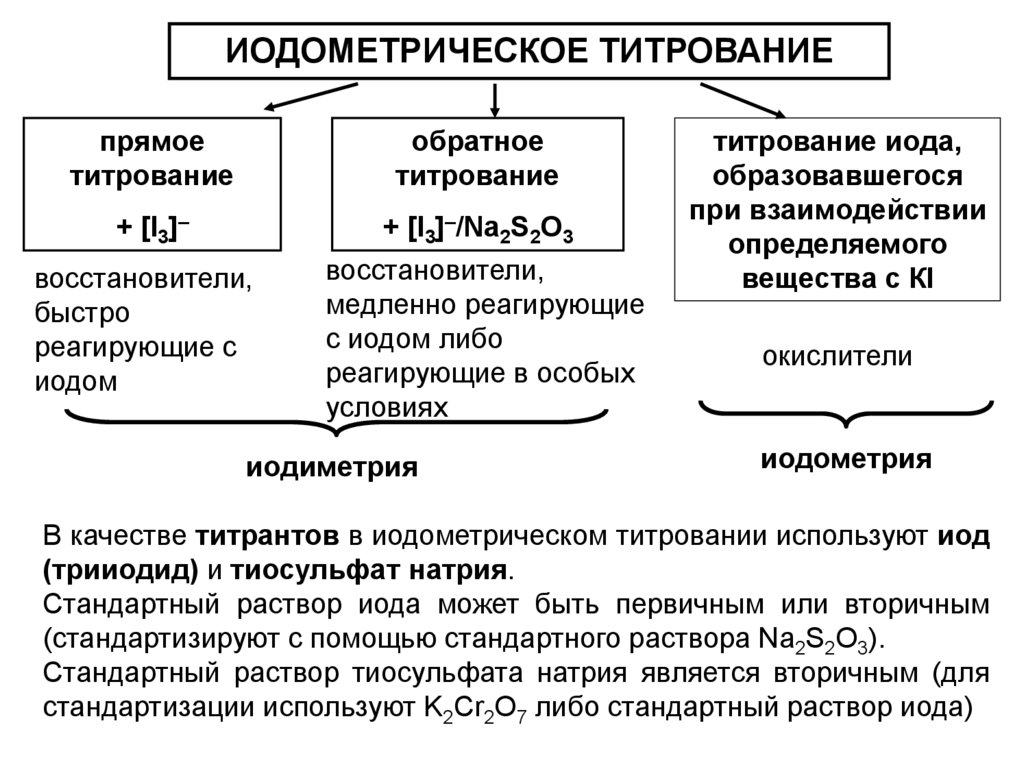
ИОДОМЕТРИЧЕСКОЕ ТИТРОВАНИЕпрямое
титрование
обратное
титрование
+ [I3]–
+ [I3]–/Na2S2O3
восстановители,
медленно реагирующие
с иодом либо
реагирующие в особых
условиях
восстановители,
быстро
реагирующие с
иодом
иодиметрия
титрование иода,
образовавшегося
при взаимодействии
определяемого
вещества с КI
окислители
иодометрия
В качестве титрантов в иодометрическом титровании используют иод
(трииодид) и тиосульфат натрия.
Стандартный раствор иода может быть первичным или вторичным
(стандартизируют с помощью стандартного раствора Na2S2O3).
Стандартный раствор тиосульфата натрия является вторичным (для
стандартизации используют K2Cr2O7 либо стандартный раствор иода)
29.
Конечную точку титрования в иодометрии обнаруживают:1. по собственной окраске иода
2. по исчезновению или появлению окраски иодкрахмального
комплекса
3. инструментальными методами.
Специфический индикатор в иодометрии – крахмал
Образует с иодом соединение синего цвета. Добавляют к титруемому
раствору с таким расчётом, чтобы время контакта его с иодом было
минимальным, т.к. длительный их контакт может привести к
нежелательным последствиям: окислению крахмала иодом, коагуляции
крахмала в присутствии иода, выпадению осадка иодкрахмального
комплекса
Поэтому если в титруемом растворе содержится иод (титрование
избытка иода при обратном титровании или титрование иода,
образовавшегося при окислении KI), то крахмал следует добавлять
незадолго до достижения конечной точки титрования, когда окраска
раствора станет бледно-жёлтой («соломенно-жёлтой»). Титрование в
данном случае заканчивают при исчезновении синей окраски иодкрахмального комплекса.
В случае прямого титрования раствором иода крахмал добавляют в
начале титрования. О наступлении конечной точки титрования
свидетельствует появление синей окраски соединения крахмала с иодом.
30.
Перманганатометрическое титрованиеТитриметрический метод анализа, основанный на использовании в
качестве титранта KMnO4.
Перманганатометрическое титрование чаще всего проводят в кислой
среде, реже – в нейтральной или щелочной. Для создания кислой
среды применяют серную кислоту.
МnO4– +8H+ + 5ē = Мn2+ +4H2O
МnO4–+ 2H2O + 3ē = МnО2 +4ОН–
МnO4– + ē = МnO42–
E0 = +1,51В, рН<4
E0 = +0,60В, рН=5–8
Е0 = + 0,54В, рН>9
Стандартный раствор KMnO4 является вторичным. Стандартизацию
растворов KMnO4 проводят каждый раз перед применением. В
качестве первичного стандартного вещества используют Na2C2O4, а
также Н2С2О4·2Н2О, Fe, As2O3 и другие вещества.
Индикаторы в перманганатометрическом титровании обычно не
используют. Конечную точку титрования обнаруживают по появлению
или исчезновению окраски KMnO4.
В перманганатометрии используют все способы титрования.
31.
Дихроматометрическое титрованиеТитриметрический метод анализа, основанный на применении в
качестве титранта K2Cr2O7
Сг2O72– + 14H+ + 6ē → 2Cr3+ + 7H2O
E0 = +1,33 В
Стандартный раствор K2Cr2O7 является первичным. Для
обнаружения конечной точки титрования обычно используют
окислительно-восстановительные индикаторы: дифениламин,
ферроин и др.
Применяют
для
определения
восстановителей,
некоторых
окислителей, а также ионов, образующих малорастворимые в воде
хроматы
или
дихроматы.
Как
и
перманганатометрию
дихроматометрию используется, главным образом, для определения
неорганических веществ.
Прямое дихроматометрическое титрование заключается в том, что
раствор определяемого восстановителя подкисляют серной кислотой
и титруют стандартным раствором K2Cr2O7. Если реакция окисления
протекает медленно, используют обратное титрование. Раствор
определяемого вещества кипятят с избытком стандартного раствора
K2Cr2O7, а затем избыток титранта, не вступивший в реакцию, титруют
стандартным раствором Fe2+ (соли Мора)
32.
Вопрос 4Сущность,
общая
характеристика
и
классификация
методов
осадительного
титрования. Кривые осадительного титрования.
Способы фиксирования конечной точки в
осадительном титровании (метод Мора, метод
Фольгарда,
метод
Фаянса).
Погрешности
титрования.
33.
Осадительное титрование – группа титриметрических методованализа, основанных на реакциях образования малорастворимых
соединений, выделяющихся из раствора в виде осадка
Требования
титровании:
к
реакциям,
используемым
в
осадительном
1. Должны протекать количественно (величина KS осадка для
бинарных электролитов не должна быть больше 10-8–10-10) и быстро
при обычных условиях, не сопровождаться образованием
пересыщенных растворов
2. Образующийся осадок должен иметь постоянный состав и не
должен загрязняться в процессе осаждения, поскольку очистить его,
как это делается в гравиметрии, нельзя
3. Должен существовать способ обнаружения конечной точки
титрования
34.
Среди всех методов осадительного титрования практическоезначение имеют аргентометрическое титрование, основанное на
образовании
малорастворимых
солей
серебра,
и
меркурометрическое титрование, в основе которого лежат реакции
образования малорастворимых соединений ртути (I).
Однако и данные методы, несмотря на большой круг возможных
определяемых объектов применяются нечасто. Это связано главным
образом с недостатками титрантов.
Так, нитрат серебра – достаточно дорогой реагент, а нитрат ртути (I)
– токсичный. Кроме того, стандартный раствор Hg2(NO3)2 содержит
еще и металлическую ртуть.
35.
Аргентометрическое титрованиеАргентометрическим титрованием называется титриметрический
метод анализа, основанный на образовании малорастворимых
соединений серебра
Используется для определения
цианидов, фосфатов и других ионов.
галогенидов,
тиоцианатов,
Основным титрантом является AgNO3. Как правило, готовится как
вторичный стандартный раствор. В качестве первичного
стандартного вещества для его стандартизации применяют
NaCl. Ионы Ag+ на свету быстро восстанавливаются примесями
органических веществ (пыль и др.) до металлического серебра,
поэтому раствор AgNO3 следует хранить в сосудах тёмного стекла с
притёртыми пробками в защищённом от света месте.
В качестве титрантов используют также тиоцианат аммония или
калия (NH4SCN или KSCN). Стандартные растворы этих веществ
являются вторичными. Для стандартизации применяют
стандартный раствор AgNO3.
36.
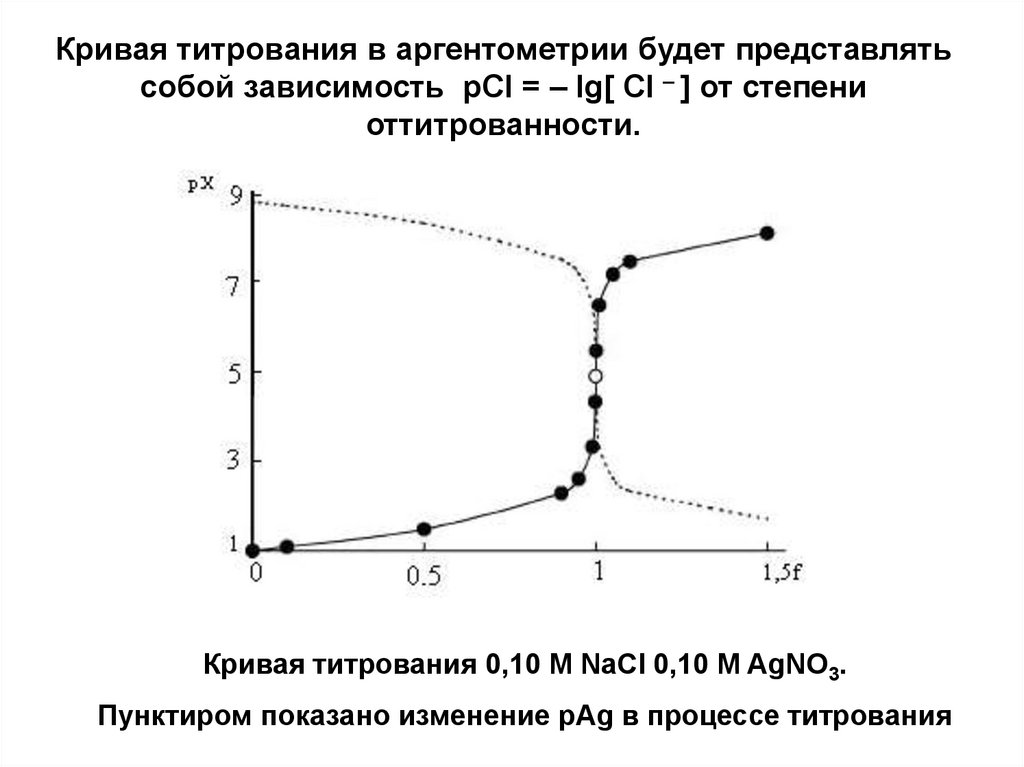
Кривая титрования в аргентометрии будет представлятьсобой зависимость pCl = – lg[ Cl – ] от степени
оттитрованности.
Кривая титрования 0,10 М NaСl 0,10 M AgNO3.
Пунктиром показано изменение pAg в процессе титрования
37.
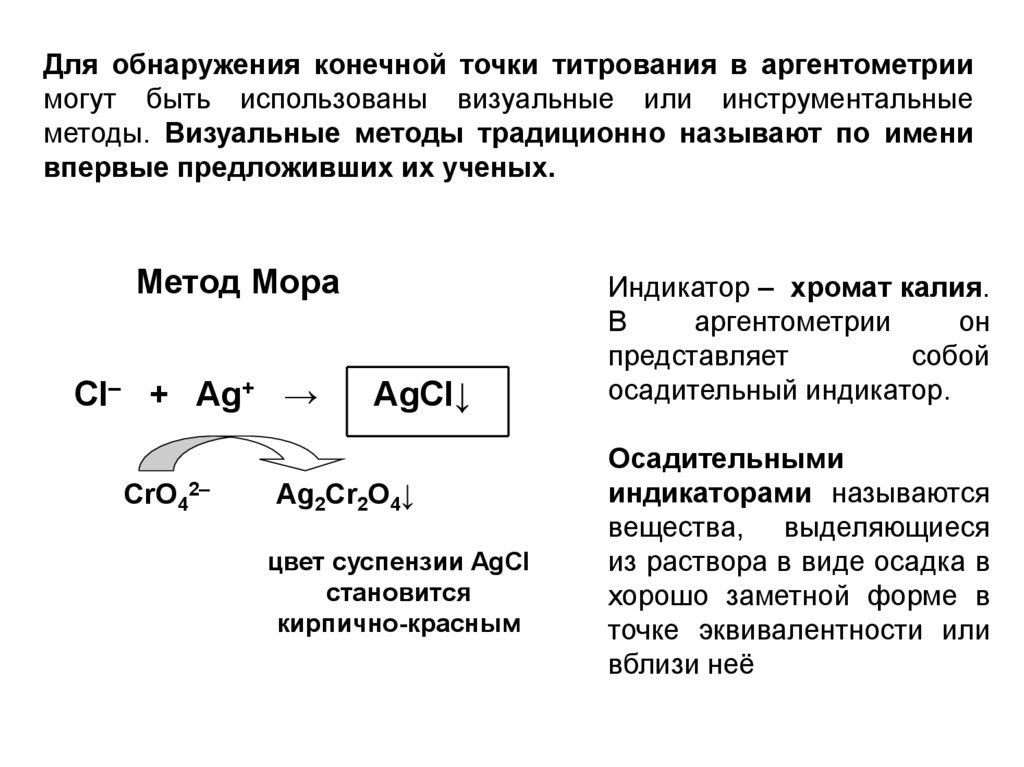
Для обнаружения конечной точки титрования в аргентометриимогут быть использованы визуальные или инструментальные
методы. Визуальные методы традиционно называют по имени
впервые предложивших их ученых.
Метод Мора
CI– + Ag+ →
CrO42–
AgCI↓
Ag2Cr2O4↓
цвет суспензии AgCI
становится
кирпично-красным
Индикатор – хромат калия.
В
аргентометрии
он
представляет
собой
осадительный индикатор.
Осадительными
индикаторами называются
вещества, выделяющиеся
из раствора в виде осадка в
хорошо заметной форме в
точке эквивалентности или
вблизи неё
38.
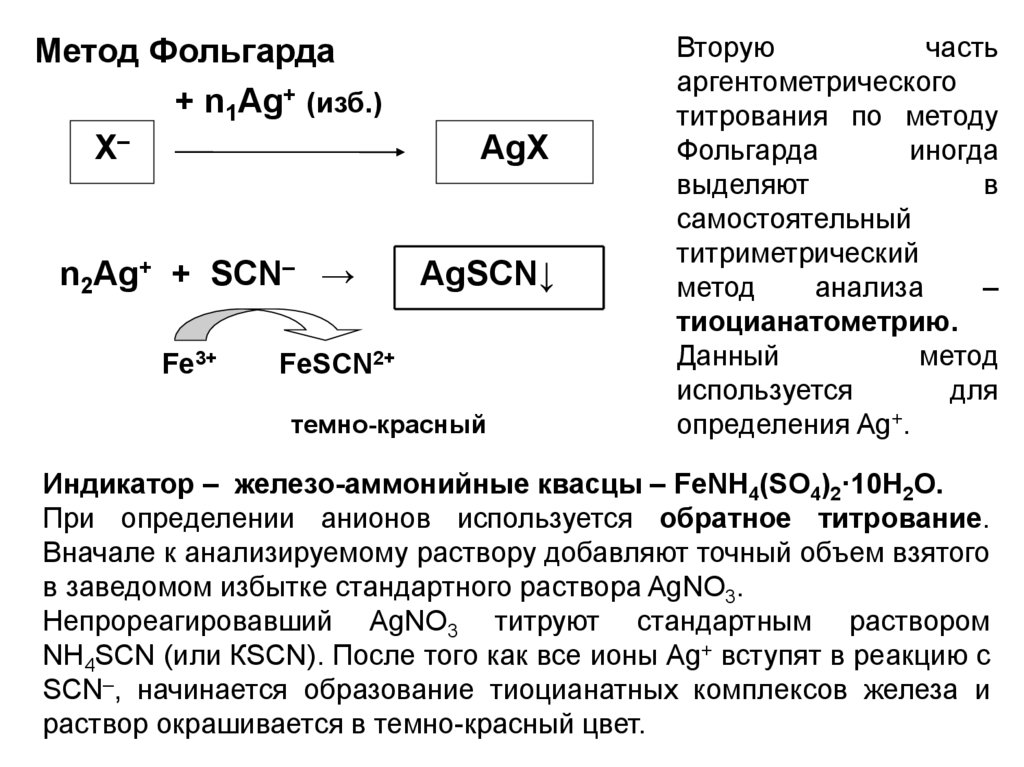
Метод Фольгарда+ n1Ag+ (изб.)
Х–
n2Ag+ + SCN– →
Fe3+
AgХ
AgSCN↓
FeSCN2+
темно-красный
Вторую
часть
аргентометрического
титрования по методу
Фольгарда
иногда
выделяют
в
самостоятельный
титриметрический
метод
анализа
–
тиоцианатометрию.
Данный
метод
используется
для
определения Ag+.
Индикатор – железо-аммонийные квасцы – FeNH4(SO4)2·10H2O.
При определении анионов используется обратное титрование.
Вначале к анализируемому раствору добавляют точный объем взятого
в заведомом избытке стандартного раствора AgNO3.
Непрореагировавший AgNO3 титруют стандартным раствором
NH4SCN (или КSCN). После того как все ионы Ag+ вступят в реакцию с
SCN–, начинается образование тиоцианатных комплексов железа и
раствор окрашивается в темно-красный цвет.
39.
Метод ФаянсаВ данном методе для обнаружения конечной точки титрования
используют адсорбционные индикаторы.
Адсорбционными индикаторами называются вещества, адсорбция
или десорбция которых осадком сопровождается изменением
окраски в точке эквивалентности или вблизи неё.
В качестве адсорбционных индикаторов в аргентометрическом
титровании чаще всего используют флуоресцеин и его
галогенопроизводные (дихлорфлуоресцеин, эозин, флоксин,
эритрозин), а также сульфофталеины (бромфеноловый синий),
родамины (родамин 6G) и другие вещества.
Большинство индикаторов имеют окрашенные анионы. Родамины
являются катионными красителями.
40.
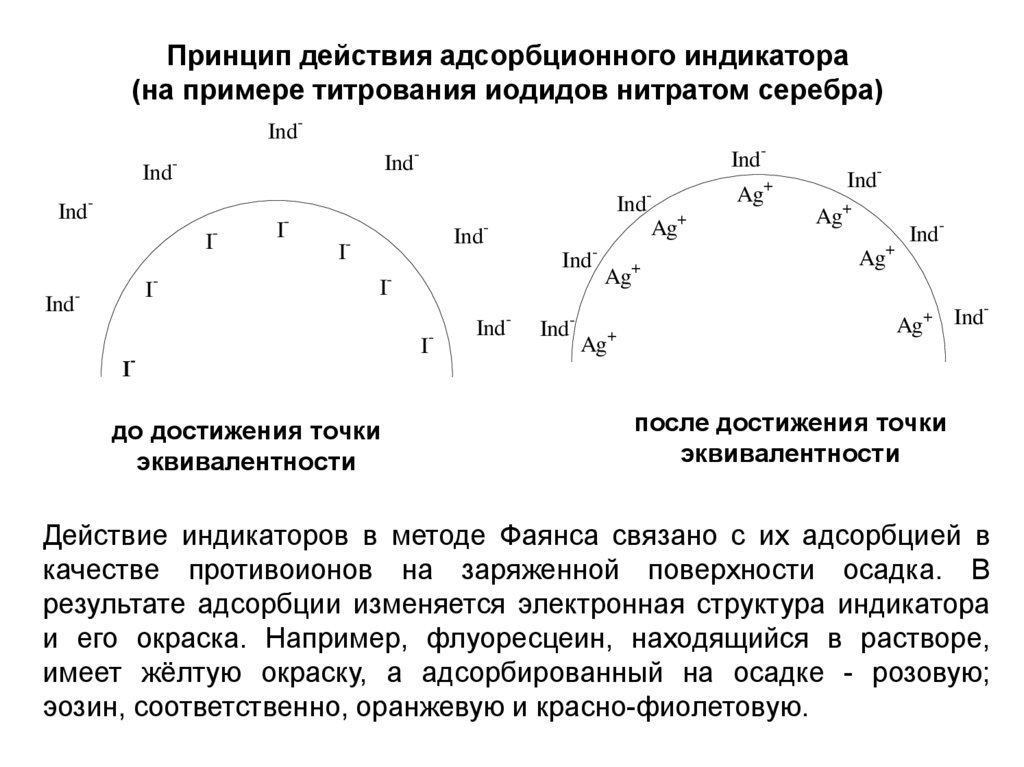
Принцип действия адсорбционного индикатора(на примере титрования иодидов нитратом серебра)
IndInd
IndI-
I
Ind-
Ind-
Ind-
-
-
I
IndAg+
Ind-
-
I
Ind-
-
I
-
I-
до достижения точки
эквивалентности
I-
Ind
Ag+
-
Ind
Ag+
+
Ag
IndAg+
Ag+
IndAg+ Ind
после достижения точки
эквивалентности
Действие индикаторов в методе Фаянса связано с их адсорбцией в
качестве противоионов на заряженной поверхности осадка. В
результате адсорбции изменяется электронная структура индикатора
и его окраска. Например, флуоресцеин, находящийся в растворе,
имеет жёлтую окраску, а адсорбированный на осадке - розовую;
эозин, соответственно, оранжевую и красно-фиолетовую.
41.
Погрешности титрованияКак и при любом титровании, здесь возможны случайные и
систематические погрешности. Систематическая погрешность связана
с несовпадением точки эквивалентности и конечной точки титрования.
Если образуется малорастворимое соединение типа АВ, то при
недотитровывании, когда f<1, погрешность отрицательна, при
перетитровывании, когда f>1, – положительна.
Формула для расчета отрицательной погрешности
[ Г ] КТТ [ Ag ] KTT [ Г ] KTT K S /[ Г ] KTT
ПТ 1 f
C0
C0
Формула для расчета положительной погрешности
[ Ag ] КТТ [ Г ] KTT
ПТ f 1
C0
[ Ag ] KTT K S , AgГ /[ Ag ] KTT
C0
Систематическая погрешность тем меньше, чем больше
концентрация титруемого вещества и чем ближе КТТ к точке
эквивалентности.




























 chemistry
chemistry








