Similar presentations:
Окислительно-восстановительное титрование. Лекция 4
1. Окислительно-восстановительное титрование
Лекция 41
2. План лекции
1. Принцип метода ОВ титрования,классификация методов редоксиметрии
2. Кривые ОВ титрования
3. Индикаторы ОВ титрования
4. Перманганатометрическое титрование
5. Дихроматометрическое титрование
6. Иодомерическое титрование
2
3. Принцип метода
• Окислительно-восстановительноетитрование (редоксиметрическое титрование)
основано на использовании окислительновосстановительных реакций, сопровождающихся переходом электронов и образованием
сопряженных редокс-пар.
z2 Red1 z1Ox2 z2Ox1 z1Red2
Окисление| Red1 z1e Ox1
Восстановление| Ox2 z2e Red 2
3
4.
• Чем выше значение Е0 (ОВ потенциала), темболее сильным является окислитель Ox.
Пример:
Ce4+
E0(Ce4+|Ce3+) = 1,44 B
MnO4– E0(MnO4–, H+|Mn2+) = 1,51 B
Cr2O72– E0(Cr2O72–, H+|Cr3+) = 1,33 B
• Чем меньше значение Е0, тем более сильным
является восстановитель Red.
Пример:
I–
E0(I2|I–) = 0,54 B
S2O32–
E0(S4O62–| S2O32–) = 0,09 B
4
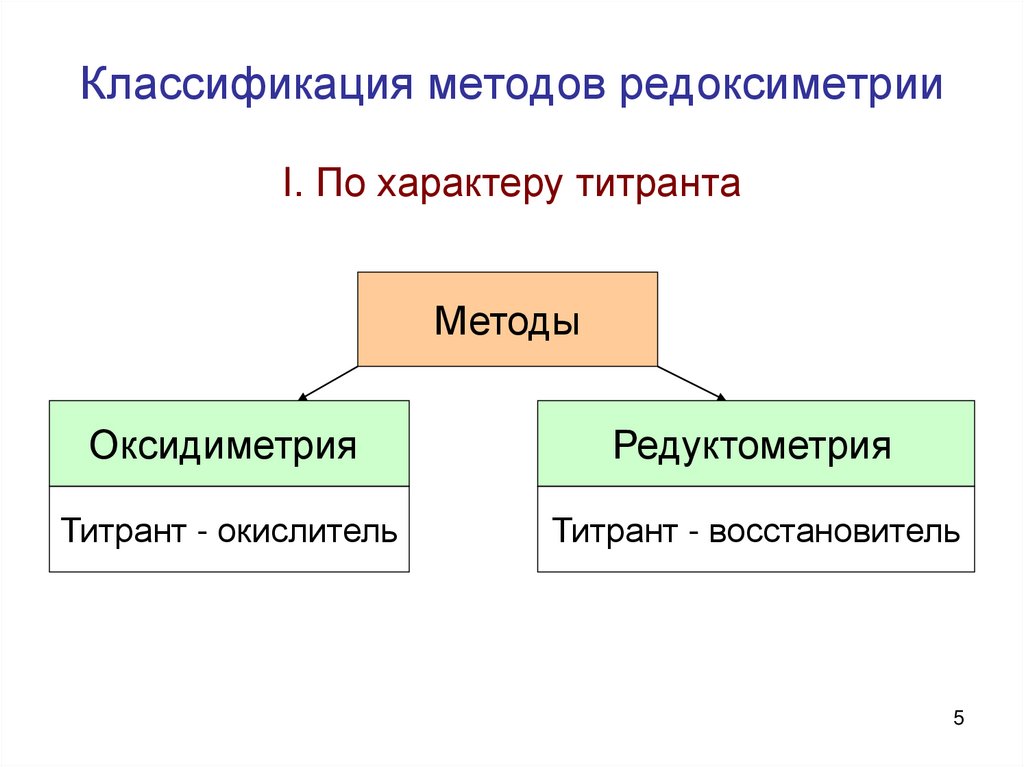
5. Классификация методов редоксиметрии
I. По характеру титрантаМетоды
Оксидиметрия
Редуктометрия
Титрант - окислитель
Титрант - восстановитель
5
6. Классификация методов редоксиметрии
II. По природе реагента• перманганатометрия (KMnO4)
• броматометрия (KBrO3)
• бромометрия (Br2)
• дихроматометрия (K2Cr2O7)
• иодатометрия (KIO3)
• иодиметрия (I2)
• иодометрия (KI, Na2S2O3)
• нитритометрия (NaNO2)
• цериметрия (Ce(SO4)2)
6
7. Условия проведения ОВ титрования
• Реакция должна протекать достаточнобыстро, чтобы равновесие устанавливалось
практически мгновенно.
Для
ускорения
достижения
равновесия
применяют:
• повышенную температуру,
• катализаторы
Например,
2
4
4
2
5C2O 2MnO 16 H 2Mn 10CO2 8H 2O
7
8. Условия проведения ОВ титрования
• Реакция должна протекать практически доконца.
0
0
0
E E1 E2 0,5 В
• В этом случае константа равновесия К ≥ 108 и
реакция протекает не менее, чем на 99,99%.
• Реакция должна протекать стехиометрически, побочные процессы должны быть
исключены.
• Конечная
точка
титрования
должна
определяться точно и однозначно либо с
индикатором, либо без индикатора.
8
9. Кривые ОВ титрования
Кривая ОВ титрования – это графическоевыражение изменения потенциала раствора Е
(В) в зависимости от объема прибавленного
титранта V (мл).
Е
V(Т)
• где Е – равновесный ОВ потенциал раствора в данный
момент титрования, В.
• V(T) – объем прибавленного титранта, мл.
9
10.
Расчетные кривые ОВ титрования строят для:– определения скачка титрования,
– подбора необходимого редокс-индикатора,
потенциал изменения окраски которого должен
попадать внутрь скачка на кривой ОВ титрования.
• При протекании ОВ реакции
z2 Red1 z1Ox2 z2Ox1 z1Red2
потенциал Е определяется по уравнению Нернста:
EOx Red E
0
Ox Red
0, 059 aOx
lg
z
aRed
• Наибольшее изменение потенциала
(скачок титрования) наблюдается в ТЭ.
раствора
Е
10
11.
Redz
e
Ox1
• Для полуреакции окисления
1
1
E1 E
0
Ox1 Red1
0, 059 aOx1
lg
z1
aRed1
• Для полуреакции восстановления Ox2 z2 e
E2 E
0
Ox2 Red 2
Red 2
0, 059 aOx2
lg
z2
aRed2
• До ТЭ расчет ведут по первой полуреакции,
отвечающей титруемому веществу, после ТЭ – по
второй полуреакции, отвечающей титранту.
• В ТЭ потенциал системы равен полусумме
потенциалов полуреакций с учетом коэффициентов:
z1 E10 z2 E20
EТЭ
z1 z2
11
12.
СтадияСтепень
титрования оттитрованности
до ТЭ
в ТЭ
после ТЭ
Потенциал Е
0<f<1
0, 059
f
E E
lg
z1
1 f
f=1
z1 E10 z2 E20
E
z1 z2
f>1
0, 059
E E
lg( f 1)
z2
0
1
0
2
Таблица 1. Формулы для расчета кривых редиксиметрического титрования
12
13.
Е, В1,50
• Кривые могут быть
несимметричными.
1,25
• Если z1 ≠ z2, ТЭ
смещена
относительно
центра кривой.
ТЭ
Скачок
титрования
1,00
• Положение ТЭ
определяется
числом
электронов,
передаваемых в
системе.
0,75
0,50
0
10
20
30 V, мл
13
Рис. 1. Кривая ОВ титрования раствора восстановителя раствором окислителя
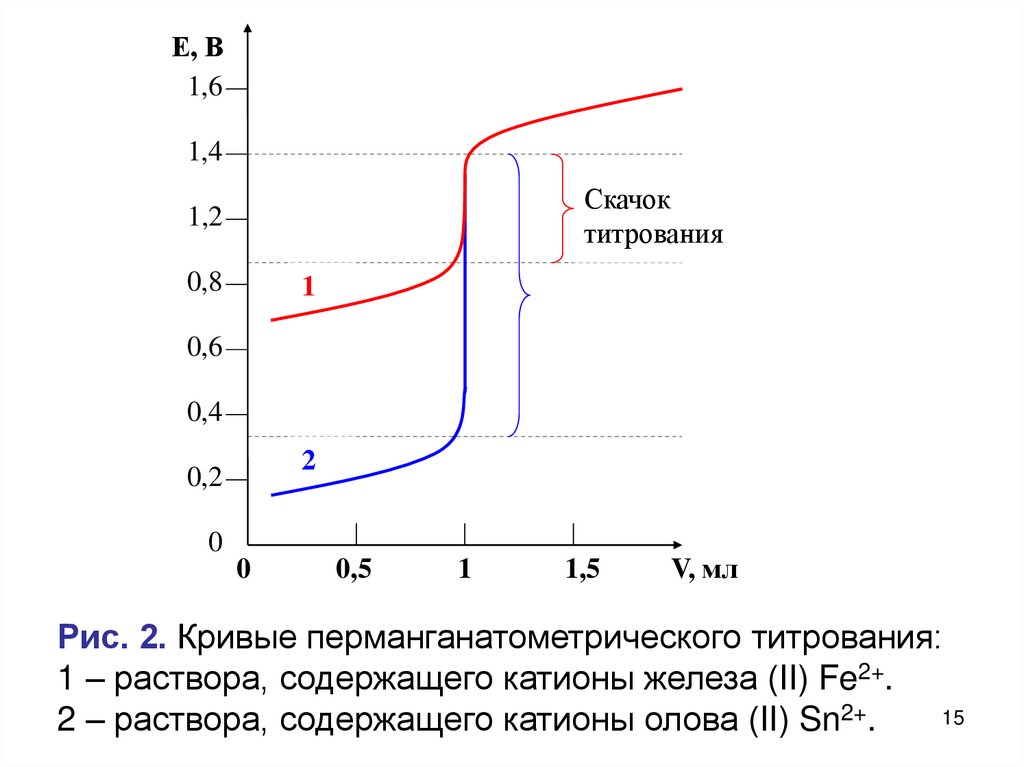
14.
Факторы, влияющие на высоту скачка титрования• Высота скачка тем больше, чем выше разность
стандартных потенциалов окислителя и восстановителя.
Например, при перманганатометрическом титровании
двух восстановителей разной силы: Fe2+ и Sn2+, высота
скачка будет выше случае олова (II).
0
0
0
EMn
1,51 0, 77 0, 74 В
2
2 E
2 E
Fe
MnO , H Mn
Fe2 Fe3
4
0
0
0
EMn
E
E
1,51 0,15 1,36 В
2
Sn 2
MnO , H Mn 2
Sn 2 Sn 4
4
• На высоту скачка титрования влияет число электронов,
участвующих в полуреакциях.
Наименьшая высота скачка в случае, когда z1 = z2 = 1.
• Высота скачка ОВ титрования не зависит от начальной
концентрации
титруемого
раствора.
Возможно
14
титрование разбавленных растворов (до 10-6 М).
15.
Е, В1,6
1,4
Скачок
титрования
1,2
0,8
1
0,6
0,4
2
0,2
0
0
0,5
1
1,5
V, мл
Рис. 2. Кривые перманганатометрического титрования:
1 – раствора, содержащего катионы железа (II) Fe2+.
15
2 – раствора, содержащего катионы олова (II) Sn2+.
16. Определение конечной точки титрования
1. Инструментальные методы:• потенциометрия
–
измерение
разности
электрохимических потенциалов в системе,
• амперометрия – измерение силы тока в растворе,
• фотометрия – измерение интенсивности поглощения
окрашенных растворов и др.
2. Визуальные методы:
• в
перманганатометрии
–
безындикаторное
титрование прекращают при появлении бледнорозовой, не исчезающей в течение минуты окраски,
которую дает избыток титранта;
• в иодометрии – специифический индикатор крахмал,
дающий синюю окраску с иодом;
• в хроматометрии и других методах – универсальные
редокс-индикаторы.
16
17. Индикаторы ОВ титрования
• Окислительно-восстановительныеиндикаторы
(редокс-индикаторы) – это органические красители,
которые при определенном потенциале раствора
окисляются или восстанавливаются с изменением
окраски.
• Окисленная и восстановленная формы индикатора
имеют различную окраску. Изменение цвета индикатора
происходит при определенном значении потенциала.
• Равновесие между окисленной и восстановленной
формами индикатора выражается уравнением:
IndOx ne Ind Red
IndOx – окисленная форма индикатора,
IndRed – восстановленная форма индикатора.
17
18.
Indne
Ind Red
Для полуреакции
Ox
ОВ
потенциал
редокс-пары
IndOx|IndRed
описывается уравнением Нернста:
E E
0
Ind
0, 059 [ IndOx ]
lg
n
[ Ind Red ]
• E0Ind – стандартный ОВ потенциал данной редокс-пары,
• [IndOx] – концентрация окисленной формы индикатора,
• [IndRed] – концентрация восстановленной формы
индикатора,
• n – количество, электронов в полуреакции.
18
19.
• Человеческий глаз воспринимает окраску растворатой формы индикатора, концентрация которой
примерно в 10 раз больше концентрации другой
формы индикатора.
[ IndOx ] 10
• Если [ Ind Red ] 1 окраска окисленной формы Ind.
[ IndOx ] 1
• Если [ Ind Red ] 10 окраска восстановленной формы.
• Потенциал раствора с окисленной формой Ind равен:
E E
0
Ind
0, 059 10
0, 059
0
lg EInd
z
1
z
• Потенциал раствора с восстановленной формой Ind:
E E
0
Ind
0, 059 1
0, 059
0
lg EInd
z
10
z
19
20.
• Интервал изменения окраски редокс-индикатораопределяется по уравнению:
E E
0
Ind
0, 059
z
• Наиболее резкое изменение окраски наблюдается при
равенстве концентраций Ох и Red форм:
E E
0
Ind
0, 059 1
0
lg EInd
z
1
• Интервал перехода окраски индикатора расположен
вокруг стандартного потенциала E0Ind и составляет:
• ΔЕ = 0,059 В (при n = 1)
• ΔЕ = 0,0295 В (при n = 2).
• Индикатор подбирают таким образом, чтобы его
интервал перехода полностью входил в пределы
скачка титрования.
20
21.
ИндикаторЕ0, В
Цвет индикатора
IndОх
IndRed
Нейтральный
красный
– 0,325 (рН 7)
0,240 (рН 0)
красный
бесцветный
Индигокармин
– 0,125 (рН 7)
0,291 (рН 0)
синий
бесцветный
Метиленовая синяя
0,011 (рН 7)
0,532 (рН 0)
синий
бесцветный
Толуиленовый синий
0,115 (рН 7)
0,601 (рН 0)
синий
бесцветный
Вариаминовый синий
0,71
фиолетовый
бесцветный
Дифениламин
0,76
фиолетовый
бесцветный
N
H
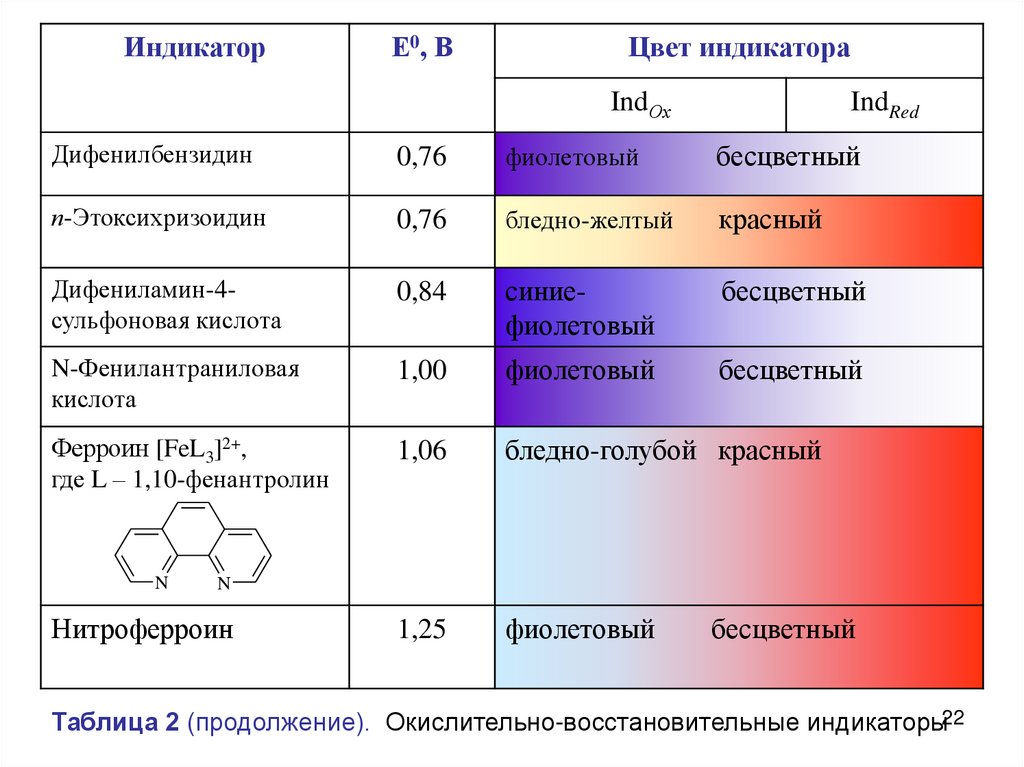
Таблица 2. Окислительно-восстановительные индикаторы
21
22.
ИндикаторЕ0, В
Цвет индикатора
IndОх
IndRed
Дифенилбензидин
0,76
фиолетовый
бесцветный
п-Этоксихризоидин
0,76
бледно-желтый
красный
Дифениламин-4сульфоновая кислота
0,84
синиефиолетовый
бесцветный
N-Фенилантраниловая
кислота
1,00
фиолетовый
бесцветный
Ферроин [FeL3]2+,
где L – 1,10-фенантролин
1,06
бледно-голубой красный
1,25
фиолетовый
N
N
Нитроферроин
бесцветный
Таблица 2 (продолжение). Окислительно-восстановительные индикаторы22
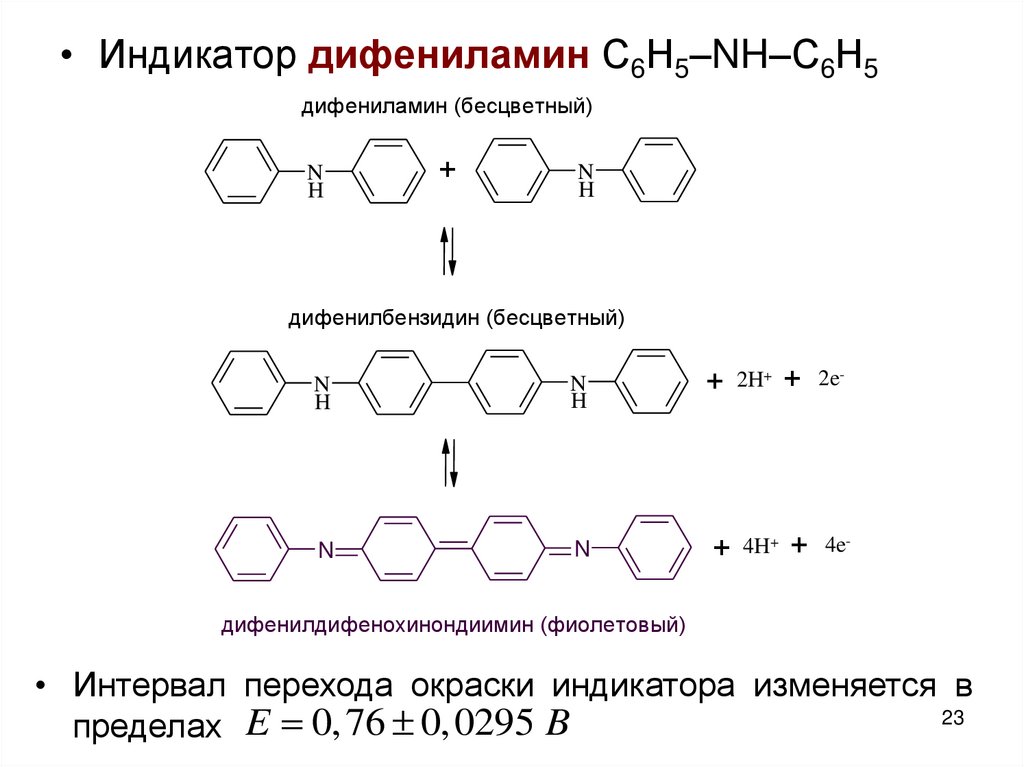
23.
• Индикатор дифениламин С6Н5–NH–С6Н5дифениламин (бесцветный)
N
H
+
N
H
дифенилбензидин (бесцветный)
N
H
N
H
N
N
+ 2H+ + 2e-
+ 4H+ + 4e-
дифенилдифенохинондиимин (фиолетовый)
• Интервал перехода окраски индикатора изменяется в
23
пределах E 0, 76 0, 0295 B
24. Классификация методов
I. По природе реагентаМетоды редоксиметрии
Перманганатометриеское титрование Титрант – KMnO4
Дихроматометрическое титрование
Титрант – K2Cr2O7
Иодометрическое титрование
Титрант – Na2S2O3
24
25. Перманганатометрическое титрование
• Перманганатометрическое титрование –метод ОВ титрования с использованием в
качестве титранта раствора перманганата
калия KMnO4.
• Перманганат калия KMnO4 – сильный
окислитель,
обладающий
интенсивной
фиолетово-малиновой окраской.
25
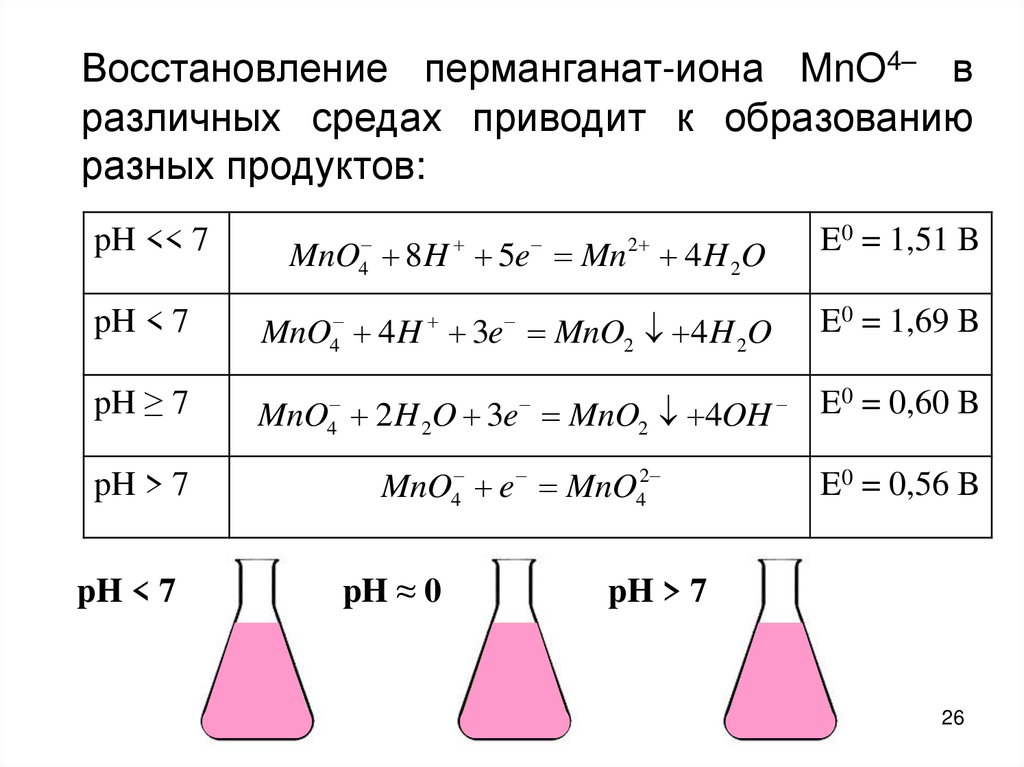
26.
Восстановление перманганат-иона MnO4– вразличных средах приводит к образованию
разных продуктов:
pH << 7
pH < 7
4
MnO 8H 5e Mn 4 H 2O
4
E0 = 1,69 B
MnO 4 H 3e MnO2 4 H 2O
pH ≥ 7
MnO 2 H 2O 3e MnO2 4OH
pH > 7
MnO4 e MnO42
pH < 7
E0 = 1,51 B
2
4
pH ≈ 0
E0 = 0,60 B
E0 = 0,56 B
pH > 7
26
27. Условия проведения перманганатометрического титрования
• ВлияниерН
среды.
Прямое
титрование
восстановителей чаще всего проводят в сильнокислой
среде (рН = 0-3), которую создают добавлением Н2SO4.
• Влияние температуры.
Температура комнатная.
Исключение: Реакция KMnO4 с щавелевой кислотой и
оксалатами идет при нагревании титруемого раствора.
• Фиксация конечной точки титрования.
• Перманганатометрия – безындикаторное титрование.
MnO4 8H 5e Mn 2 4 H 2O
2 MnO4 3Mn 2 H 2O 5MnO2 4 H
27
28.
• Используют С(1/5 KMnO4) = 0,05 – 0,1 моль/л. Такиеразбавленные растворы неустойчивы, концентрация
KMnO4 постепенно уменьшается из-за реакции:
4
4MnO 2 H 2O 4MnO2 O2 4OH
• Полученный раствор стандартизируют по щавелевой
кислоте H2C2O4∙2H2O или по оксалату натрия
Na2C2O4. Для этого титруют раствором KMnO4 навеску
щавелевой кислоты в горячем сернокислом растворе:
5H 2C2O4 3H 2 SO4 2KMnO4
10CO2 2MnSO4 K 2 SO4 8H 2O
• По
расходу
титранта
рассчитывают
точную
концентрацию раствора KMnO4. Стандартизированный
раствор хранят в склянке темного стекла.
28
29. Применение перманганатометрии
Перманганатометрическое титрование применяют для определения восстановителей:• пероксид водорода H2O2,
• нитрит натрия NaNО2,
• металлическое железо Fe и другие металлы,
• соединения Fe2+, As3+, Sb3+, Sn2+, Ti3+, Mn2+,
V4+ и др.,
• карбоновые кислоты R–COOH,
• сумма окисляющихся веществ в воде и почве
• и др.
29
30.
• Пероксид водорода определяют прямым титрованиемв сернокислой среде:
5H 2O2 2KMnO4 3H 2 SO4 2MnSO4 K 2 SO4 5O2 8H 2O
• Определение металлического железа.
Пробу, содержащую Fe, растворяют в разбавленной
H2SO4 при нагревании:
Fe H 2 SO4 FeSO4 H 2
Железо(II) Fe2+ определяют прямым титрованием в
присутствии серной кислоты:
10 FeSO4 2 KMnO4 8H 2 SO4
5Fe2 ( SO4 )3 2MnSO4 K 2 SO4 8H 2O
• Если проба содержит железо(III) Fe3+, то его
восстанавливают до железа(II) Fe2+ (восстановитель
SnCl2, Zn, др.), после чего железо(II) Fe2+ оттитровывают
раствором KMnO4.
30
31.
• В основе определения нитритов NO3– лежит реакция:5 NaNO2 2 KMnO4 3H 2 SO4
5 NaNO3 2MnSO4 K 2 SO4 3H 2O
Нитрит-ион NO3– неустойчив в кислой среде.
• Аликвоту перманганата калия KMnO4 с добавлением
серной кислоты титруют нейтральным раствором
нитрита натрия NaNО2 до исчезновения малиновой
окраски. Титрант – анализируемый раствор NaNО2.
• Определение окислителей обратным титрованием.
Определение дихромат-ионов
6 Fe2 Cr2O72 14 H 6 Fe3 2Cr 3 7 H 2O
5Fe 2 MnO4 8 H 5 Fe3 Mn 2 4 H 2O
31
32.
Достоинства перманганатометрии• титрование проводится без постороннего индикатора
– безындикаторный метод;
• титрование можно проводить в широком диапазоне
изменения рН раствора;
• высокое значение стандартного ОВ потенциала
редокс-пары позволяет определять большое число
восстановителей;
• KMnO4 доступен и сравнительно недорог.
Недостатки перманганатометрии
• невозможность
приготовления
раствора титранта по точной навеске;
стандартного
• нестабильность раствора KMnO4 при хранении.
32
33. Дихроматометрическое титрование
• Дихроматометрическое титрование – метод ОВтитрования с использованием в качестве титранта
раствора дихромата калия K2Сr2O7.
• Дихромат калия K2Сr2O7 – сильный окислитель,
используемый в кислой среде. В отличие от KMnO4
восстановление дихромата калия K2Сr2O7 приводит к
единственному продукту – катиону хрома(III) Cr3+.
Cr2O72 14 H 6e 2Cr 3 7 H 2O
• Стандартный ОВ потенциал редокс-пары
2
7
Сr2O , H | Cr
3
• при комнатной температуре равен E° = 1,36 В, поэтому
дихромат-ионы Сr2O72– способны окислять в кислой
среде целый ряд веществ-восстановителей.
33
34.
• Реальный ОВ потенциал редокс-парыСr2O72 , H | Cr 3
• сильно зависит от концентрации ионов водорода в
соответствии с уравнением Нернста:
2
14
[
Сr
O
][
H
]
0,059
0
2 7
E E
lg
3 2
6
[Cr ]
• Потенциал повышается с увеличением концентрации
[H+]. окислительная способность дихромат-ионов
Сr2O72– повышается с увеличением кислотности среды.
Дихроматометрическое титрование обычно проводят в
сильнокислых растворах:
– серная кислота H2SO4,
– ортофосфорная кислота H3PO4,
– хлороводородная кислота HCl.
34
35.
• Титрант метода – водный раствор дихромата калия cC(K2Сr2O7) = 0,1 моль/л.
• Титрант готовят по точной навеске K2Сr2O7, дважды
перекристаллизованного из воды и высушенного при
Т = 150-200°С. При хранении в закрытой емкости в
темном месте раствор K2Сr2O7 стабилен и не
изменяется в течение длительного времени.
• fэкв (K2Сr2O7) = 1/6. Молярная масса эквивалента:
M ( K 2Cr2O7 ) 294
M (1 6 K 2Cr2O7 )
49 г / моль
6
6
• Определение конечной точки титрования проводят в
присутствии редокс-индикаторов:
– дифениламина,
– дифениламинсульфоновой кислоты,
– N-фенилантраниловой кислоты.
35
36. Применение дихроматометрии
Прямым титрованием определяют восстановители:• соединения железа(II) (ферроцианиды [Fe(CN)6]4–),
• сульфиты,
• иодиды,
• арсениты,
• аскорбиновая кислота,
• метанол,
• сумма окисляющихся веществ в воде и почве и т.д.
2. Обратным титрованием определяют окислители:
• нитраты,
• хлораты,
• перманганаты и др.
1.
36
37.
1. Определение соединений железа(II) ведут прямымтитрованием аликвоты анализируемого раствора
стандартным раствором K2Cr2O7 в кислой среде:
6 Fe2 Cr2O72 14 H 6 Fe3 2Cr 3 7 H 2O
2. Определение нитратов проводят обратным титрованием. К аликвоте анализируемого раствора,
содержащего
нитрат-ионы
NO3–,
прибавляют
избыток титрованного раствора железа(II):
3Fe2 NO3 4 H 3Fe3 NO 2 H 2O
Избыток
непрореагировавшего
железа(II)
оттитровывают стандартным раствором K2Cr2O7 , в
присутствии ортофосфорной кислоты:
2
6 Feизбыток
Cr2O72 14 H 6 Fe3 2Cr 3 7 H 2O
37
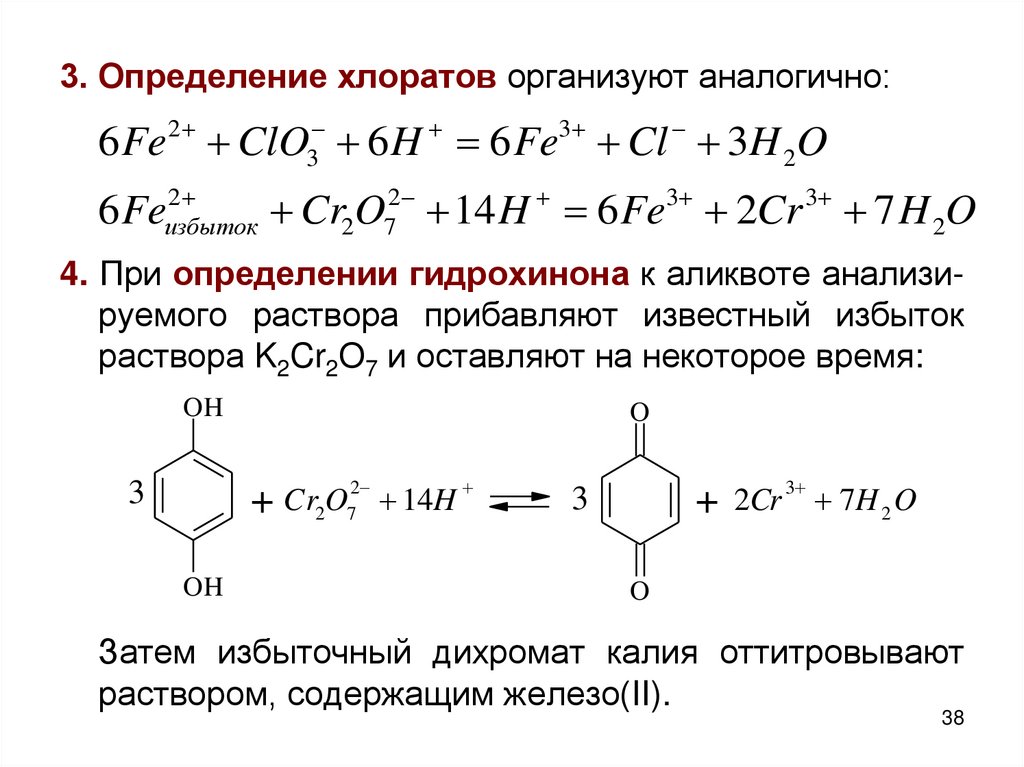
38.
3. Определение хлоратов организуют аналогично:6 Fe2 ClO3 6 H 6 Fe3 Cl 3H 2O
2
6 Feизбыток
Cr2O72 14 H 6 Fe3 2Cr 3 7 H 2O
4. При определении гидрохинона к аликвоте анализируемого раствора прибавляют известный избыток
раствора K2Cr2O7 и оставляют на некоторое время:
OH
O
2
Cr
O
14
H
+ 2 7
3
OH
3
2
Cr
7H 2 O
+
3
O
Затем избыточный дихромат калия оттитровывают
раствором, содержащим железо(II).
38
39.
Достоинства дихроматометрии• стандартный раствор титранта K2Cr2O7 готовится по
точной навеске и не требует последующей
стандартизации;
• титрант стабилен при длительном хранении;
• титрование можно проводить в солянокислой среде.
Недостатки дихроматометрии
• меньший по сравнению с перманганат-ионом
стандартный ОВ потенциал редокс-пары, более
ограниченная
возможность
определения
восстановителей;
• менее удобная фиксация КТТ, необходимость
использования редокс-индикаторов.
39
40. Иодометрическое титрование
• Иодометрическое титрование – метод ОВ титрования,в
котором
определяют
окислители
косвенным
титрованием заместителя (иод), с использованием в
качестве титранта стандартного раствора тиосульфата
натрия Na2S2O3.
Не путать с иодиметрическим титрованием!
• Иодиметрическое титрование – метод ОВ титрования,
в котором определяют восстановители прямым
титрованием с использованием в качестве титранта
стандартного раствора иода.
I
2
e
2
I
• Иод (I2) – окислитель средней силы.
2
E° (I2/I–) = 0,536 В.
• Раствором иода можно оттитровать только наиболее
сильные восстановители (H2S, SO2, Na2S2O3, SnCl2).
40
41.
• Иодид-ион (I–) – эффективный восстановитель. Однакорастворы иодида калия KI неустойчивы и окисляются
кислородом воздуха.
Метод косвенного титрования заместителя
• К анализируемому раствору окислителя прибавляют
2 I 2e I 2
избыток KI:
Выделившейся заместитель (иод) эквивалентен количеству затраченного окислителя. Иод оттитровывают
стандартным раствором тиосульфата натрия:
I 2 2 Na2 S2O3 2 NaI Na2 S4O6
2 S 2O32 2e S 4O62
тиосульфат-ион
тетратионат-ион
Потенциал данной редокс-пары E° = 0,09 В. Реакция
может протекать в широком интервале рН (рН = 2-10).
41
42.
• Количество израсходованного титранта (Na2S2O3)эквивалентно количеству образовавшегося иода
количеству определяемого окислителя:
n(1 4 O2 ) n(1 2 I 2 ) n(1 1 Na2 S2O3 )
• Титрантом метода является стандартный раствор
тиосульфата натрия Na2S2O3. Растворы Na2S2O3 при
хранении разлагаются с выделением свободной серы
(раствор мутнеет):
2
2
2
S
O
O
2
SO
• в кислой среде:
2 3
2
4 2S
• на воздухе: S 2O32 H HSO3 S
42
43. Определение конечной точки титрования
• Молекулы I2 вступают во взаимодействие с иодидионами с образованием трииодидного комплекса:I 2 I [ I 3 ]
• Индикатор – свежеприготовленный 1%-ный раствор
крахмала образует с [I3–] темно-синее адсорбционное
соединение.
• Иодкрахмальная
реакция
отличается
высокой
чувствительностью: голубая окраска заметна при
концентрации иода С = 10–5 моль/л, благодаря этому
КТТ определяется очень четко.
• Крахмал не следует добавлять в раствор с большой
концентрацией иода, так как происходит необратимое
окисление индикатора и результаты искажаются.
43
44. Применение иодометрии
Метод иодометрии применяют для определения
следующих окислителей:
пероксид водорода Н2О2,
пероксиды натрия Na2О2, магния MgО2, бария Ва2О2,
соединения медь(II),
дихромат калия K2Cr2O7,
перманганат калия KMnO4,
арсенат натрия, иод и т.д.
сумма окисляющихся веществ в воде и почве и т.д.
44
45.
1.Пероксид
водорода
определяют
методом
косвенного титрования заместителя (иода) в кислой
среде на основе реакций:
H 2O2 2KI H 2 SO4 I 2 K 2 SO4 2H 2O
I 2 2 Na2 S2O3 2 NaI Na2 S4O6
• Концентрация пероксида водорода рассчитывается
согласно соотношению:
n(1 2 H 2O2 ) n(1 2 I 2 ) n(1 1 Na2 S2O3 )
2. Определение содержания меди(II) аналогично:
2Cu 2 4 I 2CuI I 2
n(1 2 Сu 2 ) n(1 2 I 2 ) n(1 1 Na2 S 2O3 )
45
46. Определения растворенного в воде кислорода методом Винклера
• Этот метод применяют в контроле состоянияводоемов, так как недостаток растворенного
кислорода ведет к гибели рыбы и заболачиванию
водоемов.
4MnSO4 O2 8KOH 2H 2O 4Mn(OH )3 K2 SO4
2Mn(OH )3 2 KI 3H 2 SO4 2MnSO4 I 2 K2 SO4 6 H 2O
• Выделившийся иод титруют стандартным раствором
тиосульфата натрия до светло-желтой окраски.
I 2 2 Na2 S2O3 2 NaI Na2 S4O6
• К раствору добавляют несколько капель крахмала, и
титруемый раствор тотчас синеет. Продолжают
титровать раствор до исчезновения синей окраски.46
47.
Иодометрическим методом определяюторганические восстановители:
– альдегиды,
– кетоны,
– спирты,
– азот- и серосодержащие соединения и др.
Примеры определяемых веществ:
формальдегид
HCHO I 2 3KOH HCOOK 2KI H 2O
ацетон
CH3COCH 3 3I 2 4KOH CHI 3 CH 3COOK 3KI 3H 2O
Аналогично определяют глюкозу, аскорбиновую
кислоту, тиомочевину, некоторые витамины.
47
48.
• Определение сильных кислот основано на реакциикислоты с избытком иодида и иодата:
5KI KIO3 6HCl 3I 2 6KCl 3H 2O
• Выделяющийся иод оттитровывают Na2S2O3.
Иодометрия – наиболее универсальный из методов
редоксметрии.
Достоинства иодометрии
• Высокая скорость установления равновесия в системе
I2/2I–, отсутствие побочных реакций;
• Высокая чувствительность специфического индикатора
– крахмала;
• Универсальность метода, возможность определять
содержание окислителей, восстановителей, а также
некоторых веществ, не обладающих ОВ свойствами,
48
например, кислот.










































 chemistry
chemistry








