Similar presentations:
Перманганатометрия. Окислительно-восстановительное титрование. (Лекция 8)
1. Окислительно-восстановительное титрование
Окислительновосстановительноетитрование
2. План
Сущность метода ОВТКлассификация методов ОВТ
Требования к реакциям
Кривые окислительно-восстановительного
титрования
Перманганатометрия
Возможности метода
3. Сущность метода
Red1 + Ox2 ⇄ Ox1 + Red2или
Ox1 + Red2 ⇄ Red1 + Ox2
4. Классификация
Оксидиметрия – титрантом является раствор окислителя:- перманганатометрия (KMnO4);
- дихроматометрия (K2Cr2O7);
- броматометрия (KBrO3);
- цериметрия (раствор солей церия(IV));
- йодхлорметрия (ICl);
- нитритометрия (NaNO2).
Редуктометрия – титрантом является раствор восстановителя:
- титанометрия (раствор солей титана(III));
- феррометрия (FeSO4);
- аскорбинометрия (С6Н8О6).
5. Требования к реакциям
8(
K
1
0
)
р
0
0
.
0
0
(E
E
)
n
1
2
1
2
(
E
)
n
1
2
1
2
l
g
K
,K
0
5
9
10ри1200р0,59
Требования к реакциям
Реакции должны протекать практически до конца.
- стандартные ОВ потенциалы редокс-пар, участвующих
в реакции;
n1 и n2 – количество перераспределяемых электронов.
6.
Rа
R
T
0
O
x
E
l
n
F
R
e
d
0n
ET
R
FE
, n59lg[R
0
O
xed]
0
Реальные потенциалы редокс-пар
рассчитывают по уравнению Нернста:
- стандартный окислительно-восстановительный потенциал
данной редокс-пары;
- количество электронов, принимающих участие в ОВР;
- универсальная газовая постоянная (8,314 Дж·моль-1 К-1);
- постоянная Фарадея (96500 Кл/моль);
- температура по шкале Кельвина (К);
aOx и aRed - активность окисленной и восстановленной
7.
Реакции должны протекать достаточно быстро.Конечная точка титрования должна определяться
четко и однозначно.
8.
[I
n
d
]
,E
0
5
9
E
l
g
n
0,n59
00R
O
xed
Если схематично обозначить окисленную и
восстановленную формы индикатора в виде IndOx и
IndRed, то полуреакцию, отвечающую изменению
окраски можно представить:
IndOx + nē ⇄ IndRed
ОВ потенциал редокс-пары IndOx/IndRed описывается
уравнением Нернста:
интервал перехода окраски индикатора:
9.
00
n
E
n
E
o
x
r
e
d
1
2
E
1
Кривые окислительно-восстановительного титрования
Кривая титрования в редокс-метрии – это графическое изображение изменения
потенциала от объема прибавленного титранта.
До точки эквивалентности потенциал рассчитывают по определяемой редокс-паре.
В точке эквивалентности потенциал раствора рассчитывают по формуле:
После точки эквивалентности потенциал раствора
рассчитывают по редокс-паре титранта.
10.
Кривая титрования железа(II) калия перманганатом100,0 мл 0,1 н. раствора FeSO4 титруют 0,1 н. раствором
KMnO4 с концентрацией ионов водорода [H+]=1 моль/л.
5
1
Fe2+ - ē ⇄ Fe3+
MnO4- + 8 H+ + 5ē ⇄ Mn2+ + 4 H2O
5 Fe2+ + MnO4- + 8 H+ ⇄ 5 Fe3+ + Mn2+ + 4 H2O
11.
00F
E
M
n
O
E
e3 /F
2
4
e2 E
/
M
n
3
0
,
5
9
[
F
e
]1
, п1E0ox1 п2E
0
70red
l 51 1,g 072E
038,7 0,159lg0,19 07 0,59 3 0,94
8
[
M
n
O
]
[
H
,E
0
5
9
4
1,5 lgE
2
,1,5 59lg0,1 8 1,475
0
= +0,77 В
До ТЭ
= +1,51 В
Точка начала скачка титрования:
ТЭ
После ТЭ:
Точка конца скачка титрования:
Скачок на кривой титрования находится в пределах потенциала 0,94-1,48 В.
12. Кривая титрования железа(II) калия перманганатом
,11
6
Е
,м
В
,4
,1
1
2
,0
0
,0
8
,64
06
08
01
01
2
01
4
01
6
01
8
02
0V
2
0
,м
л
13.
В сильнокислой среде в присутствии серной кислоты:MnO4- + 8 H+ + 5ē
5 Mn2+ + 4 H2O
Е˚MnO4-, Н+/ Mn2+ = 1,51 В
fэ = 1/5
В нейтральной:
MnO4- + 2 H2O + 3ē
3 MnO2↓ + 4 OHЕ˚MnO4-/MnO2↓, OH- = 0,59 В
fэ = 1/3
В щелочной среде:
MnO4- + ē MnO42Е˚MnO4-/ MnО42- = 0,56 В
fэ = 1
14.
В КТТ розовая окраска частично обесцвечиваетсявследствие реакции:
2 MnO4- + 3 Mn2+ + 2 H2O 5 MnO2↓ + 4 H+
реакция Гаярда
15.
4 MnO4- + 2 H2O 4 MnO2 + 3 O2↑ + 4 OH-16. Стандартизацию раствора КМnO4
проводят поNa2C2O4, H2C2О4·2H2О, (NH4)2C2O4, As2O3, Fe(мет.),
К4[Fe(CN)б], соли Мора (NH4)2SO4·FeSO4·6Н2О.
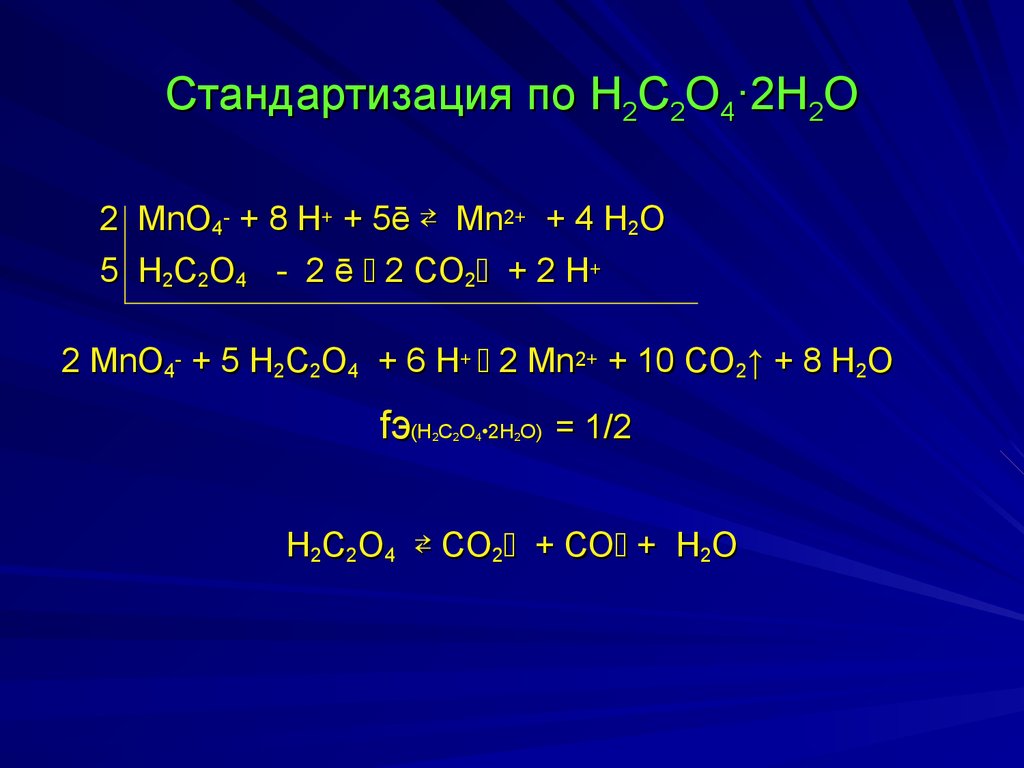
17. Стандартизация по H2C2О4·2H2О
2 MnO4- + 8 H+ + 5ē Mn2+ + 4 H2O5 H2C2O4 - 2 ē 2 CO2 + 2 H+
2 MnO4- + 5 H2C2O4 + 6 H+ 2 Mn2+ + 10 CO2↑ + 8 H2O
fэ(H C О •2H О) = 1/2
2
2
4
2
H2C2О4 CO2 + СО + H2O
18. Возможности метода
восстановители: ионы низших степеней окисления(Fe2+, Cr2+, Sn2+, AsIII и др.), анионы (Cl-, Br-, S2-, SO32-,
SCN-, NO2- и др.), поли- и оксикарбоновые кислоты,
альдегиды, сахара и др. чаще прямым способом
титрования;
окислители: Fe3+, CeIV, CrVI, BrO3-, S2O82- и др.
способом обратного титрования;
вещества, не обладающие окислительновосстановительными свойствами
(индифферентные вещества): Ba2+, Ca2+, Sr2+, Zn2+
способом обратного и заместительного титрования.
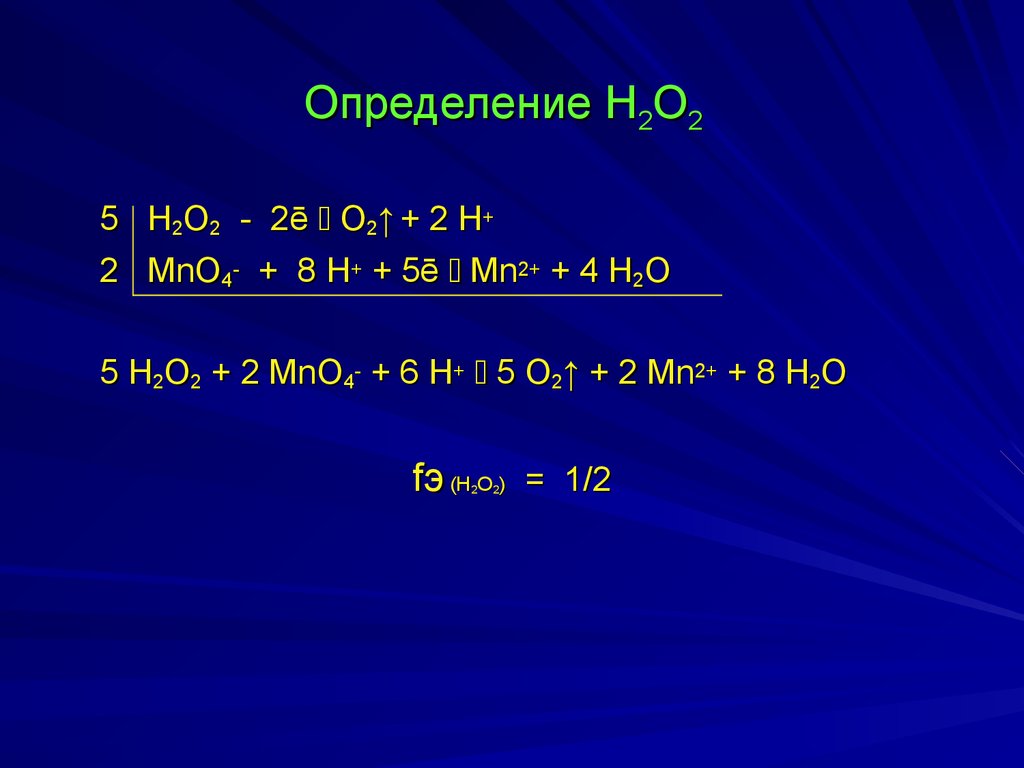
19. Определение Н2О2
5 Н2О2 - 2ē О2↑ + 2 Н+2 MnO4- + 8 H+ + 5ē Mn2+ + 4 H2O
5 H2O2 + 2 MnO4- + 6 H+ 5 O2↑ + 2 Mn2+ + 8 H2O
fэ (Н О ) = 1/2
2
2
20. Определение железа(II) в соли Мора (NH4)2Fe(SO4)2∙6H2O или FeSO4∙7H2O
51
Fe2+- ē ⇄ Fe3+
MnO4- + 8 H+ + 5ē ⇄ Mn2+ + 4 H2O
5 Fe2+ + MnO4- + 8 H+ ⇄ 5 Fe3+ + Mn2+ + 4 H2O
fэ (Fe) = 1
21.
Преимущества метода:Калия перманганат доступный и относительно недорогой
реагент.
КМnO4 отличается высоким редокс-потенциалом, является
сильным окислителем.
Безындикаторное титрование.
Титрование проводят преимущественно в кислой среде, но
возможно проведение в любых средах.
Недостатки:
Титрант готовят по установленному титру.
Растворы КМnO4 неустойчивы при хранении. Необходимо
проверять титр.
Титрование не рекомендуется проводить в присутствии Н Cl.
Иногда необходимо нагревание, а это недопустимо при
титровании термолабильных веществ.



















 physics
physics chemistry
chemistry








