Similar presentations:
Осадительное титрование
1.
ОСАДИТЕЛЬНОЕТИТРОВАНИЕ
2.
Осадительное титрование•серебра:
Ag+ + Br- → AgBr↓
•ртути:
•бария:
•свинца:
•цинка:
3Zn2+
Hg22+ + 2Cl- → Hg2Cl2↓
Ba2+ + SO42- → BaSO4↓
Pb2+ + CrO42- → PbCrO4↓
2K+ + 2[Fe(CN)6]2- →
Zn3K2[Fe(CN)6]2↓
3.
Осадительное титрованиеАргентометрия
Ag+ + Hal- → AgHal↓
Меркурометрия
Hg22+ + 2Hal- → Hg2Hal2↓
4.
Осадительное титрованиеАргентометрия
Метод Мора
Hal- + Ag+ → AgHal↓ (белый)
ПР(AgCl) = 1,78·10-10
S(AgCl) = 1,2·10-5 моль/л.
CrO42- + 2Ag+→ Ag2CrO4↓ (кирпично-красный)
ПР(Ag2CrO4) = 2,1·10-12
S(Ag2CrO4) = 8,1·10-5 моль/л.
5.
Осадительное титрованиеАргентометрия
Метод Мора
•Условия титрования:
2Ag2CrO4↓ + 2Н+ → 4Ag+ + Cr2O7 2- + H2O
Ag+ + OH- → AgOH↓
2AgOH↓ → Ag2O↓ + H2O
•Возможности метода:
NH+ + H2O ↔ NH3·H2O + H+
6.
Осадительное титрованиеАргентометрия
Метод Фольгарда
(тиоцианатометрия, роданометрия)
Ag+ + NCS– → AgNCS↓
Fe3+ + 3NCS– → [Fe(NCS)3]
•Условия титрования:
Fe3+ + H2O ↔ FeOH2+ + H+
2Fe3+ + 2I– → 2Fe2+ + I2
AgCl↓ + NCS– → AgNCS↓ + Cl–
7.
Осадительное титрованиеАргентометрия
Метод Фаянса-Ходакова
HInd ↔ H+ + Ind–
Ag+ + I– → AgI↓
•первичный адсорбционный слой:
m[AgI]·nI–
•вторичный (внешний) адсорбционный слой:
{m[AgI]·nI– ·(n – x)K+}x–
8.
Осадительное титрованиеАргентометрия
Метод Фаянса-Ходакова
•первичный адсорбционный слой:
m[AgI]·nAg+
•вторичный (внешний) адсорбционный слой:
{m[AgI]·nAg+ ·(n – x)NO3-}x+
9.
Осадительное титрованиеМеркурометрия
Hg22+ + 2Cl- → Hg2Cl2↓
Hg22+ + 2Br- → Hg2Br2↓
Hg22+ + 2I- → Hg2I2↓
Титрант метода:
Hg2+ + Hg → Hg22+
10.
Осадительное титрованиеМеркурометрия
Индикаторы:
3Hg22+ + 2[Fe(NCS)3] → 3[Hg(NCS)2] + 2Fe3+
•дифенилкарбазон (1%-ный раствор в 95%-ном этаноле)
C6H5-NH-NH-C-N=N-C6H5
║
O
11.
Методы комплексообразования (комплексиметрия)Меркуриметрическое титрование
Hg2+ + 2Cl– → [HgCl2]
Индикаторы:
Na2[Fe(CN)5NO] → 2Na+ + [Fe(CN)5NO]2–
Hg2+ + [Fe(CN)5NO]2– → Hg[Fe(CN)5NO]↓
12.
Методы комплексообразования (комплексиметрия)Меркуриметрическое титрование
Индикаторы:
•дифенилкарбазид (1) или продукт его окисления –
дифенилкарбазон (2):
C
H
N
H
-N
H
6
5
C
H N
H
-N
H
65
O
O
C
H
6
5
N
H
-N
H
1
C
H
6
5
N
=
N
2
13.
Методы комплексообразования (комплексиметрия)Меркуриметрическое титрование
Определение хлорид- и бромид-ионов:
Hg2+ + Cl- → [HgCl]+
[HgCl]+ + Cl- → [HgCl2]
Hg2+ + [HgCl2] → 2[HgCl]+
Определение йодид-ионов:
Hg2+ + 4I– → [HgI4]2–
[HgI4]2– + Hg2+ → 2HgI2
14.
Методы комплексообразования (комплексиметрия)Меркуриметрическое титрование
Определение тиоционат-ионов:
2NCS– + Hg2+ → [Hg(NCS)2]
3Hg22+ + 2[Fe(NCS)3] → 3[Hg(NCS)2] +
2Fe3+
Определение солей ртути (ІІ):
Hg2+ + 2NCS– → [Hg(NCS)2]
Fe3+ + 3NCS– → [Fe(NCS)3]
15.
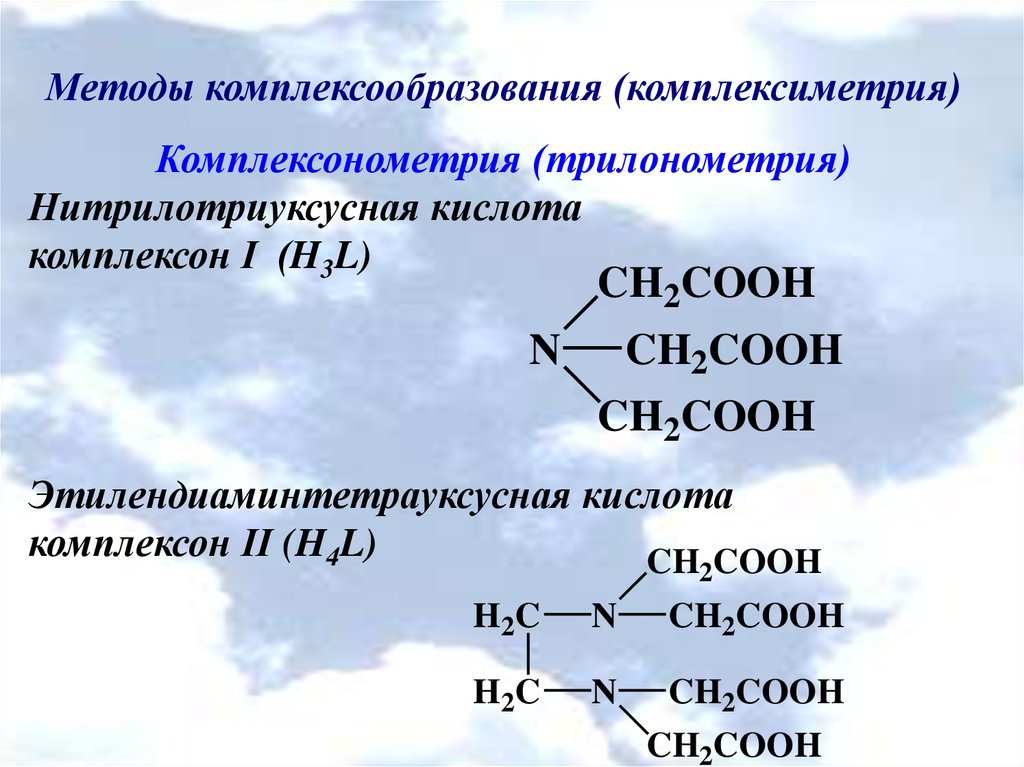
Методы комплексообразования (комплексиметрия)Комплексонометрия (трилонометрия)
Нитрилотриуксусная кислота
комплексон І (H3L)
CH2COOH
N
CH2COOH
CH2COOH
Этилендиаминтетрауксусная кислота
комплексон ІІ (H4L)
CH COOH
2
H 2C
N
CH2COOH
H 2C
N
CH2COOH
CH2COOH
16.
Методы комплексообразования (комплексиметрия)Комплексонометрия (трилонометрия)
комплексон ІІІ
(трилон Б, ЭДТА,
динатрия эдетат)
NH2L· H2O
CH2COONa
H 2C
N
CH2COOH
H 2C
N
CH2COOH
CH2COONa
17.
Методы комплексообразования (комплексиметрия)Комплексонометрия (трилонометрия)
CH2COO-
CH2COONa
H2C
N
H2C
N
CH2COOH
CH2COOH
CH2COONa
H2C
N
CH2COOH
H2C
N
CH2COOH
2Na+ +
CH2COO-
18.
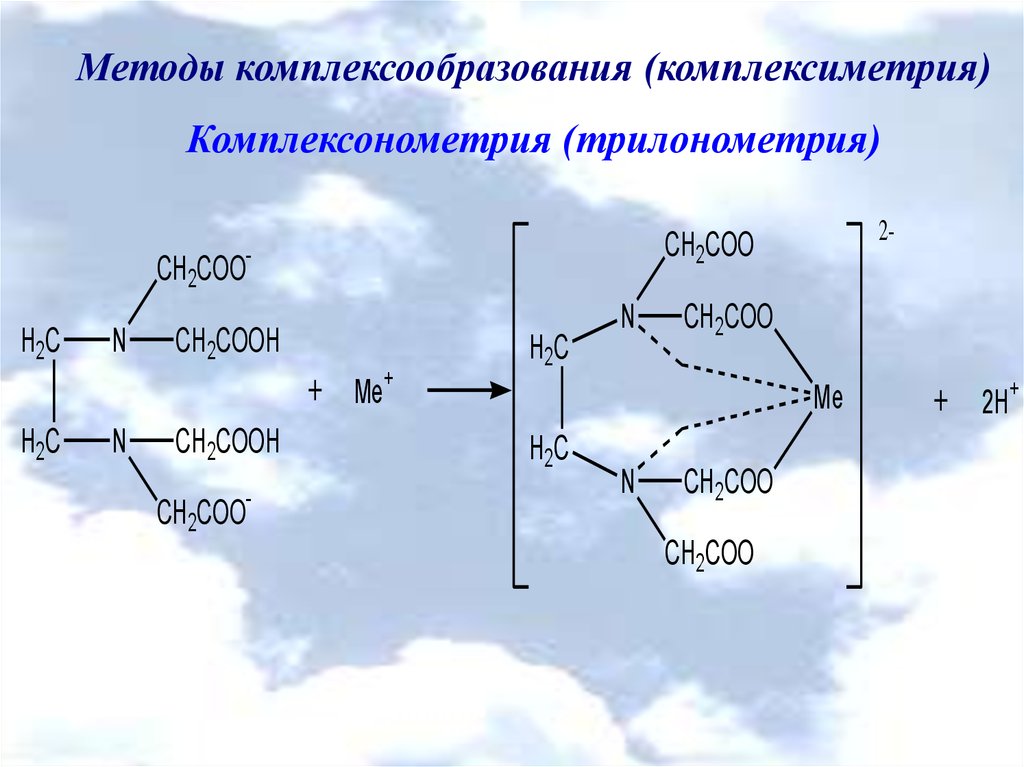
Методы комплексообразования (комплексиметрия)Комплексонометрия (трилонометрия)
CH2COOH2C
N
CH2COOH
+ Me+
H2C
N
CH2COOH
CH2COO
-
2-
CH2COO
H2C
N
CH2COO
Me
H2C
N
CH2COO
CH2COO
+ 2H+
19.
Методы комплексообразования (комплексиметрия)Комплексонометрия (трилонометрия)
H2L2- + Me2+ → [MeL]2- + 2H+
H2L2- + Me3+ → [MeL]- + 2H+
H2L2- + Me4+ → [MeL] + 2H+
Me2+ + H2Ind- → [MeInd]- + 2H+
[MeInd]- + H2L2- → [MeL]2- + H2Ind-
20.
Методы комплексообразования (комплексиметрия)Комплексонометрия (трилонометрия)
Обратное титрование:
Me2+ + H2L2- → [MeL]2- + 2H+
Изб. H2L2- + Mg2+ → [MgL]2- + 2H+
Заместительное титрование:
Me2+ + [MgL]2- → [MeL]2- + Mg2+
Me2+ + [H2L]2- → [MgL]2- + 2H+
21.
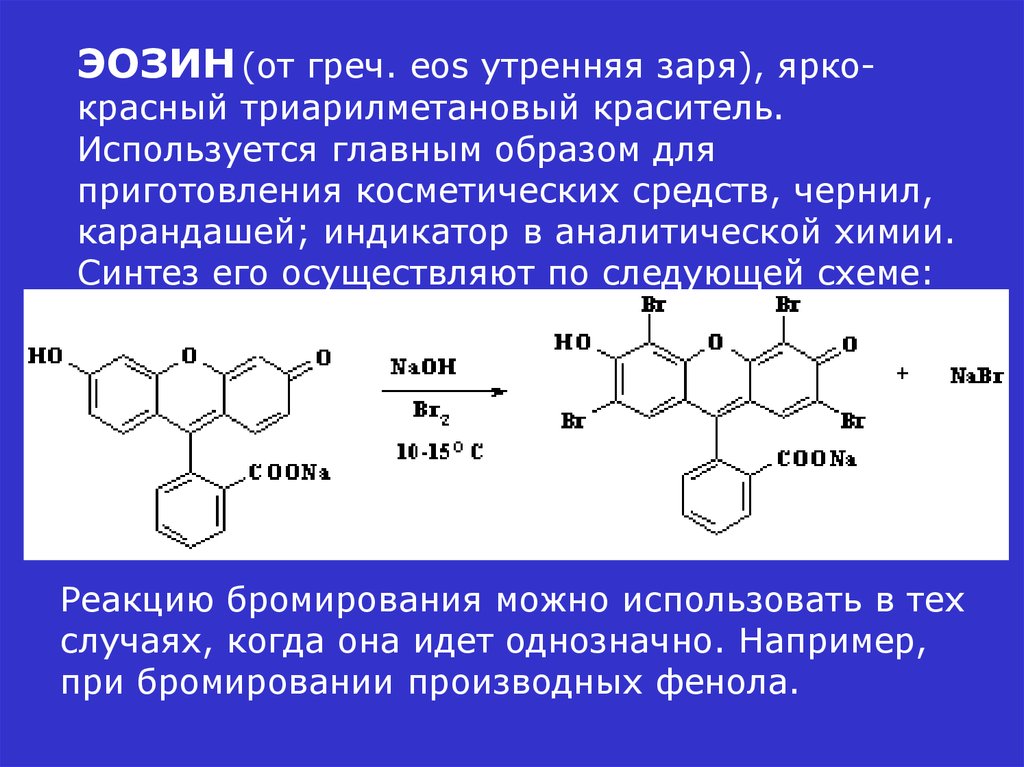
ЭОЗИН (от греч. eos утренняя заря), ярко-красный триарилметановый краситель.
Используется главным образом для
приготовления косметических средств, чернил,
карандашей; индикатор в аналитической химии.
Синтез его осуществляют по следующей схеме:
Реакцию бромирования можно использовать в тех
случаях, когда она идет однозначно. Например,
при бромировании производных фенола.


















 chemistry
chemistry








