Similar presentations:
Комплексонометрия – метод количественного титриметрического анализа
1.
2.
Комплексонометрия–
метод
количественного
титриметрического
анализа, основанный на образовании
комплексных
соединений
ионов
металлов с комплексонами.
Комплексонами называют органические
соединения, молекулы которых содержат
как кислотные, так и основные группы и
потому способные образовывать с
ионами металлов внутрикомплексные
соединения.
3.
Внутрикомплексные соединения образуются в тех случаях,когда ионы металла-комплексообразователя с одной
стороны замещают активные ионы водорода кислотных
функциональных групп, а с другой стороны образуют связь
по донорно-акцепторному механизму за счет свободных
орбиталей иона металла и атомов основных групп,
имеющими неподеленные электронные пары.
К числу функциональных групп, содержащих ионы водорода,
способные
замещаться
ионами
металлакомплексообразователя, относятся: −COOH, −OH, −SO3H,
−NH2, −SH, =NH.
К числу функциональных групп, с которыми ионы металлакомплексообразователя способны образовывать связь по
донорно-акцепторному механизму, относятся: ≡N, =NH,
−NH2, −OH, =C=O, − S −, −N=N−.
С помощью метода комплексонометрии определяют
содержание в растворе различных ионов металлов: Mg2+,
Ca2+, Zn2+, Cd2+, Al3+, Ni2+, Cu2+, Co2+, Fe3+ и др.
4.
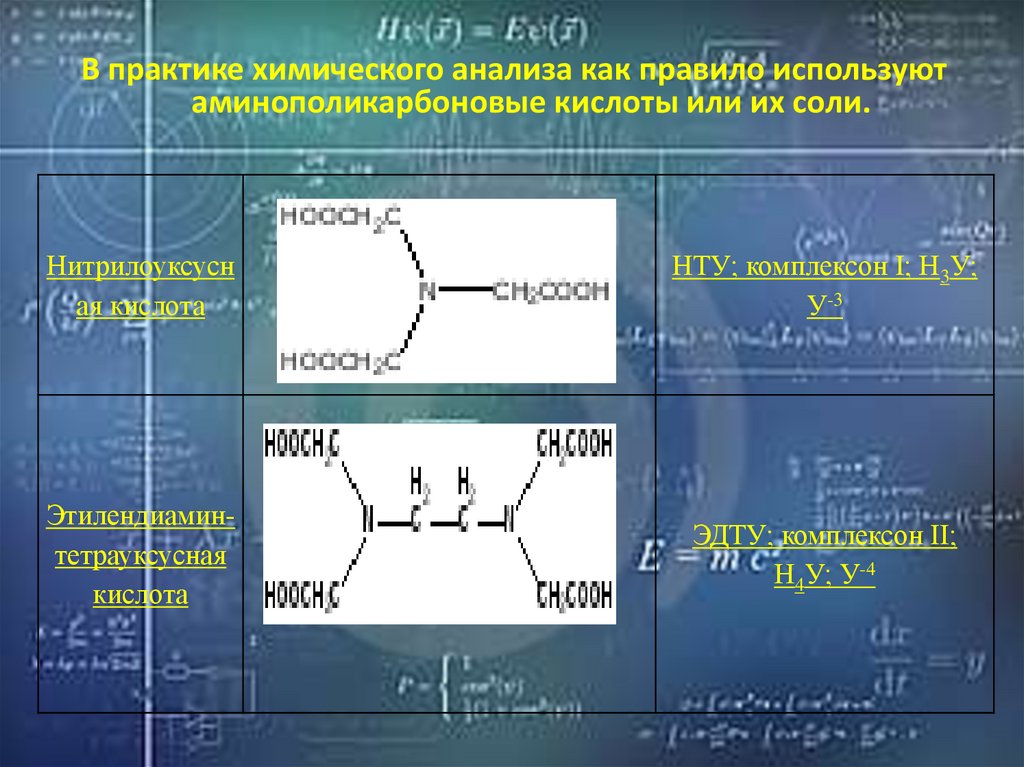
В практике химического анализа как правило используютаминополикарбоновые кислоты или их соли.
Нитрилоуксусн
ая кислота
НТУ; комплексон I; Н3У;
У-3
Этилендиаминтетрауксусная
кислота
ЭДТУ; комплексон II;
Н4У; У-4
5.
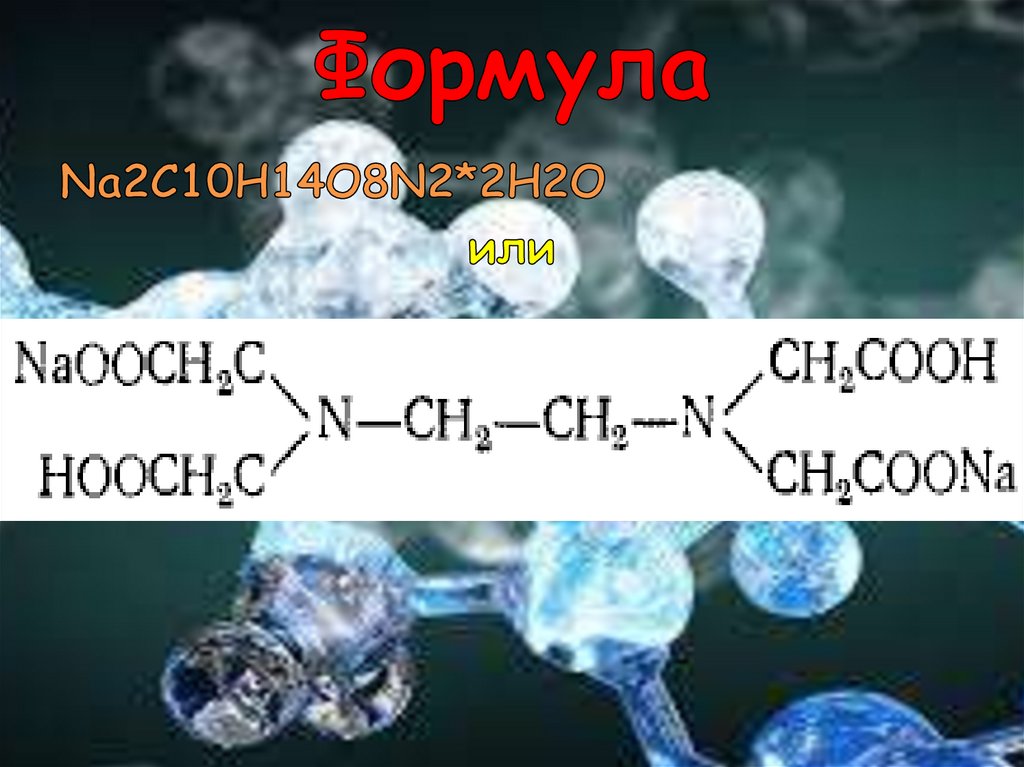
Чаще всего в качестве комплексона используютЭДТА
(двузамещенный
этилендиаминтетраацетат натрия)
6.
7.
При взаимодействии с ЭДТА ион металлазамещает ионы водорода карбоксильных
групп и образует координационную связь за
счет неподеленных электронных пар атомов
азота и свободных орбиталей иона металла.
При этом образуется хелатный комплекс с
тремя пятичленными циклами. Схематично
эту реакцию можно выразить уравнением:
8.
При взаимодействии с ЭДТА ион металлазамещает ионы водорода карбоксильных
групп и образует координационную связь за
счет неподеленных электронных пар атомов
азота и свободных орбиталей иона металла.
При этом образуется хелатный комплекс с
тремя пятичленными циклами. Схематично эту
реакцию можно выразить уравнением:
9.
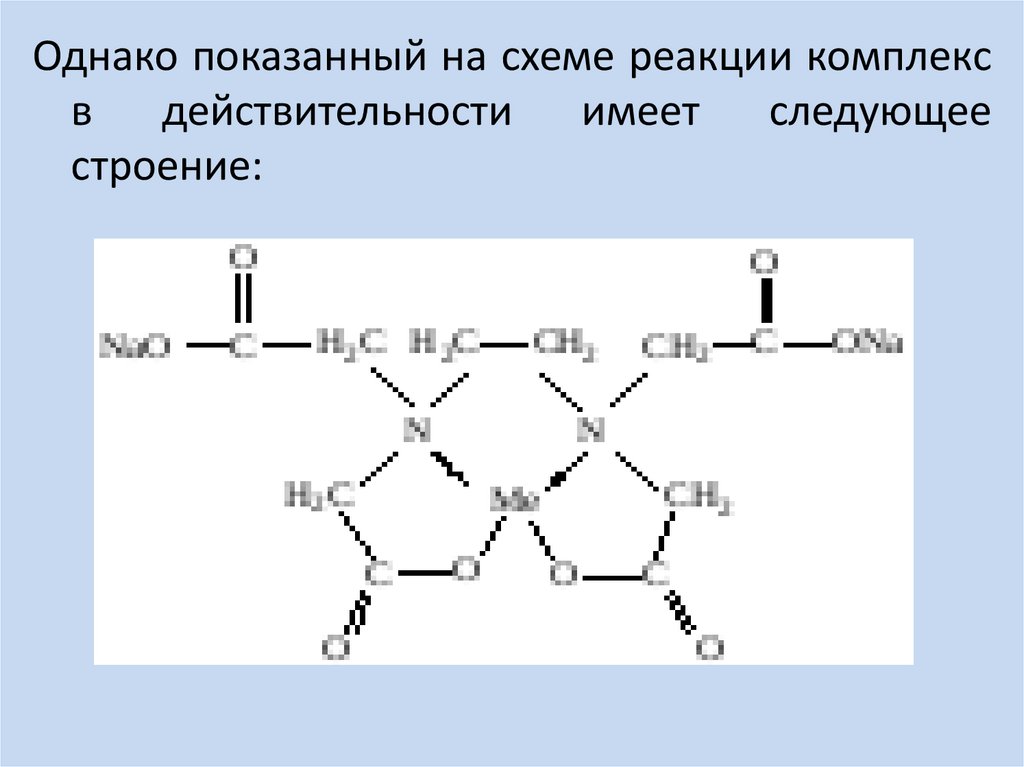
Однако показанный на схеме реакции комплексв
действительности
имеет
следующее
строение:
10.
При титровании ЭДТА солейкомплексообразователей
следующие реакции:
1) диссоциация комплексона:
Na2H2Y 2Na+ + H2Y2−
2) взаимодействие с металлами:
Me2+ (Ca2+) + H2Y2− MeY2− + 2H+
Me3+ (Al3+) + H2Y2− MeY− + 2H+
Me4+ (Th4+) + H2Y2- MeY + 2H+
металловпротекают
11.
Реакциис
участием
комплексонов
протекают
стехиометрично,
образуются
очень
прочные
комплексы с соотношением металла к лиганду 1:1 не
зависимо от заряда иона металла.
Комплексоны
не
удовлетворяют
требованиям
предъявляемым первичным стандартным веществам,
поэтому их точную концентрацию устанавливают путем
стандартизации. В качестве первичных стандартных
веществ используют соли Са2+ и Mg2+, приготовленные
из фиксаналов или металлический цинк. В последнем
случае, гранулы цинка взвешивают на аналитических
весах, помещают в мерную колбу и растворяют в
небольшом количестве НСl или H2SO4, после
растворения Zn, раствор нейтрализуют и доводят
объем до метки. По массе цинка и объему полученного
раствора
рассчитывают
точную
концентрацию
первичного стандартного раствора.
12.
При проведение комплексонометрическогоопределения необходимо соблюдать
определенные условия, важнейшим из
которых является рН раствора. В сильно
кислых растворах (рН<3) образуются
малоустойчивые кислые комплексы. При
повышении рН устойчивость
образовавшихся комплексов возрастает,
однако в сильно щелочных средах рН>10
происходит образование малоустойчивых
оксокомплексов или гидрооксиды Ме.
13.
Из выше приведенных реакций следует,что образование комплексонатов
происходит с выделение кислоты, что
приводит к увеличению рН.
Поэтому, как правило, титрование
проводят
в
присутствии
соответствующих буферных растворов
поддерживающих
рН
на
определенном уровне.
14.
В комплексонометрии используют методыпрямого и обратного титрования, а
также метод замещения.
Метод прямого титрования. Анализируемый
раствор,
содержащий
катионы
определенного
металла,
титруют
стандартным
раствором
ЭДТА
в
присутствии буферного раствора. Этим
методом определяют Mg2+, Ca2+, Zn2+, Cd2+,
Al3+, Ni2+, Cu2+, Co2+, Fe3+, Pb2+, Ba2+ и другие
катионы.
15.
Метод обратного титрования. В тех случаях, когда потем или иным причинам невозможно провести
прямое
титрование,
используют
обратное
титрование.
К
анализируемому
раствору
прибавляют точно измеренный объем стандартного
раствора комплексона, нагревают до кипения для
завершения реакции комплексообразования, а
после
охлаждения
оттитровывают
избыток
комплексона стандартными растворами MgSO4 или
ZnSO4. Этот метод применяют в тех случаях, когда
нет подходящего индикатора, когда в буферном
растворе выпадает осадок гидроксида металла и
когда реакция комплексообразования протекает
медленно. Методом обратного титрования также
определяют содержание катионов в нерастворимых
в воде соединениях (Ca2+ в CaC2O4, Mg2+ в
MgNH4PO4, Pb2+ в PbSO4 и т.п.).
16.
Метод замещения. Метод основан на том, чтоионы Mg2+ дают с комплексоном менее
устойчивое комплексное соединение, чем
подавляющее большинство других катионов.
Поэтому при добавлении определяемого
катиона к комплексонату Mg произойдет
реакция обмена. Например, при определении
ионов тория, к анализируемому раствору
добавляют комплексонат магния MgY2-, а
затем оттитровывают выделившиеся ионы
Mg2+ стандартным раствором ЭДТА (6):
Th4+ + MgY2− ThY + Mg2+ (5)
Mg2+ + H2Y2− MgY2− + 2H+ (6)
17.
Как правило, для фиксирования точки концатитрования в комплексонометрии используют так
называемые
металл-индикаторы,
которые
представляют собой органические красители,
образующие
с
катионами
определяемых
металлов растворимые в воде окрашенные
комплексные соединения. Получаемые при этом
комплексы менее устойчивы, чем комплексы
металлов с комплексонами.
Металлоиндикаторы - это органические красители
(мурексид, эриохром черный Т, эриохром
синечерный Б, цинкон и др.), которые образуют с
определяемыми ионами растворимые в воде
окрашенные комплексные соединения, менее
прочные, чем комплекс катиона металла с
трилоном Б.
18.
При добавлении индикатора к раствору солиметалла образуется комплекс металла с
индикатором, окрашенный определенным
образом.
При титровании ЭДТА полученного раствора,
малоустойчивый комплекс металла с
индикатором разрушается и образуется
более устойчивый неокрашенный комплекс
металла с комплексоном, а индикатор
выделяется в свободном виде, и в конечной
точке раствор приобретает окраску,
свойственную индикатору.
19.
Сущность действия металл-индикатора на примереэриохрома черного Т можно представить следующим
образом:
1) при добавлении индикатора к раствору соли металла
(рН=8−10) образуется комплекс металла с индикатором
красного цвета:
Me2+ + HInd2− MeInd− + H+
красный
2) при титровании полученного раствора ЭДТА этот
комплекс разрушается, образуется более устойчивый
бесцветный комплекс металла с комплексоном, а
индикатор выделяется в свободном виде, придавая
раствору синюю окраску:
MeInd− + Na2H2Y MeNa2Y + HInd2− + H+
красный б/цв. б/цв. синий
20.
Титрование кальция и магния растворомЭДТА в присутствии Эриохрома черного Т.
21.
Эриохромчёрный
Т
—
комплексонометрический индикатор.
Физико-химические свойства:
Чёрные или коричневые кристаллы, хорошо
растворяются в спирте, плохо растворимы в
воде. Токсичен!
Применение:
Применяется в качестве комплексометрического
индикатора для определения ионов Mg, Mn, Pb,
Zn, Cd, In, Zr, лантаноидов. В интервале рН 9,5—
10,0 имеет синюю окраску, а его комплексы с
ионами кальция, магния и цинка в тех же
условиях красно-фиолетового цвета.
22.
Хромовый темно-синий кислотный.Физическо- химические свойства :
Порошок темно-коричневого или черного цвета.
Легко растворим в воде. 0,05 % раствор —
вишнево-красного цвета.
В интервале рН 9,5—10,0 имеет синефиолетовую окраску, его комплексы с ионами
кальция, магния и цинка в тех же условиях
красного цвета.
Переход окраски при прямом титровании от
красной
к сине-фиолетовой.
23.
Мурексид (MX) - органический краситель, пурпурааммония, аммиачная соль. Имеет пурпурно-красный
цвет .
Физико- химические свойства:
Тёмно-красные, коричневатые или пурпурные мелкие
кристаллы с зеленоватым блеском, плохо растворим в
воде и нерастворим в этаноле, диэтиловом эфире.
Молекулярная масса 238,18.
Применение:
В аналитической химии - как металлоиндикатор .
Индикатор для комплексонометрического
определения никеля (рН 9,5-10), меди (рН 8-10),
скандия (рН 2,6), кальция (рН 10,8-13,2), марганца (рН
10), тория (рН 2,5) и других ионов.
24.
Для поддержания рН раствора на требуемом уровнеобычно в титруемый раствор добавляют аммиачную
буферную смесь.
Индикаторы подбираются таким образом, чтобы интервал
перехода их окраски находился в пределах скачка
титрования. В настоящее время известно около 150
металл-индикаторов.
Кроме металл-индикаторов для фиксирования точки
конца титрования в комплексонометрии используют
обычные кислотно-основные индикаторы, так как
реакция
комплексообразования
сопровождается
выделением ионов водорода H+ в количестве,
эквивалентном количеству определяемого катиона.
Выделившуюся
кислоту
определяют
методом
нейтрализации с обычными кислотно-основными
индикаторами.
25.
Условия комплексонометрическоro титрования:1. Реакции комплексообразования должны протекать
быстро, количественно и стехиометрично, чтобы
вблизи точки эквивалент-ности определяемые
катионы были практически полностью связаны в
комплекс. Константа нестойкости образующихся
комплексов должна быть малой величиной.
2. Определяемые ионы должны образовывать с
металлоиндиктором менее прочные комплексы,
чем их комплексы с трилоном Б.
3. Комплексонометрическое титрование следует
проводить при определенном значении рН (рН <
10), так как в щелочной среде могут образовываться
осадки гидроксидов определяемых катионов или их
основные соли.
26.
ПрименениеОсновная функция: делает нерастворимые соли металлов
растворимыми.
В аналитической химии для определения
многих катионов и анионов,
напр.: Ca, Mg, Cu, Со, Ni, Zn, Fe, Mo, Al, редкоземельных
элементов, Tc, U, SO42−, PO43−, CN− и др.
при потенциометрических, полярографических и
амперометрических определениях, для маскировки,
В производстве медицинских препаратов и при отравлениях
тяжелыми металлами,
В производстве бытовой химии и синтетических моющих средств,
При консервировании и др.
В реставрации для удаления следов коррозии с изделий из бронзы и
других цветных металлов, особо хорошо себя проявляет в очистке
изделий из
В промышленности для промывки теплоэнергетического
оборудования, труб, котлов; водоподготовки в котельных и
теплосетях; в виде стабилизатора в процессах полимеризации; в
целлюлозно-бумажной промышленности; при производстве каучука;
в аналитической химии и в многих других областях.
27.
ТРИЛОН Б является торговым названием динатриевой солиэтилендиаминтетрауксусной кислоты и представляет собой
кристаллический порошок белого цвета. Данное название
введено фирмой БАСФ и использовалась как торговая марка
для данного вещества, но очень быстро вошло в обиход и
используется другими фирмами для обозначения продукта.
Используются также тринатриевая и тетранатриевая соль
этилендиаминтерауксусной кислоты, но для связывания
одного и того же количества ионов их надо брать в большем
количестве. ТРИЛОН Б это ион коагулянт. Схема действия его
основана на извлечении ионов металла из нерастворимых
солей металлов и замещения их на ионы натрия, почти все
соли которого растворимы в воде причем независимо от
валентности металла 1 молекула трилона реагирует с 1
молекулой металла. Это ценное свойство нашло огромное
применение в аналитике.
28.
ТРБ-2Na + CaCO3 ----> ТрБ-Ca + Na2Co3(раств) (нераств)
(раств) (раств)
Аналогичное взаимодействие происходит
с ионами меди железа (II и III) магния,
марганца. Причем ТРИЛОН Б не является
29.
Благодаря вышеуказанным свойствамТРИЛОН Б находит широкое применение
различных областях промышленности.
В частности, его применяют для очистки
трубопроводов котлов и нагревательных
элементов от накипи и ржавчины.
Накипь - это известковый нарост
образованный солями магния и кальция,
всегда присутствующих в любой воде, и
определяющих ее жесткость. Образуется
в трубопроводах, на нагревательных
элементах из-за уменьшения
растворимости солей с повышением
температуры. В результате чего
уменьшается полезное сечение
трубопроводов, а в теплообменниках
значительно падает коэффициент
теплообмена. Аналогично, Трилон Б
применяют для очистки автомобильных
систем охлаждения, защиты стиральных
машин как отдельный препарат или в
комплексе со стиральным порошком.
Трилон Б применяют также в
аналитической химии, для
качественного и количественного
определения солей металлов, благодаря
возможности вещества образовывать с
ионами металлов комплексоны,
окрашенные в различный цвет. Причем
цвет раствора будет зависеть от иона
металла, с которым образован
комплекс.
30.
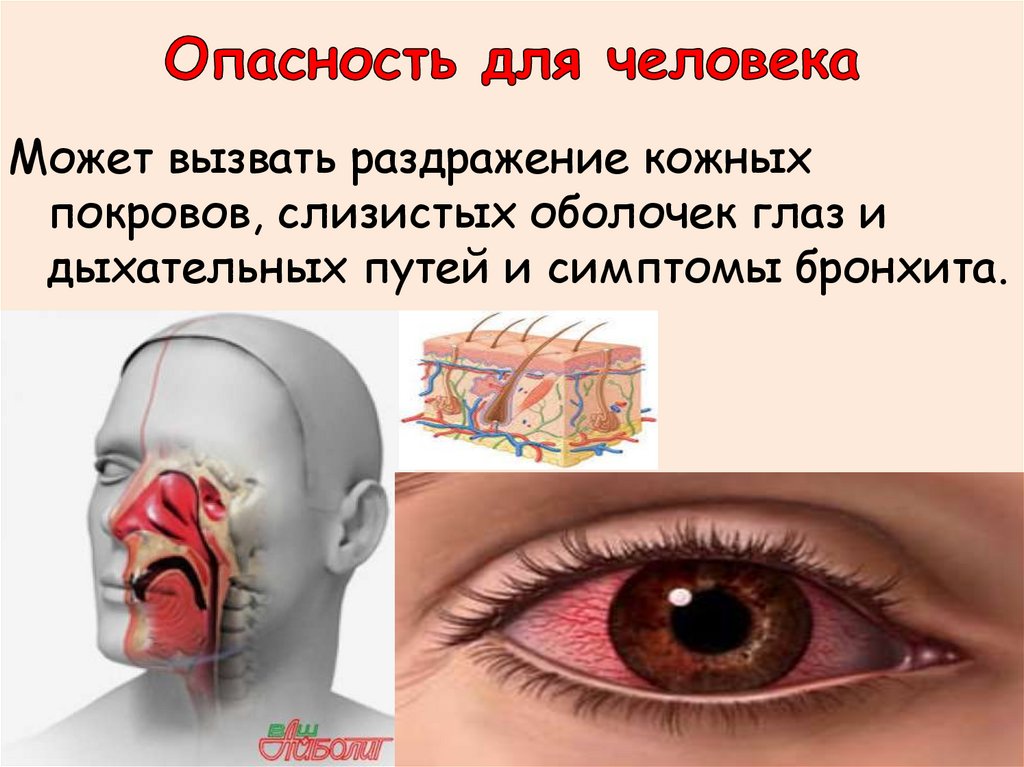
Может вызвать раздражение кожныхпокровов, слизистых оболочек глаз и
дыхательных путей и симптомы бронхита.
31.
Средстваиндивидуальной
защиты
Противопылевой
респиратор, средства
защиты лица, глаз.
Меры первой помощи
Вынести пострадавшего
на свежий воздух, снять
загрязненную одежду.
Глаза и кожные
покровы тщательно и
обильно промыть
водой. Оттягивать веки
от глазных яблок для
более полного
промывания. При
проглатывании
прополоскать рот, дать
воды для питья.


























 chemistry
chemistry








