Similar presentations:
Многоатомные спирты
1.
Многоатомные спитры2.
ОпределениеМногоатомные спирты –
органические соединения, в
молекулах которых содержится
несколько гидроксильных групп,
соединённых с углеводородным
радикалом.
Общая формула - R(OH)n
запишите в тетрадь
3.
• Выполните в тетради.• Задание: Основываясь на принципах
номенклатуры, дайте названия следующим
спиртам:
СН2ОН-СН2ОН
СН2ОН-СНОН-СН2ОН
• Задание: Составьте формулы следующих
спиртов, исходя из названия:
2- метилбутандиол-1,3
• 2,2-диметилпентантриол-1,3,5
• сорбит
4.
Физические свойства этиленгликоля• Этиленгликоль —представитель
предельных двухатомных
спиртов — гликолей
• Название гликоли получили
вследствие сладкого вкуса
многих представителей ряда
(греч. «гликос» — сладкий)
• Этиленгликоль - бесцветная
сиропообразная жидкость
сладкого вкуса, без запаха,
ядовит. Хорошо смешивается с
водой и спиртом,
гигроскопичен, tкип. 197ºС
5.
Этиленгликоль – яд !• Дозы вызывающие смертельное отравление
этиленгликолем варьируются в широких пределах - от
100 до 600 мл. Смертельной дозой для человека
является 50-150 мл. Смертность при поражении
этиленгликолем очень высока и составляет более 60%
всех случаев отравления
• Механизм токсического действия этиленгликоля до
настоящего времени изучен недостаточно.
Этиленгликоль быстро всасывается (в том числе через
поры кожи) и в течение нескольких часов циркулирует
в крови в неизмененном виде, достигая максимальной
концентрации через 2-5 часов. Затем его содержание
в крови постепенно снижается, и он фиксируется в
тканях
6.
Применение этиленгликоля• Важным свойством
этиленгликоля является
способность понижать
температуру замерзания
воды, от чего вещество
нашло широкое
применения как
компонент автомобильных
антифризов и
незамерзающих
жидкостей
• Он применяется для
получения лавсана
(ценного синтетического
волокна)
7.
Применение этиленгликоля:антифризы – незамерзающие жидкости;
синтетическое волокно лавсан;
ПЭТ – пластиковые бутылки
8.
Физические свойства глицерина• Глицерин – трехатомный
CH2 – CH – CH2
предельный спирт.
• Бесцветная, вязкая,
OH OH
гигроскопичная, сладкая OH
на вкус жидкость.
• Смешивается с водой в
любых отношениях ,
неограниченно
растворим в воде.
• Глицерин в отличие от
этиленгликоля- не
ядовит.
• tкип. 290ºС
9.
Применение глицерина• В производстве взрывчатых веществ, в
частности тринитрата глицерина
• При обработке кожи, для
предотвращения от высыхания
• В текстильной промышленности для
придания тканям мягкости и
шелковистости
• Как компонент некоторых клеeв
• При производстве пластмасс в качестве
пластификатора – компонента,
придающего материалу гибкость и
эластичность
• В производстве кондитерских изделий
и напитков (как пищевая добавка E422)
• Широко используется в парфюмерной
промышленности: входит в состав
кремов, помад, зубных паст,
предотвращая их от высыхания и
способствуя увлажнению и смягчению
кожи
• Несмотря на взрывоопасность этого
вещества, в очень малых дозах его
применяют в медицине в качестве
сосудорасширяющего средства при
сердечно-сосудистых заболеваниях
10.
Применение глицерина:умягчитель кожи и ткани;
нитроглицерин – сердечное средство и основа
динамита;
косметические средства;
кондитерские изделия;
пластмассы
11.
Физические свойстваПисьменно ответьте на вопросы:
1. Почему низшие этиленгликоль и глицерин –
вязкие жидкости; ксилит, сорбит – твёрдые
вещества?
2. Почему они гигроскопичны и неограниченно
растворимы в воде?
3. Чем объяснить их сладкий вкус?
4. Чем объяснить их высокие температуры
кипения?
12.
Химические свойстваДля многоатомных спиртов
характерны основные реакции
одноатомных спиртов. В отличие от них,
они могут образовывать производные
по одной или по нескольким
гидроксильным группам, в зависимости
от условий проведения реакций.
Перенесите все свойства и уравнения
реакций в тетрадь
13.
I. Общие с одноатомными спиртами1. Взаимодействуют с активными
металлами.
2CH2OH-CH2OH + 2Na →
2CH2ONa – CH2ONa + H2
гликолят натрия
14.
2. Взаимодействии сгалогеноводородами (HCl, HBr)
CH2OH – CH2OH + 2HCl →
CH2Cl– CH2Cl + 2H2O
1,2 – дихлорэтан
15.
3. Взаимодействии с кислотами – реакцияэтерификации
СН2-ОН
│
СН-ОН +3 С17Н35СООН →
│
СН2-ОН
• + 3Н2О
СН2- О – О - С- С17Н35
│
СН - О – О - С- С17Н35 +
│
СН2- О- О - С- С17Н35
Триглицерид
16.
Я пью его в мельчайших
дозах,
На сахар капаю раствор,
А он способен бросить в
воздух
Любую из ближайших гор.
• О каком веществе идет речь?
17.
II. Особые свойства1. Нитрование – взаимодействие с HNO3
Образуются полные и неполные сложные
эфиры.
CH2 – OH HO – NO2
CH2 – O – NO2
|
H+ |
CH – OH + HO – NO2 → CH – O – NO2 + 3H2O
|
|
CH2 – OH HO – NO2
CH2 – O – NO2
глицеринтринитрат
(нитроглицерин)
взрывчатое вещество, применяется при
производстве динамита. При его взрыве
выделяется большое количество газов и тепла:
CH2ONO2-CHONO2-CH2ONO2 →
12CO2 + 6N2 + O2 + 10H2O +
Q
18.
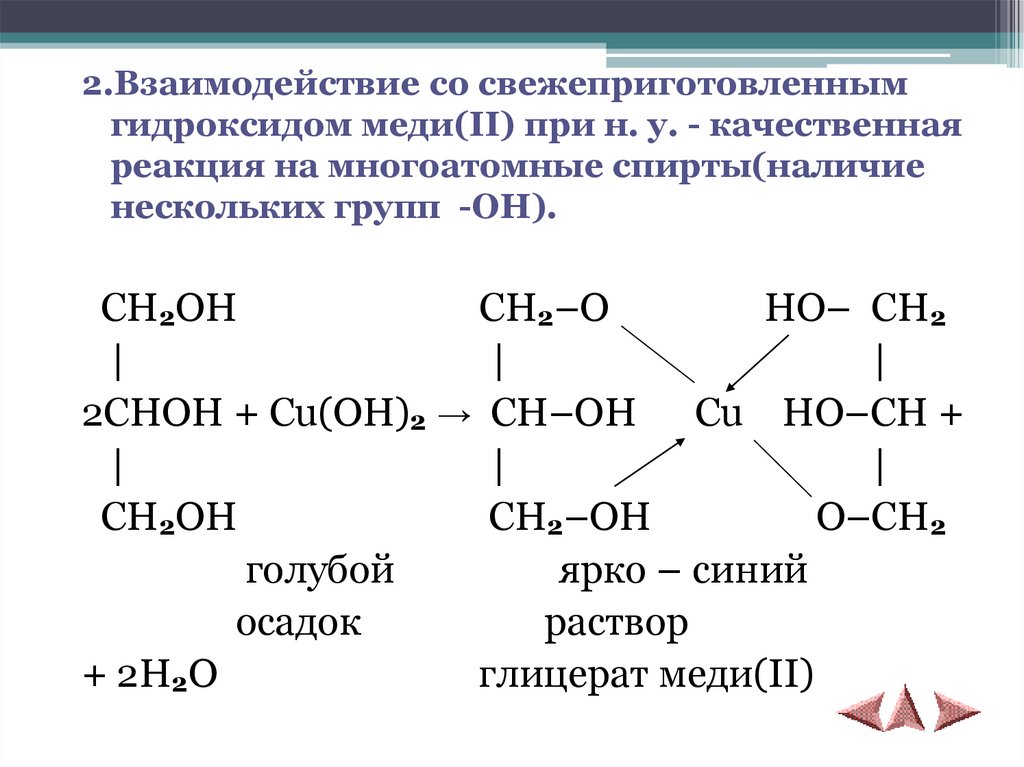
2.Взаимодействие со свежеприготовленнымгидроксидом меди(II) при н. у. - качественная
реакция на многоатомные спирты(наличие
нескольких групп -ОН).
CH2OH
CH2–O
HO– CH2
|
|
|
2CHOH + Cu(OH)2 → CH–OH Cu HO–CH +
|
|
|
CH2OH
CH2–OH
O–CH2
голубой
ярко – синий
осадок
раствор
+ 2H2O
глицерат меди(II)
19.
5. Окисление растворомперманганата калия
Вывод: Особые свойства
многоатомных спиртов
связаны с увеличением
числа гидроксильных групп,
влиянием их друг на друга и
углеводородный радикал
20.
Получение многоатомных спиртовЭтиленгликоль
получают:1.Гидролизом дигалогенпроизводных
алканов
Cl-СН2-СН2-Cl + 2HOH → ОН-CH2-CH2-OH
+ 2HCl
2. Окислением этилена р-ром КМnO4
СН2=СН2 + О + НОН → ОН-СН2-СН2-ОН
Глицерин
получают:
Омылением жиров
21.
Д.з.; конспект в тетради, задачаКакая масса тринитроглицерина
образуется при взаимодействии18,4г
глицерина и 44,1г азотной кислоты7



















 chemistry
chemistry








