Similar presentations:
Уравнение Клапейрона
1.
Уравнение КлапейронаCEE
Клапейрон (фр.)
вывел уравнение
состояния
идеального газа,
объединив законы
Бойля-Мариотта и
закон Гей-Люссака
– Шарля.
p
p1
1 (p1, V1, T1)
p1
p2
0
V1
1′ (p1 ,V2 ,T1 )
2 (p2, V2, T2)
V2 V
2.
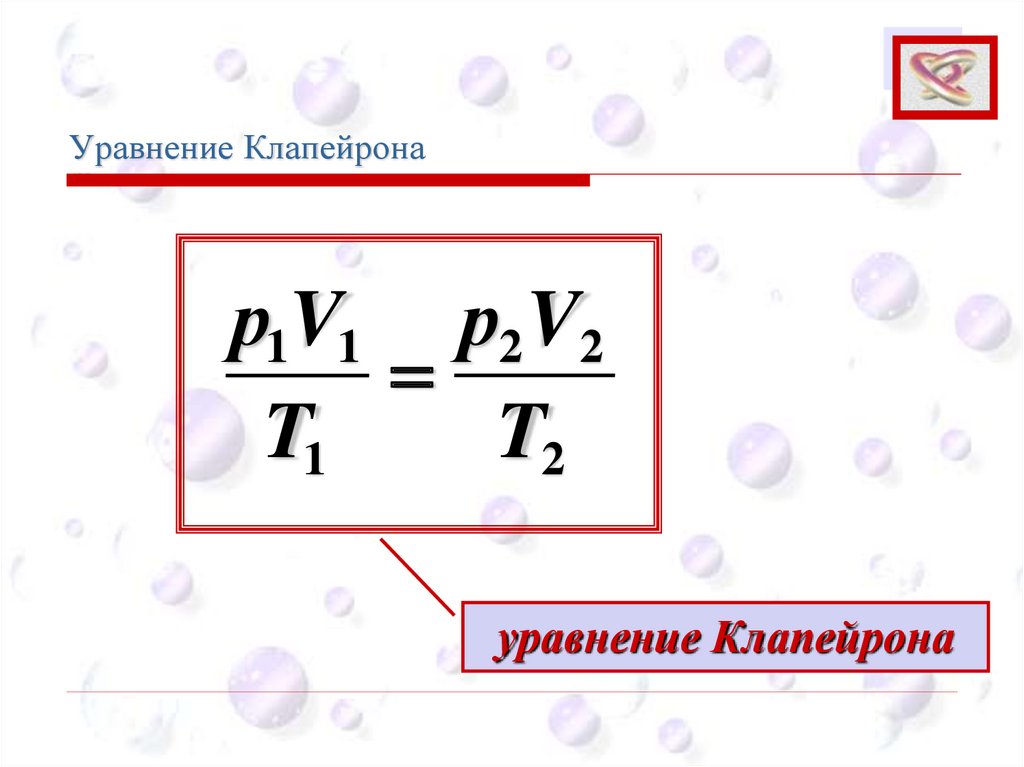
Уравнение КлапейронаCEE
р1V1 р2 V2
=
T1
T2
уравнение Клапейрона
3.
Уравнение КлапейронаCEE
(1)
4.
Уравнение Менделеева-КлапейронаCEE
Менделеев объединил уравнение Клапейрона с
законом Авогадро.
Согласно закону Авогадро:
Один моль любого газа при нормальных
условиях (Т = 273 К и р = 1,013∙105 Па)
занимает один и тот же объем (молярный)
Vm, равный:
Vm = 0,0224 м3/моль = 22,41 ∙ 10-3 м3/моль.
Подставим эти данные в (1):
5.
Уравнение Менделеева-КлапейронаCEE
p Vm
Дж
const = R =
= 8,31
T
моль К
6.
Уравнение Менделеева-КлапейронаCEE
(молярная газовая постоянная)
7.
Уравнение Менделеева-КлапейронаCEE
Тогда для 1 моль газа уравнение (1)
можно записать в виде:
pVm = R T
(2)
Уравнение МенделееваКлапейрона для 1 моль газа
8.
Уравнение Менделеева-КлапейронаCEE
9.
Основы МКТCEE
Задача молекулярно-кинетической теории
состоит в том, чтобы установить связь между
микроскопическими (масса, скорость,
кинетическая энергия молекул) и
макроскопическими параметрами
(давление, объем, температура).
m ʋ Eк
?
p V T
10.
CEEГаз, состоящий из отдельных атомов, а не
молекул, называют одноатомным.
К одноатомным газам относят инертные газы —
гелий, неон, аргон. В случае идеальных газов
пренебрегают силами взаимодействия молекул, т. е.
их потенциальная энергия полагается равной нулю,
поэтому внутренняя энергия идеального газа
представляет собой кинетическую энергию теплового
движения молекул.
11.
Основное уравнение МКТ газовCEE
1 m0 N
F=
кв
3 l
2
С другой стороны, сила F, действующая со стороны
газа в направлении, перпендикулярном к
поверхности S стенки сосуда:
F = pS
H
p = 1Па = 1 2
м
р – давление газа на стенку сосуда.
12.
Основное уравнение МКТ газовCEE
Или
1 m0 N
p=
кв
3 V
2
1
= m0 n кв
3
Основное уравнение МКТ
n=
N
‒ концентрация молекул
V
2
(5)
13.
Основное уравнение МКТ газовCEE
Средняя кинетическая энергия хаотического движения
молекул газа
1
E = m0 кв
2
Откуда
кв
2
=
2
2E
m0
(5)
14.
Основное уравнение МКТ газовCEE
1
p = m0 n кв
3
2
2E
1
2
= m0 n
= nE
3
m0
3
(6)
Основное уравнение МКТ
15.
Основное уравнение МКТ газовCEE
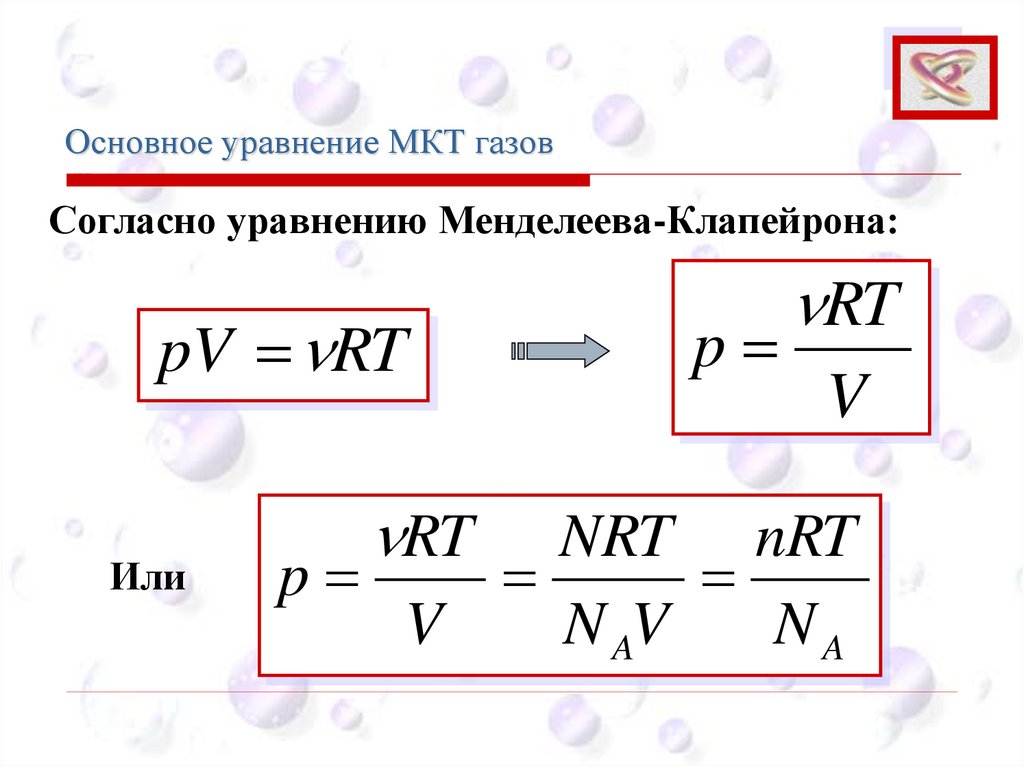
Согласно уравнению Менделеева-Клапейрона:
pV = RT
Или
RT
p=
RT
V
NRT nRT
p=
=
=
V
N AV
NA
16.
Основное уравнение МКТ газовCEE
С другой стороны:
Тогда:
2
p= n E
3
2
nRT
n E =
3
NA
Откуда:
nRT 3 3 R
E =
=
T
N A 2n 2 N A
17.
Основное уравнение МКТ газовCEE
R
k=
NA
18.
Основное уравнение МКТ газовCEE
Тогда:
3
E = kT
2
(7)
Средняя кинетическая энергия хаотического
движения молекул газа прямо пропорциональна
абсолютной температуре.
Температура есть мера средней кинетической
энергии поступательного движения молекул.
19.
Основное уравнение МКТ газовCEE
(7)
(6)
2
2 3
p = n E = n kT
3
3 2
Или
p = nkT

















 physics
physics








