Similar presentations:
Молекулярная физика и термодинамика. Молекулярная физика
1. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
2. Молекулярная физика
Молекулярная физика-раздел физики изучающий строение и свойства вещества, исходя из молекулярнокинетических представлений основывающихся натом , что все тела состоят из молекул, находящихся в
непрерывном, хаотическом движении.
Процессы изучаемые молекулярной физикой являются
результатом совокупного действия огромного числа
молекул. Законы поведения большого числа молекул
изучаются на основе статистического метода основанного на том, что свойства макроскопической системы определяются свойствами частиц системы, особенностями их движения и усреднёнными значениями динамических характеристик этих частиц.
3. Термодинамика
Термодинамика-раздел физики изучающий свойствамакроскопических систем находящихся в состоянии
термодинамического равновесия и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы которые лежат в основе
этих превращений. Этим термодинамический метод
отличается от статистического.
Термодинамика имеет дело с термодинамической системой (совокупностью макроскопических тел, которые взаимодействуют друг с другом, или с другими
телами (внешней средой)). Основа термодинамического метода определение состояния термодинамической системы.
4.
Состояние системы задаётся термодинамическими параметрами (параметрами состояния)- совокупностьюфизических величин, характеризующих свойства термодинамической системы. Обычно, в качестве параметров выбирают: давление, температуру, удельный
объем.
• Температура- физическая величина характеризующая
состояние термодинамического равновесия макроскопической системы (система в термодинамическом
равновесии если её состояние с течением времени
не изменяется. Измеряется в кельвинах К и градусах
Цельсия ⁰С.
(Т=273,15+t)
термодинамическая температурная шкала определяется по одной реперной точке, в качестве которой
5.
взята тройная точка воды, в которой при давлении609 Па вода, пар и лёд находятся в термодинамическом равновесии. Т=273,15 К.
• Удельный объём v- объём единицы массы. Когда тело однородно, (то его плотность ρ=const) то V m 1
при постоянной массе удельный объём пропорционален общему объёму V и макроскопические свойства тела можно охарактеризовать объёмом тела V.
• Давление Р- физическая величина численно равная
силе действующей на единицу площади поверхности
тела, по направлению нормали к этой поверхности.
dFn
P
dS
6. Молекулярно-кинетическая теория идеальных газов (МКТ)
7. ИДЕАЛЬНЫЙ ГАЗ
В МКТ пользуются идеализированной модельюидеального газа согласно которой:
• Собственный объём молекул газа пренебрежимо
мал по сравнению с объёмом сосуда.
• Молекулы не взаимодействуют между собой.
• Молекулы (частицы) сталкиваются по законам соударения абсолютно упругих тел.
Наиболее близко под условия идеального газа подходит любой разряженный газ.
8. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА (УРАВНЕНИЕ МЕНДЕЛЕЕВА-КЛАПЕЙРОНА)
Опытным путём, ещё до составления МКТ был установлен ряд законов, описывающий поведениеидеальных газов:
• Закон Бойля-Мариотта
• Закон Гей-Люсака
• Закон Авогадро
• Закон Дальтона
9. Закон Бойля-Мариотта
ИзотермаT const PV const
m const
Т – температура газа (в Кельвинах)
m – масса газа
V – объём занимаемый газом
Р – давление газа
10. Закон Гей-Люсака
Р const V V (1 t )m const
0
V const P P (1 t )
m const
0
t – температура по шкале Цельсия
P₀,V₀ - давление и объём при 0˚С
1
1
K
α – коэффициент
273,15
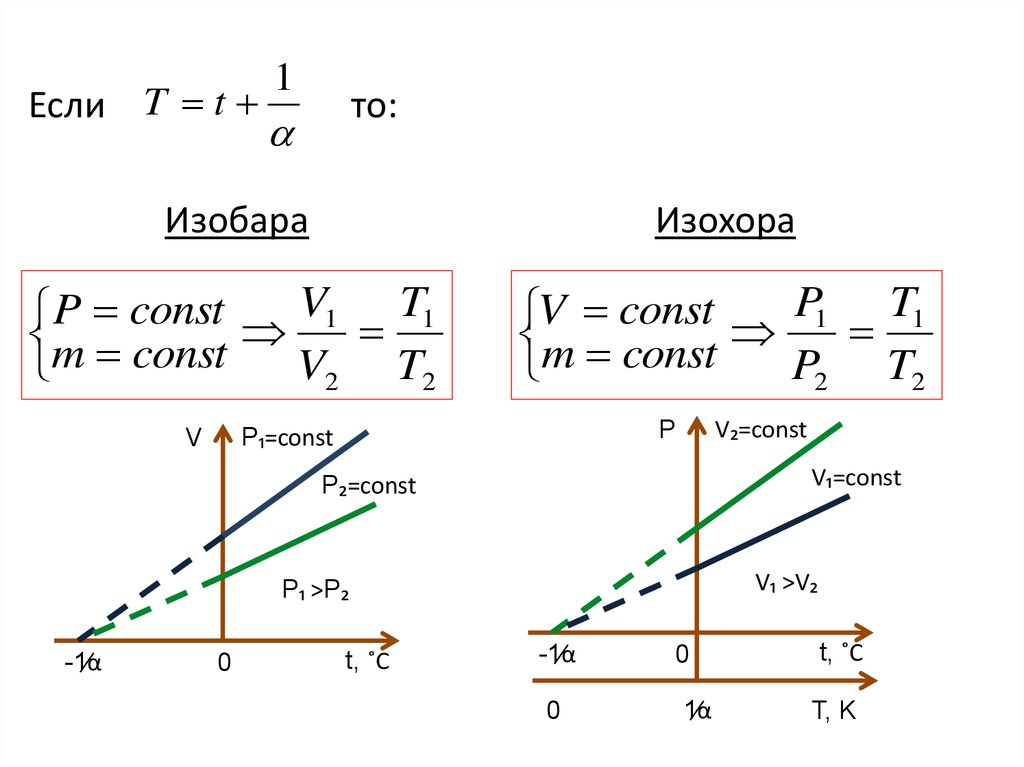
11.
Если T t1
то:
Изобара
Изохора
P const V1 T1
m const
V2 T2
V const P1 T1
m const
P2 T2
V₂=const
P
P₁=const
V
V₁=const
P₂=const
V₁ >V₂
P₁ >P₂
-1̸α
0
t, ˚C
-1̸α
0
0
1̸α
t, ˚C
T, K
12. Закон Авогадро
Моли любых газов при одинаковых температуре идавлении занимают одинаковые объёмы. При
нормальных условиях этот объём равен :
V м 22.41 10
3
м
3
моль
В одном моле различных веществ содержится одно
и тоже число молекул, называемое : постоянная
Авогадро.
N a 6,022 10
23
моль
1
13. Закон Дальтона
Давление смеси идеальных газов равно суммепарциальных давлений входящих в неё газов.
Р Р1 Р2 Р3 Рп
Р₁,Р₂,Р₃,…,Рn – парциальные давления газов ( давления которые оказывали бы газы смеси, если бы
они занимали объём равный объёму смеси при
той же температуре).
14. Уравнение Клапейрона
Состояние некоторой массы газа m определяется тремя параметрами: давлением Р объёмом V и температурой Т. Между этими параметрами существуетсвязь называемая уравнением состояния : f(P,V,T)=0.
где каждая из переменных является функцией двух
других.
Французский физик Клапейрон (1799-1864) ,соединив
уравнения Бойля-Мариотта и Гей-Люсака вывел
уравнение состояния идеального газа:
PV
const
T
15. Молярная газовая постоянная
Д. И. Менделеев объединил уравнение Клапейрона изакон Авогадро, отнеся уравнение Клапейрона к одному молю вещества, использовав молярный объём
Vm . Согласно закону Авогадро, при одинаковых Р и m
моли всех газов занимают одинаковый объём Vm, и
общая для всех газов постоянная R - молярная газовая постоянная.
Числовое значение R определяется из уравнения состояния идеального газа, полагая что 1 моль вещества
находится при нормальных условиях:
P0 1,013 10 5 ( Па)
Дж
R 8,31(
)
Т 0 273,15( К )
3
3
моль К
V
22
,
41
10
(
м
моль
)
m
16. Уравнение Менделеева-Клапейрона
PVm RTУравнение состояния идеального газа для одного моля
вещества.
От данного уравнения можно перейти к уравнению
Менделеева-Клапейрона для произвольной массы газа. Если 1 моль занимает объём Vm , то , при тех же условиях , масса m займёт объём V m M Vm, где Ммолярная масса (масса 1 моля вещества (кг/моль)) .
m
PV
RT RT
M
m
- количество вещества
M
17.
Часто используется иная форма записи уравнения состояния идеального газа с использованием постояннойБольцмана k.
R
k
1,38 10 23 ( Дж К )
Na
RT kNaT
P
nkT
Vm
Vm
Na
N
n
- концентрация молекул
Vm
V
При одинаковых температуре и давлении все газы содержат в единице объёма одинаковое число молекул.
Число молекул содержащееся в 1 мᶟ газа при нормальных условиях определяется числом Лошмита.
P0
Nl
2,68 10 25 ( м 3 )
kT0
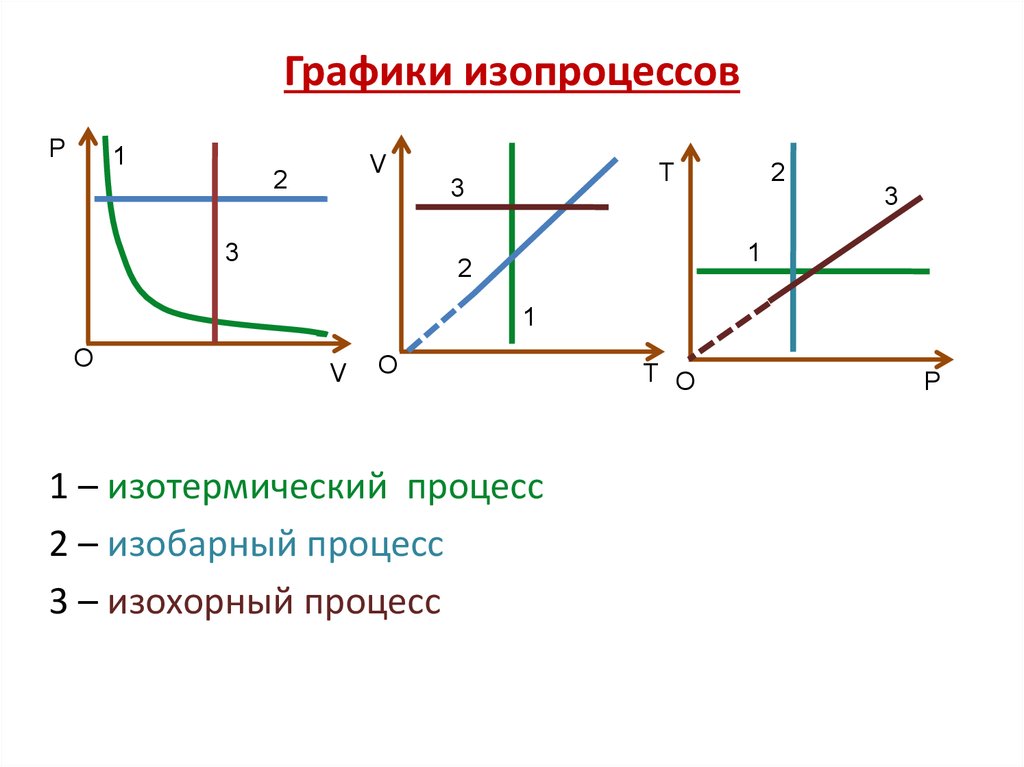
18. Графики изопроцессов
P1
V
2
Т
3
3
2
3
1
2
1
O
V
O
1 – изотермический процесс
2 – изобарный процесс
3 – изохорный процесс
T O
Р
19. Основное уравнение молекулярно-кинетической теории идеальных газов
20.
Для вывода основного уравнения молекулярно-кинетической теории (ОУМКТ) идеальных газов рассмотрим одноатомный идеальный газ. Газ заключён в сосуд с абсолютно упругими стенками. Молекулы газадвигаются хаотически, число столкновений между
молекулами пренебрежимо мало, по сравнению с
ударами об стенки.
∆S
Выделим на стенке сосуда элементарную
v∆t
площадку ∆S и определим давление на
неё. При каждом соударении каждая молекула движущаяся перпендикулярно площадке передаёт ей
импульс m0 ( m0 ) 2m0 . Где:
m₀- масса молекулы
v – скорость молекулы
21.
За время ∆t площадки ∆S достигнут только те молекулыкоторые заключены в объёме цилиндра с основанием ∆S, и высотой v∆t . Число этих молекул n S t где
n - концентрация молекул.
Молекулы двигаются под разными углами и имеют разные скорости, (причём скорости молекул при соударении меняются). Для упрощения хаотическое движение молекул заменяют на движение вдоль 3 взаимно перпендикулярных направлений. Вдоль каждого двигается треть от общего числа молекул, причём
половина (⅙ часть от всех молекул)в одну сторону, а
половина в другую. Тогда число ударов в заданном
1
направлении будет n S t .
6
22.
При столкновении с площадкой эти молекулы передадут ей импульс:1
1
p 2m0 n S t m0 n 2 S t
6
3
Тогда давление газа на стенку сосуда будет:
p
1
P
nm0 2
t S
3
Если газ в объёме V содержит N молекул двигающихся
со скоростями 1 , 2 , 3 , ..., n ,то целесообразно рассматривать среднюю квадратичную скорость кв
характеризующую всю совокупность молекул газа.
кв
1
N
N
2
i
i 1
23. Основное уравнение МКТ
Тогда уравнение давления примет вид:1
P nm0 кв
3
2
Основное уравнение МКТ для идеального газа
Учитывая что n=N/V, можно выразить:
1
PV Nm0 кв
3
2
2 m0 кв
N
3
2
2
2
E
3
Е –суммарная кинетическая энергия поступательного
движения всех молекул.
24. Средние значения скорости и энергии
12
Так как масса всего газа m Nm0 ,и PV m кв
3
1
2
То для 1 моля газа PVm M кв RT , следовательно:
3
кв
3RT
M
3RT
m0 N a
3kT
m0
Значение средней квадратичной скорости молекул газа
Аналогично:
E m0 2 3
0
kT
N
2
2
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа.
25. Закон Максвелла для распределения молекул идеального газа по скоростям и энергиям теплового движения
26.
При выводе основного уравнения МКТ молекулам задавали различные скорости. В результате многократных соударений скорость каждой молекулы меняется по модулю и направлению. Однако, из-за хаотического движения молекул, все направления движения считаются равновероятными, то есть в любом направлении движетсяпримерно одинаковое количество молекул. По МКТ, в
газе, находящемся в состоянии равновесия, при постоянной температуре, как бы не изменялись отдельные
скорости молекул при столкновениях, среднеквадратичная скорость кв молекул массой m₀ остаётся постоянной. Значит, в газе находящемся в равновесии устанавливается некоторое стационарное, не изменяющееся со
временем распределение молекул по скоростям, подчиняющееся определённому статистическому закону.
Этот закон теоретически был выведен Максвеллом.
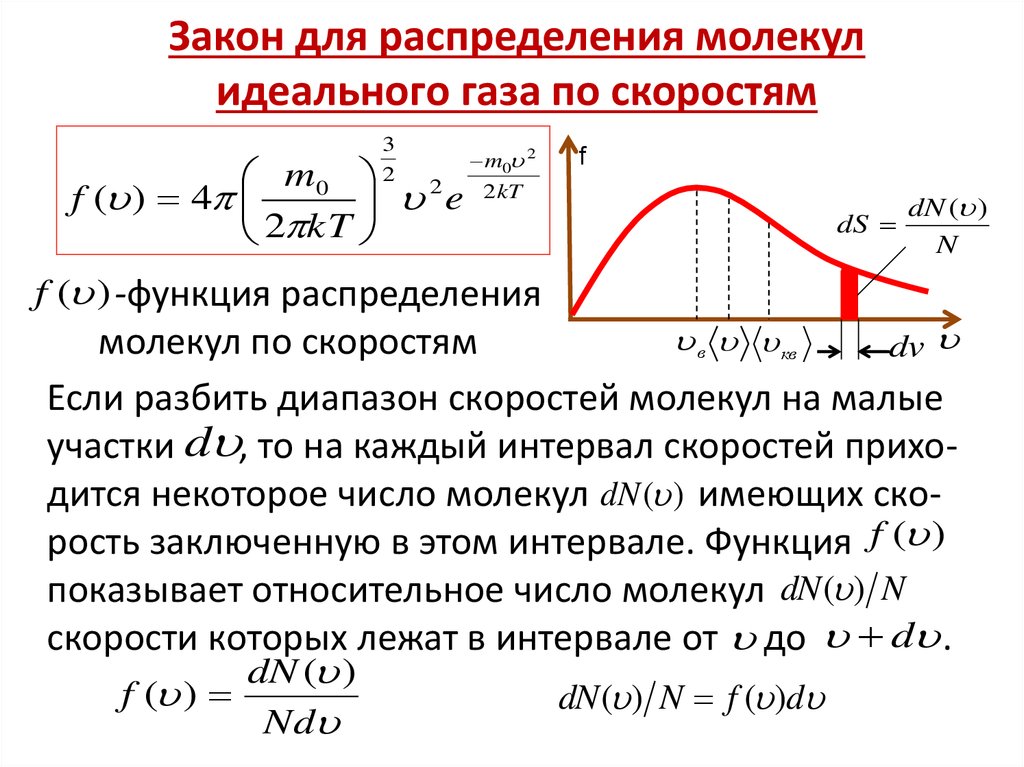
27. Закон для распределения молекул идеального газа по скоростям
32
m0 2
f ( ) 4
e
2 kT
m0 2
2 kT
f ( ) -функция распределения
f
dS
dN ( )
N
в кв
молекул по скоростям
dv
Если разбить диапазон скоростей молекул на малые
участки d , то на каждый интервал скоростей приходится некоторое число молекул dN ( ) имеющих скорость заключенную в этом интервале. Функция f ( )
показывает относительное число молекул dN ( ) N
скорости которых лежат в интервале от до d .
dN ( )
f ( )
dN ( ) N f ( )d
Nd
28.
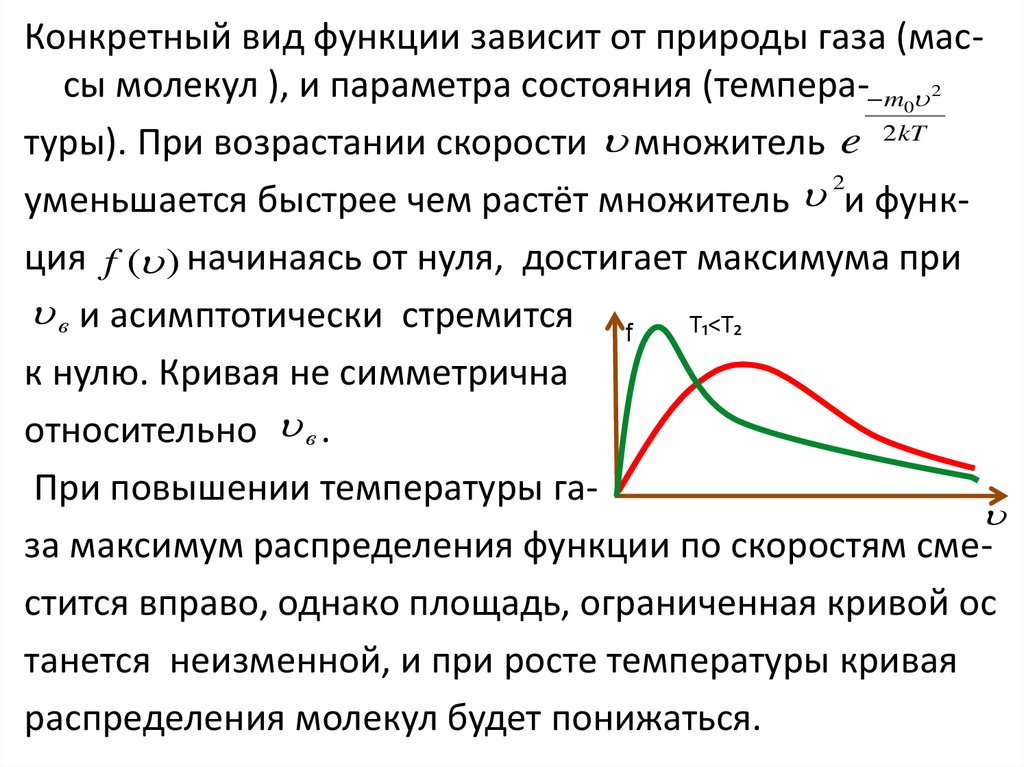
Конкретный вид функции зависит от природы газа (массы молекул ), и параметра состояния (темпера- m0 2туры). При возрастании скорости множитель e 2 kT
2
уменьшается быстрее чем растёт множитель и функция f ( ) начинаясь от нуля, достигает максимума при
в и асимптотически стремится f Т₁<Т₂
к нулю. Кривая не симметрична
относительно в .
При повышении температуры га
за максимум распределения функции по скоростям сместится вправо, однако площадь, ограниченная кривой ос
танется неизменной, и при росте температуры кривая
распределения молекул будет понижаться.
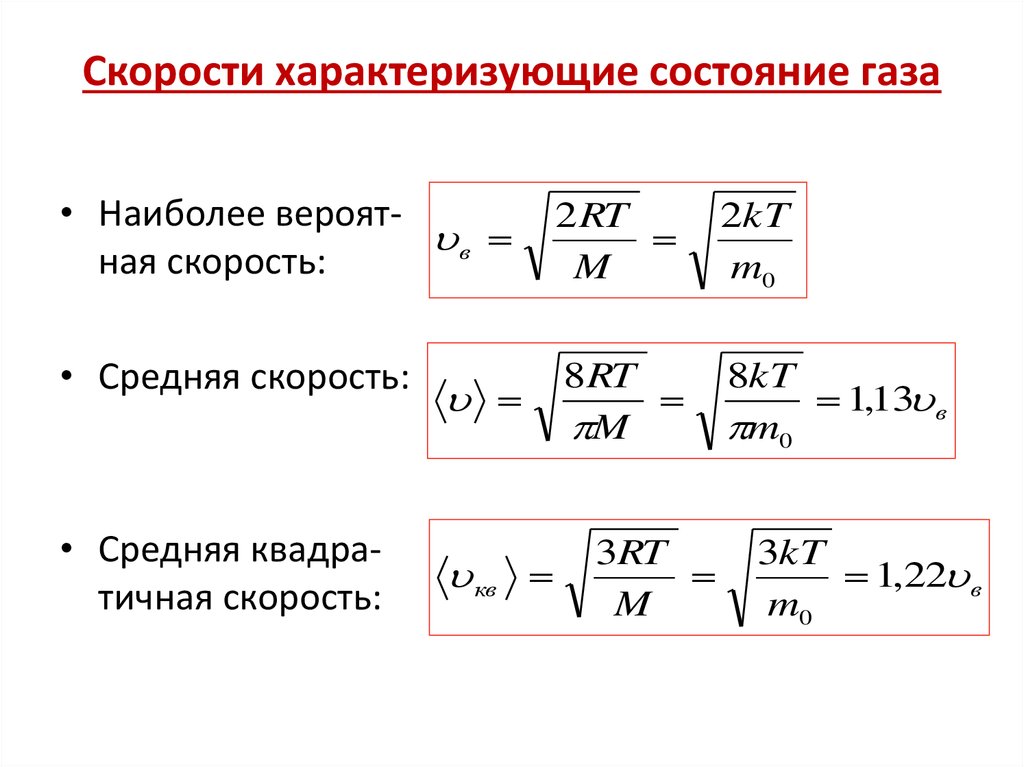
29. Скорости характеризующие состояние газа
• Наиболее вероят вная скорость:
2 RT
M
2kT
m0
• Средняя скорость:
8RT
M
8kT
1,13 в
m0
• Средняя квадратичная скорость:
кв
3RT
M
3kT
1,22 в
m0
30. Функция распределения молекул по энергиям теплового движения
f ( )2
kT
3
2
1
2
e
kT
Функция распределения молекул по энергиям
Средняя кинетическая энергия одной молекулы
идеального газа:
f d
0
3
2
kT
0
2
3
2
e
kT
3
d kT
2
Полученный результат совпадает с полученным
ранее.
31. ФОРМУЛА БОЛЬЦМАНА ЭЛЕМЕНТЫ КЛАССИЧЕСКОЙ СТАТИСТИКИ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА-БОЛЬЦМАНА)
32.
Газы атмосферы находится в потенциальном поле тяготения Земли. Если бы не было:• Поля тяготения Земли: атмосферный воздух рассеялся бы по вселенной
• Теплового движения молекул: молекулы воздуха упали бы на Землю.
Тяготение и тепловое движение приводят к стационарному состоянию газа, при котором происходит убыль
концентрации и давления газа с ростом высоты над
Землей.
Если газ (или другая система частиц) находится во внешнем потенциальном силовом поле, то распределение частиц по объёму описывается с помощью закона Больцмана.
33. Закон Больцмана
Если высота над Землей равна h , то давP₂h
dh
ление Р , на высоте
давление:
P+dP
dh
P dP dh 0 dP 0 (давление с
P
высотой убывает).
h
Разность давлений Р и P dP равна весу газа, заключённого в объёме цилин- P₁ h₁
дра высотой dh с основанием, площадь которого равна единице площади. Значит:
h₂
P P dP gdh
- плотность газа на высоте h ( при изменении высоты на dh плотность газа можно считать постоянной).
dP gdh
34. Барометрическая формула
Используя уравнение состояния идеального газа (УСИГ)m
m PM
PM
dP
gM
PV RT
dP
gdh
dh
M
V RT
RT
P
RT
При большом изменении высоты от h1 до h2 давление
меняется от Р1 до Р2 .
P2
dP
Mg
P P RT
1
h2
h1
P2
Mg
dh ln
(h2 h1 )
P1
RT
Р2 P1e Mg ( h2 h1 ) RT
Барометрическая формула – характеризует атмосферное давление в зависимости от высоты.
35.
Если считать что h1 0 уровень моря, то:Mgh
RT
m0 gh
kT
P P0 e
Где:
P -давление на высоте h
P0 -давление на уровне моря
Так как P nkT ,значит:
n n0 e
Mgh
RT
n0 e
n0 e
En
kT
n 0 -концентрация молекул на уровне моря h 0
n -концентрация молекул на высоте h
E n m0 gh -потенциальная энергия в поле тяготения.
m0 -масса одной молекулы
36. Формула Больцмана
n n0 eEn
kT
Закон Больцмана устанавливает число частиц dn x, y, z
координаты которых находятся в интервале от x до
x dx , от y до y dy , от z до z dz .То есть dn x, y, z число молекул находящееся в элементарном объёме.
Распределение молекул газа по координатам и скоростям , при наличии произвольного потенциального
поля описывают распределением Максвелла-Больцмана .
dn const .e
p x2 p 2y p z2
2 mkT
dxdydze
En x , y , z
kT
dxdydz
37.
dn -число молекул находящихся в шестимерном пространстве в элементе объёма d dxdydzdpx dp y dp zEn x, y, z -потенциальная энергия молекулы во внешнем силовом поле в точке с координатами x, y, z и
проекциями импульса по осям p x , p y , p z .
Закон Максвелла-Больцмана представляет собой произведение двух функций распределения, одна из них
расписывает распределение по координатам, другая
по скоростям.
38. СРЕДНЕЕ ЧИСЛО СТОЛКНОВЕНИЙ СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ
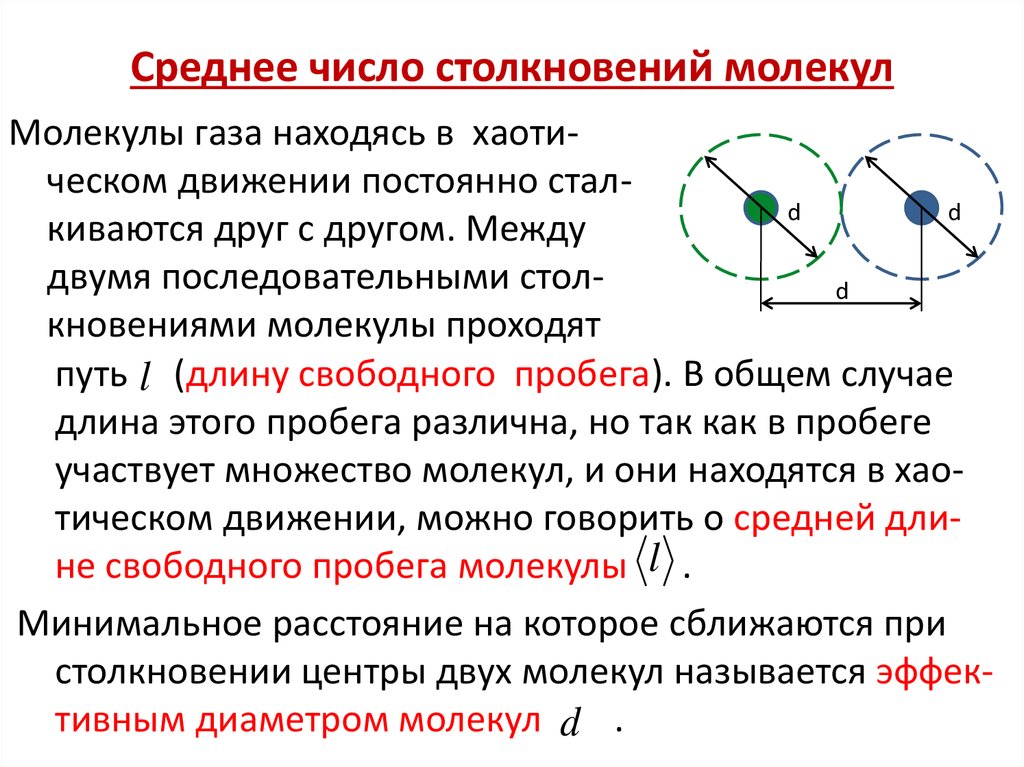
39. Среднее число столкновений молекул
Молекулы газа находясь в хаотическом движении постоянно сталdd
киваются друг с другом. Между
двумя последовательными столd
кновениями молекулы проходят
путь l (длину свободного пробега). В общем случае
длина этого пробега различна, но так как в пробеге
участвует множество молекул, и они находятся в хаотическом движении, можно говорить о средней длине свободного пробега молекулы l .
Минимальное расстояние на которое сближаются при
столкновении центры двух молекул называется эффективным диаметром молекул d .
40.
Эффективный диаметр молекул зависит от скоростисталкивающихся молекул, от температуры газа (немного растёт с ростом температуры).
В среднем за 1 секунду молекула проходит путь равный
средней арифметической скорости ( 1), и если
z среднее число столкновений испытанное молекулой за 1 секунду, то средняя длина свободного пробега:
l
z
41.
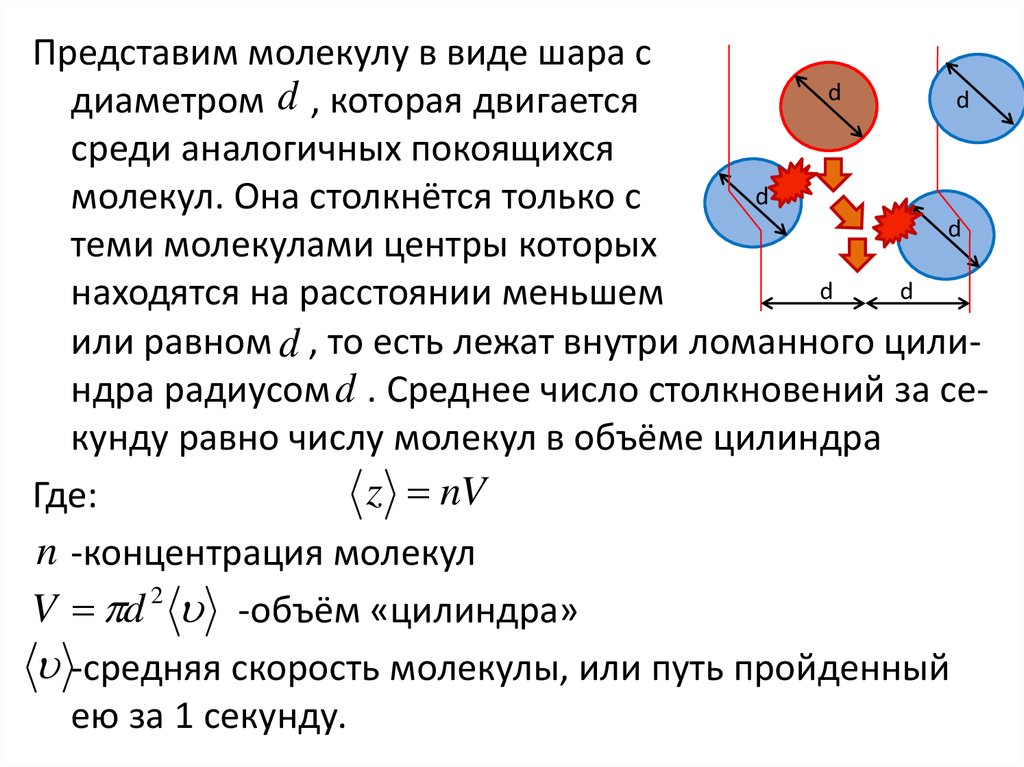
Представим молекулу в виде шара сd
d
диаметром d , которая двигается
среди аналогичных покоящихся
d
молекул. Она столкнётся только с
d
теми молекулами центры которых
d
d
находятся на расстоянии меньшем
или равном d , то есть лежат внутри ломанного цилиндра радиусом d . Среднее число столкновений за секунду равно числу молекул в объёме цилиндра
z nV
Где:
n -концентрация молекул
2
V d -объём «цилиндра»
-средняя скорость молекулы, или путь пройденный
ею за 1 секунду.
42.
Среднее число столкновений:2
z n d
Среднее число столкновений, с учётом движения других молекул:
z 2n d 2
Средняя длина свободного пробега молекул:
1
l
2
2n d
Значит l обратно пропорциональна концентрации молекул n . Так как Р nkT при постоянной температуре T концентрация молекул n пропорциональна
l1
давлению Р и значит:
n2 P2
l2
n1 P1
43. ЯВЛЕНИЯ ПЕРЕНОСА В ТЕРМОДИНАМИЧЕСКИ НЕРАВНОВЕСНЫХ СРЕДАХ
44.
В термодинамически неравновесных средах возникаютособые необратимые процессы называемые
явлениями переноса в результате которых происходит перенос энергии, массы, импульса. Это:
• Теплопроводность (перенос энергии)
• Диффузия (перенос массы)
• Внутреннее трение (перенос импульса)
Для простоты ограничимся одномерными явлениями
переноса.
45. Теплопроводность
Если в одной области газа кинетическая энергия больше чем вТ(Е )
другой, то, с течением времени,
вследствие постоянного столкновения молекул, происходит процесс выравнивания
средних кинетических энергий молекул (температур).
Перенос энергии в виде температур подчиняется
Закону Фурье
к
dT
j E
dx
46.
j E- плотность теплового потока (величина определяемаяэнергией переносимой в форме теплоты в единицу
времени через единичную площадку перпендикулярную положительному направлению потока).
- теплопроводность (коэффициент теплопроводности).
dT - градиент температуры равен скорости изменения
dx температуры на единицу длины х в направлении к
нормали к этой площадке.
При теплопроводности энергия переносится в направлении убывания температуры ( j E и dT dx противоположны по знаку). Теплопроводность численно равна
плотности теплового потока при градиенте температуры равной единице:
1
cV l
3
47.
cV - удельная теплоёмкость газа при постоянном объёме.(количество теплоты необходимое для нагревания 1 кг газа на 1 К при постоянном объёме.- плотность газа
-средняя скорость теплового движения молекул
l - средняя длина свободного пробега молекул
48. Диффузия
Диффузия - самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов,жидкостей или твёрдых тел.
Диффузия - обмен масс между телами.
Для однородного газа диффузия подчиняется
Закону Фика
d
jm D
dx
j m -плотность потока массы (величина определяемая
массой вещества диффундирующего в единицу времени через единичную площадку
перпендикулярную потоку.
49.
D -диффузия (коэффициент диффузии)d -градиент плотности равен скорости изменения
dx плотности на единицу длины х в направлении к нормали этой площадки. Перенос массы осуществляется
в направлении убывания плотности (знаки j m и d dx
противоположны).
Диффузия численно равна плотности потока массы при
градиенте плотности равном единице.
1
D l
3
50. Вязкость. Внутреннее трение
v₁<v₂Вязкость (внутреннее трение)свойство жидкостей или газов
v₁
v₂
оказывать сопротивление перемещению одной части вещества
относительно другой.
При прохождении одних слоев жидкости (газа) относительно других , возникают силы внутреннего трения,
направленные по касательной к поверхности слоев.
Действие этих сил проявляется в том, что со стороны
слоя двигающегося медленнее, на слой двигающийся быстрее действует тормозящая сила. И наоборот
на слой двигающийся медленнее со стороны более
51.
быстрого слоя действует ускоряющая сила. Сила внутреннего трения тем больше, чем больше рассматриваемая поверхность и зависит от того, насколько быстроменяется скорость течения жидкости (газа) при переходе от слоя к слою. Пусть 2 1 скорости слоев газа
(жидкости) и 2 1 разница между скоростями
слоев . Направление в котором отсчитывается расстояние между слоями газа (жидкости) х перпендикулярно скоростям течения слоев жидкости.
Величина x показывает как быстро меняется скорость при переходе от слоя к слою в направлении х
перпендикулярном направлению движения слоев и
называется градиентом скорости. Модуль сил внут
реннего трения:
F
S
x
52.
-коэффициент пропорциональности, зависящий отприроды жидкости (газа) называется динамической
вязкостью . (Единица измерения Па с) равен динамической вязкости среды в которой при градиенте скорости с модулем равным 1 м/с на 1 м, возникает сила
1 Н на 1 м² поверхности касания слоев.
Чем больше вязкость, тем сильнее вещество отличается
от идеального, и тем большие силы внутреннего трения в них возникают. Вязкость зависит от температуры (у жидкостей с ростом температуры уменьшается,
у газов увеличивается).
Течение называется ламинарным если вдоль потока
каждый выделенный слой скользит относительно соседних не перемешиваясь с другими и турбулентным
если вдоль потока происходит перемешивание газа.
53.
Внутреннее трение подчиняетсяЗакону Ньютона
d
F
S
j p
dx
x
j p -плотность потока импульса (величина определяемая
полным импульсом переносимым в единицу времени в положительном направлении потока через единичную площадку перпендикулярную пути потока
(импульс переносится в направлении убывания скорости, знаки j p и d dx противоположны)).
Динамическая вязкость численно равна плотности
потока импульса, при градиенте скорости равном 1:
1
l
3
54.
Закономерности всех явлений переноса сходны междусобой, сходство их математических выражений обусловленно общностью процесса перемешивания молекул в процессе их хаотического движения и сталкивания между собой.
Коэффициенты , D, связаны между собой:
1
3 cV l
D
1
D l
1
3
cV
1
l
3
55. ЗАКОНЫ ТЕРМОДИНАМИКИ
56. Термодинамическая система
Термодинамическая система- макроскопические объекты (тела и поля) которые могут обмениваться энергией как с друг другом так и со внешней средой, то естьс телами и полями, которые являются внешними по
отношению к данной системе.
Произвольная термодинамическая система находящаяся в любом термодинамическом состоянии обладает
полной энергией E складывающейся из: кинетичесм ех
кой энергии E к (энергии механического движения
как целого или её макроскопических частей), потенвн
E
циальной энергии п (во внешних силовых полях:
гравитационного, электромагнитного и т.д.), внутренней энергии U
E Е м ех Е вн U
к
п
57. Внутренняя энергия системы
Внутренней энергией тела (или системы тел) U называется энергия зависящая только от термодинамического состояния тела (системы) и включающая в себяэнергию всех видов внутреннего движения в системе
(теле) и энергию взаимодействия всех частиц (ионов,
атомов, молекул) входящих в тело (систему). Внутренняя энергия совпадает с энергией покоя системы.
58.
Например, внутренняя энергия газа,состоящего из многоатомных молекул, складывается из:• Кинетической энергии Eк теплового поступательного
и вращательного движения молекул.
• Кинетической Eк и потенциальной Eп энергий колебаний атомов в молекулах.
• Потенциальной энергии Eп обусловленной межмолекулярными взаимодействиями (не учитывается
для идеального газа).
• Энергии электронных оболочек атомов и ионов.
• Кинетической Eк и потенциальной Eп энергий взаимодействия нуклонов в ядрах атомов.
59.
Внутренняя энергия является однозначной функциейтермодинамического состояния системы. Её значение не зависит от того, с помощью какого процесса
система пришла в данное состояние. Изменение U
при переходе системы из одного состояния 1 в другое 2 равно U U 2 U1 , и не зависит от вида процесса перехода из 1 в 2. Если система совершает круговой процесс, то полное изменение внутренней
энергии: dU 0
В идеальном газе молекулы между собой не взаимодействуют, следовательно внутренняя энергия будет
равна: U N
N -число молекул
i
kT -средняя энергия одной молекулы
2
60. Степени свободы
i степень свободы – число независимых переменных(координат) определяющих положение системы в
пространстве
z
Для материальной точки (молекулы) i 3 число
координат трёхмерного пространства (x,y,z)
x
y
Для двухатомного газа (совокупность 2 материальных точек, жестко связанных недеформи- z
рованной связью) i 5 (x,y,z-3 поступательx
ные, 2 –вращательные)
y
Для трёх- и многоатомных молекул i 6 (3z
поступательные, 3- вращательные
x
y
61.
Внутренняя энергия для 1 моля идеального газаi
i
U m kTN a RT
2
2
Внутренняя энергия для газа массой m
i m
i
U
kTN a RT
2M
2
Элементарное изменение внутренней энергии
i m
i
dU
kN a dT RdT
2M
2
62. Первое начало термодинамики
63.
Обмен энергией между термодинамическойсистемой и внешними телами происходит либо при
совершении работы, либо с помощью теплообмена.
• Количество энергии переданное системе внешними
телами путём теплообмена называется количеством
теплоты Q сообщенной системе.
• Количество энергии переданное системе внешними
телами при силовом взаимодействии между ними
называется работой А .
64.
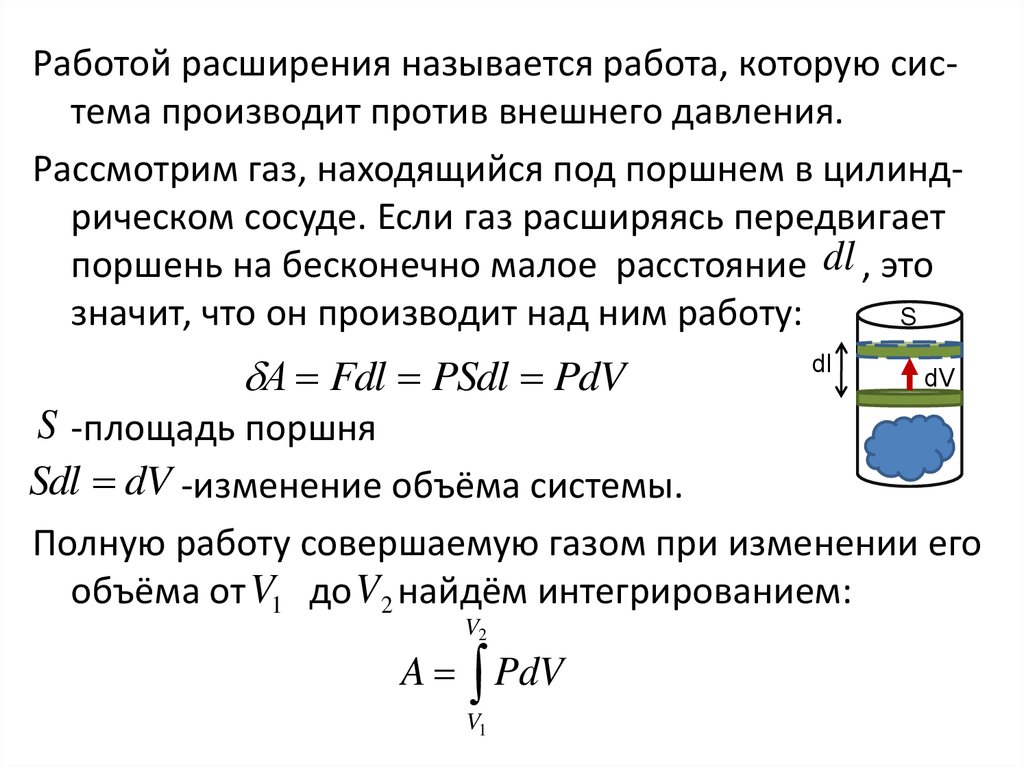
Работой расширения называется работа, которую система производит против внешнего давления.Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде. Если газ расширяясь передвигает
поршень на бесконечно малое расстояние dl , это
значит, что он производит над ним работу:
S
А Fdl PSdl PdV
dl
dV
S -площадь поршня
Sdl dV -изменение объёма системы.
Полную работу совершаемую газом при изменении его
объёма от V1 до V2 найдём интегрированием:
V2
A PdV
V1
65.
Изменение внутренней энергии U12закрытой системы (системы которая не может обмениваться веществом с внешней средой), которое происходит припереходе системы из состояния 1 в состояние 2 ,
совершенной над системой
равно сумме работы А12
внешними силами и количества теплотыQ сообщаемого системе.
Q12
U12 A12
А12 А12 - работа совершенная системой над
внешними телами в процессе 12.
66. Первое начало термодинамики
U Q AКоличество теплоты, сообщенное системе, расходуется
на изменение внутренней энергии и совершение
системой работы против внешних сил.
В дифференциальной форме уравнение имеет вид:
Q dU dA
dU -бесконечно малое изменение внутренней энергии
системы.
dA -элементарная работа
Q -бесконечно малое количество теплоты
Единицы измерения всех этих величин-Дж (джоули).
67. ТЕПЛОЕМКОСТЬ
68. Теплоемкость
• Теплоемкость C - физическая величина численно равная отношению количества теплоты Q к изменениютемпературы тела dT в рассматриваемом термодинамическом процессе. Единица измерения (Дж/К).
Q
C
dT
• Удельная теплоемкость c - теплоемкость единицы
массы тела (количество теплоты необходимое для
нагревания 1 кг вещества на 1 К) (Дж/кгК).
C
Q
c
m mdT
69.
• Молярная теплоемкость C m -теплоемкость одногомоля вещества (Дж/мольК).
C
Q M Q
C m cM
dT mdT
Различают теплоемкости при постоянном объеме и
постоянном давлении, если в процессе нагревания
вещества его объем или давление поддерживаются
постоянными. С учетом A PdV , C m Q dT
первое начало термодинамики для 1 моля газа имеет вид:
Cm dT dU m PdV
Для произвольной массы газа, то же самое уравнение:
СdT dU PdV
70. Теплоемкость при изохорном процессе (V=const)
Если газ нагревается при постоянном объеме, то работавнешних сил равна нулю, и сообщаемая извне газу
теплота идет на увеличение его внутренней энергии
m
A PdV 0 Q dU dU m CV dT
M
Молярная теплоемкость газа при постоянном объеме
равна изменению внутренней энергии 1 моля газа
при повышении температуры на 1 К.
dU m
iR
CV dT
CV 2
m iR
i
dU m RdT
Q
dT
M 2
2
71. Теплоемкость при изобарном процессе (P=const)
При изобарном процессе теплоемкость можно выразить через первое начало термодинамики:CР
dU m PdVm
dT
dT
dU m
dT
Так как
не зависит от вида процесса (внутренняя
энергия идеального газа не зависит ни от P , ни отV , а
определяется только температурой Т ) и всегда равна СV
то продифференцировав уравнение PVm RТ по Т получим:
PdV
RdT
m
dT
Следовательно:
dT
R
dU m
iR
i 2
СP
R CV R R
R
dT
2
2
72.
С P CV R - Уравнение МайераУравнение Майера показывает, что изобарная теплоемкость всегда больше изохорной на величину газовой
постоянной. При изобарном процессе работа равна:
V2
m
A PdV P(V2 V1 )
R(T2 T1 )
M
V1
Физический смысл молярной газовой постоянной R: если Т₂-Т₁=1 К, то для 1 моля идеального газа R=А, то
есть: R численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на 1 К.
При сообщении газу массой m количества теплоты Q его
внутренняя энергия возрастёт на величину dU m M CV dT
m
Q C p dT C v dT RdT
M
73. Теплоемкость при изотермическом процессе (Т=const)
При изотермическом процессе (dT 0 dU 0 ) теплоемкость определяется:dQ
Сm
dT
Работа равна:
V2
V2
V2 m
P1
m
dV m
A PdV RT
RT ln
RT ln
M
V
M
V1 M
P2
V1
V1
Следовательно:
m
dT 0 dU CV dT 0 Q A Q A
M
Q A
74. АДИАБАТИЧЕСКИЙ ПРОЦЕСС
75.
Адиабатическим называется процесс, при котором отсутствует теплообмен между системой и окружающейсредой .( к нему можно отнести все быстро протекающие процессы).
Q 0
Согласно первому закону термодинамики:
Q A dU dU A
Вся внешняя работа системы совершается за счет изменения внутренней энергии.
Для адиабатического процесса характерно:
m
PdV CV dT
M
m
PdV VdP
RdT
M
C P CV С p
PdV VdP
R
1
PdV
CV
CV
CV
76.
2 i 2 R i 2CV
2iR
i
Сp
ɣ-показатель адиабаты (коэффициент Пуассона)
dP
dV
P
V
Проинтегрируем уравнение пределах от P1 ,V1 до P2 ,V2
соответственно получим:
1
2
V
P2
ln ln
P1
V
P2 V1
P1V1 P2V2
P1 V2
PV const
Уравнение адиабатического процесса (уравнение Пуассона)
TV 1 const
T Р 1 const
77.
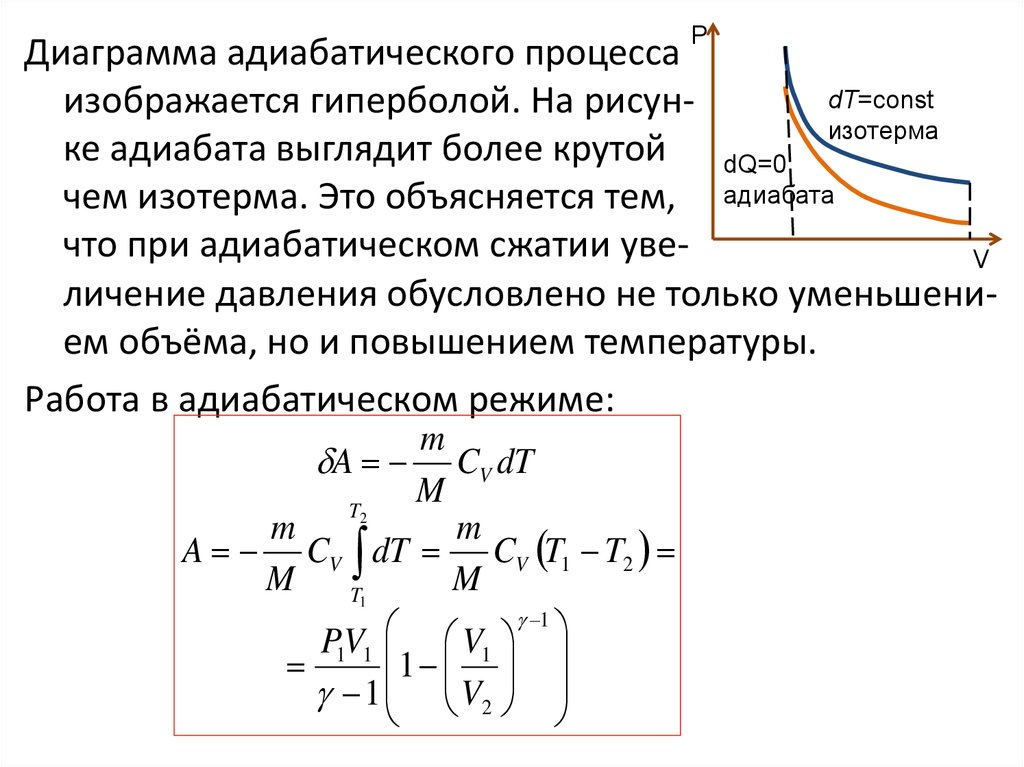
РДиаграмма адиабатического процесса
dT=const
изображается гиперболой. На рисунизотерма
ке адиабата выглядит более крутой dQ=0
чем изотерма. Это объясняется тем, адиабата
что при адиабатическом сжатии увеV
личение давления обусловлено не только уменьшением объёма, но и повышением температуры.
Работа в адиабатическом режиме:
m
A CV dT
M
T2
m
m
A CV dT CV T1 T2
M
M
T1
1
P1V1 V1
1
1 V2
78.
Работа совершаемая при адиабатическом расширениименьше чем при изотермическом, потому что при
адиабатическом расширении происходит охлаждение газа, а при изотермическом температура остается
постоянной из-за притока извне эквивалентного количества теплоты.
Рассмотренные изохорный, изобарный, изотермический и адиабатный процессы имеют общую особенность: они происходят при постоянной теплоемкости.
Процесс, при котором теплоемкость постоянна, называется политропным. Исходя из первого начала термодинамики, при условии постоянства теплоемкости,
можно вывести уравнение политропы
PV n const
79.
C Cpn
C CV
n
- показатель политропы
C • 0, n
-уравнение адиабаты
-уравнение изобары
C • СP , n 0
-уравнение изотермы
C • , n 1
-уравнение изохоры
C • СV , n
Все рассмотренные процессы- частные случаи политропного процесса.
80. Квантование энергии
В идеальном случае молярные теплоемкости зависяттолько от числа степеней свободы, и не зависят от
температуры. Это справедливо для одноатомных
газов. Но уже у двухатомных газов число степеней
свободу проявляющееся в теплоемкости зависит от
температуры.
Исследования показали что у двухатомного газа (водорода) изохорная теплоемкость СV равна:
3
• При низкой температуре (<50⁰ С) СV R
2
5
• При средней (комнатной) температуре СV R
2
7
• При высокой температуре СV R
2
Данное явление можно объяснить тем, что при низких
температурах наблюдается только поступательное
81.
движение молекул, при комнатной температуре добавляется вращение, а при высокой температуре добавляются и колебания.Расхождение теории и эксперимента можно объяснить
квантованием энергии вращения и колебания, то есть
тем, что при вычислении теплоемкости необходимо
учитывать то, что возможны не любые колебательные
и вращательные движения , а лишь определённый
дискретный ряд значений энергий. Если энергия теплового движения недостаточна (например для возбуждения колебаний), то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень
свободы «замораживается» и к ней не применим закон распределения энергии). Этот процесс называется
квантованием энергии
82. КРУГОВОЙ ПРОЦЕСС. (ЦИКЛ)
83. Круговой процесс (цикл).
Круговой процесс (цикл)-совокупРa
2
ность термодинамических про1
цессов, в результате которых сисb
V₁
V₂ V
тема возвращается в исходное состояние. В диаграммах изображаются замкнутыми
кривыми, где началу и концу цикла соответствует одна и та же точка. Термодинамическая система совершающая круговой процесс называется рабочим телом
Обычно это газ. Круговые процессы лежат в основе
деятельности всех тепловых машин.
Цикл можно разбить на процесс расширения (из состояния 1 в состояние 2) и процесс сжатия (из 2 в 1).
84.
При расширении газа цикл выполняет положительнуюработу A1 измеряемую площадью фигуры (V₁1a2V₂).
Сжатие газа происходит под действием внешних сил,
которые совершают положительную работу A2 А2 ,
измеряемую площадью (V₁1b2V₂). Так как А1 А2 то
цикл совершает работу А А1 А2 А1 А2 ограниченную кривой (1а2b1) .
Прямым циклом называется круговой процесс в котором система совершает положительную работу
А PdV 0, замкнутая кривая на диаграмме P-V изображая прямой цикл описывается по часовой стрелке
Обратный цикл это круговой процесс в котором система
совершает отрицательную работу А PdV 0 (замкнутая кривая против часовой стрелки).
85.
В связи с тем , что полное изменение внутренней энергии рабочего тела (газа) в результате кругового процесса равно 0, ( U 0 ) первое начало термодинамикиимеет вид:
Q U A A
Q -общее количество теплоты сообщенное газу в круговом процессе
А - работа газа в круговом процессе
В прямом цикле А 0, Q 0 газ совершает работу за
счёт сообщенной ему теплоты. В обратном цикле совершается работа А A, ( A 0) и от газа отводится
эквивалентное количество теплоты.
86.
Термодинамический процесс обратимый, если он может происходить как в прямом, так и в обратном направлениях через одни и те же промежуточные состояния , причем, когда система возвращается в исходноесостояние, то ни в ней, ни в окружающей среде изменений не происходит. Всякий не удовлетворяющий
этим условиям процесс необратимый.
Термический КПД для кругового цикла имеет вид:
Q2
A Q1 Q2
1
Q
Q1
Q1
-КПД
Q1 -количество теплоты полученное системой
Q2 -количество теплоты отданное системой
Q Q1 Q2 -общее количество теплоты
87. ТЕПЛОВОЙ ДВИГАТЕЛЬ ЦИКЛ КАРНО
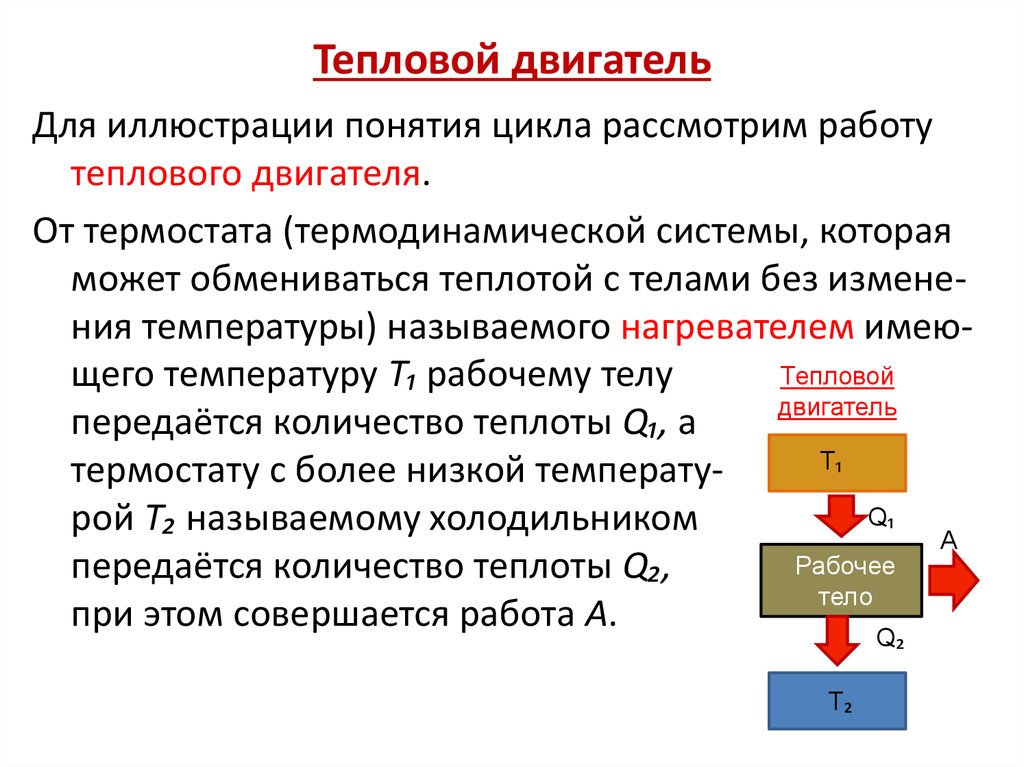
88. Тепловой двигатель
Для иллюстрации понятия цикла рассмотрим работутеплового двигателя.
От термостата (термодинамической системы, которая
может обмениваться теплотой с телами без изменения температуры) называемого нагревателем имеюТепловой
щего температуру Т₁ рабочему телу
двигатель
передаётся количество теплоты Q₁, а
Т₁
термостату с более низкой температуQ₁
рой Т₂ называемому холодильником
A
Рабочее
передаётся количество теплоты Q₂,
тело
при этом совершается работа А.
Q₂
Т₂
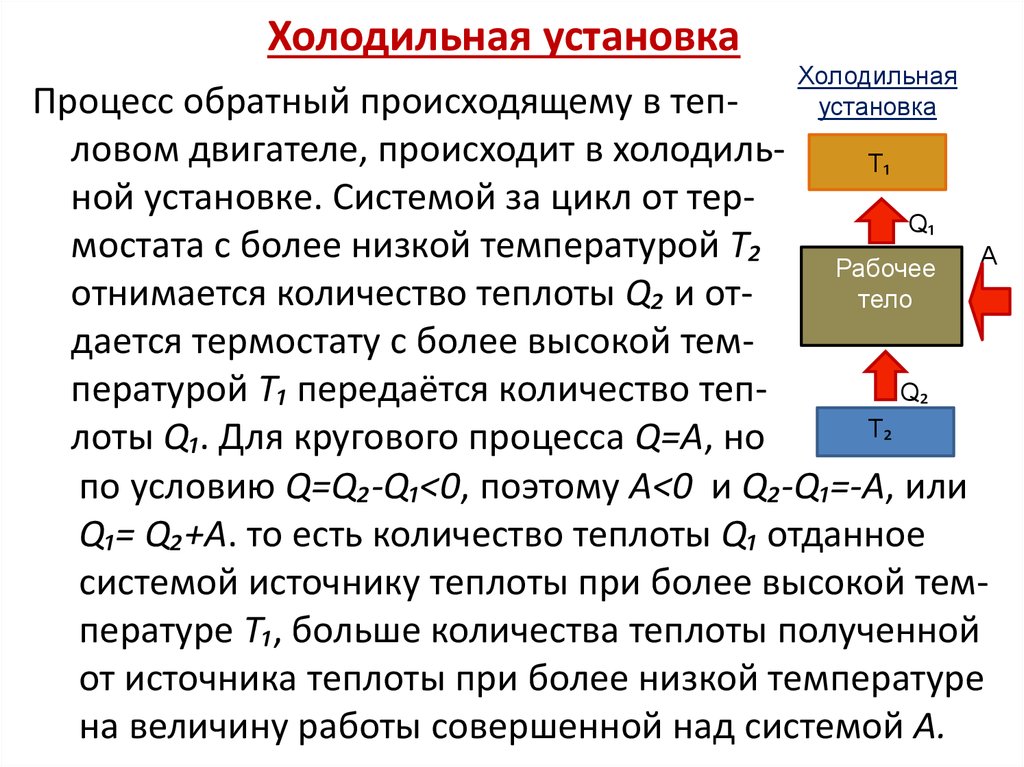
89. Холодильная установка
Холодильнаяустановка
Процесс обратный происходящему в тепловом двигателе, происходит в холодильТ₁
ной установке. Системой за цикл от терQ₁
мостата с более низкой температурой Т₂
A
Рабочее
отнимается количество теплоты Q₂ и оттело
дается термостату с более высокой температурой Т₁ передаётся количество тепQ₂
Т₂
лоты Q₁. Для кругового процесса Q=А, но
по условию Q=Q₂-Q₁<0, поэтому А<0 и Q₂-Q₁=-А, или
Q₁= Q₂+А. то есть количество теплоты Q₁ отданное
системой источнику теплоты при более высокой температуре Т₁, больше количества теплоты полученной
от источника теплоты при более низкой температуре
на величину работы совершенной над системой А.
90. Цикл Карно
изотермыКарно разработал наиболее эко- Р 1 Q₁>0
2
номичный цикл, состоящий из
А
адиабаты
двух изотерм и двух адиабат, в
4
котором в качестве рабочего
3
Q₂<0
тела используется идеальный
V
газ заключенный в сосуд с поршнем.
При изотермическом расширении (dT 0 U const )
(участок траектории 1-2) газ находится в тепловом
контакте с нагревателем имеющим постоянную температуру Т1 const . От нагревателя получаем некоторое количество теплоты Q1 0 , после этого газ теплоизолируется (участок траектории 2-3) и расширение
происходит адиабатически. На участке 3-4 газ входит
91.
в тепловой контакт с холодильником, имеющим постоянную температуру Т1 Т 2 const . При этом газ изотермически сжимается и передаёт холодильнику количество теплотыQ2 . Затем система снова изолируется, и в процессе 4-1 адиабатно сжимается до своегопервоначального состояния (точка 1).
Работа которую совершает газ в цикле Карно:
A Q Q1 Q2
Термическое КПД цикла Карно:
A
Qповед
V2 m
V2
m
RT1 ln
RT 2 ln
Q1 Q2 M
V1 M
V1 T1 T2
V2
m
Q1
T1
RT1 ln
M
V1
92.
T1 T2Т2
1
T1
Т1
Для прямого цикла Карно справедливо соотношение:
Q1 Q2
Q1
T1 T2
Q1
Q2
T1
T1
T2
В обратном цикле Карно количество теплоты Q1 отводится от газа в процессе 2-1 изотермического сжатия
при температуре Т1 , а количество теплоты Q2 подводится к газу в процессе 4-3 изо- Р 1 Q₁<0
изотермы
термического расширения при
2
условии Т1 Т 2 , а Q1 0, Q2 0 и
адиабаты
работа A Q1 Q2 0 соверша4
емая в один цикл отрицатель3
Q₂>0
ная. Это справедливо для люV
93.
бого обратного цикла. Если рабочее тело совершаетобратный цикл, то при этом осуществляется передача теплоты от холодного тела горячему за счет совершения работы внешними силами.
Величина равная отношению теплотыQотв отведенной в
обратном цикле от охлаждаемого тела к совершенной в этом цикле работе A называется холодильным
коэффициентом .
Q
отв
A
Для обратного цикла Карно справедливо:
Qотв Q2 A A Q1 Q2 Q1 Q2
Холодильный коэффициент обратного цикла Карно
равен:
Q2
T2
Q1 Q2
T1 T2


















































































 physics
physics








