Similar presentations:
Уравнение состояния
1.
Уравнение состояния.Чужков Юрий Петрович
Доцент кафедры Физики, к.ф-м.н
2.
План занятия.1. Микропараметры и макропараметры.
2. Уравнение состояния идеального газа.
3. Давление газа на стенки сосуда.
4. Степени свободы сложной системы.
5. Закон равнораспределения энергии.
6. Примеры и задачи.
3.
Основы молекулярно – кинетической теорииМикропараметры
Координаты
x, y, z
молекулы
Импульс
молекулы p = mυ
Макропараметры
Давление P
Броуновское
движение
Температура T
P2>P1 T2>T1
V2<V1
Объем V
Задача статистической механики – выразить свойства системы в целом
через характеристики отдельных молекул, т.е. перекинуть мост между
макро – и микроскопическими описаниями системы.
4.
Уравнение состояния идеального газаИдеальный газ – газ, взаимодействием молекул которого
Идеальный
газ – газ, взаимодействием молекул
можно пренебречь.
которого можно пренебречь.
Соотношение, определяющее связь между параметрами
состояния какого-либо тела, называется уравнением
состояния
F(p,V,T) = 0
F(p,V,T) - некоторая функция параметров тела
T –Термодинамическая температура. Единица измерения - Кельвин (К)
Термодинамическая температура Т связана с температурой t по шкале
Цельсия соотношением: Т = t + 273.15
Температура, равная 0К, называется абсолютным нулем температуры
5.
Газовые законыЗакон Бойля – Мариотта
pV = const
Закон Гей – Люссака
Объем некоторой массы газа
при постоянном давлении
пропорционален его
абсолютной температуре
V
При изотермическом процессе
произведение объема данной
массы на его давление постоянно.
P = const
T= const
p
T1>T3
T3
0
T
0
pV
const
T
V
Уравнение Клапейрона
6.
Физические основы МКТУравнение состояния идеального газа
Моли всех газов при одинаковых условиях (при одинаковых
температуры и давлении) занимают одинаковый объем
При нормальных условиях (Т = 273 К и р = 105 Па) объем моля
любого газа равен 22,4 ∙10-3 кг/моль
Когда количество газа равно одному молю, величина константы R в
уравнении Клапейрона одинакова для всех газов
pV/T = R
R =8.31Дж/моль∙К –универсальная газовая постоянная
pV RT
Уравнение состояния идеального газа для 1 моля.
7.
Уравнение состояния идеального газа.pV
m
RT
Уравнение Менделеева -Клапейрона
Умножим и разделим правую часть на число Авогадро NA
N
m
N A - Число молекул в газе массой m
m NA
m
R
R
pV
RT N A
T N
T
NA
NA
NA
R
pV N
T
NA
R
8 ,31
23
k
1
,
38
*
10
Дж/К -постоянная Больцмана
23
N A 6 ,02 * 10
8.
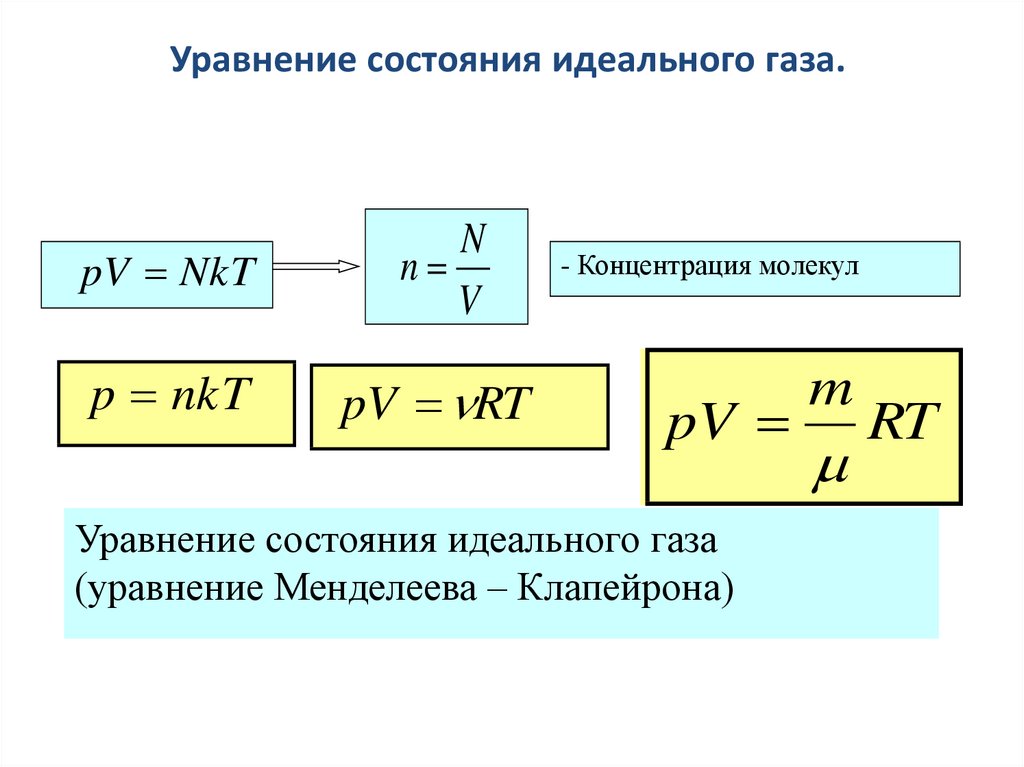
Уравнение состояния идеального газа.pV NkT
N
n
V
p nkT
pV RT
- Концентрация молекул
pV
Уравнение состояния идеального газа
(уравнение Менделеева – Клапейрона)
m
RT
9.
Термодинамические параметры и процессыДавление
газа на стенки сосуда
Основным уравнением кинетической теории газов принято называть
уравнение , устанавливающее связь между давлением газа, его
объемом и энергией.
1. Давление газа на стенку не зависит от формы сосуда
2. Отражение молекул происходит по зеркальному закону;
vx
3. Если газ находится в равновесии, все направления
vx
F
p n
S
движения молекул равновероятны
Давление, оказываемое молекулами на стенку численно
равно среднему значению силы, действующей на единицу
площади стенки нормально к ее поверхности и возникает
вследствие ударов о нее молекул.
10.
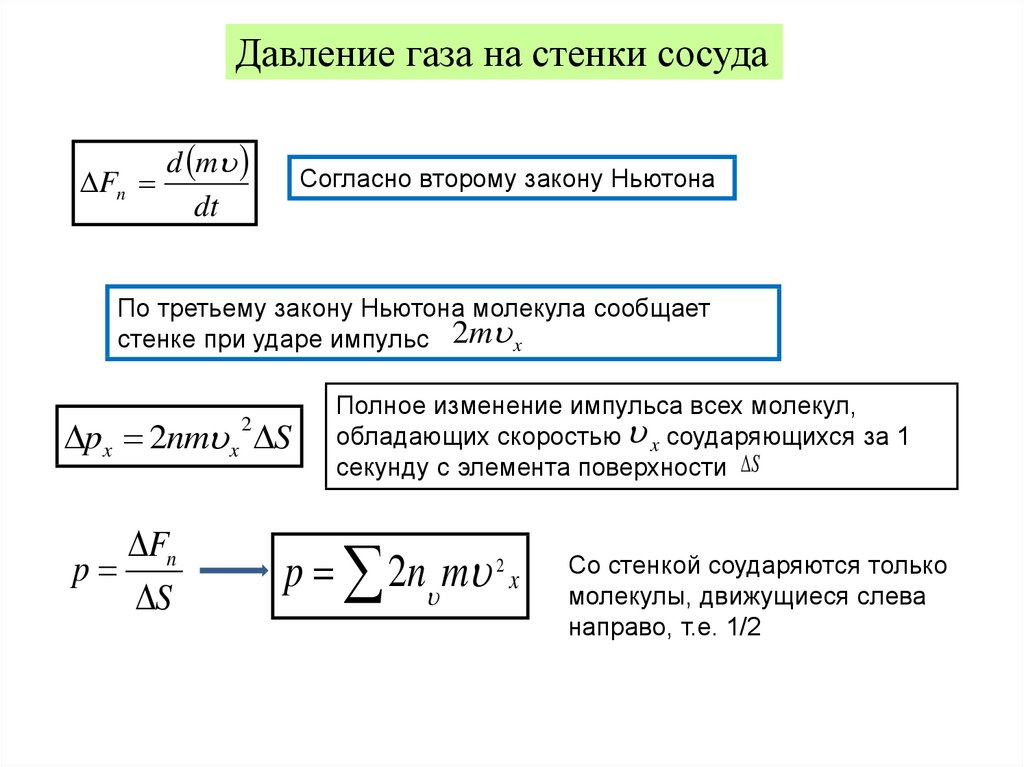
Термодинамические параметры и процессыДавление
газа на стенки сосуда
Fn
d m
dt
Согласно второму закону Ньютона
По третьему закону Ньютона молекула сообщает
стенке при ударе импульс 2m x
px 2nm x S
2
Fn
p
S
Полное изменение импульса всех молекул,
обладающих скоростью x соударяющихся за 1
секунду с элемента поверхности S
p 2n m 2 x
Со стенкой соударяются только
молекулы, движущиеся слева
направо, т.е. 1/2
11.
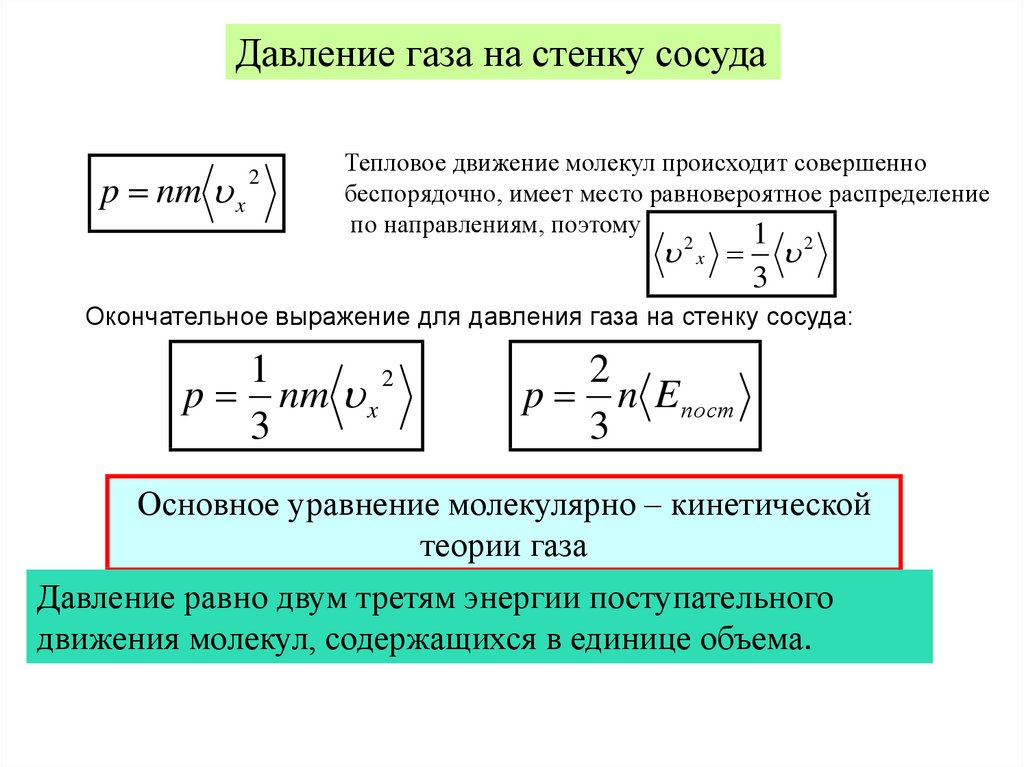
Термодинамические параметры и процессыДавление
газа на стенку сосуда
p nm x
2
Тепловое движение молекул происходит совершенно
беспорядочно, имеет место равновероятное распределение
по направлениям, поэтому
1
2x
3
2
Окончательное выражение для давления газа на стенку сосуда:
1
2
p nm x
3
2
p n E пост
3
Основное уравнение молекулярно – кинетической
теории газа
Давление равно двум третям энергии поступательного
движения молекул, содержащихся в единице объема.
12.
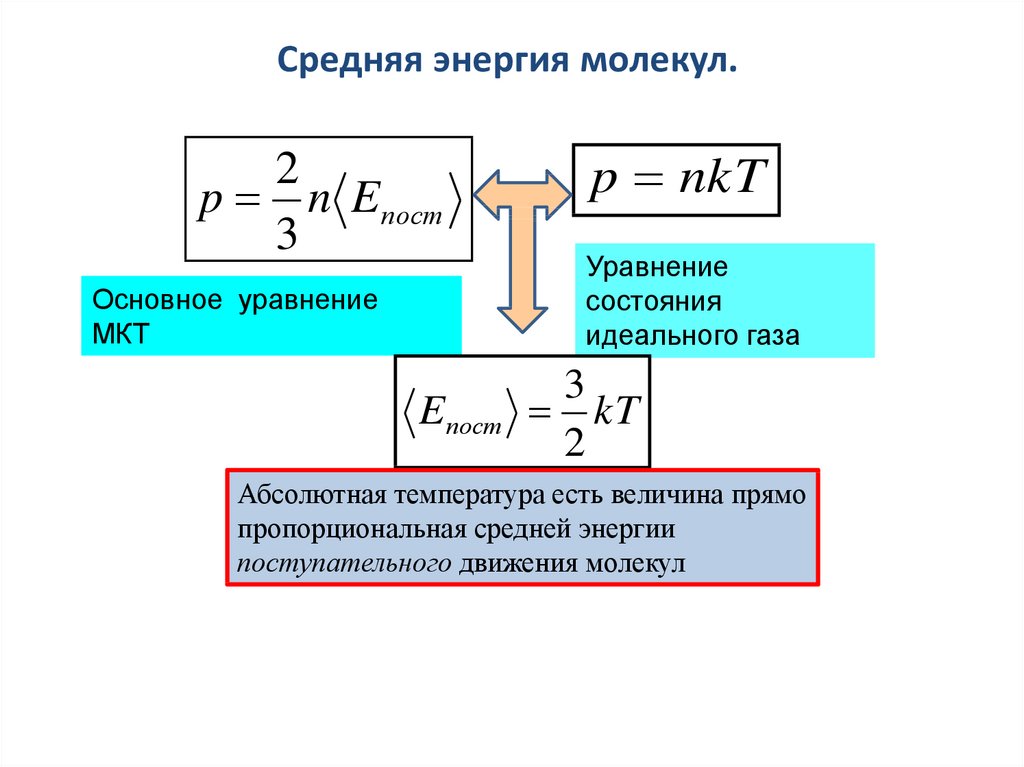
Средняя энергия молекул.2
p n E пост
3
Основное уравнение
МКТ
Eпост
p nkT
Уравнение
состояния
идеального газа
3
kT
2
Абсолютная температура есть величина прямо
пропорциональная средней энергии
поступательного движения молекул
13.
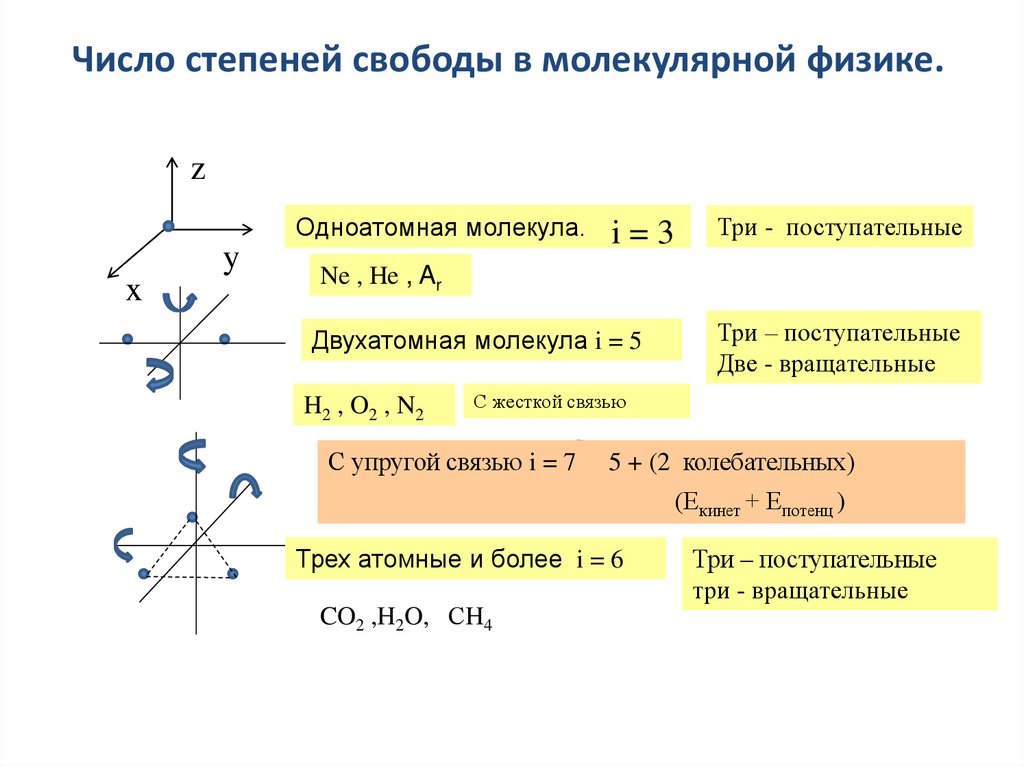
Степени свободы сложной системы.Eпост
3
kT
2
Средняя энергия зависит только от
температуры и не зависит от массы молекулы
Эта формула определяет энергию только
поступательного движения молекулы
Наряду с поступательным движением возможны также вращение молекулы
и колебания атомов, входящих в состав молекул.
Статистическая физика устанавливает закон о равнораспределении
энергии по степеням свободы молекулы.
Числом степеней свободы механической системы называется
количество независимых величин, с помощью которых может быть
задано положение системы. Обозначается i.
14.
Число степеней свободы в молекулярной физике.z
Одноатомная молекула.
y
x
i=3
Три - поступательные
Ne , He , Ar
Двухатомная молекула i = 5
H2 , O2 , N2
Три – поступательные
Две - вращательные
С жесткой связью
С упругой связью i = 7
5 + (2 колебательных)
(Екинет + Епотенц )
Трех атомные и более i = 6
CO2 ,H2O, СH4
Три – поступательные
три - вращательные
15.
Закон распределения энергииНа каждую степень свободы (поступательную, вращательную
и колебательную) в среднем приходится одинаковая
кинетическая энергия, равная ½ кТ
i
E kT
2
i - сумма числа поступательных, числа вращательных и удвоенного
числа колебательных степеней свободы молекулы
i = nпост + nвращ +2nколеб
16.
Примеры и задачиЗадача 1
Решение
Сколько атомов водорода содержится в 50 г
водяного пара?
Число Авогадро
m
NA- число молекул в одном моле
m
- Моль – количество газа N N A
H 2O 2 16 10 кг / моль
3
Задача 2
H 2O H 2 O
50 10 3
23
23
N
6
,
02
10
16
,
7
10
18 10 3
Найти массу одной молекулы аммиака
NH 3
Решение N m N N – число молекул. Для одной молекулы
A
3
Молярная масса аммиака NH 3 14 3 10 кг / моль
17 10 3
m
2,82 10 26 кг
23
6,02 10
m
NA
17.
Примеры и задачиЗадача 3
Определить число n молекул воздуха в единице объема при
температуре 00С и давлении 1,013∙105 Па.
Уравнение состояния идеального газа p nkT
Решение
p
n
kT
1.013 105
25
3
n
2
,
7
10
м
1.38 10 23 273
Найти плотность ρ воздуха при температуре 00С и давлении
1,0∙105 Па . Молярная масса воздуха μ = 29∙10-3 кг/моль.
Задача 4
Решение
pV
m
Уравнение состояния идеального газа
RT
m p
V RT
1.0 105 29 10 3
1,29кг / м 3 1,29г / л
8.31 273
18.
Примеры и задачиЗадача 5
Решение
m
pV RT
Какое давление на стенки сосуда производят 0,02 кг кислорода,
занимающего объем 0,2 м3 при температуре 400С?
Уравнение состояния идеального газа
p
m RT
V
t = 40 +273 =313 K
Молярная масса О2
32 10 3
кг
моль
0,02 8,31 313
4
0
,
8
10
Па
3
32 10 0,2
В закрытом сосуде емкостью 2 м3 находится 1,4 кг азота (N2) и
Задача 6 2 кг кислорода (О2 ). Найти давление газовой смеси в сосуде,
если температура смеси t = 270 C.
p
Решение
p
m RT
V
По закону Дальтона давление смеси газов равно сумме
p p N 2 p O2
парциальных давлений
RT
p
V
N 28 10 3 кг / моль
2
m N 2 m O2
p 8,31 300 1,4 2 1,4 10 5 Па
N O
2 10 3 28 32
2
2
О 32 10 3 кг / моль
2
t 27 273 300K
19.
Пример 1Примеры и задачи
В сосуде, закрытом поршнем, находится
идеальный газ. График зависимости
объема газа от температуры при изменения
его состояния приведен на рисунке.
Какому состоянию газа соответствует
наибольшее давление?
Пример 2
v
Укажите точку, в которой достигалась
наибольшая температура идеального газа
в ходе процесса, график которого
изображен на рисунке
3
1
4
0
T
2
p
1
Сравните объем данной массы
идеального газа в состоянии 1 и 2.
Пример 3
2
T
p
V
20.
Примеры и задачиПример 1
p 4 R
T4
V4
p4V4 RT4
R
p4
tg
V4
tg
T4
pmax соответствует Т.4
Пример 2
pV RT
T
R
R
V R
p p tg
T
Пример 3
v
Объем
максимальный в
т.2
T3 T2 T1
3
2
1
4
β
0
T
2
p
1
T
p
T3
T2
T1
V
















 physics
physics








