Similar presentations:
Уравнение состояния идеального газа
1.
Уравнениегаза
состояния идеального
2.
ПРОВЕРКА РЕШЕНИЯ ЗАДАЧ1.Определить скорость,
энергию теплового
движения и давления
молекул кислорода при
температуре 127ºС ,
если концентрация газа
составляет 3 10 20 м 3
2.Определить скорость,
энергию теплового
движения и давления
молекул азота при
температуре - 100ºС ,
если концентрация газа
составляет 8 10 24 м 3
3.Определить скорость,
энергию теплового
движения и давления
молекул водорода при
температуре 247ºС ,
если концентрация газа
18 3
составляет 6 10 м
4.Определить скорость,
энергию теплового
движения и давления
молекул гелия при
температуре 6000ºС ,
если концентрация газа
составляет 3 10 27 м 3
3.
ВОПРОСЫ1.
2.
3.
4.
5.
6.
7.
Что называется идеальным газом?
Назовите макроскопические параметры
Как температуру выразить в кельвинах?
Почему не может быть Т < 0 ?
От чего зависит энергия молекул?
Как измерили скорость молекул?
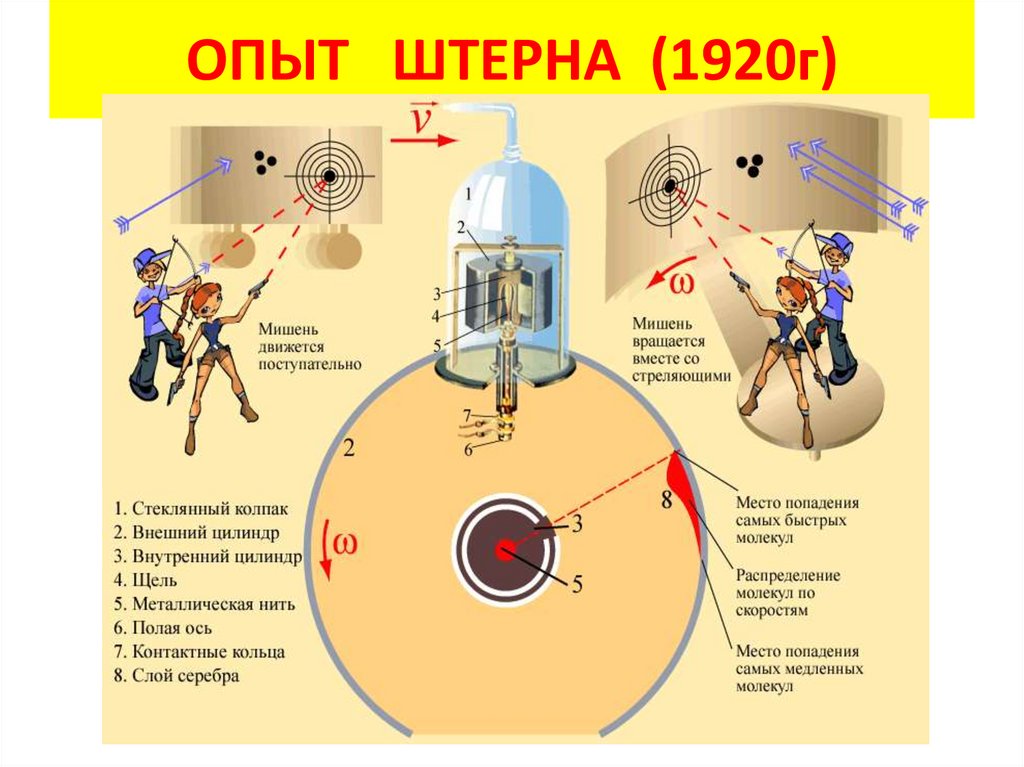
Почему полоска серебра в опыте Штерна
оказалась размытой?
4.
ОПЫТ ШТЕРНА (1920г)5.
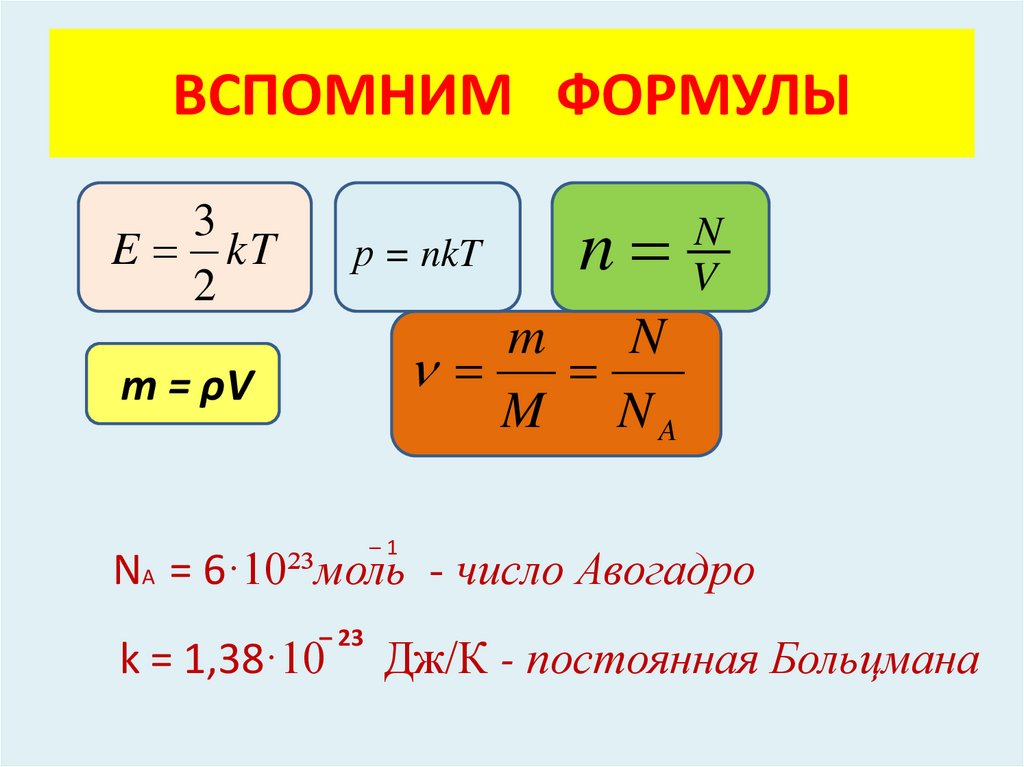
ВСПОМНИМ ФОРМУЛЫ3
E kT
2
р = nkT
n
N
V
m
N
M NA
m = ρV
–1
NA = 6·10²³моль - число Авогадро
– 23
k = 1,38·10
Дж/К - постоянная Больцмана
6.
ОБЪЕДИНИМ ПАРАМЕТРЫ p, V, T• Объединим три формулы:
m
N
NA
1) р = nkT
2) n V
3) N
M
m
kN AT заменим R = kNA
Получим: pV
M
-23
23
R = 1,38·10 ·6·10 = 8,3 Дж/моль·К –
универсальная газовая постоянная
7.
Уравнение Менделеева –Клайперона
8.
УРАВНЕНИЕ СОСТОЯНИЯ• Еще две полезные формулы
p
pV = νRT
M
RT
где ν – количество вещества (моль)
ρ – плотность газа (кг/м³)
От чего зависит плотность газа?
pM
RT
9.
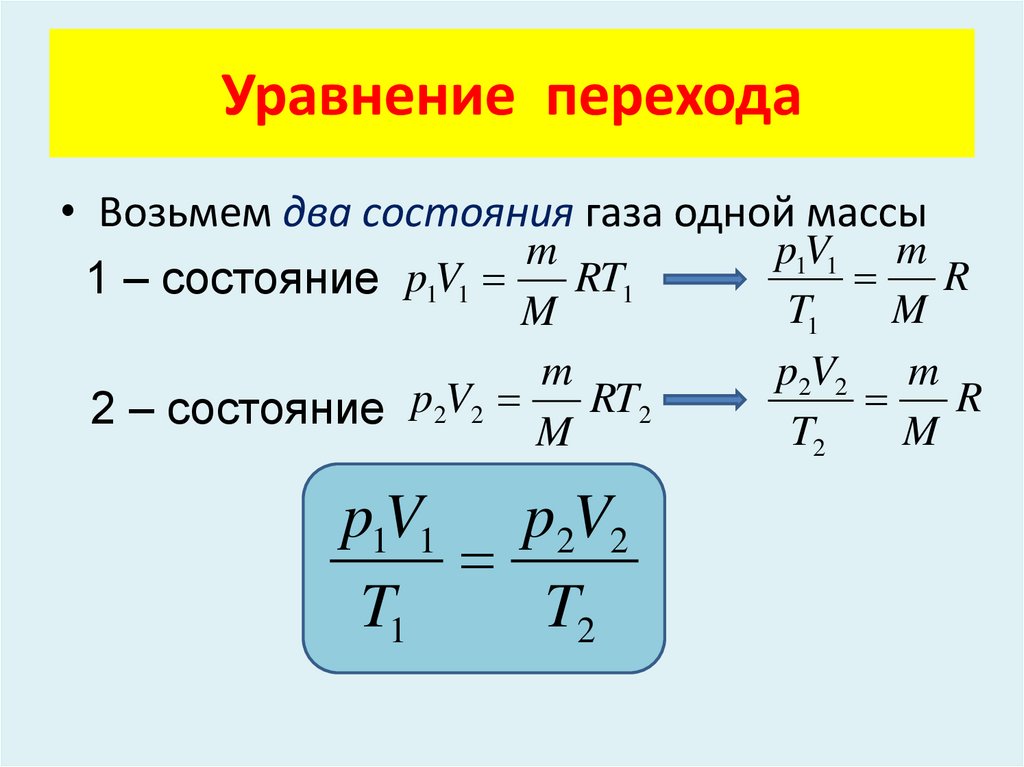
Уравнение перехода• Возьмем два состояния газа одной массы
p1V1 m
m
R
RT1
1 – состояние p1V1
M
m
2 – состояние p2V2 M RT2
p1V1 p2V2
T1
T2
T1
M
p2V2 m
R
T2
M
10.
НОРМАЛЬНЫЕ УСЛОВИЯ• 1. Давление равно атмосферному
5
5
р=1атм= 1,013·10 Па ≈10 Па
• 2. Температура равна 0ºС
Т = 273К
Задача: найти объём 1моля газа при
нормальных условиях
11.
ЗАДАЧА• Дано:
ν = 1моль
р = 100000Па
Т = 273К
V-?
Решение
12.
ЗАДАЧА• Дано:
ν = 1моль
р = 100000Па
Т = 273К
V-?
Решение
pV = νRT
V
RT
p
13.
ЗАДАЧА• Дано:
Решение
RT
V
pV = νRT
ν = 1моль
p
р = 100000Па
1моль 8,3 273
V
0,0226 м 3 22,6 л
Т = 273К
100000
V-?
Ответ: 22,6л
14.
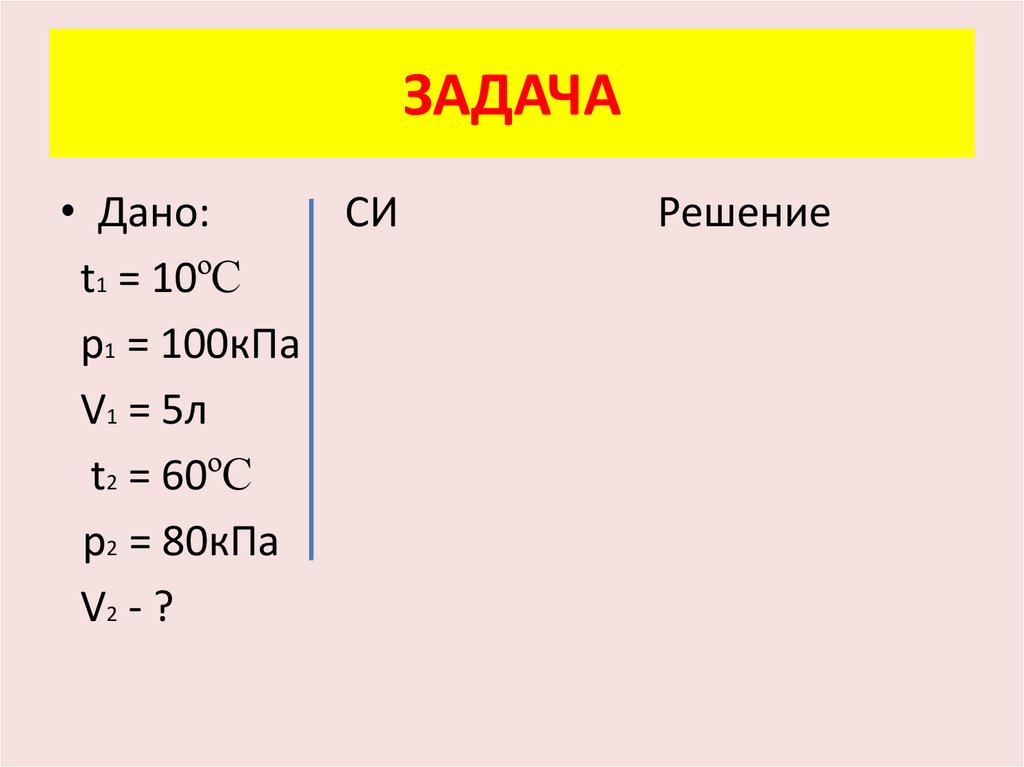
ЗАДАЧА• При температуре 10ºС и
давлении 100 кПа воздух
занимает объём 5л. Каким
будет объём данной массы
воздуха при давлении 80кПа
и температуре 60ºС?
15.
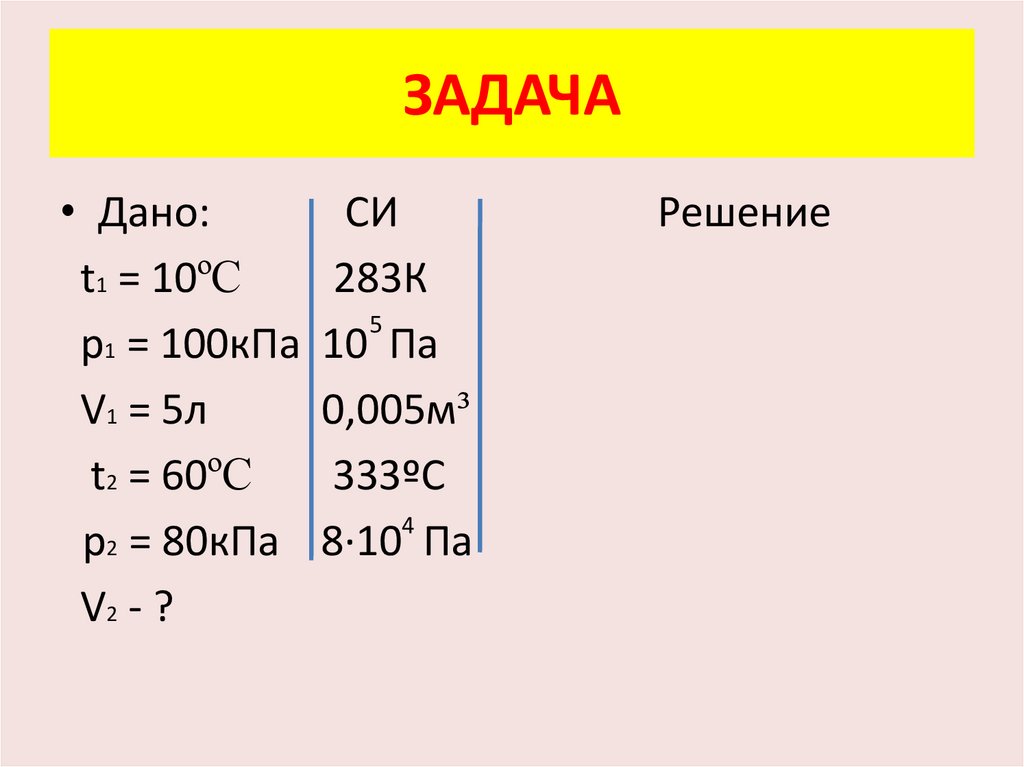
ЗАДАЧА• Дано:
СИ
t1 = 10ºC
p1 = 100кПа
V1 = 5л
t2 = 60ºC
p2 = 80кПа
V2 - ?
Решение
16.
ЗАДАЧА• Дано:
t1 = 10ºC
p1 = 100кПа
V1 = 5л
t2 = 60ºC
p2 = 80кПа
V2 - ?
СИ
283К
5
10 Па
0,005м³
333ºС
4
8·10 Па
Решение
17.
ЗАДАЧА• Дано:
t1 = 10ºC
p1 = 100кПа
V1 = 5л
t2 = 60ºC
p2 = 80кПа
V2 - ?
СИ
283К
5
10 Па
0,005м³
333ºС
4
8·10 Па
Решение
p1V1 p2V2
T1
T2
p1V1T2
V2
p2T1
18.
ЗАДАЧА• Дано:
СИ
Решение
t1 = 10ºC
283К
p1V1 p2V2
5
p1 = 100кПа 10 Па
T1
T2
V1 = 5л
0,005м³
p1V1T2
V2
t2 = 60ºC
333ºС
p2T1
4
p2 = 80кПа 8·10 Па
V2 - ?
5
10 0,005 333
3
V2
0
,
00735
м
7,35 л
4
8 10 283
19.
ДОМАШНЕЕ ЗАДАНИЕ• §70
• Упр 13 (6,7)
• Знать уравнение состояния
идеального газа и его физический
смысл.














 physics
physics








