Similar presentations:
Карбоновые кислоты
1. КАРБОНОВЫЕ КИСЛОТЫ
2. КАРБОНОВЫЕ КИСЛОТЫ
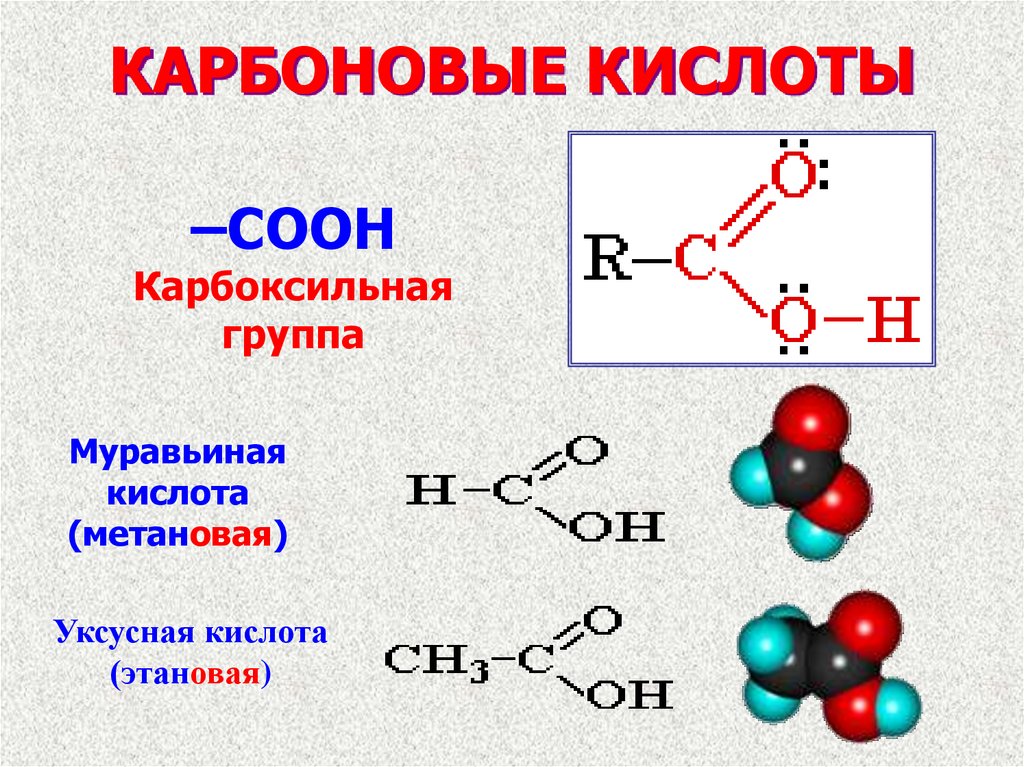
–COOHКарбоксильная
группа
Муравьиная
кислота
(метановая)
Уксусная кислота
(этановая)
3.
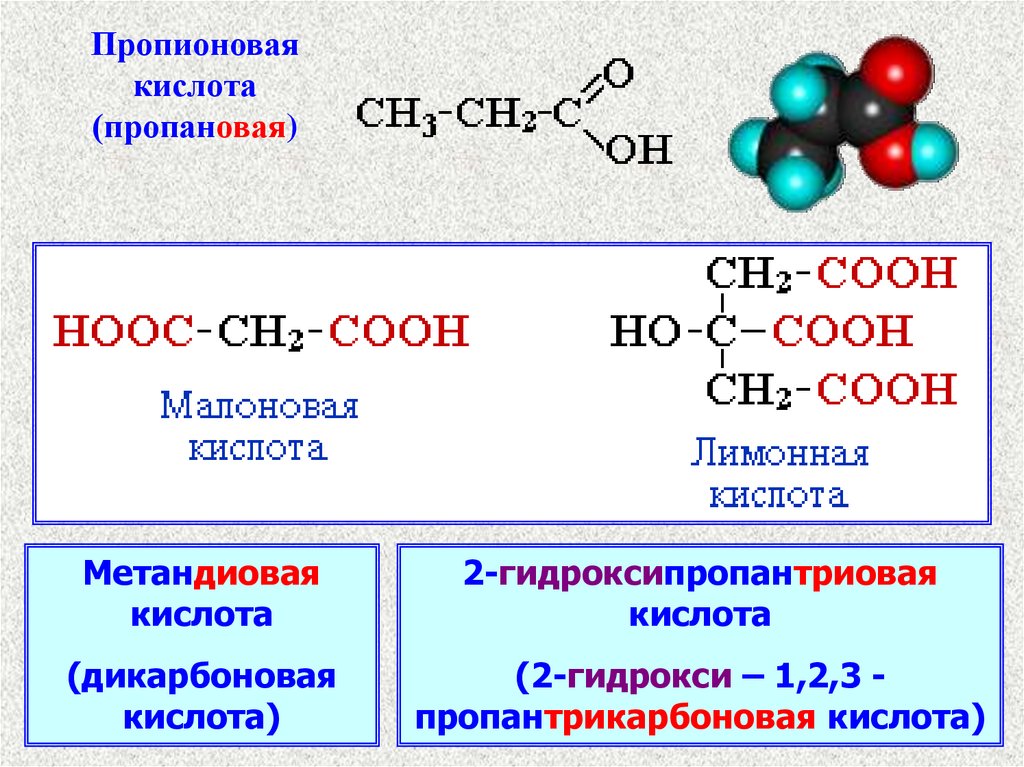
Пропионоваякислота
(пропановая)
Метандиовая
кислота
2-гидроксипропантриовая
кислота
(дикарбоновая
кислота)
(2-гидрокси – 1,2,3 пропантрикарбоновая кислота)
4.
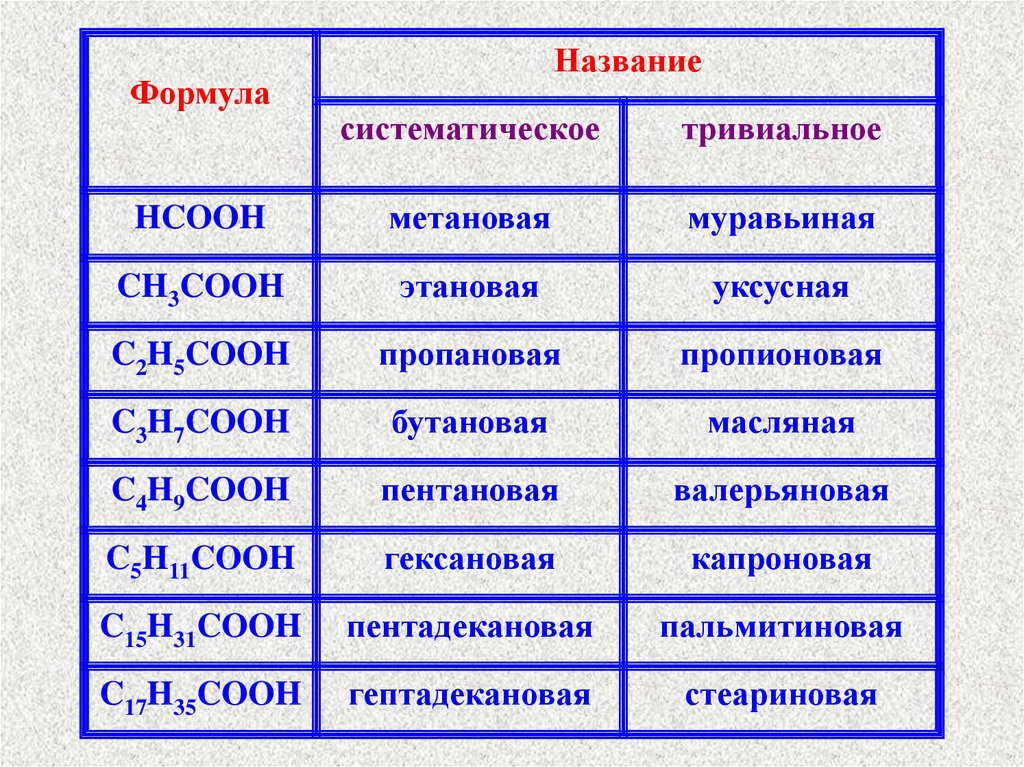
ФормулаНазвание
систематическое
тривиальное
HCOOH
метановая
муравьиная
CH3COOH
этановая
уксусная
C2H5COOH
пропановая
пропионовая
C3H7COOH
бутановая
масляная
C4H9COOH
пентановая
валерьяновая
C5H11COOH
гексановая
капроновая
C15H31COOH
пентадекановая
пальмитиновая
C17H35COOH
гептадекановая
стеариновая
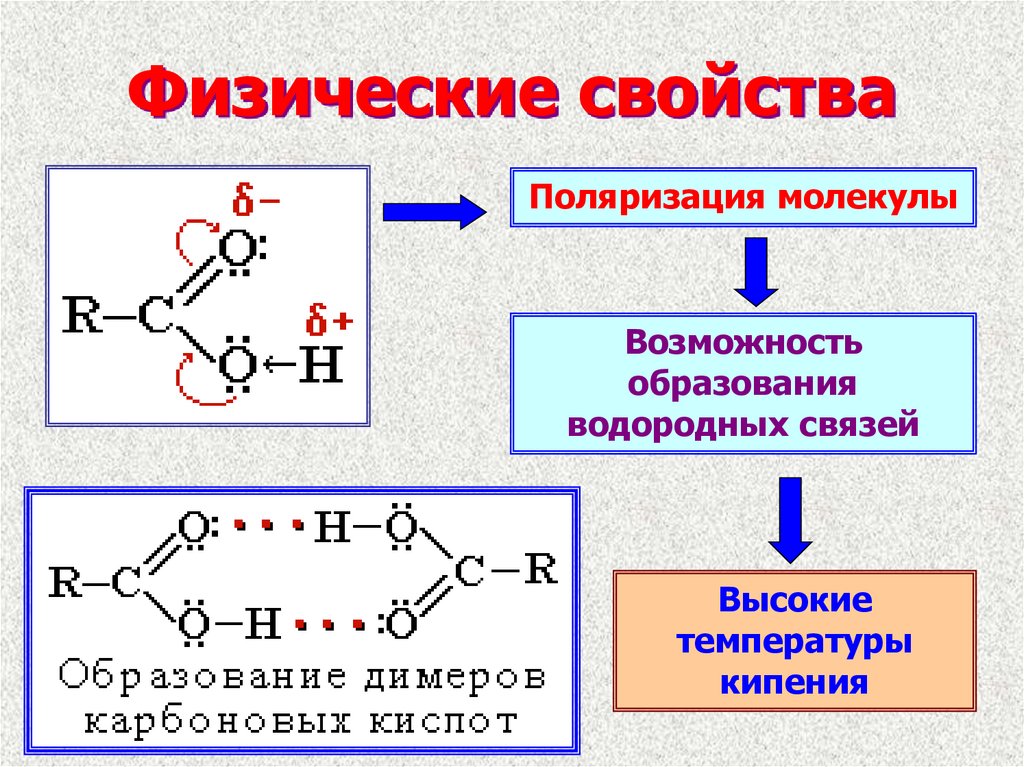
5. Физические свойства
Поляризация молекулыВозможность
образования
водородных связей
Высокие
температуры
кипения
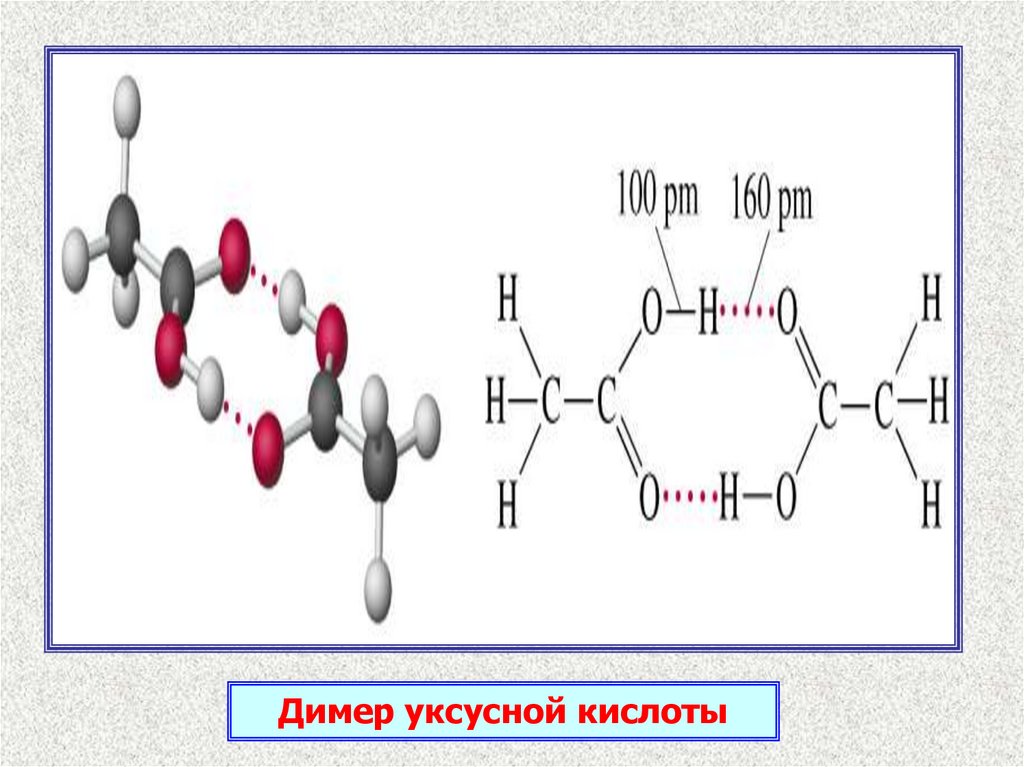
6.
Димер уксусной кислоты7.
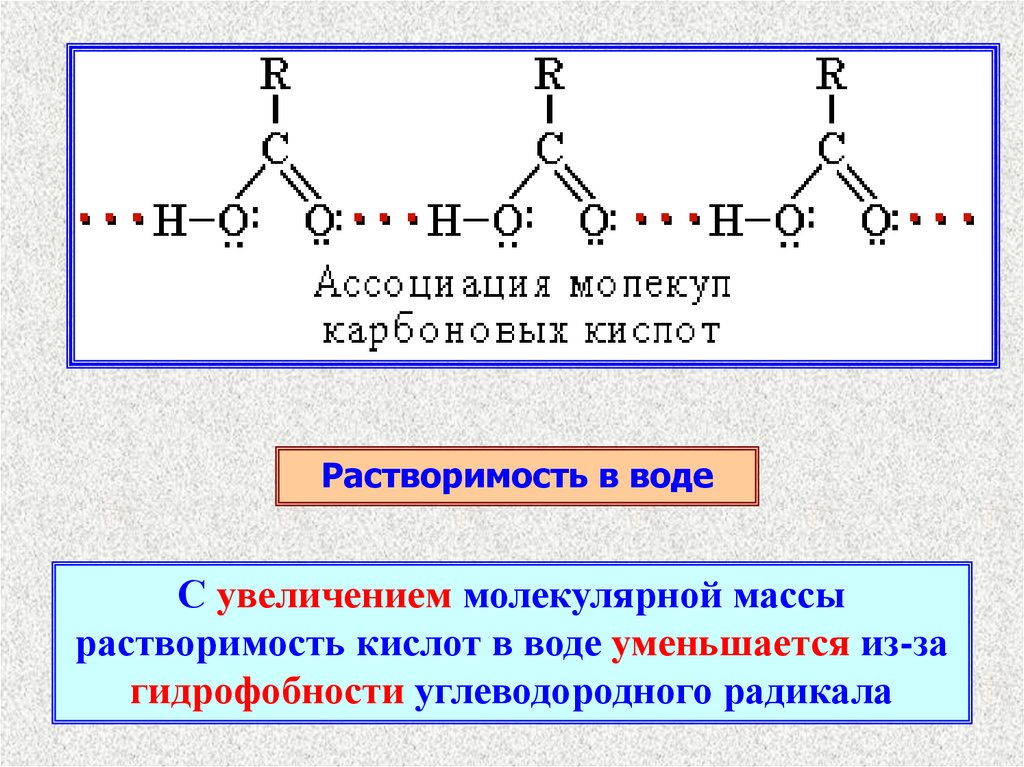
Растворимость в водеС увеличением молекулярной массы
растворимость кислот в воде уменьшается из-за
гидрофобности углеводородного радикала
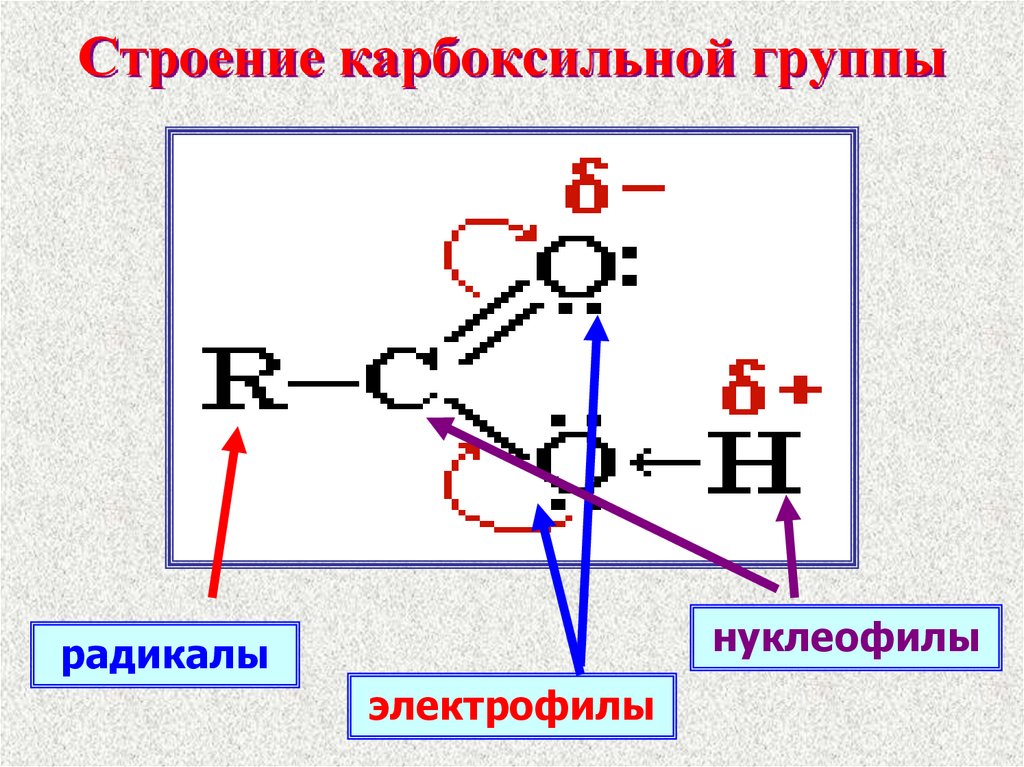
8. Строение карбоксильной группы
нуклеофилырадикалы
электрофилы
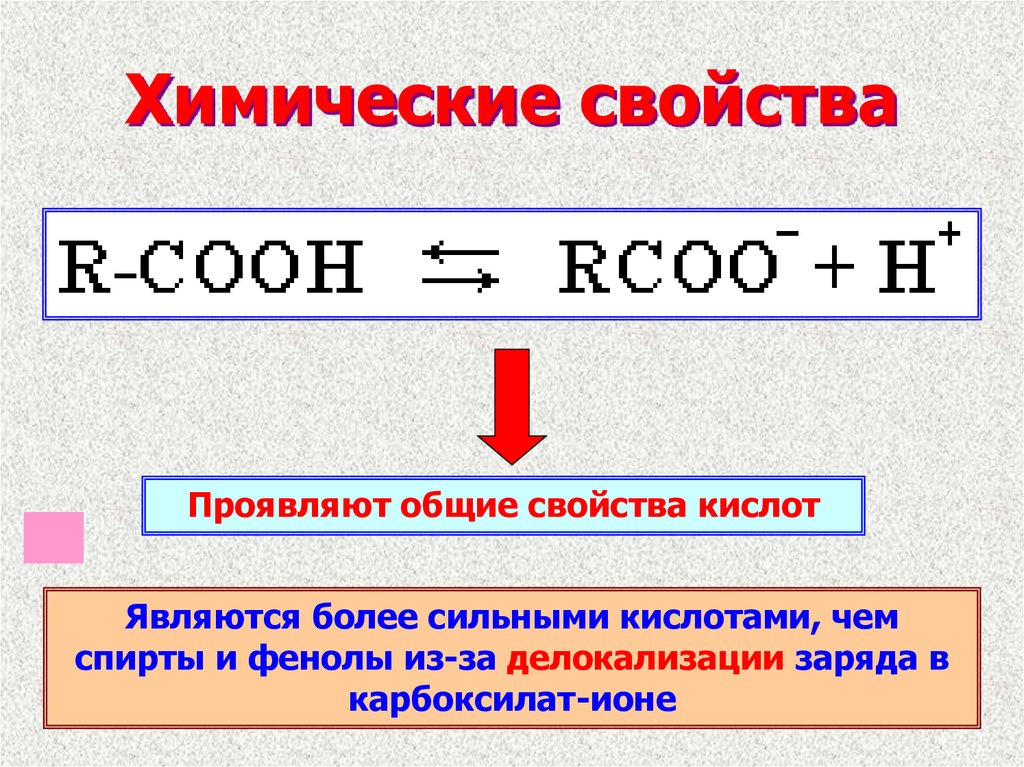
9. Химические свойства
Проявляют общие свойства кислотЯвляются более сильными кислотами, чем
спирты и фенолы из-за делокализации заряда в
карбоксилат-ионе
10.
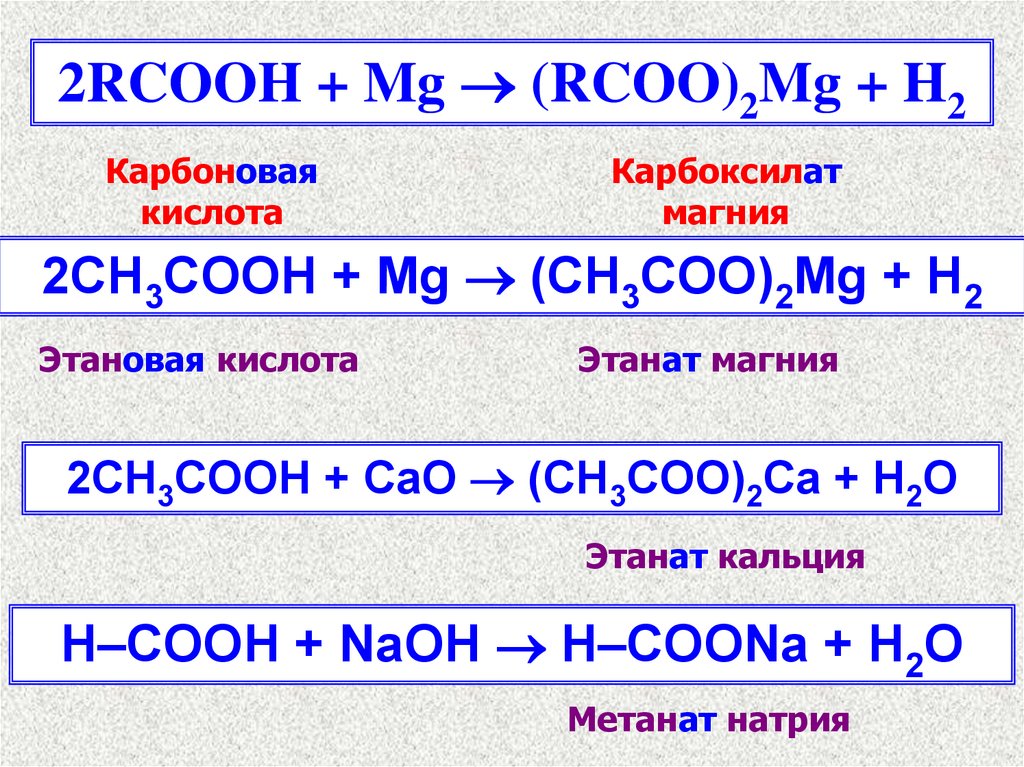
2RCOOH + Mg (RCOO)2Mg + H2Карбоновая
кислота
Карбоксилат
магния
2СH3COOH + Mg (CH3COO)2Mg + H2
Этановая кислота
Этанат магния
2СH3COOH + СaO (CH3COO)2Ca + H2O
Этанат кальция
H–COOH + NaOH H–COONa + H2O
Метанат натрия
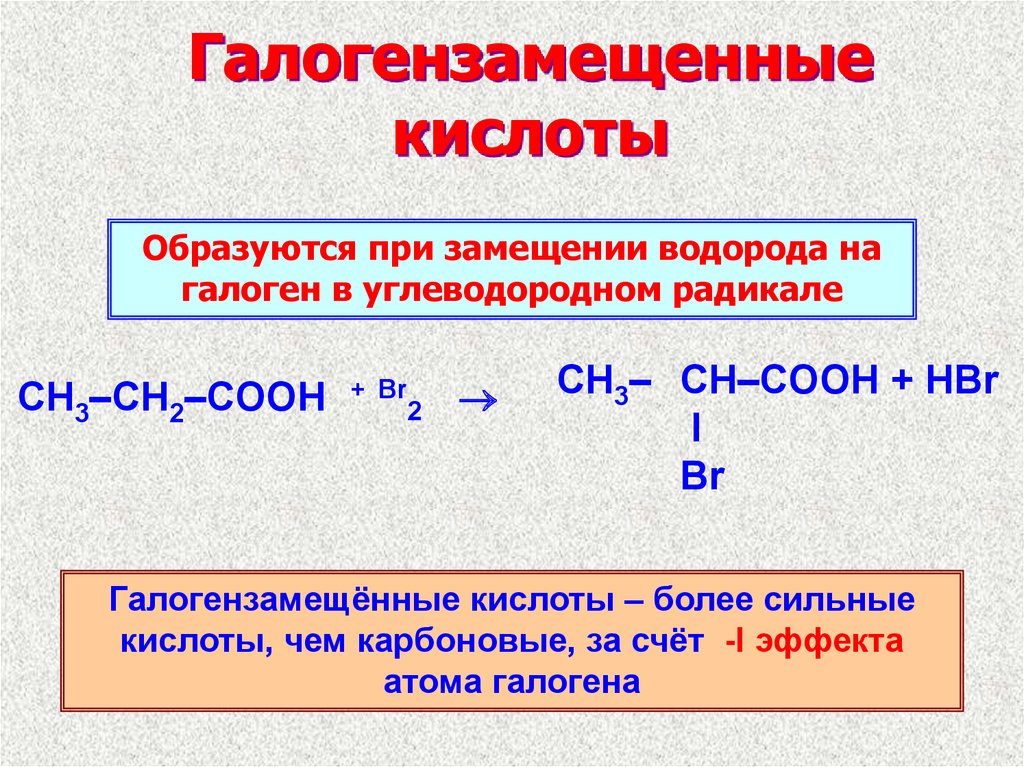
11. Галогензамещенные кислоты
Образуются при замещении водорода нагалоген в углеводородном радикале
CH3–CH2–COOH
+ Br
2
CH3– CH–COOH + HBr
I
Br
Галогензамещённые кислоты – более сильные
кислоты, чем карбоновые, за счёт -I эффекта
атома галогена
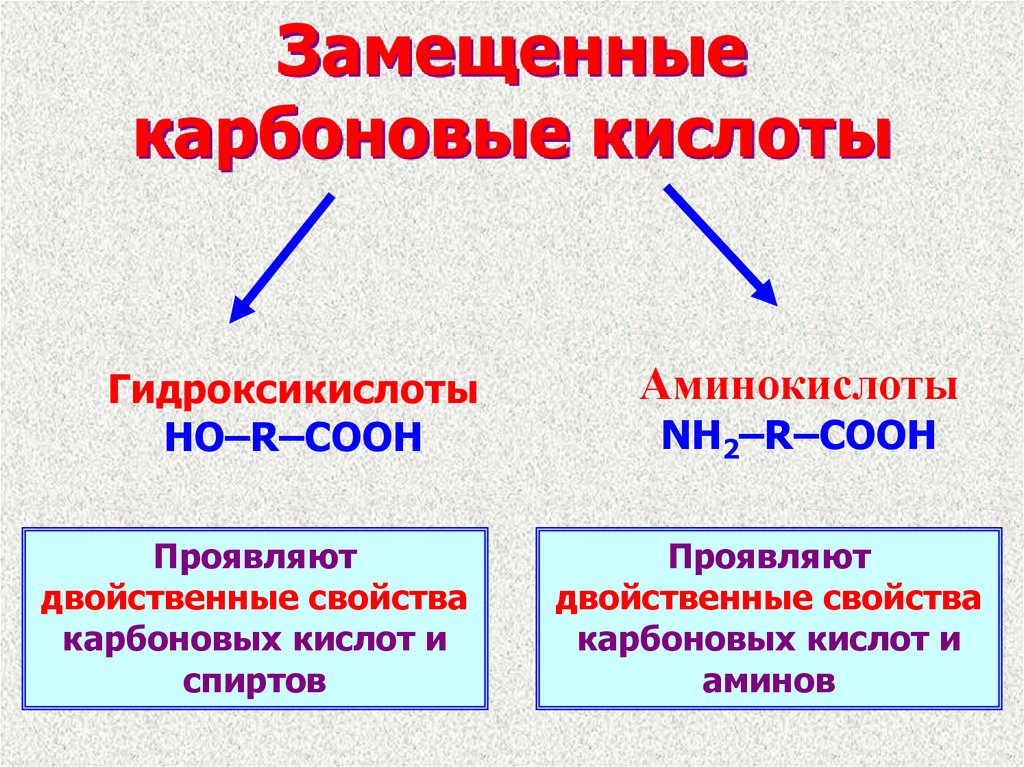
12. Замещенные карбоновые кислоты
ГидроксикислотыHO–R–COOH
Проявляют
двойственные свойства
карбоновых кислот и
спиртов
Аминокислоты
NH2–R–COOH
Проявляют
двойственные свойства
карбоновых кислот и
аминов
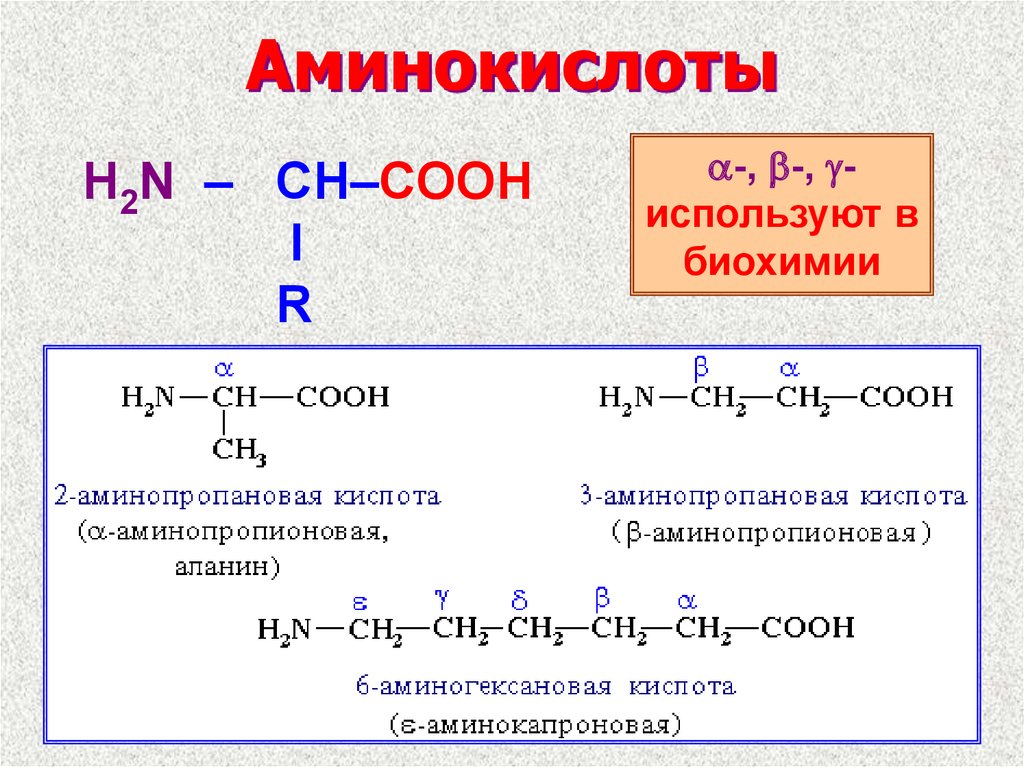
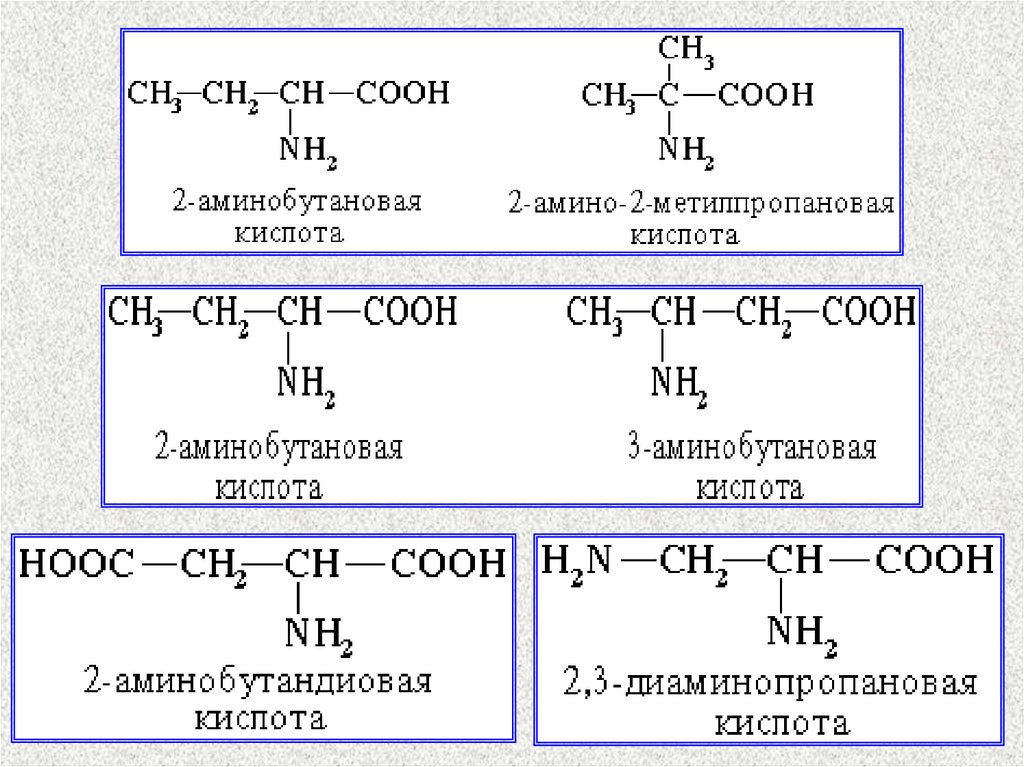
13. Аминокислоты
H2N – CH–COOHI
R
a-, b-, gиспользуют в
биохимии
14.
15.
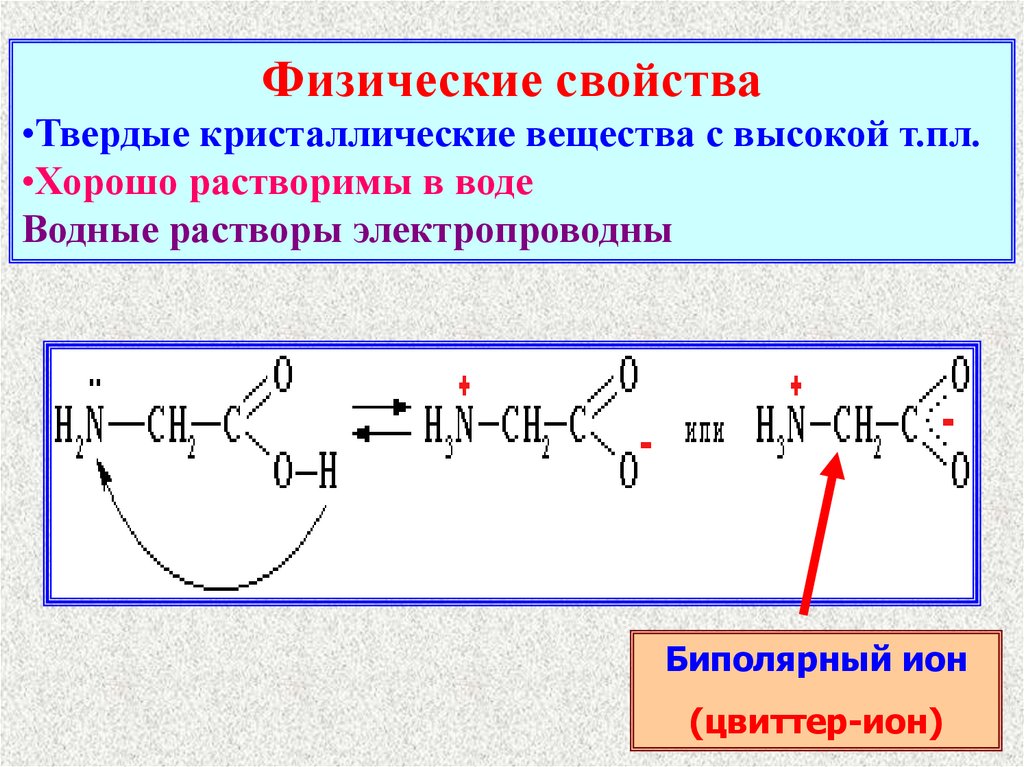
Физические свойства•Твердые кристаллические вещества с высокой т.пл.
•Хорошо растворимы в воде
Водные растворы электропроводны
Биполярный ион
(цвиттер-ион)
16.
Химические свойстваАминокислоты являются
амфотерными соединениями
H2N–CH2–COOH + HCl Cl- [H3N–CH2–COOH]+
Как основание
H2N–CH2–COOH + NaOH H2N–CH2–COO- Na+ + H2O
Как кислота
17.
HN
H
H
O
C
C
O
H
H
N
O
C
C
O
H
H
H
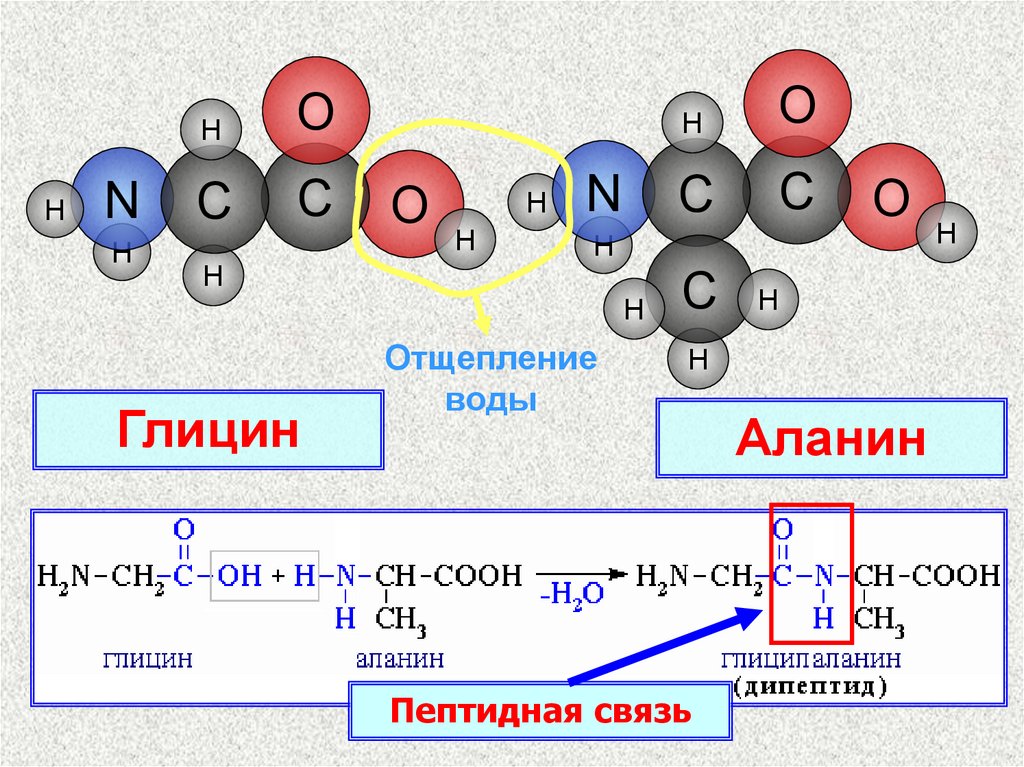
Глицин
H
Отщепление
воды
C
H
H
Пептидная связь
Аланин
H
18. Контрольные задания:
1. Напишите уравнения реакций, при помощи которых можно осуществитьпревращения по схеме:
• СН4 → С2Н2 → СН3СОН → СН3СООН → (CH3COO)2Mg.
Укажите условия осуществления реакций и названия всех веществ.
2. Продолжите следующие предложения:
• а) реакция этерификации протекает между……;
• б) альдегиды, которые получают путем окисления спиртов следует тотчас удалять
из сферы реакции т.к. …;
• в) Кислотные свойства угольной кислоты выражены…, чем у муравьиной кислоты
3. Задача. Сколько водорода при н.у. можно получить из 30 г уксусной кислоты и
магния массой 24 г магния?



 chemistry
chemistry








