Similar presentations:
Карбоновые кислоты
1. Карбоновые кислоты
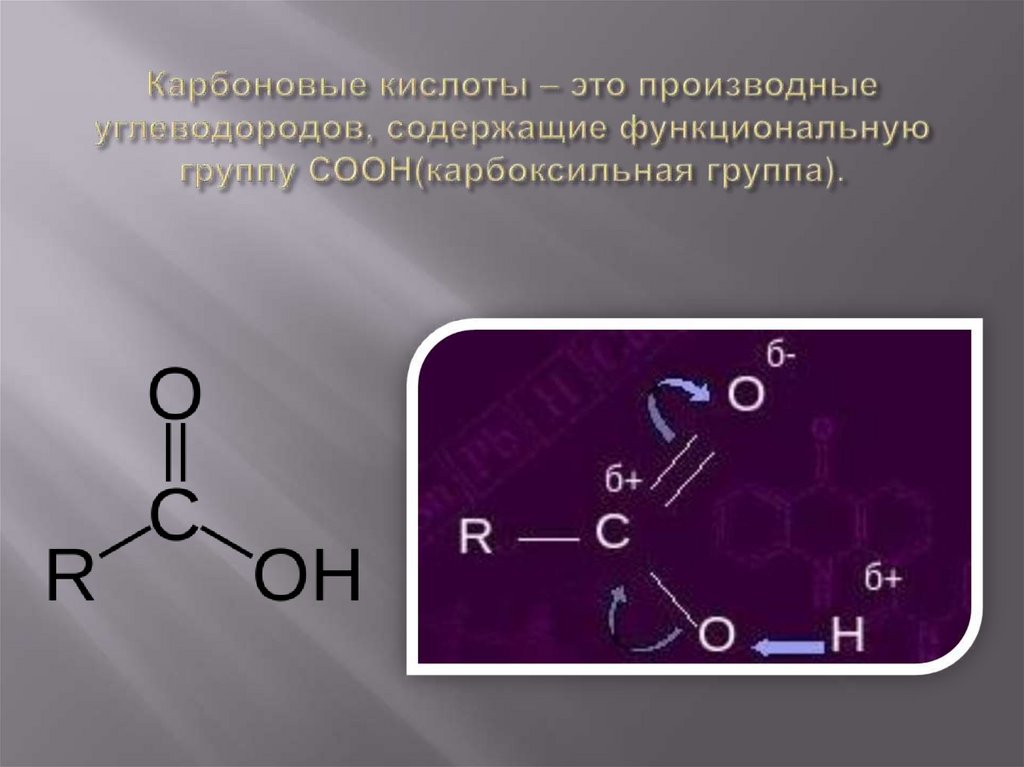
2. Карбоновые кислоты – это производные углеводородов, содержащие функциональную группу СООН(карбоксильная группа).
3. Карбоновые кислоты – это производные углеводородов, содержащие в молекуле одну или несколько карбоксильных групп.
карбонильная группаO
C
OH
гидроксильная
группа
карбоксильная
группа
4. Классификация карбоновых кислот
1. По числу карбоксильных групп:Одноосновные : CH3COOH УКСУСНАЯ
Двухосновные : HOOC – CH2 – COOH МАЛОНОВАЯ
Многоосновные: HOOC – CH2C(OH)(COOH)CH2 –
COOH
ЛИМОННАЯ
2. По характеру углеводородного радикала:
Предельные : CH3 – (CH2)10 – COOH лауриновая
Непредельные: CH2 = CH – COOH акриловая
Ароматические: C6H5 – COOH бензойная
5. Общая формула одноосновных карбоновых кислот
R – COOH или CnH2n+1COOHНоменклатура
К названию соответствующего предельного УВ
прибавляется окончание - овая и слово кислота:
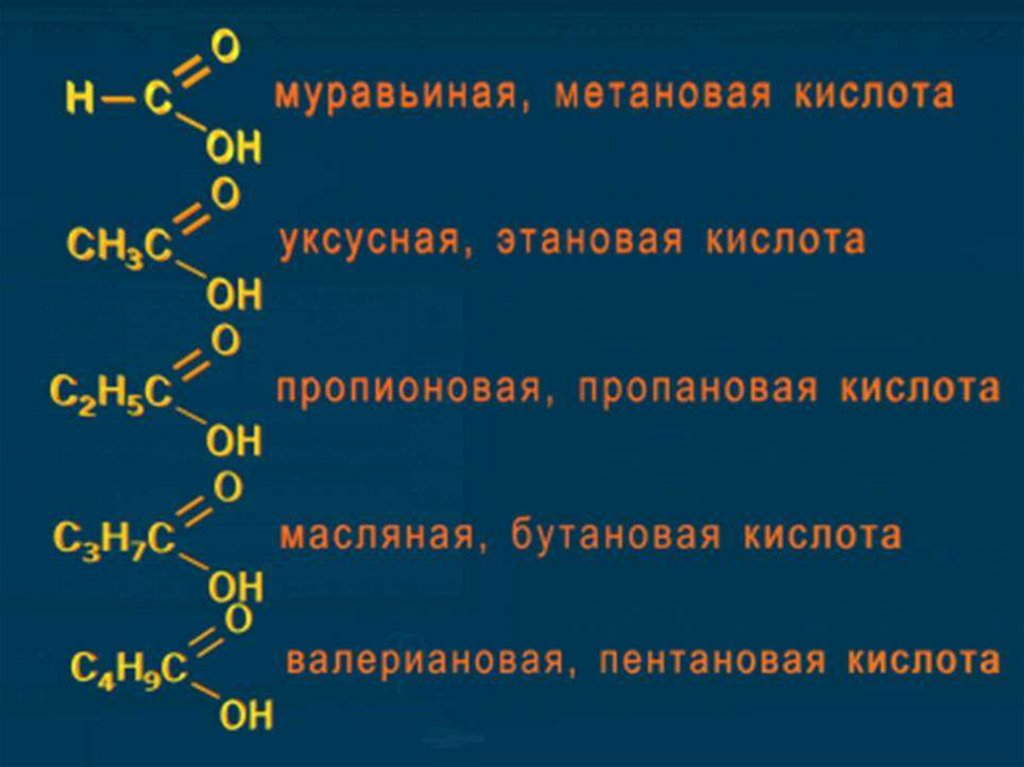
Метан – метановая кислота HCOOH
Этан – этановая кислота CH3 - COOH
Пропан – пропановая CH3 – CH2 - COOH
Бутан – бутановая кислота СН3 – СН2 – СН2 - СООН
6.
7.
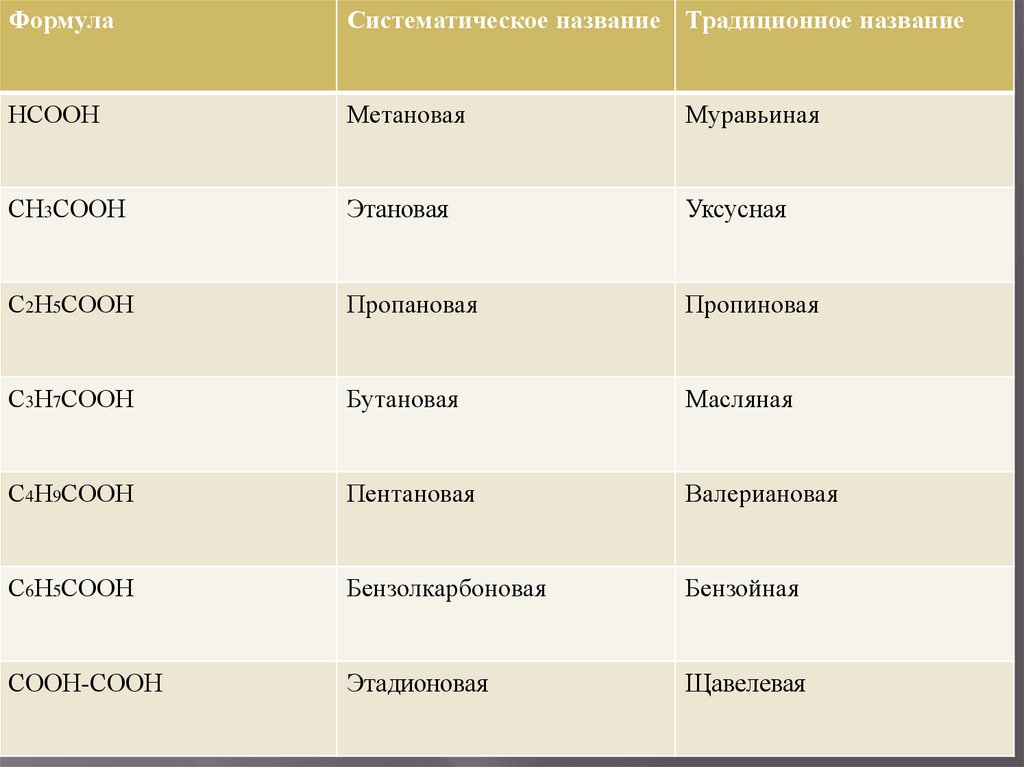
ФормулаСистематическое название Традиционное название
НСООН
Метановая
Муравьиная
СН3СООН
Этановая
Уксусная
С2Н5СООН
Пропановая
Пропиновая
С3Н7СООН
Бутановая
Масляная
С4Н9СООН
Пентановая
Валериановая
С6Н5СООН
Бензолкарбоновая
Бензойная
СООН-СООН
Этадионовая
Щавелевая
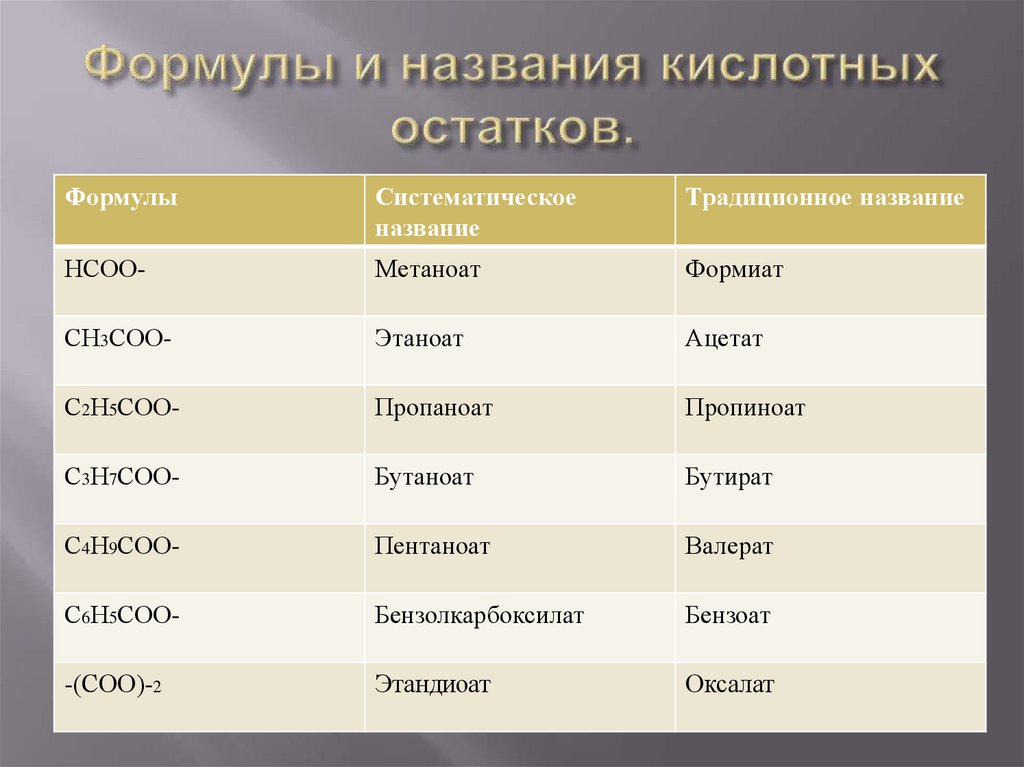
8. Формулы и названия кислотных остатков.
ФормулыСистематическое
название
Традиционное название
НСОО-
Метаноат
Формиат
СН3СОО-
Этаноат
Ацетат
С2Н5СОО-
Пропаноат
Пропиноат
С3Н7СОО-
Бутаноат
Бутират
С4Н9СОО-
Пентаноат
Валерат
С6Н5СОО-
Бензолкарбоксилат
Бензоат
-(СОО)-2
Этандиоат
Оксалат
9. Физические свойства одноосновных карбоновых кислот
Низшие карбоновые кислоты – жидкости с острымзапахом, хорошо растворимые в воде.
С повышением относительной молекулярной массы
растворимость кислот в воде уменьшается, а
температура кипения повышается.
Высшие кислоты, начиная с пеларгоновой
(нонановой) CH3 – (CH2)7 – COOH, - твердые
вещества, без запаха, нерастворимые в воде.
10. Низшие карбоновые кислоты
- бесцветные жидкости с резкимзапахом. При увеличении
молярной массы температура
кипения возрастает.
Карбоновые кислоты обнаружены
в природе:
НСООН – крапива, выделения
муравьёв, хвоя ели
СН3СООН – продукты скисания,
брожение спиртовых жидкостей
(образование уксуса)
11. …карбоновые кислоты в природе:
С2Н5СООН –древесная
смола
12. …карбоновые кислоты в природе:
С3Н7СООН –сливочное
масло
13. …карбоновые кислоты в природе:
С4Н9СООН –корни травы
валерианы
14. …карбоновые кислоты в природе:
С6Н5СООН –гвоздичное
масло
15. -(СООН)-2 – щавель, шпинат, клевер, ревень, томаты, многие ягоды (в виде соли калия)
16. Химические свойства кислот
Общие свойства карбоновых кислот аналогичнысоответствующим свойствам неорганических
кислот:
1.
Диссоциируют в водном растворе.
2.
Реагируют с металлами.
3.
Реагируют с основными и амфотерными оксидами
и гидроксидами.
4.
Реагируют с солями более слабых летучих кислот.
5.
Горят с образованием углекислого газа и воды.
6.
Реагируют со спиртами
17. 1. Кислоты диссоциируют на ионы водорода и ионы кислотного остатка:
CH3COOHH+
+ CH3COO-
2. Реагируют с металлами:
2 CH3COOH + Zn
(CH3COO)2Zn + H2
ацетат цинка
Соли уксусной кислоты – ацетаты.
18. Химические свойства кислот
3. Реагируют с основными и амфотерными оксидами игидроксидами.
2HCOOH + MgO
(HCOO)2Mg + H2O
2CH3COOH + Zn(OH)2
(CH3COO)2Zn + H2O
4. Реагируют с солями более слабых летучих кислот.
2HCOOH + Na2SiO3
2HCOONa + H2SiO3
2CH3COOH + Na2CO3
2CH3COONa + H2O + CO2
5. Реагируют со спиртами.
O
O
R C
+ H OR*
R C
+ H2O
OH
O R*
кислота
спирт
сложный эфир
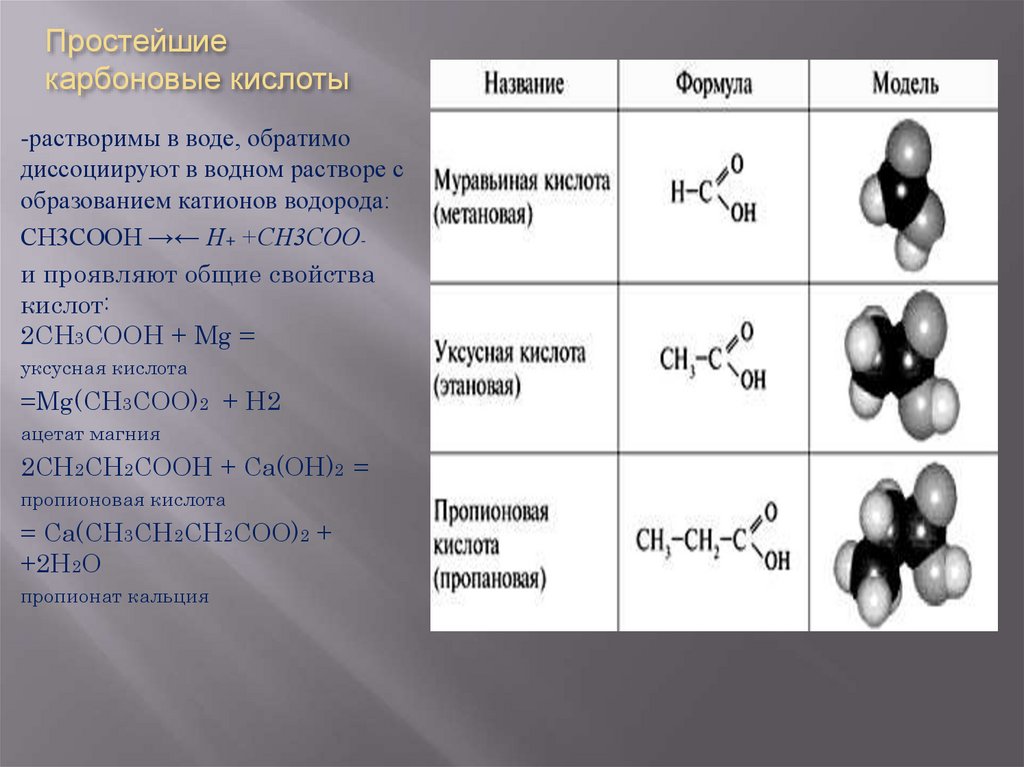
19. Простейшие карбоновые кислоты
-растворимы в воде, обратимодиссоциируют в водном растворе с
образованием катионов водорода:
СН3СООН →← Н+ +СН3СООи проявляют общие свойства
кислот:
2СН3СООН + Mg =
уксусная кислота
=Mg(CH3COO)2 + H2
ацетат магния
2СН2СН2СООН + Са(ОН)2 =
пропионовая кислота
= Са(СН3СН2СН2СОО)2 +
+2Н2О
пропионат кальция
20. Важное практическое значение имеет взаимодействие карбоновых кислот со спиртами: СН3СООН + СН3ОН→←СН3СООСН3 + Н2О
21. вступает в реакцию «серебряного зеркала» как альдегиды:
22. …
и разлагается поддействием
водоотнимающих средств:
Н2SO4(конц.), t
НСООН
→ CО +Н2О
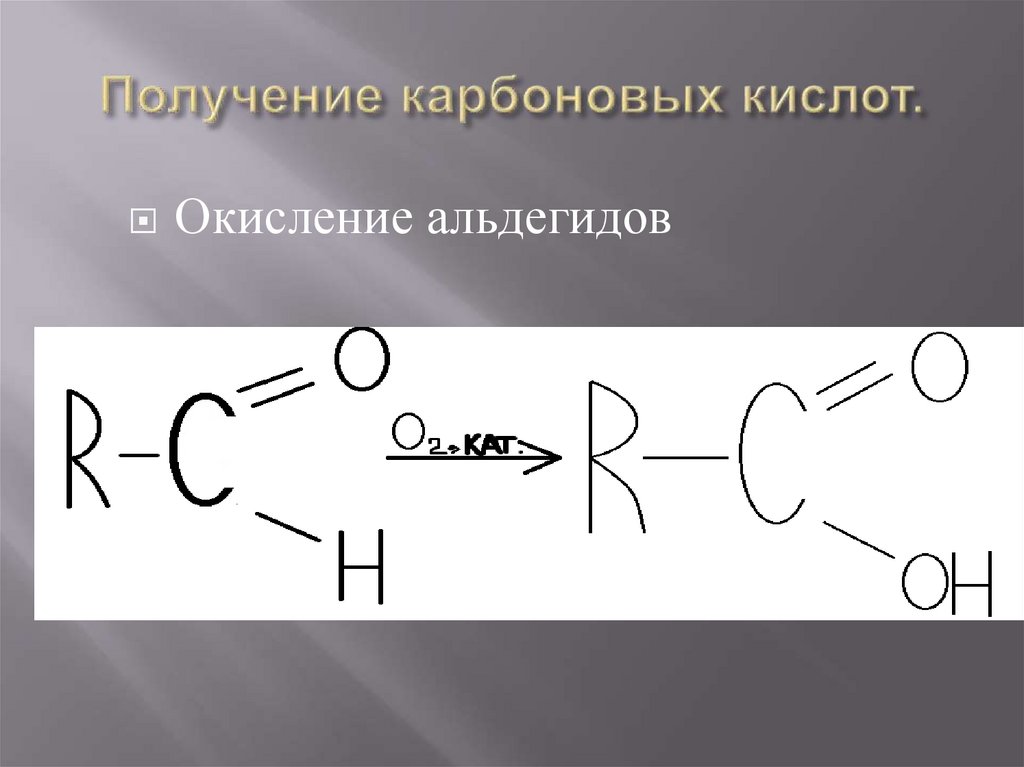
23. Получение карбоновых кислот.
Окисление альдегидов24. … получение карбоновых кислот
Окисление углеводородов25. … получение карбоновых кислот
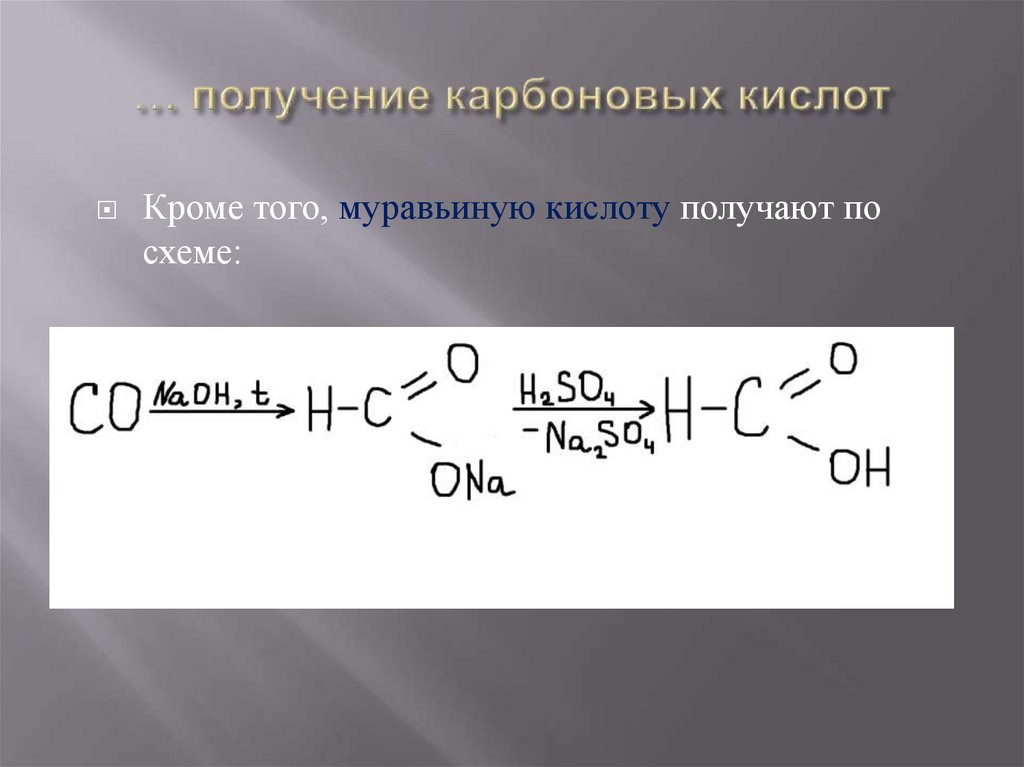
Кроме того, муравьиную кислоту получают посхеме:
26. … получение карбоновых кислот
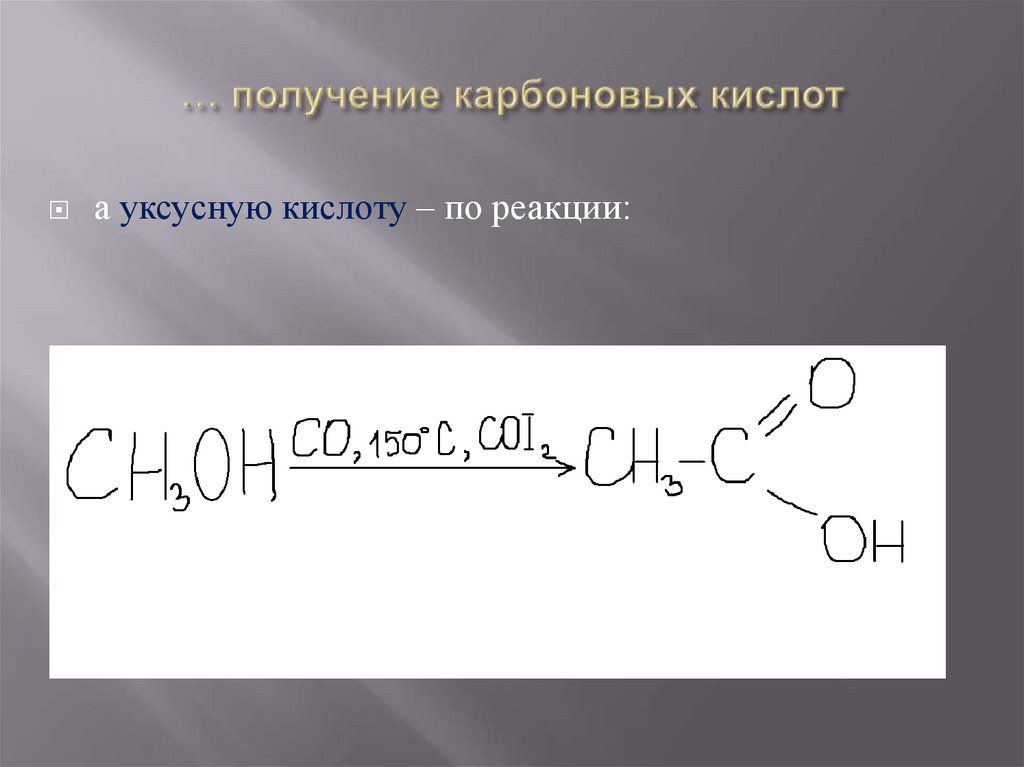
а уксусную кислоту – по реакции:27. Применение карбоновых кислот.
Применяют муравьиную кислоту как протраву прикрашении шерсти, консервант фруктовых соков,
отбеливатель, дезинфекционный препарат.
Уксусную кислоту используют как сырьё в
промышленном синтезе красителей, медикаментов,
ацетатного
волокна, негорючей
киноплёнки,
органического стекла.



















 chemistry
chemistry








