Similar presentations:
Карбоновые кислоты
1. ОРГАНИЧЕСКАЯ ХИМИЯ Карбоновые кислоты
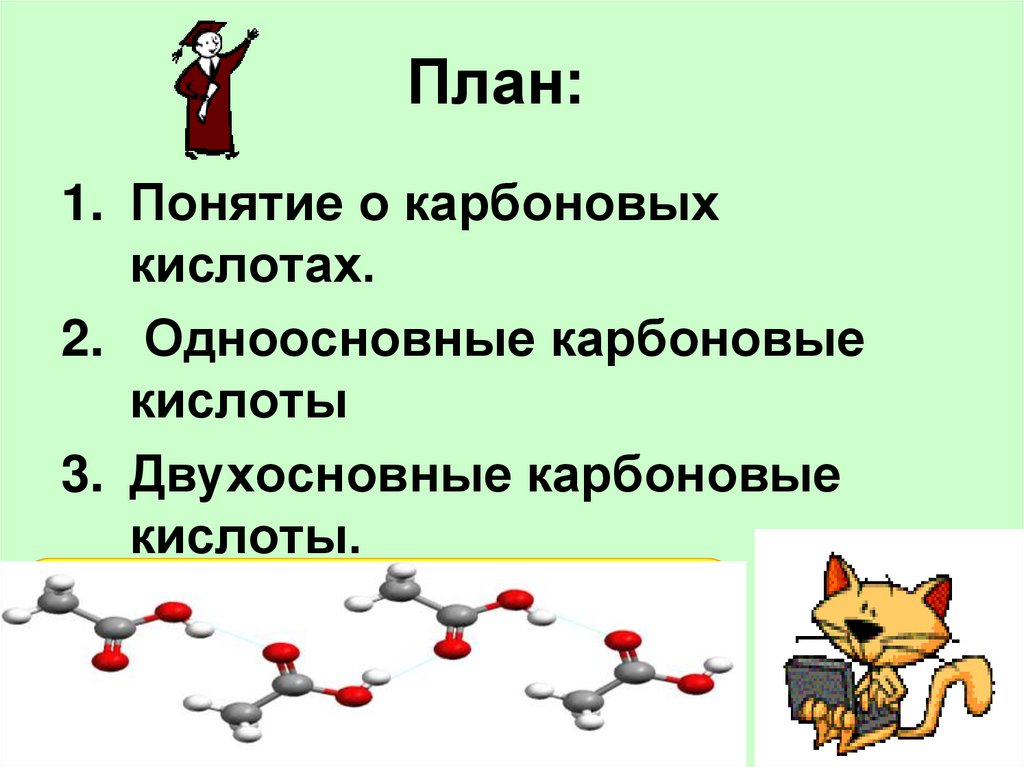
2. План:
1. Понятие о карбоновыхкислотах.
2. Одноосновные карбоновые
кислоты
3. Двухосновные карбоновые
кислоты.
3.
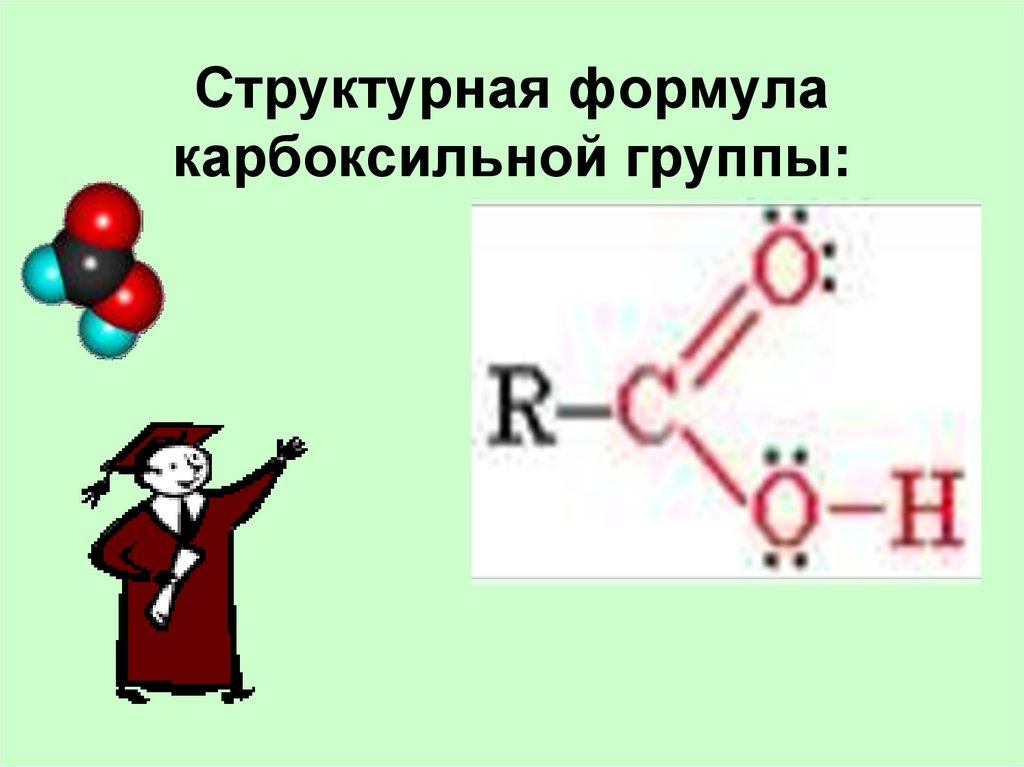
Понятие о карбоновых кислотах.Карбоновыми кислотами называются производные
углеводородов, в молекуле которых содержится одна или
несколько карбоксильных групп –COOH, связанных с
углеводородным радикалом
Общая формула предельных одноосновных кислот:
СnH2n+1COOH (или СnH2nO2)
В зависимости от природы радикала, связанного с
карбоксильной группой, кислоты подразделяются на
предельные, непредельные и ароматические.
Число карбоксильных групп определяет основность
кислот.
4. Структурная формула карбоксильной группы:
5.
Классификация карбоновыхкислот
По типу углеводородного радикала
По числу карбоксильных групп
предельные
одноосновные
непредельные
двухосновные
ароматические
многоосновные
6.
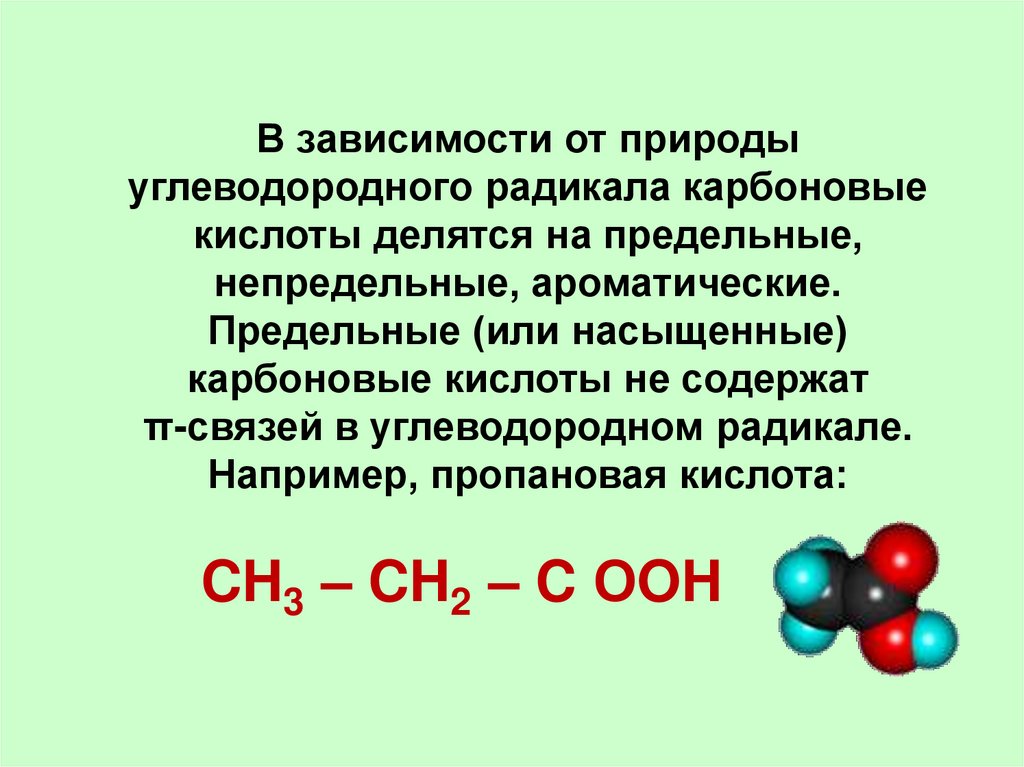
В зависимости от природыуглеводородного радикала карбоновые
кислоты делятся на предельные,
непредельные, ароматические.
Предельные (или насыщенные)
карбоновые кислоты не содержат
π-связей в углеводородном радикале.
Например, пропановая кислота:
CH3 – CH2 – C ОOH
7.
В молекулах непредельныхкарбоновых кислот
карбоксильная группа связана с
ненасыщенным, непредельным
углеводородным радикалом.
Например, акриловая кислота:
CH2 = CH – COOH
8.
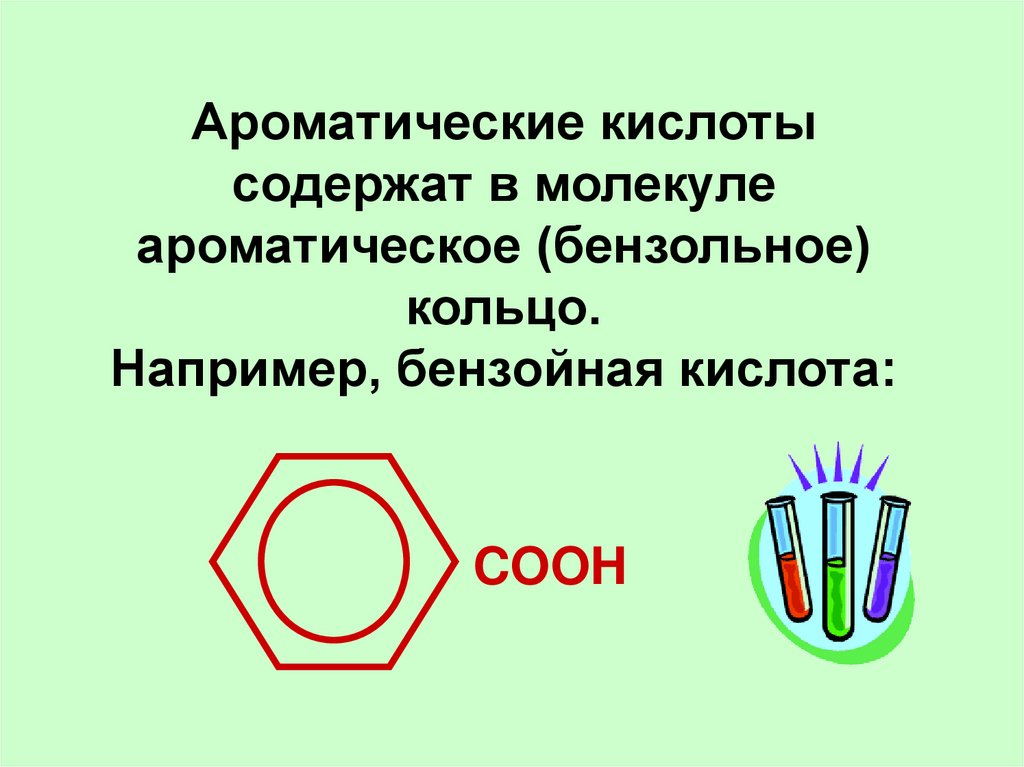
Ароматические кислотысодержат в молекуле
ароматическое (бензольное)
кольцо.
Например, бензойная кислота:
COOH
9. Номенклатура
10.
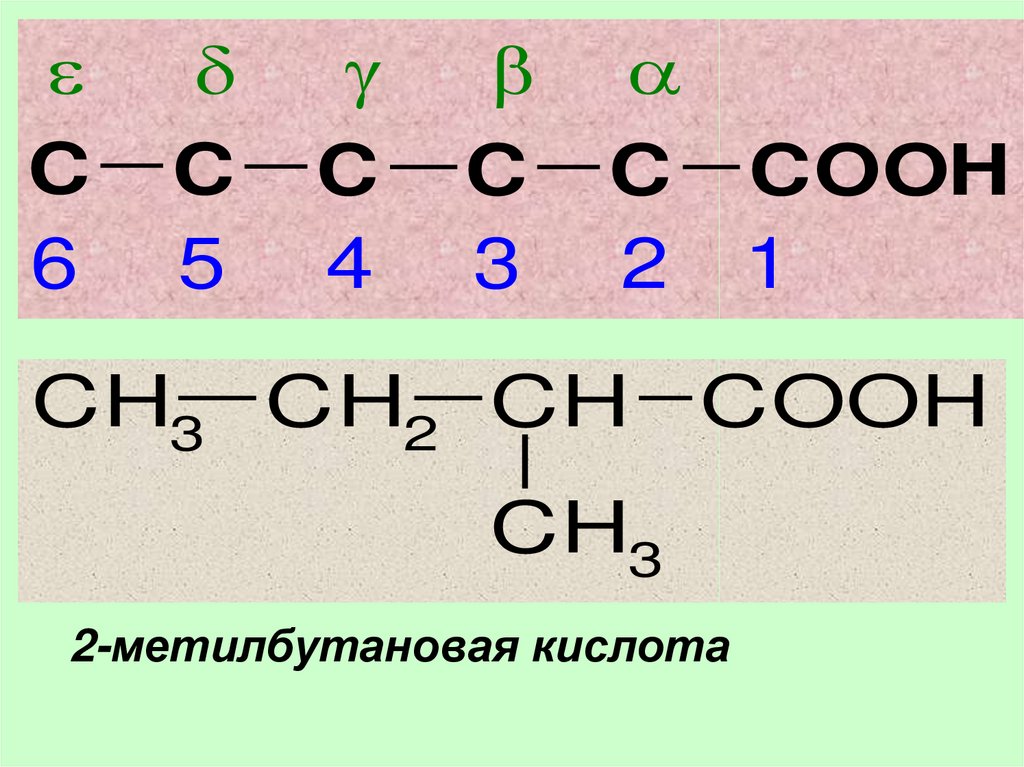
C C C C C COOH6 5 4 3 2 1
CH3 CH2 CH COOH
CH3
2-метилбутановая кислота
11. Гомологический ряд
ФормулаНазвание
систематическое
тривиальное
HCOOH
метановая
муравьиная
CH3COOH
этановая
уксусная
C2H5COOH
пропановая
пропионовая
C3H7COOH
бутановая
масляная
C4H9COOH
пентановая
валерьяновая
C5H11COOH
гексановая
капроновая
C15H31COOH
пентадекановая
пальмитиновая
C17H35COOH
гептадекановая
стеариновая
12.
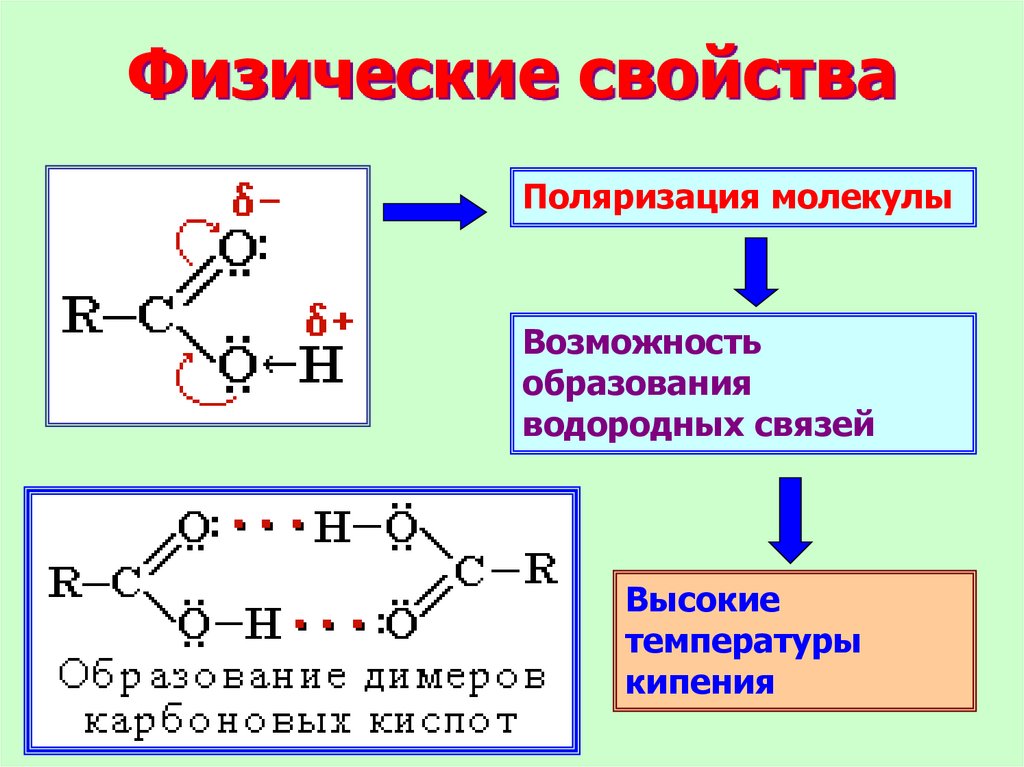
Физические свойстваПоляризация молекулы
Возможность
образования
водородных связей
Высокие
температуры
кипения
13.
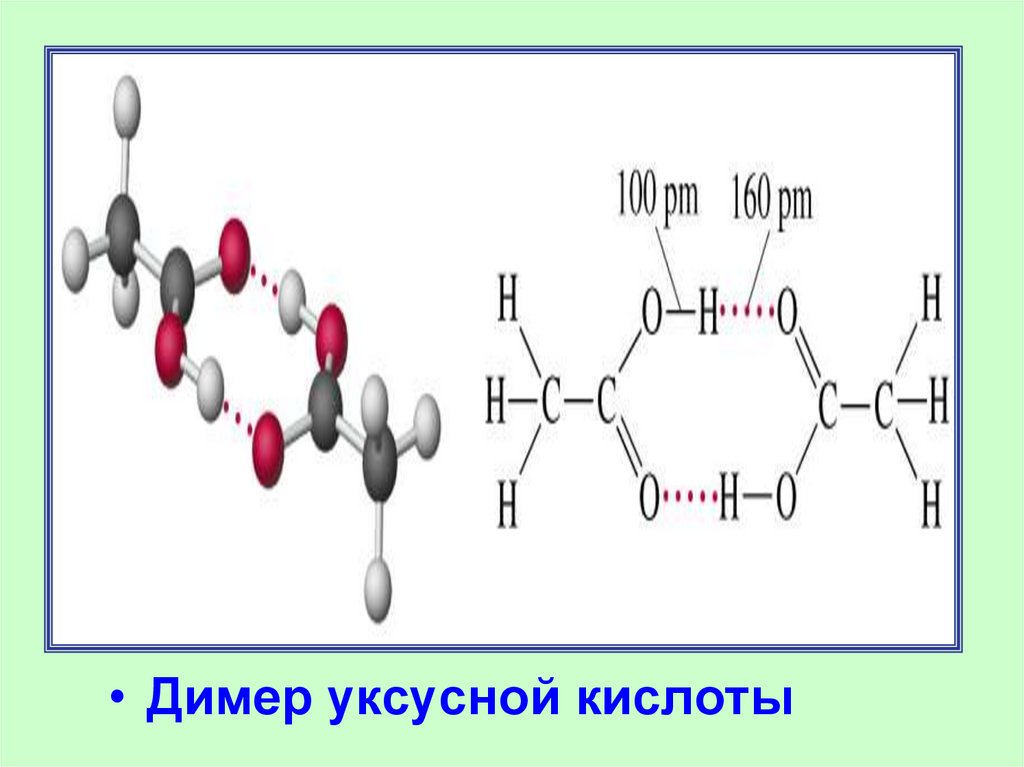
• Димер уксусной кислоты14.
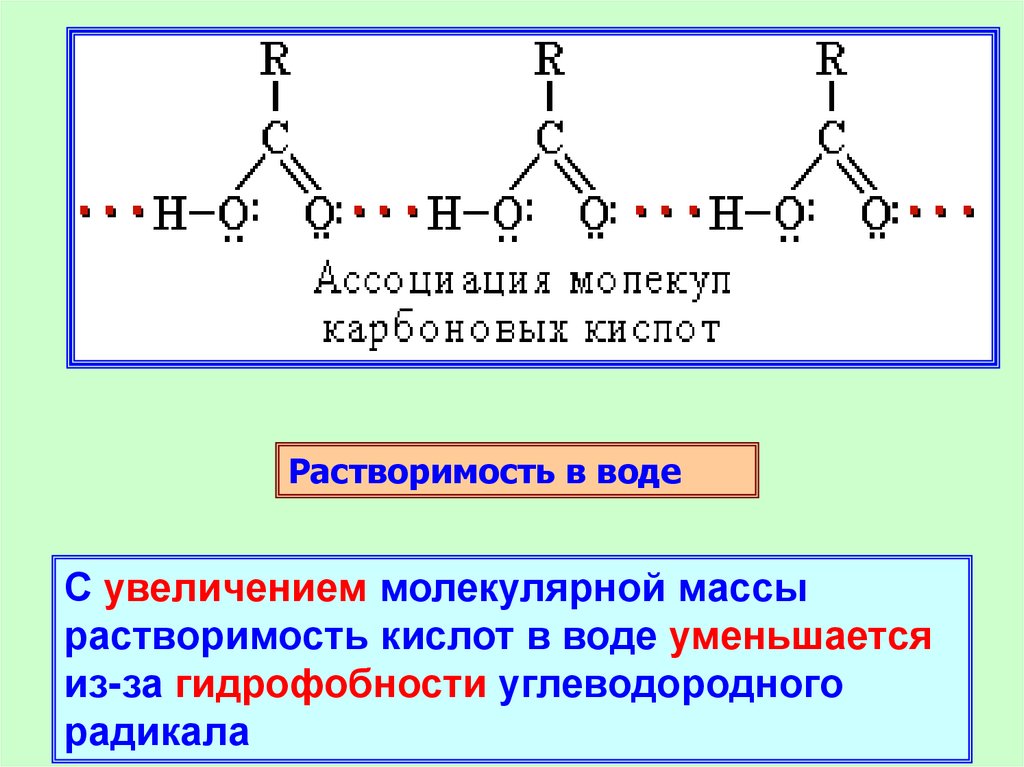
Растворимость в водеС увеличением молекулярной массы
растворимость кислот в воде уменьшается
из-за гидрофобности углеводородного
радикала
15. Физические свойства
Низшие карбоновые кислоты — жидкостис острым запахом, хорошо растворимые в
воде. С повышением относительной
молекулярной массы растворимость
кислот в воде уменьшается, а температура
кипения повышается. Высшие кислоты,
начиная с пеларгоновой С8Н17СООН —
твердые вещества, без запаха,
нерастворимые в воде.
16.
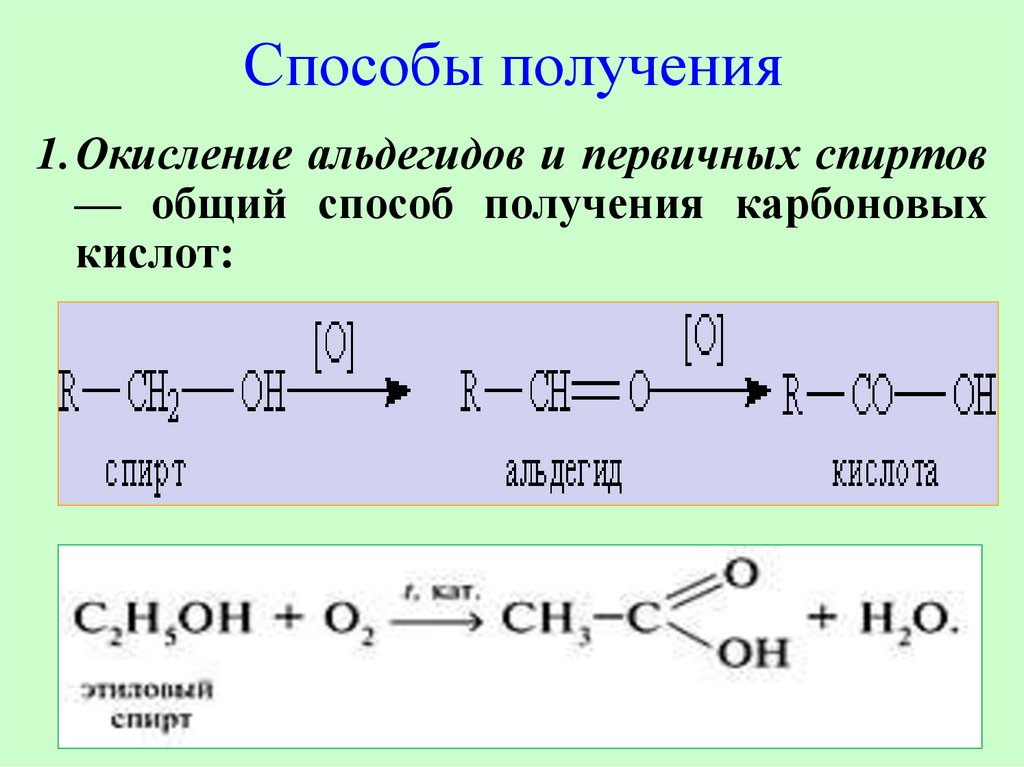
Способы получения1.Окисление альдегидов и первичных спиртов
— общий способ получения карбоновых
кислот:
17.
2.Другой общий способ — гидролиз
галогензамещенных
углеводородов,
содержащих три атома галогена у одного
атома углерода:
R CCl3 R C (OH )3 R COOH H 2O
3 NaOH
-3NaCl
18.
3. Взаимодействие реактива Гриньяра сСО2:
2O
R MgBr CO2 R COO MgBr H
R COOH Mg OH Br
19.
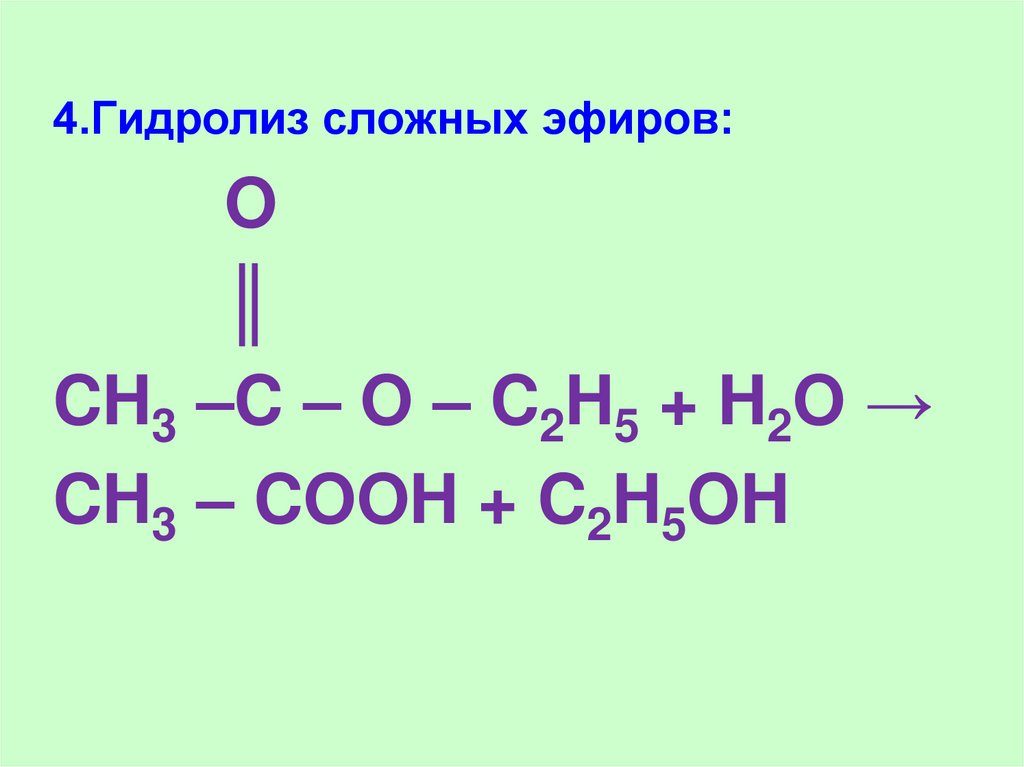
4.Гидролиз сложных эфиров:O
║
CH3 –C – O – C2H5 + H2O →
CH3 – COOH + C2H5OH
20. 5.Лабораторный способ
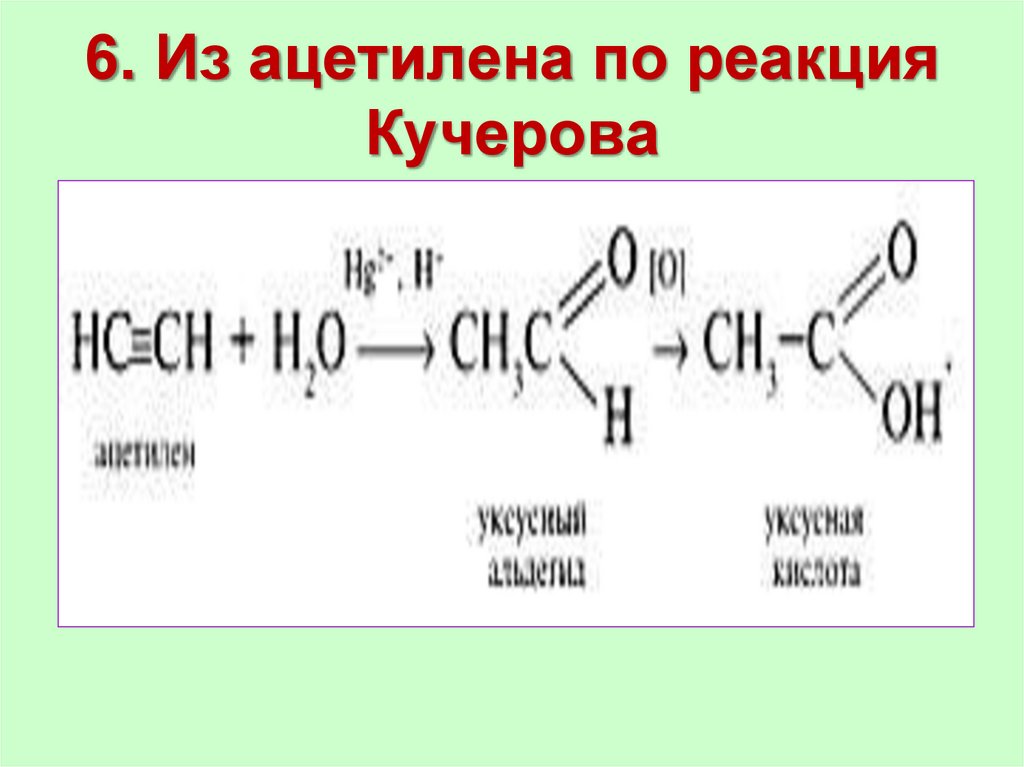
21. 6. Из ацетилена по реакция Кучерова
22. 7.Окисление бутана:
23.
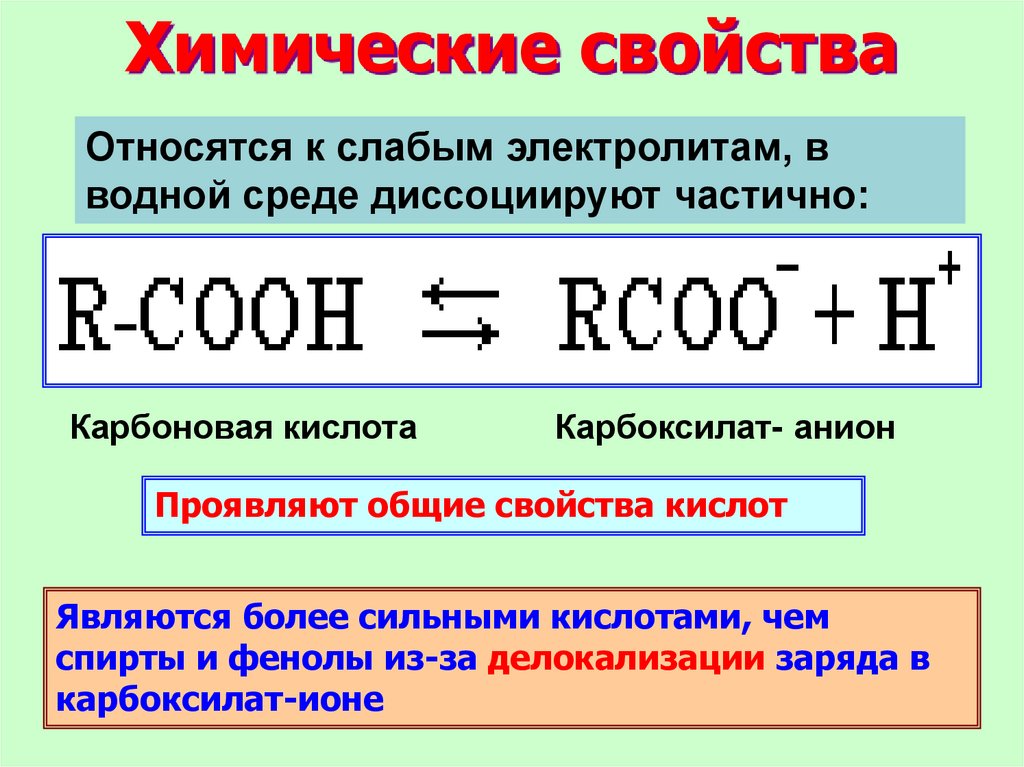
Химические свойстваОтносятся к слабым электролитам, в
водной среде диссоциируют частично:
Карбоновая кислота
Карбоксилат- анион
Проявляют общие свойства кислот
Являются более сильными кислотами, чем
спирты и фенолы из-за делокализации заряда в
карбоксилат-ионе
24.
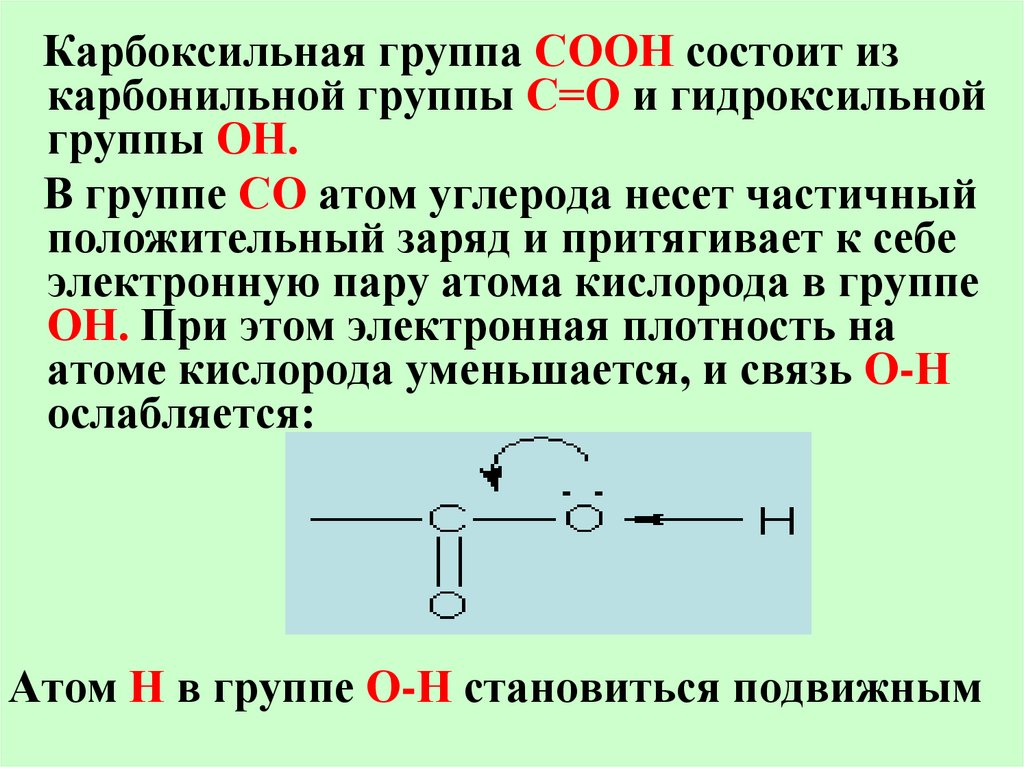
Карбоксильная группа СООН состоит изкарбонильной группы С=О и гидроксильной
группы ОН.
В группе СО атом углерода несет частичный
положительный заряд и притягивает к себе
электронную пару атома кислорода в группе
ОН. При этом электронная плотность на
атоме кислорода уменьшается, и связь О-Н
ослабляется:
Атом Н в группе О-Н становиться подвижным
25. Уксусная кислота
Уксусная кислота (этановая)СН3СООН–самая древняя из органических кислот.
Аптекари – алхимики средневековья
получали её из перебродившего вина.
Чистая уксусная кислота – б/ц жидкость
с резким запахом. 100% кислота
называется «ледяной»Она
используется
при консервировании пищевых
продуктов.
26. Уксусная кислота в больших количествах применяется в химической промышленности.
Основную часть уксусной кислотыиспользуют для получения
искусственных волокон и пластмасс на
основе целлюлозы. Уксусную кислоту
применяют в производстве красителей,
медикаментов, ядохимикатов,
органического стекла.
27. Модель молекулы уксусной кислоты:
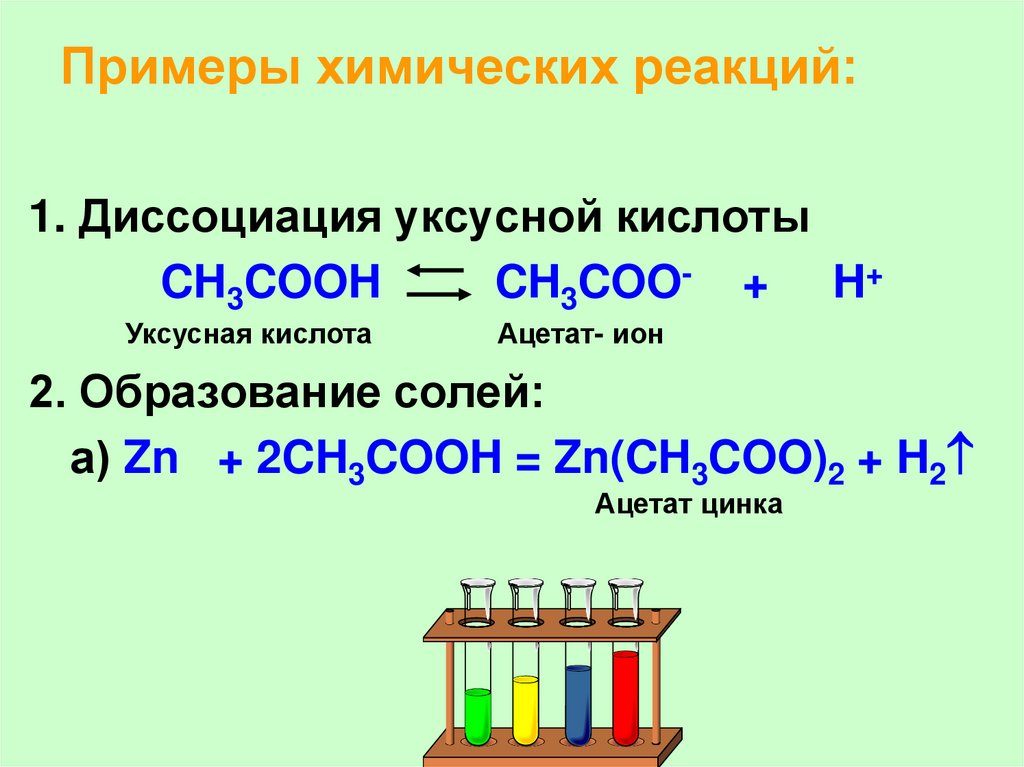
28. Примеры химических реакций:
1. Диссоциация уксусной кислотыCH3COOH
CH3COO- + H+
Уксусная кислота
Ацетат- ион
2. Образование солей:
а) Zn + 2CH3COOH = Zn(CH3COO)2 + H2
Ацетат цинка
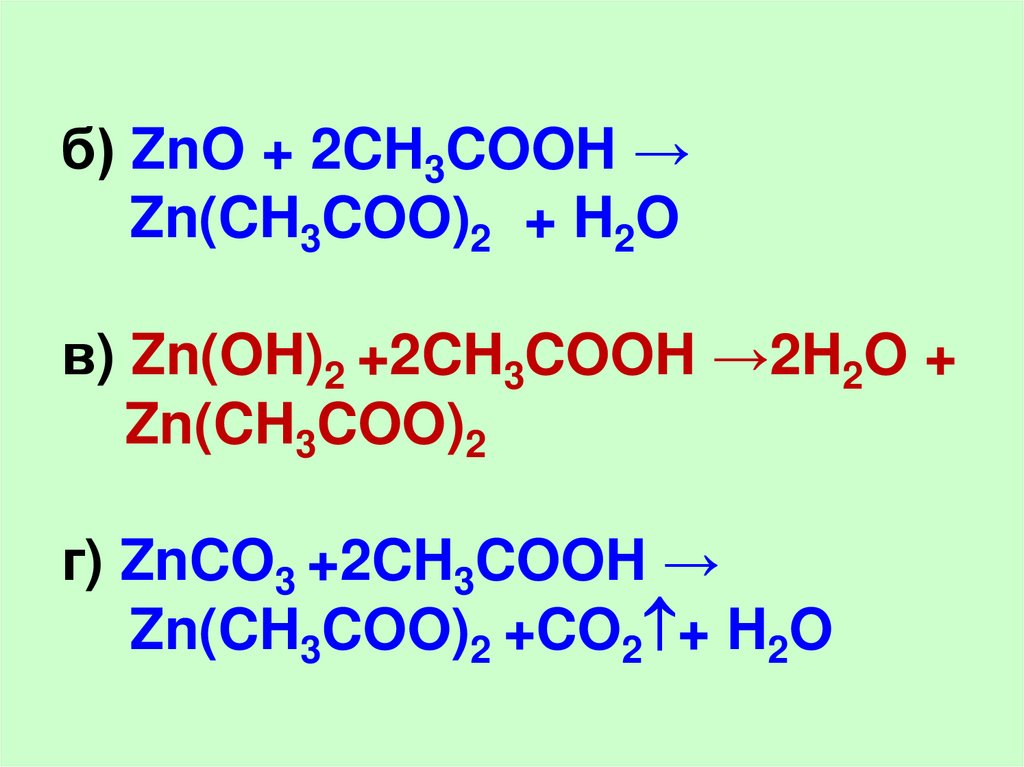
29.
б) ZnO + 2CH3COOH →Zn(CH3COO)2 + H2O
в) Zn(OH)2 +2CH3COOH →2H2O +
Zn(CH3COO)2
г) ZnCO3 +2CH3COOH →
Zn(CH3COO)2 +CO2 + H2O
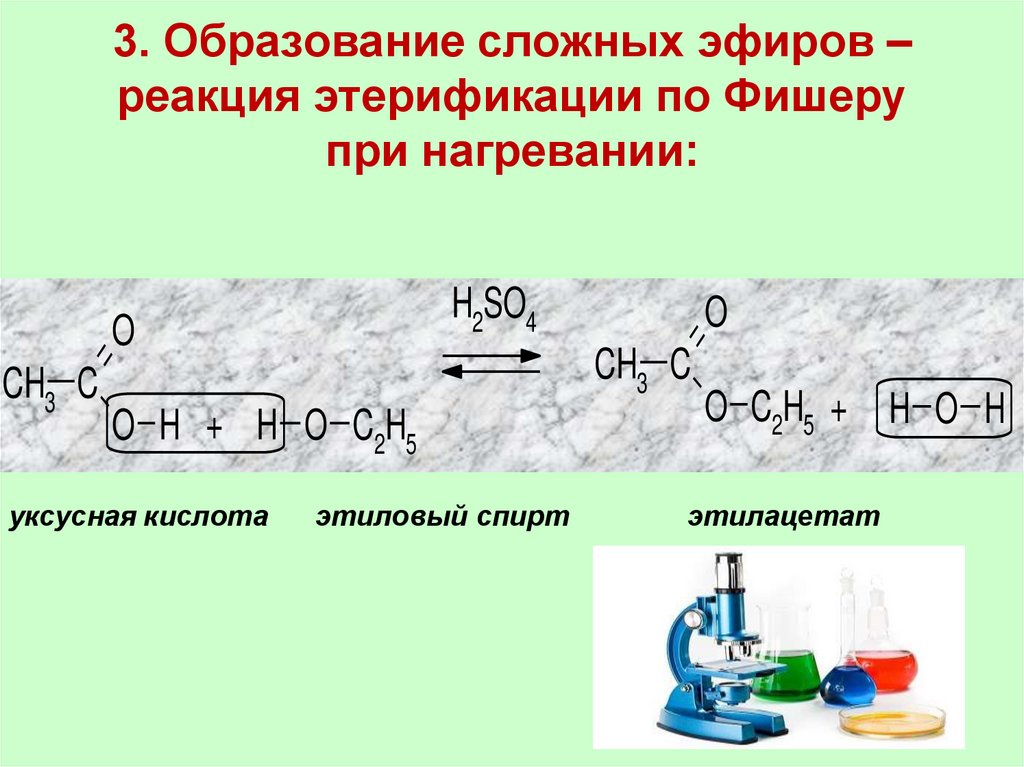
30. 3. Образование сложных эфиров – реакция этерификации по Фишеру при нагревании:
H2SO4O
CH3 C
CH3 C
O H + H O C2H5
уксусная кислота
O
этиловый спирт
O C2H5 + H O H
этилацетат
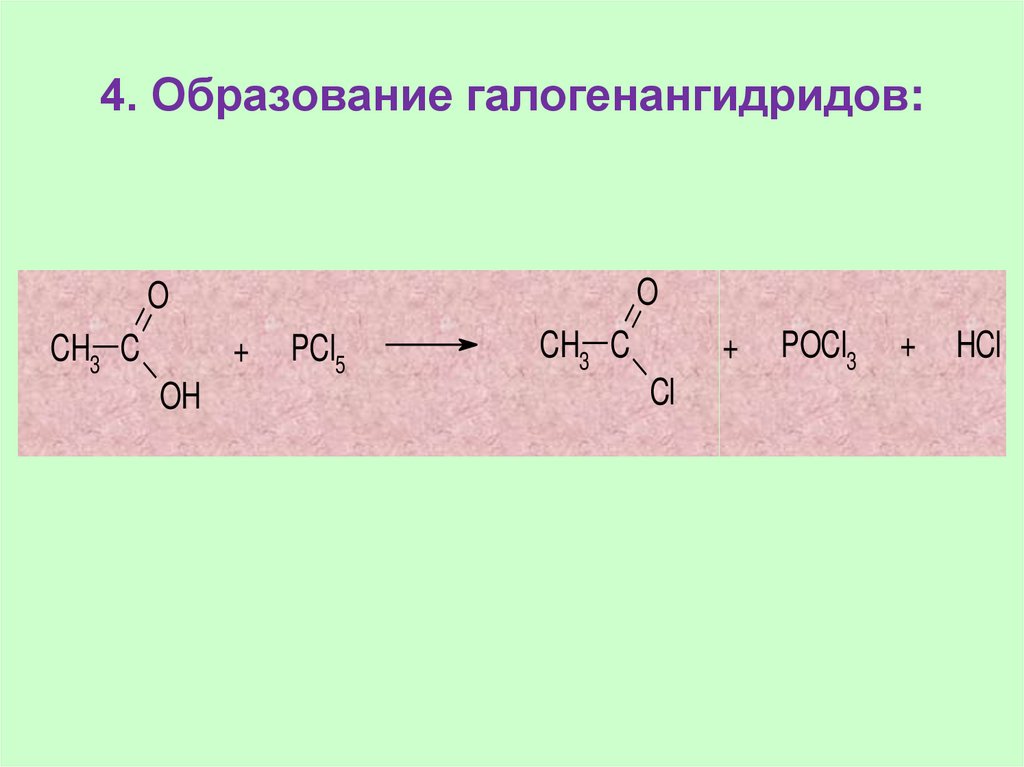
31. 4. Образование галогенангидридов:
OO
CH3 C
+
OH
PCl5
CH3 C
+
Cl
POCl3
+
HCl
32.
5. Реакции замещения (с галогенами) – внее способны вступать предельные
карбоновые кислоты.
CH3 – COOH + Cl2 → CH2Cl –COOH+ HCl
монохлоруксусная кислота
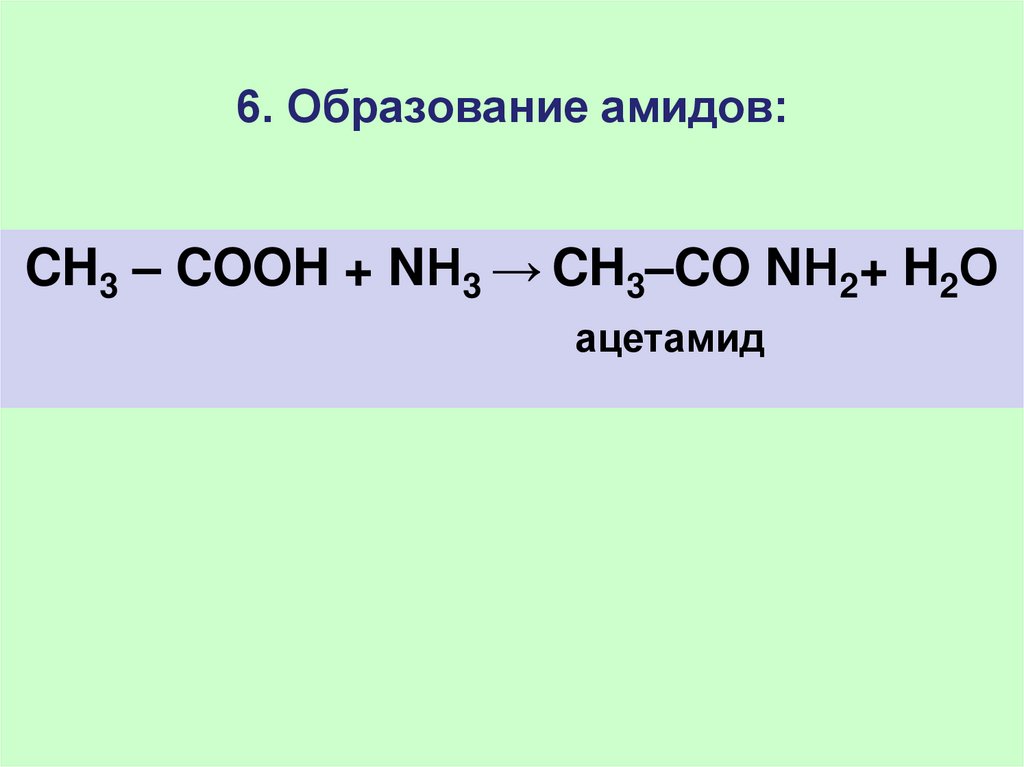
33. 6. Образование амидов:
CH3 – COOH + NН3 → CH3–CO NН2+ H2Оацетамид
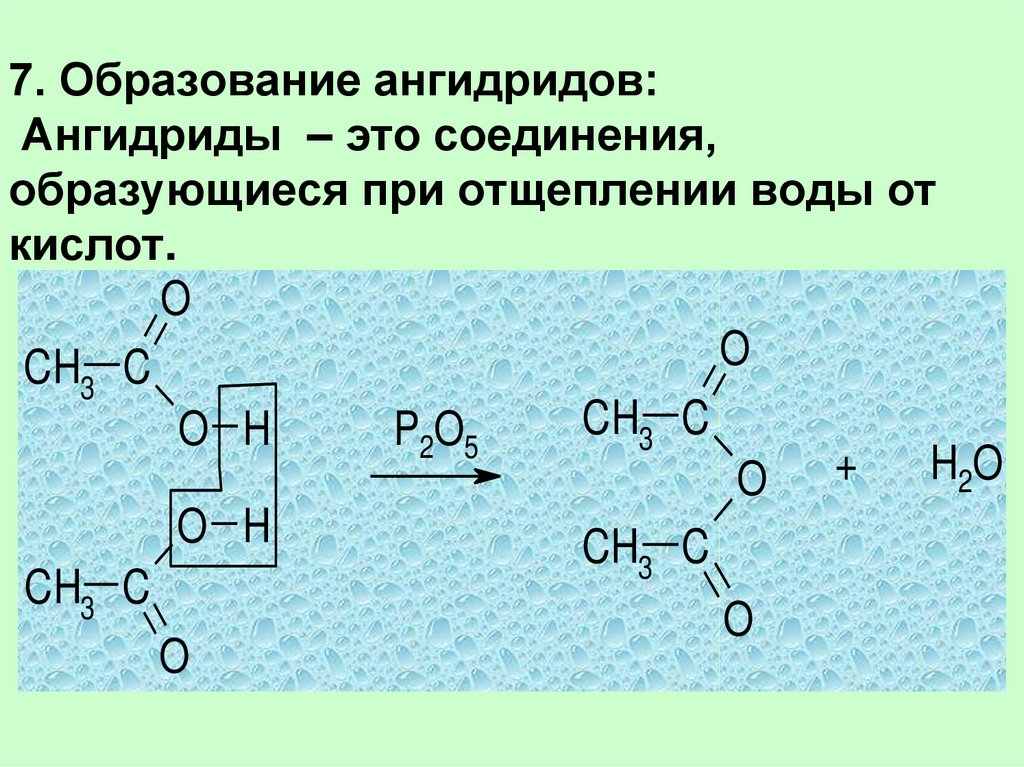
34. 7. Образование ангидридов: Ангидриды – это соединения, образующиеся при отщеплении воды от кислот.
OO
CH C
3
O H
O H
CH3 C
O
P2O5
CH3 C
O
CH3 C
O
+
H2O
35.
Муравьиная кислота (метановая) НСООН -Содержится в выделениях
муравьёв, в
щетинках крапивы, в яде пчёл.
Спиртовые растворы муравьиной
ислоты используются в лечении
ревматизма. В структуре
той кислоты есть альдегидная
руппа,
поэтому для нее характерны
ледующие реакции:
36. Модель молекулы муравьиной кислоты:
37.
1. Окисление муравьиной кислоты (этареакция свойственна только для
данной кислоты):
2KMnO4 + 5HCOOH + 3H2SO4 →
K2SO4 + 2MnSO4 + +5CO2↑ + 8H2O
38.
2. Раствор муравьиной кислоты, вотличие от других карбоновых кислот
дает реакцию «серебряного зеркала» :
39.
40. 3. Реакция дегидратации:
HCOOH + Н2SO4 → CO2 ↑ + H2O41.
Среди изомеров валериановой кислоты наибольшеезначение имеет 3-метилбутановая кислота
(изовалериановая кислота) СН3-СH(СН3)-СН2-СООН,
которую получают из валерианового корня или
синтетически. Она применяется для синтеза
лекарственных веществ: валидола, бромурала и др.
В пищевой промышленности используют
изоамиловый эфир изовалериановой кислоты
(яблочная эссенция).
42.
В промышленных масштабах бензойнуюкислоту получают окислением толуола.
Применяют в медицине при кожных
заболеваниях как наружное
антисептическое противогрибковое
средства, а её натриевую соль – как
отхаркивающее средство. Кроме того,
бензойную кислоту и её соли используют
при консервировании пищевых
продуктов (пищевые добавки E210, E211,
E212, E213). Эфиры бензойной кислоты
(от метилового до амилового) обладают
сильным запахом и применяются в
парфюмерной промышленности.
Некоторые другие производные
бензойной кислоты, широко
применяются для синтеза красителей.
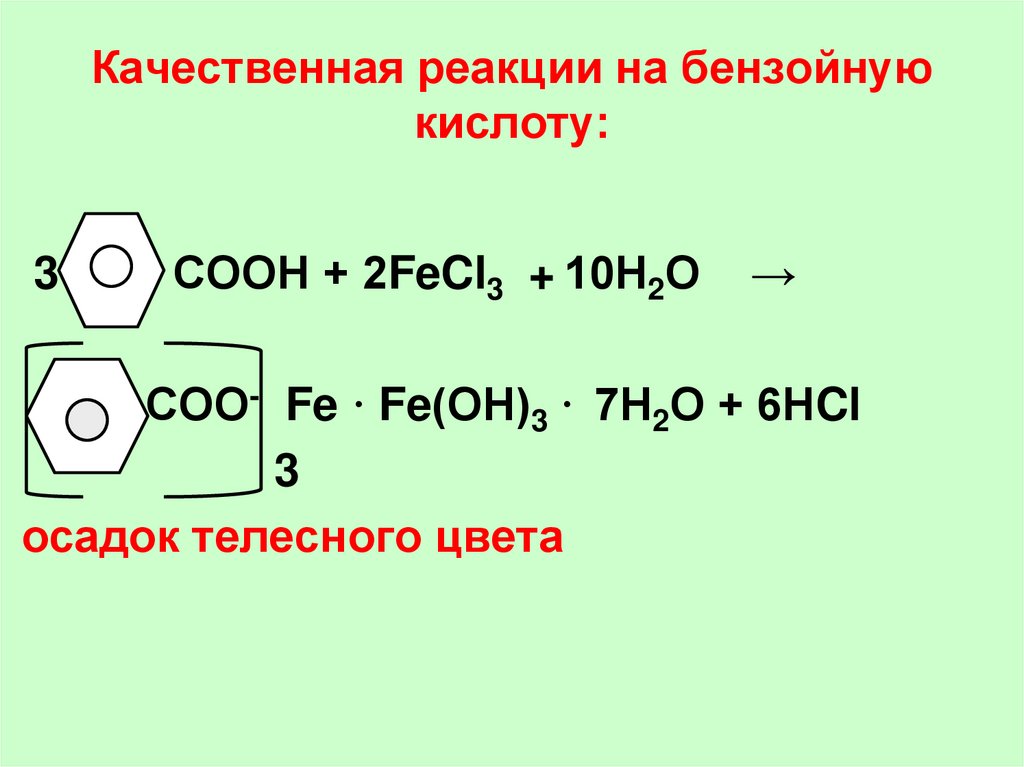
43. Качественная реакции на бензойную кислоту:
3СООН + 2FeCl3 + 10Н2О
→
СОО- Fe · Fe(ОН)3 · 7Н2О + 6НCl
3
осадок телесного цвета
44.
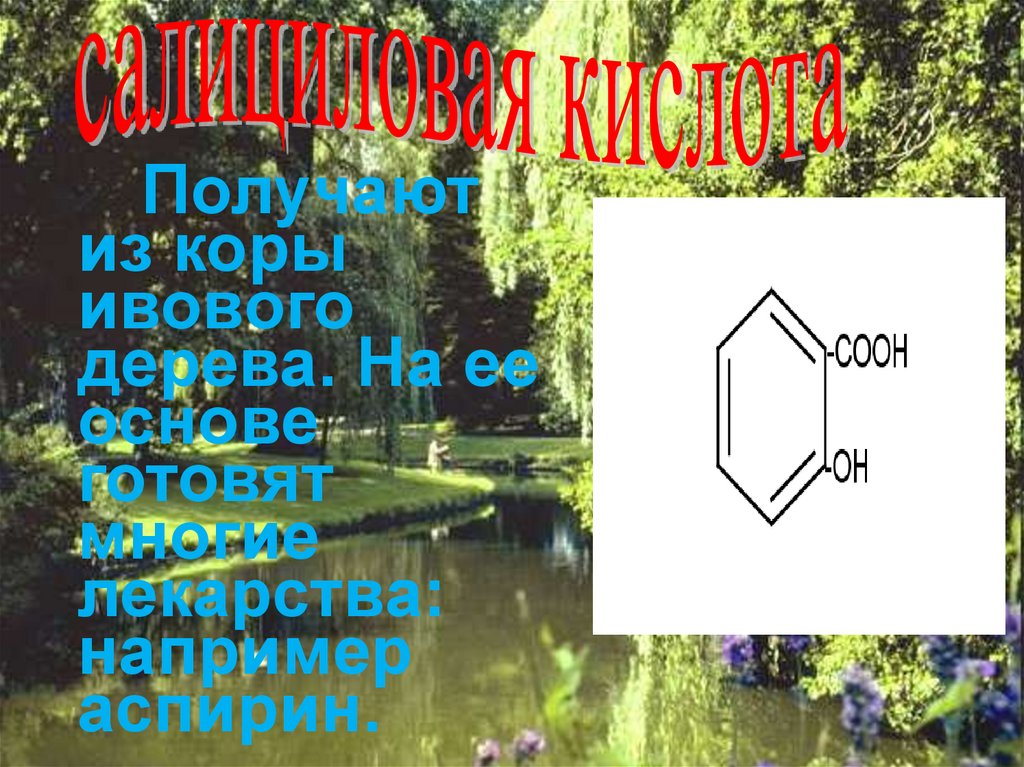
Получаютиз коры
ивового
дерева. На ее
основе
готовят
многие
лекарства:
например
аспирин.
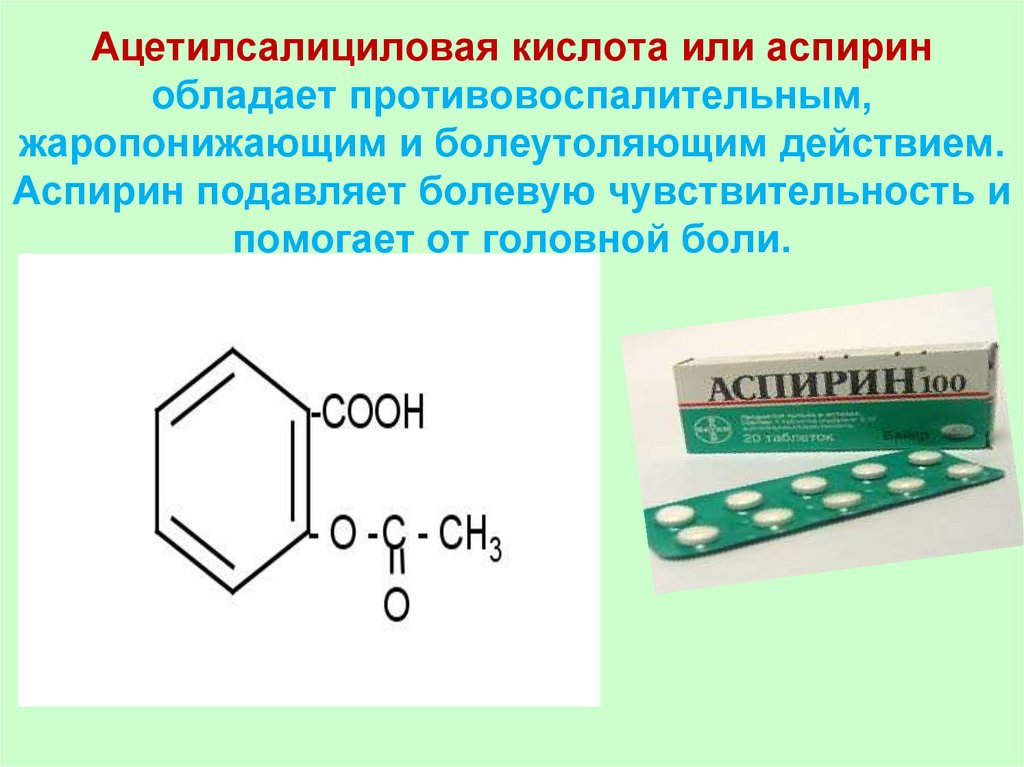
45. Ацетилсалициловая кислота или аспирин обладает противовоспалительным, жаропонижающим и болеутоляющим действием. Аспирин
подавляет болевую чувствительность ипомогает от головной боли.
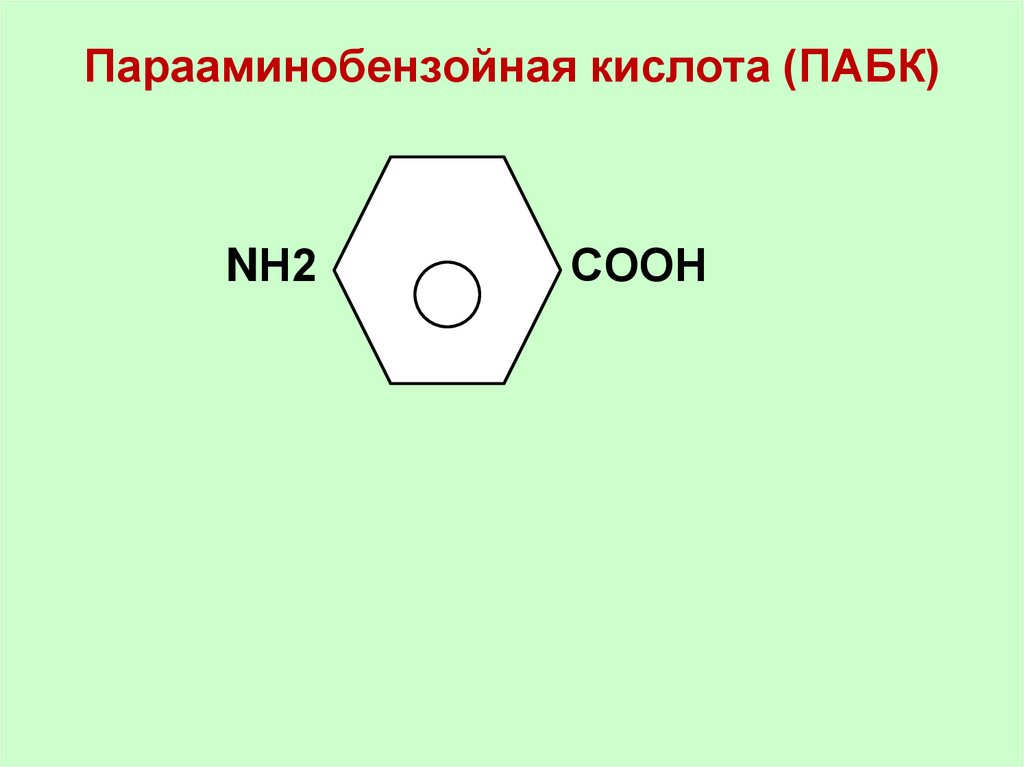
46. Парааминобензойная кислота (ПАБК)
NН2СООН
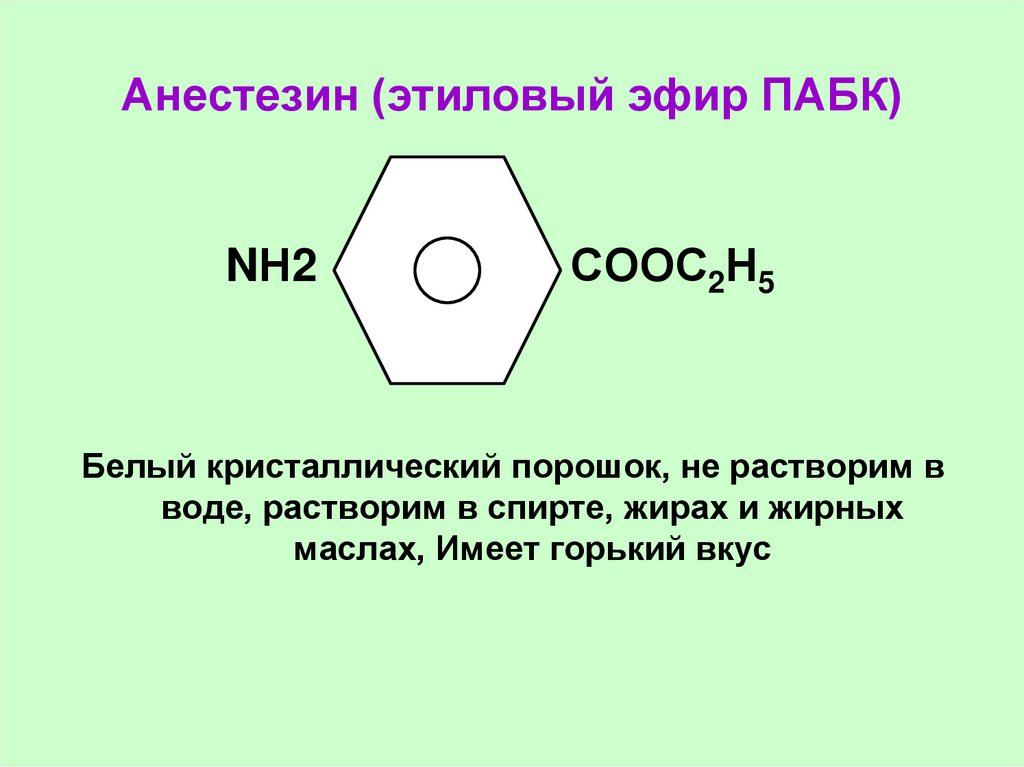
47. Анестезин (этиловый эфир ПАБК)
NН2СООС2Н5
Белый кристаллический порошок, не растворим в
воде, растворим в спирте, жирах и жирных
маслах, Имеет горький вкус
48.
Стеариновая кислота относится квысшим карбоновым кислотам и имеет
формулу С17Н35СООН.
Она является одной из наиболее
распространённых в природе высших
жирных кислот. Стеариновая кислота —
главная составная часть многих жиров и
масел, из которых её выделяют
гидролизом.
49.
Соли стеариновой кислотыназываются стеаратами.
Стеараты кальция, магния или железа,
так же как сама стеариновая кислота, в
воде нерастворимы.
Стеараты щелочных металлов, например
стеарат натрия С17Н35СООNa, хорошо
растворимы в воде. Они являются
основой мыл: хозяйственного,
банного, туалетного,
детского.
50.
Насыщенная карбоноваякислота. Наиболее
распространённая в природе
жирная предельная кислота: в
виде сложных эфиров
глицерина входит в состав
почти всех природных жиров.
Соли пальмитиновой кислоты
наряду с солями некоторых др.
карбоновых кислот являются
мылами. Смесь
пальмитиновой кислоты и
стеариновой кислоты
составляет основу стеарина.
51.
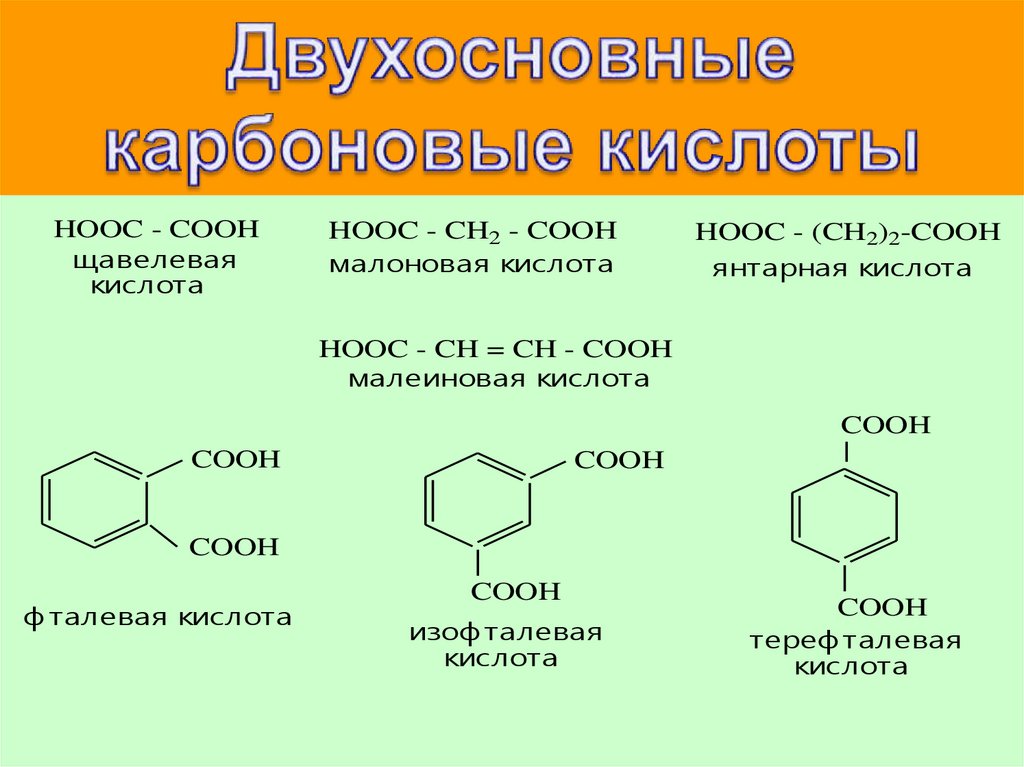
HOOC - COOHщавелевая
кислота
HOOC - CH2 - COOH
малоновая кислота
HOOC - (CH2)2-COOH
янтарная кислота
HOOC - CH = CH - COOH
малеиновая кислота
COOH
COOH
COOH
COOH
ф талевая кислота
COOH
изоф талевая
кислота
COOH
тереф талевая
кислота
52. Номенклатура
• Систематическая номенклатура непредельныхкарбоновых кислот (ИЮПАК):
• Выбирают в молекуле наиболее длинную
углеродную цепь с двумя карбоксильными группами
СООН.
• Нумерацию цепи начинают с атома углерода
карбоксильной группы, причем, с того конца
молекулы, у которого ближе и больше радикалов.
• Называют окружающие радикалы: в порядке
возрастания, с указанием количества и положения в
цепи.
• По длине цепи называют углеводород (алкен, алкин,
диен и т.д.), указывая положение ненасыщенных
связей, добавляя –диовая кислота.
53. Пример:
CH34
6
3
5
2 1
CH3 - CH - CH2 - CH - CH2 - C - COOH
COOH
CH3
CH3
7
2,2,4,6 - тетраметилгептандиовая кислота
54. Изомерия
1. Изомерия строения углеродногоскелета (структурная):
а) строение углеводородного
радикала
HOOC - CH2 - CH2 - COOH HOOC - CH - COOH
бутандиовая кислота
CH3
2-метилпропандиовая
кислота
55. б)структурная изомерия связанная с положением ненасыщенных связей:
HOOC - CH = CH - CH2 - CH2 - COOH HOOC - CH2 - CH = CH - CH2 - COOH2-гексендиовая кислота
3-гексендиовая кислота
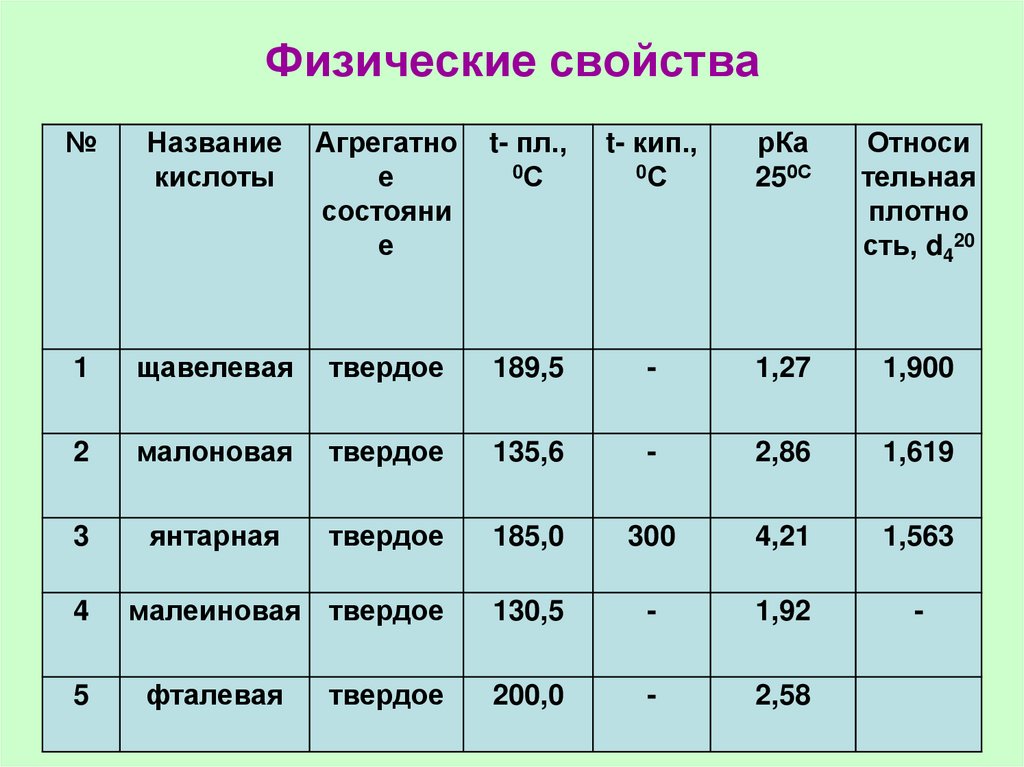
56. Физические свойства
№Название
кислоты
Агрегатно
е
состояни
е
t- пл.,
0С
t- кип.,
0С
рКа
250С
Относи
тельная
плотно
сть, d420
1
щавелевая
твердое
189,5
-
1,27
1,900
2
малоновая
твердое
135,6
-
2,86
1,619
3
янтарная
твердое
185,0
300
4,21
1,563
малеиновая твердое
130,5
-
1,92
-
200,0
-
2,58
4
5
фталевая
твердое
57.
1. Реакция окисление :Ag(NH3)2OH
CH - CH2 - COOH
HOOC-CH2-COOH
CH2 - CH2-COOH
-Ag -H2O
-H2O
-NH3
O
OH
3-оксопропановая
пропандиовая
3-оксипропановая
кислота
кислота
кислота
O
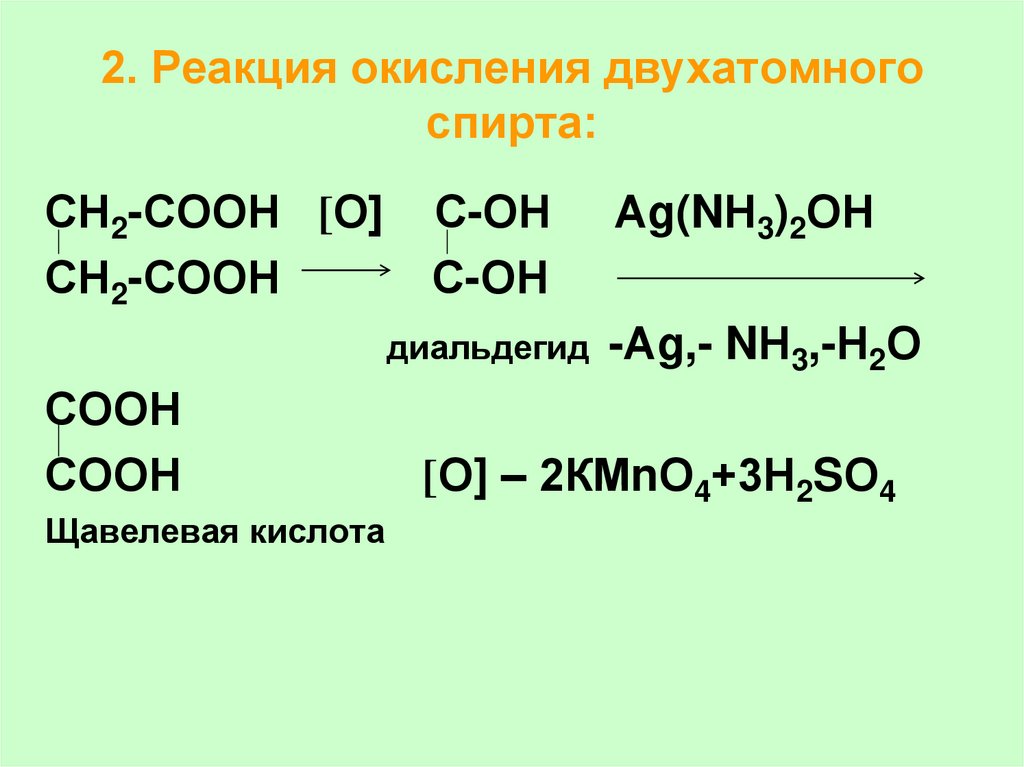
58. 2. Реакция окисления двухатомного спирта:
СН2-СООН [О]СН2-СООН
С-ОН
С-ОН
диальдегид
СООН
СООН
Щавелевая кислота
Аg(NН3)2ОН
-Аg,- NН3,-Н2О
[О] – 2КМnО4+3Н2SО4
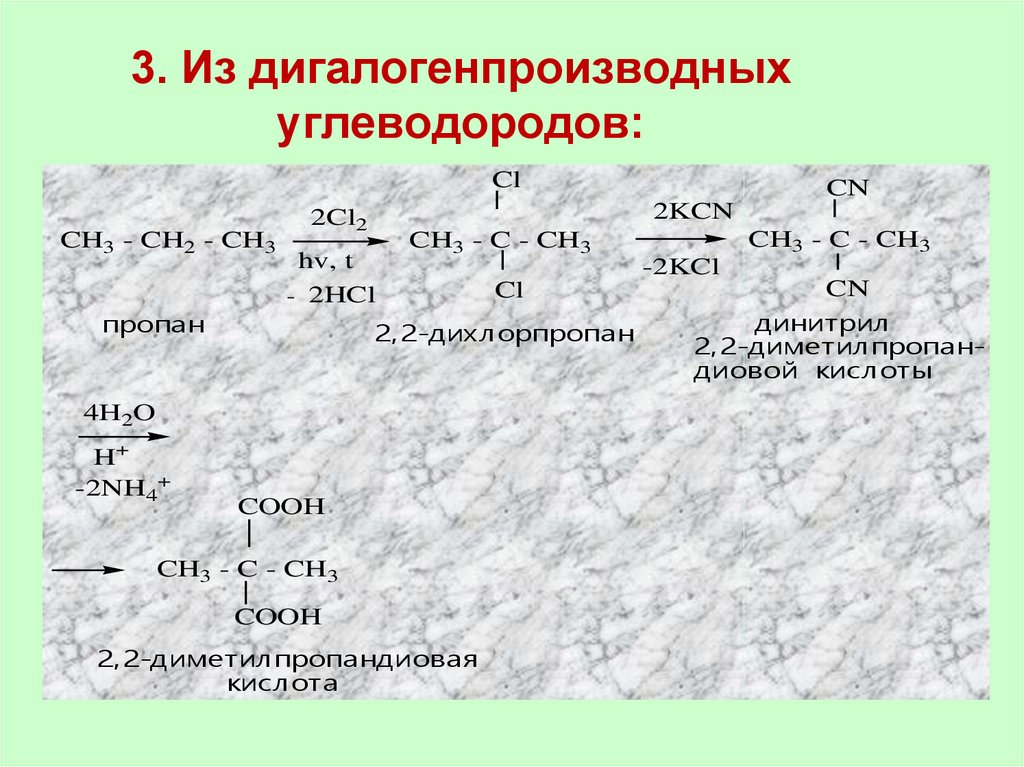
59. 3. Из дигалогенпроизводных углеводородов:
ClCH3 - CH2 - CH3
пропан
2KCN
2Cl2
hv, t
- 2HCl
CH3 - C - CH3
CH3 - C - CH3
-2KCl
Cl
2,2-дихлорпропан
4H2O
H+
-2NH4+
CN
COOH
CH3 - C - CH3
COOH
2,2-диметилпропандиовая
кислота
CN
динитрил
2,2-диметилпропандиовой кислоты
60. 4. Промышленный способ получения щавелевой кислоты:
1) НСООNа- НСООNа → СООNа- СООNа +Н22) СООNа- СООNа + 2НСl → СООН- СООН +
2 NаСl
61.
Благодаря наличию в молекуледвухосновных карбоновых кислот
двух
функциональных групп СООН,
увеличиваются кислотные свойства
соединения по сравнению с
одноосновными карбоновыми
кислотами
аналогичного строения.
62. 1.Свойства гидроксильной группы:
а) диссоциация (кислотные свойства):Н2С2О4 ↔ Н+ + НС2О4+
-2
НС2О 4 ↔ Н + С2О4
-----------------------------------------------
Н2С2О4 ↔ 2Н+ + С2О4-2
оксалат –ион
Чем ближе карбоксильные группы, тем
выше кислотные свойства соединения.
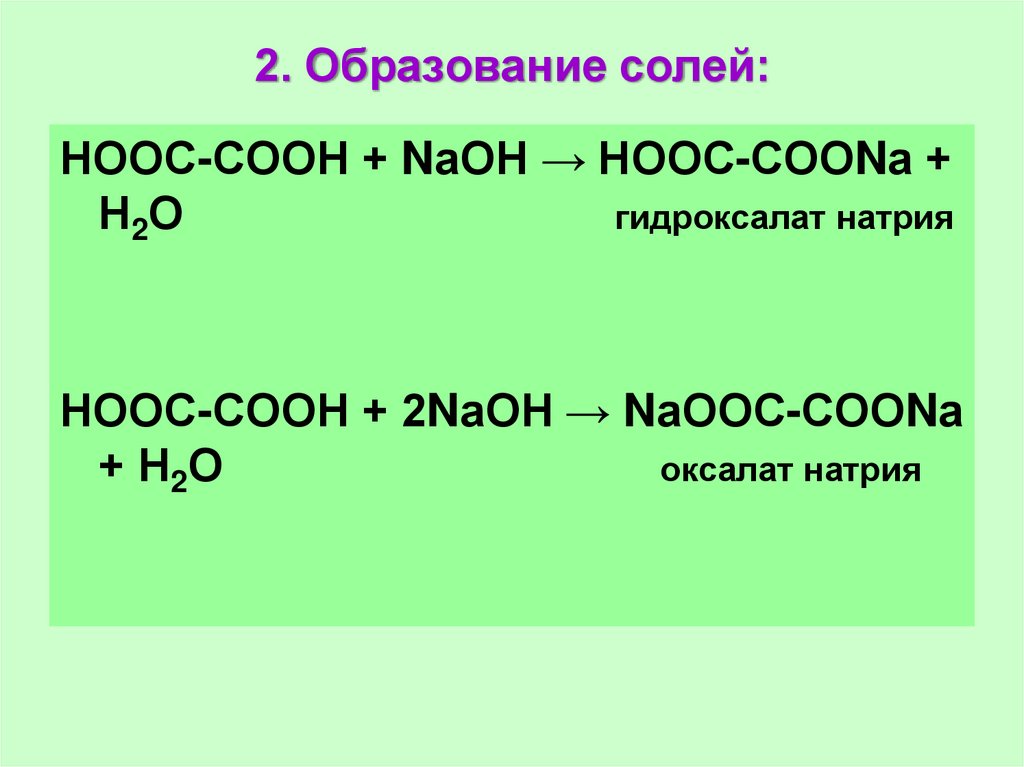
63. 2. Образование солей:
НООС-СООН + NаОН → НООС-СООNа +Н2О
гидроксалат натрия
НООС-СООН + 2NаОН → NаООС-СООNа
+ Н2О
оксалат натрия
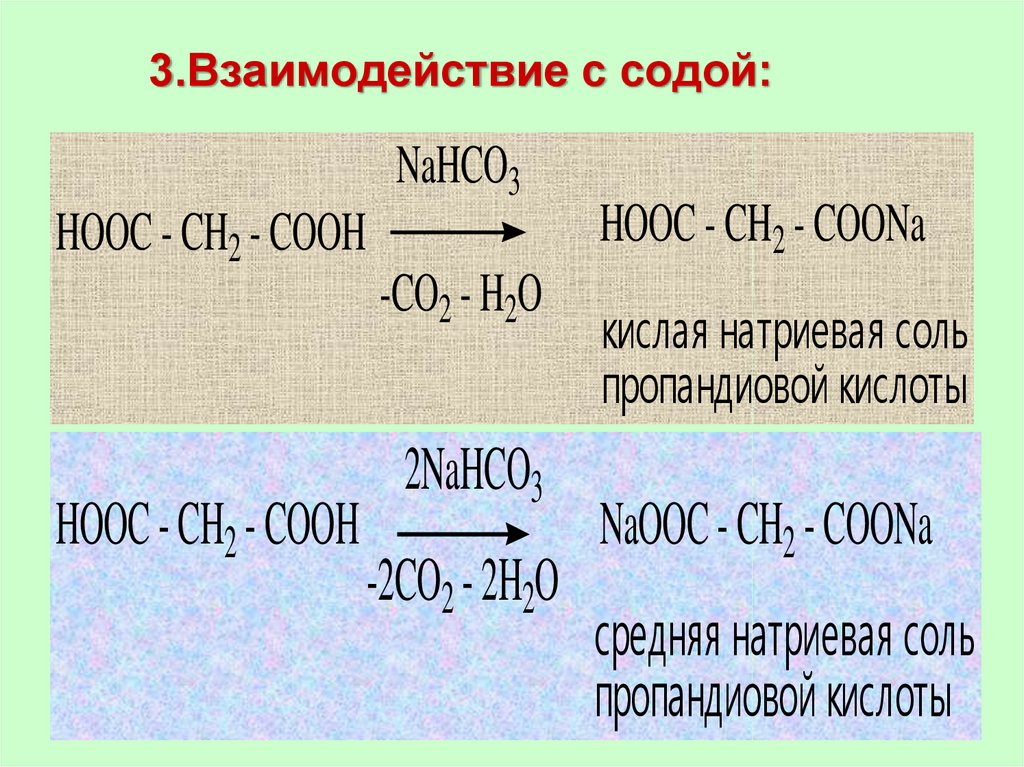
64. 3.Взаимодействие с содой:
NaHCO3HOOC - CH2 - COOH
-CO2 - H2O
HOOC - CH2 - COOH
2NaHCO3
-2CO2 - 2H2O
HOOC - CH2 - COONa
кислая натриевая соль
пропандиовой кислоты
NaOOC - CH2 - COONa
средняя натриевая соль
пропандиовой кислоты
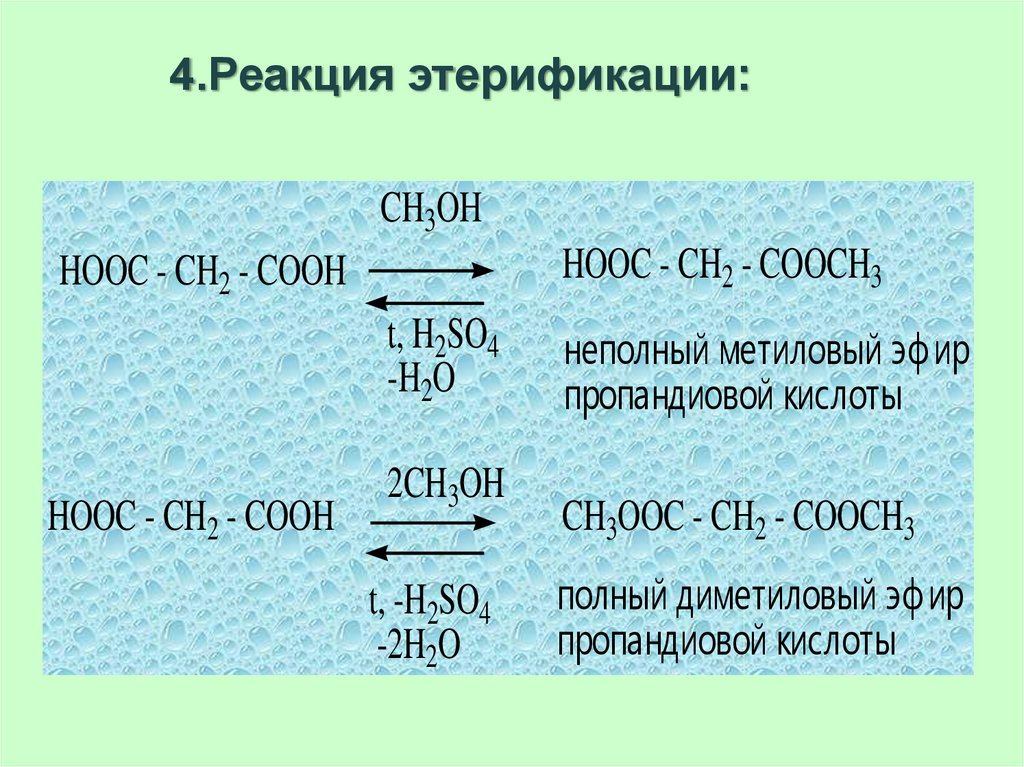
65. 4.Реакция этерификации:
CH3OHHOOC - CH2 - COOCH3
HOOC - CH2 - COOH
t, H2SO4
-H2O
HOOC - CH2 - COOH
2CH3OH
t, -H2SO4
-2H2O
неполный метиловый эфир
пропандиовой кислоты
CH3OOC - CH2 - COOCH3
полный диметиловый эфир
пропандиовой кислоты
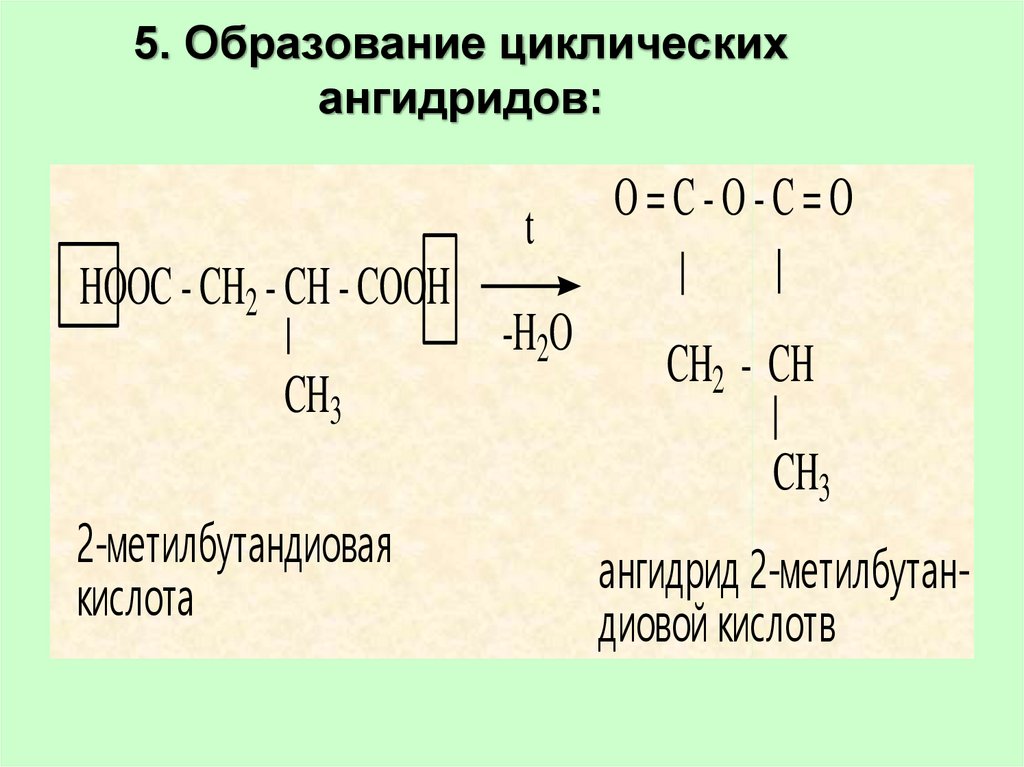
66. 5. Образование циклических ангидридов:
tHOOC - CH2 - CH - COOH
CH3
2-метилбутандиовая
кислота
-H2O
O=C-O-C=O
CH2 - CH
CH3
ангидрид 2-метилбутандиовой кислотв
67. 6.Образование хлорангидридов:
НООС-СООН + РСl5 → НООС-СОСl + Н2Онеполный хлорангидрид
щавелевой кислоты
НООС-СООН + 2РСl5 → СlОС-СОСl + 2Н2О
полный хлорангидрид
щавелевой кислоты
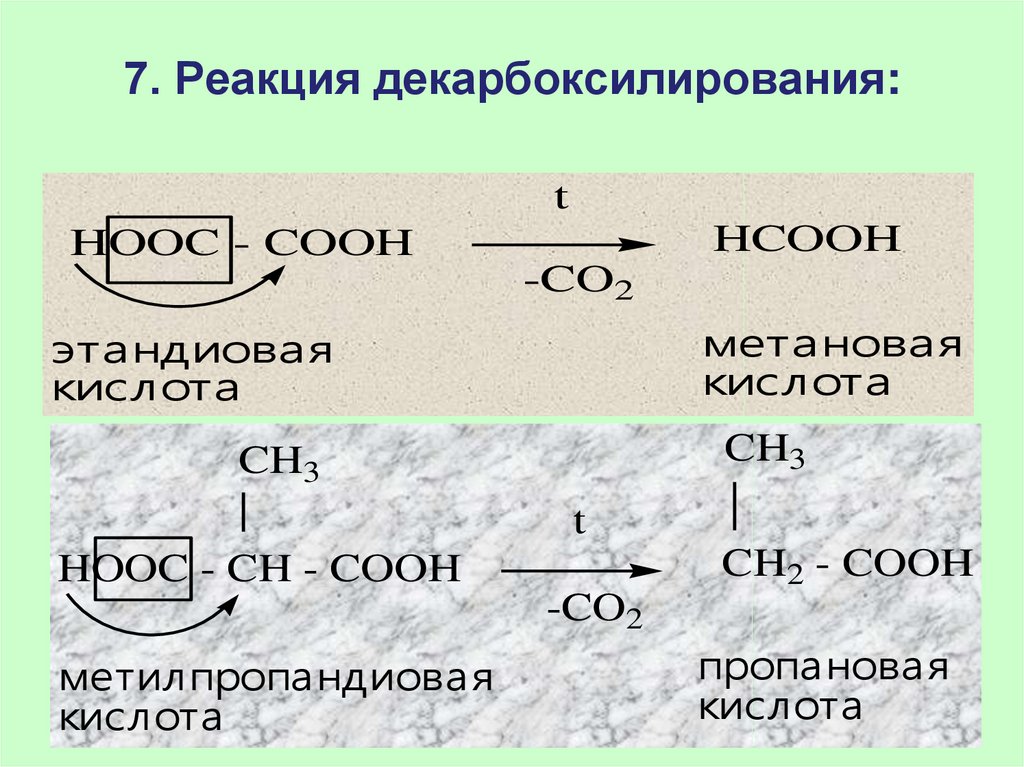
68. 7. Реакция декарбоксилирования:
tHCOOH
HOOC - COOH
-CO2
метановая
кислота
этандиовая
кислота
CH3
CH3
t
CH2 - COOH
HOOC - CH - COOH
-CO2
метилпропандиовая
кислота
пропановая
кислота
69. 8. Реакция окисления:
[О]НООС-СООН
СО2↑ + Н2О
[О] – КМnО4 + Н2SО4
70. 9. Качественная реакция на щавелевую кислоту:
НООС-СООН + СаСl2 → ООС-СОО↓ +2НСlСа
оксалат кальция
белый
71. Щавелевая кислота
Бесцветноевещество в виде кристаллов.
Содержится в щавеле, ревене,
шпинате, клевере и помидорах.
Применяется в текстильной
промышленности, органическом
синтезе, для отчистки металлов
от ржавчины и накипи.
72.
Впервые получена в XVII векеперегонкой янтаря. Содержится
недозрелых фруктах и буром
угле. Используется, как лекарственное средство. Для получения
пластмасс, смол, пищевой промышленности используется в качест
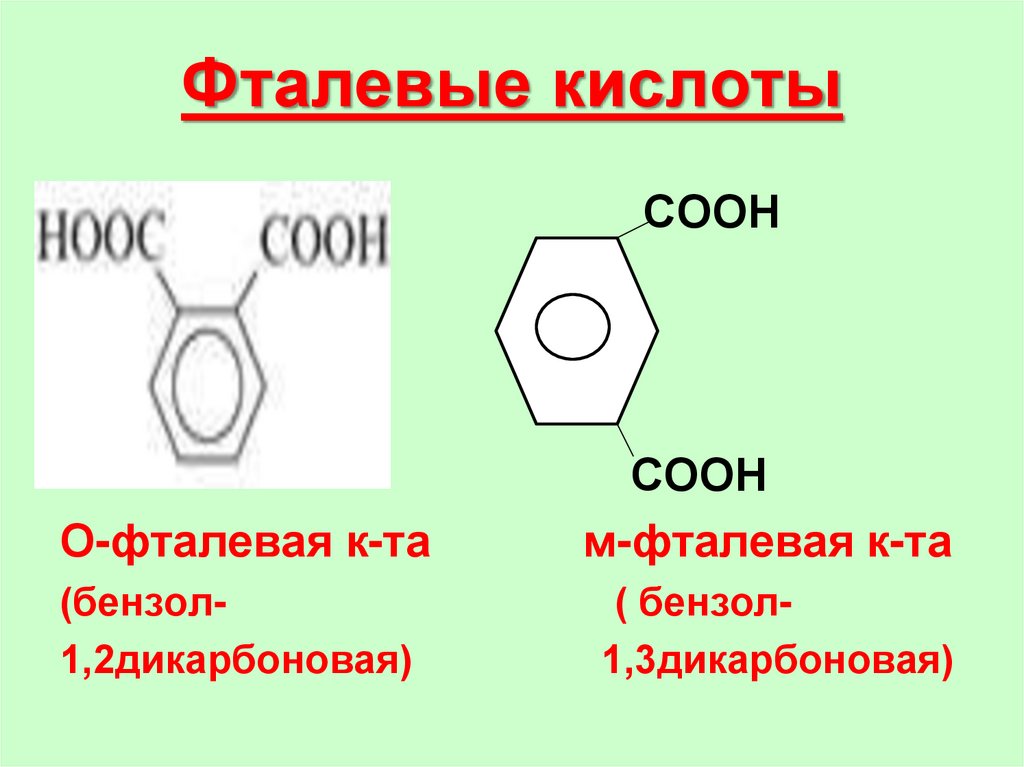
73. Фталевые кислоты
СООН
О-фталевая к-та
СООН
м-фталевая к-та
(бензол1,2дикарбоновая)
( бензол1,3дикарбоновая)
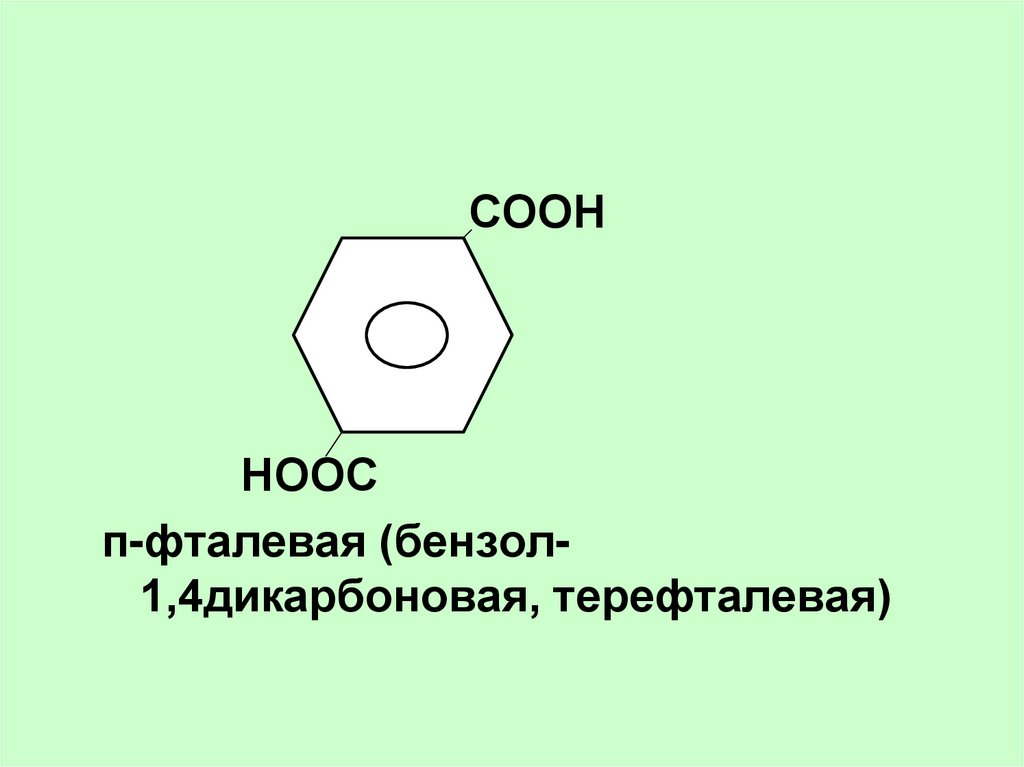
74.
СООННООС
п-фталевая (бензол1,4дикарбоновая, терефталевая)
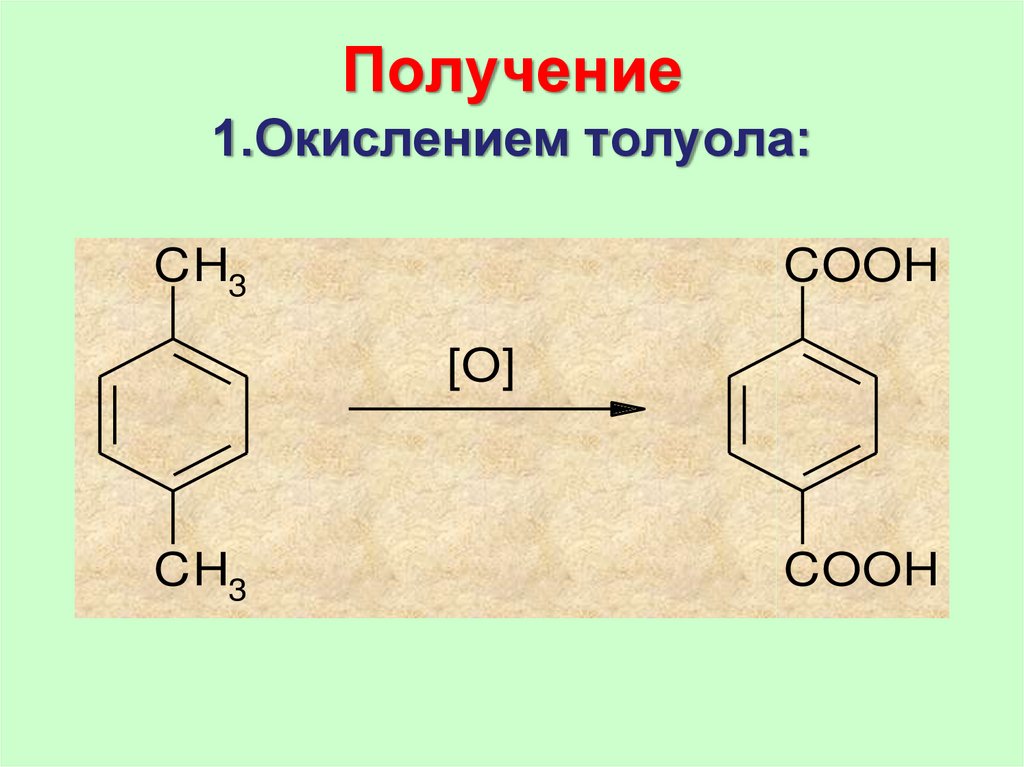
75. Получение 1.Окислением толуола:
CH3COOH
[O]
CH3
COOH
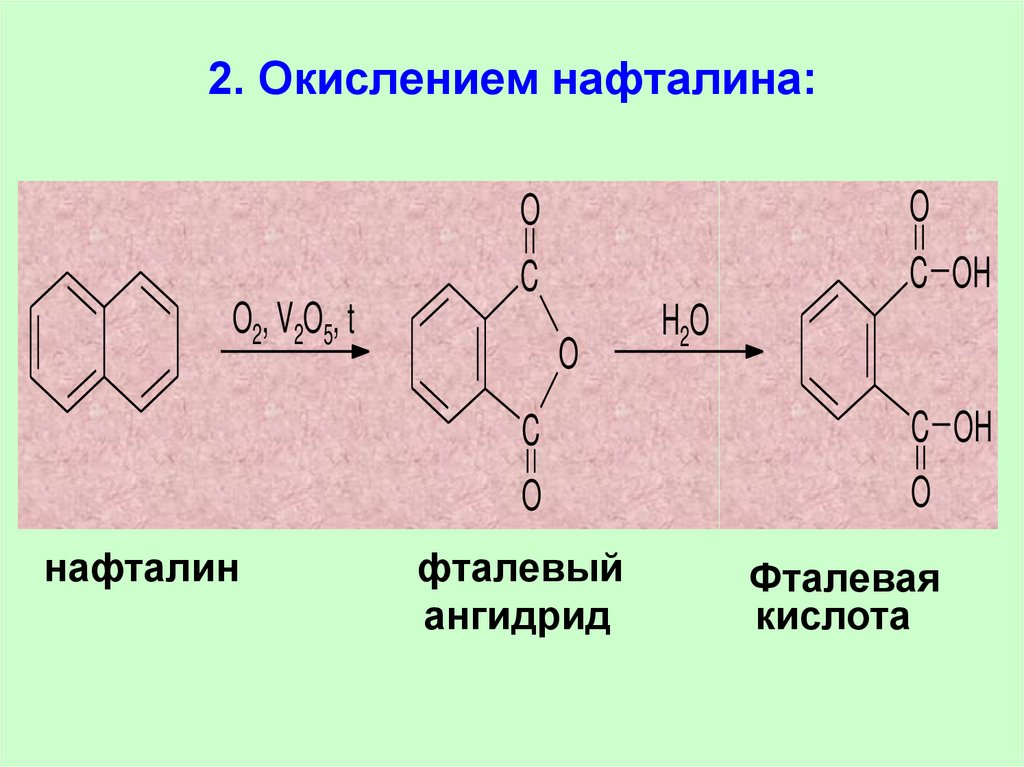
76. 2. Окислением нафталина:
OO
C
C OH
O2, V2O5, t
нафталин
O
H2O
C
C OH
O
O
фталевый
ангидрид
Фталевая
кислота
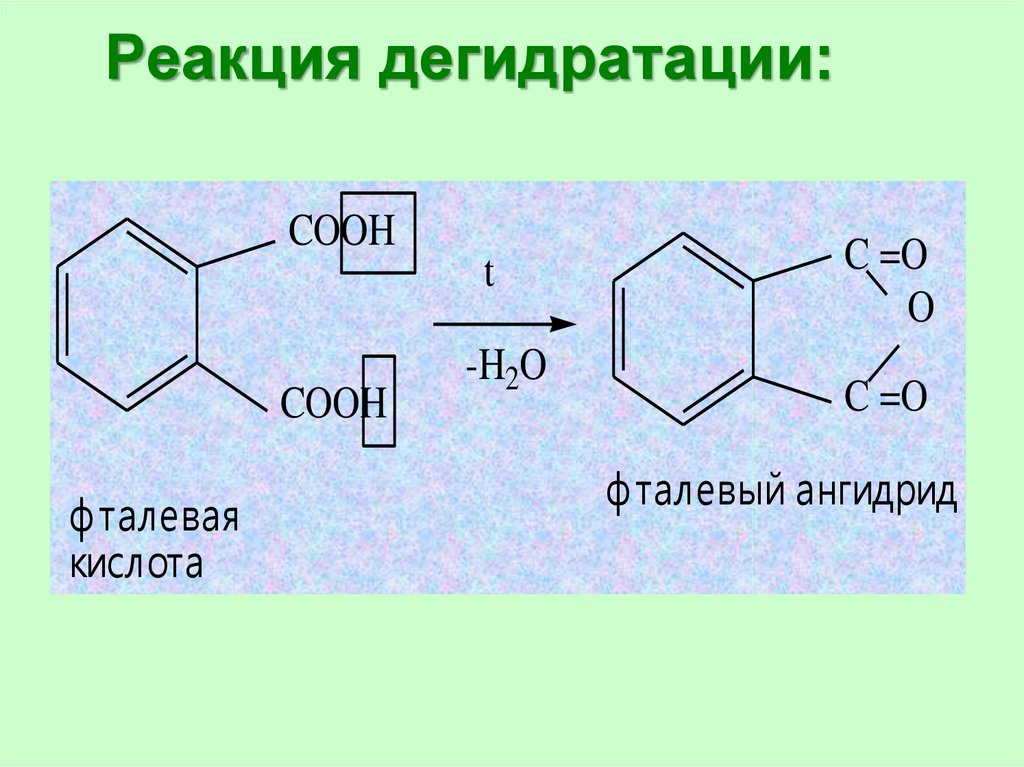
77. Реакция дегидратации:
COOHt
COOH
ф талевая
кислота
-H2O
C =O
O
C =O
ф талевый ангидрид
78. Применение
При конденсации фталевогоангидрида с фенолом в присутствии
безводного хлорида цинка
образуется фенолфталеин, который
применяется в медицине как
слабительное средство (пурген).
Фенолфталеин применяется в химии
как индикатор.
79. 4. Вопросы и задания.
1. Что называется карбоновымикислотами?
2. Напишите молекулярную и
структурную формулу карбоксильной
функциональной группы.
3. Напишите структурную формулу
уксусной кислоты. Каковы её
физические свойства и где она
применяется?
4. Перечислите химические свойства
уксусной кислоты.
80. 5. С какими из ниже перечисленных веществ будет реагировать уксусная кислота? Напишите уравнения воз-можных реакций и назовите
5. С какими из ниже перечисленныхвеществ будет реагировать уксусная
кислота? Напишите уравнения возможных реакций и назовите вещества.
Zn(OH)2, Cu, NaCl, Mg, BaCO3, FeO, CO2,
KOH.
6. Назовите формулу известной вам
жирной карбоновой кислоты.
7. Где применяются стеараты натрия и
калия?










































 chemistry
chemistry








