Similar presentations:
Органическая химия
1.
ОРГАНИЧЕСКАЯХИМИЯ
2.
Органическая химия• Лекции для студентов, обучающихся по
специальности «Биоинженерия и
биоинформатика»
• Профессор кафедры химии Института
Фармации Белобородов Владимир
Леонидович, заслуженный работник высшей
школы РФ
• Доцент кафедры химии Савватеев Алексей
Михайлович
3.
Кислотность и основностьорганических соединений
4.
1. Кислотные и основные свойстваорганических соединений
ПРОТОЛИТИЧЕСКАЯ
ТЕОРИЯчастицы,
Нейтральные
молекулы или заряженные
которые способны
в зависимости
от условий проявлять
(Теория
Брёнстеда-Лоури)
как свойства кислот, так и оснований, называются
амфотерными
По
теории Брёнстеда–Лоури кислотой называют вещество,
способное отдавать протон, а основанием – вещество,
способное
связывать
(принимать)
протон в сопряженное
Кислота, отдавая
протон,
превращается
основание, а основание, приняв протон, становится
сопряженной кислотой
5.
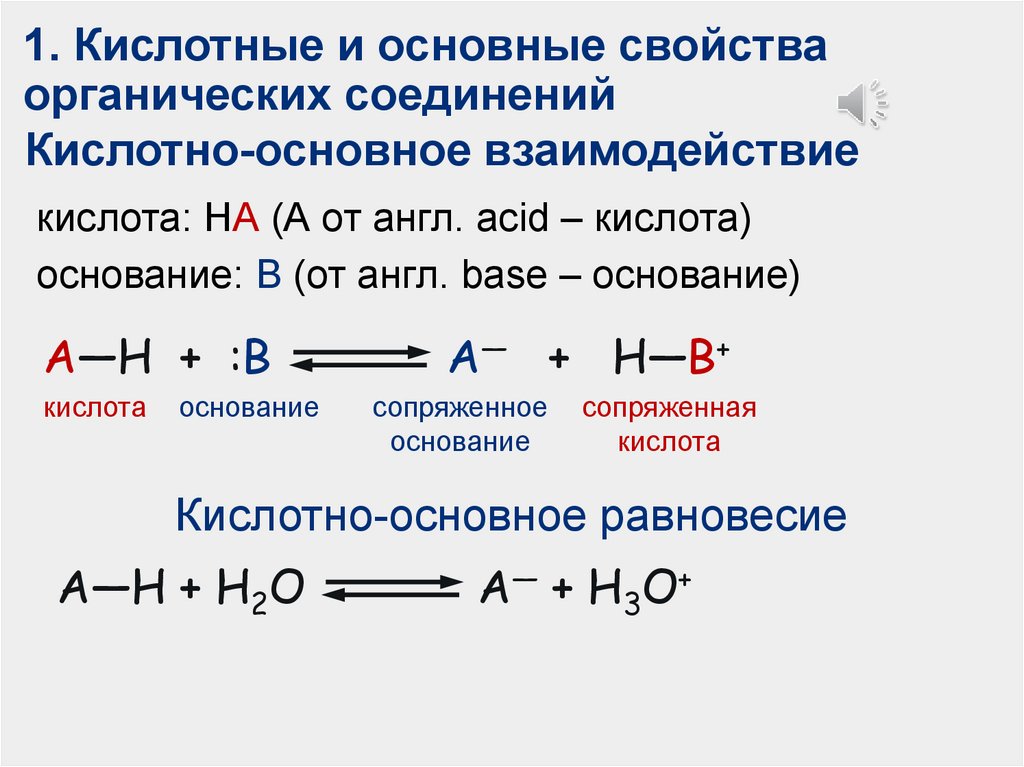
1. Кислотные и основные свойстваорганических соединений
Кислотно-основное взаимодействие
кислота: НА (А от англ. acid – кислота)
основание: В (от англ. base – основание)
A—H + :B
кислота
основание
A— + H—B+
сопряженное
основание
сопряженная
кислота
Кислотно-основное равновесие
A—H + H2O
A— + H3O+
6.
Количественные характеристикиКонстанта равновесия Kp
pKa =
-lgK
a +
—
[A ] [H3O ]
Kp =
[AH]
[H
O]
2
pKВН+
Константа кислотности Ka
Чем меньше значение pKa, тем сильнее
[A—] [H3O+]
кислота
K
=
K
[H
O]
=
a
p
2
Чем больше значение pKВН+, тем[AH]
сильнее основание
7.
1. Кислотные и основные свойстваорганических соединений
Количественные характеристики
pKa = -lgKa
pKВН+
Чем меньше значение pKa, тем сильнее кислота
Чем больше значение pKВН+, тем сильнее основание
8.
9.
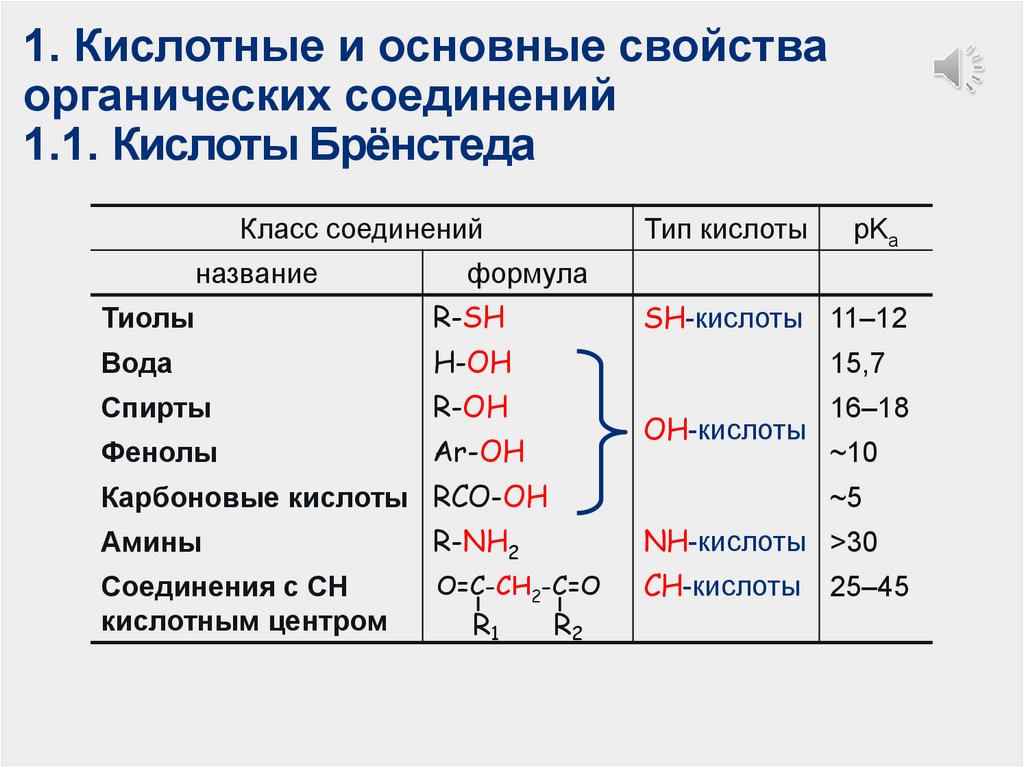
1. Кислотные и основные свойстваорганических соединений
1.1. Кислоты Брёнстеда
Класс соединений
название
Тип кислоты
pKa
формула
Тиолы
R-SH
Вода
H-OH
15,7
Спирты
R-OH
16–18
Фенолы
Ar-OH
SH-кислоты 11–12
ОН-кислоты
Карбоновые кислоты RCO-OH
~5
Амины
R-NH2
Соединения с СН
кислотным центром
О=С-CH2-С=О
R1
~10
NH-кислоты >30
R2
СH-кислоты
25–45
10.
11.
1. Кислотные и основные свойстваорганических соединений
1.1. Кислоты Брёнстеда
Качественная оценка силы кислот
Стабильность
аниона,
CH3COOH
+ H2O
CH3определяется
COO- + H3O+
уксусная кислота
совокупностьюацетат-ион
факторов:
oСила
природой
атома
в кислотном
центре, обусловленная
его
кислоты
определяется
стабильностью
сопряженного
электроотрицательностью
и поляризуемостью;
основания
(аниона), образующегося
из этой кислоты.
oЧем
степенью
делокализации
заряда:
стабильнее
анион, темотрицательного
сильнее кислота
стабилизация аниона путем делокализации по
сопряженной системе;
электронное влияние заместителей, связанных с
кислотным центром
o эффектом сольватации
12.
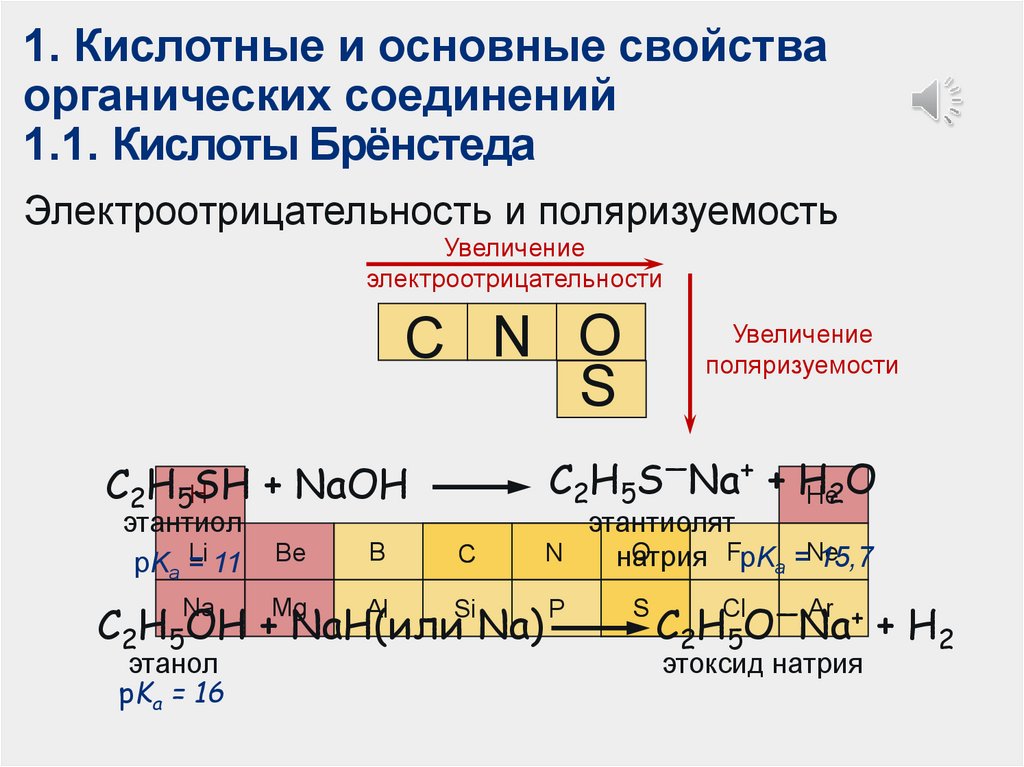
1. Кислотные и основные свойстваорганических соединений
1.1. Кислоты Брёнстеда
Электроотрицательность и поляризуемость
Увеличение
электроотрицательности
C N O
S
C2H5S—Na+ + H
He2O
C2H5HSH + NaOH
этантиол
Li 11
pKa =
Be
B
C
этантиолят
O
FpK =Ne
N
натрия
15,7
a
Na
Mg
Al
Si
P
C2H5OH + NaH(или Na)
этанол
pKa = 16
Увеличение
поляризуемости
S
Cl — Ar +
C2H5O Na
этоксид натрия
+ H2
13.
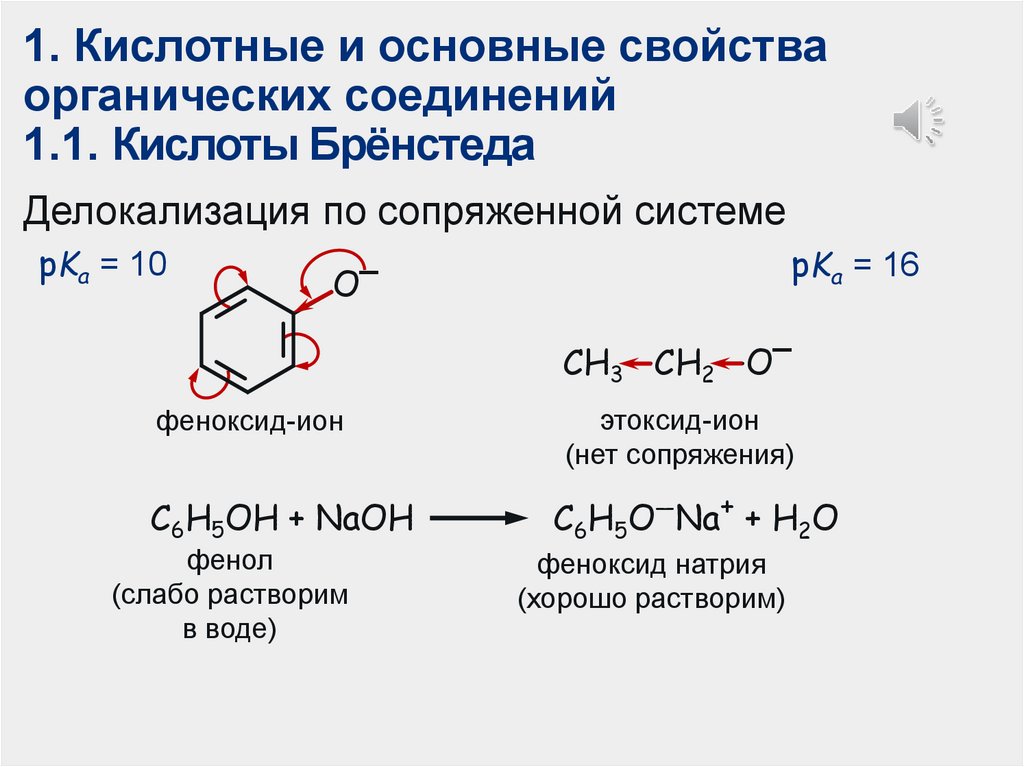
1. Кислотные и основные свойстваорганических соединений
1.1. Кислоты Брёнстеда
Делокализация по сопряженной системе
pKa = 10
pKa = 16
O−
CH3—CH2—O−
феноксид-ион
C6H5OH + NaOH
фенол
(слабо растворим
в воде)
этоксид-ион
(нет сопряжения)
C6H5O—Na+ + H2O
феноксид натрия
(хорошо растворим)
14.
1. Кислотные и основные свойстваорганических соединений
1.1. Кислоты Брёнстеда
Делокализация по сопряженной системе
Стабильность карбоксилат-иона
O
0,123 нм
R—C
0,136 нм
O—H
R—C
O
R—C
O
R—C
O
OH
O
O
+B
-BH+
R—C
O
O-
карбоксилат-ион
0,127 нм
R—C
0,127 нм
pKa карбоновых кислот ≈ 5
O
O
15.
1. Кислотные и основные свойстваорганических соединений
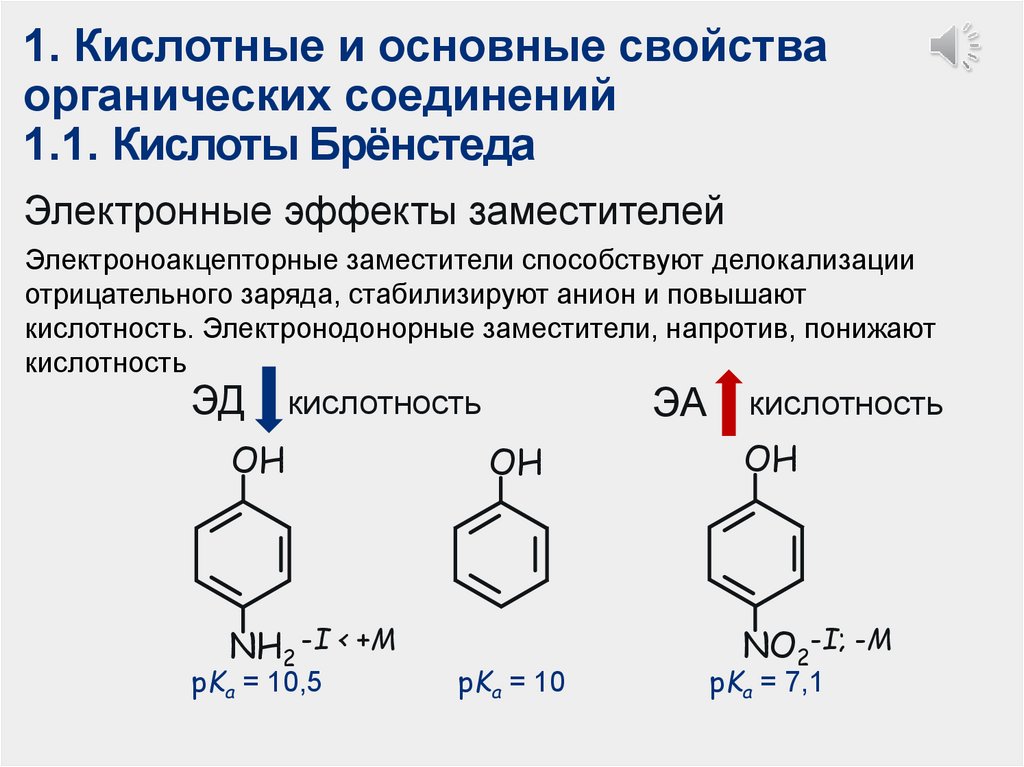
1.1. Кислоты Брёнстеда
Электронные эффекты заместителей
Электроноакцепторные заместители способствуют делокализации
отрицательного заряда, стабилизируют анион и повышают
кислотность. Электронодонорные заместители, напротив, понижают
кислотность
ЭД
ЭА
кислотность
OH
NH2 -I < +M
pKa = 10,5
OH
pKa = 10
кислотность
OH
NO2-I; -M
pKa = 7,1
16.
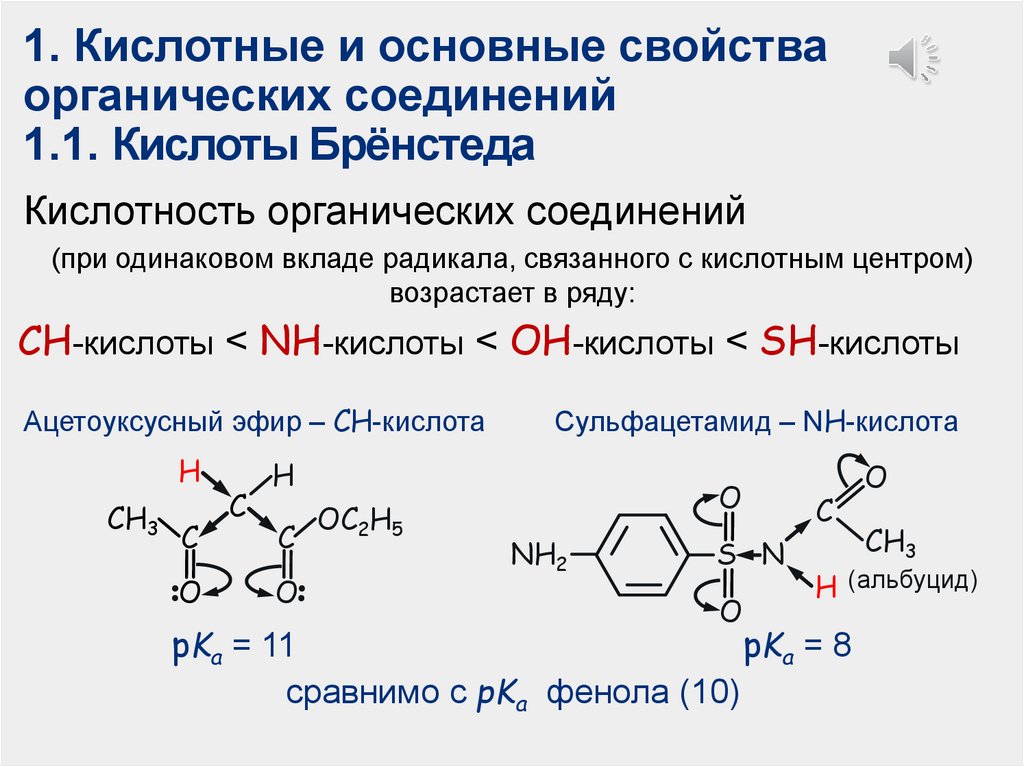
1. Кислотные и основные свойстваорганических соединений
1.1. Кислоты Брёнстеда
Кислотность органических соединений
(при одинаковом вкладе радикала, связанного с кислотным центром)
возрастает в ряду:
CH-кислоты < NH-кислоты < ОН-кислоты < SH-кислоты
Ацетоуксусный эфир – СН-кислота
H
CH3
C
O
C
Сульфацетамид – NН-кислота
H
C
O
OC2H5
O
NH2
S―N
O
C
O
CH3
H (альбуцид)
pKa = 11
pKa = 8
сравнимо с pKa фенола (10)
17.
Эффект сольватацииПри сольватации иона происходит перераспределение заряда с
участием окружающих его молекул растворителя.
Поскольку всю совокупность взаимодействий между ионом и
окружающей его средой учесть чрезвычайно трудно, то обычно
пользуются эмпирическим правилом:
Чем меньше размер иона и чем
больше локализован в нём заряд, тем он
лучше сольватируется.
метиловый спирт на 2,5 порядка более сильная кислота, чем третбутиловый спирт, содержащий гидрофобные объёмные алкильные
группы у кислотного центра.
18.
19.
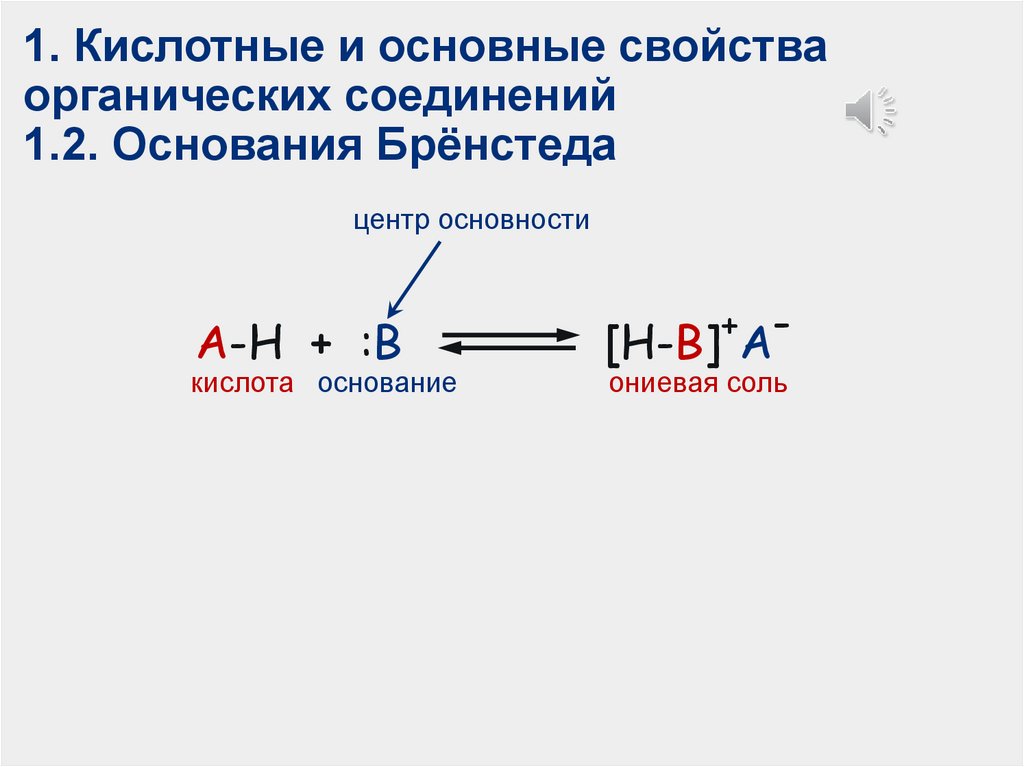
1. Кислотные и основные свойстваорганических соединений
1.2. Основания Брёнстеда
центр основности
A-H + :B
кислота основание
[H-B] A
+
ониевая соль
20.
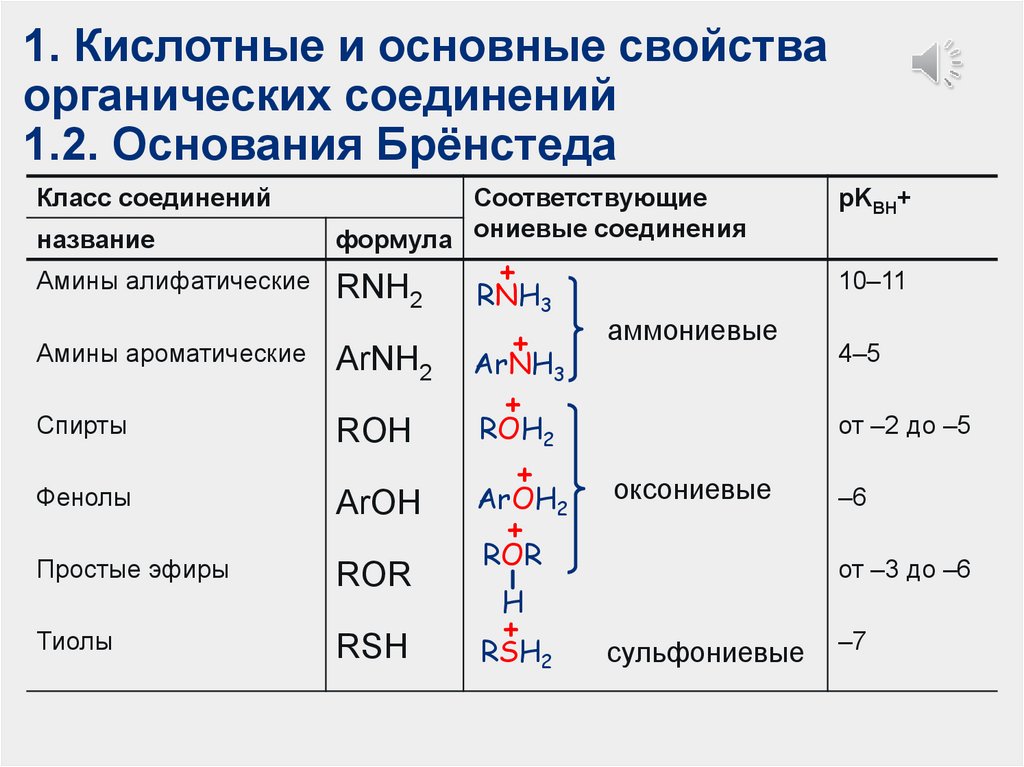
1. Кислотные и основные свойстваорганических соединений
1.2. Основания Брёнстеда
Класс соединений
название
Амины алифатические
Амины ароматические
Соответствующие
формула ониевые соединения
RNH2
+
RNH3
+
ArNH2
ArNH3
ROH
ROH2
Фенолы
ArOH
ArOH2
Простые эфиры
ROR
Тиолы
RSH
Спирты
10–11
аммониевые
+
+
+
оксониевые
–6
от –3 до –6
H
RSH2
4–5
от –2 до –5
ROR
+
pKВН+
сульфониевые
–7
21.
22.
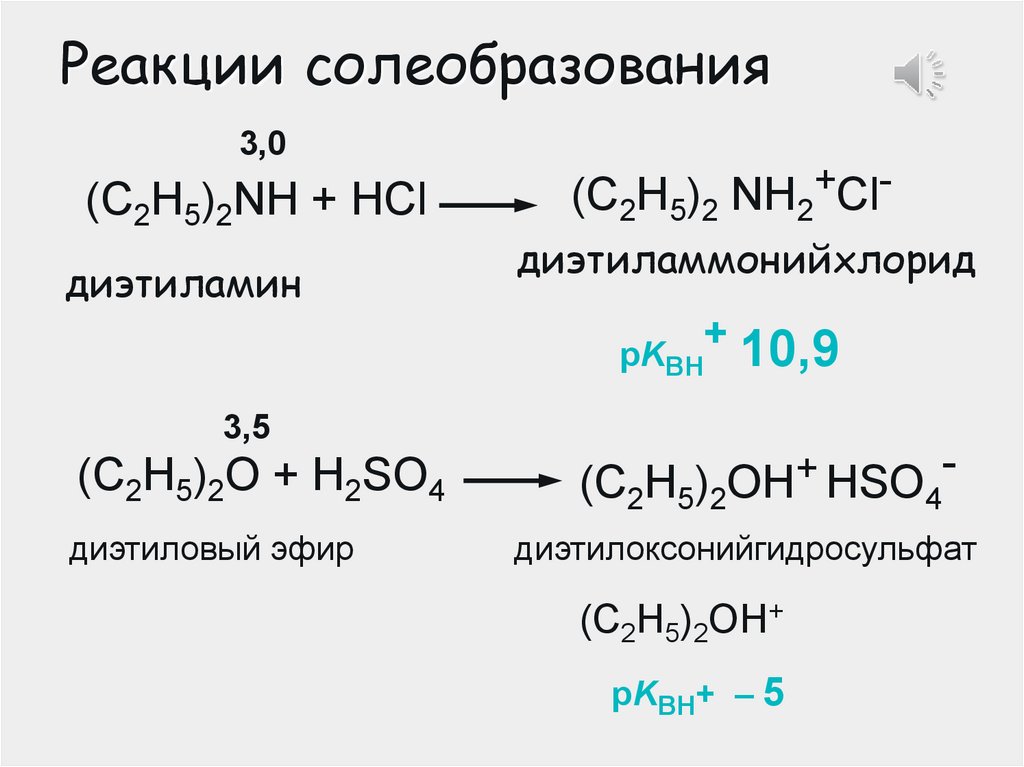
Реакции солеобразования3,0
(C2H5)2NH + HCl
диэтиламин
(C2H5)2 NH2+Clдиэтиламмонийхлорид
рKВН
+ 10,9
3,5
(C2H5)2О + H2SO4
диэтиловый эфир
(C2H5)2
ОH+ HSO
4
диэтилоксонийгидросульфат
(C2H5)2ОH+
рKВН+ – 5
23.
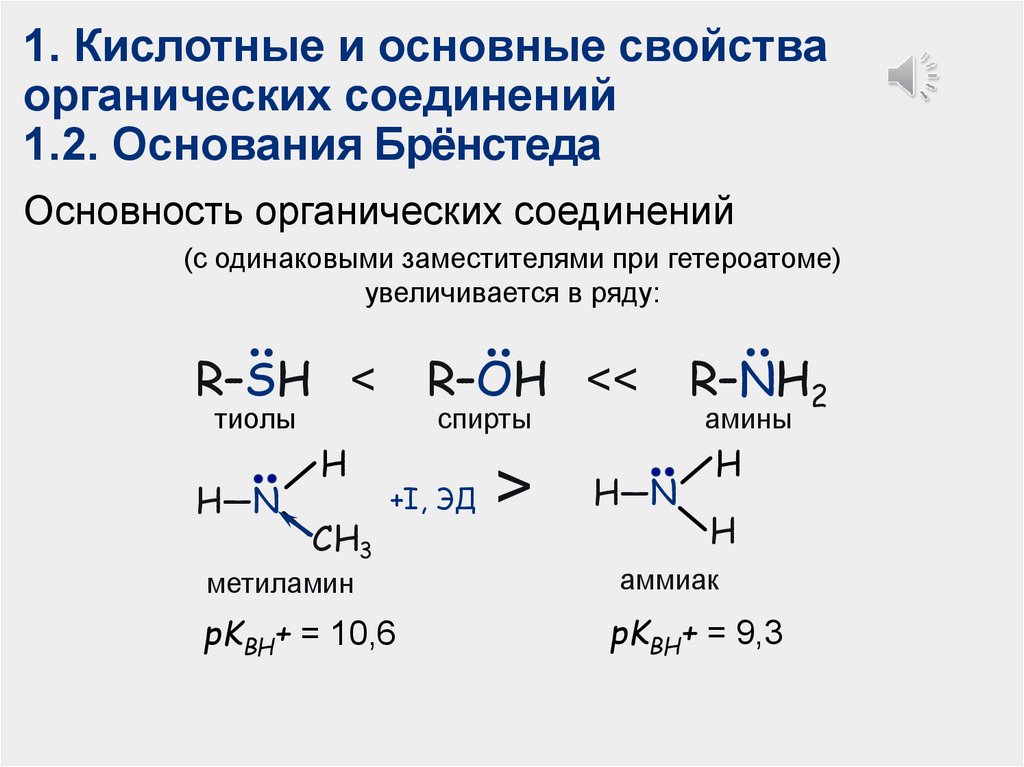
1. Кислотные и основные свойстваорганических соединений
1.2. Основания Брёнстеда
Основность органических соединений
(с одинаковыми заместителями при гетероатоме)
увеличивается в ряду:
R–SH <
R–OH <<
тиолы
H—N
H
CH3
спирты
+I, ЭД
метиламин
pKВН+ = 10,6
>
H—N
R–NH2
амины
H
H
аммиак
pKВН+ = 9,3
24.
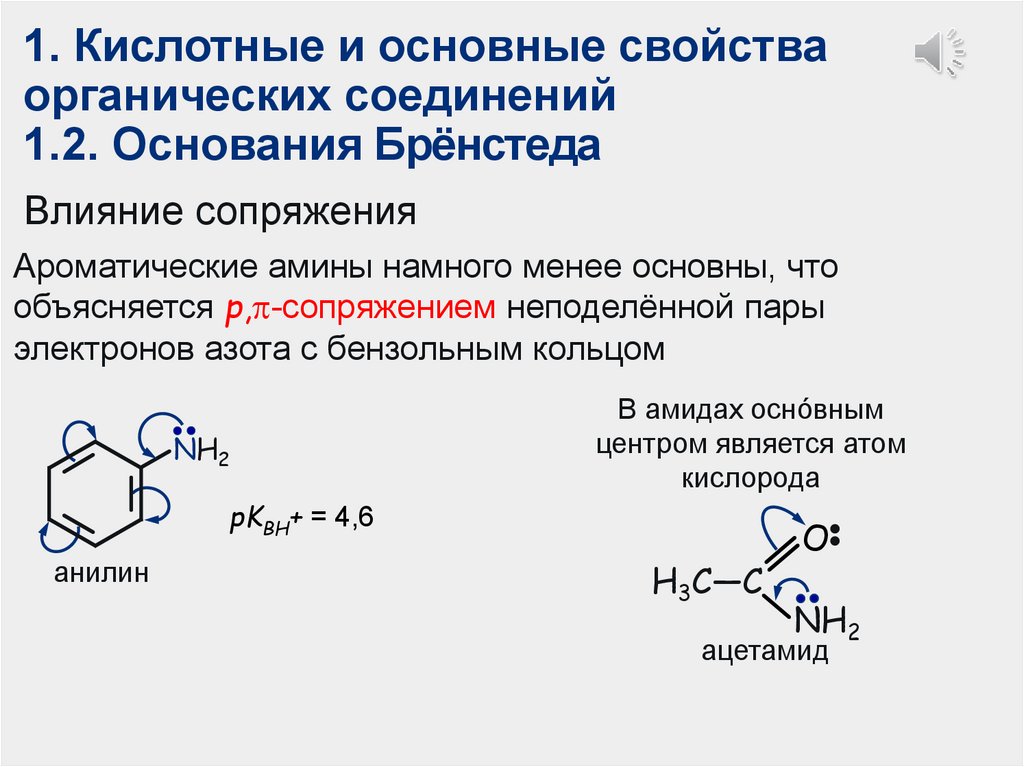
1. Кислотные и основные свойстваорганических соединений
1.2. Основания Брёнстеда
Влияние сопряжения
Ароматические амины намного менее основны, что
объясняется р, -сопряжением неподелённой пары
электронов азота с бензольным кольцом
NH2
В амидах оснóвным
центром является атом
кислорода
pKВН+ = 4,6
анилин
H3C—C
O
NH2
ацетамид
25.
1. Кислотные и основные свойстваорганических соединений
1.2. Основания Брёнстеда
Реакции солеобразования
(C2H5)2NH + HCl
диэтиламин
(C2H5)2NH2+Cl-
диэтиламмонийхлорид
26.
1. Кислотные и основные свойстваорганических соединений
1.2. Основания Брёнстеда
Электронные эффекты заместителей
Электронодонорные заместители повышают основность,
электроноакцепторные – понижают
ЭД
ЭА
основность
NH2
NH2
-I < +M
OCH3
pKa = 5,3
pKa = 4,6
основность
NH2
NO2-I; -M
pKa = 1,0
27.
28.
1. Кислотные и основные свойстваорганических соединений
1.2. Основания Брёнстеда
Гуанидин – сильное основание
H2N―C―NH2
+H+
H2N―C―NH2
NH2
NH
pKВН+ = 13,5
H2N—C—NH—CH2CH2CH2CH—COOH
NH
NH2
-аминокислота аргинин
+














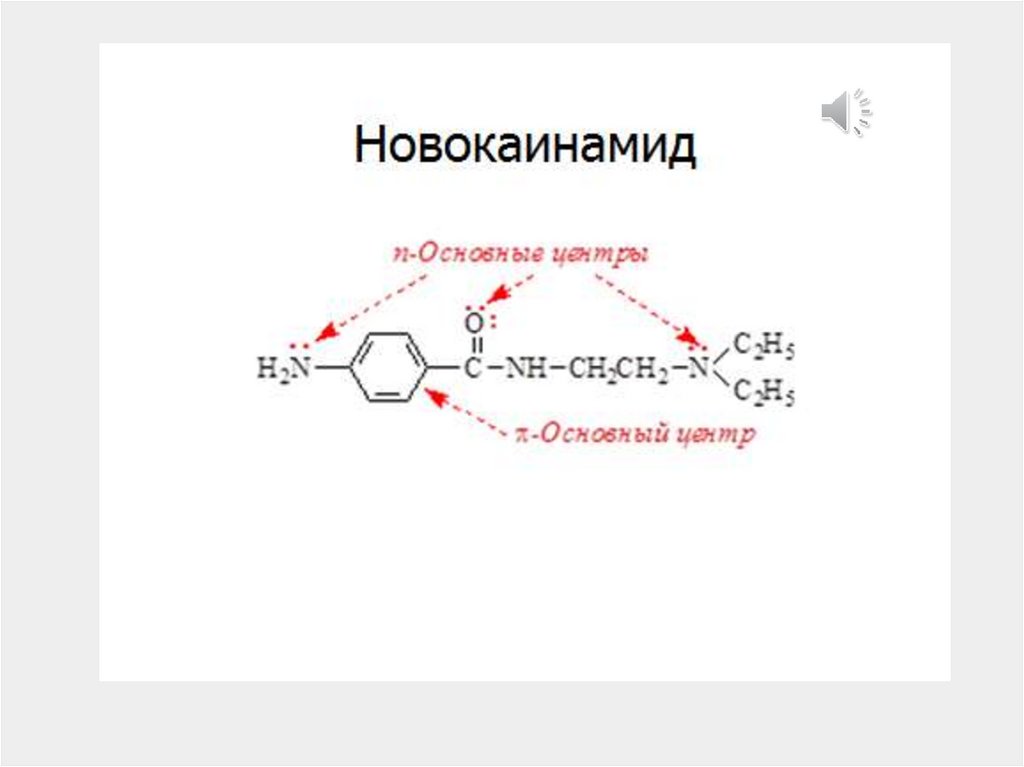


 chemistry
chemistry








